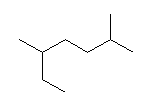
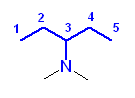
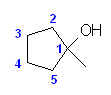
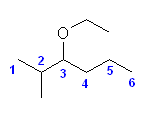
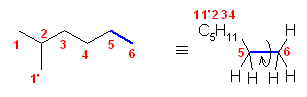
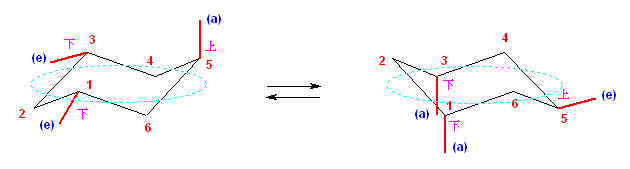
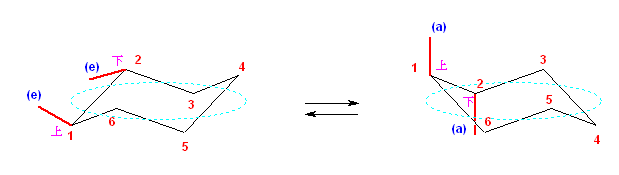
2.01-2.10
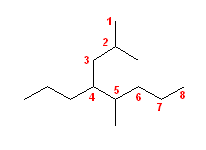
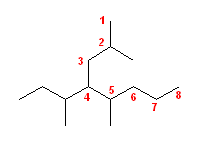
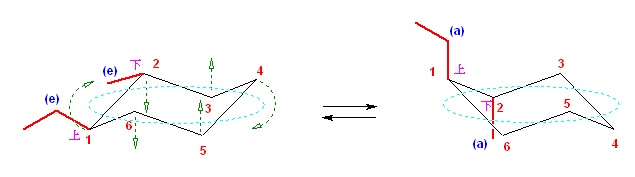
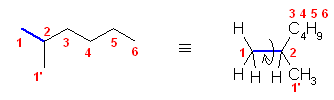
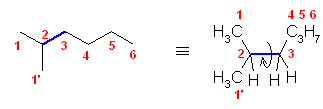
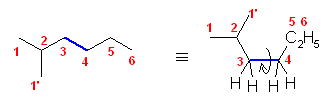
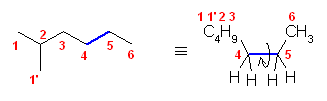
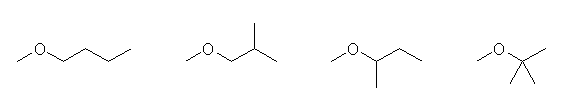
2.01
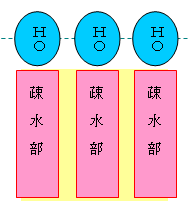
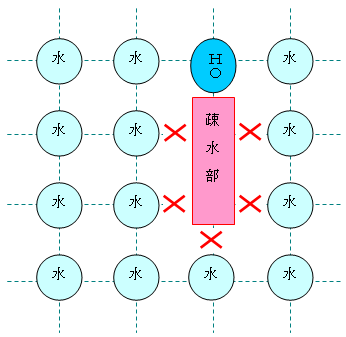
分子模型の図において、元素と色の対応は次の通り。
ただし、これは、それぞれの原子の結合の数からも判断できるはず。
黒:炭素(結合の数は4本)
青:窒素(結合の数は3本)
赤:酸素(結合の数は2本)
灰色:水素(結合の数は1本)
※ 炭素、窒素、酸素は、黒、青、赤で表すことが多い。水素原子は、いつも決まった色ではないが、白や水色に近い薄い色で表されることが多い。
次に、構造から、どんな官能基をもつ化合物か判断する。
(a) -OH(水酸基)をもつので、アルコールである。
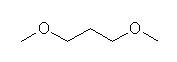
(b) R-O-R(エーテル結合)の構造をもつので、エーテルである。
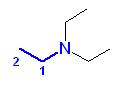
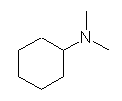
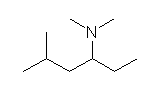
(c) -NH2(アミノ基)をもつので、アミンである。
ここに挙げられた分子は、それぞれ「置換命名法」「基官能命名法」の両者で命名することができる。いずれを用いても命名できるようにすること。ただし、問題文でIUPAC体系名と指定された場合は、置換命名法を用いることが必要となる。
(整理)
IUPAC体系名(置換命名法): 「側鎖置換基」+「主鎖」+「接尾語」
基官能命名法: 「アルキル基」+「スペース」+「一般名」
(解答例)
IUPAC体系名(置換命名法)では次のようになる。
「側鎖置換基」+「主鎖」+「接尾語」
(a) propan-1-ol
(b) methoxymethane
(c) pronan-1-amine
上の例では、(a)(c)では側鎖置換基は無し。(b)では、エーテル結合は主官能基にならない(接尾語として命名できない)ので、側鎖置換基(メトキシ基)の結合したアルカン(メタン)として命名している。
基官能命名法では次のようになる。
「アルキル基」+「スペース」+「一般名」
(a) propyl alcohol
(b) dimethyl ether
(c) propyl amine
2.02
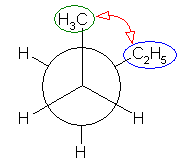
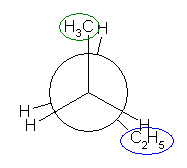
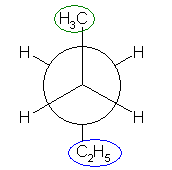
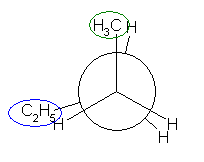
「第2級炭素」とは、着目している炭素上にアルキル基が2つ結合しているものを指す。プロパンの2位の炭素は第2級である。(CH3-)CH2(-CH3) : メチル基が2つ結合しているので。
「第3級炭素」とは、着目している炭素上にアルキル基が3つ結合しているものを指す。2-メチルプロパンの2位の炭素は第3級である。
ので。
「第4級炭素」とは、着目している炭素上にアルキル基が4つ結合しているものを指す。2,2-ジメチルプロパンの2位の炭素は第4級である。
「第1級炭素」は、着目している炭素上にアルキル基が1つ結合しているもの、および、メタンのように着目している炭素上にアルキル基がないもの(「第0級」ではない。)を指す。
(解答例)
まず、分子式 C5H12 を見ると、一般式 CnH2n+2 に従っている(n=5)ことがわかる。
その結論として、この分子式の化合物には、二重結合も、環の構造も含まれない。(このようなことを指して、「不飽和度が0である」という。)
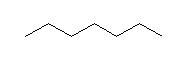
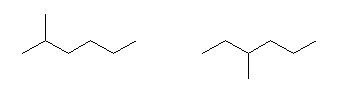
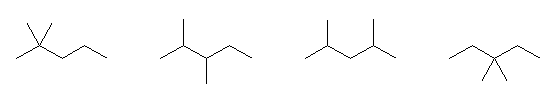
分子式 C5H12 の化合物の異性体は、次のように探す。
1) 炭素5個がすべて直線状に並んでいるもの。
2) 炭素4個が直線状に並び、残りの炭素1個は、枝であるもの。
3) 炭素3個が直線状に並び、残りの炭素2個は、枝であるもの。
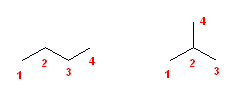
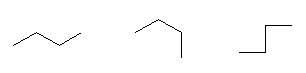
このようにして描いたのが次の3つである。
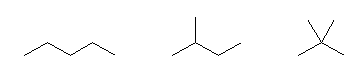
この3つの異性体は、左からそれぞれ、
pentane、2-methylbutane、2,2-dimethylpropane
である。
(体系名さえきちんと命名できれば、すべての慣用名を覚える必要はないのだが、2-methylbutane の慣用名は、isopentane である。また、2,2-dimethylpropane の慣用名は、neopentane である。)
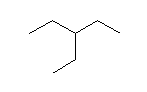
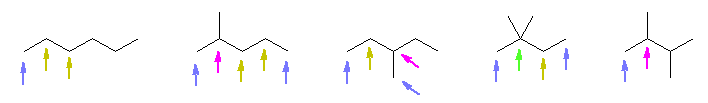
ここで、注意するべき点が1つある。枝となる炭素が2個の場合、「エチル基が1つ」または「メチル基が2つ」の両方がありえる。上図 2,2-dimethylpropane では、メチル基が2つである。今、炭素3個が直線状に並んだプロパン上にエチル基を書き込むと、次の図になる。
しかし、これは、2-ethylpropane ではない。この図を90度右に回転させることで、上の3つの構造のうち、2つめ(2-methylbutane)と同一であることがわかる。
すなわち、異性体を重複なくすべて探すためには、はじめに自分で設定した主鎖(単純なアルカンなので、最も長い炭素の鎖)を固定して考え、枝として書いた部分が主鎖にならない(枝の部分に沿って数えたほうが炭素鎖が長い、という状況にならない)ために、枝を描くとき、「メチル基は両端の炭素上には置けない」「エチル基は両端から2番目までの炭素上には置けない」「n-プロピル基は両端から3番目までの炭素上には置けない」といったルールを守る必要がある。
従って、問いの条件にあうのは、上記3つの構造から選ぶと、
a) 2-methylbutane
第3級炭素は、メチル基の結合した(2位の)炭素である。
b) 2,2-dimethylpropane
メチル基の2つ結合した(2位の)炭素は、第4級である。また、1、3位および2つのメチル基(主鎖をプロパンとして固定しているため、このように使い分けているが、真ん中の炭素の4つのメチル基が結合しているものとみなすことができ、この4つの炭素は完全に等価(差がない)である。)は、第1級である。ちなみに、pentane では、2、3、4位の炭素が第2級、2-methylbutane では、3位の炭素が第2級である。
2.03
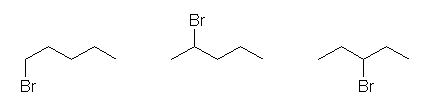
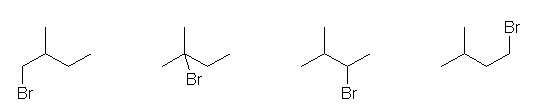
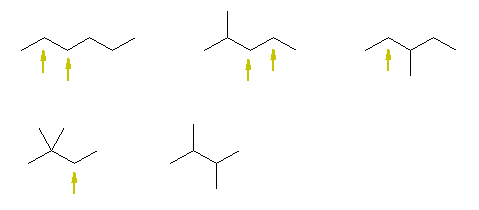
はじめに C4H10 の構造異性体を描き、つづいて、水素のひとつを臭素に置き換える、といった手順で描くとよい。
(解答例)
まず、分子式 C4H10 を見ると、一般式 CnH2n+2 に従っている(n=4)ことがわかる。
その結論として、この分子式の化合物には、二重結合も、環の構造も含まれない。問い2.2と同様に、この分子式をもつアルカンの異性体をすべて描くと、次の通りとなる。

左からそれぞれ、
butane、2-methylpropane
である。
このそれぞれについて、水素のひとつを臭素に置き換えることを考える。説明のために、次のように炭素に番号をつけておく。(この問いの説明のためだけの番号である。)
まずは、以下の原則を知っておこう。(遠くない将来、立体化学まで考慮した場合に、この原則が成り立たないケースもでてくるが、今はその例外は考えなくてよい。)
1) 同じ炭素上の水素は、互いに等価である。
2) 分子をまわしたり、結合の方向を入れ替えても、原子の並び順が変わっていなければ、化合物は変わらない。
上のいずれも、同一の構造を有しており、butane である。
3) 骨格の対称性を考えて、分子を回したり、左右を反転させたときに重ねることができる原子は、等価である。
butane の(この問いのための番号で)1位と4位、2位と3位は、(左右を入れ替えれば重ねることができるので)それぞれ等価である。また、2-methylpropane の(この問いのための番号で)1位と3位と4位は(120度ずつ図を回転させれば、互いに重ねることができるので)等価である。
4) 等価な水素のいずれかを臭素に置き換えても、異なる化合物にはならない。
たとえば、butane の1位の炭素には、3つの水素が結合している。そのどれを臭素に置き換えても、同じ化合物を与える。
butane の1位で置き換えた場合、(CH2BrCH2CH2CH3;1-bromobutane)となる。
また、butane の(この問いのための番号で)4位の炭素は、1位の炭素と等価であったから、この4位の炭素上の3つの水素のいずれを臭素に置き換えても、やはり同じ化合物を与える。(CH3CH2CH2CH2Br;1-bromobutane であり 4-bromobutaneではない。)
従って、butane には、互いに等価でない水素は2種類ある。(1位、4位の炭素で1種類、2位、3位の炭素で1種類である。)
また、2-methylpropane には、互いに等価でない水素は2種類ある。(1位、3位、4位の炭素で1種類、2位の炭素で1種類である。)
これらを、それぞれ臭素で置き換えた構造は、次の通りで、この問いで求めるべき4種類の異性体である。
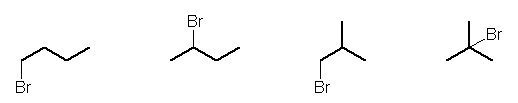
体系名は、左より
1-bromobutane、2-bromobutane、1-bromo-2-methylpropane、2-bromo-2-methylpropane
である。
2.04
炭素が、正四面体型の対称性をもつ場合と、正方形型の対称性をもつ場合とで比較してみるとよい。両者に成り立つことであれば、実験的にこれらを区別する証拠にはならないが、、一方のみに成り立つことがあれば、区別をするための証拠になりえる。
(解答例)
a) 正方形型か正四面体型かを区別するための証拠にはならない。
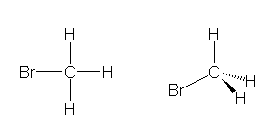
メタンが正方形型の分子であると仮定するなら、そのモノ置換体は、どの位置を置換しても、炭素を中心に平面内で90度、180度、270度回転させることで必ず重ねることができる。(すなわち、モノ置換体には異性体が存在しない。)
メタンが正四面体型の分子であると仮定しても、そのモノ置換体は、どの位置を置換しても、炭素を中心とした回転で、必ず重ねることができる。(すなわち、モノ置換体には異性体が存在しない。)
すなわち、「臭化メチル(IUPAC名、bromomethane)には構造異性体が存在しない」という実験事実は、メタンの構造が正方形型である場合でも、正四面体である場合でも、いずれも成立するから、これらを区別するためには役にたたない。
b) 正方形型か正四面体型かを区別するための証拠にはならない。
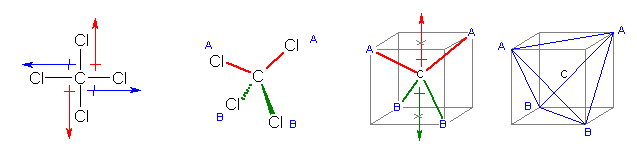
メタンが正方形型の分子であると仮定するなら、赤の矢印で示した2本の C-Cl 結合の分極は互いに打ち消しあうし、また、青の矢印で示した2本の C-Cl 結合の分極も互いに打ち消しあうので、分子全体として、双極子モーメントをもたない。
メタンが正四面体型の分子であると仮定しても、分子全体として、双極子モーメントを持たない。正四面体 AABB を、立方体に内接するように描いた。また、体の中心を C と置いた。C-A、および C-B は、四塩化炭素における C-Cl 結合に相当する。赤で示した2本の C-A にそれぞれ分極があるとして、その分極のベクトル和を赤の矢印で示している。また、緑で示した2本の C-B にそれぞれ同様に分極があるとして、その分極のベクトル和を緑の矢印で示している。赤の矢印と緑の矢印は大きさが同じで向きが対向しているから、四塩化炭素が正四面体型の分子である場合でも、分子全体としては双極子をもたない。
c) 正四面体型の分子であることを示唆する証拠になる。
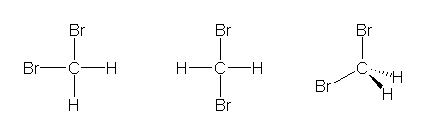
もし、メタンが正方形型の分子であると仮定するなら、図に示すように、隣接した2箇所が臭素化された分子と、対向した2箇所が臭素化された分子の構造は、空間内の回転や平行移動だけでは重ね合わせることができない。すなわち、この2つの構造は、構造異性体である。
一方で、メタンが正四面体型の分子であると仮定するなら、メタンの4つの水素のうちどの2つを臭素で置換しても、構造異性体とはならず、ただ1種類のみの構造が書けるだけである。
従って、「ジブロモメタンに構造異性体がない」という実験事実は、メタンが正方形型ではなく、正四面体型の対称性をもつことを示す証拠である。
2.05
ここでは基官能命名法で化合物名が与えられている。アルキル基(慣用名をふくむ)の名称と構造の対応がわかればよいので、教科書 §2.1(p83〜)を参照すること。
(解答例)
構造式と体系名を以下に記す。(かならず、体系名で命名できるようにすること。)
(a) isopropyl alcohol
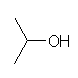
propan-2-ol
(b) isopentyl fluoride
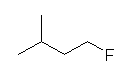
1-fluoro-3-methylbutane
(c) sec-butyl iodide
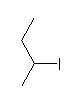
2-iodobutane
(d) tert-pentyl alcohol
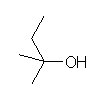
2-methylbutan-2-ol
(e) tert-butyl amine
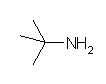
2-methylpropan-2-amine
(f) n-octyl bromide
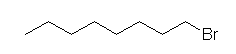
1-bromooctane
(b)(c)(f) は、接尾語として命名できる官能基がないので、フッ素、ヨウ素、臭素は、それぞれ側鎖の置換基として命名する。
(a)(d) は、アルコールなので、水酸基(-OH)をもつ。体系名では、接尾語 -ol を用いて命名する。
(f) 母音が重なるが、「bromo」+「octane」は、bromoctane ではなく、bromooctane であることに注意すること。
2.06
ここに挙げられた分子は、それぞれ「置換命名法」「基官能命名法」の両者で命名することができる。いずれを用いても命名できるようにすること。ただし、問題文でIUPAC体系名と指定された場合は、置換命名法を用いることが必要となる。
(解答例)
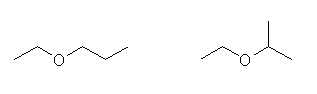
(a)
基官能命名法: ethyl methyl ether
置換命名法: methoxyethane
(エーテル結合 R-O-R は、接尾語として命名できる官能基ではないため、主鎖エタンに、メトキシ基(メチルオキシ基の短縮形)が置換しているものとして命名する。主鎖エタンの1位と2位は、等価であるため、「1-」methoxyethane と位置番号を示す必要はない。すなわち、1-methoxyethane と 2-methoxyethane は、同一の構造を示す。なお、同一の構造を示していても、「位置番号の数字として、小さいものを選ぶ」というルールに反しているため、2-methoxypropane は体系名として間違いである。)
(b)
基官能命名法:methyl propyl ether
置換命名法: 1-methoxypropane
(a) とは異なり、主鎖プロパンの1位と2位とでは等価でないから、メトキシ基の位置を区別して示す必要がある。(1-methoxypropane と 2-methoxypropane は、互いに異なる化合物である。)
(c)
基官能命名法: sec-butyl amine
置換命名法: butan-2-amine
(d)
基官能命名法: n-butyl alcohol
置換命名法: butan-1-ol
(基官能命名法において、アルキル基が枝分かれをもたないことを明示する n- は、省略しても差し支えない。)
(e)
基官能命名法: isobutyl bromide
置換命名法: 1-bromo-2-methylpropane
(置換命名法において、主鎖の選び方で、同じ炭素数3として2通り選ぶことができる。しかし、主鎖の選び方の「(7)側鎖の数を多くなるように選ぶ」より、1-bromo-2-methylpropane が正解である。2-(bromomethyl)propane は誤り。)
(f)
基官能命名法: sec-butyl chloride
置換命名法: 2-chlorobutane
2.07
ここではIUPAC体系名(置換命名法)で化合物名が与えられている。なお、「イソプロピル、isopropyl」および「イソブチル、isobutyl」は、IUPACで使用が認められている慣用名で、それぞれ「1-methylethyl」「2-methylpropyl」のことである。p84,p85を参照のこと。また、IUPAC体系に従った複合官能基名として与えられている「1,1-dimethylethyl」は、慣用名で表す場合には「tert-butyl」となる。
(解答例)
以下に示した構造と、原子の並び順が同じであれば、左右を入れ替えたり、分子の形を変えてあっても正解である。なお、わかりやすくするため、以下の構造式の主鎖の位置番号を赤色の数字で併せて示した。
(a)
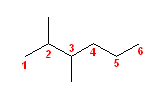
(b)
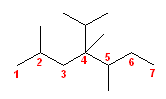
(c)
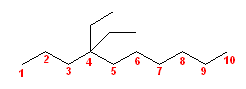
(d)
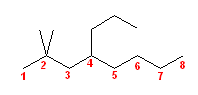
(e)
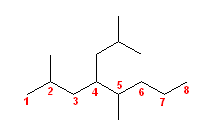
(f)
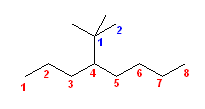
(f) の構造式に示した青色の数字は、側鎖(1,1-dimethylethyl 基)の位置番号である。
なお、(e) の構造に関して、2位のメチル基がない場合は、主鎖の選び方が異なることに注意すること。
これは、主鎖の選び方の「(7)側鎖の数を多くなるように選ぶ」のルールによるものである。
更に、(e) の構造に関して、2位のメチル基が3位に移った構造である場合にも、主鎖の選び方が異なることに注意すること。
これは、主鎖の選び方の「(7)側鎖の数を多くなるように選ぶ」のルールでは、まだ唯1つに主鎖を決められないため、その下位の「(8)側鎖の位置番号の組が小さくなるように選ぶ」によるものである。
2.08
c) については、跳ばしてよいです。今の皆さんの段階では、ひとつずつの慣用名を覚えていくより、体系名(置換命名法)で正しく命名できることの方が重要でしょう。知らない慣用名がでてきた場合には、構造を調べればよいですし、頻度が高くでてくる慣用名については、段階を経て親しんでください。慣用名は、そのひとつづつについて知らなければ答えられませんが、体系名の規則(置換命名法)は、(ほとんど)すべての構造に対して適用可能です。
とはいえ、d、e、f で問われている isopropyl 基、sec-bytyl 基、tert-bytyl 基は、頻出の(アルキル基の)慣用名であるから、きちんと押さえておこう。(もちろん、体系名のルールに従って複合置換基名(1-methylethyl 基、2-methylpropyl 基、1,1-dimethylethyl 基)として命名できる必要もある。)
a) の問いには、解答の導きかたが併記されている。まずは、よく読んでみよう。
問い2.2でも書いたように、異性体を重複なくすべて探すためには、はじめに自分で設定した置換命名法に用いる主鎖(単純なアルカンなので、最も長い炭素の鎖)を固定して考え、枝として書いた部分が主鎖にならないようにすればよい。
d 〜 f) ここで「イソプロピル基を含んでいる」という文章の解釈には2通りありえる。ここでは、「構造の一部がイソプロピル基と合致するものを探す」こととして捉えてよいものとする。従って、体系名上、側鎖置換基として「isopropyl」(または「1-methylethyl」を含んでいなくてもよいこととして解答すること。
たとえば、2,3-dimethylbutane; (CH3)2CHCH(CH3)2 は、構造上はイソプロピル基と合致する部分を持っているが、側鎖置換基としてはイソプロピル基を持たない。
(解答例)
a) b)
主鎖がオクタンであるもの。
octane
主鎖がヘプタンであるもの。
残りの炭素は1つなので、メチル基が1つ結合している。
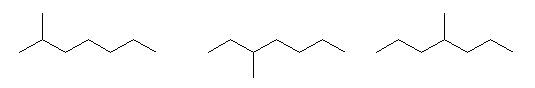
2-methylheptane, 3-methylheptane, 4-methylheptane
※ 5-methyl〜 は、左右を入れ替えると、3-methyl〜 と重複していることがわかる。
主鎖がヘキサンであるもの。
残りの炭素は2つなので、メチル基が2つ結合している場合と、エチル基が結合している場合とがある。
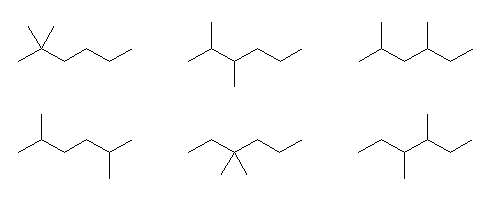
2,2-dimethylhexane, 2,3-dimethylhexane, 2,4-dimethylhexane,
2,5-dimethylhexanem 3,3-dimethylhexane, 3,4-dimethylhexane
※ たとえば、3,5-dimethyl〜 は、左右を入れ替えると 2,4-dimethyl〜 となり、同じ名称のものがある。すでに書いた構造と重複していることがわかる。
3-ethylhexane
※ 2-ethylhexane として構造を描くと、主鎖(最も長い炭素鎖)が、エチル基の上に伸びて数えた heptane となることがわかる。すでに、上の構造で 3-methylheptane として数え済みである。
主鎖がペンタンであるもの。
残りの炭素が3つである。メチル基が2つ結合している場合と、メチル基、エチル基が1つずつ結合している場合とがある。
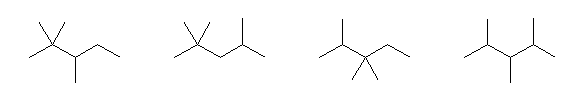
2,2,3-trimethylpentane, 2,2,4-trimethylpentane, 2,3,3-trimehylpentane, 2,3,4-trimethylpentane
3-ethyl-2-methylpentane, 3-ethyl-3-methylpentane
エチル基が、2位(や4位)には来ることができない。2位にエチル基がある場合は、上と同様で、主鎖(最も長い炭素鎖)が、エチル基の上に伸びて数えた hexane となってしまうためである。
主鎖がブタンであるもの。
エチル基が結合すると、主鎖がブタンではなくなってしまう。4つの炭素がすべてメチル基であるものしか数えなくてよい。
2,2,3,3-tetramethylbutane
(d) 側鎖として isopropyl 基(2-methylethyl 基)を化合物の名称に含むものは、オクタンの骨格異性体 18種類の中には存在しない。
isopropyl 基は、-CH(CH3)2 の構造であるから、この部分構造を持つ化合物は、次の 8 種類である。
(e) 側鎖として sec-butyl 基(1-methylpropyl 基)を化合物の名称に含むものは、オクタンの骨格異性体 18種類の中には存在しない。
sec-butyl 基は、-CH(CH3)CH2CH3 の構造であるから、この部分構造を持つ化合物は、次の 4 種類である。
(e) 側鎖として tert-butyl 基(1,1-dimethylethyl 基)を化合物の名称に含むものは、オクタンの骨格異性体 18種類の中には存在しない。
tert-butyl 基は、-C(CH3)3 の構造であるから、この部分構造を持つ化合物は、次の 4 種類である。
(発展)
(c) 「いくつの構造異性体が慣用名をもつか」という問いに対して、正しい答えを知るためには、18種類の構造異性体ひとつずつに対して、慣用名があるかないか、ということを知らなければならない。あまり有用ではないので、この問いに答える必要はない。
ガソリンのオクタン価という言葉に関連して、有名な構造異性体のひとつに「イソオクタン」がある。これは、次の構造を持つ化合物である。
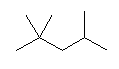
類似の慣用名をもつ物質に、「イソブタン」「イソペンタン」「イソヘキサン」などがある。
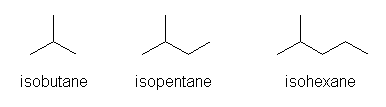
この一連の構造から、なにか法則性があるように勘違いしそうだが、慣用名には、一般的な法則は存在しない。
なお、慣用名の中には、IUPAC で認められているものもある。しかし、誘導体を作ってもよいもの(たとえば、「ベンゼン」という慣用名に対し、置換基名を付して「メチルベンゼン」という名前の付け方が許されるもの)もあるが、誘導体を作ってはいけない場合もある。(たとえば、「イソプロピル基」に対し、「ブロモイソプロピル基」という誘導体を作ることは許されない。)
慣用名の世界は、かように複雑であるから、体系名をつけることができるようになった方が、簡単である。
また、関連して、炭素数が3から6の範囲の「イソプロピル基」「イソブチル基」「イソペンチル基」「イソヘキシル基」は、慣用名として許容されるが、「イソへプチル基」「イソオクチル基」はIUPACの命名規則においては認められていない。
2.09
ここに与えられているのは、すべてアルカンである。命名は、置換命名法で行う。詳細は、授業時配布のプリントおよび教科書 §2.2(p88〜)を参照すること。
ここで、主鎖の選び方で間違いやすいのは、(c)、(f) である。特に、(c) では、プリント6ページ、主鎖(母体となる炭化水素)の選び方の、「(7)側鎖の数」(教科書では、p90の「6.」)を考慮しないと正しい答えにならないので注意すること。
なお、短縮構造式(簡略構造式)を、価標を用いた骨格構造式に直してみると、主鎖を探しやすい。問い 2.13 も参照すること。
(解答例)
(a) 2,2,4-trimethylhexane
(b) 2,2-dimethylbutane
(c) 3-methyl-4-propylheptane
(d) 2,2,5-trimethylhexane
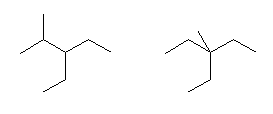
(e) 3,3-diethyl-4-methyl-5-propyloctane
(f) 5-ethyl-4,4-dimethyloctane
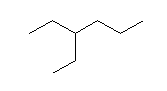
(g) 3,3-diethylhexane
(h) 4-(1-methylethyl)octane
または、4-isopropyloctane
(i) 2,6-dimethylheptane
(b) R-C(CH3)3 と書かれていても、カッコの中のメチル基のひとつは主鎖になっていることに注意する。1,1,1-trimethylpropane は誤り。
(c) 4-(1-methlpropyl)heptane は主鎖の選び方の誤り。
(d) R-CH(CH2CH2CH3)2 と書かれていても、カッコの中のプロピル基のひとつは主鎖になっていることに注意する。1,1-dipropyl〜という形の命名は誤り。
(f) の命名において、側鎖をアルファベット順に並べる際、「dimethyl」は、倍数接頭語の d ではなく、メチル基の m で比較する。そのため、e(エチル)< m(メチル)の順で並べる。
2.10
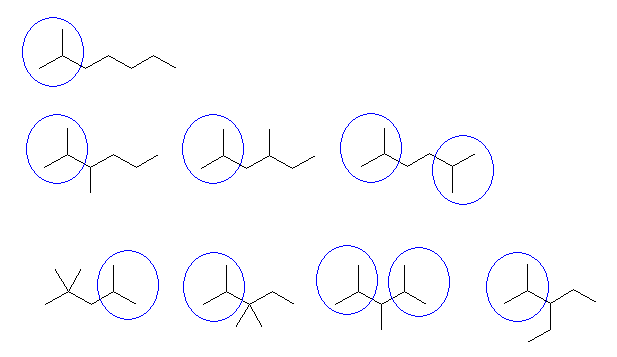
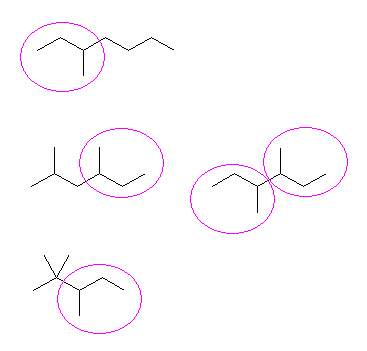
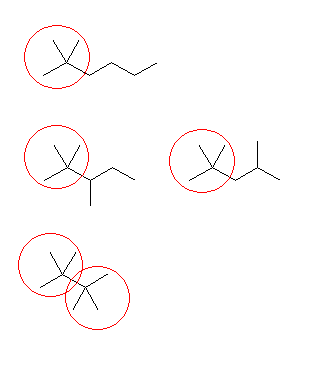
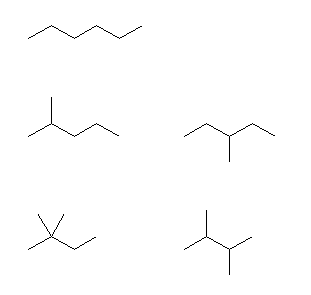
問い 2.2 と同様、骨格異性体を重複なくすべて書き出し、その中から与えられた条件に合致するものを答えればよい。
なお、第1級炭素上の水素を第1級の水素、第2級炭素上の水素を…(以下同文)という。
(解答例)
まず、問い 2.2 でも解いたように、
分子式 C5H12 の構造異性体は、次のように探す。
1) 炭素5個がすべて直線状に並んでいるもの。
2) 炭素4個が直線状に並び、残りの炭素1個は、枝であるもの。
3) 炭素3個が直線状に並び、残りの炭素2個は、枝であるもの。
このようにして描いたのが次の3つである。

この3つの異性体は、左からそれぞれ、
pentane、2-methylbutane、2,2-dimethylpropane
である。
pentane は、第1級炭素と第2級炭素をもつ。
2-methylbutane は、第1級炭素、第2級炭素と第3級炭素をもつ。
2,2-dimethylpropane は、第1級炭素と第4級炭素をもつ。
従って、
a) pentane が、第1級水素と第2級水素しか持っていない化合物である。2-methylbutane は、第3級水素を持つし、2,2-dimethylpropane は、第2級水素を持たない。
b) 2,2-dimethylpropane が、第1級水素しか持たない化合物である。第4級炭素上には水素が結合していないからである。pentane は、第2級水素も持つし、2-methylbutane は、第2級炭水素および第3級水素をもつ。
c) 2-methylbutane が条件に該当する。
d) 2-methylbutane が条件に該当する。pentane の第2級水素の数は、計6個であるし、2,2-dimethylpropane は、第2級水素を持たない。
2.11-2.20
2.11
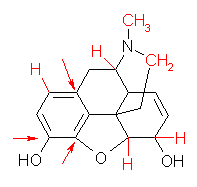
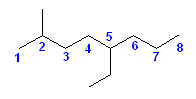
炭素が4本の結合をもっているべきことを思い出して数えればよい。
(解答例)
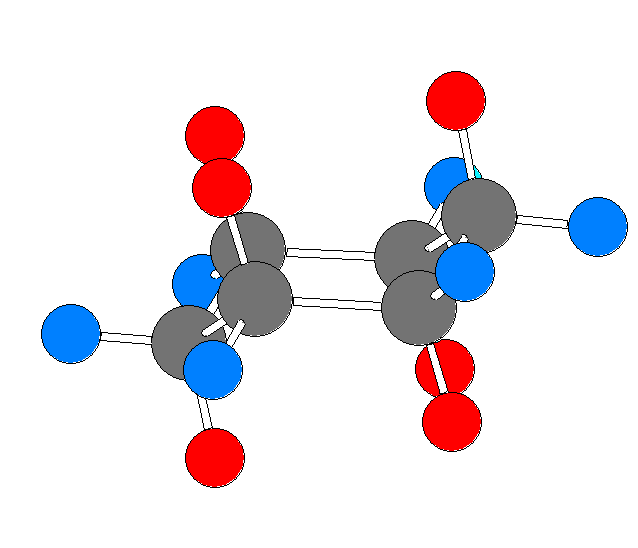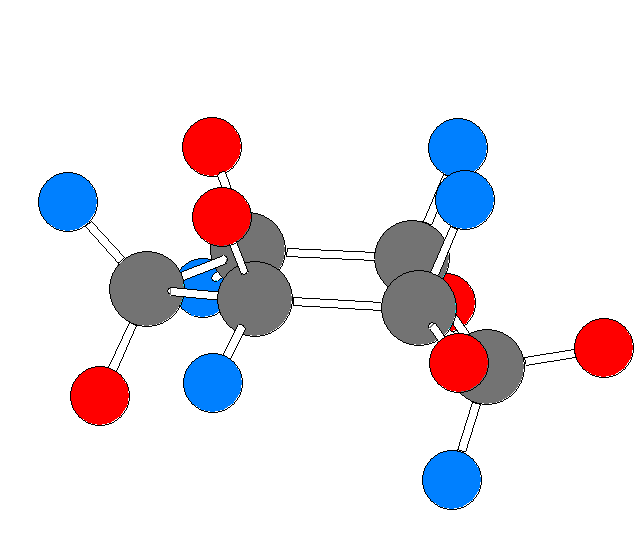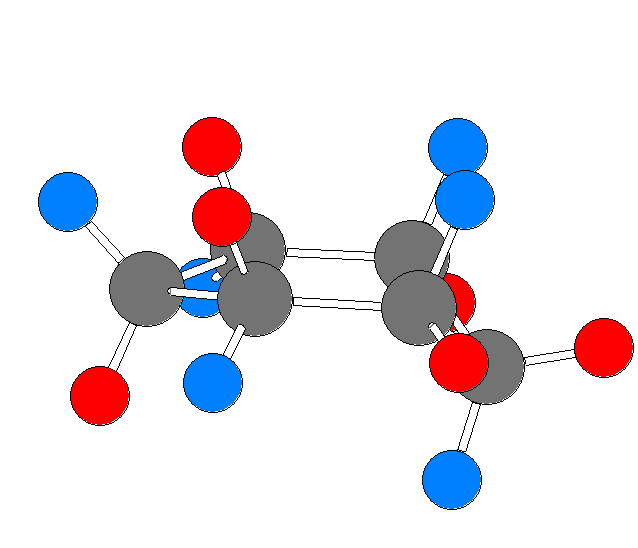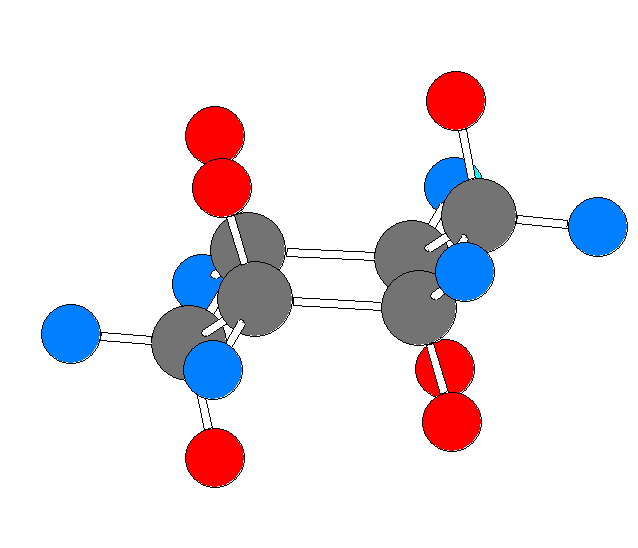
モルヒネの3次元模型 を見て数えて、自分の解答と照らし合わせてみること。
次のモルヒネの構造式中に、(一部の)水素を明示した。なお、矢印で示した炭素には、水素は結合していない。
2.12
骨格構造式に直す際、省略してよいのは炭素原子(の元素記号「C」)および、元素記号を省略した炭素上に結合した水素原子(の結合を表す価標および元素記号「-H」)のみであることに注意する。
窒素や酸素上の水素はもちろん、なにかの都合で炭素原子の元素記号を記した場合は、そこに結合した水素も省略しない。
(解答例)
置換命名法による命名を併せて示す。
(a) hexan-1-ol

(b) hexane

(c) 3,5-dimethylheptane
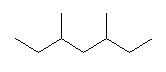
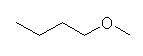
(d) 1-methoxybutane
(e) N-ethylpropan-1-amine
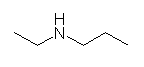
上記構造式の窒素上の水素原子は省略できない。
「N-ethyl」は、窒素上のエチル基を表す「置換基名」。
母体は「propan-1-amine」で、主鎖(プロパン)+接尾語(アミン)の形で命名されている。
もし、分子内にアミノ基に優先する官能基がある場合は、置換基名として「N-ethylamino」を用いるなどする。ただし、この分子を 1-(N-ethylamino)propane と命名するのは間違い。(置換命名法で命名する場合は、この分子の場合はアミノ基が最優先される官能基なので、接尾語「-amine」で命名する必要があるため。)
(f) 2-bromo-5-methylhexane
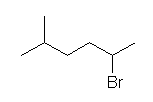
なお、基官能命名法では、
(a) hexyl alcohol
(d) butyl methyl ether
(e) ethyl propyl amine
となる。
2.13
2.12 のヒントを参照。
(解答例)
(a)
(b)
(c)
(d)
(e)
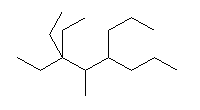
(f)
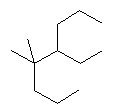
(g)
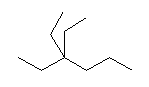
(h)
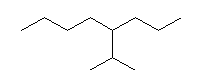
(i)
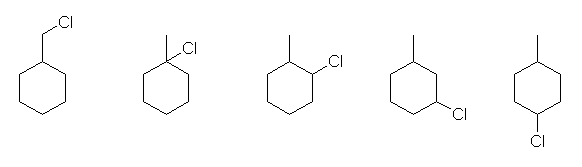
2.14
教科書では、§2.3(p92〜)を参照すること。環状炭化水素の主鎖の選び方は、p93「1.」で記しているように、鎖状部分と環状部分をくらべたときに、いずれかが炭素数が大きい場合は、その大きい方、炭素数が同数であれば環状部分となる。
(解答例)
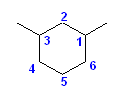
(a)
置換基の位置番号のつけ方について、シクロペンタン環上の2つの置換基の位置番号は、右回りに数えても、左回りに数えても 1,2 となり、「(3)位置番号の組が小さくなるように選ぶ」では決まらない。そこで、「(4)置換基の名称」により、アルファベット順に先のエチル基の結合した炭素を番号の小さい1位とする。
1-ethyl-2-methylcyclopentane
(b)
シクロアルカン上に置換基がひとつしかないので、1-ethyl〜 とはならない。位置番号は省略される。
ethylcyclobutane
(c)
置換基の位置番号のつけ方について、シクロヘキサン環上の3つの置換基の位置番号は、「(3)位置番号の組が小さくなるように選ぶ」で決められる。なお、命名上、側鎖置換基は、アルファベット順に並べられるため、エチル基 < メチル基の順に記す。(メチル基が2つあることを示す倍数接頭語の di はアルファベット順に考慮されない。)
4-ethyl-1,2-dimethylcyclohexane
(d)
3,6-dimethyldecane
(e)
2-cyclopropylpentane
(1-methylbutyl)cyclopropane では、主鎖の選び方の誤り。
(f)(g)(h)
側鎖を複合置換基として命名する場合には、カッコを忘れないこと。
複合置換基に組み込まれた倍数接頭語は、アルファベット順を考慮する際に含まれることに注意する。たとえば、1,1-dimethylethyl基は、(m ではなく)d で始まる置換基である。もし、この複合置換基が2つ結合した化合物では、倍数接頭語(di ではなく)bis を用いるので、たとえば 2-chloro-1,1-bis(1,1-dimethylethyl)cyclohexane などとなる。(この例では、c で始まるクロロ基 < d で始まる 1,1-dimethylethyl基の順にアルファベット順にならべている。)
また側鎖アルキル基に、慣用名を用いる場合、アルファベット順を考慮する際に、isopropyl 基、isobutyl 基は、「i」で始まる置換基であるが、ハイフンを挟んだ sec-butyl 基、tert-butyl 基、は、( s や t ではなく、)「b」で始まる置換基であることに注意する必要がある。
特に、(h) では、側鎖を複合置換基として命名している場合と、慣用名として命名している場合とでは、置換基の位置番号が入れ替わることに注意。これは、(a) と同様、「(4)置換基の名称」によりアルファベット順に先になる置換基の結合した炭素を1位とするためである。
(f) 1-ethyl-3-(2-methylpropyl)cyclohexane
または、1-ethyl-3-isobutylcyclohexane
(g) 5-(1-methylethyl)nonane
または、5-isopropylnonane
(h) 1-(1-methylethyl)-4-(1-methylpropyl)cyclohexane
または、1-sec-butyl-4-isopropylcyclohexane
2.15
2通りとは:
IUPAC体系名(置換命名法): 「側鎖置換基」+「主鎖」+「接尾語」
基官能命名法: 「アルキル基」+「スペース」+「一般名」
なお、基官能命名法による「alkyl halide」は、日本語で書くとき「ハロゲン化アルキル」となる。
例: methyl fluoride → フッ化メチル
(解答例)
命名において、置換命名法を用いたものにはスペースが入っていないこと、基官能命名法をもちいたものは、アルキル基と一般名の間にスペースが入っていることに注意する。
a) 2-chlorobutane
sec-butyl chloride
第2級のハロゲン化アルキルである。
b) 1-chloro-4-methylpentane
isohexyl chloride
第1級のハロゲン化アルキルである。
c) bromocyclohexane
cyclohexyl bromide
第2級のハロゲン化アルキルである。
置換命名法による上の場合、位置番号は省略される。
d) 2-fluoropropane
isopropyl fluoride
第2級のハロゲン化アルキルである。
2.16
メチルシクロヘキサンは、(あとで学ぶ「立体化学」、すなわち、環に対する上下の区別などを無視して考えれば)5種類の異なる環境にある水素があることに注意する。
(解答例)
メチルシクロヘキサンは、非等価な水素が5種類あるから、それぞれについて水素を塩素で置き換えた構造は、次の5つ。
左より、第1級、第3級、第2級、第2級、第2級、のハロゲン化アルキルで、命名は
(chloromethyl)cyclohexane
1-chloro-1-methylcyclohexane
1-chloro-2-methylcyclohexane
1-chloro-3-methylcyclohexane
1-chloro-4-methylcyclohexane
一番左の構造は、複合置換基として chloromethyl 基を持っているので、カッコが必要である。シクロアルカン上に置換基がひとつだけなので、位置番号は省略される。
2番目以降は、主基(接尾語として命名する官能基)は存在しないので、塩素、メチル基が置換したシクロヘキサンとして命名する。位置番号をつける際、置換基の位置関係だけでは1通りに番号を決めることができないので、アルファベット順で先にくる chloro 基で、位置を 1 とする。
2.17
a) では、体系的名称を書けという指示である。置換命名法を用いること。
なお、置換命名法をもちいるとき、エーテル結合は主官能基にはならないため、接尾語として命名することができない。
主鎖を探すときの規則は、1) 主官能基の数が最多、2) 多重結合が最多、3) 炭素鎖が最長の順に探すのであった。問いに挙げられた分子は、いずれも 1) 主官能基をもたない。2) 多重結合ももたない。であるから、3) に従い、最も長い炭素鎖を主鎖とする。(ここで、酸素原子は、炭素鎖の中に数えないことに注意してください。前回の宿題の中で、何人かがこの手の間違いをしていました。)
また、主鎖が選ばれた次に炭素に順に番号を振るのですが、この順についても、1) 主官能基の位置番号を最も小さく、2) 多重結合の位置番号を最も小さく、3) 側鎖置換基の位置番号を最も小さく、の順でした。1)、2) は上と同じ理由でここでは考慮しなくてよいので、側鎖の位置番号(の組)を最小にします。(主官能基ではないので、)エーテル結合(アルキルオキシ基)も、アルキル基と同列に扱われます。その上で、数字の組が小さくなるように選んでください。
b)、c) この教科書の用語では、エーテルについての「慣用名」と表記しているのは、基官能命名法にもとづいたもの(「アルキル基」+スペース+「アルキル基」+スペース+「一般名;すなわち、『エーテル』」)のことです。
(解答例)
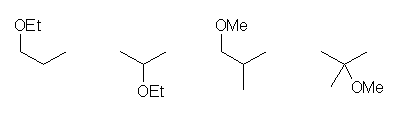
次に示すうち、置換命名法のものが問いの a) に対する答えである。この教科書の用語で「慣用名」は、基官能命名法による命名で、c) に対する答えである。基官能命名法も、アルキル基を命名することさえできれば、原則的に可能であるのだが、アルキル基が単純な名称をもつもの以外は用いない方がよいだろう。
1) 置換命名法における主鎖は、(主基も多重結合もないので)最も長い炭素鎖なので、エタンである。
置換命名法: methoxyethane
基官能命名法:ethyl methyl ether
2) エーテル結合に対して左右対称である。置換命名法では、主鎖は(どちらを選んでも)エタンである。また、基官能命名法では、「アルキル基」+スペース+「アルキル基」+スペース+「一般名;すなわち、『エーテル』」とするところ、2つのアルキル基が等しいから、「ジアルキル」+スペース+「エーテル」とする。
置換命名法: ethoxyethane
基官能命名法: diethyl ether
3)
置換命名法: 4-methoxyoctane
炭素数の大きい方のアルキル基に慣用名がないから、基官能命名法はあまり一般的ではないが、次の2つのいずれかで命名することも可能。
methyl 1-propylpentyl ether
methyl octan-4-yl ether
末端炭素の位置で結合した第1級のアルキル基(炭素8であれば、octyl 基、オクチル基)ではなく、第2級のアルキル基について、後者の様に octan-4-yl 基、オクタン-4-イル基とする方法は、1993年IUPAC 以降の規則で認められている。ただし、この規則を適用する場合、第1級のアルキル基においても位置番号は省略せず、octyl 基を octan-1-yl 基と呼ぶことになる。
4) 置換命名法における主鎖は、炭素数の長いところで探すとブタンである。このブタンの上には、2つの置換基が結合している。位置番号の数字の組が小さくなるように選ぶ。
置換命名法: 1-isopropoxy-3-methylbutane
ここで、isopropoxy 基は、isopropyloxy 基の短縮形(発展の項を参照のこと)
1-isopropyloxy-3-methylbutane
1-(1-methylethyloxy)-3-methylbutane
のいずれかでも可。
基官能命名法に従う場合は、両アルキル基が慣用名をもつから、
isopentyl isopropyl ether
5) 置換命名法における主鎖は、炭素数の長いところで探すとブタンである。
置換命名法: 1-propoxybutane
基官能命名法: butyl propyl ether
6) 置換命名法における主鎖は、炭素数の長いところで探すとペンタンである。
置換命名法: 2-isopropoxypentane
4) と同様、isopropoxy 基は、isopropyloxy 基の短縮形(発展の項を参照のこと)
基官能命名法を用いる場合、構造の似ている(炭素数の1つ少ない)butan-2-yl 基は、sec-butyl 基という慣用名をもつのに対し、pentan-2-yl 基には、慣用名が無い。従って、もし、sec-pentyl 基と書いてしまうと誤りである点に注意しなければいけない。
基官能命名法では、3) に倣って次の2つのいずれかで命名することも可能。
isopropyl 1-methylbutyl ether
propan-2-yl pentan-2-yl ether
(発展)
原則として RO- 基は、「アルキル」+「オキシ」基として命名するが、次のもののみ、短縮形(アルコキシ)とした簡略名の使用が推奨される。
CH3O- : methoxy-
C2H5O- : ethoxy-
C3H7O- : propoxy-, isopropoxy-
C4H9O- : butoxy-, isobutoxy-, sec-butoxy-, tert-butoxy-
C6H5O- : phenoxy-
これ以外のものは認められていないから、例えば n-C5H11-O- は、ペンチルオキシ基、pentyloxy 基としなければいけない。ペントキシ基、pentoxy 基は許容されていない。
2.18
「同族体」についての説明は、教科書の p80 にあります。(こういうとき、巻末の索引を用いてくださいね。)
(解答例)
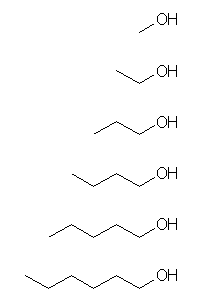
同族体(homolog)は、共通の構造をある程度たもちながら炭素鎖の長さが異なるもので、メチレン基 -CH2- を一つずつ増やしていった関係のものである。これを、アルコールについて、炭素の数が1から6に至るまで行うのであるから、次のものが互いに同族体である。
構造式、置換命名法、基官能命名法 の順に示す。
CH3OH, methanol, methyl alcohol
CH3CH2OH, ethanol, ethyl alcohol
CH3CH2CH2OH, propan-1-ol, propyl alcohol
CH3CH2CH2CH2OH, butan-1-ol, butyl alcohol
CH3CH2CH2CH2CH2OH, pentan-1-ol, pentyl alcohol
CH3CH2CH2CH2CH2CH2OH, hexan-1-ol, hexyl alcohol
これを骨格構造式で描いておこう。
また、次のものも互いに同族体である。
(CH3)2CHOH, propan-2-ol, isopropyl alcohol
(CH3)2CHCH2OH, 2-methylpropan-1-ol, isobutyl alcohol
(CH3)2CHCH2CH2OH, 3-methylbutan-1-ol, isopentyl alcohol
(CH3)2CHCH2CH2CH2OH, 4-methylpentan-1-ol, isohexyl alcohol
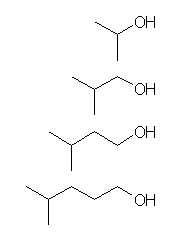
2.19
体系的名称(置換命名法に従ったもの)をつける。従って、基官能命名法に従った「なんとかアルコール」とはならないことに注意する。
水酸基(-OH)が主基(主官能基)である。命名上の母体(主鎖+接尾語)のもととなる主鎖を選ぶとき、および主鎖に位置番号を置くとき、いずれも炭素鎖の長さ(や、多重結合;ここに挙げられた構造中には無いが)に優先して、主基の結合した炭素鎖から選び、主基の位置番号が小さくなるように番号をつける。
(解答例)
いずれも主基である水酸基の位置番号が小さくなるように選ぶことに注意。
また、b)、e) では(主基が環上に1つなので、必ず主基の位置を1にするために)-1-ol の位置番号は省略される。それに対し、a) や b) では主基の位置が1以外の異性体が存在するから、主基の位置番号 -1-ol は省略できない。
また、接尾語 -ol が母音から始まっているから、母体主鎖アルカンの最後の e が落ちていることにも注意すること。(間に位置番号の数字を挟んでいても、母音が重なっている形であるから、propane-1-ol は、誤りである。)
a) propan-1-ol
b) 4-methylcyclohexan-1-ol
c) 5-chloro-2-methylpentan-2-ol
d) 5-methylhexan-3-ol
e) 4-chloro-3-ethylcyclohexanol
f) 2,6-dimethyloctan-4-ol
第1級のアルコールは、a)
第2級のアルコールは、b), d), e), f)
第3級のアルコールは、c)
2.20
C6H14O が分子式である。
この分子式について整理しておく。酸素は、2本の結合を持つ元素である。従って、アルカン R-H の水素を水酸基で置き換える場合、R-O-H となり、この置き換えの前後で水素の数が増減していないことがわかる。また、アルカンにエーテル結合を導入する場合も同じである。R-R' という炭素-炭素間の結合に酸素を挟みこんで R-O-R' としても、2つのアルキル基の構造(従って水素の数)には変化がない。
一般的な事実として、CnHm という分子と、CnHmO という分子は、n, m が不変なら、不飽和度(分子内に多重結合や環の構造がどれだけあるのかについての指数)は変化しない。(酸素の数は、いくつでも変わらない。)つまり、C6H14O は、C6H14 と同じ不飽和度を持つ。C と H の数が、n、2n+2 の関係なので、これは多重結合も環状構造も持たないことがわかる。すなわち、C6H14O が分子式である化合物は、(C6H14と同様に)多重結合も環の構造も持たない。
さて、その上で、C6H14O が分子式であるアルコールを重複なくすべて描いて、与えられた条件に従うものを探す。
その際、問い 2.3 の解答例で解説した方法と同じようにして、1) アルカン C6H14 の骨格異性体を重複なくすべて書き出してから、2) 等価ではない水素をひとつずつ水酸基に置き換える、といった手順で考えるとよい。
(解答例)
1) アルカン C6H14 の骨格異性体を重複なくすべて書き出してから、2) 等価ではない水素をひとつずつ水酸基に置き換える、といった手順で考える。
C6H14 の骨格異性体を重複なくすべて書き出すため、主鎖が hexane であるもの、pentane であるもの、butane であるもの、というように探すと次の5通りが見つかる。
そのそれぞれについて、等価ではない水素を水酸基に置き換えることにより、すべてのC6H14O の分子式をもつアルコールを得ることができる。(同じ分子式をもつエーテルも存在する。)ただし、この問いでは、第3級のアルコールを書き出せばよい。
第3級のアルコールは、アルカンの第3級の水素を水酸基に置き換えた構造をもつから、該当するのは、次の3つである。
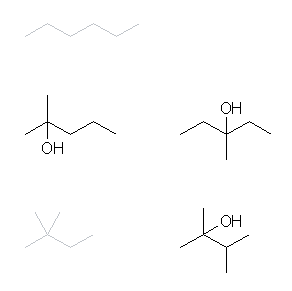
2-methylpentan-2-ol, 3-methylpentan-3-ol
2,3-dimethylbutan-2-ol
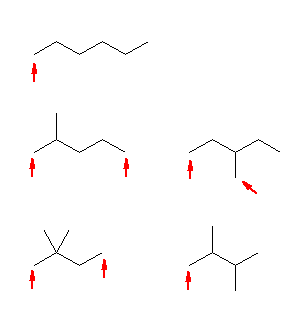
問われてはいないが、同様に第1級のアルコールを探すと、8通り、
(次の図では、 C6H14 の骨格異性体について、第1級の水素の位置を、等価なものを省いて示した。)
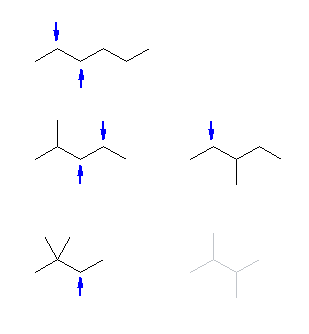
第2級のアルコールを探すと6通りとなる。
(次の図では、 C6H14 の骨格異性体について、第2級の水素の位置を、等価なものを省いて示した。)
2.21-2.30
2.21
a),b) 基官能命名法(「アルキル基」+スペース+「一般名」)で命名するときに、アルキル基の部分が、第何級であるか(一般名を決める置換基が結合している炭素が第何級であるのか)で考えればよい。
c) アミンの場合は、アミノ基の結合した炭素の級数ではなく、アミノ基の窒素の級数なので、注意する必要がある。(教科書 p100 参照、問い2.22ヒント参照)
※ 細かいことではあるが、上の説明で「主官能基の結合した炭素」ではなく、「一般名を決める置換基が結合した炭素」と表現しているのは、a) のようなハロゲン化アルキルのハロゲンは、置換命名法における主官能基にはなれない(接尾語として命名できない)からである。
(解答例)
a) 第3級のハロゲン化アルキルである。
b) 第3級のアルコールである。
c) 第1級のアミンである。
置換命名法による化合物名
a) 2-bromo-2-methylpropane
b) 2-methylpropan-2-ol
c) 2-methylpropan-2-amine
基官能命名法による化合物名
a) tert-butyl bromide
b) tert-butyl alcohol
c) tert-butyl amine
2.22
問い 2.17 と同様、この教科書の用語で「慣用名」と表記しているのは、基官能命名法にもとづいたもののことです。
従って、基官能命名法、置換命名法の両者で答えればよい。
アルコールやハロゲン化アルキルの級数は、その一般名を決める炭素が第何級であるかによって決まるのであるが、アミンの場合は、アミノ基の結合した炭素ではなく、窒素上にいくつアルキル基が結合しているかによって決められるので注意すること(教科書 p100, p101 の上)。
(解答例)
窒素上のアルキル基を数える。
第1級のアミン: a), c)
第2級のアミン: b), d), f)
第3級のアミン: e)
置換命名法による化合物名(体系名)
a) hexan-1-amine
b) N-isobutylbutan-2-amine
または、 N-(2-methylpropyl)butan-2-amine
c) cyclohexanamine
d) N-propylbutan-1-amine
e) N,N-diethylpropan-1-amine
f) N-ethyl-3-methylcyclopentanamine
置換命名法では、-amine が接尾語である。母音ではじまる接尾語なので、主鎖アルカンの最後の e が落ちることに注意する。また、置換命名法では、「アルカン」と「-amine」 の間にスペースが入らない。
b) では、主基(アミノ基)の結合した炭素鎖で、もっとも長い部分を探す。与えられた構造式のアミノ基右側は、2位にアミノ基の結合したブタン、左側は(総炭素数は、右側と同じ4つであるが)メチル基とアミノ基の結合したプロパンである。従って、右側のブタンが主鎖であり、butan-2-amine として命名する必要がある。
基官能命名法による化合物名(この教科書の用語で「慣用名」)
a) hexyl amine
b) sec-butyl isobutyl amine
c) cyclohexyl amine
d) butyl propyl amine
e) diethyl propyl amine
f) ethyl 3-methylcyclopentyl amine
×f) ethyl 3-methylcyclohexyl amine
基官能命名法では、「amine」は、接尾語ではなく、アミノ基をもつ化合物の一般名である。「アルキル」と「amine」の前に、スペースが入る。
b) で、2つのアルキル基の名称におけるアルファベット順を考慮するとき、sec-butyl 基は、b 始まり、isobutyl 基は i 始まりであることに注意すること。
2.23
※ 構造を描くとともに、基官能命名法で化合物名が与えられているものについては置換命名法で、置換命名法で化合物名が与えられているもについては基官能命名法で、それぞれ命名しなおしてみること。
(解答例)
a) 1-プロパンアミン(propan-1-amine)が母体である。
授業配布のプリントを見よ。置換命名法で、主鎖を選択するとき、上記図で窒素の右へ数えても左へ数えても、炭素長は等しい。「1) 主基の結合した炭素鎖で、2) 多重結合の数、3) 炭素鎖の長さ、4) 二重結合数の数、5) 主基の位置番号、6) 多重結合の位置番号」の条件では、選択できないが、その下位の優先順位である規則 「(7) 側鎖の数の多い方を主鎖として選ぶ」により、上図、青で示した部分が母体となる。
基官能命名法では : isobutyl propyl amine
b) ethanamine が母体である。
基官能命名法では : diethyl amine
c) hexan-1-amine が母体である。
基官能命名法では : 5-methylhexyl amine
(isoheptyl 基という慣用名は、認められていない)
d)
置換命名法では : N-methyl-N-propylpropan-1-amine
e) pentan-3-amine が母体である。
基官能命名法では : dimethyl pentan-3-yl amine 、または、1-ethylpropyl dimethyl amine
f)
置換命名法では : N-ethyl-N-methylcyclohexanamine
2.24
問い 2.22 のヒントを参照すること。
(解答例)
窒素上のアルキル基を数える。
第1級のアミン: a), d)
第2級のアミン: b)
第3級のアミン: c)
置換命名法による化合物名(体系名)
a) 6-methylheptan-1-amine
b) 3-methyl-N-proylbutan-1-amine
c) N-ethyl-N-methylethanamine
d) 2,5-dimethylcyclohexanamine
d) のシクロヘキサン環の位置番号は、主基であるアミノ基を 1 とし、他の置換基の位置番号の組がなるべく小さくなるように(次にでてくる置換基の数字を小さくするように)選ぶので、教科書の問いの構造で、アミノ基からはじめて反時計回り。
基官能命名法による化合物名(教科書の用語で「慣用名」)
a) 6-methylheptyl amine
(isooctyl 基という慣用名は認められていない。)
b) isopentyl propyl amine
または、 3-methylbutyl propyl amine
c) diethyl methyl amine
d) 2,5-dimethylcyclohexyl amine
2.25
混成状態を考えよ。
(解答例)
a) エーテル酸素は、2本の単結合と2対の孤立電子対をもつ。従って、σ 結合と孤立電子対の和は4。従って、sp3 混成をもち、結合角はおよそ 110 度。
b) アミン窒素は、3本の単結合と1対の孤立電子対をもつ。従って、σ 結合と孤立電子対の和は4。従って、sp3 混成をもち、結合角はおよそ 110 度。
c) アルコール水酸基の酸素は、2本の単結合と2対の孤立電子対をもつ。従って、σ 結合と孤立電子対の和は4。従って、sp3 混成をもち、結合角はおよそ 110 度。
d) 第4級のアンモニウム塩の中心窒素は、4本の単結合をもつ。従って、σ 結合と孤立電子対の和は4。従って、sp3 混成をもち、結合角はおよそ 110 度。
2.26
水素結合の形成には、酸性度の高い水素(その水素を与えたときに描かれる共役塩基の構造がなんらかの理由で安定であるもの。通常、電気陰性度の高い原子上にある場合が多いが、例外もある。)と、電子対(ルイス塩基)が必要である。
他の物質と混合せず単独で水素結合を示すためには、その物質の構造中に、上記2つともをあわせもたないといけない。
教科書の「問題解答の指針」の囲みも参照すること。特に、酸素、窒素、(硫黄)、および、フッ素が水素結合受容能をもつことに注意する。
(解答例)
0) ethanol
酸性度の高い水素(水酸基の水素、pKa 15 程度)をもつ。
水酸基の酸素原子がルイス塩基性を示す。
そのため、エタノールは分子間に水素結合がある。
1) butanoic acid
酸性度の高い水素(カルボキシ基の水素、pKa 5 程度)をもつ。
酸素原子がルイス塩基性を示す。(主にカルボキシ基のカルボニル酸素)
そのため、同種の分子同士で水素結合をする。また、エタノールとも水素結合する。
2) diethyl methyl amine; N,N-dimethylethanamine
酸性度の高い水素を持たない。
窒素原子が孤立電子対をもっており、ルイス塩基性を示す。
そのため、水素結合供与能はなく、水素結合受容能はあるので、同種の分子同士では水素結合できないが、エタノールのように水素結合供与能をもつ物質とは、水素結合する。
3) 1-bromobutane
(十分に)酸性度の高い水素はない。強いていえば、臭素の結合した炭素上の水素は、他の位置の水素の比べれば、相対的に酸性度が上がっている。
ルイス塩基性は示さない。臭素は、孤立電子対をもつが、中性分子におけるハロゲン(ただし、フッ素以外)の電子対は、ほとんど水素結合受容能を示さない。(ただし、負電荷をもつハロゲン化物イオンは、ルイス塩基である。)
従って、同じ分子同士で水素結合を示さない。また、エタノールとも水素結合をしない。
4) methyl propyl amine; N-methylpropanamine
第2級のアミンは、窒素上に酸性度の高い水素を持ち、水素結合供与能を示す。
窒素原子が孤立電子対をもっており、ルイス塩基性を示す。
そのため、同種の分子同士でも水素結合することができ、エタノールとも水素結合する。
5) 2-ethoxyethanol; ethylene glycol monoethyl ether
酸性度の高い水素(水酸基の水素、pKa 15 程度)をもつ。
水酸基の酸素、および、エーテル酸素が、ともにルイス塩基性を示す。
そのため、同種の分子同士で水素結合をする。また、エタノールとも水素結合する。
6) 1-fluorobutane
酸性度の高い水素は無く、水素結合供与能は示さない。(酸素、窒素、フッ素に結合した水素は、水素結合供与能を示すが、ここでは、フッ素に結合した水素はない。フッ素の結合した炭素上の水素は、水素結合供与能を示すわけではない。)
中性分子のハロゲンではあるが、フッ素は例外的に水素結合受容能をもつ。
そのため、、同じ分子同士では水素結合を示さないが、エタノールとは水素結合をすることができる。
(発展)
物質の沸点などに影響を与える「分子間引力」は、いくつかに分類されるが、いずれも静電引力(すなわち、+電荷と−電荷の間の引力)によるものである。
1) イオン−イオン結合(陽イオンと陰イオンの間の引力)
2) イオン−双極子結合(陽イオンと水の酸素上の δ- だったり、陰イオンと水の水素上の δ+ だったり。)
たとえば、食塩(NaCl)は、沸騰し気化する(周囲のナトリウムイオンや塩化物イオンとのイオン−イオン結合を切って、NaCl 分子として飛び出していく)ためには、1400℃ 以上に加熱してやる必要がある。一方で、食塩を水に入れてかき混ぜると、すぐに溶けてバラバラの(溶媒和を受けた)イオンになってしまう。1本ずつのイオン−双極子結合(下方の表に示すように、イオン−イオン結合の1/10程度)がさほど強くなくても「周囲の水全体からの和」になるから、かなり大きな影響をもつことがわかるだろう。この「溶媒和」の概念は、有機化学を学ぶにあたって、あとで非常に大きな意味合いをもってくる。
3) 双極子−双極子結合(電気的に中性な分子であっても、分極を生じて双極子モーメントを持つ場合※、その部分電荷 δ+ と δ- の間の引力である。)
たとえば、エーテルは、ほぼ同じ構造や分子量をもつアルカンと比較して沸点が高い。(教科書では、テトラヒドロフラン, THF と、シクロペンタンで比較している。)
ここで、アルコールは、水素結合をもつのに対し、エーテルは(水素結合を受けることのできるルイス塩基性の酸素をもつものの、酸性度の高い水素を持たないので、)単独では水素結合をもたないので注意する。
4) 双極子−誘起双極子相互作用。単独では全く分極を持たない分子でも、近傍に電荷が存在すると、+電荷により δ- が、-電荷により δ+ が誘起され、結果として静電引力を生じる。
5) 誘起双極子−誘起双極子相互作用(ロンドンの分散相互作用)(van der Waals 力)すべての分子間に働く力である。近隣分子の中での電子密度の揺れに起因する瞬間双極子に対し、それに誘起された双極子(δ+ の近傍には、δ-が誘起される)が引力を示す。
電気的中性、無極性であるような分子間に働く引力としては、この分散力が最も大きな寄与をもち、分子と分子の接触面積に(ほぼ)比例した大きさを示す。
6) 水素結合。教科書(ブルース「有機化学」)では区別しているが、水素結合を双極子−双極子結合の一種と考えることもできる。水素結合の供与体となるのは、酸性度の高い(電気陰性度の高い原子上にあって、正に分極し &edlta;+ をもつ)水素と、酸素などの孤立電子対(負に分極している)の間の引力であり、水素の酸性度が高いほど強く、また同時に、ルイス塩基(電子対供与体)の塩基性が高いほど強い。典型的な水素結合の強さとして、約 20 kJ/mol という値を知っておくとよいだろう。
相互作用の典型的な大きさ、距離依存性は、次の通り(出展:アトキンス「物理化学」第6版)
| 相互作用の型 | 距離依存性 | 典型値(kJ/mol) | 註 |
| イオン−イオン | 1/r | 250 | |
| イオン−双極子 | 1/r2 | 15 | |
| 水素結合 | 20 | ||
| 双極子−双極子 | 1/r3 | 2 | 静止している双極子間 |
| 双極子−双極子 | 1/r6 | 0.6 | 回転している双極子間 |
| ロンドン(分散) | 1/r6 | 2 | すべての分子同士にはたらく |
イオン−イオン相互作用よりもイオン−双極子相互作用の方が小さいことを、ごく単純に近似して議論すると、次のようになる。すなわち、 Aδ+-Bδ-…(+) というような相互作用を考える場合、「Bδ-…(+)」の部分は引力であるが、「Aδ+- -…(+)」の間には斥力が働くからである。
分散力で、距離依存性が 1/r6 であるということは、わずかでも距離が伸びると引力の大きさが、途端に減衰してしまうことを意味しており、分子が接したときに初めて生じる引力であることがわかる。
※二酸化炭素や四塩化炭素のように、分子が永久双極子をもっていなくても、それぞれの結合は大きく分極しているような分子もある。(ただ、対称性のため双極子モーメントはゼロである。)議論の詳細は、ここでは省略するが、引力的相互作用はゼロにはならないが、距離依存性が大きく、単純化された議論では省略することがある。
2.27
メタン、エタン、プロパン、ブタンと分子が大きくなると、その表面積が増えるので、分子間の接触面積の増加に伴って van der Waals の相互作用(ロンドンの分散力)が大きくなる。そのため。同族列であれば分子量が大きいほど沸点や融点が高い傾向がある。
ここでは、そういった分子量だけから推測される沸点の順に、逆転が起きているような組み合わせが示されている。すなわち、van der Waals 力(ロンドンの分散力)以外の分子間相互作用を考え、その大小を議論すること。
(解答例)
水、メタノール、アンモニア、フッ化水素のいずれも分子間の水素結合があり、通常予測されるよりも沸点が高い。
水の水素結合は、教科書 p108 の模式図に示されるように、酸素上の2組の孤立電子対と、2つの酸性水素を使用するので、隣接する4つの分子との間に水素結合を形成し、3次元的なネットワークを形成する。それに対し、孤立電子対を1対しかもたないアンモニアや、酸性水素を1つしか持たないメタノールやフッ化水素は、水素結合しても直線型しかとれない。
a) メタノールは、疎水部であるアルキル基(メチル基)をもち、また、酸性水素を1つしか持たない。そのため、水のような水素結合による3次元のネットワークを形成することができず、…O(R)-H…O(R)-H… と直線型になる。(R はメチル基で、酸素より下方に伸びているものとして見てください。)そのため、左右の2つの分子との間に水素結合しているだけなので、水における水素結合(4本)よりも安定化の効果が小さい。
b) 酸素上の水素の方が窒素上の水素より酸性度が高いので、アンモニアにおける水素結合より、水における水素結合の方が強いと考えられる。また、アンモニアには孤立電子対が1組しかないから、水素結合しても …NH3…NH3…NH3… と直線型になる。そのため、左右の2つの分子との間に水素結合しているだけなので、水における水素結合(4本)よりも安定化の効果が小さい。
c) b) と同じ理屈を並べるなら、1本の水素結合についてはその強さは、フッ化水素におけるものの方が、水における水素結合より強いと考えられる。しかし、その本数が異なる。フッ化水素が水素結合をすると、…H-F…H-F…H-F… と直線型になる。そのため、左右の2つの分子との間に水素結合しているだけなので、水における水素結合(4本)よりも安定化の効果が小さい。
いずれも、水素結合で、より大きく安定化を受けている水分子は、そのネットワークから分子を飛び出させるためには余分な熱エネルギーが必要である。すなわち、沸点が高い。
2.28
沸点は、データベースやウェブで調べることも可能であるが、ここでは、分子間力の大小を推測することで、沸点の順をつけること。
たとえば、メタンと水とアンモニアのように、沸点の順を感覚として知っているような物質に照らし合わせてかんがえてやると、間違いは減るはずである。
(解答例)
沸点の高いほうから低い方に並べる。
propane-1,2,3-triol > butane-1,2-diol > pentan-3-ol > pentan-3-amine > hexane > 3-methylpentane
水素結合性の水酸基の数で、はじめの3つのアルコールの沸点の順がきまっている。アルコールとアミンでは(水とアンモニアで、水の方が沸点が高い、アンモニアは常温常圧では気体)アルコールの方が水素結合が強い。これは水素の酸性度(アルコールの pKa 15程度、第1級アミンの pKa 40程度)が影響しているものと思われる。また、水素結合性の置換基の無いヘキサンと 3-メチルペンタンは、分子量が同じである。いずれも分子全体として双極子モーメントをもっていないので、ロンドンの分散力が分子間力に対して支配的であるが、ロンドンの分散力は、2.26 の(発展)の項でも示したように、分子間の接触面積が大きいほど強い。従って、同じ分子量のアルカンであっても、枝分かれのない細いひも状の分子の方が、枝分かれがあることで分子の形が丸っこくなって表面積も小さくなったものよりも沸点が高い。
2.29
a) 同族列であるから、分子量のみで比較してよい。
b) 4つの選択肢のうち、3つまでは骨格異性体である。ロンドンの分散力は、2.26 の(発展)の項でも示したように、分子間の接触面積が大きいほど強い。
c) 4つの選択肢のうち、3つは、-CH3, -OH, -Cl という変化である。それぞれの構造に対応してありえる分子間相互作用の形を考えてみること。2.26 の(発展)の項も参照すること。
(解答例)
沸点の高いほうから低くなる順に示す。
a) 1-bromohexane > 1-bromopentane > 1-bromobutane
b) n-nonane > n-octane > 2-methylheptane > 2,2,3,3-tetramethylbutane
c) pentan-1-ol > butan-1-ol > 1-chlorobutane > pentane
ペンタノールとブタノールは同族列なので、分子量で沸点順が決まる。また、ブタノール、1-クロロブタン、ペンタンは、炭素の数だけ見れば4、4、5となっているが、分子量(というより、分子の表面積)はほぼ同じとみなせる。これらのうち、水素結合をもつのは、アルコールであるので、最も沸点が高い。1-クロロブタンとペンタンは、ともに水素結合はない。1-クロロブタンは、塩素、炭素の電気陰性度の差により分極しているため、双極子モーメントがゼロではない。そのため、ペンタンより沸点が高い。
(発展)
なお、「分子量で比較する」という言葉から、「重いものが沸騰しにくい」=「沸騰は、分子が重力に打ち勝って飛び出していく」というイメージをもつ学生もいるようですが、それは誤りです。大気圧と分子間の引力が、分子を束縛していて、熱エネルギーがこれに対向するだけですので、重力は直接には関係ありません。分子量が大きいほど、分子の表面積が大きくなるので、van der Waals力(ロンドン力)が強くはたらく(そのため、分子間の束縛が強くなる)だけです。
2.30
教科書 p111 の記述を詳読すること。
水への溶けやすさは、親水部の水に対する親和性の高さと、分子全体に対する親水部の割合できまる。
b) は、教科書の記述のみでは、正しく判断できないと思います。教科書の記述(「4個以下(3個以下)の炭素をもつアルコールは水に溶けるが、4個以上(5個以上)の炭素をもつアルコールは水に溶けない」)および、下の(発展)の項を参照してください。
(解答例)
水に対する溶解度の大きいものから小さくなる方向に示す。
a) propane-1,3-diol > propan-1-ol > butane-1-ol > 1-chlorobutane
はじめの3つ(アルコール)については、水酸基1つあたりの炭素数が、1.5個、3個、4個です。クロロブタンは親水部がありません。
b) cyclopentanamine > cyclopentanol > methylcyclopentane
沸点は、アルコール > アミン > アルカン となりますが、水への溶解度は事実上、逆のようですね。シクロペンタンアミン(シクロペンチルアミン)は、水に可溶、シクロペンタノール(シクロペンチルアルコール)は水に微溶です。
(発展)
ボルハルト=ショアー「現代有機化学(下)」の記述より引用
アミンは、アルコールよりも弱い水素結合を形成する。
アルコールは容易に水素結合を形成する(上巻;8-2節参照)ので、異常に沸点が高い。原理的にはアミンも同じようになるはずであり、表21-1は確かに予想どおりであることを示している。しかし、アミンはアルコールよりも水素結合が弱い*ので、アミンの沸点はアルコールよりも低くなり、水に対する溶解度も小さい。一般にアミンの沸点は、対応するアルカンとアルコールの沸点の中間になる。アミンは水やアルコールと水素結合することができるので、比較的小さなものはこれらの溶媒に可溶である。アミンの疎水性部分が炭素6個を越えると、水に対する溶解度は急激に減少し、それより大きなアミンは、事実上、水には不溶である。
(赤字強調はこのウェブ用です。)
*水素結合するときすべてのアミンが水素受容体となれるが、水素供与体になれるのは第一級および第二級アミンだけである。これは、第三級アミンが供与できる水素をもっていないからである。
2.31-2.40
2.31
シクロヘキサンは、親水部を全く持っていない分子である。すなわち、水とは混ざらない。なので、水と混ざり
(解答例)
エタノール
理由はヒントに書いたとおり。
2.32
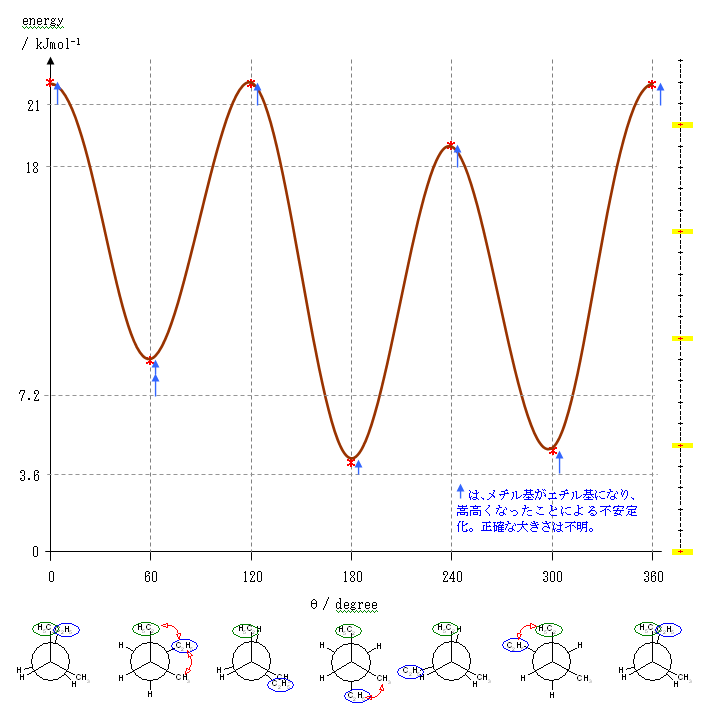
ペンタンの C2 - C3 結合のまわりの回転:
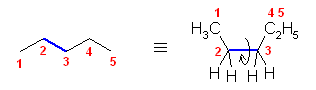
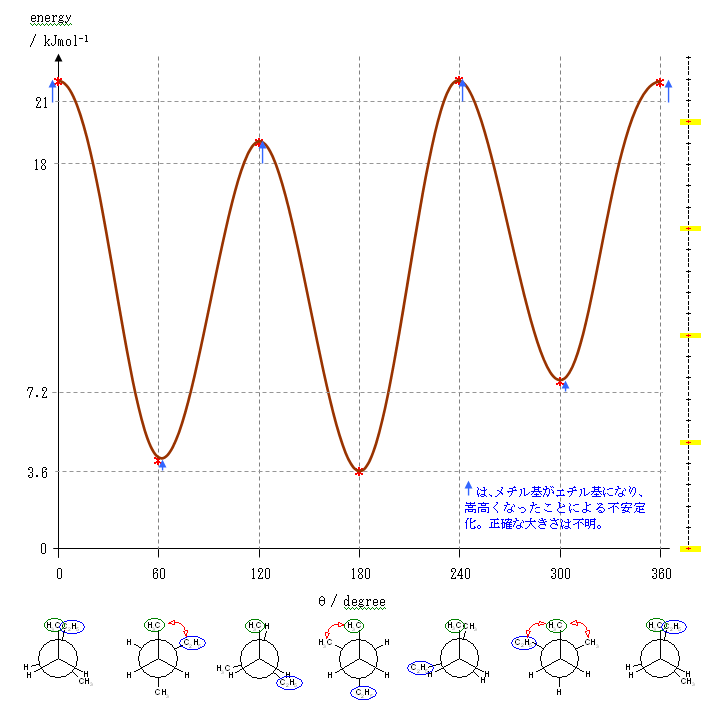
ポテンシャルエネルギーの概形については、ブタンの C2 - C3 結合のまわりの回転に関するポテンシャルエネルギー図(教科書 p 116、図 2.5)を参照してください。
要点を整理しておくと、
- 重なり形配座には、3組の重なり形相互作用があり、それぞれの組の相互作用の和が分子全体のポテンシャルエネルギーとなる。
水素−水素間: 4 kJ/mol
水素−メチル間: 6 kJ/mol
メチル−メチル間: 11 kJ/mol - ねじれ形配座では、ゴーシュ相互作用の有無を確認する必要がある。60度の2面角の位置のうち一方でも水素である場合は、ゴーシュ相互作用を考えなくてよいが、アルキル基同士がその位置関係にある場合は、無視できない。
メチル−メチル間: 3.8 kJ/mol
(解答例)
2位炭素上のメチル基(1位炭素)および、3位炭素上のエチル基(4位炭素、5位炭素)の間の2面角を基準とした。(360度で1回転であるが、2面角360度は、0度のときと同じであるので表からは省略している。)
(※)以下の表で、ポテンシャルエネルギーを求める際にはエチル基とメチル基が同じ反発をもつものとしている。
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 | 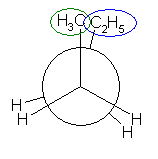 |
 |
 |
 |
 |
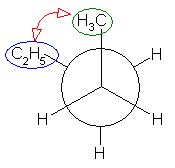 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | メチル−エチルの重なり×1 水素−水素の重なり×2 |
メチル−エチルのゴーシュ相互作用 | メチル−水素の重なり×1 エチル−水素の重なり×1 水素−水素の重なり×1 |
なし | メチル−水素の重なり×1 水素−水素の重なり×1 エチル−水素の重なり×1 |
メチル−エチルのゴーシュ相互作用 |
| ひずみエネルギーの概値※ | 11+4+4 19 kJ/mol |
3.6 kJ/mol | 6+6+4 16 kJ/mol |
0 kJ/mol | 6+4+6 16 kJ/mol |
3.6 kJ/mol |
以上の概算値をもとにポテンシャルエネルギー図を書く。
まず、それぞれの配座ごとのひずみエネルギーの大きさをプロットし、
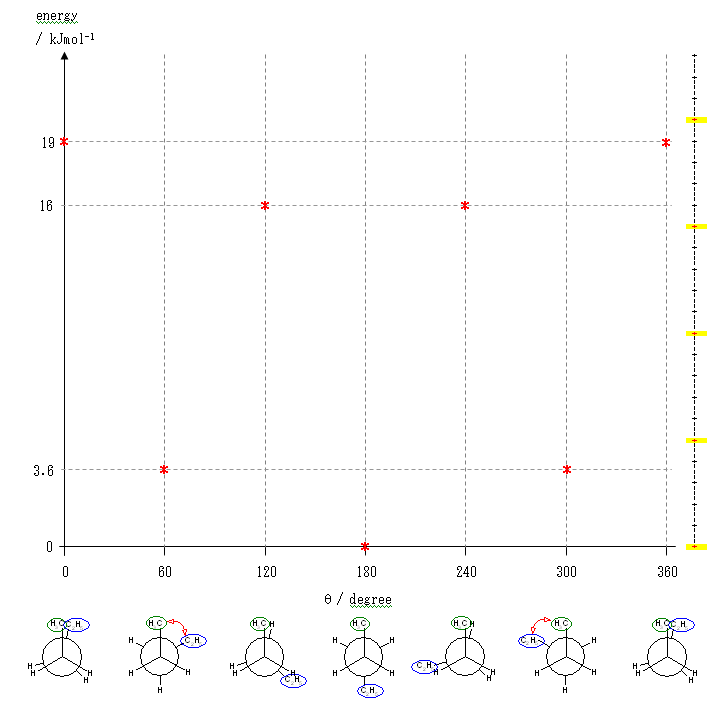
ついで、これを滑らかな線で結ぶ。
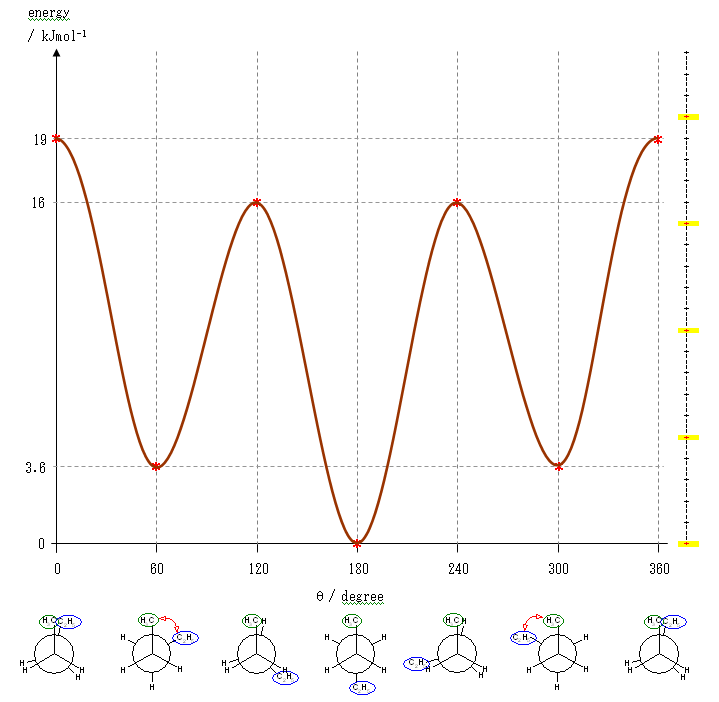
ここでは、横軸を、上の表と共通になるよう、2位炭素上のメチル基(1位炭素)および、3位炭素上のエチル基(4位炭素、5位炭素)の間の2面角としているが、任意の回転の位置を基準としても書ける。従って、基準の選び方によっては(上図のようにポテンシャルの山から始まるのではなく、)回転角 0度のところに(ねじれ形配座に由来して)ポテンシャルの谷がくるように書くことも可能である。
2.33
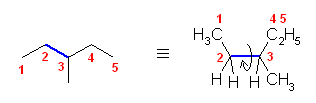
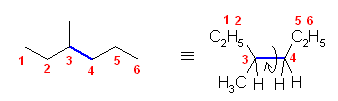
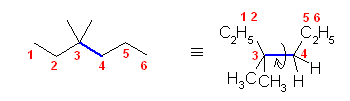
最も安定な配座を探すのであるから、ねじれ形配座を考える。そのうちで、ゴーシュ相互作用の有無を考慮するとよい。
なお、問いの範囲外ではあるが、ねじれ形配座3つと重なり形配座3つのすべてについて、ポテンシャルエネルギー(重なり形、ゴーシュの2種の相互作用の和)をおよその数値として見積もり、定性的なポテンシャルエネルギー図を書いてみること。
(解答例)
(※)以下の表で、ひずみエネルギーの概値を求める際にはエチル基とメチル基が同じ反発をもつものとしている。
(a)
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 | 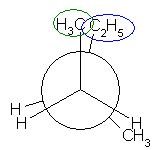 |
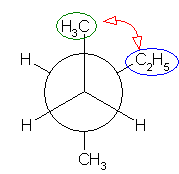 |
 |
 |
 |
 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | メチル−エチルの重なり メチル−水素の重なり 水素−水素の重なり |
メチル−エチルのゴーシュ相互作用 | メチル−水素の重なり×2 エチル−水素の重なり |
メチル−メチルのゴーシュ相互作用 | メチル−メチルの重なり×1 水素−水素の重なり×1 エチル−水素の重なり×1 |
エチル−メチルのゴーシュ相互作用 メチル−メチルのゴーシュ相互作用 |
| ひずみエネルギーの概値※ | 11+6+4 21 kJ/mol |
3.6 kJ/mol | 6+6+6 18 kJ/mol |
3.6 kJ/mol | 11+4+6 21 kJ/mol |
7.2 kJ/mol |
| エチル基は、メチル基よりかさ高いから、エチル基とメチル基の間のゴーシュ相互作用は、メチル基間のゴーシュ相互作用より大きいと予想される。そのため、3.6 kJ/mol より大きい値となる。 | 最も安定な配座である。 |
(b)
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 |  |
 |
 |
 |
 |
 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | エチル−エチルの重なり メチル−水素の重なり 水素−水素の重なり |
エチル−エチルのゴーシュ相互作用 エチル−メチルのゴーシュ相互作用 |
エチル−水素の重なり メチル−エチルの重なり 水素−水素の重なり |
メチル−エチルのゴーシュ相互作用 | エチル−水素の重なり×2 メチル−水素の重なり×1 |
エチル−エチルのゴーシュ相互作用 |
| ひずみエネルギーの概値※ | 11+6+4 21 kJ/mol |
7.2 kJ/mol | 6+11+4 21 kJ/mol |
3.6 kJ/mol | 6+6+6 18 kJ/mol |
3.6 kJ/mol |
| 最も安定な配座である。 | (a) と同様に考えて、エチル−メチルのゴーシュ相互作用より、エチル−エチルのゴーシュ相互作用の方が大きいと予想される。 |
(c)
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 |  |
 |
 |
 |
 |
 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | エチル−エチルの重なり×1 メチル−水素の重なり×2 |
エチル−エチルのゴーシュ相互作用 エチル−メチルのゴーシュ相互作用 |
エチル−水素の重なり メチル−エチルの重なり メチル−水素の重なり |
メチル−エチルのゴーシュ相互作用×2 | エチル−水素の重なり メチル−水素の重なり エチル−メチルの重なり |
エチル−エチルのゴーシュ相互作用 エチル−メチルのゴーシュ相互作用 |
| ひずみエネルギーの概値※ | 11+6+6 23 kJ/mol |
7.2 kJ/mol | 6+11+6 23 kJ/mol |
7.2 kJ/mol | 6+6+11 23 kJ/mol |
7.2 kJ/mol |
| エチル−エチルのゴーシュ相互作用の方が、エチル−メチルのゴーシュ相互作用より大きいことを考えると、この配座がもっとも安定である。 |
2.34
単純に数学の(算数の?)問題なので、ノーヒントで。
(解答例)
式に代入する。
n = 8 のとき、135 度。
n = 9 のとき、140 度。
これらの値は、sp3混成炭素の結合角よりも大きい。しかしながら、このようなひずみは、シクロアルカンを構成する炭素が同一平面から外れることで解消可能である。
なお、n = 5 のときの値である 108 度は、sp3混成炭素の結合角に最も近くなる。そのため、一見しただけでは、シクロペンタンが正五角形をとる場合にもっともひずみが小さくなるように思われるかもしれない。しかし、実際には、シクロペンタンは、その構成炭素5つがすべて同一平面内にある正五角形の配座が最安定なのではない。これは、すべての炭素が同一平面内にある場合は、水素同士が重なり形の位置関係をとることになるためである。
(発展)
この問いで求められているのは、幾何学的な正多角形のひとつの内角の大きさであって、シクロアルカンの結合角ではない。その意味では「結合角」という問題文の表現はあまり適切ではないかもしれない。
それはさておき、正多角形の内角を与える教科書の与式は、次のように考えて求めることができる。
- 問題としている多角形に、対角線を補助線として書き加える。このとき、補助線同士が交差しないようにする。また、四角形以上の形が残らないよう、なるべく多くの対角線を書く。これにより、多角形を三角形の集合として表すことができる。
- 四角形は、2つの三角形で構成させることができる。五角形は3つの三角形で構成される。同様に考えていくと、n角形は、(n−2)個の三角形で構成される。
- このとき、多角形の内角の和は、その多角形を構成している三角形すべての内角の和として表すことができる。
- 従って、n角形の内角の和は、一般に(n−2)×180 度である。
- 正多角形では、すべての内角が等しいから、上式を展開したのち、1つの内角を求めるために、 nで割る。
2.35
問題文に与えられた情報
- 鎮静剤としての効果は、細胞膜(非極性な環境)を通りぬける能力と関係がある。
従って、「鎮静剤としての効果が大きいのはどちらか」という問いは、「細胞膜を通り抜ける能力が大きいのはどちらか」という問いになる。従って、「疎水性の大きなものはどちらか」という問いであると判断してよい。
※ もとの文章が、やはり「関係がある」のみであれば、問題の作成者が悪いし、もとの文章が「比例関係」または「正の相関」があると述べられていたのであれば、訳者のセンスが問われるところか。
(解答例)
へキセタールとバルビタールとで構造を比較すると、アルキル基部分のみが異なっており、残りは共通であることがわかる。バルビタールはエチル基2つをもつのに対し、へキセタールは、エチル基とヘキシル基をもつ。アルキル基部分がより大きいヘキセタールの方が、より大きな疎水性をもつと考えられる。従って、ヒントに示した論拠より、ヘキセタールの方が鎮静剤としての効果が大きいと考えられる。
2.36
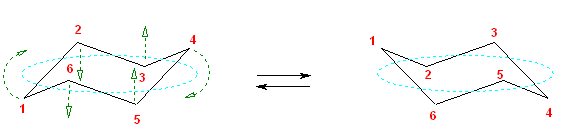
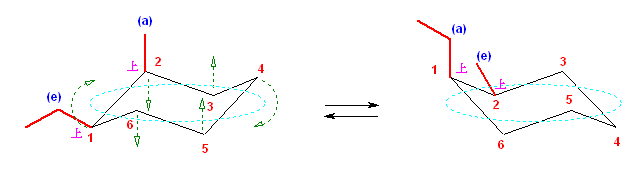
シクロヘキサンの「いす形配座」を正しく書き、アキシャルとエカトリアルの結合をすべて正しく書き加えることができれば、この問いは簡単でしょう。
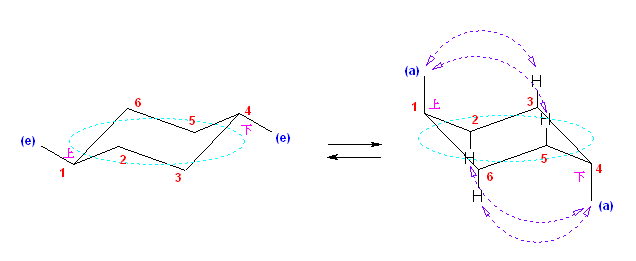
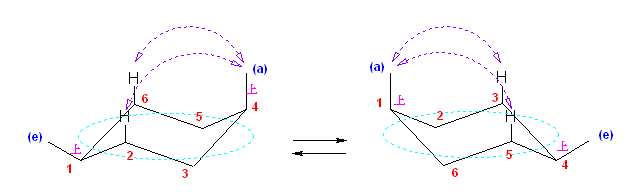
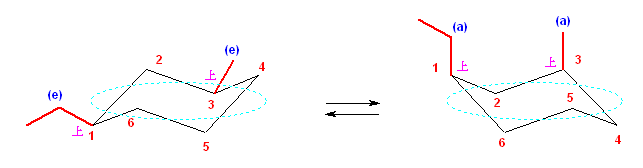
(解答例)
次図、左がアキシャル位にメチル基がある配座異性体。右がエカトリアル位にメチル基がある配座異性体。
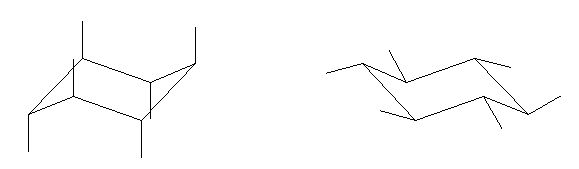
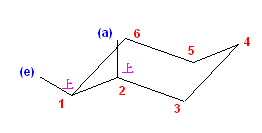
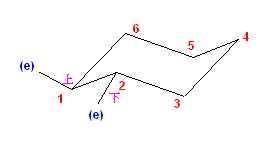
この2つは、異なる配座にある。しかし、6つのメチル基について、メチル基根元の炭素からでている水素との位置関係(環の上か下か)を調べると、ともに同じ構造であることが判る。(配座異性体であるが、立体異性体ではない。)
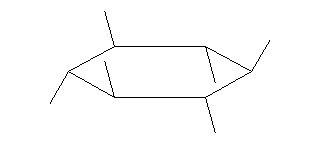
従って、この2つの配座異性体は、環の反転にともない相互変換される。
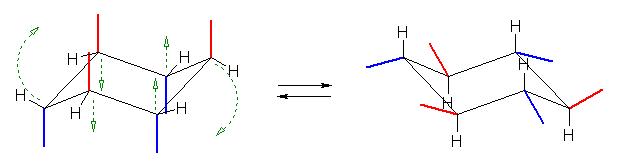
最後の図では、水素を補って示した。また、環の上方に結合したメチル基を赤色で、下方に結合したメチル基を青色で示している。(発展)の項に示した、シクロヘキサンの環反転のアニメーション gif もよく見ておいてください。
(発展)
シクロヘキサンの環反転のアニメーション gif を作成してみました。
赤と青は水素原子、黒は炭素原子です。
環反転の際のエネルギー障壁は、エタンの炭素−炭素の回転とほぼ同じ程度なので、室温で非常に早く進行します。1秒間に10万回くらい、下のアニメーションのような動きをするとのことです。そのため、たとえばメチルシクロヘキサンのように置換基をもつ場合でも、2つの配座異性体(メチル基がアキシャル位にあるもの、エカトリアル位にあるもの)を室温で分離することはできません。
註1 炭素骨格の結合角ひずみ、また、12組の水素間の重なり形相互作用(ねじれひずみ)があり、エネルギーが高いために、平面正六角形型は途中で経由せず、代わりに舟形(およびねじれ舟形)を通るのですが、このアニメーションの動きは、厳密に正しいわけではありません。およそのイメージとして捉えてください。
註2 gif アニメーションの作成には、「GIFアニメ工房」というサイトを利用しました。
2.37
教科書 p121 から p122 にかけての囲み「問題解答の指針」をなぞること。
(解答例)
教科書の「問題解答の指針」をよく読んで、理解してからでないと、以下の記述、理解できないかもしれません。
1) ひずみをもたないことが知られているシクロヘキサンの「生成熱」の数値 -123.4 kJ/molより、「ひずみのない」メチレン −CH2- ひとつあたりの生成熱が -20.5666 kJ/mol である。
2) シクロヘプタンが、まったくひずみをもたないと仮定するならば、メチレン7つ分なので、-20.5666×7 = -143.9666 kJ/mol の生成熱をもつはずである。(この値は、教科書 表2.9 の、中ほど、「ひずみのない状態の生成熱」として値がでている。有効数字の扱いのせいか、教科書の値では、-143.9 kJ/mol となっているが、まるめるならば、-144.0 の方が良いだろう。)
3) 一方で、実測の生成熱は、同じ教科書の表より、-118.0 kJ/mol である。この値は、ひずみがない場合よりも、値が大きい(負で、絶対値が小さい)。
4) 生成熱の値が上がっている(負で、絶対値が小さくなっている)ということは、なんらかのひずみをもっていることを示す。差を計算すると、-118-(-144) = 26 である。従って、シクロヘプタンは、26 kJ/mol のひずみをもっている。
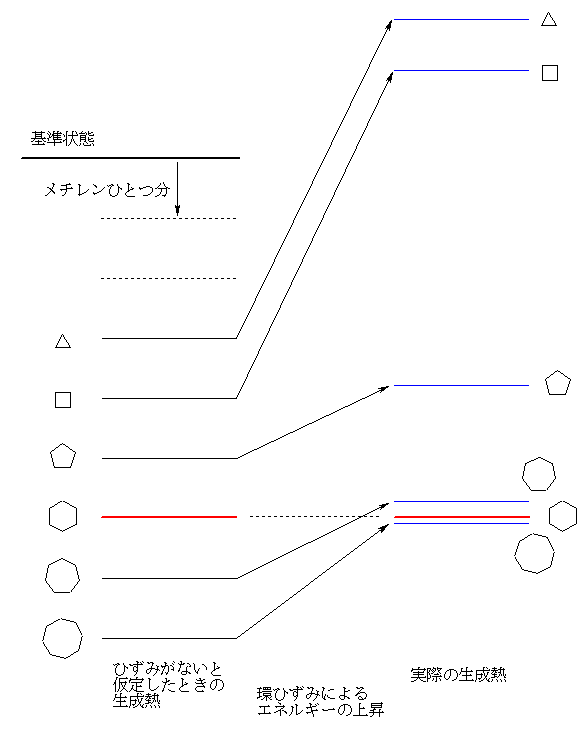
(※)生成熱が正であるということは、同数の原子の反応であるならば、炭素と水素とを燃焼させるよりも、シクロブタンやシクロプロパンを燃焼させるほうが大きなエネルギーを取り出すことができることを意味する。シクロプロパン、シクロブタンのように生成熱が正の(すなわち、「熱力学的には不安定である」ような)化合物でも、(速度論的な意味で)「安定に」存在することが可能である。
余談であるが、ダイヤモンドも、また、熱力学的には不安定であるような(生成熱が正の)物質である。(すなわち、同じ重さのグラファイトを燃やすよりも、ダイヤモンドを燃やすほうが多くの熱を取り出すことが可能である。)
(発展)
生成熱 heat of formation の詳細については、物理化学でも学ぶはずである。
基準状態(その元素ごとに、常温、常圧でもっとも安定な状態。炭素であれば、グラファイトの固体、水素であれば H2 の気体。)の元素の生成熱は、定義としてゼロである。
その状態(基準であるゼロの高さ)から、その物質を生成するための反応エンタルピー変化。炭素数5以上のシクロアルカンについて、この値が負であるということは、グラファイトと水素からシクロアルカンを生成する反応が生じるなら、発熱反応となることを示す。
2.38
水素との1,3-ジアキシャル相互作用は、上図で示したように、メチル基とのゴーシュ相互作用と等しい。
右のニューマン投影図において、環の骨格の一部を R で示している。
(解答例)
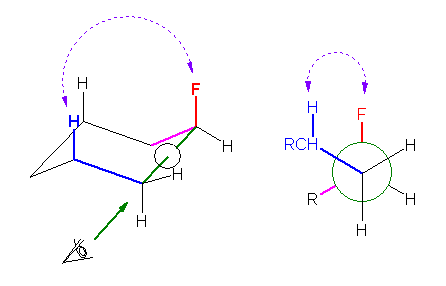
フッ素がアキシャル位にあるフルオロシクロヘキサンの配座異性体は、エカトリアル位にあるものよりも 1.0 kJ/mol だけ不安定である(と問題文に与えられている)。これは、2組の水素−フッ素の 1,3-ジアキシャル相互作用によるものである。
一方、ヒントにも述べたように、一組の水素−フッ素の 1,3-ジアキシャル相互作用が、メチル基とフッ素の間のゴーシュ相互作用と等しい。
よって、1-フルオロプロパンについて、フッ素が3位炭素のメチル基とゴーシュの関係にある配座は、アンチにあるものに比べて、0.5 kJ/molだけ不安定であると計算できる。
2.39
表 2.10 には、平衡定数が与えられているから、そこから計算する。
(解答例)
平衡定数が 5.4 と与えられている。
Keq = [水酸基がエカトリアルにある配座異性体]/[水酸基がアキシャルにある配座異性体] = 5.4
よって、アキシャルの存在量を 1 とすると、エカトリアルの存在量が 5.4 であるから、全体に対するエカトリアルの割合は 5.4/(1+5.4) = 0.84375 より、84 % である。
2.40
着目している置換基が、同じ炭素上の水素との比較で、シクロヘキサンの平均的な面よりも上なのか、下なのかで考える。(環の反転で、この上下関係は入れ替わらない。)上同士、下同士であれば「シス体」、上と下の組み合わせであれば「トランス体」である。
(解答例)
a) 臭素は、環の下方
塩素は、環の下方
従って、同じ方向なので、シス体。
b) メチルは、環の上方
臭素は、環の上方
従って、同じ方向なので、シス体。
c) メチルは、環の下方
臭素は、環の下方
従って、同じ方向なので、シス体。
d) メチルは、環の上方
臭素は、環の下方
従って、逆の方向なので、トランス体。
e) メチルは、環の上方
塩素は、環の下方
従って、逆の方向なので、トランス体。
f) 手前メチルは、環の上方
右側メチルは、環の下方
従って、逆の方向なので、トランス体。
2.41-2.50
2.41
2つの配座異性体が互いに入れ替わるとき、そのポテンシャルエネルギーが同じであれば、等量ずつ存在する。ポテンシャルエネルギーが異なる場合、安定なものの割り合いが増える。ポテンシャルエネルギー差が大きければ大きいほど、偏りは大きくなる。
従って、2種のシクロヘキサン誘導体について、環反転の前後でのポテンシャルエネルギー(ひずみエネルギー)について考察すること。
環の反転の前後の配座を示す。
trans-1,4-dimethylcyclohexane
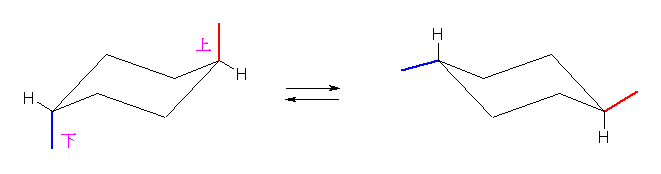
cis-1-tert-butyl-3-methylcyclohexane
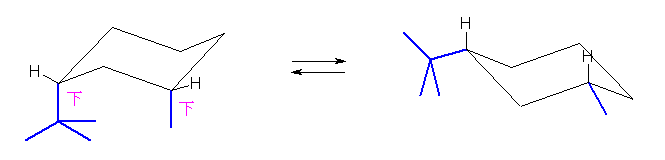
(あらためて言うまでもないと思うが、trans-1,4-dimethylcyclohexane は、2つのメチル基が上と下の組み合わせであればよいから、左端の炭素の上方および右端の炭素の下方に2つのメチル基を書くなどしてもよい。cis-1-tert-butyl-3-methylcyclohexane についても上図では、下方、下方の組み合わせで書いているが、上方、上方の組み合わせでもよい。また、いずれの構造も炭素の位置番号は、回り順もふくめて、自分で任意に決めて問題ない。)
(解答例)
いずれの構造も、ジエカトリアル体については、ひずみの要因はない。(エカトリアル位の基については、ゴーシュ相互作用のみを数えればよい。ただし、水素とアルキル基の間のゴーシュ相互作用は数えない。)
したがって、ジアキシャル体のもつひずみが大きい方が、平衡定数が大きくなる(安定なものの割合が増える)。
trans-1,4-dimethylcyclohexane では、メチル−水素の 1,3-ジアキシャル相互作用が4組ある。(従って、(メチル−水素の 1,3-ジアキシャル相互作用の大きさは、メチル基間のゴーシュ相互作用と等しいから)3.6×4 = 14.4 kJ/mol のひずみである。(教科書 p129 の下から3行目の計算では、やはりまた有効桁数の扱いにより、やや異なるが、14.6 kJ/mol と計算している。)
cis-1-tert-butyl-3-methylcyclohexane では、メチル−水素の1,3-ジアキシャル相互作用が1組、tert-ブチル−水素の1,3-ジアキシャル相互作用が1組、tert-ブチル−メチルの1,3-ジアキシャル相互作用が1組、存在している。ここで、具体的な数値は与えられているないものの、tert-ブチルが非常に嵩高い(かさだかい)ことを考えると、これらの合計は、trans-1,4-dimethylcyclohexane のもつひずみよりもずっと大きい。(数値的な扱いについては、発展の項を参照のこと)
実際、tert-ブチル基は、非常に嵩高いため、事実上、いす形シクロヘキサンのアキシャル位にくることができないと覚えてしまっても問題ない。
まあ、というわけで、ジエカトリアル体の割合が多いのは、cis-1-tert-butyl-3-methylcyclohexane である。
(と言っても、trans-1,4-dimethylcyclohexane のポテンシャルエネルギーの差、14.4 kJ/mol も、ジアキシャル体の割合は室温において 1 % 未満となるような値であるから、どちらの誘導体においても、ほとんどすべてがジエカトリアル体となっている。)
(発展)
水素との間の1,3-ジアキシャル相互作用(1組)の大きさについて、別の教科書(マクマリー有機化学)からの数値を引用しておく。
| substituent | steric strain / kJ mol-1 | |
|---|---|---|
| -H | 0 | |
| -F | 0.5 | |
| -Br | 1.0 | |
| -OH | 2.1 | |
| -CH3 | 3.8 | ※, ※3 |
| -CH2CH3 | 4.0 | ※2, ※3 |
| -CH(CH3)2 | 4.6 | ※3 |
| -C6H5 | 6.3 | |
| -C(CH3)3 | 11.4 | ※3 |
※ ブルースの教科書では、3.6 という数字になっている。
※2 問い2.32、2.33あたりと関連して、この数値は、メチル基−エチル基間のゴーシュ相互作用の大きさとも等しい。メチル−水素間の1,3-ジアキシャル相互作用(= メチル−メチル間のゴーシュ相互作用)より、わずかに大きなだけの値である。
※3 アルキル基の級数の増加(メチル基→エチル基→イソプロピル基→tert-ブチル基)により、ひずみは大きくなっていくが、2級アルキル基から3級アルキル基への増加のところで、極端な差を生じていることがわかる。
これについては、次のように説明できる。
1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式を、置換基がエチル基、イソプロピル基、tert-ブチル基と変化させて示した。
エチル基およびイソプロピル基では、アルキル基の根元の単結合で自由回転でき、嵩高い部分が外側に逃げることができるため、メチル基と比較して、急に大きなひずみを生じるわけではないことが見て取れる。しかしながら、tert-ブチル基では、どのように自由回転させても、結局嵩高い部分が2つ離れた環上のアキシャル水素と非常に近い空間を占めざるを得ない。そのために極端に大きな反発を生じる。
同様の関係を、今度は、シクロヘキサンの環の平面に(ほぼ)垂直な方向、環の上方から眺めた時の、1,3-ジアキシャル相互作用の様子を用いて、模式的に示した。白丸は、3位、および5位のアキシャル水素である。置換基は、左より、水酸基、メチル基、エチル基、イソプロピル基、t-ブチル基である。
水酸基では、酸素上の(水素より小さな)孤立電子対が3位、および5位のアキシャル水素と反発するだけであるのに対し、メチル基、エチル基、イソプロピル基では、置換基の中の C-H 結合が、また、t-ブチル基では、置換基の中の C-CH3 結合が、それぞれ3位、および5位のアキシャル水素と反発する。
2.42
1) いす形配座でシクロヘキサン骨格を書き、適当に番号をつける。
2) 置換基を書き込む。このとき、cis-体であるなら、環の上と上、または下と下、trans-体であるなら、環の上と下、という立体配置に気をつけること。この時点では、アキシャルとエカトリアルに気をつかわなくてもよい。
3) 書き込んだ置換基が、アキシャルか、エカトリアルかを調べる。
4) 環を反転させる。環の反転では、
・シクロヘキサン骨格の炭素の位置を変えず、平均的な平面の上下だけを変化させる。従って、環を裏返すのでもなければ、左右を入れ替えるのでもない。環の上方から見たときの炭素につけた番号の回り順(右回りか、左回りか)も、変化しない。
・置換基の立体配置は変化しない。(すなわち、環の上側の置換基は、環の反転の前後で上側のままである。)
・環の反転により、アキシャル位はエカトリアル位になり、エカトリアル位はアキシャル位になる。
ことに気をつけること。
5) 安定である配座異性体(環の反転の前なのか後なのか)を、教科書の解答の指針に沿って探す。
6) すなわち、もし、置換基の両方がエカトリアル位にあるものが書けるなら、それがもっとも安定である。
7) もし、一方がアキシャル位で、もう一方がエカトリアル位であるなら、環を反転させても(アキシャル→エカトリアル)(エカトリアル→アキシャル)となり、両方がエカトリアル位にくることは、(椅子型の配座のままでは)不可能である。その場合は、より嵩高い基がエカトリアル位にくるほうが安定である。
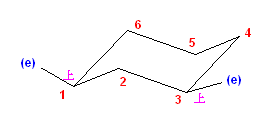
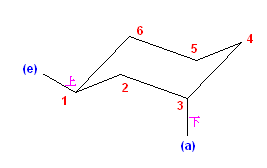
(解答例)
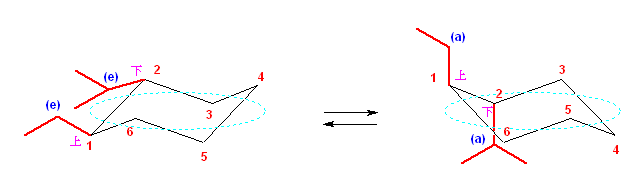
a) cis-1-ethyl-2-methylcyclohexane は、環の反転の前後で、次の図のような椅子形配座をとる。
反転の前後で、2つの置換基は、いずれもアキシャルとエカトリアルの組み合わせであるので、より嵩高いエチル基がエカトリアル位にある配座(上図で、左側)の方が、やや安定である。
左の配座のもつひずみエネルギーの内訳:
2位メチル基の 1,3-ジアキシャル相互作用(メチル基と4位水素、メチル基と6位水素)
1位エチル基と2位メチル基間のゴーシュ相互作用
右の配座のもつひずみエネルギーの内訳:
1位エチル基の 1,3-ジアキシャル相互作用(エチル基と3位水素、エチル基と5位水素)
1位エチル基と2位メチル基間のゴーシュ相互作用
問い2.41の、発展の項に示した数値を用いると、2つの配座の間に、0.4 kJ/mol のエネルギー差がある。これは、この2つの配座が室温において平衡にあるとき、左の配座が 54 %、右の配座が46 % で存在していることを意味する。
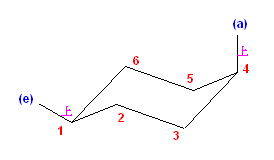
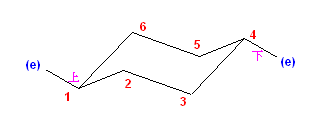
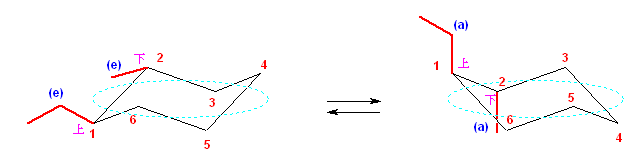
b) trans-1-ethyl-2-methylcyclohexane は、環の反転の前後で、次の図のような椅子形配座をとる。
左側の配座で、2つの置換基がともにエカトリアル位に来ているため、より安定な配座である。
左の配座のもつひずみエネルギーの内訳:
1位エチル基と2位メチル基間のゴーシュ相互作用
右の配座のもつひずみエネルギーの内訳:
1位エチル基の 1,3-ジアキシャル相互作用(エチル基と3位水素、エチル基と5位水素)
2位メチル基の 1,3-ジアキシャル相互作用(メチル基と4位水素、メチル基と6位水素)
c) 上で示した4つの配座のもつひずみエネルギーの大小関係を模式的に図で示すと次のようになる。ピンク色の破線は、ひずみのない基準(無置換のシクロヘキサン)である。
cis-の立体異性体は、エネルギーが近い(水素との1,3-ジアキシャル相互作用の大きさが、メチルとエチルとでどの程度違うか、の差(の2倍)だけしか違わない)ので、2つの配座の両方をとることが予想されるが、trans-の立体異性体では、そのほとんどが両エカトリアルの配座をとると予想される※。なので、このような問いにおいては、それぞれの立体異性体について、とり得る配座のうちもっとも安定なもの同士で比較すればよい。従って、trans-体の方が安定である。
※少しばかり半定量的に議論しておこう。
エチル基とメチル基の差を完全に無視してよいと仮定するならば、trans-体の両エカトリアルの配座と、両アキシャルの配座では、そのエネルギー差は、(メチル−水素間の1,3-ジアキシャル相互作用)×4−(メチル−メチルのゴーシュ相互作用)=(メチル−水素間の1,3-ジアキシャル相互作用)×3 と計算できるから、およそ 10 kJ/mol 程度であることがわかる。この値は、室温付近における平衡定数※ Keq が 0.018 であることに対応している。(下記、発展の項を参照すること。)すなわち、両アキシャルの配座をとる分子は、全体の2%未満である。
(発展)
教科書 §2.13 の平衡定数※ Keq は、2つの配座間のエネルギー差 ΔE より、次式で計算することができる。
Keq = exp(-ΔE/RT)
これは、ボルツマン分布の式と呼ばれ、物理化学においても基本的な式である。Rは、気体定数、Tは温度である。
27℃、T=300(K)であるとき、RT = 8.314(J/K/mol)×300(K) = 2494(J/mol) である。すなわち、およその値として、室温付近では RT = 2.5 kJ/mol を知っておくとよい。
室温付近において、
Keq = exp(-ΔE(kJ/mol)/2.5)
から計算した値を、参考までにリスト化しておこう。
ただし、e は自然対数の底で、2.718
| ΔE(kJ/mol) | Keq | |
| 0 | 1/e0 | 1 |
| 2.5 | 1/e1 | 0.368 |
| 5.0 | 1/e2 | 0.135 |
| 7.5 | 1/e3 | 0.050 |
| 10.0 | 1/e4 | 0.018 |
| 12.5 | 1/e5 | 0.0067 |
| 15.0 | 1/e6 | 0.0025 |
| 17.5 | 1/e7 | 0.00091 |
| 20.0 | 1/e8 | 0.00033 |
| 22.5 | 1/e9 | 0.00012 |
| 25.0 | 1/e10 | 0.00004 |
2.43
問い4.42のヒントから抜粋
1) いす形配座でシクロヘキサン骨格を書き、適当に番号をつける。
2) 置換基を書き込む。このとき、cis-体であるなら、環の上と上、または下と下、trans-体であるなら、環の上と下、という立体配置に気をつけること。
3) 書き込んだ置換基が、アキシャルか、エカトリアルかを調べる。
要は書いてみなっせってこってす。
(解答例)
a)
椅子形配座では、2つの置換基が、必ずアキシャル−エカトリアルの組み合わせになる。
b)
椅子形配座では、2つの置換基が、両エカトリアル、または両アキシャルになる。
c)
椅子形配座では、2つの置換基が、両エカトリアル、または両アキシャルになる。
d)
椅子形配座では、2つの置換基が、必ずアキシャル−エカトリアルの組み合わせになる。
e)
椅子形配座では、2つの置換基が、必ずアキシャル−エカトリアルの組み合わせになる。
f)
椅子形配座では、2つの置換基が、両エカトリアル、または両アキシャルになる。
2.44
まず、椅子形配座を2種類(環反転の前後)を書いてみること。
ついで、それぞれの配座のもつひずみのひとつずつについて数え上げ、合計する。
なお、数値はすでに教科書に挙がっているものを用いればよい。
メチル−水素間の 1,3-ジアキシャル相互作用(1組あたり)3.6 kJ/mol
メチル−メチル間のゴーシュ相互作用 3.6 kJ/mol
(解答例)
a)
両エカトリアルの配座では、ひずみはまったく存在しない。両アキシャルでは、メチル−水素間の 1,3-ジアキシャル相互作用が4組存在する。従って、エネルギー差は、14.4 kJ/mol である。これは、ボルツマン分布の式から計算すると、室温における平衡定数が、 Keq = 0.0032 に相当する。すなわち、99.7% がジエカトリアルの配座をとっている。
b)
環の反転前後でどちらの配座も、等しくメチル−水素間の 1,3-ジアキシャル相互作用が2組をもつ。従って、エネルギー差は、0 kJ/mol である。
上図の左右のそれぞれの配座は、環反転の前後を表しているものの、空間内での移動(具体的には、シクロヘキサンの骨格のつくる平均的な面(水色の破線による楕円)の回転軸に沿った180度の回転)により、完全に重ね合わせることができるから、互いに異性体である(配座異性体である)ものではない。
もし、1位の炭素と4位の炭素のいずれかが 13C で同位体ラベルされているなど、この2つの配座を化学的に区別することが可能であったならば、2つの配座が、(エネルギー差が0、すなわち平衡定数 Keq = 1 より)等量ずつ存在していることになる。
2.45
※ 構造を描くとともに、基官能命名法で化合物名が与えられているものについては、置換命名法で命名しなおしてみること。
(解答例)
a)
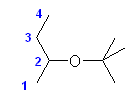
置換命名法では : 2-tert-butoxybutane
b)
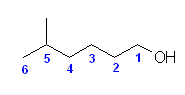
なお、イソヘプチル基は、IUPACで慣用名として認められていないので、皆さんは、基官能命名法としても、isoheptyl alcohol は用いないようにしてください。
置換命名法では : 5-methylhexan-1-ol
c)
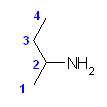
置換命名法では : butan-2-amine
d) 臭化イソペンチル, isopentyl bromide
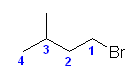
置換命名法では : 1-bromo-3-methylbutane
e)
f)
g)
置換命名法では : N,N-diethylethanamine
h)
i)
j)
k)
l)
m)
n)
o)
2.46
(a) 問題文に「体系的名称」と指定しているので、ここでは置換命名法に則って解答しなければいけない。
(b) 9 〜 11 は、そのままでも、ほとんど骨格構造式であるが、骨格構造式では「C」という元素記号を全く使わずに表すことが可能であるから、そのように書き直すこと。
(解答例)
(1) 2,2,6-trimethylheptane
側鎖置換基:2-methyl、2-methyl、6-methyl(で、2,2,6-trimethyl)
主鎖:heptane
主官能基:なし
(2) 5-bromo-2-methyloctane
側鎖置換基:5-bromo、2-methyl
主鎖:octane
主官能基:なし
(3) 5-methylhexan-3-ol
側鎖置換基:5-methyl
主鎖:hexane
主官能基:水酸基なので、接尾語は -ol である。-ol が母音で始まるから、母体の最後の e が省略される。
なお、主基(接尾語が -ol であることを決めている官能基)である水酸基の位置番号が小さくなることを優先するので、2-methylhaxan-4-ol は誤り。
(4) 3,3-diethylpentane
側鎖置換基:3-ethyl、3-ethyl
主鎖:pentane
主官能基:なし
構造式を描いてみればすぐにわかるように、主鎖をメタンとした tetraethylmethane は、誤り。
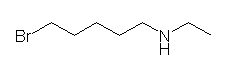
(5) 5-bromo-N-ethylpentan-1-amine
側鎖置換基:5-bromo、N-ethyl
主鎖:pentane
主官能基:アミノ基なので、接尾語は -amine である。-amine が母音で始まるから、母体の最後の e が省略される。
基官能命名に従うなら、「アルキル基」+スペース+「アルキル基」+スペース+「一般名;アミン」とするので、「ethyl 5-bromopentyl amine」となる。
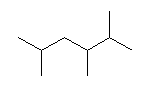
(6) 2,3,5-trimethylhexane
側鎖置換基:2-methyl、3-methyl、5-methyl
主鎖:hexane
主官能基:なし
側鎖置換基の位置番号の組が小さくなるよう、構造式の右側から左側へ番号が振られている。2,4,5-trimethylhexane では誤り。
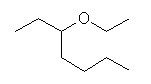
(7) 3-ethoxyheptane
側鎖置換基:3-ethoxy
主鎖:heptane
主官能基:なし。エーテル結合は、主官能基になれない。(接尾語として命名できない。)
基官能命名に従うなら、「アルキル基」+スペース+「一般名;エーテル」とするので、「ethyl 1-ethylpentyl ether」などとなる。
1-ethylpentyl 基は、IUPAC1993 規則では、heptan-3-yl基と書くことも許される。ただし、同規則に従う場合は、n-heptyl 基についても heptan-1-yl 基と書かなければならない。
(8) 1,3-dimethoxypropane
側鎖置換基:1-methoxy、3-methoxy
主鎖:propane
主官能基:なし。エーテル結合は、主官能基になれない。(接尾語として命名できない。)
どうしてもエーテルとして宣言する必要があれば、propane-1,3-diol の dimethyl ether であるという言い方をしてもよい。
(9) N,N-dimethylcyclohexanamine
側鎖置換基:N-methyl、N-methyl
主鎖:cyclohexane
主官能基:アミノ基なので、接尾語は「-amine」とする。
基官能命名に従うなら、「アルキル基」+スペース+「アルキル基」+スペース+「一般名;アミン」とするので、「cyclohexyl dimethyl amine」となる。
もし、シクロヘキサン環上に、アミノ基より優先される官能基(たとえば水酸基)がある場合は、側鎖置換基として「N,N-dimethylamino」を用いることになる。
(10) 3-ethylcyclohexanol
側鎖置換基:3-ethyl
主鎖:cyclohexane
主官能基:水酸基なので、接尾語は「-ol」とする。
主基である水酸基が一つだけ結合した環状化合物なので、cyclohexan-1-ol とはならず、主基の位置番号(-1-)は省略される。
基官能命名法に従うなら、「アルキル基」+スペース+「一般名;アルコール」とするので、「3-ethylcyclohexyl alcohol」とすることもできる。
(11) 1-bromo-4-methylcyclohexane
側鎖置換基:1-bromo、4-methyl
主鎖:cyclohexane
主官能基:なし。臭素(ハロゲン)は、主官能基になれない。(接尾語として命名できない。)
基官能命名法に従うなら、「アルキル基」+スペース+「一般名;ブロミド(ハライド)」とするので、「4-methylcyclohexyl bromide」とすることもできる。
(発展)
解答の解説では、基官能命名法に従った場合についても述べておいた。ただし、アルキル基の構造が複雑な場合(「1-ethylpentyl」「4-methylcyclohexyl」などのように、複合置換基として命名しなければならない場合)は、無理に基官能命名法を用いないほうがよいと思われる。
2.47
炭素の級数については、問い 2.2 のヒントを参照すること。
(解答例)
1-ethyl-2-isobutylcyclohexane
a) 上図、水色で印をつけた炭素、3つ。
b) 上図、黄色で印をつけた炭素、6つ。
c) 上図、桃色で印をつけた炭素、3つ。
2.48
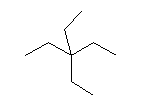
いずれもねじれ形の配座である。ゴーシュ相互作用をもつ置換基の組み合わせと数に着目すること。問い 2.32 のヒントも参照すること。
なお、3番目の投影図については、塩素の結合した炭素側から見ている。手前と向こう側を入れ替えて考えなおしてもよいが、ひずみエネルギー(重なり形、ゴーシュ)については、書き直さなくても見積もることができる。
問いの範囲外ではあるが、重なり形の相互作用をもつものについてもエネルギーの大小を見積もると同時に、この結合軸の周りの回転にともなうポテンシャルエネルギー図を書いてみること。(数値がわからない部分については、定性的に書けばよい。)
(解答例)
塩化イソブチル isobutyl chloride(基官能命名法)の体系名(置換命名法)は、1-chloro-2-methylpropane である。
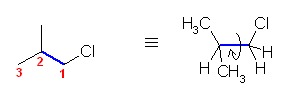
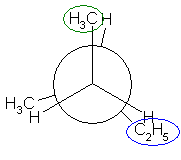
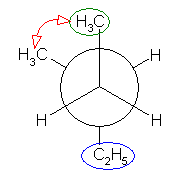
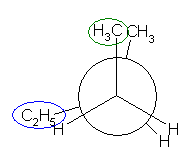
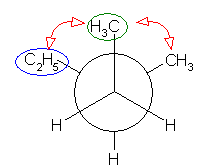
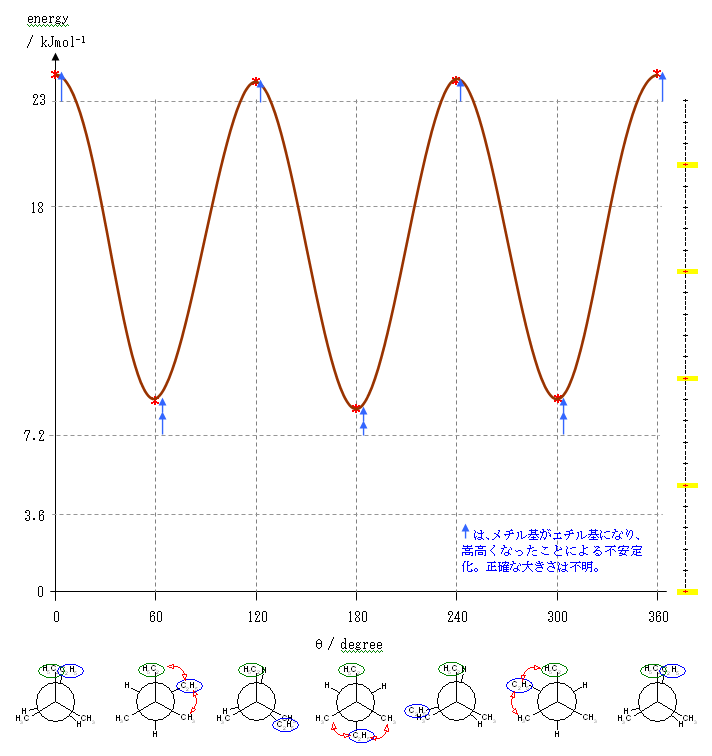
2位炭素上のメチル基(3位炭素)のうち一方(自分で任意に決める)と、1位炭素上の塩素の間の2面角を基準とした。(360度で1回転であるが、2面角360度は、0度のときと同じであるので表からは省略している。)
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 | 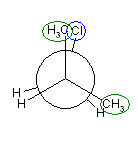 |
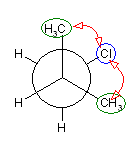 |
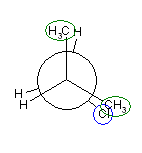 |
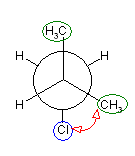 |
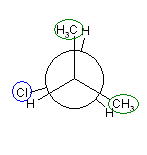 |
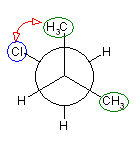 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | メチル−塩素の重なり メチル−水素の重なり 水素−水素の重なり |
メチル−塩素のゴーシュ相互作用×2 | メチル−塩素の重なり メチル−水素の重なり 水素−水素の重なり |
メチル−塩素のゴーシュ相互作用 | 水素−塩素の重なり メチル−水素の重なり×2 |
メチル−塩素のゴーシュ相互作用 |
| 2番目および3番目の投影式 | はじめの投影式。 |
2面角にして180度、300度の配座は、ともに同じひずみエネルギーの内訳を持っており、ともに最安定である。
塩素は、水素より大きく、メチルより小さい。
そのため、重なり形相互作用は、
水素−水素(4 kJ/mol) < 水素−塩素 < 水素−メチル(6 kJ/mol)
メチル−水素(6 kJ/mol) < メチル−塩素 < メチル−メチル(11 kJ/mol)
ゴーシュ相互作用は、
メチル−水素(0 kJ/mol) < メチル−塩素 < メチル−メチル(3.6 kJ/mol)
これらをもとに、各配座ごとに矛盾のないおよそのひずみエネルギーの大きさを仮定し、定性的なポテンシャルエネルギー図を書くと次のようになる。
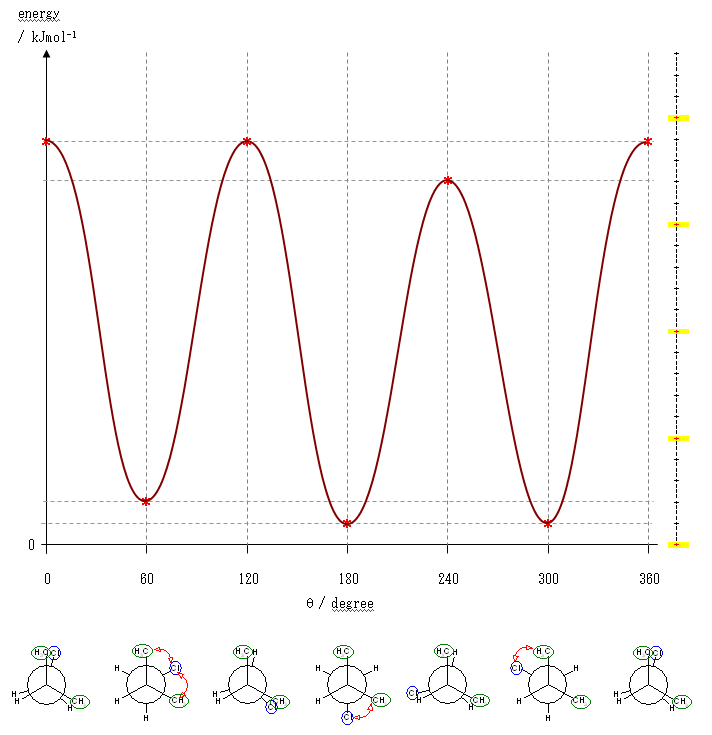
上図は、メチル−塩素のゴーシュ相互作用を 1 kJ/mol、水素−塩素の重なり相互作用を 5 kJ/mol、メチル−塩素の重なり相互作用を 9 kJ/mol と仮定して作図したものである。
2.49
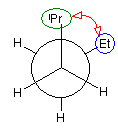
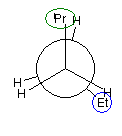
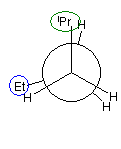
パズルとしてといてみてください。
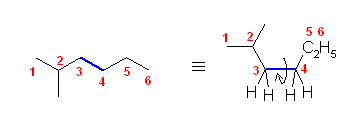
a) 炭素がすべて第2級であるということは、第1級炭素がないということである。直鎖のアルカンや、枝分かれのあるアルカンを考える場合、その末端の炭素は、必ず第1級になっていることに注目して考えればよいだろう。また、枝分かれがあれば、その付け根の位置は、第3級または第4級になってしまうことにも注目する。
b) 水素がすべて第1級である。これは、炭素が第1級であるか、または第4級であるかのいずれかであることを示す。問題文に指示されたアルカンの範囲では、第2級炭素、および第3級炭素上には、かならず水素が結合しているため、第2級水素、第3級水素があることになってしまうためである。なお、当然のことながら(4本の結合がすべてアルキル基で置換された)第4級炭素上には水素が結合していない。
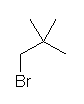
c) isopropyl 基(1-methylethyl 基)は3つの炭素からできてる。そのため、(2つの isopropyl 基が炭素を重複して使用していないと考えれば、)問題文の指示である7つの炭素のうち、6つの炭素は isopropyl 基に帰属する。
(解答例)
a) cyclohexane
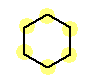
末端もなく、枝分かれもない構造は環状アルカンのみが描ける。
b) 2,2,3,3-tetramethylbutane
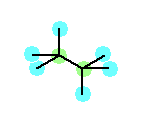
第1級炭素と第4級炭素のみからできている構造を考えればよい。
c) 2,4-dimethylpentane
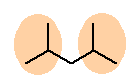
2つのイソプロピル基を1つの炭素上に置換したものが上の構造。ただし、命名上の側鎖としてイソプロピル基をもっているわけではない。
2.50
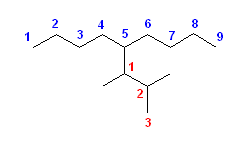
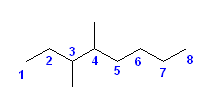
それぞれ「置換命名法」「基官能命名法」の両者で命名する。
IUPAC体系名(置換命名法): 「側鎖置換基」+「主鎖」+「接尾語」
基官能命名法: 「アルキル基」+「スペース」+「一般名」
(解答例)
置換命名法、基官能命名法の順に記す。
次の解答例では、基官能命名法を用いる際、許容されているアルキル基の慣用名は、なるべくこれを用いたが、複合置換基としてアルキル基を命名しても、もちろんよい。
a)
butan-2-amine
sec-butyl amine
b)
2-chlorobutane
sec-butyl chloride
c)
N-ethylbutan-2-amine
sec-butyl ethyl amine
d)
1-ethoxypropane
ethyl propyl ether
e)
2-methylpentane
基官能命名法では命名できない。
慣用名 isohexane
f)
propan-2-amine
isopropyl amine
g)
2-bromo-2-methylbutane
1,1-dimethylpropyl bromide
なお、sec-pentyl 基は、IUPACで慣用名として許容されないので、sec-pentyl bromide は不可。
h)
4-methylpentan-1-ol
isohexyl alcohol
i)
bromocyclopentane
cyclopentyl bromide
j)
cyclohexanol
cyclohexyl alcohol
2.51-2.60
2.51
同族体で分子量のことなるものは、分子量の大きいものの方が van der Waals 力(ロンドン力)が強くはたらく。骨格異性体で、分子量が同じ場合は、枝分かれのないものの方が表面積が大きいので、 van der Waals 力(ロンドン力)が強くはたらく。
e) (慣用名)イソヘキサン isohexane は、2-methylpentane
i) いきなり密度かよって思った? いやいや落ち着いてよく考えてみてください。分子間力が強いほど、互いにぎゅっと近づきあうって考えたらいいですね。
(解答例)
a) 同族列である。炭素数の多い 1-bromohexane の方が高沸点である。
b) 骨格異性体である。分子量は同じであるが、枝分かれの少ない 1-chloropentane の方が、1-chloro-3-methylbutane より高沸点である。
c) 疎水部のより小さい(水酸基1個あたりの炭素数の少ない)butan-1-ol の方が水への溶解度が大きい。
d) 官能基異性体である。一方はエーテルなので、水素受容能はあるものの、水素結合供与能がないため、水素結合できない。同種分子間で水素結合可能な hexan-1-ol の方が高沸点である。
e) 骨格異性体である。枝分かれの少ない hexane の方が高融点である。2-methylpentane の融点、-153.7 ℃、hexane の融点 -95 ℃
f) 水素結合可能なアルコールの方が沸点が高い。pentan-1-ol の方が高沸点である。
g) 塩素より臭素の方が大きいから、接触面積が増えて van der Waals 力(ロンドン力)が強くはたらく。そのため 1-bromopentane の方が、1-chloropentane よりも高沸点である。(「重いから気液の界面から飛び出しにくい」のではない。2.29(発展)の項も参照)
h) 官能基異性体である。一方はエーテルなので、水素受容能はあるものの、水素結合供与能がないため、水素結合できない。同種分子間で水素結合可能な butan-1-ol の方が高沸点である。
i) 同族列である。炭素数の多い octane の方が分子間力も強く、密度も高くなる。
オクタンの密度、0.70 g/mL, ヘプタンの密度、0.68 g/mL だそうです。
j) 水素結合の強さは、アルコール > アミンであるから、対応する(アルキル基部分の共通な)アルコールとアミンでは、アルコールの方が高沸点である。(水、アンモニアについて思い出すこと。)3-methylbutan-1-ol の方が 3-methylbutanamine より高沸点である。
k) 骨格異性体で、一方は第一級アミン、もう一方は第二級アミンである。水素結合可能な水素の数が多い第一級アミンの方が、分子間力が強く働くと考えられる。(教科書 p112 の一番下の記述も参照。)また、ヘキシルアミンには分岐がないが、ジイソプロピルアミンは、枝分かれにより分子表面積が小さくなっているのも分子間力の順として同じ方向に作用する。よって、hexan-1-amine の方が高沸点である。
2.52
問い 2.2、2.8 などと同じように考える。すなわち、アルカンの骨格異性体を重複なくすべて探すためには、はじめに自分で設定した置換命名法に用いる主鎖(単純なアルカンなので、最も長い炭素の鎖)を固定して考え、枝として書いた部分が主鎖にならないようにすればよい。
(解答例)
主鎖がヘプタンであるもの。
heptane
主鎖がヘキサンであるもの。
残りの炭素は1つなので、メチル基が1つ結合している。
2-methylhexane, 3-methylhexane
※ 4-methyl〜 は、左右を入れ替えると、3-methyl〜 と重複していることがわかる。
主鎖がペンタンであるもの。
残りの炭素は2つなので、メチル基が2つ結合している場合と、エチル基が結合している場合とがある。
2,2-dimethylpentane, 2,3-dimethylpentane, 2,4-dimethylpentane,
3,3-dimethylpentane
3-ethylpentane
主鎖がブタンであるもの。
残りの炭素が3つである。メチル基が3つ結合している。エチル基を考えると、主鎖がブタンより長くなってしまうので、以下の一つのみ。
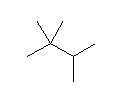
2,2,3-trimethylbutane
2.53
ここでは、フッ素の有無に着目してください。
(解答例)
フッ素は、水素結合受容能をもつので、水に対する溶解度を上げる。
Mortrin より Ansaid の方が水に対する溶解度が高いと考えられる。
2.54
ここで、問題文の指示は、「体系的名称(すなわち、置換命名法に従った化合物名)として正しくないものを探し、正しく命名しなおせ」である。
1) 基官能命名法に従って命名されている場合。
2) 置換命名法に従って命名されているが、主鎖の選び方、その他が間違っているため、構造と対応した命名になっているものの、正しくない場合。
の2通りについて考慮すること。
そのためには、与えれた化合物名だけを眺めていても答えは出ないので、まずは、この化合物名(正しいにしろ、誤っているにしろ)に対応した構造式を描いてみること。
(解答例)
a) 次の構造を示す。
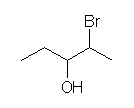
主鎖の位置番号のつけかたが間違っている。
2-bromopentan-3-ol
b) 次の構造を示す。
主鎖のとり方、位置番号のつけかたまでは合っているが、側鎖を正しくアルファベット順に並べていない。
4-ethyl-2,2-dimethylheptane
c) 次の構造を示す。
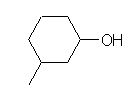
位置番号のつけ方が間違っている。主基を1にするのは正しいが、環の上の回り方を逆にすると、側鎖番号をもっと小さくできる。
3-methylcyclohexanol
d) 次の構造を示す。
位置番号のつけ方が間違っている。最優先事項として、主基の番号を小さくしなければいけない。そのため、主基(水酸基)を1にする。
2,2-dimethylcyclohexanol
e)
側鎖の複合置換基名として、2,2-dimethylethyl 基は正しくない。もし、これに相当する構造を書けば、上のようになるはずである。「アルキル基」に位置番号を振るときには、常に末端ではなく根元側を1番にするからである。この点を Al Kane 氏が誤解していたのだとすると、2,2-dimethylethyl 基という誤称が、1,1-dimethylethyl 基(すなわち、tert-butyl 基)のことを指していたかも知れないが、ここでは、上の構造で名称を与えておく。
5-isobutylnonane
または、5-(2-methylpropyl)nonane
f) 臭化イソペンチル isopentyl bromide は、基官能命名法に従った名称であり、体系名ではない。
1-bromo-3-methylbutane
g)
3,3-dichlorooctane で正しい。
h) 次の構造を示す。
主鎖の選び方が間違っている。最も長い炭素鎖を選ばねばならない。
2,5-dimethylheptane
i) 次の構造を示す。
位置番号のつけ方が間違っている。最優先事項として、主基の番号を小さくしなければいけない。そのため、母体は pentan-4-ol ではなく、pentan-2-ol としなければいけない。
5-bromopentan-2-ol
j) 次の構造を示す。
主鎖の選び方が間違っている。長さが同じ主鎖を選べるので、分岐の数(側鎖の数)が多くなるよう選ばねばならない。
3-ethyl-2-methyloctane
k) 次の構造を示す。
主鎖の選び方が間違っている。最も長い炭素鎖を選ばねばならない。
2,3,3-trimethyloctane
l) 次の構造を示す。
位置番号のつけ方が間違っている。最優先事項として、主基の番号を小さくしなければいけない。そのため、母体は hexan-4-amine ではなく、hexan-3-amine としなければいけない。
5,N,N-trimethylhexan-3-amine
2.55
a) の構造では、2つの置換基がアンチの位置関係にあるので、ゴーシュ相互作用は考えなくてよい。b)、c) の構造においても、2つの置換基が隣接炭素上にないから、ゴーシュ相互作用は生じない。従って、この3つの構造のもつひずみとしては、アキシャル位にある置換基に由来する 1,3-ジアキシャル相互作用である。
ところで、メチル基と塩素を比較すると単原子の置換基である塩素の方が、嵩が小さい。これは、教科書p126、表2.10 の平衡定数の数値とも合致する。
1,3-ジアキシャル相互作用の大きさは、
メチル−水素間(1組) 3.6 kJ/mol
塩素−水素間(1組) 1.1 kJ/mol
を用いて見積もってよい。
また、発展に述べるような理由で、塩素−メチル間の1,3-ジアキシャル相互作用は、非常に大きな値をもつと考えてよい。別法で見積もったところ、35〜40 kJ/mol 程度になりそうです。
(解答例)
それぞれの構造のもつひずみの要因を挙げると次のようになる。
a) 1-chloro-2-methylcyclohexane
塩素−3位水素間、塩素−5位水素間の 1,3-ジアキシャル相互作用、
メチル−4位水素間、メチル−6位水素間の 1,3-ジアキシャル相互作用。
b) 1-chloro-3-methylcyclohexane
塩素−5位水素間の 1,3-ジアキシャル相互作用、
メチル−5位水素間の 1,3-ジアキシャル相互作用。
塩素−メチル間の 1,3-ジアキシャル相互作用。
c) 1-chloro-4-methylcyclohexane
塩素−3位水素間、塩素−5位水素間の 1,3-ジアキシャル相互作用、
メチル−2位水素間、メチル−6位水素間の 1,3-ジアキシャル相互作用。
a),c) は内訳が同じなので同じエネルギーを持つ。
ヒントに挙げた数値を用いると、1.1×2 + 3.6×2 = 9.4 kJ/mol である。
b) は、ヒントに挙げた数値を使うなら、1.1 + 3.6 + 30 kJ/mol 以上である。この合計値は a)、c) の 9.4 kJ/mol よりもずっと大きいため、b)の構造がもっとも高いエネルギーをもつ。
(発展)
cis-1-chloro-3-methylcyclohexane のジアキシャル体について、Chem3D を用いた構造をいくつか示す。
Stick and Ball 方式で示したもの。緑色が塩素。Stick and Ball 方式は、結合の順序をわかりやすくするため、原子のサイズを小さめに表示している。
上と同じ方向から、今度は、実際の原子のサイズを反映している空間充填方式で示したもの。
つぎに、同じ構造を、シクロヘキサン環の軸方向(面の上方)から見たものを示す。
さて、最後の図のメチル基を赤線で囲んだ。更に、このメチル基と 1,3-ジアキシャル相互作用している水素を青線で囲んだ。この水素と重ねるようにして、塩素原子と同じ大きさの円を緑色で示した。
1,3-ジアキシャル相互作用とは、2つの置換基が(その置換基を構成する原子の軌道電子が、互いに静電反発することで)反発しようとすることに由来するひずみである。水素−水素間の1,3-ジアキシャル相互作用はないものとみなしてよいし、水素−塩素間の1,3-ジアキシャル相互作用も、メチル−水素間の1,3-ジアキシャル相互作用の1/3より小さい値であった。これは、この図からもわかるように、2つの置換基が空間的にほとんど重ならないことに由来している。
赤い線と青の円は、一部が重なっており、これが 3.6 kJ/molという大きさのメチル−水素間の1,3-ジアキシャル相互作用の原因である。これが赤い線と緑の円になると、この重なりの領域がずっと大きくなっている。重複した部分の面積でおよそ10倍以上になっている。すなわち、それだけ反発が大きい(ひずみが大きい)はずであることがわかる。
(メチル基は、付け根の炭素との間の単結合で自由回転できるので、上の構造では塩素との重なりが小さくなる方向い回転して、逃げている。)
この図だけでは、塩素−メチル間の1,3-ジアキシャル相互作用の大きさは正確にはわからない。そのため、上の構造を Chem3Dを用いて構造最適化を行い、生成熱を求めた。その結果、trans-1-chloro-3-methylcyclohexane の、メチルがアキシャル位に、塩素がエカトリアル位にある方の配座異性体と比べて、37 kJ/mol のエネルギーの上昇があるという結果になった※。
この2つの立体異性体の配座がもつひずみは、
シス体で、
塩素−水素間の 1,3-ジアキシャル相互作用、
メチル−水素間の 1,3-ジアキシャル相互作用、
塩素−メチル間の 1,3-ジアキシャル相互作用。
トランス体で、
メチル−水素間の 1,3-ジアキシャル相互作用×2組
であるから、ここから見積もると、塩素−メチル間の1,3-ジアキシャル相互作用の大きさは、39.5 kJ/mol となる。
註:※ とても真面目に計算をしたわけではないので、数値の精度は保証できません。
2.56
C7H16 は、CnH2n+2 に従っている(n=7)ので、不飽和度が0である。すなわち、問い 2.52 と同様、全ての骨格構造式を描くところからはじめる。その中で、第2級水素(第2級炭素に結合した水素)をもたないものを挙げる。
(解答例)
C7H16 の骨格異性体をすべて挙げると次の通り。
主鎖がヘプタンであるもの。

heptane
第1級炭素2つおよび第2級炭素4つをもつ。
主鎖がヘキサンであるもの。
残りの炭素は1つなので、メチル基が1つ結合している。

2-methylhexane, 3-methylhexane
第1級炭素3つ、第2級炭素3つ、第3級炭素を1つをもつ。
主鎖がペンタンであるもの。

2,2-dimethylpentane, 2,3-dimethylpentane, 2,4-dimethylpentane,
3,3-dimethylpentane
いずれも、第1級炭素を4つもつ。メチル基の結合の位置によるが、いずれも、第2級炭素を2つ、または1つ持つ。

3-ethylpentane
第1級炭素を3つ、第2級炭素を3つ、第3級炭素を1つもつ。
ここまで、すべて問題の条件に合致しない。
唯一合致するのが、次の主鎖がブタンであるもの。

2,2,3-trimethylbutane
第1級炭素が5つ、第3級炭素が1つ、第4級炭素が1つである。第2級炭素をもたないので、従って第2級水素をもたない。
2.57
置換命名法では、「側鎖置換基」+「主鎖」+「接尾語」の形で命名するが、この問いに与えられた名称の化合物は、いずれも主官能基を示す接尾語をもっていない。主鎖部分が多重結合をもっていない。(主鎖部分が、アルカンであり、アルケン、アルキンなどになっていない。)
1) まずは、化合物名のうち、どの部分が主鎖を示しているかを見出し、主鎖の構造を描くこと。
2) 主鎖に位置番号を振る。主官能基をもたないシクロアルカンであれば、この時点ではどこを 1 にしても構わない。直鎖状のアルカンであれば、1つの末端のいずれかを 1 とする。
3) 側鎖置換基の構造を、対応した位置番号のところに描き加える。
(解答例)
a)
b)
c)
d)
e)
f)
2.58
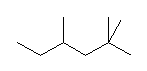
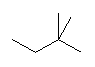
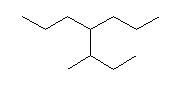
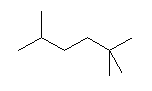
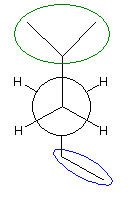
(解答例)
1、2位炭素および2位の炭素上のメチル基を、イソプロピル基とみなし、iPr の記号で表した。また、5位、6位の炭素をエチル基とみなし、Et の記号で表した。すなわち、
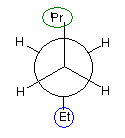
と、
は同じものを表す。
また、下記のニューマン投影図において、イソプロピル基とエチル基のつくる2面角を基準とした。(360度で1回転であるが、2面角360度は、0度のときと同じであるので表からは省略している。)
| 2面角 | 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
|---|---|---|---|---|---|---|
| ニューマン投影図 | 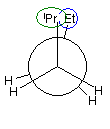 |
 |
 |
 |
 |
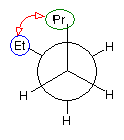 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | |
| 相互作用の種類 | イソプロピル−エチルの重なり 水素−水素の重なり×2 |
イソプロピル−エチルののゴーシュ相互作用 | イソプロピル−水素の重なり エチル−水素の重なり 水素−水素の重なり |
なし | イソプロピル−水素の重なり エチル−水素の重なり 水素−水素の重なり |
イソプロピル−エチルののゴーシュ相互作用 |
| もっとも不安定な配座 | もっとも安定な配座 |
c,d) 2-methylhexane の炭素−炭素結合は、すべて単結合なので、結合軸のまわりで自由回転が可能である。
また、この際、手前側または奥側の炭素に結合している3つの置換基がすべて等しい場合、3つのねじれがた配座のひずみエネルギーの大きさが等しくなる。
1位炭素と2位炭素の間の結合まわりの回転
2位炭素上のメチル基(図では、1’とした)と2位炭素のまわりの回転も同じである。1位炭素上に3つの水素が結合しており、これらが等しいため、3つのねじれがた配座のひずみエネルギーはすべて等しい。
2位炭素と3位炭素の間の結合まわりの回転
プロピル基(C4からC6)が、1位、1’位の炭素の間にある場合には、2箇所のゴーシュ相互作用があるのに対し、1位または1’位の炭素に対するアンチ位にある場合には1箇所しかゴーシュ相互作用がない。したがって、ねじれ形配座のひずみエネルギーは等しくない。
3位炭素と4位炭素の間の結合まわりの回転
上の表に示したように、イソプロピル基とエチル基がアンチ位にある場合とゴーシュ位にある場合とでひずみエネルギーに差がある。
4位炭素と5位炭素の間の結合まわりの回転
イソブチル基とメチル基がアンチ位にある場合とゴーシュ位にある場合とでひずみエネルギーに差がある。
5位炭素と6位炭素の間の結合まわりの回転
6位炭素上に3つの水素が結合しており、これらが等しいため、3つのねじれがた配座のひずみエネルギーはすべて等しい。
2.59
それぞれの置換基が、それぞれ環の上、下どちらなのかを調べよ。
(解答例)
a) 下と上。従って、トランス体。
b) 上と下。従って、トランス体。
c) 下と下。従って、シス体。
d) 上と上。従って、シス体。
2.60
C5H11Br の異性体をすべて書き出すためには、
1) アルカン C5H12 の骨格異性体を重複なくすべて書き出してから、
2) 等価ではない水素をひとつずつ臭素に置き換える。
下の(発展)で、同族体について例示したので、参照してください。
命名は、すべて英語で行うこと。
a) 体系的名称(置換命名法に従った名称)では、臭素は主官能基になれない。側鎖アルキル基および側鎖置換基(bromo-)の結合したアルカンとして命名する。
b), c) 慣用名(基官能命名法に従った名称)では、「アルキル基」+スペース+「一般名;bromide」として命名する。(日本語にする場合は、臭化アルキル)
d), e), f) ハロゲン(臭素)の結合した炭素の級数に着目して判断する。
(解答例)
C5H12 は、分子式が、一般式 CnH2n+2に従っているから、不飽和度は0で、二重結合も環の構造も持たない。枝分かれを含めて考えた骨格異性体は、次の3種類である。
ここで、矢印で示しているのは、等価ではない炭素である。たとえば、2番目の構造、2-methylbutane の、側鎖メチル基の炭素は、主鎖1位の炭素と等価である。また、3番目の構造、2,2-dimethylpropane の側鎖メチル基の炭素は、主鎖1番および主鎖3番の炭素とそれぞれ等価である。
第4級の炭素(水素が結合していない)を除いて、それぞれの炭素上の水素を臭素に置き換えることにより、異なる構造をもつ臭化アルキルを与える。
pentane から誘導される臭化アルキル
左より、
(1) 1-bromopentane
pentyl bromide
第1級の臭化アルキルである。
(2) 2-bromopentane
1-methylbutyl bromide
第2級の臭化アルキルである。
なお、基官能命名法を用いる際、1-methylbutyl 基が、sec-pentyl 基という慣用名ではないことに注意すること。
(3) 3-bromopentane
1-ethylpropyl bromide
第2級の臭化アルキルである。
2-methylbutane から誘導される臭化アルキル
左より、
(4) 1-bromo-2-methylbutane
2-methylbutyl bromide
第1級の臭化アルキルである。
(5) 2-bromo-2-methylbutane
1,1-dimethylpropyl bromide
第3級の臭化アルキルである。
1,1-dimethylpropyl 基は、tert-pentyl 基という慣用名が、IUPACによって許容されている。従って、tert-pentyl bromide でもOK。
(6) 2-bromo-3-methylbutane
1,2-dimethylpropyl bromide
第2級の臭化アルキルである。
置換命名法で、2つの置換基(メチル基、臭素)の位置番号が、どちらから数えても2位と3位なので、アルファベット順で先にくる臭素の方を2位とする。
基官能命名法において、1,2-dimethylpropyl 基を、1位にメチル基の置換した isobutyl 基として命名することはできない。isobutyl 基は、IUPACで許容されている慣用名であるが、その名前のまま使うことのみが許されており、誘導体を作ることは認められていないからである。
(7) 1-bromo-3-methylbutane
isopentyl bromide
または、3-methylbutyl bromide
第1級の臭化アルキルである。
2,2-dimethylpropane から誘導される臭化アルキル
第4級炭素上には水素がないから、第1級炭素上で臭素が置換した、上の一つのみである。
(8) 1-bromo-2,2-dimethylpropane
2,2-dimetylpropyl bromide
第1級の臭化アルキルである。
置換命名法において、主鎖の候補として、長さの等しい炭素鎖の選び方が2通りあるが、主鎖上の置換基の数を多くするように選ぶため、bromomethyl 基とmethyl 基が結合した propane ではなく、bromo 基と、2つの methyl 基の結合した propane として命名する。
基官能命名法で、2,2-dimethylpropyl 基は、IUPACで認められた neopentyl 基という慣用名を用いても良い。(tert-pentyl 基ではない。)
(発展)
類例を挙げておく。
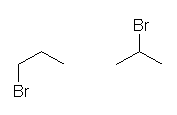
C3H7Br の異性体をすべて書き出すためには、
propane の非等価な水素を臭素に置き換えることを考える。
結果として得られるのは、次の2種類の構造である。
C4H9Br の異性体をすべて書き出すためには、
butane の骨格異性体をすべて挙げ、それらについて非等価な水素を臭素に置き換えることを考える。

結果として得られるのは、次の4種類の構造である。
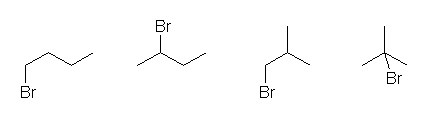
C6H12Br の異性体をすべて書き出すためには、
hexane の骨格異性体をすべて挙げ、それらについて非等価な水素を臭素に置き換えることを考える。
第1級の臭化アルキルが8通り、第2級の臭化アルキルが6通り、第3級の臭化アルキルが3通りあることが上図よりわかる。なお、第4級炭素(緑色の矢印で示した)には、水素がないから、第4級の臭化アルキルは生じない。
2.61-2.70
2.61
接尾語として命名できる主官能基をもつのは、b), c), h) の3つである。
主鎖のとりかたに特に気をつけるべきなのは、c), f), g) 。
(解答例)
b), c), h) の3つは、主基(主官能基)をもつ。そのため、主基を結合した炭素を含む主鎖を選ぶ。主基は1つで、また、多重結合がないから、「主基を結合した最も長い炭素鎖」が主鎖となる。位置番号は、主基の番号が小さくなるように主鎖の一端から数え始める。
上記3つ以外は、主基をもたない。
e) の塩素は、基官能命名法では、アルキル+スペース+クロリド(日本語では塩化アルキル)と命名できるものの、置換命名法では塩化物に相当する接尾語はない。従って、塩素は、他の置換基(この例では、エチル基、メチル基)と同列に扱われ、位置番号は、置換基の位置番号の数字の組が小さくなるよう、主鎖の一端から数え始める。
f) はエーテル結合をもつ。水酸基であれば、主基となることができるのだが、エーテル結合は主基とならない。そのため、メトキシ基は側鎖置換基として数えることになる。その場合、主鎖は「最も長い炭素鎖」になるので、メトキシ基と直接結合していない部分(教科書の分子構造では、右端と中央付近の分岐点から下のイソブチル基側を結んだ部分)となる。従って、メトキシ基を含む部分は、複合置換基として命名する。従って、エチル基の2位(根元から遠い方の炭素)にメトキシ基の置換した(2-methoxyethyl)基とする。
a) butane
b) propan-1-ol
c) 4-propylnonan-1-ol
d) 2-methyl-5-isopropyloctane
または、2-methyl-5-(1-methylethyl)octane
e) 6-chloro-4-ethyl-3-methyloctane
f) 4-(2-methoxyethyl)-2-methylheptane
g) 6-isobutyl-2,3-dimethyldecane
または、2,3-dimethyl-6-(2-methylpropyl)decane
置換基をアルファベット順に並べる際、一方の置換基を isobutyl 基とする場合は、「i」、複合置換基として 2-methylpropyl 基とする場合は、「m」で数えることになるから、di + methyl 基(倍数接頭語の「d」ではなく、「m」)との順序が入れ替わることに注意。
h) 8-methyldecan-4-amine
i) 1-isobytyl-2-methylcyclohexane
または、1-methyl-2-(2-methylpropyl)cyclohexane
g) と同様、一方の側鎖に慣用名を用いるか、複合置換基名とするかで、アルファベット順が入れ替わる。特に、この化合物の場合は、(置換基の数字の組は、どちらから数えても 1,2 であり変わらないから)アルファベット順が位置番号に影響を与えることに注意。
2.62
2.42 のヒントを参照すること。
(解答例)
a)
2つの置換基が両エカトリアルとなる左の配座の方が安定である。
b)
2つの置換基が両エカトリアルとなる左の配座の方が安定である。
c)
2つの置換基が両エカトリアルとなる左の配座の方が安定である。
d)
環の反転の前後で、2つの置換基がアキシャルとエカトリアルをとる。より嵩高い置換基がエカトリアル位に来たほうが安定であるから、左の配座の方がやや安定である。※
e)
2つの置換基が両エカトリアルとなる左の配座の方が安定である。
f)
環の反転の前後で、2つの置換基がアキシャルとエカトリアルをとる。より嵩高い置換基がエカトリアル位に来たほうが安定であるから、右の配座の方がやや安定である。※
※ エチル基とイソプロピル基のもつ立体ひずみの大きさ(2つ離れた炭素上のアキシャル水素との1,3-ジアキシャル相互作用の大きさ)は、問い 2.41 の発展の項に示した。イソプロピル基がエカトリアル位にある方の配座異性体の方が、エチル基がエカトリアル位にあるものよりも、1.2 kJ/mol だけ安定である。これは、平衡にあるときに40%、60%の存在比になるような値である。
2.63
アルコール R-OH が水に溶けていくとき、水素結合による水分子間の結合を切り、代わりにそこに入りこむことになる。
(解答例)
漫画で示した。
点線は、水分子の水素結合のネットワーク(実際はこんな平面4配位ではないですが。)
また、アルコールはアルキル基部分では van der Waals 相互作用により分子間引力を感じている。水酸基部分では、水素結合もあるだろう。
これを水に溶かすと、
(1)アルコールのアルキル基同士のvan der Waals 相互作用がなくなる。
また、(2)アルキル基が水同士の水素結合の切断(図中、×で示した。)を起こす。
(1)は、アルキル基同士の接触が失われる代わりに、水分子との接触が生じるため、代わりの van der Waals 相互作用が生じるので損も得もないと考えることもできる。
系は、(2)の分だけ、全体として損をすることになる。そのため、アルキル基は水の中に分散しにくい(疎水性である)。
2.64
問い 2.20 のヒントにも書いたように、酸素原子の増減では、炭素原子と水素原子の数に影響を与えないから、不飽和度を考える際、分子式 C5H12O は、C5H12 と同じとして考えてよい。すなわち、CnH2n+2 に従っている(n=5)ので、不飽和度が0である。 従って、この条件のエーテルは、多重結合も環状構造も持っていない。
エーテルの全ての異性体を描くとき、大きくわけて2つのアプローチがありえる。以下、いずれを用いて考えてもよい。
(方法1)
エーテル結合酸素を、第2級の炭素(-CH2-)に置き換えてしまうと、アルカンになることを利用する。
1) はじめに、酸素を -CH2- に置き換えた(エーテルの分子式より炭素数の1つ多い)アルカンの骨格異性体をすべて書き出す。この問いの場合は、C6H14 についてである。
2) 任意の2級炭素を酸素に置き換えると、エーテルになることを利用する。ただし、等価な炭素の酸素への置き換えは、それぞれ同じエーテルを与えるので注意する。
(方法2)
エーテルの構造が、R-O-R' であり、2つのアルキル基をもつ構造であることを利用する。
1) 2つのアルキル基、-R と -R' の炭素数の合計は不変でなければならない。この問いの場合は、5個である。従って、-R と -R' の炭素数の組み合わせは{1個、4個}であるか、または{2個、3個}のいずれかでなければならない。(エーテル結合は、エステル結合やアミド結合とは異なり、左右が対称な部分構造をもつから{3個、2個}の組み合わせは、{2個、3個}の組み合わせと同じ分子構造を与えることになる。{4個、1個}も{1個、4個}の組み合わせと同じ。)
なお、このとき、炭素数0個のアルキル基は存在しない。酸素の片側にすべての炭素があり、もう一方が炭素を持たない構造というのは、R-O-H で、すなわちアルコールである。エーテルについてのみ考えればよいのであるから、ここでは考慮しなくてよい。
2) 炭素数 1個、および2個のアルキル基は、methyl 基、ethyl 基 しか存在しないが、炭素数3以上のアルキル基には、骨格異性体が存在するので、これをすべて重複なく探して、1) に対して組み合わせてやればよい。
3) たとえば炭素数が4のアルキル基の骨格異性体をすべて重複なく探すためには、炭素数4のアルカンの骨格異性体を重複なくすべて探し、次に等価でない水素が何種類あるのかを見つければよい。
(解答例)
ヒントに示した方法を含む3通りの方法で解答しておくが、いずれの方法で見つけても、同じ答えになる。
方法1:C6H14 の骨格異性体から出発する方法
C6H14 の骨格異性体をすべて描き、等価ではない第2級炭素をすべて見つける。
ここで、第1級の炭素を酸素に置き換えると、アルコールが得られる。また、酸素は、結合の手が2本しかないから、第3級、第4級の炭素を酸素に置き換えることはできない。
よって、第2級の炭素を酸素に置き換えた次の6通りとなる。
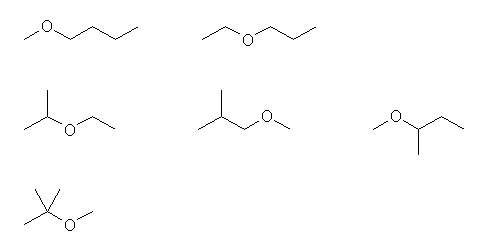
方法2:エーテル結合の両側、2つのアルキル基にわけて考える方法。
1) -R と -R' の炭素数の組み合わせが{1個、4個}である場合
2) -R と -R' の炭素数の組み合わせが{2個、3個}である場合
方法3:置換命名法における主鎖の長さごとに分類して探す方法
側鎖置換基としてとりえるパターンが、単純な枝分かれアルカンやアルキル基に比べて複雑になるので、炭素数が増えたとき、慣れないうちは、数え落としの原因となりえるから、この3番目の方法は推奨しない。
(下図において、-OMe は -OCH3, -OEt は -OCH2CH3 を示す。これらは、以後、註記がなくても一般的に用いられる略号である。)
1) 主鎖が butane である場合。
側鎖に methoxy 基を1つもつ。
2) 主鎖が propane である場合。
側鎖に、「ethoxy 基、一つ」または、「methoxy 基と methyl 基」をもつ。ただし、methyl 基は、主鎖の末端炭素上には置換できない(その場合は、主鎖の長さが増えてしまうので、すでに数えたものと重複するため)のに対し、methoxy 基は主鎖末端炭素上に置換できる。methoxy 基の置換により、主鎖の炭素鎖長が変わらないためである。
また、一般には、「methoxymethyl 基」を側鎖にもつ場合も考慮しなければならないが、この場合、主鎖の末端炭素上での置換は考えなくてよい。これは、炭素長の1つ多い主鎖に methoxy 基が結合したものとして考えることができるためである。
2位に methoxymethyl 基が結合したものとして考える場合も、すでに、描いた構造と一致する(次図、下段、右から2番目)。従って、この問いの場合は、新たな構造として数えるものはでてこない。(主鎖が pentane 以上のときは、同様に1位、2位上の methoxymethyl 基による置換は考慮しなくてよいが、3位より内側での置換は、数え忘れないようにしないといけない。)
3) 主鎖が ethane の場合。
アルキルオキシ基上として、炭素が3の場合、propoxy, isopropoxy がありえる。しかし、これらのアルコキシ基上には、炭素数3の直鎖が含まれるため、主鎖が ethane ではなくなる。これ以外に組み合わせとして、「ethoxy 基と methyl 基」、および「methoxy 基と ethyl基」、「methoxy 基と、2つの methyl 基」について探すことになるが、いずれも、ethane 上に methyl 基が結合した時点で主鎖が ethane ではなくなるので、この問いの場合は、新たな構造として数えるものはでてこない。
命名は、次の通り。構造式との対応は、方法1の図の順。
置換命名法、基官能命名法の順。
(1) 1-methoxybutane
butyl methyl ether
(2) 1-ethoxypropane
ethyl propyl ether
(3) 2-ethoxypropane
ethyl isopropyl ether
(4) 1-methoxy-2-methylpropane
isobutyl methyl ether
(5) 2-methoxybutane
sec-butyl methyl ether
(6) 2-methoxy-2-methylpropane
tert-butyl methyl ether
置換命名法は方法3に、基官能命名法は方法2に直接対応していることがわかると思う。
※ 基官能命名法では、スペースで区切って「アルキル基名」をアルファベット順に並べる。このときに直接比較するアルファベットを赤文字で示しておいた。特に、「isopropyl」、「isobutyl」などは「i」で始まるひとつの単語として考えるのに対し、「sec-butyl」、「tert-butyl」などは、ハイフンで区切った接頭辞(イタリックで表記する)は別の単語としてみなすのでアルファベット順い含めないことに留意する。
2.65
なるべく多くの置換基がエカトリアル位にある方が安定である。
(解答例)
1,3,5-トリメチルシクロヘキサン。
環の位置番号が決まっていない場合は、cis-を優先するので、環の同じ側(紙面奥側)に結合している2つのメチル基が、1位と3位となる。
環の反転の前後の2つの配座異性体を書くと、次図のようになる。
左の配座の方が、安定である。
左の配座のひずみエネルギー:
5位メチル基と、1位および3位の水素の間での、1,3-ジアキシャル相互作用。
計 3.6×2 = 7.2 kJ/mol
右の配座のひずみエネルギー
1位メチル基と、5位水素の間での、1,3-ジアキシャル相互作用、3.6 kJ/mol。
3位メチル基と、5位水素の間での、1,3-ジアキシャル相互作用、3.6 kJ/mol。
1位メチル基、3位メチル基間での、1,3-ジアキシャル相互作用。
最後の項の大きさを知るためには、問い 2.71 を解く必要がある。
2.66
a) 主基(アミノ基)をもつので、接尾語 -amine を用いて命名する。
b) 主鎖の選び方に注意すること。主官能基、多重結合ともに存在しないので、炭素鎖長が最も長い部分で主鎖とするが、同じ長さとなる2通りのとり方が考えられる。側鎖の数が多くなるほうで選択すること。
(解答例)
a) N,6-dimethylheptan-3-amine
b) 3-ethyl-2,5-dimethylheptane
c) 1,2-dichloro-3-methylpentane
d) 2,3-dimethylpentane
e) 5-tertpentylnonane
または、5-(1,1-dimethylpropyl)nonane
f) 5-(2-ethylbutyl)-3,3-dimethyldecane
2.67
2.44 と同様に解く。
(解答例)
両エカトリアルである左の配座のひずみエネルギー:
1位メチル基と2位メチル基の間のゴーシュ相互作用、3.6 kJ/mol
両アキシャルである右の配座のひずみエネルギー:
1位メチル基の、3位および5位水素との 1,3-ジアキシャル相互作用、7.2 kJ/mol。
2位メチル基の、4位および6位水素との 1,3-ジアキシャル相互作用、7.2 kJ/mol。
従って、2つの配座の間のエネルギー差は、10.8 kJ/molである。
2.68
問題文の、「5つの置換基(水酸基)がすべてエカトリアル位にある」という情報をもとに書く。
(解答例)
なお、価標の先に元素記号を書かないと、メチル基であるとみなされるので、この問いのように価標があらかじめ書き込まれている場合は、水素も書き忘れないようにする。水素を省略して、次図でももちろんよい。
2.69
e) では、主鎖のとり方に注意すること。
a), c), g), f) 主基(水酸基)をもつので、接尾語(-ol)を用いて命名する。主鎖の位置番号のつけ方に、主基が影響するので注意すること。
(位置番号をつける際の優先順位の1が、「主基の位置番号の組が小さくなるように」であった。)
一方で、主基も多重結合ももたないものでは、位置番号をつける際、優先順位の3番目「置換基の位置番号の組が小さくなるように」に従う。そのため、置換基の位置関係の似ている g) と h) では、番号が異なることに注意する。
(解答例)
a) 5-methylhexan-3-ol
b) bromocyclopentane
c) 2-methylpentan-3-ol
d) 5-bromo-2-methyloctane
e) 5-ethyl-6-propyldecane
f) 6-bromohexan-2-ol
g) 4-ethyl-3-methylcyclohexanol
h) 4-bromo-1-ethyl-2-methylcyclohexane
2.70
「沸点が高い」とは、分子間の相互作用が強いことを示す。
水への溶解度の大小は、水との水素結合のしやすさと関係している。
(解答例)
a) アルコール分子が、分子間相互作用するとき、水酸基は水酸基との間で、水素結合をし、アルキル基部分は互いにファンデルワールス相互作用をしている。第2級のアルコールであるヘキサン-3-オールでは、水酸基部分がとなりのアルコールと水素結合しようとしたときに、アルキル基のかさ高さが邪魔になりやすいと考えられる。このため、第1級のアルコールであるヘキサン-1-オールの方が、分子間の相互作用が強くなり、沸点が高くなると予想される。
b) ジエチルエーテルは、酸素の両端に結合している2つのエチル基が自由に動けるために、かさ高い構造となる。周囲に水があって、エーテル酸素の孤立電子対を用いて、水との間に水素結合をしようとしても、自由に動けるアルキル基(エチル基)が邪魔をしてしまいがちである。しかしながら、テトラヒドロフランでは、酸素の両端のアルキル基が環の構造をとるように固定されている。そのため、酸素がアルキル基のかさ高さによる保護をうけずに、むき出しになっている。そのため、水分子からの水素結合を受けやすくなる。
2.71-2.73
2.71
それぞれの配座異性体のもつひずみの内訳をリスト化して比較すること。
(解答例)
環の反転の前後の2つの配座を書くと次図になる。
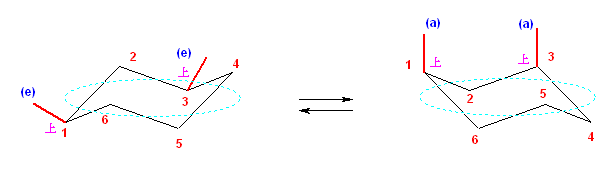
両エカトリアルである左の配座のひずみエネルギー:
ひずみは存在しない。
両アキシャルである右の配座のひずみエネルギー:
1位メチル基と5位水素との 1,3-ジアキシャル相互作用、3.6 kJ/mol。
3位メチル基と5位水素との 1,3-ジアキシャル相互作用、3.6 kJ/mol。
1位メチル基と3位メチル基の 1,3-ジアキシャル相互作用、x kJ/mol。
問題文の情報より、2つの配座の間のエネルギー差は、23.0 kJ/molであるから、x = 15.8 kJ/molである。
2.72
この問いは解かなくて良い。
(解答例)
2.73
それぞれの配座異性体のもつひずみの内訳をリスト化、合計すること。そのために、まずは配座異性体をひとつ書いてみること。
2.71 で解いた値も、計算上必要である。
(解答例)
環の反転の前後の2つの配座を書くと次図になる。
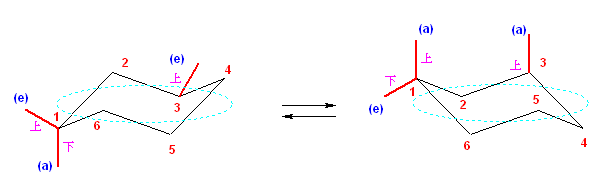
3位メチルがエカトリアル位にある左の配座のひずみエネルギー:
1位アキシャルメチル基の、3位および5位水素との 1,3-ジアキシャル相互作用、7.2 kJ/mol。
3位メチルがアキシャル位にある右の配座のひずみエネルギー:
1位アキシャルメチル基と5位水素との 1,3-ジアキシャル相互作用、3.6 kJ/mol。
3位メチル基と5位水素との 1,3-ジアキシャル相互作用、3.6 kJ/mol。
1位アキシャルメチル基と3位メチル基の 1,3-ジアキシャル相互作用、15.8 kJ/mol。
よって、エネルギー差は、15.8 kJ/molで、3位のメチル基がエカトリアル位にある方が安定である。室温においては、この2つの配座が平衡にある場合、3位のメチル基がエカトリアル位にある左の配座が 99.8 % となる。