1.01-1.10
1.01
���ȏ���1.1�̋L�q����݁A�u���q�ԍ��v�A�u���ʐ��v�����ꂼ�ꉽ��\���Ă���̂����m�F���悤�B
�i��j
���q�ԍ��́A���q�j���̗z�q�̐��ɓ������B�i���q�j�݂̂������d�א��ɓ������B�]���āA�����̌��q�ɂ����ẮA���͂̓d�q�̐��ƌ��q�ԍ����������B�j
���ʐ��́A���q�j���̗z�q�̐��ƒ����q�̐��̘a�ł���B�i�����q�͓d�ׂ������Ȃ����߁A�����q�̐����ω����Ă��A���q�j�̂����d�א��ɉe����^���Ȃ��B�܂�A���͂̓d�q�̐��ɉe����^���Ȃ��B�j
�����̌��q�ɂ����āA���͂̓d�q�̐����قȂ��Ă���A���̌��f�̉��w�I�������قȂ�A�ʂ̌��f�Ƃ��Ĉ�����B����ŁA�����̌��q�ɂ����Ď��͂̓d�q�̐��������ł���A�������f�i�̓��ʑ́j�Ƃ��Ĉ�����B
�_�f�͌��q�ԍ���8�Ȃ̂ŁA�_�f�̂ǂ̓��ʑ̂ł����Ă��A���q�j���̗z�q�̐��́A������8�ł���B
16O �ɂ��ẮA�z�q�̐��{�����q�̐���16�ł��邩��A�����q�̐���8�ł���B
17O �ɂ��ẮA�z�q�̐��{�����q�̐���17�ł��邩��A�����q�̐���9�ł���B
18O �ɂ��ẮA�z�q�̐��{�����q�̐���18�ł��邩��A�����q�̐���10�ł���B
1.02
�������q�̉��d�q�i�ŊO�k�ɂ���d�q�j�̐��́A���̌��f�̎����\��̈ʒu�ƊW���Ă���B
��P�����P�A��Q�����Q�A�Ƃ�������B�������A�������q�ł͂Ȃ��C�I���ł���ꍇ�A�d�ׂ̐��ɉ����ĉ��d�q�̐��������Ă��邱�Ƃɂ����ӂ��Ȃ���Ȃ�Ȃ��B�u���`�E�����q�́A�P�̉��d�q�������Ă���v�̂ł��邪�A���`�E���C�I���iLi+�j�́A���d�q�̐��́i�������q�ł̉��d�q���P���A���d�ׂ̕��P���������āj�O�ƂȂ�B
�i��j
a. �z�E�f�i��P�R���j���R��
�S�d�q��=���q�ԍ�=�T�B�d�q�z�u�F(1s)2(2s)2(2p)1
b. ���f�i��P�T���j���T��
�S�d�q��=���q�ԍ�=�V�B�d�q�z�u�F(1s)2(2s)2(2p)3
c. �_�f�i��P�U���j���U��
�S�d�q��=���q�ԍ�=�W�B�d�q�z�u�F(1s)2(2s)2(2p)4
d. �t�b�f�i��P�V���j���V��
�S�d�q��=���q�ԍ�=�X�B�d�q�z�u�F(1s)2(2s)2(2p)5
1.03
a. �T���B�i��
���w�I�������o���Ă���Ȃ�A�����\����T���̂��ȒP�ɂȂ�B
���d�q���ɂ��ẮA�₢1.2�Ɠ����l����������B
b. �d�q�z�u�ɂ��ẮA���ȏ��W�y�[�W�A�\1.2���Q�Ƃ��邱�ƁB
�i��j
���Ƃ��ΐ��_���J���E���iKOH�j�A�����J���E���iKCl�j�Ƃ���������킩��悤�ɁA�J���E���͂P���̗z�C�I���ɂȂ�₷���B���̂��Ƃ������P���i�A���J�������j�ł��邱�Ƃ��ސ��ł���B
�J���E���iK�j�́A��P���A��S�����Ɉʒu����B���q�ԍ��͂P�X�ł���B
�����\��̈ʒu����A�J���E���̓d�q�z�u��(K�k)2(L�k)8(M�k)8(N�k)1 �̌`�i�� ���̂悤�ȕ\�L�@�́A�����ȓd�q�z�u�ł���ƔF�߂��Ȃ����A�e�X�g�ŏ����Ă��~�ɂ��܂��B�j�ł��邱�Ƃ�������B�ȗ������ɑS�d�q�̔z�u�������ƁA���̒ʂ�B
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)1
M�k��d�O���ɓd�q������n�߂�̂́A4s�����܂��Ă���ŁA�����\��̑J�ڋ����i��S�����̂R���i3B���j����ƂȂ邱�Ƃɒ��ӂ���B
�]���āA���d�q���͂P�A�s�Γd�q����߂�O���� 4s �ł���B
1.04
���q�ԍ����q���g�Ɏ����\��̈ʒu���m�F����i�Ƃ������o���Ă��܂��ׂ����x���j�B
�����\��̈ʒu����A���d�q�k�̓d�q�����ӂ��߁A�d�q�z�u���킩��͂��B
�������A�\�������ɏ]���Č��q�ԍ������Ƃɐ����Ă����Ă��悢�B
������ɂ��Ă��A�d�q�z�u�������ۂɂ́A
1) ���q�ԍ��Ƒ��d�q�����Ή����Ă��邱�ƁA
2) ����k��d�O���ɓd�q������n�߂�̂́A���̏�̊k��s�O�������܂��Ă���ł��邱�Ɓi�\�������Ɏ�����Ă��錴�q�O���̑��G�l���M�[�̏��ԁj
�ɒ��ӂ��邱�ƁB
�\�������Ɏ�����Ă��錴�q�O���̑��G�l���M�[�̏��Ԃ́A�i���R�̂��ƂȂ���j�����\�̌`�Ɩ��ڂɊW������̂ŁA�����\�̌`�i��P���A��Q�����ys�z�u���b�N�A��R�������P�Q�����yd�z�u���b�N�A��P�R�������P�W�����yp�z�u���b�N�B�����^�m�C�h�A�A�N�`�m�C�h���yf�z�u���b�N�B�j�Ƃ̑Ή��Ŋo���Ă��悢�B
�i��j
b. ����������n���Q���i��P�V���j�ł��邱�Ƃ��o���Ă���A���d�q�k�� s �� p �O���ɂV�̓d�q�������Ă��邱�Ƃ������ɔ���͂��ł���B
a. ���f�i��R�����A��P�V���j�́A(K�k)2(L�k)8(M�k)7 �i�� ���̂悤�ȕ\�L�@�́A�c�ȉ����c�j�̌`�ł���̂ŁA��������Ƃɓd�q�z�u�������ƁA���̒ʂ�B
(1s)2(2s)2(2p)6(3s)2(3p)5
�L�f�i��S�����A��P�V���j�́A(K�k)2(L�k)8(M�k)18(N�k)7�̌`�Ȃ̂ŁA�d�q�z�u�́A
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)5
���E�f�i��T�����A��P�V���j�́A(K�k)2(L�k)8(M�k)18(N�k)18(O�k)7�̌`�Ȃ̂ŁA�d�q�z�u�́A
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)6(5s)2(4d)10(5p)5
1.05
1.2 ���� 1.4 �܂ʼn����Ă���m�[�q���g�ő��v����ˁB��r���錳�f�̌��q�ԍ������Ƃɓd�q�z�u���c�_���Ă��悢���A��Ɏ����\��Ō��f��T���āA��������Ƃɓd�q�z�u���c�_���Ă��悢�B�i�d�q�z�u�Ǝ����\��̈ʒu�͑Ή����Ă��邽�߁B�j
�i��j
a. �Y�f�i6C�j�F(1s)2(2s)2(2p)2
�P�C�f�i12Si�j�F(1s)2(2s)2(2p)6(3s)2(3p)2
�Ƃ��ɉ��d�q�����S�œ������B�������Ȃ̂ŁA�����\�ł͓����c�̗�ɂȂ��ł���B
b.�t�b�f�i9F�j�F(1s)2(2s)2(2p)5
�L�f�i35Br�j�F(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)5
�Ƃ��ɉ��d�q�����V�œ������B�������Ȃ̂ŁA�����\�ł͓����c�̗�ɂȂ��ł���B�i�n���Q���j
c. �_�f�i8O�j�F(1s)2(2s)2(2p)4
�����i16S�j�F(1s)2(2s)2(2p)6(3s)2(3p)4
�Ƃ��ɉ��d�q�����U�œ������B�������Ȃ̂ŁA�����\�ł͓����c�̗�ɂȂ��ł���B
d. �}�O�l�V�E���i12Mg�j�F(1s)2(2s)2(2p)6(3s)2
�J���V�E���i20Ca�j(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2
�Ƃ��ɉ��d�q�����Q�œ������B�������Ȃ̂ŁA�����\�ł͓����c�̗�ɂȂ��ł���B
�i���W�j
�e���̌��f�̕ʖ��F
��P���F�A���J�������i�������A1H �͏����j
��Q���F�A���J���y�ދ����i���`�ɂ́A4Be�A12Mg �͏����j
��P�R���F�y�ދ����i5B �͏����j�A�܂��́A�z�E�f��
��P�S���F�Y�f��
��P�T���F�v�j�N�g�Q���A�܂��́A���f��
��P�U���F�J���R�Q���A�܂��́A�_�f��
��P�V���F�n���Q��
��P�W���F��K�X�i�H�K�X�j�A�܂��́A�M�K�X
1.06
���ȏ��ɁA�ɐ����L�����Ƃ́A�قȂ����d�C�A���x�������q�Ԃ̋��L�����ł���B�Əq�ׂĂ���B���Ȃ킿�u�ɐ����傫���v�Ƃ́A�u���ɂ̒��x���傫���v�u�����Ɋ֗^����ӂ��̌��q�̓d�C�A���x�̍����傫���v�Ƃ������Ƃ��Ӗ�����B
���������āA�����ł́A���ȏ� p13�A�\1.3 �Ȃǂ���d�C�A���x��ǂݎ��A���̍����r����悢�B
�i��j
�����̗��[�ɂ��錴�q�ɂ����A���ȏ�p13�A�\1.3���d�C�A���x��ǂݎ���āA���̍����Ƃ�B
a)
H-CH3
EN(H) = 2.1
EN(C) = 2.5
�� ΔEN = 0.4
Cl-CH3
EN(Cl) = 3.0
EN(C) = 2.5
�� ΔEN = 0.5
�]���āA��ҁACl-CH3 �̌����̕������傫�����ɂ��Ă���A�傫�ȋɐ������B
b)
H-OH (ΔEN = 1.4), H-H (ΔEN = 0)
�]���āAH-OH �̌����̕����傫�����ɂ��Ă���A�傫�ȋɐ������B
c)
H-Cl (ΔEN = 0.9), H-F (ΔEN = 1.9)
�]���āAH-F �̌����̕����傫�����ɂ��Ă���A�傫�ȋɐ������B
d)
Cl-Cl (ΔEN = 0), Cl-C3 (ΔEN = 0.5)
�]���āACl-C3 �̌����̕����傫�����ɂ��Ă���A�傫�ȋɐ������B
1.07
1.6 �̃q���g��ǂ߁B
�i��j
���ȏ� p13�A�\1.3���A�d�C�A���x�̍������Ƃ߂�ƁA
Na-I (ΔEN = 1.6)
Li-Br (ΔEN = 1.8)
Cl-Cl (ΔEN = 0)
K-Cl (ΔEN = 2.2)
a) KCl, b) Cl2
1.08
���ȏ��ɉ�������Ă���B������Ƌ������āA���l�̖�肪������悤�ɗ������邱�ƁB
�Ȃ��A���ȏ� p14 ������R�s�ڂ̕��͂́A���̂悤�ɒ������Ă����Ă��������B
�i��j�ɐ������ɂ�����d�Ԃ̋����́A10-8 cm �ł��邩��A�d�ׂƋ����̐ς́A�c
�i���j�ɐ������ɂ�����d�Ԃ̋������A10-8 cm �ł���Ƃ���Ȃ�A�d�ׂƋ����̐ς́A�c
�d�Ԃ̋����́A���̂Q�̌��q�̊Ԃ̌������ł�������A�z�C�I���A�A�C�I���̔��a�̘a�������肵�܂�����A�������܂��Ă�����̂ł͂���܂���B
10-8 cm�i���Ȃ킿�A10-10 m�A�܂��́A100 pm�i�s�R���[�g���j�A�܂��́A1 ���i�I���O�X�g���[���j�j�̋����ɓd�q�P���̃v���X�d�ׂƃ}�C�i�X�d�ׂ�����đ��݂���Ƃ��A�o�Ɏq���[�����g�̑傫���� 4.80 D �ɂȂ�Ƃ����i���ȏ��Ɏ�����Ă���j�v�Z���ʂ��o���Ă����ƕ֗��ł��B�Y�f�Ȃǂ̌��q���܂ތ������� 1 �I���O�X�g���[���O��ł���ꍇ�������̂ŁA�ϑ����ꂽ�o�Ɏq���[�����g�̒l���A4.8 D �ɔ�ׂĂǂ̂��炢�̊������Ƃ������Ƃ��A�����d�ׂ̑傫�������߂�ꍇ����������ł��B
�i��j
�Y�f�A�t�b�f�̊e���q���i�����I�Ɂj���A���ɑѓd���Ă����Ԃ��l���āA���̓d�Ԃ̋����͌��������Ɠ������Ƃ����O��ōl����B
�u�t�b�f�����S�ɕ��ɑѓd���Ă���ꍇ�ɂ́v
C-F �������A���S�ɁA�C�I���̑� C+ �� F- �ɂȂ��Ă���ꍇ�ɂ�
Q �̒l�Ƃ��āA�d�q�P���̓d�ׁi�d�C�f�ʁj���g������A
�u���̑o�Ɏq���[�����g�́c�v
μ = Q �~ r �̎��ɁA
Q = 4.80 �~ 10-10 esu
r = 1.39 ���i= 1.39 �~ 10-10 m = 1.39 �~ 10-8 cm�j
�������āA�P�ʂ����Z����ƁA���ȏ��̎��̒ʂ�ŁA6.67 D �ɂȂ�B
���̌v�Z�ł��邪�A���ɂ悤�Ɍv�Z���Ă��悢�B
�d�q�P���̓d�ׁi�d�C�f�ʁj�� �P�𗣂ꂽ�ʒu�ɂ���Ƃ��A���̑o�Ɏq���[�����g�̑傫���́A4.80 D �ł������B���A�d�Ԃ̋����� 1.39 ���Ȃ̂ŁA�iμ = Q �~ r �̎����A�d�ׂ̑傫���������Ȃ�A�o�Ɏq���[�����g�͋����ɔ�Ⴗ�邩��A�j
4.80 �~ 1.39/1 = 6.67
�i�����́j�u�o�Ɏq���[�����g�̒l�� 1.60 D �ł��邱�Ƃ�p����ƁA�v
�d�Ԃ̋��� r ���Œ�ł���Ƃ���Ȃ�Aμ = Q �~ r �Ōv�Z�����ׂ� μ �̒l�� 6.67 D ��菬�����l�ɂȂ��Ă���̂́A�d�� Q ���A�d�q�P���̓d�ׂ�菬�����������߂ł���B
�]���āA���̕��ɂ̊��������߂邽�߂̌v�Z���́A
1.60 / 6.67 = 0.24
�����d�ׂ̑傫���́A�d�q�P���̓d�ׁi�d�C�f�ʁj�� 0.24 �{�ł���B
�i���܂�A���������������͂��Ȃ����A������菑���Ȃ�A�u C0.24+�| F0.24-�v�Ƃ����Ӗ��B�j
�i���W�j
�o�Ɏq���[�����g�ɂ��āA���ȏ���ǂ�ł��킩��ɂ����Ƃ�����������܂����B�ȉ��A�厖�ȂƂ�������������ljӏ������ɂ��Ă����܂��B
�E�o�Ɏq���[�����g�́A�����ɂ�茈��ł���ʂł��B
�E�o�Ɏq���[�����g μ �́Aμ = Q �~ r �̎��ŕ\�����Ƃ��ł��܂��BQ �͓d�ׂ̑傫���Ar �͓d�Ԃ̋����ł��B
�Er = 1 ���AQ ���d�q�Ɠ����d�ׁi�d�C�f�ʁj�̂Ƃ��Aμ = 4.8 D �ł��B
�]���āA���镨���i���q�j�̑o�Ɏq���[�����g μ �̒l���킩���Ă���Ƃ�
�E�d�ׂ̑傫�� Q ���킩��A�d�Ԃ̋��� r ���v�Z���邱�Ƃ��ł��܂��B
�E�d�Ԃ̋��� r ���킩��A�d�ׂ̑傫�� Q ���v�Z���邱�Ƃ��ł��܂��B
���ۂɂ́A�d�Ԃ̋��� r �́A���q�̍\���i���������Ȃǁj�Ɗ֘A�t����ꍇ�������ł��B�d�ׂ̑傫���́A�d�q�P�P�ʂł͂Ȃ��i�d�C�f�ʂ̐����{�̒l�ł͂Ȃ��j�A���� 20 % ���Ƃ��A50 % ���Ƃ��̔��[�Ȓl�ɂȂ�ꍇ�������ł��B
���q�j�╪�q�̍��i�ɉ����čL�����Ă���d�q�́A�_�Ƃ��đ��݂���̂ł͂Ȃ��A����m�����z�ŁA�_�̂悤�ɔ�Ǎ݉����đ��݂��Ă��邽�߂ł��B
1.09
���ȏ��̗�́uH3C-OH�v�ł́A���ڂ��Ă��錋���́uC-O�v�ł���B�]���āA�����ł́A�ߎ��I�ł͂��邪�A�uH3C�v�ƁuOH�v�̊Ԃ̌����Ƃ��čl�����ɁA�P�ɈقȂ�d�C�A���x�����ӂ��̌��q�uC-O�v�Ƃ��čl���Ă悢�B
�i��j
�ɐ��̌������������@�Ƃ��āA�����������@�����邪�A�����ł́Aδ+�Aδ- �̋L����p���ď������Ƃ��w������Ă���B
�����̗��[�ɂ��錴�q�Q�ɂ��čl���A�d�C�A���x�̏��������f�� δ+ ���A�d�C�A���x�̂��傫�����f�� δ- ��t������悢�B
���̖₢�ł́A�d�C�A���x�̑召�̑��ΓI�ȊW������Ă���B�\ 1.3 �ɖ߂��ċ�̓I�Ȑ��l���m�F���Ȃ��Ă��A���̖₢�ɋ�����ꂽ�g�̌��f�ł́A�d�C�A���x�̑召�W�����f�ł��Ȃ��Ă͂Ȃ�Ȃ��B
a) HOδ--Hδ+
b) Fδ--Brδ+
c) H3Cδ+-Nδ-H2
d) H3Cδ+-Clδ-
e) HOδ--Brδ+
f) H3Cδ--Mgδ+Br
g) Iδ+-Clδ-
h) H2Nδ+-Oδ-H
���悻�AF > O > N �` Cl > C > H �̏��B
b), g) �́A�����\�̏c�̈ʒu�W�ŗ������邱�ƁB
�i���W�j
���̖₢�ł́A���W�i������\���_�v�ŁA���ڂ��錋���������Ă��邪�A���q�S�̂Ƃ��Ă̕��ɂ̕����i�ɐ��̌����j���l���Ȃ��Ă͂����Ȃ��ꍇ�́A
�P�j�Ód�|�e���V�����}�b�v�̂悤�ɁA�ʂ̕��@�ŋ��߂����q���̓d�q���x�̃}�b�v���Q�l�ɂ��邩�A�܂��́A
�Q�j�����Ƌߎ��I�ȕ��@�ɂȂ邪�A���q���ɑ��݂��邷�ׂĂ̌����ɑ��āA�d�C�A���x�̍���蕪�ɂ̕�������Ƃ��ď����A���������ׂăx�N�g���Ƃ��đ������킹�Ă��A
�Ȃǂ��Ȃ���Ȃ�Ȃ��B
�Ȃ��Af) �̂悤�ɁA�������A���L����̒Y�f�ƌ��������L�@�������́A�u�L�@�����������v�ƌĂ��B���̒��ł��AR-MgBr �̍\�����������́A�O���j�����iGrignard�j����Ƃ��Ēm���Ă���B
1.10
���̖₢�ŊY������Ód�|�e���V�����}�́A���ȏ��� p15 �ł���B
���Ɏ����ꂽ LiH �ł́A���̐������� Li ��\���B���̂Ő��ɑѓd���Ă��邱�Ƃ��킩��BLiδ+ �Ə����Ă��悢�B�E�̐Ԃ��������AHδ-�ł���B
�E�Ɏ����ꂽ HF �ł́A���̐������� Hδ+�ł���B�܂��A�E�̐Ԃ������� Fδ-�ł���B
�i��j
a) �ɐ������������́A�Ód�|�e���V�����}�ɂ����āA���̕����i�j�ƁA���̕����i�ԁj�������Ă���B�]���āALiH �� HF �ł���B
b) ���q�̑傫���́A���q�j�̎��͂̓d�q�_�̑傫���Ō��܂�i���ȏ� p4 �` p5 �Q�Ɓj�B���̂��߁AHδ+ �� Hδ- �ł́A�����͂̓d�q������ Hδ- �̕����傫���Ȃ�X���ɂ���B
LiH �ł́A�Ԃ����������f�ł���BHδ- �ɑѓd���Ă���̂ŁA�����̐��f���q�iH-H �ɂ����鐅�f���q�j���傫���Ȃ��Ă���BHF �ł́A�����������f�ł���BHδ+ �ɑѓd���Ă���̂ŁA�����̐��f���q��菬�����Ȃ��Ă���B
c) �F���画�f�ł���B���f�̈ʒu�������Ƃ����Ȃ��Ă���̂ŁAHF �ł���B
�Ód�|�e���V�����}�ɂ����āA�ǂ̈ʒu�ɂǂ̌��f������̂���������Ă��Ȃ��ꍇ�A���f�̓d�C�A���x�̑召����A���ɂ̕�����\�ߗ\�����Ă���Ód�|�e���V�����}������K�v������B
1.11-1.20
1.11
�`���d�ׂɂ��ẮA
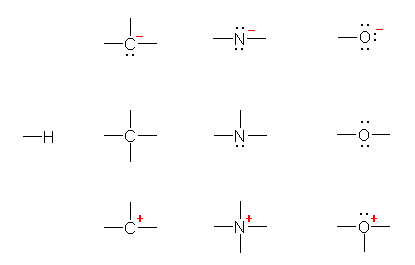
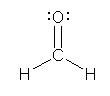
�Ӗ��FLewis�\���i�_�d�q�\���j���������Ƃ��ɁA���錴�q�ɋA������鉿�d�q�̐��ƁA���̒����̌��q�����Ƃ��Ƃ��ׂ����d�q�̐��̍��ɑ�������d�ׂł���B
���ߕ��F���ȏ� p 17 �̎��ɂ�苁�߂邱�Ƃ��\�ł���B
�������A���̎��̌`���ۈËL���悤�Ƃ��Ȃ����ƁB�`���d�ׂ̈Ӗ��������ł���A���̎����ǂ̂悤�ɗU������邩�킩��͂��ł���B�i�t�ɁA���̎��ɂ킴�킴���Ă͂߂Ȃ��Ă��������`���d�ׂ����߂邱�Ƃ��\�ł���͂��B�j
�i��j
a) ���_�����C�I�� HO- �̓d�q�\���������Ǝ��}�̂悤�ɂȂ�B
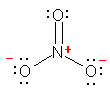
�_�f�́A���f�Ƃ̋��L�����łЂƂA���͂̂R�̌Ǘ��d�q�łU�A���v�V�̉��d�q�������Ă���B����A�_�f���q�́A���d�q���U�Œ����ƂȂ邩��AHO-�ɂ����ẮA�_�f���q�̉��d�q���ЂƂ����A�_�f���q���`���d�ׁu-1�v�������Ă���B
b) ���_�����C�I���̐Ód�|�e���V�����}�i���ȏ� p17) ���m�F����ƁA���f�͉��A�_�f�͐ԂƂȂ��Ă��āA�_�f���̕������A���ƂȂ��Ă��邱�Ƃ��킩��B���q�S�̂Łu-1�v���̃C�I���ł��邽�߁A���q���ł͑��ΓI�ɐ��ɕ��ɂ��Ă�����̂̐��f��ɐF�͌�������Ȃ��B
c) �I�L�\�j�E���C�I�� H3O+ �̓d�q�\���������Ǝ��}�̂悤�ɂȂ�B
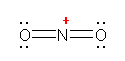
�_�f�́A���f�Ƃ̋��L�����łR�A���͂̌Ǘ��d�q�łQ�A���v�T�̉��d�q�������Ă���B�_�f���q�́A���d�q���T�Œ����ƂȂ邱�Ƃ���A�I�L�\�j�E���C�I���ɂ����ẮA�_�f���q�̉��d�q���ЂƂ��Ȃ��A�_�f���q���`���d�ׁu+1�v�������Ă���B
d) �Ód�|�e���V�����}���݂�ƁA���q�S�̂Łu+1�v�̓d�ׂ����C�I���ł��邱�Ƃ���A�S�̓I�ɐ������邪�A���̒��ł����ΓI�ɐF�̔���������T���ƁA�_�f��ł����������Ƃ��킩��B����́A�C�I���S�̂Ƃ���Ɓi���̓d�ׂ������j�d�q���s�����Ă���Ȃ���A�d�C�A���x�̍����_�f���ɓd�ׂ����Ă��邱�Ƃ������B
�����Ő������Ă����ׂ����Ƃ́A���̓_�ł���B
�܂��A�C�I�������d�ׂ́A�\�ʓd�ׂ̐�Βl�Ƃ��Č����B�]���āA�����̐��ɂ�����_�f���A�I�L�\�j�E���C�I���̎_�f�̕����A���z���i�Ód�|�e���V�����}�b�v�ŐF�j�ɂȂ��Ă���B���������āA�I�L�\�j�E���C�I���i�̎_�f���q�j���A���d�ׂ����C�I���Ƃ��Ă͂��炭���Ƃ����蓾�邱�Ƃ���������B
�������Ȃ���A���q���̕����́A���q���ł̑��ΓI�ȓd�C�A���x�̑召�Ō��܂��Ă���B���Ȃ킿�A�u�_�f���q���A+1 �̌`���d�ׂ�������Ƃ����āA�I�L�\�j�E���C�I�����\������ق��̌��q�i���f�j�������ɕ��ɂ��Ă���킯�ł͂Ȃ��B�v�`���d�ׂ́A���q�S�̂̓d�ׂ��P�N���\�����̋K���ɏ]���č\���������ہA�ǂ̌��q�ɓd�ׂ���肠�Ă邩���u�`���I�Ɂv���߂邾���ł��邱�Ƃ������B
�������A�Ǘ��d�q�͉��d�q�Q�Ƃ��Đ�����̂ɑ��A���L�����͉��d�q�P�Ƃ��Đ�����̂ł��邩��A��̂悤�ɂP����d�q�\�������������Ȃ��Ă��A���}�̂悤�ɒ����̐����q����A�I�L�\�j�E���C�I���␅�_�����C�I���������邱�Ƃ��l���Ă��A�`���d�ׂ��ǂ��ɕ`�����ׂ����͔��f�ł��邾�낤�B
�}�ŁA�� H �́A���f���q�i�v���g���j�i�܂��́A���f�C�I���AH+�j ��\���B
�i���W�j
���錴�q�����Ƃ��ƍŊO�k�ɂ��d�q�̐��i���d�q���A��P���̏ꍇ�͂P�A��Q���̏ꍇ�͂Q�A��R���̏ꍇ�͂R�c�j���A�����̐���Ǘ��d�q�̐������߂��B���Ƃ��A�_�f�́A���d�q�����U�ŁA�Q�{�̌����ƂQ�̌Ǘ��d�q���������B
�Ƃ��낪�A�I�L�\�j�E���C�I�� H3O+ �̎_�f�̂悤�ɁA�A�����j�A���f�Ɠ����悤�ɂR�{�̌����ƂP�̌Ǘ��d�q�������߂ɂ́A�_�f�̉��d�q�̐����A���f�Ɠ����T�ł���K�v������B���Ȃ킿�A�����̎_�f���q����d�q���ЂƂD�����Ƃł��̓d�q��Ԃ�B���ł���B���̂Ƃ��A�_�f�́u�`���d�ׂ́{�P�ł���B�v
���Ȃ킿�A�����̖{���ƌǗ��d�q�̐��̃p�^�[����������A�`���d�ׂ����o�����Ƃ��\�ł���B
���ۂ� H3O+ �Ƃ����C�I���̏ꍇ�A���̎_�f�����ł͂Ȃ����������R�̐��f�̏�ɂ������I�ɐ��d�ׂ��L�����Ă���̂ł��邪�A�`���d�ׂ��l����ꍇ�́A�u���f�̌`���d�ׂ̓[���ŁA�_�f�̌`���d�ׂ��{�P�ł���v�Ɛ�����B�܂�A�`���d�ׂƂ́A���q�̍��i�̒��ɂ���d�q���A���Ȃ炸�����ꂩ�̌��q�ɋA�������Ă��܂��l�����ŁALewis �\���i�_�d�q�\���j�ɑΉ��������̂ƂȂ�B
1.12
1.11�̃q���g�┭�W�̍����Q�l�ɂ��Ă��������B
a) �_�f���q���A�R�{�̋��L�����ƂP�̓d�q�������Ă���B����́A�d�C�I�ɒ����Ȓ��f���q�Ɠ����d�q�z�u�ł��邱�Ƃ������B
b) �Y�f���q���A�R�{�̋��L�����ƂP�̓d�q�������Ă���B����́A�d�C�I�ɒ����Ȓ��f���q�Ɠ����d�q�z�u�ł��邱�Ƃ������B
c) ���f���q���A�S�{�̋��L�����������Ă���B����́A�d�C�I�ɒ����ȒY�f���q�Ɠ����d�q�z�u�ł��邱�Ƃ������B
d) ���f���q���A�S�{�̋��L�����������Ă���B����ɁA�z�E�f���q���S�{�̋��L�����������Ă���B����́A���f�A�z�E�f�Ƃ��ɁA�d�C�I�ɒ����ȒY�f���q�Ɠ����d�q�z�u�ł��邱�Ƃ������B
�i��j
a) �_�f���q���A�R�{�̋��L�����ƂP�̓d�q�������Ă���A�`���d�ׁu+1�v�����B
b) �Y�f���q���A�R�{�̋��L�����ƂP�̓d�q�������Ă���A�`���d�ׁu-1�v�����B
c) ���f���q���A�S�{�̋��L�����������Ă���A�`���d�ׁu+1�v�����B
d) ���f���q���A�S�{�̋��L�����������Ă���A�`���d�ׁu+1�v�����B����ɁA�z�E�f���q���S�{�̋��L�����������Ă���A�`���d�ׁu-1�v�����B
b) �ŁA�Y�f���R�{�̌����������Ă��Ă��A�Ǘ��d�q���Ȃ��ꍇ�ɂ́A�d�C�I�ɒ����ȃz�E�f���q�Ɠ����d�q�z�u�ł���A�`���d�ׂ́u+1�v�ł��邱�Ƃɒ��ӂ���ׂ��B
1.13
a),b) �́A���ȏ��̉���Q�l�ɂ��ĉ����B
�Ȃ��Ac) �ȉ������l�ɍl���ĉ������Ƃ��ł��邪�A���Ƃ��A
c)�Ad) �ł́A�G�^�� C2H6 �̍\�����Q�l�ɂ���Ƃ悢�B
e) �́A���^���A�~�� CH3NH2 �̍\�����Q�l�ɂ���Ƃ悢�B
f) �́ANa+��OH- �ɕ����čl���Ă��悢���A�� H2O �̍\�����Q�l�ɂł���B
g) ����́A�Y�_ H2CO3 �̋�������iH+ ���͂��ꂽ���́j�ł���B
�܂��A���q�S�̂Ƃ��ā|�P�̓d�ׂ����̂ŁA�d�C�A���x�̍����_�f�ɂ��̕��̌`���d�ׂ����蓖�Ă�Ƃ���Ȃ�A
�d�C�I�ɒ����Ȑ��f���P�{���������������Ȃ����ƁA
�d�C�I�ɒ����ȒY�f���S�{�̌����������ƁA
�d�C�I�ɒ����Ȏ_�f���i�Q�̌Ǘ��d�q�Ɓj�Q�{�̌����������ƁA
�������A�`���d�ׂ��|�P�ł���_�f�́A�n���Q���Ɠ����d�q�z�u�ɂȂ�̂ŁA�i�R�̌Ǘ��d�q�Ɓj�P�{�̌����������ƁA
�Ȃǂ̏����A�\���������グ�邱�Ƃ��ł���͂��ł���B
h) ���q�Ƃ��Ē����ł��邩��A�܂��͑S���̌��q�������Ō`���d�ׂ������Ȃ����̂Ƃ��Č����̖{�������߂邱�Ƃ��ł���B
�i��j
�q���g�ɂ��������A���ꂼ��̌��f�̌����̐��ƌǗ��d�q�̐��ɒ��ӂ��đg�ݗ��Ă�B�p���邱�Ƃ��ł���p�[�c�����}�ɋ����Ă����B
�������A�Q�{�ȏ�̌����͒P�����Q�{�ł�������A��d�����P�{�ł�������Ƃ������ύX�͋��������̂Ƃ���B
������p���A�e���f��̌`���d�ׂ̘a�����q��C�I���S�̂̉����ƈ�v����悤�ɕ`�����_�d�q�\���iLewis �\���j���ȉ��Ɏ����B
a)
b)
c)
d)
e)
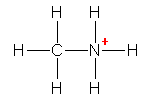
f)
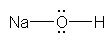
�������A�i�g���E���Ǝ_�f�́A�d�C�A���x�̍������ɑ傫�����߁A���L�����Ƃ������A�قڊ��S�ȃC�I�������ł���Ɖ��߂��邱�Ƃ��ł���B��������Ǝ��}�ɂȂ�B
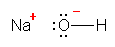
g)
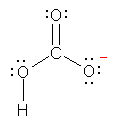
h)
�i���W�j
d) �ł́A C+ �����\���i�J���{�J�`�I���j��`������Ȃ��B�J���{�J�`�I���� C+ �́A���d�q���R�����Ȃ����߁A�ǂ����Ă��I�N�e�b�g�������Ƃ͂ł��Ȃ��B����́A�ꕔ�̃z�E�f�̉������iBH3�j��A�ꕔ�̃A���~�̉������iAlH3�j�ȂǂƓ����ł���B
�Ȃ��A�J���{�J�`�I���́A�I�N�e�b�g�����Ă��Ȃ����߁A�Ǘ��d�q���������i���Ƃ��A���̎_�f�A�������C�I���A�A�~���̒��f�A�c�j�Ƃ����ɔ������Ă��܂��X��������B����������������̂ŁA������Ȃǂ̐g�̉��̗l�X�ȕ����Ƃ͈قȂ�A����ȏ������łȂ��ƒ����Ԉ���ɑ��݂ł��Ȃ��ƍl���Ă��悢���낤�B
�������Ȃ���A����A���낢��ȗL�@���w�����ɂ��Ċw�K���钆�ŁA�����̓r���Ɂi�ߓn�I�Ɂj�o�R����\���Ƃ��ăJ���{�J�`�I�����l����ꍇ���łĂ��邱�Ƃ�����A�ʒu�Â��Ƃ��ďd�v�ł���B
1.14
a)�Ab) �Ƃ��ɕ��q��������ƁA�s�O�a�x���O�ł��邱�Ƃ��킩��B�_�f���܂݁A��d�����������Ȃ����\�Ƃ��ẮA�G�[�e�������i�G�[�e���j�Ɛ��_��i�A���R�[���j�Ƃ��l�����邾�낤�B
�i��j
a) C,C,O �̂R�̌��q�̕��т��l����ƁA�i���q���R�����Ȃ����߁A�}��������l���邱�Ƃ͂ł��Ȃ��̂Łj�_�f���[�ɂ��邩�����ɂ��邩�̂Q�ʂ肪�l������B
�܂��́Apropane CH3CH2CH3 �ɂ��āA�P���܂��͂Q���̒Y�f���_�f�ɒu�����ē�����\�����l���Ă��悢�B
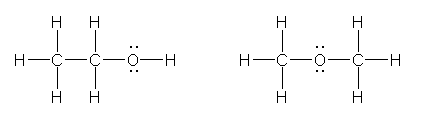
ethanol (ethyl alcohol), methoxymethane (dimethyl ether)
b) C,C,C,O �̂S�̌��q�̕��т��l����B�}�����ꂪ�Ȃ��ꍇ�́A�_�f���[�ɂ��邩�����ɂ��邩�̂Q�ʂ肪�l������B�}�����ꂪ����ꍇ�A�_�f�͌������Q�{���������Ȃ��̂ŁA�}������̈ʒu�ɂ͎_�f�����Ȃ����Ƃ��l����ƂP�ʂ肵�������Ȃ��B
�܂��́AC4H10 �̍��i�ِ��� butane �� 2-methylpropane �ɂ��āA�P���܂��͂Q���̒Y�f���_�f�ɒu�����ē�����\�����l���Ă��悢�B
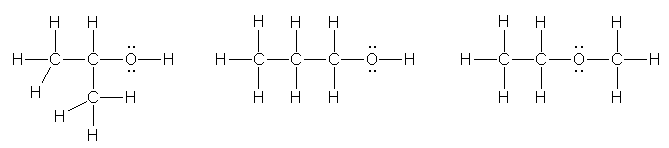
propan-2-ol (isopropyl alcohol), propan-1-ol (propyl alcohol), methoxyethane (ethyl methyl ether)
�� �����́A�u�������@�̂��ƂɁA�J�b�R�̒��Ɋ�\�����@�������������̂��������B
1.15
�����\�̈ʒu�W����A�e���f�̉��d�q�����킩��B��ʓI�ɌǗ��d�q�����̂́A���d�q�����T�̒��f���i�P�j�A�U�̎_�f���i�Q�j�A�V�̃n���Q���i�R�j�ł��邩��A�����̌��f��T���Ƃ悢�B
�������A���̖₢�ł͊Y�����Ȃ����A�J���o�j�I�� C�| �́A�i���d�q�����T�ŁA���f�Ɠ������d�q�z�u�������A�j�R�{�̋��L�����̑��ɌǗ��d�q�����B
�܂��A�����̊w�K�̒��ŁA�Y�f���Q�{�̌����ƂP�̌Ǘ��d�q�������q��i H�|C(:)�|H ���ŏ��P�ʂƂ��Ă��悤�ȍ\���A�J���x���Ƃ����j���łĂ���B�������A����͒Y�f��̌����̐����Q�{�ł��邩��A�\�������炷���ɔ��ʂ����B
�i��j
a) �`���d�ׂ������Ȃ����f�́A���d�q���T�Ȃ̂ŁA�R�{�̌����ƂP�̌Ǘ��d�q�����B
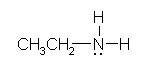
ethanamine (ethyl amine)
b) �`���d�ׂ������Ȃ����f�́A���d�q���T�Ȃ̂ŁA�R�{�̌����ƂP�̌Ǘ��d�q�����B
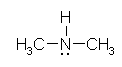
N-methylmethanamine (dimethyl amine)
c) �`���d�ׂ������Ȃ��_�f�́A���d�q���U�Ȃ̂ŁA�Q�{�̌����ƂQ�̌Ǘ��d�q�����B
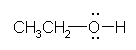
ethanol (ethyl alcohol)
d) �`���d�ׂ������Ȃ��_�f�́A���d�q���U�Ȃ̂ŁA�Q�{�̌����ƂQ�̌Ǘ��d�q�����B
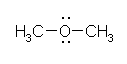
methoxymethane (dimethyl ether)
e) �`���d�ׂ������Ȃ����f�́A���d�q���V�Ȃ̂ŁA�P�{�̌����ƂR�̌Ǘ��d�q�����B
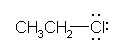
chloroethane (ethyl chloride)
f) �`���d�ׂ������Ȃ��_�f�́A���d�q���U�Ȃ̂ŁA�Q�{�̌����ƂQ�̌Ǘ��d�q�����B�܂��A�`���d�ׂ������Ȃ����f�́A���d�q���T�Ȃ̂ŁA�R�{�̌����ƂP�̌Ǘ��d�q�����B
(hydroxylamine)
�� �����́A�u�������@�̂��ƂɁA�J�b�R�̒��Ɋ�\�����@�������������̂��������B
�i���W�j
f) �� hydroxylamine �q�h���L�V���A�~���́A�u�A�����j�A�v��u���v�Ɠ��l�A���@���̕��ނł��B�܂��A���̖��̂́A�u���_��{�A�~���v�Ƃ��đg�ݗ��Ă�ꂽ���̂ł͂Ȃ��A�u�q�h���L�V���A�~���v���ЂƂ̊������ꂽ���p���ł��B�i���̂��߁A���_��ɑ�������i���݂̃��[���Łj�������u�q�h���L�V�v�ł͂Ȃ��A�Â��������ɑ�������u�q�h���L�V���v���g���Ă��܂��B�j�Ȃ��ANH3 ���Ȃ��A�����j�A�Ƃ����̂��Y�܂Ȃ��̂Ɠ����悤�ɁAH2NOH �́A�l���̗]�n�Ȃ��u�q�h���L�V���A�~���v�ł���Ƃ��������l�̂Ȃ��Ƃ���ł��B�l�b�g��ȂǂŁu�q�h���L�V�A�~���v�Ə�����Ă���ꍇ������܂����i���̗������Ă������j����́A���ł��B
1.16
�ȗ��\�����́A�}������̂���\�����A�Ȃ�ׂ��P�s���Ɂi�^�C�v���C�^�[�Ń^�C�v�ł���悤�Ȍ`�Łj�������̂ł���B���ȏ� p22 �̕\ 1.5 �̑Ή��\���悭�݂Ă����Ƃ悢�B���ɁA�P�N���\�����ɂ����Ď卽�̏㉺�����ɐL���悤�ȑ����̕�����A�J�b�R��p���ĂP�s���ɏ����Ă������@�Ȃ̂ŁA�J�b�R�̎g�����Ɋ����悤�ɂ��悤�B
�� ���Ȃ炸�����A���ׂĂ��P�s���ɏ����Ȃ��Ɗȗ��\�����ł���Ƃ����Ȃ��킯�ł͂Ȃ��B
�� �ȗ��\�����́A�̍\������������A���q�̗��̍\�����������肷��͓̂��ӂł͂Ȃ��B
�i��j
���ȏ�p22 �̕\ 1.5 �ł́A�ȗ��\���̗�Ƃ��āA�}������̕����ɉ��W��p���A�卽���L���Ă���s�̏㉺�ɑ�������������ł�����̂����邪�A�����ł́A�P�s�ɂ��ׂď������̂𐳉��Ƃ��Ď����B
a) CH3CH2CH2Cl
����ɁA�����J��Ԃ��P�� -CH2- ���J�b�R�ł�����A���̂悤�ɏ������Ƃ��\�B
CH3(CH2)2Cl
�}�̉E���i���f���j���珑���n�߂āA���̂悤�ɂ��Ă��B
ClCH2CH2CH3
b) ���q���ɃG�X�e�������������Ă���B���̕�����^�ʖڂɏ�����
CH3C(=O)OCH2CH3
�ƂȂ�B����́A�J�b�R���� (=O) �̍\�����A������Q�Ԗڂ̒Y�f���猋�����Ă���A����ɁA�����Y�f�i������Q�Ԗڂ̒Y�f�j�ɁA�J�b�R�ɑ����Ď�����Ă��� -OCH2CH3 ���������Ă��邱�Ƃ������B
�������A�G�X�e�������́A���̂�����̕��@�ŏ������Ƃ��\�B
CH3CO2CH2CH3
CH3COOCH2CH3
�܂��A�������q�ɂ��āA�}�̉E���i�G�`���G�X�e�����j����ȗ��\���������ƁA���̂悤�ɂ�������B
CH3CH2OC(=O)CH3
�܂��́ACH3CH2OCOCH3
�G�X�e���������A���̍��E�����ւ��邱�Ƃ��ł��Ȃ���Ώ̂ȍ\���ł��邩��A���̂悤�ɏ����Ă͂����Ȃ��B
�~ CH3CH2CO2CH3
�~ CH3CH2COOCH3
�i�����̏������ł́A�|�_�G�`���̑���ɁA�v���p���_���`���̍\����\���Ă��܂��B�j
c) CH3CH2C(=O)N(CH3)CH2CH3
�}�̉E���iN��̃G�`����j���珑���n�߂�ƁA
CH3CH2N(CH3)C(=O)CH2CH3
d) CH3CH2CN
�}�̉E���i�V�A�m��j���珑���n�߂�ꍇ�́A
NCCH2CH3
�Ƃ���B
R-C��N �i�j�g�����j�́A�i������ł��邪�A���ِ̈��̂Ƃ��� R-N+��C:- �i�C�\�j�g�����j�̍\��������̂ŁA�j�uCN�v���ЂƂɂ܂Ƃ߂� CN-CH2CH3 �Ə������Ƃ��ł��Ȃ��B
�� ���ȏ��ł͗Ꭶ���Ȃ����A�����̃A���L������ȗ����āA���`����ł���� -Me�A�G�`����ł���� -Et �Ƃ������\�L�A�܂��� -C2H5�A�܂��A�v���s����ł���� -Pr�A�܂��� -n-C3H7 �ƂȂ�ꍇ������B�����łȂ��Ƃ��A���p����������A���L����̏ꍇ�́A���̊��p���ɉ�����������p���邱�Ƃ��\�ł���B
�������́A���̒ʂ�B
a) 1-chloropropane (propyl chloride)
b) ethyl ethanoate
�G�^���_�iethanoic acid�j�̊��p���ł���u�|�_�iacetic acid�j�v��p����ꍇ�́A
ethyl acetate
�H�ɁA��\�����@��p���āAethanoic acid ethyl ester �i�܂��́Aacetic acid ethyl ester�j�Ƃ���ꍇ������B
c) N-ethyl-N-methylpropanamide
d) propanenitrile
1.17
1.15 �̃q���g���Q�l�ɂ��Ă��������B
�i��j
a) 1-chloropropane �̉��f�B
b) ethyl acetate ����� N-ethyl-N-methylpropanamide �̂��ׂĂ̎_�f���q�i�R�ӏ��j
c) N-ethyl-N-methylpropanamide ����� propanenitrile �̂��ׂĂ̒��f���q�i�Q�ӏ��j
d) ���ׂĂ̐��f�A����ђY�f���q
1.18
���ȏ� p22 �̕\ 1.5 �̑Ή��\���悭�݂Ă��������B
�i��j
���i�\�����̃��[���ɑ������������Ŏ����Ă����B�Y�f�̈ʒu�Ɂi��Q���ł���j-CH2- �ȂǂƏ������ނ̂́A�B�������A�Y�f�̌��f�L���uC�v����������ł����āA���̒Y�f��Ɍ����������f���ȗ�����͕̂s�B�i���Ƃ��Α�Q���̒Y�f�̈ʒu�� -C- �Ƃ̂ݏ����͕̂s�Ba) �̗�Ō����Ȃ�AC-NH-C-C-C �ł̓_���A�Ƃ������Ƃł��B�����܂ŏ�������A���r���[�ɂ����AKekulé �\���Ƃ��āA��̏ȗ��������ɏ����Ă��������B�j
�� ��蕶�̎w���ɂ��A�Ǘ��d�q�́A�S�Ď����Ȃ�������Ȃ��B
�� Kekulé �\���ɏ]���AC-H �����܂ŏȗ������A���ׂď����̂��{���̖��̈Ӑ}��������Ȃ��ł��ˁB
a)
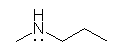
N-methylpropanamine (methyl propyl amine)
b)
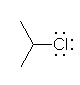
2-chloropropane (isopropyl chloride)
c)
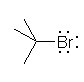
2-bromo-2-methylpropane (tert-butyl bromide)
d)
2,2,6-trimethylheptane
�� a) �` c) �̖����̃J�b�R�̒��́A��\�����@�ɏ]�������̂ł��B
1.19
He2+ �Ƃ������q�C�I���ɂ��ẮA
�E�w���E�����q�����f���q�Ɠ��l�A1s �O�����g���ĕ��q�O��������Ă������ƁB
�E���ȏ� p28�̐}1.4�̂悤�ɍ�}���ꂽ MO�_�C�A�O�����ɂ����āAσ �� σ* ���ł���Ƃ���܂ł́AH2 ���q�Ɠ��l�ł��邱�ƁB
�EH2 ���q�ł́A�����̕��q�O���iMO�j�ɁA���v�Q�̓d�q�������Ă������̂ɑ��AHe2+ �Ƃ������q�C�I���ł́A���v�R�̓d�q�����邱�ƁB
���킩��B�������A���q�C�I�����o���o���̌��q�ɕ�����Ă��܂��ق�������Ȃ̂��A���q�C�I��������ق�������Ȃ̂���ސ�����B
���́i���W�j�ɁAHe2 ���q�ɂ��ďq�ׂĂ����̂ŁA������Q�l�ɂ��čl���邱�ƁB
�i��j
���A���W�̍��ɑ����AHe2+ �Ƃ������q�C�I���ɂ��čl����B����MO�_�C�A�O�����́A�w���E�����q�����q����邱�Ƃ̂ł��鋗���܂ŋ߂Â����Ƃ��A�Q�� 1s �O������ 1σ �� 1σ* �O��������Ƃ���܂ł͓����ł���B�������Ȃ���A���x�́A�S���łS�̓d�q�ł͂Ȃ��A�R�̓d�q�������Ă����Ԃ��l���邱�ƂɂȂ�B�]���āA���}�̂悤�ɂȂ�B
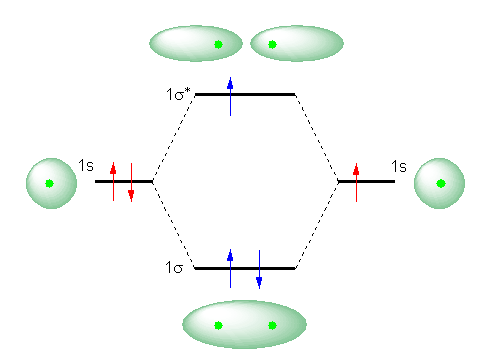
�����ŁA���̂Q�̌��q�ł���ꍇ�i�������A����͂Q�̓d�q�������A�d�C�I�ɒ����ȒP���q���q�A��������́AHe+ �Ƃ����z�C�I���ƂȂ�B���̂Ƃ��̓d�q�z�u��Ԃ̖��Ŏ����j�̃G�l���M�[�ƁA���q����鋗���Ɍ��q������A���q�O���������Ă���ꍇ�̓d�q�z�u�i���̓d�q�z�u�j�̃G�l���M�[�Ƃ��r����ƁA���q�C�I�������邱�Ƃɂ��i1σ�O���ɓ��邱�ƂŁj���艻�ł���d�q���Q����̂ɑ��A1σ* �ɓ����ĕs���艻����d�q�͂P�����Ȃ�����A�g�[�^���ł͈���ƂȂ邱�Ƃ����҂����B�i�������A���f���q H2 �Ő����Ă���悤�ȓd�q�z�u�ɔ�ׂ�ƁA���艻�̑��a�͔����ł���Ƃ������ƂɂȂ邪�B�j
���̂��߁AHe2+ �Ƃ������q�C�I���́A����ɑ��݂��邱�Ƃ��ł���ƍl������B
�i���W�j
�d�C�I�ɒ����ȃw���E�����q�́A1s �ɂQ�̓d�q�����B���̂��߁A�܂��AHe2 �Ƃ����i�d�C�I�ɒ����́j�w���E���Q���q���q���l����ƁA����MO�_�C�A�O�����́A���̂悤�ɂȂ�B
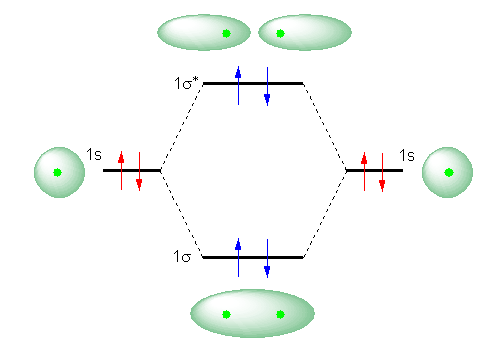
���̐}�ɂ����āA�Ԃ̖��Ŏ����ꂽ�S�̓d�q�́A���ꂼ��w���E�����q�� 1s �O���ɓ����Ă���B���Ȃ킿�A�Q�̂��̌��q�Ƃ��đ��݂��Ă���Ƃ��̓d�q�z�u��\���B
�܂��A���� 1s �O���́A�Q�̌��q���A���q�����邱�Ƃ̂ł���悤�ȋ����܂ŋ߂Â��ƁA���ݍ�p���āA1σ �� 1σ* �O��������B���̂悤�ɂ��Đ��������q�O���ɁA�v�S�̓d�q������Ă��ƁA��}�A�̖��Ŏ������悤�ȓd�q�z�u�ƂȂ�B�i���q�ɂ����āA�\�������ɏ]���A�Ⴂ�G�l���M�[�̌��q�O�����珇�ɂQ���d�q���z�u���ꂽ�B�����悤�ɁA���q�ɂ����Ă��A�Ⴂ�G�l���M�[�̕��q�O�����珇�ɂQ���d�q���z�u�����B�j
�����ŁA���̂Q�̌��q�ł���ꍇ�i�Ԗ��̓d�q�z�u�ł���ꍇ�j�̃G�l���M�[�ƁA���q����鋗���Ɍ��q������A���q�O���������Ă���ꍇ�̓d�q�z�u�i���̓d�q�z�u�j�̃G�l���M�[�Ƃ��r����ƁA1σ�O���ɓ��邱�Ƃň��艻�������̃G�l���M�[���A1σ* �ɓ����ĕs���艻���邱�Ƃɂ��A���S�ɑł�������Ă��܂��A�g�[�^���Ƃ��Đ����̓����S���Ȃ���Ԃł��邱�Ƃ��킩��B
���̂��߁AHe2 �Ƃ����Q���q���q�́A�P���q���q He ���Q����Ɣ�ׂāA���Ɉ��艻����Ȃ��B����ɂ��AHe2 �Ƃ����Q���q���q�͈���ɑ��݂ł��Ȃ��B
1.20
p �O���̐L�т���������̏d�Ȃ�́A�����̎��̎���ɁA�~���^�̑Ώ̐������悤�ȕ��q�O����^���邩��Aσ �O���i���������̏ꍇ�́Aσ* �O���j��^����B
p �O����������d�Ȃ�ꍇ�́A���q�̌������܂ޕ��ʂ��ߖʂƂȂ�A�ʂ̏㉺�Ŕg�����̕������t�]����悤�ȑΏ̐����q�O���Ƃ��āAπ �O���i���������̏ꍇ�́Aπ* �O���j��^����B
���ȏ� p 29�A�}1.5�A�}1.6 ���Q�Ƃ��邱�ƁB
�i��j
a) p �O����������d�Ȃ�Aπ �O���ƂȂ��Ă����B�ׂ荇���Q�� p �O�����A�ʑ����t�i�g�����̕����ɑΉ������Ɨ��̐F�ƂȂ��Ă���j�̊W�ł���A���������̋O����^����B�]���āAπ*
b) p �O���̐L�т��������� s �O���Əd�Ȃ��Ă���B���̋O���̏d�Ȃ�́A�Q�̌��q�j�����Ԑ��̉��ɉ~���^�̑Ώ̐������̂ŁAσ �O���ƂȂ�B�Q�̋O���̈ʑ��̊W�́A�Q�̌��q�j�̊Ԃɐߖʁi�g�����Ő�Βl���O�ƂȂ�悤�ȂƂ���A�O���̖͎��}�ɂ����ẮA�F����ΐF�ɐ�ւ�鋫�E�ƂȂ�ʁj���ł��Ă��܂��W�ł��邱�Ƃ���A���������̋O����^����B�]���āAσ*
c) �Q�� p �O�����A�O�������т���������d�Ȃ��Ă���B���̋O���̏d�Ȃ�́A�Q�̌��q�j�����Ԑ��̉��ɉ~���^�̑Ώ̐������̂ŁAσ �O���ƂȂ�B�Q�̋O���́A�قȂ�F�ŏd�Ȃ��Ă������Ƃ��Ă���A�Q�̌��q�j�̊Ԃɐߖʁi�g�����Ő�Βl���O�ƂȂ�悤�ȂƂ���A�O���̖͎��}�ɂ����ẮA�F����ΐF�ɐ�ւ�鋫�E�ƂȂ�ʁj���ł��Ă��܂��W�ł��邱�Ƃ���A���������̋O����^����B�]���āAσ*
d) p �O���̐L�т��������� s �O���Əd�Ȃ��Ă���B���̋O���̏d�Ȃ�́A�Q�̌��q�j�����Ԑ��̉��ɉ~���^�̑Ώ̐������̂ŁAσ �O���ƂȂ�B�Q�̋O���̈ʑ��̊W�́A�Q�̌��q�j�̊Ԃɂ͐ߖʁi�g�����Ő�Βl���O�ƂȂ�悤�ȂƂ���A�O���̖͎��}�ɂ����ẮA�F����ΐF�ɐ�ւ�鋫�E�ƂȂ�ʁj�������Ȃ��W�ł��邱�Ƃ���A�������̋O����^����B�]���āAσ
1.21-1.30
1.21
1) �v���p���̍\�����AKekulé �\���ŏ����A�܂��A�u10�́v���L�������m�F���邱�ƁB
2) ���ȏ��Ap34 �}1.12 �Ɠ��l�̂��Ƃ��l����悢�B
�����܂łŏ\���ɉł���͂������A������Ă珑�������Ă����B
3) ���L�����̗��[�̌��q�����O���ɂ��čl����B���Ƃ��AH-H �Ƃ������q�ł́A���ꂼ��̐��f���q�� 1s �O���i���q�O���j���Aσ �O���i���q�O���j���`������B
4) �����ƌ����ɂ́A�Q�̌��q�O���i�Q�̐��f���q�ɗR������ 1s �O���� 1s �O���j����́A�Q�̕��q�O���i�������� σ �O�� �� ���������� σ* �O���j���ł���B����ɁA�������̕��q�O���i�������� σ �O���j�ɓd�q���Q����A���̌��q�̏�Ԃ�����ɂȂ�B���Ȃ킿�u������������v�B
5) �Y�f�Ɛ��f�A�Y�f�ƒY�f�̊Ԃ̌����ł��A��Ɠ��l�̂��Ƃɂ��A�������̕��q�O���������Ă���B�i����сA�������̕��q�O���Ɠ����ɁA���������̕��q�O���������Ă���B�j
6) ���̖₢�Őu����Ă���̂́A���ꂼ��̌��q�̂ǂ̋O�����A���L�����i�������̕��q�O���j���`�����Ă���̂��A�Ƃ������Ƃł���B
7) �u�������́v���q�O�����`�����Ă���Q�̌��q�O���ƁA�u���������́v���q�O�����`������Q�̌��q�O���́A��ʂ��čl����K�v�͂Ȃ��B�i�Ȃ��Ȃ�A�Q�����q�O�����u�������v�u���������v���Q�����q�O�����`�����邩��ł���B�j
�i��j
�R����Y�f���q�́A��������S�{�� σ �����������Ă���B�]���āAsp3 �����̏�Ԃł���B
�Q�{����Y�f�|�Y�f�����́A���ꂼ��̒Y�f���q�� sp3 - sp3 �̏d�Ȃ�ɂ���Č`�������B
�W�{����Y�f�|���f�����́A�Y�f���q�� sp3 �ƁA���f���q�� 1s �O���̏d�Ȃ�ɂ���Č`�������B
�i���W�j
VSEPR�i���q���k�d�q�����j���_
�i�uσ ������ �{ �Ǘ��d�q�̐��v�����q�̑Ώ̐������߂�j�́A�L�@���q�݂̂Ȃ炸�A���@�������Ȃǂ̍\����\������̂ɂ��p�����Ă���B�i�}�́A http://www.uwplatt.edu/~hamiltoj/chem114/ �����p�j
1.22
���ȏ��A���ɕ����Ď�����Ă������悭�Q�Ƃ��邱�ƁB
1, 3 �́A�A���f�q�h�̍\�������B
4 �́A�������ł̓V�A�������f�i�ʖ��A�_�j�ł���BH �� R�i�A���L����j�ɒu������ƁA�j�g�����̍\���ł���B
�i��j
1)
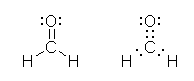
�����̒Y�f�́A�R�{�� σ �����i�Q�{�� C-H �����A�P�{�� C-O �����j�����B����ɁA�P�{�� π �����iC-O �����j�����B�]���āA�����Ɋւ��d�q�̐��́A�i σ �����ƌǗ��d�q�Ȃ̂Łj�R�ł���B����āA sp2 �����ŁA�����p�́A120�x�B
2)
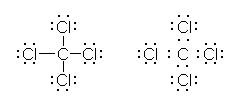
�����̒Y�f�́A�S�{�� σ �����������Asp3 �����ł���B�����p�͂��悻 110 �x�B
3)
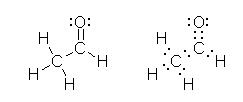
�z���~����i-CHO�j�̒Y�f�́A�R�{�� σ �����i C-H �����AC-C �����A����� C-O �����j�����B����ɁA�P�{�� π �����iC-O �����j�����B�]���āA�����Ɋւ��d�q�̐��́A�i σ �����ƌǗ��d�q�Ȃ̂Łj�R�ŁA sp2 �����ŁA�����p�́A120�x�B
���`����i-CH3�j�̒Y�f�́A�S�{�� σ �����������Asp3 �����ł���B�����p�͂��悻 110 �x�B
4)
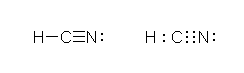
�V�A�m��i-C��N�j�̒Y�f�́A�Q�{�� σ �����i C-H �����AC-N �����j�ƁA�Q�{�� π �����iC-N �ԂɂQ�{�j�����B�Y�f���q�́Asp �����ŁA�����p�́A180�x�B
�i���W�j
Lewis �\���ɂ��āB
�_�f�A���f�A�n���Q���ȂǁA���q��̌Ǘ��d�q�L����K�v������B
���̋��ȏ��ł́A���L�����̂悤�ɁA���L�����́A���W�ŕ\���Ă��邪�A���ȏ��ɂ���ẮA���L�E���̂悤�ɁA���L���������ׂēd�q�̑Ƃ��ċL�����Ƃ�v�����Ă���ꍇ������B
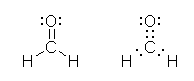
1.23
�����ł́A���� sp3 �ł��A���悻110�x�̌����p���A��⏬�����Ȃ��ɂ��Ĉ����Ă���B���ȏ��� ��1.11 ���n�ǂ��邱�ƁB
�݂��ɔ������������̂Ƃ��āAσ �����ƌǗ��d�q���ɍl����Ȃ�A�����Ȑ��l�ʑ̂̍\���ƂȂ�̂����A���ۂɂ́A�Ǘ��d�q�̕����A���Ƃ̔��������傫���B���̂��߁A�Ǘ��d�q�Γ��m�̍��p�x��A�Ǘ��d�q�� σ�����̊Ԃɍ��p�x�����L����Aσ�����Ԃ̌����p�������߂ɂȂ�X��������B
�i��j
�݂��ɔ������������̂�������B
H2O�F�Q�{�� σ �����ƂQ�g�̌Ǘ��d�q�B
H3O+�F�R�{�� σ �����ƂP�g�̌Ǘ��d�q�B
CH4�F�S�{�� σ ����
�Ǘ��d�q�̕����Aσ ���������������傫������A���� H-O-H �̌����p�́A���^���� H-C-H �̌����p��菬�����Ȃ�B
���l�ɁAH3O+ �� H-O-H �̌����p�́A���^���� H-C-H �̌����p��菬�����Ȃ邪�A�Ǘ��d�q���P�g�����Ȃ�����A���� H-O-H �̌����p���͑傫���Ȃ�Ɨ\�z�����B
�܂��AH3O+ �� H-O-H �̌����p�́A�����d�q�z�u�ł���A�����j�A NH3 �� H-N-H ��A���`���A�j�I�� CH3- �� H-C-H �Ƃقړ����l�ł���Ɨ\�z�����B
�i����j
���݂̗L�@���w�̊w�K�i�K�ɂ����ẮA�i������Ԃ��瓱����錋���p�Ƃ��āA�j180�x�A120�x�A���悻110�x�̊Ԃ̋�ʂ�������悢�B
��⍂�x�Ȋw�K�Ƃ��āA���̖₢�̂悤�Ɂu��ʘ_�Ƃ��āv�Ǘ��d�q�� σ ���������傫�Ȕ����������Ƃ�m���Ă���A���̂��Ƃ������p�ɂǂ̂悤�ȉe����^���邩�𗝉����Ă���ƁA�Ȃ��ǂ��B
�X�̉������ŁA�ǂ̂悤�Ȍ����p�����̂��A�Ƃ������A�i��ʘ_�ł͂Ȃ��A���镨���ɓ��������j���l���o����K�v���͒Ⴂ�B
1.24
���ȏ� p43 �̐}���m�F���邱�ƁB
�i��j
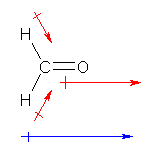
���̐Ód�|�e���V�����}�ł́A�d�q���x�̍����i���ɑѓd���Ă���j���q��ł͐ԂɁA�t�ɓd�q���x�̒Ⴂ�i���ɑѓd���Ă���j���q��ł͐ɁA���ꂼ�ꒅ�F����ĕ\������Ă���B
�}���݂�ƁA���f���q�̑��݂���ʒu�ōł��F���Z���Ȃ��Ă���B����́A���f�Ɛ��f�̓d�C�A���x�̈Ⴂ�f���Ă���A�i�S�̂Ƃ��ĂP���̕��d�ׂ�ттĂ��āA�d�q���x���S�̓I�ɒႢ�̂ł��邪�A���̒��ł��j�d�C�A���x�����ΓI�ɏ��������f������A�d�C�A���x�̑��ΓI�ɑ傫�����f���ɓd�q���������Ă��邱�Ƃ������B
�`���d�ׂ́A���f��Ɂu+1�v�����蓖�Ă�̂ł͂��邪�A���ۂɓd�q���x���������Ă���̂́A���̒��f�����ł͂Ȃ��A���q�S�̂ł���B�����āA�d�C�A���x�̑召�ɉ����ĕ��q���ł̕��ɂ������Ă���B���̂��߁A�ł��������d�q���x�����̂́i�`���d�� +1 �������f�ł͂Ȃ��A�d�C�A���x�̏��������q�ł���j���f���q�ł���B
1.25
�Ód�|�e���V�����}�b�v�̐F�̈Ⴂ�ɂ��A�e���q�̏�ł̓d�q���x�̕��m�邱�Ƃ��ł���B
�����ŁA�u�ɐ����傫���v�Ƃ́A���q�S�̂ł̓d�ׂ̕肪�傫�����Ƃ��w���Ă���A�P�{�P�{�̌����ɂ�����u�����̕��Ɂi�قȂ�d�C�A���x�̌��q�Ԃ̌����ɐ�������́j�v�Ƃ͈قȂ邱�Ƃɒ��ӂ���B
��G�c�ɂ́A���q�S�̂̓d�ׂ̕�́A�e�����ɐ����Ă��镪�ɂ��x�N�g���Ƃ��đ������킹�����̂ƍl���Ă悢�B���Ȃ킿�A���q�̒��̈ꕔ�ł͓d�ז��x�ɍ��������Ă��A�Ώ̐����悭�A���̕��ɂ��ł�������Ă��܂��ꍇ�ɂ́A���q�S�̂Ƃ��Ă͋ɐ��������Ȃ����ƂɂȂ�B
�i��j
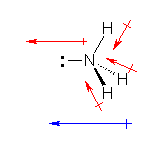
���^���A�A�����j�A�A���́A�Ƃ��ɒ��S�̌��q�i�Y�f�A���f�A�_�f�j���Asp3 �������Ƃ��Ă���A�Ǘ��d�q�� σ ���������l�ʑ̂ƂȂ�悤�ȍ\�������B
��}�ł́A�Ǘ��d�q���A�j���̑ȉ~�A����ѓ��F�̃^�}�ŕ\���Ă���B
���^���́A���S�̒Y�f���琳�l�ʑ̂̑Ώ̐��ŁA�S�{�� C-H ���������B
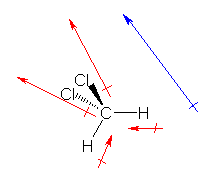
���ȏ� p13 �̓d�C�A���x�̐��l�iENH=2.1, ENC=2.5�j���A���f�����킸���� δ+ �ɂȂ�悤�ȕ��ɂ������߁A�Ód�|�e���V�����}�ɂ����āA���l�ʑ̂̒��_�ɑ�������Ƃ���ŁA�킸���ɓd�q���x���Ⴂ�i���ΐF����݂����銴���ɂȂ��Ă���j���Ƃ��킩��B�������A���̂S�{�̌����̕��ɂ͑ł�������Ă���i���x�N�g���̘a�Ƃ��ă[���ɂȂ�j�A���q�S�̂Ƃ��Ă͓d�ׂ̕�͂Ȃ��B���̂R�̒��ŁA�ł������ȋɐ��������Ă���B
�ގ��̍\���Ƃ��āA�l�����Y�f CCl4 �i�Ód�|�e���V�����}�́A���ȏ� p48�j��A�A�����j�E���C�I���i�Ód�|�e���V�����}�́A���ȏ� p43�j�Ȃǂł���A�e�����͓d�C�A���x�̍��ɗR�����ĕ��ɂ������Ă�����̂́A���q�S�̂Ƃ��ẮA�Ώ̐��̊W����ł�������Ă���A�d�ׂ̕肪�Ȃ��B
�A�����j�A�A����ѐ��̐Ód�|�e���V�����}�b�v�ŐԂ��ʒu�́A�Ǘ��d�q�̂��镔���ł���B�܂��A�A�����j�A�� N-H ��������ѐ��� O-H �������A�d�C�A���x�̍��ɗR�����āANδ--Hδ+�AOδ--Hδ+ �̂悤�ɕ��ɂ��Ă���B�A�����j�A����ѐ��ł́A���̕��ɂ́A���q�̑Ώ̐�����ł������ꂽ��͂��Ȃ��B�Ód�|�e���V�����}������ƁA�A�����j�A�̐��f���A���̐��f�̂ق������Z���\������Ă��邱�Ƃ��킩��B����́A�d�C�A���x�̍����AN-H ��� O-H �ł��傫�����߁A���f��̐��̕����d�ׂ��A���ɂ����Ă��傫���Ȃ��Ă��邱�Ƃ������Ă���ƍl������B���̂��Ƃ���A�A�����j�A���A���̕����傫�ȋɐ��������q�ł���ƍl������B
1.26
���`���J���{�A�j�I���i���`���J���o�j�I���A���`���A�j�I���j�́A���ȏ� p41 �̐}�Ŋm�F�ł���悤�ɁACH3- �ł���B
�Y�f�̉��d�q���S�ŁA�d�C�I�����ł��邪�A���`���J���{�A�j�I���̒����̒Y�f���u-1�v�̌`���d�ׂ�S���Ă���A���d�q���T�����Ă����Ԃł���B���̒Y�f�́A�d�C�I�����Ȓ��f�Ɠ����d�q�z�u�����B���Ȃ킿�A���`���J���{�A�j�I���ƃA�����j�A�iNH3�j�́A�\���������ł���B
�i��j
�R�{�� σ �����ƁA�P�̌Ǘ��d�q�̊Ԃɔ��������邩��A���l�ʑ̌^�̍\���ƂȂ�BH-N-H �̌����p�́A���悻110�x�ł���B
1.27
���ȏ� p44�A��1.13 �Q�ƁB�\1.6�̃f�[�^���Q�Ƃ��邱�ƁB
�����\��A���̕��̌��f�̕����A���O���̊k���ŊO�k�ɂȂ邽�߁A���q�̃T�C�Y�A�������Ƃ��傫���Ȃ�B
�܂��A�������Z�����̂̕����A���������ł���B
�i��j
��R�����̉��f���A��S�����̏L�f�̕������q�T�C�Y���傫���B���̂��߁A�������́ABr2 �̕��� Cl2 ���������A�����̋������ABr2 �̕��� Cl2 �����ア�B
�f�[�^�����p�������B
Cl2�F������ 198 pm, �����𗣃G�l���M�[ 243 kJ/mol
Br2�F������ 228 pm, �����𗣃G�l���M�[ 193 kJ/mol
�o�W wikipedia �u��17�����f�v
���l�ɍl���āA
�����̒����́A�Z�����̂��璷���Ȃ鏇��
CH3-F �� CH3-Cl �� CH3-Br
�����̋����́A�������̂���キ�Ȃ鏇��
CH3-F �� CH3-Cl �� CH3-Br
�ł���Ɨ\�������B
�i���W�j
�Z�������̕������������ł���̂́A�u���q�j�|���L�d�q�|���q�j�v�Ƃ��������ɂ����āA���q�j�̓d�ׂ������ꍇ�ł��A���q�j�Ƌ��L�d�q�̕��ϓI�������Z���ق����A���傫�ȐÓd���͂������炾�Ɨ����ł��邾�낤�B�i�����̐Ód���͂ɋt����ēd�q�����̋����܂ň��������̂ɕK�v�Ȏd���i�G�l���M�[�j���A�͂��߂ɋ߂��ʒu�ɂ������ꍇ�̕����A���傫���Ȃ�B�j
�X�ɂ́A���k�ɂ��Օ����ʂ��l�����u�L���j�d�ׁv���l���ɓ��������ɂȂ�ׂ����낤�B�i�ڍׂ́A�����ł͏ȗ��j
�������A�����ł͌��ۂ̌X����������Ɖ������Ă������Ƃ��d�v�B�P���ɁA��苭���o�l�ɂ��A�Q�̌��q�j�����߂��Ɉ������Ă���A�Ƃ����C���[�W�ł��悢�B
1.28
1.27 �̃q���g���Q�ƁB
�i��j
��蒷�������́A�傫�Ȍ��f���W�������A��苭�������́A�����Ȍ��f���W�������B
1) C-I �����̕��������AC-Cl �����̕��������B
2) C-Cl �����̕��������AC-C �����̕��������B
3) H-Cl �����̕��������AH-H �����̕��������B
1.29
����͌����ł͂Ȃ����A�P���ȃC���[�W�Ƃ��āA�O���̏d�Ȃ�̂ł����ԓI�ȑ̐ς��傫�����ǂ������A�O���̐}���画�f������@�����肤��B
�O���̏d�Ȃ�ɂ��Ă̌����ȋc�_�́A�ʎq���w�Ȃǂ̉Ȗڂ̊w�K�ɂ䂾�˂邪�A�₢�́u�O���Ԃ��d�Ȃ�̌����������v�Ƃ́A�X�̌��q�O���ɔ�ׂāA�O�����d�Ȃ��Đ�����i�������́j���q�O����������ɂȂ邱���A�Ɨ������Ă悢�B
�i��j
�O���Ԃ̏d�Ȃ�̌����������̂́Aσ�@�����̕����ƍl������B
�i���W�j
���q�O�����i�������́j���q�O���̕�������ɂȂ�̂́A
�P�̌��q�j�̐��d�ׂɑ�������Ă���d�q�����܂ň��������d���i�G�l���M�[�j���A���̌��q�O���̃G�l���M�[�ł���A
�Q�̌��q�j�̐��d�ׂ̗������瑩������Ă���d�q�����܂ň��������d���i�G�l���M�[�j���A�������̕��q�O���̃G�l���M�[�ł���
���Ƃ��痝���ł���B�����ŁA������ σ �����̓d�q�́A�Q�̌��q�j�̂��傤�NJԂɂ���̂ɑ��A������ π �����̓d�q�́A���� σ �����̏㉺�ɂ���B���q�j�Ƃ̋������l����ƁAσ �����̓d�q�̕����A�����̌��q�j�Ƃ���߂��A�]���āA�����q�j����̑����������B����Ă�����ł���B
1.30
�P���ɁA�����ƌ����̋����̊W���l���Ă݂邱�ƁB�������ɂ��ẮA��d�����ƒP�����Ŕ�r�����ꍇ�A�ǂ��ł����������l���邱�ƁB
�i��j
sp2-sp2 �̏d�Ȃ�Ő����� C-C σ �����̌������i�T�^��Ƃ��āAH2C=CH2 �� 133 pm �j�̕����A sp3-sp3 �̏d�Ȃ�Ő����� C-C σ �����̌������i�T�^��Ƃ��āAH3C-CH3 �� 154 pm �j�����Z���A����āA�����B
���Z�������ł�苭���Ȃ�̂́A���L�����̓d�q���A���q�j�ɂ�苭����������邽�߂ł���B
���W�Ɏ����� s ���̊����ŋc�_����Ȃ�A��� s ���̍��� sp2 �����O���̕����As ���̒Ⴂ sp3 �����O�������Z���������̌���������B
�i���W�j
s ���̊������c�_�ɗp����ꍇ������B
sp3 �����O���́A25 % �� s ���������A
sp2 �����O���́A33 % �� s ���������A
sp �����O���́A50 % �� s �������B
s �O���̕����Ap �O���������q�j�ɋ߂��ʒu�ɂ���O���ł���̂ŁA�����O���ԂŔ�r�����ꍇ���Asp3 �� sp2 �� sp �� s �����オ��ɏ]���āA�O������茴�q�j�ɋ߂����Ƃ��킩��B���̂��߁A���q�O�����`������̂Ɏg�p���鍬���O�����Asp3 �� sp2 �� sp �� s �����オ��ɏ]���āA�����������Z���Ȃ�X��������B
1.31-1.40
1.31
�܂��́AKekulé �\���ɏ��������Ă݂�Ƃ悢���낤�B
�P�����F σ ����
��d�����F σ ������ π ����
�O�d�����F σ �����ƂQ�{�� π ����
�_�f�A���f�́A���ꂼ��Ǘ��d�q�����邱�Ƃ������Ƃ��Ȃ����ƁB
���ڂ��Ă��錴�q�j�̎��͂̔�������d�q�́Aσ �����ƌǗ��d�q�ł��邩��A���̘a���S�̏ꍇ�isp3�j�A�R�̏ꍇ�isp2�j�A�Q�̏ꍇ�isp�j�ōl����B
�i��j
�ԂŎ������̂� sp3 �����������q�A�Ŏ������̂� sp2 �����������q�A�Ŏ������̂� sp �����������q�ł���B
a) 7-methyloct-5-en-2-yne
b) vitamin C
caffeine
�J�t�F�C�����A���F�Ŏ��������f�́A�R�{�� σ �����ƌǗ��d�q�������߁A�����܂ł̊w�K���e�ɉ����čl����ƁAsp3 ���������Ă���ƍl���ē��R�ł���B�������Ȃ���A���ۂɂ́A�����̒��f�́Asp2 �������Ƃ�A�c���� p �O���ɌǗ��d�q����ꂽ�\�����Ƃ�B����́A�����̒��f�ɗאڂ��� sp2 �����̌��q�����邽�߂ł���B����ɂ��A���f�� p �O�����P�Ƃő��݂���̂ł͂Ȃ��A�אڂ������q��� p �O���� π �������̑��ݍ�p�����ĕ��q�O�����`�����邽�߂ł���B����́A�J�t�F�C���̂R�������f�������Ă݂邱�ƂŁA�Y�����钂�f���A���ʂR�z�����Ƃ邱�Ƃ�����m�F�ł���B
�r�^�~��C �̕��q�̂R�����͌^
�J�t�F�C�� �̕��q�̂R�����͌^
1.32
�uA-B-C �̌����p�v�Ƃ́A�����̌��q B �ɂ��āAB-A ���� B-C �������p�x�̂��Ƃł���B�i���w�̋L���ŁA�pABC �Ə������Ƃ��Ɏ������̂Ɠ����B�j
���d�����́Aσ ������ π ��������ł��Ă���B���̂����A�����p�ɉe����^����̂́Aσ �����ł���Bσ �����ƌǗ��d�q���݂��ɔ����������B���݂̌��ɔ������������̂̐����S�̏ꍇ�́A���l�ʑ̌^�ɁA�R�̏ꍇ�͐��O�p�`�^�ɁA�Q�̏ꍇ�͒����^�ɂȂ�B
�i��j
a) �`���d�� +1 �������f�́A���d�q���S�ŁA�d�C�I�ɒ����ȒY�f�Ɠ����ł���B�����̒��f��ɂ́A�S�{�� σ �����iN-CH3 �����~�Q�AN-H �����~�Q�j������A���l�ʑ̌^�̍\�������B����āAC-N-C �̌����p�́A���悻 110�x�ł���B
b) ethanamine �̂P�ʁi�A�~�m��̌����ʒu�j�̒Y�f�́A�S�{�� σ�����iC-CH3 �����~�P�AC-H �����~�Q�AC-NH2 �����~�P�j�������A���l�ʑ̌^�̍\�������B����āAC-C-N �̌����p�́A���悻 110�x�ł���B
c) N-methylmethanamine (dimethyl amine) �� H-C-N �̌����p�ɂ��Đu����Ă���B���f��̃��`����Y�f�i�Q���邪�A�ǂ���������ł���j�́A�S�{�� σ �����iC-H �����~�R�AC-N �����~�P�j�����̂ŁA���l�ʑ̌^�̍\�������B����āAH-C-N �̌����p�́A���悻 110�x�ł���B
d) methoxymethane (dimethyl ether) �� H-C-O �̌����p�ɂ��Đu����Ă���B�_�f��̃��`����Y�f�i�Q���邪�A�ǂ���������ł���j�́A�S�{�� σ �����iC-H �����~�R�AC-O �����~�P�j�����̂ŁA���l�ʑ̌^�̍\�������B����āAH-C-O �̌����p�́A���悻 110�x�ł���B
1.33
1.31 �ȂǂƓ��l�ɍl���邱�ƁB
d) ��_���Y�f�̍\���́AO=C=O �ł���B
e) �M�_�i���^���_�j�̍\���́AH-C(=O)OH �ł���B
f) �͗�O�Ƃ��čl���A���݂̒m���ł́A�����ȈӖ��ł̐����������Ȃ����̂Ƃ��Ă��������B���쐬�҂̈Ӑ}�́A�����炭�A���f���q N2 ���A:N��N: �Ə����A�G�`�� H-C��C-H �Ɠ����d�q�z�u�������̂ƍl���Ă悢���Ƃɂ��Ă���̂��Ǝv���܂��B
�i��j
a) Be �� 2sp �����O���ƁA���f�� 1s �O���B
�x�����E�� Be �́A���d�q���Q���������Ȃ��̂ŁA�Q�{�̋��L�������`�����Ă��I�N�e�b�g�����Ȃ��B�����^���q�ABeH2 �̍\���ɂ́ABe ��ɋ�� p �O�����Q����B�Ǘ��d�q�͂����Ȃ��̂ŁA�����������̂͂Q�{�� σ �����݂̂ł���B
b) B �� 2sp2 �����O���ƁA���f�� 1s �O���B
�z�E�f B �́A���d�q���R���������Ȃ��̂ŁA�R�{�̋��L�������`�����Ă��I�N�e�b�g�����Ȃ��B���ʂR�z�ʁi���O�p�`�^�j���q�ł��� BH3 �̍\���ɂ́A��� p �O�����P����A�R�{�� σ �����������������Ă���B
c) �Y�f�� 2sp3 �����O���ƁA���f�� 3sp3 �����O���B
�Y�f�͂S�{�� σ �����������Ă���A���l�ʑ̌^���Ƃ�B�܂��A���f���Aσ �����P�{�̑��ɁA�R�̌Ǘ��d�q�������Ă���B
d) O=C=O �̒����\�������B���̂����AC-O σ �����́A�Y�f�� 2sp �����O���ƁA�_�f�� 2sp2 �����O���B�܂��AC-O π �����́A�Y�f�� 2p �O������ю_�f�� 2p �O���B
�_�f�́Aσ �����Aπ �����̑��ɁA�Q�̌Ǘ��d�q�����B�Y�f�́A�Q�{�� σ �����ƂQ�{�� π ���������̂ŁA�i�O�d�����ł͂Ȃ����jsp �����ŁA�����^�ł��邱�Ƃɒ��ӂ��邱�ƁB
e)
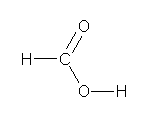
H-C �����F���f�� 1s �O���ƒY�f�� 2sp2 �����O���B
C=O �����Fσ �����́A�Y�f�� 2sp2 �����O���Ǝ_�f�� 2sp2 �����O���B�܂��Aπ �����́A�Y�f�� 2p �O������ю_�f�� 2p �O���B
C-O �����F�Y�f�� 2sp2 �����O���Ǝ_�f�� 2sp3 �����O���B
O-H �����F�_�f�� 2sp3 �����O���Ɛ��f��1s �O���B
f) �G�`�� H-C��C-H �Ɠ����d�q�z�u�������̂ƍl����Ȃ�A�G�`���̒Y�f���q�� sp �����O�������B
�i���W�j
���f���q N2 �� �_�f���q O2 �̕��q�O���Ɠd�q�z�u�̏ڍׂɂ��ẮA���@���w�ȂǂŊw�K����B���f���q N2 �� �_�f���q O2 �̕��q�O�����l����ہA2s �� 2p �������������ɕ��q�O�����`�������ď����̂����ʂł���B
�Q�̒��f���q�� z ����ɂ�����̂Ƃ���B�Q�̌��q�� 2s �O������� σ �� σ* ���ł���B�܂��A�Q�̌��q�� 2pz �O������́A�i�O���̐L�т��������̏d�ˍ��킹�Ȃ̂Łj���l�� σ �� σ* ���ł���B�Q�̌��q�� 2px �O���� 2py �O������́Aπ �� π* ���Q���ł���B
���f�̏ꍇ���ƁA�����̕��q�O���̂����A2s �O���ɗR������ σ �� σ*�A����сA2p �O���ɗR�����錋�����̂R�̋O���i2pz �O���ɗR������ σ�A2px �O���� 2py �O���ɗR������Q�� π �j�ɁA�Q�̌��q�̌v10�̉��d�q�������Ă���B���̂��߁A�������O���ɓ������d�q�̐����W�A���������̋O���i2s �O���ɗR������ σ*�j�ɓ������d�q�̐����Q�Ȃ̂ŁA�i�����U�̓d�q�ɂ�鋤�L�����Ɠ����ƍl���āj�����������R�ł���Ƃ����B���Ȃ킿�A���f���q�́A�Q�̒��f�Ԃ��O�d���������ƍl���Ă悢�B
1.34
no hint �ŁB
�i��j
�A�����j�A NH3 �́A�R�{�� N-H σ �����ƁA�P�g�̌Ǘ��d�q��������A���q�S�̂Ƃ��Ă͐��l�ʑ̌^�̑Ώ̐��������̂́A�d�ׂ̕��z�́A���l�ʑ̌^�̑Ώ̂ł͂Ȃ��B�Ód�|�e���V�����}�ɂ����āA�Ǘ��d�q�̂���ӂ肪�Z���ԂɂȂ��Ă���A���f�́A���d�C�A���x�̍������f�Ɍ������Ă��邽�߁A���ΓI�ɐ��ɑѓd���Ă���̂ŁA���Z���Ȃ��Ă���B�i�O�p���̑Ώ̐��ƂȂ��Ă���A���q�͑o�Ɏq���[�����g�����B�j
�A�����j�E���C�I���́A�S�{�� N-H σ �����������A���^���Ɠ����ŁA���l�ʑ̌^�̍\���������A�d�ׂ̕��z�����l�ʑ̌^�̑Ώ̐��������B�i���q�́A�����̕��ɂ��݂��ɑł�������A���q�S�̂Ƃ��Ă͑o�Ɏq���[�����g�������Ȃ��B�j
���q�S�̂Ƃ��Đ��̂P���ɑѓd���Ă��邽�߁A�S�̂Ƃ��Ē������q���������i���j�ɕ��Ă���B�`���d�ׂ́A���f��� +1 ��������̂́A�����̕��ɂ́AH�iδ+�j�|N�iδ-�j�ł��邩��A���ΓI�ɂ͒��f���ł͂Ȃ��A�S�̐��f���ł��F���Z���B
�C���[�W�}
�A�����j�E���C�I���ł́A�S�̂����ɑѓd���Ă��镪�A��}�ɂ����đS�̓I�ɉ����ɕ`����邪�A���f�|���f�̏㉺�W�i�d�C�A���x�ɂ���Ă��܂��Ă���j�́A����ւ��Ȃ��B
1.35
��������Q��ȏ�̌��f���܂ނ̂ŁA���ׂĂ̌����ɂ͓d�C�A���x�̍��ɗR�����ĕ��ɂ�����B���ꂼ��̕��q�̍\�����l�����A���ɂ��ł����������̂͂ǂꂩ���l����B
�W�̂����S���Y������B
�P�ɋL���������邾���ł͂Ȃ��A�Ȃ��o�Ɏq���[�����g���O�ɂȂ邩�i�e�����ɗR�����镪�ɂ��A�ǂ̂悤�ȑΏ̐��̊W����A�ǂ̂悤�ɑł��������̂��j��������Ɛ����ł��邱�ƁB
�i��j
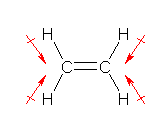
���q�Ԃ̓d�C�A���x�̍��ɗR�����錋���̕��ɂ�ԂŎ������B�܂��A���q�S�̂Ƃ��ẮA���̊e���̃x�N�g���a�ɂȂ�̂ŁA���̘a���[���ɂȂ�Ȃ����̂ɂ��ẮA�x�N�g���a��̖��Ŏ������B�i�������A���̒����́A���m�ł͂Ȃ��ł��B�j
a) �o�Ɏq���[�����g���[���ł���B
�U�{�� C-H �����ɂ����镪�ɂ��A���q�̑Ώ̐��̊W����݂��ɑł������������߁B���W�̍��ɏ������������Q�Ƃ���ƁA�Q�̃��`���� -CH3 ���ƂɁA�R�{�� C-H �����ɗR�����镪�ɂ̘a���Ƃ��Ă��ƁA���ꂪ���E�őł����������W�ɂȂ��Ă��邱�Ƃ��킩��Ǝv���B
b)
�S�̌��q�����ׂē��ꕽ�ʓ��ɂ���\���ł��邪�A�����̕��ɂ͑ł�������Ȃ��B
c)
C-H �����AC-Cl �����̒����̈Ⴂ�������ΐ��l�ʑ̌^�̍\���ł��邪�A���ɂ͑ł�������Ȃ��B
d)
���f���R�{�� σ �����ȊO�ɌǗ��d�q�������߁A���ʂR�z�ʂł͂Ȃ��A�O�p���^�̕��q�ł���B�Ǘ��d�q���܂߂čl����Ȃ�ΐ��l�ʑ̌^�ƌ����Ă��悢�B��̍\���}�ł́A�i���܂��ʓI�ł͂Ȃ��������ł��邪�j�Ǘ��d�q�����W�Ŏ����Ă���B
e) �o�Ɏq���[�����g���[���ł���B
�U�̌��q�����ׂē��ꕽ�ʓ��ɂ���\���ł���B���E�Q�{���� C-H �����ɂ�镪�ɂ��A�݂��ɑł����������̂ŁA���q�S�̂Ƃ���ƕ��ɂ��Ȃ��B
f)
e �̍\������A�P�{�� C-H ������ C-Br �����ɂȂ������́Be �Ɠ��l�ɁA�U�̌��q�����ׂē��ꕽ�ʓ��ɂ���\���ł��邪�A���ɂ��ł�������Ȃ��B
g) �o�Ɏq���[�����g���[���ł���B
�x�����E���������^�Q�z�ʂƂȂ邩��A�Q�{�� Be-Cl �����ɗR�����镪�ɂ��݂��ɑł����������B
h) �o�Ɏq���[�����g���[���ł���B
���ʂR�z�ʁA���O�p�`�^�̕��q�ƂȂ�B�R�{�� B-F �����ɗR�����镪�ɂ��݂��ɑł����������B
�i���W�j
���܁A���ʂR�z�ʂ̉������i���Ƃ��ACH3+�j�A����сA���l�ʑ̌^�S�z�ʂ̉������i���Ƃ��ACCl4�j���������Ƃ���B���S���q�Ɍ������Ă�����̂����ׂē����ł���Ƃ���Ȃ�A�Ώ̐��̊W����A���q�̓d�ׂ̕�͂Ȃ��A���q�S�̂Ƃ��Ă̑o�Ɏq�͎����Ă��Ȃ����Ƃ͗e�Ղɗ����ł���ł��낤�B
���ɁA���ʂR�z�ʂ̉��������ACAB2�A���l�ʑ̂S�z�ʂ̉��������ACAB3 �Ƃ��悤�B�����āA���ꂼ��̌����ɑ��AC-A �̕����A����� C-B �̕����ɁA���}�̂悤�ȕ��ɂ������Ă�����̂Ƃ���B
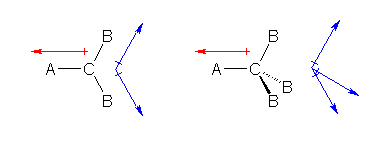
�����ŁAA��B�����͓������f�ł������ƍl����ƁA�Ԃ̖��Ɛ̖��͌����́i�����̐L�тĂ�������ɉ����Ă��āj�قȂ���̂́A���������ł��邱�ƂɂȂ�B���̂Ƃ��AA��B�����͓������f�ł������ꍇ�ɂ͑Ώ̐��̊W���A���q�S�̂Ƃ��Ă͓d�ׂ̕肪�Ȃ��̂ł��邩��A�Ԃ̖��Ɛ̖��̃x�N�g���̑��a�́A�[���łȂ���Ȃ�Ȃ��B�܂�A��}�ɂ����āA�̖��̃x�N�g���̘a�́A�Ԃ̖��ƌ������t�Œ����̓����x�N�g����^����B
�i�������A���Ƃ����̂R�z�ʂ̏ꍇ�́A���}�̂悤�ȍ�}�ɂ���Ăł��A�S���������e��������邱�Ƃ��ł���B�j
1.36
���鉖��́u�����_�v�Ƃ́A���̉�� H+ ��������\���̂��̂ł���B
����_�́u��������v�Ƃ́A���̎_�� H+ ����o�����\���̂��̂ł���B
�i��j
NH3 �̋����_�́ANH4+ �ł���B
Cl- �̋����_�́AHCl �ł���B
HO- �̋����_�́AH2O �ł���B
H2O �̋����_�́AH3O+ �ł���B
NH3 �̋�������́ANH2- �ł���B
HBr �̋�������́ABr- �ł���B
HNO3 �̋�������́ANO3- �ł���B
H2O �̋�������́AHO- �ł���B
1.37
�_�𗣂̕��t���AH+ ����o���鑤�ɕ���̂������_�ł���B�]���āAKeq �Ȃ�т� Ka ���傫�����̂������_�ł���BpKa �͏��������̂������_�ł���B
pKa = - log (Ka)
�ł��邩��A
Ka = 10-pKa = 1/10pKa
�܂��A
Ka �ɑΉ����� pKa �̒l
106 �� -6
102 �� -2
10-2 �� +2
10-6 �� +6
�ȂǁB
�i��j
�_���x�w�� pKa �́A�������l�����قNj��_�ł��邱�Ƃ������B
�ipKa ���������Ƃ������Ƃ́AKa ���傫�����Ƃ������B�j
���̂��߁ApKa �� 5.2 �̉����� A �ƁApKa �� 5.8 �̉����� B �ł́AA �̕������ΓI�ɋ����_�ł���B�ipKa �� 5 �O��̉������́A�|�_�Ȃǂ̃J���{���_�Ɠ����x�̋����̎_�ł���B�j
�_�𗣒萔�i�_���x�萔�jKa �́A�傫�Ȓl�����قNj��_�ł���B
���̂��߁AKa �� 3.4 �~ 10-3 �̉����� C �ƁAKa �� 2.1 �~ 10-6 �̉����� D �ł́AC �̕������ΓI�ɋ����_�ł���B
���Ȃ݂ɁAKa �� pKa �Ƃ�ϊ����Ă������B
������ A �� Ka �́A1/105.2 = 6.3 �~ 10-6
������ B �� Ka �́A1/105.8 = 1.6 �~ 10-6
������ C �� pKa �́A-log10(3.4 �~ 10-3) = 2.5
������ D �� pKa �́A-log10(2.1 �~ 10-6) = 5.7
1.38
Keq ����� Ka �̒�`�����v���o�����ƁB
���ȏ� p 51 ��1/3�̕ӂ�̎��A
Ka = Keq �~ [H2O]
�̊W������B�܂��A�����̐��̃����Z�x [H2O] �́A55.5 mol/L�i18g/mol �̐����A1 kg�i1L�j�̒��ɉ��������邩�̌v�Z�j�Ƃ��Ă悢�B
�i��j
Ka = Keq �~ [H2O] ���
Keq = Ka / [H2O]
����āA����ɐ��l��������B
Keq = 4.53 �~ 10-6 �� 55.5
= 8.16 �~ 10-8
�ƂȂ�B
1.39
pKa ���� Ka �����߂�ɂ́A���ȏ� p52 �u���̎w�j�v���Q�Ƃ���B���m�Ȓl�����߂�ɂ́A���d�쓙��p���邱�ƁB
�܂��A�����u���̎w�j�v�ɗ^���Ă���悤�ɁA�r�^�~��C ��pKa �l�Ƃ��āA4.17��p���邱�ƁB
�i��j
��蕶���A���_�� pKa �� 4.82 �ł���̂ŁA
Ka = 1/104.82 = 1.51 �~ 10-5 �ł���B
�r�^�~��C�́ApKa �� 4.17 �ł��邩��A���_�Ɣ�r�����ꍇ�A��� pKa �̏����ȃr�^�~��C�̕����A���ΓI�ɋ����_�ł���Ƃ�����B
1.40
�݉t�̎_�����́A���_ HCl �ł���B�]���āA�₢�ɗ^����ꂽ�e�����Ɖ��_�Ƃ̒��a�������������悢�B
�܂��A���ꂼ��̔������ɂ����āABrønsted-Lowry �̒�`�ɂ�鉖����ł��邩����肵�Ă݂邱�ƁB
�i��j
a) 2 HCl + Mg(OH)2 �� MgCl2 + 2 H2O
b) HCl + KHCO3 �� KCl + H2CO3
c) 2 HCl + CaCO3 �� CaCl2 + H2CO3
�������Ab)�Ac) �Ƃ��ɁA�������Y�_ H2CO3 �́A�Z�x���オ�����Ƃ�
H2CO3 �� H2O + CO2
�̔������i�s����B
Brønsted-Lowry �̒�`���ӎ����āA�s�v�ȗz�C�I���������珜���ď����ƁA�����B
a) HCl + OH- �� Cl- + H2O
b) HCl + HCO3- �� Cl- + H2CO3
c) �̔����́A���̂Q�i�K�ɂ킯�ď������Ƃ��ł���B
HCl + CO32- �� Cl- + HCO32-
HCl + HCO32- �� Cl- + H2CO3
Brønsted-Lowry �̎_����̒�`�ɏ]���A
a) �̔����ł́AHCl ���_���_�A���_���}�O�l�V�E������𗣂��� OH- ������Ƃ��Ă͂��炢�Ă���B
b) �̔����ł́AHCl ���_���_�A�Y�_���f�C�I�� HCO3- ������Ƃ��Ă͂��炢�Ă���B
c) �̔����ł́A��P�i�K�ł́A�Y�_�C�I�� CO32- ������Ƃ��ē����A���̋����_�ł���Y�_���f�C�I�� HCO3- ��^����B�܂��A��Q�i�K�ł́A���̒Y�_���f�C�I�� HCO3- ������Ƃ��Ă͂��炢�Ă���B
1.41-1.50
1.41
����n�t�� pH �Ɖt���i�_���A�A���J�����j�̊W�́c
�i��j
a,c �́ApH �� 7 ���傫�����n�t�ł��邩��A����B
b �́ApH �� 7 ��菬�������n�t�ł��邩��A�_���B
1.42
����_ HA �����ΓI�ɋ��_�ł���Ƃ������Ƃ́A���̋������� A- �́AH+ �����ɂ����A���ΓI�Ɏ㉖��ł���B
���l�ɁA����_ HA �����ΓI�Ɏ�_�Ȃ�A���̋������� A- �͑��ΓI������ł���B
���ڂ��Ă��镨���̉���̑��ΓI�ȋ���f���邽�߂ɂ́A���ꂼ��̋����_�̎_�̋���� pKa �̒l�Ɋ�Â��Ĕ��f����悢�B
�i��j
a) �|�_ CH3CO2H �� pKa �� 4.8�A�M�_ HCO2H �� pKa �� 3.8 �ƁA�M�_�̕������ΓI�ɋ��_�ł���B����́A�|�_�ƃM�_�ł́A�M�_�̕�����葽���𗣂��āA����������Ă��邱�Ƃ������B
�܂�A�M�_�̋�������̕����AH+ �����ɂ����B
�i���ΓI�ɋ����_�̋�������̕����A���ΓI�Ɏア����ł���B�j
�]���āACH3CO2- �̕����AHCO2- ������������ł���B
b) ���ƃA�����j�A�ł́ApKa ���r����ƁA���̕������ΓI�ɋ����_�ł��邱�Ƃ��킩��B����́A���ƃA�����j�A�ł́A���̕�����葽���𗣂��āA����������₷�����Ƃ������B
�܂�A���̋�������̕����AH+ �����ɂ����B
�i���ΓI�ɋ����_�̋�������̕����A���ΓI�Ɏア����ł���B�j
�]���āANH2- �̕����AHO- ������������ł���B
c) �I�L�\�j�E���C�I�� H3O+ �ƁA�v���g�������^�m�[�� CH3OH2+ ���r����ƁA�v���g�������^�m�[���̕������ΓI�ɋ����_�ł��邱�Ƃ��킩��B����́A�I�L�\�j�E���C�I���ƃv���g�������^�m�[���ł́A�v���g�������^�m�[���̕�����葽���𗣂��āA����������₷�����Ƃ������B
�܂�A�v���g�������^�m�[���̋�������̕����AH+ �����ɂ����B
�i���ΓI�ɋ����_�̋�������̕����A���ΓI�Ɏア����ł���B�j
�]���āA�� H2O �̕����A���^�m�[�� CH3OH ������������ł���B
��������A���ɂ��Ă���Q�̕����̑g�̒��ł̑��ΓI�Ȏ_�̋���݂̂����ł���B��ΓI�Ȏ_�̋���͖��ɂ���K�v���Ȃ��B���ہA��L�̂悤�ɁA�R�̑g�ɂ��āA���ׂē��������œ������������Ƃ��ł��邪�Aa) �̐|�_��M�_�́A������u��_�v�ɕ��ނ������̂ŁA���n�t���Łi�Z�x�ɂ���邪�j�����������p�[�Z���g���x���_�𗣂��ċ���������Ă���Bc) �̃I�L�\�j�E���C�I����v���g�������^�m�[���́A�u���_�v�ł���B�i�t�ɁA�����̋�������ł��鐅��^�m�[���́A����Ƃ��Ă͂����ア�B�jb) �ł́A����A�����j�A�́A���肪��������ł���v���g����^���Ď_�Ƃ��Ă͂��炭�ǖʂ͂�����̂́A���n�t���_�����������Ƃ͂Ȃ��A�킴�킴�u�_�v�Ƃ��ĕ��ނ���邱�Ƃ͂قƂ�ǂȂ��B
1.43
1.42 �Ɠ����q���g�B�������A�Y�����鋤���_�� pKa �ɂ��Ă͋��ȏ���1.18 ��T�����ƁB
�i��j
���ꂼ��̋����_�ACH3NH3+�ACH3NH2�ACH3OH2+�ACH3OH�ACH3CO2H ��pKa �ׂĔ�r����B
���ɁA10.7�A40�A-2.5�A15.5�A4.76 �ł��邩��A�������_�Ƃ��Ă̋����̏��ɂȂ�ׂ�B
�y���ڂ��Ă��镨���̋����_���A�_�̋����̏��Ɏ����z
CH3OH2+�A
CH3CO2H�A
CH3NH3+�A
CH3OH�A
CH3NH2
���̏��ŁA���̎_�̋����������ׂ�ƁA����Ƃ��Ă̋����́A�ア���ɂȂ��Ă���B
�y���ڂ��Ă��镨���̉���Ƃ��Ă̎ア���z
CH3OH�A
CH3CO2-�A
CH3NH2�A
CH3O-�A
CH3NH-
1.44
Brønsted-Lowry �̎_�Ƃ��Ĕ������� = H+ ��i����j�ɋ��^����B
����Ƃ��Ĕ������� = ����i�_�j���� H+ �����B
�i��j
a) CH3OH + NH3 �� CH3O- + NH4+
CH3OH ���_�ACH3O- �����̋�������
NH3 ������ANH4+ �����̋����_
CH3OH + HCl �� CH3OH2+ + Cl-
CH3OH ������ACH3OH2+ �����̋����_
HCl ���_�ACl- �����̋�������
b) NH3 + CH3O- �� NH2- + CH3OH
NH3 ���_�ANH2- �����̋�������
CH3O- ������ACH3OH �����̋����_
NH3 + HBr �� NH4+ + Br-
NH3 ������ANH4+ �����̋����_
HBr ���_�ABr- �����̋�������
1.45
���_�Ƃ́A�_�Ƃ��ē����₷�����̂������̂�����A�_�Ƃ��Ă͂��炢�����ʂł��鋤������ɂȂ�₷���B��_�́A�_�Ƃ��ē����ɂ������̂������̂�����A�_�̌`�̂܂c��₷���B
���܁ABrønsted-Lowry �̒�`�ɂ��_������t�ŏ����ƁA�����ƂȂ�B
�_�P + ����Q ���� �_�P�̋������� + ����Q�̋����_
�]���āA�_�P�A����сA����Q�̋����_���r�����Ƃ��A���ΓI�ɋ����_�͏����A���ΓI�Ɏア�_��������������ɕ��t�������B
��̓I�Ȏw�j�Ƃ��āA�^����ꂽ�_����t�̗��ӂɂ�����_��T���o���ApKa �Ȃǂ̐��l���A���ΓI�Ȏ_�̋��x�肹��B���_������A��_�����鑤�ɕ��t�������͂��ł���B
�i��j
�q���g�ɏ���������ɂ��ƂÂ��čl����ƁA
p54
���^�m�[���Ɛ��_�����C�I���̔���
���ӂɂ�����_�F���^�m�[���ipKa = 15.5)
�E�ӂɂ�����_�i���ӂɂ����鉖��A���_�����C�I���̋����_�j�F���ipKa �` 15)
����āA���̔����ł͍��E�̎_�̋���ɑ傫�ȍ��͂Ȃ��A���t���ǂ��炩����ɌX�����Ƃ��Ȃ��B
���^�m�[���ƃI�L�\�j�E���C�I���̔���
���ӂɂ�����_�F�I�L�\�j�E���C�I���ipKa < 0�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A���^�m�[���̋����_�j�F�v���g�������^�m�[���ipKa = -2.5�j
���̔������A���E�̎_�̋���ɑ傫�ȍ��͂Ȃ��A���t���ǂ��炩����ɌX�����Ƃ��Ȃ��B
�|�_�Ɛ��_�����C�I���̔���
���ӂɂ�����_�F�|�_�ipKa = 4.76�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A���_�����C�I���̋����_�j�F���ipKa �` 15�j
���̔����ł́A���ӂ̎_�������A�E�ӂ̎_���ア�B�]���āA���ӂ̋��_�������A�E�ӂ̎�_��������ɕ��t���X���B
�|�_�ƃI�L�\�j�E���C�I���̔���
���ӂɂ�����_�F�I�L�\�j�E���C�I���ipKa < 0�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A�|�_�̋����_�j�F�v���g�����|�_�ipKa = -6.1�j
���̔����ł́A�E�ӂ̎_�������A���ӂ̎_���ア�B�]���āA�E�ӂ̋��_�������A���ӂ̎�_��������ɕ��t���X���B
���`���A�~���Ɛ��_�����C�I���̔���
���ӂɂ�����_�F���`���A�~���ipKa = 40�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A���_�����C�I���̋����_�j�F���ipKa �` 15�j
���̔����ł́A�E�ӂ̎_�������A���ӂ̎_���ア�B�]���āA�E�ӂ̋��_�������A���ӂ̎�_��������ɕ��t���X���B
���`���A�~���ƃI�L�\�j�E���C�I���̔���
���ӂɂ�����_�F�I�L�\�j�E���C�I���ipKa < 0�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A���`���A�~���̋����_�j�F���`���A�����j�E���ipKa = 10.7�j
���̔����ł́A���ӂ̎_�������A�E�ӂ̎_���ア�B�]���āA���ӂ̋��_�������A�E�ӂ̎�_��������ɕ��t���X���B
1.46
�����ł́A��蕶�ɖ��L�͂���Ă��Ȃ����A�G�`���iH-C��C-H�j���ABrønsted - Lowry �̎_�Ƃ��Ă͂��炭�������������Ώ\���ł���B
�Ȃ����̖₢�ł́A���t���ǂ���ɕ邩�������Ă���̂ŁA���������A���t�����Ƃ��ď����Ă������Ƃ��]�܂����B
�i��j
a) �G�`���Ɛ��_�����C�I���̔���
HC��CH + HO- ���� HC��C- + H2O
���ӂɂ�����_�F�G�`���ipKa = 25�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A���_�����C�I���̋����_�j�F���ipKa = 15.7�j
���̔����ł́A�E�ӂ̎_�������A���ӂ̎_���ア�B�]���āA�E�ӂ̋��_�������A���ӂ̎�_��������ɕ��t���X���B
b) �G�`���ƃA�~�h�C�I���̔���
�G�`���Ɛ��_�����C�I���̔���
HC��CH + NH2- ���� HC��C- + NH3
���ӂɂ�����_�F�G�`���ipKa = 25�j
�E�ӂɂ�����_�i���ӂɂ����鉖��A�A�~�h�C�I���̋����_�j�F�A�����j�A�ipKa = 36�j
���̔����ł́A���ӂ̎_�������A�E�ӂ̎_���ア�B�]���āA���ӂ̋��_�������A�E�ӂ̎�_��������ɕ��t���X���B
c) a, b �̓���������킩��悤�ɁA���_�����C�I���̓G�`�����琅�f�C�I���i�v���g���j�������������Ƃ��ł��Ȃ��B����A�A�~�h�C�I���́A�G�`�����琅�f�C�I���������������Ƃ��\���ɉ\�ł���B
�������A�G�`���Ɣ�ׂđ��ΓI�ɂ�苭���_�ł��鐅����������ƁA��苭�_�ł��鐅���A�~�h�C�I���ɑ����f�C�I����^���锽���݂̂��i�s���Ă��܂��B�܂��A��������A�Z�`���h�C�I���iHC��C-�j���������Ƃ��Ă��A����͐��Ɣ������ăA�Z�`�����Ɛ��_�����C�I����^��������ɔ������i�s����B���ʂƂ��Đ����鐅�_�����C�I���̓G�`�����琅�f�C�I���������������Ƃ��ł��Ȃ��B
���������āA�G�`���ƃA�~�h�C�I���̔����́A�����ł͐i�s���Ȃ��B�i�G�`����苭���_�i= ���j����������Ƃ��A�G�`�����_�Ƃ��Ĕ��������邱�Ƃ͂ł��Ȃ��B�j
1.47
���ȏ� p57 �̌v�Z����p���Ă悢�B�������A���ɗp����͎̂_���x�萔 Ka �ł���A�_���x�w�� pKa �ł͂Ȃ����Ƃɒ��ӂ���B�܂��A���̎��̗U���́A���L�u���W�P�v�Ɏ����Ă������̂ŁA�m�F���Ă������ƁB
�e�퉻������ pKa �l�ɂ��ẮA�����̕t�^II�i�y�[�W�AA-8)�ɂ܂Ƃ߂��Ă���B
�i��j
a) HCl �� H2O �̑g�ݍ��킹�ɂ����āA���ΓI�ɋ����_�ł��� HCl ���_�Ƃ��Ă͂��炭���������ƁA
HCl + H2O ���� Cl- + H3O+
�� ���ΓI�Ɏア�_�ł��鐅���_�Ƃ��Ă͂��炭����������B�i�� ���W�Q�j
�㎮�ɂ����āA
�������̎_�FHCl , pKa = -7
�������̎_�FH3O+ , pKa = -1.7
�]���āA���t�萔��
Keq = 107 / 101.7 = 105.3 �� 2 �~ 105
�i100.3 = 1.995�c �ł��邪�A100.25 = 1.778�c�A100.35 = 2.238�c �ł��邱�Ƃ��l����ƁA���x�͂P�����x�����Ȃ��ƍl���Ă悢���낤�B���������āA2.0 �~ 105 �ł͂Ȃ��A2 �~ 105�Ƃ���B�j
���t�萔�� 1 �����傫������A���t�ɒB�������Ƃ̔Z�x�́A�������̕����o�������������B
b) CH3CO2H ���_�Ƃ��Ă͂��炭���������ƁA
CH3CO2H + H2O ���� CH3CO2- + H3O+
�㎮�ɂ����āA
�������̎_�FCH3CO2H , pKa = 4.8
�������̎_�FH3O+ , pKa = -1.7
�]���āA���t�萔��
Keq = 10-4.8 / 101.7 = 10-6.5 �� 3 �~ 10-7
���t�萔�� 1 ��������������A���t�ɒB�������Ƃ̔Z�x�́A�������̕������o�����̕��������B�|�_�͎�_�ł���A�Z�x�ɂ���邪���n�t���ł��������� % ���𗣂��Ă���ɂ����Ȃ��B
c) H2O ���_�Ƃ��Ă͂��炭���������ƁA
CH3NH2 + H2O ���� CH3NH3+ + HO-
�㎮�ɂ����āA
�������̎_�FH2O , pKa = 15.7
�������̎_�FCH3NH3+ , pKa = 10.7
�]���āA���t�萔��
Keq = 10-15.7 / 10-10.7 = 10-5 �� 1 �~ 10-5
���t�萔�� 1 ��������������A���t�ɒB�������Ƃ̔Z�x�́A�������̕������o�����̕��������B���`���A�~���͎㉖��ł���B�i���`���A�~���̋����_�� pKa = 10.7 �ł���̂ŁA���`���A�~���� pKb = 14 -10.7 = 3.3 �ł���ƕ\�����邱�Ƃ�����B�j
d) CH3NH3+ ���_�Ƃ��Ă͂��炭���������ƁA
CH3NH3+ + H2O ���� CH3NH2 + H3O+
�㎮�ɂ����āA
�������̎_�FCH3NH3+ , pKa = 10.7
�������̎_�FH3O+ , pKa = -1.7
�]���āA���t�萔��
Keq = 10-10.7 / 101.7 = 10-12.4 �� 4 �~ 10-13
�i���W�P�j
�_�P�iHA1) �̉𗣕��t
HA1 ���� H+ + A1-
�_�𗣕��t�萔
| Ka1 = | [ H�{] | [ A1�|] |
| [ HA1 ] | ||
�_�Q�iHA2) �̉𗣕��t
HA2 ���� H+ + A2-
�_�𗣕��t�萔
| Ka2 = | [ H�{] | [ A2�|] |
| [ HA2 ] | ||
���܁A�_�P�����Ƃ��A�_�Q�����Ƃ���B���̂��߁A�_�P�Ǝ_�Q�̋�������Ƃ������鎮�������B
HA1 �{ A2- ���� A1- + HA2
���t�萔
| Keq = | [ A1- ] | [ HA2 ] |
| [ HA1 ] | [ A2- ] | |
���q�ƕ���ɋ��ʂ� [H+] ���|���Ă���ό`����B
| Keq = | [ A1- ] | [ HA2 ] | [ H+ ] |
| [ HA1 ] | [ A2- ] | [ H+ ] | |
| = | [ H+ ] | [ A1- ] | [ HA2 ] | ||
| [ HA1 ] | [ H+ ] | [ A2- ] | |||
| = | Ka1 |
| Ka2 |
���̎��̏d�v�Ȍ��_�Ƃ��āA�������̎_�Ɣ������̎_�� pKa ���r�����Ƃ��A���̍����P�ȉ��̏ꍇ�A���t�萔 Keq �� 1/10 �` 10 �͈̔͂ɂ���B���Ȃ킿�A�������ߏ�ɂ���ꍇ�������āA���t�ɒB�����Ƃ��̗ʂ��A���ʂ̂��̂łP0%�ȏ㑶�݂��邩��A���������S�ɂǂ��炩����ɕ�Ƃ͌����������B
����ɑ��ApKa �̍����Q�ȏ゠��Ȃ�A���t�萔 Keq �� 1/100 �������A�܂���100�ȏ�Ƃ������ƂɂȂ�B���Ȃ킿�A�������ߏ�ɂ���ꍇ�������āA���t�ɒB�����Ƃ��̗ʂ��A���ʂ̂��̂�1%�����ł���B���������Ĕ������قځu���S�ɐi�s����v���u���S�ɐi�s���Ȃ��v�̂����ꂩ�ł���B
�i���W�Q�j
HCl �� H2O �̔����ŁA���ΓI�ɋ����_�ł��� HCl �ł͂Ȃ��A���ΓI�Ɏア�_�ł��� H2O ���_�Ƃ��ē��������������Ƃ��ł���B
HCl + H2O ���� H2Cl+ + OH-
�㎮�ɂ����āA
�������̎_�FH2O , pKa = 15.7
�������̎_�FH2Cl+ , pKa �l���ځBHCl �� pKa �l -7 ��菬�����l�ł���̂͊ԈႢ�Ȃ��ł��낤�B
�X�I�ɁA�������̎_�� pKa �� -7 �Ƃ��Čv�Z���Ă݂�B
���t�萔��
Keq = 10-15.7 / 107 = 10-22.7 �� 2 �~ 10-23
�X�Ɍv�Z��i�߂�B
���t�萔�����������ƁA
| Keq = | [ H2Cl+ ] | [ OH- ] |
| [ HCl] | [ H2O ] | |
�ł������B
1 mol/L �̉��_�iHCl �̐��n�t�j���l���A�e�����̔Z�x�����߂Ă݂悤�B
�ʏ�́A�u���_�ł��邩�� 100% �𗣂��Ă���B�v�Ƃ��Ĉ���������^�ʖڂɌv�Z����ƁApKa = -7 ��p����ƁA1 mol/L �̉��_�ɂ����� HCl �̉𗣓x α = 0.999999 �ł���B���Ȃ킿�AHCl �̌`�̂܂ܐ��ɗn���Ă�����̂̔Z�x�́A1 �~ 10-7 �����c���Ă��Ȃ��B���Ȃ킿�A
[ HCl ] = 1 �~ 10-7
�܂��A���i�n�}�����˂�j�́A55.5 mol/L �ł���B
[ H2O ] = 5.6 �~ 102
1 mol/L �̉��_�́A[ H+ ] = 1.0 mol/L �A���Ȃ킿 pH = 0 �Ȃ̂ł��邩��A�����ɂ����鐅�̃C�I���ς��l���āA
[ OH- ] = 1.0 �~ 10-14
���t�萔�̒l�ƁA��L�R�̔Z�x��������B
| Keq = | [ H2Cl+ ] | (1.0 �~ 10-14) | = 2 �~ 10-23 |
| (1.0 �~ 10-7) | (5.6 �~ 102) | ||
�� [ H2Cl+ ] �� 1 �~ 10-13
���ۂɂ́AH3O+ �� H2O ��肸���Ƌ����_�ł���̂Ɠ��l�ɁA�����炭�AH2Cl+ �� HCl ��肸���Ƌ����_�ł��낤����AKeq �̒l�͍X�ɏ������Ȃ�B�܂�AH2Cl+ �Z�x�́A��L�l���������������Ȓl�ɂȂ�BH2Cl+ �� pKa ���A-20 �Ƃ��ē��l�Ɍv�Z����ƁA[ H2Cl+ ] �� 1 �~ 10-26 �ƂȂ邪�A����́A170 L �� 1mol/L ���_���� H2Cl+ �� 1 ���q�����Ă�����x�̗ʂł���B
���������������Ȓl�Ȃ̂ŁA�ʏ�͖������Ă��܂��āA���̂悤�Ȕ����͎����㐶���Ȃ��A�Ƃ��Ă��܂��Ă悢�B�j
1.48
pKa �ׂ�Γ���������̂����A�����ł́ApKa �̒l����c�_����̂ł͂Ȃ��A�\������_�̋����i���Ȃ킿�A��������̈��萫�j�𐄘_���邱�ƁB
������ňقȂ�����̌��f�ԂŔ�r����ꍇ�F���ȏ� p59�u�傫�������ɈقȂ錴�q���r�����ƁA���̌��q�����d�ׂ������t���Ă���x���������߂�ۂɂ́A���q�̑傫�����d�C�A���x���d�v�ƂȂ�B���Ƃ��A�����\�̏c�̗�����ɂ����ɏ]���āA���q�͑傫���Ȃ�A���̓d�C�A���x�͌������邪�A����̈��萫�͑��傷��̂ŁA���̋����_�̋��������傷��B�v
���������̌��f�ԂŔ�r����ꍇ�F���ȏ� p58�u���q�̑傫�����������x�Ȃ���A�ł������_�́A�d�C�A���x�������Ƃ��傫�����q�Ɍ������Ă��鐅�f�������Ă���B�v
�i��j
a) �n���Q���Ԃł̔�r�A���Ȃ킿�A������̌��f�Ԃ̔�r�ɂȂ�B�傫�������ɈقȂ錴�q���r�����ƁA���̌��q�����d�ׂ������t���Ă���x���������߂�ۂɂ́A���q�̑傫�����d�C�A���x���d�v�ƂȂ�B���Ƃ��A�����\�̏c�̗�����ɂ����ɏ]���āA���q�͑傫���Ȃ�A���̓d�C�A���x�͌������邪�A����̈��萫�͑��傷��̂ŁA���̋����_�̋��������傷��B
�]���āA�_�̋����́AHCl �� HBr
pKa �Ŋm�F�i���ȏ������t�^�A�y�[�WA-8�j����ƁAHCl �� pKa = -7�AHBr �� pKa = -9 �ŁA��L�ɍ��v����B
b) �_�f�ƒ��f�ł́A������Q�����̌��f�Ȃ̂ŁA���������̌��f�Ԃł̔�r�ɂȂ�B���q�̑傫�����������x�Ȃ���A�ł������_�́A�d�C�A���x�������Ƃ��傫�����q�Ɍ������Ă��鐅�f�������Ă���B
���d�C�A���x�̍����_�f�̕���������������艻�ł���B�]���āA�_�̋����́ACH3CH2CH2NH3+ �� CH3CH2CH2OH2+
pKa �Ŋm�F����B���ȏ������̕\�ɂ́A���̂��͍̂ڂ��Ă��Ȃ����A������Ŕ�r���邱�Ƃ��ł���̂ŁA���Ƃ��A�A���L���� n-propyl � methyl ��ɂȂ������̓��m�̔�r����B
�v���g�������`���A���R�[���� pKa = -2.5�A�v���g�������`���A�~���� pKa = 10.7�i���ȏ� p58 �ɂ��l���ڂ��Ă���B�j�ŁA��L�̏��ɍ��v����B
c) �_�f�ƒ��f�ł́A������Q�����̌��f�Ȃ̂ŁA���������̌��f�Ԃł̔�r�ɂȂ�B���q�̑傫�����������x�Ȃ���A�ł������_�́A�d�C�A���x�������Ƃ��傫�����q�Ɍ������Ă��鐅�f�������Ă���B
���d�C�A���x�̍����_�f�̕���������������艻�ł���B�]���āA�_�̋����́ACH3CH2CH2NH2 �� CH3CH2CH2OH
��Ɠ��l�A������Ŕ�r����ƁA���^�m�[���� pK = 15.5, ���`���A�~���� pKa = 40 �ŁA��L�̏��ɍ��v����B
d) ������ňقȂ�����̌��f�ł���_�f�A�����Ŕ�r���邩��A���傫�����q�ŋ���������艻����A��苭���_��^����B
�]���āA�_�̋����́ACH3C(=O)OH �� CH3C(=O)SH
�i���W�j
d) �̈���ŗ^�����Ă��� CH3C(=O)SH �ɂ��āB
���������F�`�I�|�_�Athioacetic acid
�J���{���_�̎_�f�̈�𗰉��Œu�����������̍\���̉������̈�ʖ��́A�`�I�J���{���_�ł���B�_�f���Q�Ƃ��u�������� CH3C(=S)SH �Ƃ����ꍇ�́A�W�`�I�J���{���_�B
������̏ڍׁF
�����ɂ́ACH3C(=O)SH �� CH3C(=S)OH ���ǂ�����`�I�|�_�ł���̂ŁA�������ʂ���ꍇ�́A�_�����f�̌������Ă��錳�f�ŋ�ʂ���B
CH3C(=O)SH, thioacetic S-acid, S-�`�I�|�_
CH3C(=S)OH, thioacetic O-acid, O-�`�I�|�_
�|�_�ɑ��A�`�I�|�_�̂悤�Ȃ��́A���Ȃ킿�A�_�f�𑼂̌��f�Œu�����������̂��A�u�ތ^�_�v�Ƃ����A���̒u���̎d���ɂ�薽�������܂�B
�i�O���y�[�W�j���̗ތ^�_
�i�O���y�[�W�j�_�̗ތ^�U���̂̐ړ����Ƒ}����
1.49
�ł���������i�����_���ł��ア�j�̂́A�ł��s����ŁAH+ �����₷�����̂ł���B
�i��j
�n���Q���Ԃł̔�r�A���Ȃ킿�A������̌��f�Ԃ̔�r�ɂȂ�B�傫�������ɈقȂ錴�q���r�����ƁA���̌��q�����d�ׂ������t���Ă���x���������߂�ۂɂ́A���q�̑傫�����d�C�A���x���d�v�ƂȂ�B���Ƃ��A�����\�̏c�̗�����ɂ����ɏ]���āA���q�͑傫���Ȃ�A���̓d�C�A���x�͌������邪�A����̈��萫�͑��傷��B�i����̋����A�������₷���́A�C�I���̈��萫�i�������ɂ����j�̋t���j
�]���āA�n���Q�������C�I��������̋������ɂȂ�ׂ��
F- �� Cl- �� Br- �� I-
1.50
1-48, 49 �̃q���g���Q�Ƃ��邱�ƁB
�i��j
a) �d�C�A���x���傫���̂́A������Ԃ̔�r�Ȃ̂ŁA�������̏������i�����\��A��Ɉʒu����A���q���a�̏������j�_�f�B
b) ������ԂŔ�r����̂ŁA�傫�������ɈقȂ錴�q���r�����ƁA���̌��q�����d�ׂ������t���Ă���x���������߂�ۂɂ́A���q�̑傫�����d�C�A���x���d�v�ƂȂ�B�����̂ق����_�f������������������艻�ł��邩��A�_�̋����́AH2O �� H2S
����� pKa �Ŋm�F����ƁA���� pKa = 15.7�A�������f�� pKa = 7.0
c) ��Ɠ��l�ɁA�_�̋����́ACH3OH �� CH3SH
���ȏ��̊����iA-8)�̕\�ɂ��ƁA�G�^�m�[���� pKa = 16.0 �ɑ��A�G�^���`�I�[�� pKa = 10.5 �ł���B
�܂��A�ׂ̋��ȏ��̓��l�̕\����A�t�F�m�[���� pKa = 9.9 �ɑ��A�`�I�t�F�m�[���� pKa = 6.6�A�܂��A�x���W���A���R�[���� pKa = 15.4 �ɑ��A�x���W���`�I�[���� pKa = 9.4 �Ȃǂ̃f�[�^������B
1.51-1.60
1.51
�ȉ������ׂē��`�ł��邱�Ƃ��l����B
��苭������ł���B
H+ �����₷���B
�����_�̍\����������ł���B
�����_�����ア�_�ł���B
�i��j
a) ���d�ׂ����� OH- �̕����A������ H2O ���z�C�I�� H+ �����₷���B�]���āAOH- �̕�����������ł���B
�܂��́A�����̕��q��̋����_�́A���ꂼ�� H2O �� H3O+ �ł���BpKa �����Ă����炩�Ȃ悤�ɁAH3O+ �̕��������_�ł���B����āA���̋������� H2O �̕����ア����ł���B
b) �_�f�ƒ��f�̂悤�ɓ������̌��f�ԂŔ�r����̂ŁA���d�C�A���x�̍����_�f�̕����A�_���x�������Ȃ�A�܂��A�����_�����l�Ɏ_���x�������Ȃ�B���̂��߁A�_�f�̕����A����x���Ⴍ�Ȃ�B����āA�A�����j�A�̕���������������ł���B
c) �|�_�C�I���́A���\���������A���d�ׂ̔�Ǎ݉��̌��ʂ̂��߁A���g�L�V�h�C�I���ɂ���ׂĂ�����ł���B�����_�ɂ��čl����Ȃ�A�|�_�i�J���{���_�j�́A���^�m�[���i�A���R�[���j�����_���x�������B����āA���g�L�V�h�C�I���̕���������ł���B
d) �_�f�Ɨ����̂悤�ɓ�����̌��f�ԂŔ�r����̂ŁA���傫�ȗ����ŁA�_���x�������Ȃ�A�܂����l�ɋ����_���_���x�������Ȃ�B���̂��߁A����x���Ⴍ�Ȃ�B�]���āA���g�L�V�h�C�I���̕���������ł���B
1.52
�\���̈Ⴂ�ɒ��ڂ��A���ꂼ��̎_�̋�����������艻������̂͂ǂ��炩����������B
�i��j
a) 2-methoxyethanol �̋�������� CH3OCH2CH2O-�Abutan-1-olNo��������� CH3CH2CH2CH2O- �ł���B
�_�f�́A�Y�f�����d�C�A���x�������̂ŁA σ ������ʂ������d�ׂ������A��Ǎ݉���������ʂ����B�i���ȏ��̗p��ł́A�u�d�q�������U�N���� inductive electron withdrawal�v�A�P�Ɂu�U�N���� inductive effect�v(
I ���ʁj�Ƃ������B�j���̂��߁A2-methoxyethanol �̕������ΓI�ɋ����_�ł���B
�y���Ӂz�_�f���q���Ap�O����π�����ɗאڂ��Č��������ꍇ�ɂ́A�����ʁiM ���ʁA�܂��́AR ���ʁj�ɂ��d�q���^���Ƃ��ē����ꍇ������B���Ƃ��A�x���[����� π �d�q���x���r����ƁA���u���̃x���[�������A���g�L�V������x���[���i�A�j�\�[���j�̕����A�����B
b) 1.48(b) �Ƌ��ʁB�_�f�ƒ��f�ł́A������Q�����̌��f�Ȃ̂ŁA���������̌��f�Ԃł̔�r�ɂȂ�B���q�̑傫�����������x�Ȃ���A�d�C�A���x�̑傫�����q�Ɍ������Ă��鐅�f�̕��������_���������B
�]���āA�v���g�������ꂽ propan-1-ol �̕������ΓI�ɋ����_�ł���B
c) a) �Ɠ��l�ɍl����B�_�f���q�ɂ��U�N���ʂ́Aσ ������ʂ��A�Ԃɂ��錋���̐���������ƌ��ʂ���������B�]���āA3-methoxypropan-1-ol �����A2-ethoxyethanol �̕������ΓI�ɋ����_�ł���B
d) ���������_�����������\��قȂ邱�Ƃɒ��ӂ��邱�ƁB1-hydroxypropan-2-one �́A�_�����������\��́A���_��ł���A�A���R�[���Ɠ����� pKa �����Ɗ��҂����B����Apropanoic acid �́A�J���{���_�ł���B�i-OH �̕����I�ȍ\���������A����͐��_��Ƃ������A�J���{�L�V��̈ꕔ�ł���B�j�]���āApropanoic acid �̕������ΓI�ɋ����_�ł���B
1.53
���f����уt�b�f�ɂ��U�N���ʁi�d�C�A���x�̑傫�����q���Aσ ������ʂ��ēd�q����������ʁj�ɂ��A������������艻������ʂɂ��āA���̑召���l����B
�i��j
�����̃A���R�[���ŁA�_�����f�́A���_��̐��f�ł���B�i�d�C�A���ł���_�f�̒��ڌ������Ă��邩��B�j
���f���t�b�f���U�N���ʂɂ��A������������艻������ʂ����B
�U�N���ʂ́A�Ԃɂ��� σ �����̐��������邲�ƂɌ�������B
σ �����̐��������ł���A���d�C�A���x�̑傫�Ȍ��q����̗U�N���ʂ��傫���B
�]���āA�����̉��������_���x�̌������鏇�ɂȂ�ׂ�ƁA
�i�����Ƃ��_���x�������j 2-fluoropropan-1-ol �� 2-chloropropan-1-ol �� 3-chloropropan-1-ol �� propan-1-ol
1.54
�{���I�ɂ́A1.53 �Ɠ�����ނ̖₢�ł���B
�u�����������v���u���̋����_����_�ł�����̂���v
�U�N���ʂɂ����艻�������Ă�����̂̕����A�ア����ł���Ƃ�����B
�i��j
a) �t�b�f�̕����d�C�A���x���傫�����߁A�U�N���ʂ��傫���B���̂��߁A2-bromopropanoic acid ���� 2-fluoropropanoic acid �̕��������_�ł���B�����̋�������ł́A2-bromopropanoate ion �̕����A2-fluoropropanoate ion ������������ł���B
b) ���f�ɂ��U�N���ʂ́A�Ԃɂ��� σ ������������ƌ�������B���̂��߁A3-chlorobutanoic acid ���A2-chlorobutanoic acid �̕��������_�ł���B�����̋�������ł́A3-chlorobutanoate ion �̕����A2-chlorobutanoate ion ������������ł���B
c) 3-bromopropanoic acid �́A�L�f�ɂ��U�N���ʂ̂��߁Apropanoic acid ���������_�ł���B�����̋�������ł́A3-bromopropanoate ion �����Apropanoate ion �̕�����������ł���B
d) �J���{�j����̎_�f�i�I�L�\��j�́A�d�C�A���x�̍����_�f�ɂ��U�N���ʂ������B4-hydroxybutan-2-one �̕����A1-hydroxybutan-2-one �ɂ���ׂĎ_�����f�i���_��̐��f�j�ƃJ���{�j����̈ʒu���������߁A���ΓI�Ɏア�_�ł���B���������āA��������ł́A�i4-hydroxybutan-2-one �̋�������ł���j3-oxobutyloxide ion �̕����A�i1-hydroxybutan-2-one �̋�������ł���j2-oxobutyloxide ion ������������ł���B
1.55
������Ă����������Ɠǂ݁A�v�_�����Ă������ƁB
�i��j
�_�����f�����������d�C�A���x�̍������f���r����Ƃ��A
���������̌��f�̏ꍇ�A�d�C�A���x�̍������̂Ɍ����������f�̕������_�ł��邪�A
�قȂ�����̌��f�̏ꍇ�A�d�C�A���x�̏��Ƃ͋t�ɂȂ�A���傫�Ȍ��q�Ɍ����������f�̕������_�ł���B
����A�U�N���ʂɂ��ẮA���q�̃T�C�Y�͊W�Ȃ��A�d�C�A���x�̍������f�̕����������ʂ����B
1.56
����̓J���{���_�A��������̓X���z���_�ł��邩��A�_���x�̈Ⴂ�i�召�j�͖����ł���̂����A�����ł́A�Ȃ��J���{���_�����X���z���_�̕��������_�ł���̂����������B
�����_�Ƃ́A������������艻����Ă�����̂ł���B�܂�A���ꂼ��̋�������������A���艻�̗v�����������邱�ƁB
��̓I�ɂ́A���d�ׂ̔�Ǎ݉��̌��ʂ��l������̂ŁA���̑召����������悢�B
�i��j
���ꂼ��̋�������ɂ��āA�����������Ă݂�ƁA
�|�_�C�I��, acetate ion
�}�̂悤�ɁA�Q�̎_�f��ɕ��d�ׂ���Ǎ݉������\�������B
���^���X���z���_�C�I��, methanesulfonate �C�I��
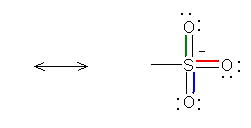
�}�̂悤�ɁA�R�̎_�f��ɕ��d�ׂ���Ǎ݉������\�������B
�J���{���_�̋�����������A�X���z���_�̋�������̕����A��Ǎ݉��̒��x���傫�����߁A�X���z���_�̋�������̕�������ł���B���Ȃ킿�A�J���{���_�����X���z���_�̕����_�Ƃ��ċ����B
����ɁA��������R�����Ȃ̂łT�{�ȏ�̌��������\�����������Ă悢���ƁA�������Y�f���d�C�A���Ō��q�T�C�Y���傫�����Ƃ���A������ɕ��d�ׂ����悤�Ȏ��̋��Ɍ��\���̊�^���l����ꍇ������B
1.57
1.56 �Ɠ��l�B
a) �́A�Y�_ H2CO3 �̂Q�i�K�𗣂ɂ���Đ�����B�Y�_�C�I���B
b) �́A�Ɏ_ HNO3 �̉𗣂ɂ���Đ�����B�Ɏ_�C�I���B
�i��j
a) �Y�_�C�I��, carbonate ion
����ɁA�_�f�̕����Y�f���d�C�A���x�������̂ŁA��^�͏����������̂悤�ȋɌ��\�����������Ƃ��ł���B
b) �Ɏ_�C�I��, nitrate ion
����ɁA�_�f�̕������f���d�C�A���x�������̂ŁA��^�͏����������̂悤�ȋɌ��\�����������Ƃ��ł���B�i�������A���f��̌`���d�ׂ� 2+ �ƂȂ��Ă���B���̂悤�Ɉ�ӏ��ɓd�ׂ��W�������\���́A�ʏ�͏����Ȃ��Ă悢�B�j
1.58
a,b,c) �u�\�̒��Łv�Ǝw�肳��Ă���̂ł��邩��A���ȏ��̊����t�^II�i�y�[�W A-8�j�̕\���Q�Ƃ���B
f) 1.56 ���Q�Ƃ��邱�ƁB
�i��j
a) �ł� pKa �̏����ȗL�@��������T���B�]���āA���̕\����́A�v���g�����A�Z�g�j�g�����B�������q�Ɍ��肵�ĒT���A�x���[���X���z���_�B
b) �ł� pKa �̑傫�ȗL�@��������T���B�]���āA���̕\����́A�G�^���B�i���^���� pKa = 60 �ɑ��A�G�^���̕\�L�u�� 60�v�́u60 ���傫���l�v�i�ł��邪�A�ǂ��܂ő傫���̂��͎����I�Ɍ��߂邱�Ƃ��ł��Ȃ��j�Ɠǂނ̂ŁB�j
c) �J���{�L�V�� -CO2H �������Ă�����̂̒�����T���B�]���āA���̕\�ł́A�g���t���I���|�_ CF3CO2H�B�_���x���������R�́A�t�b�f�̗U�N���ʂł���B�i�d�C�A���x�̍����t�b�f���Aσ������ʂ��āA��������̕��d�ׂ������A���艻����B�j
d) s ���̍����O���̕����A���q�j�ɂ��߂��ʒu�ɕ��z���Ă���B���Ȃ킿�A���d�ׂ����艻����A������������Ă���B�]���āAsp2 �����O���̕����d�C�A���x�������B
�i���q�j�ɋ߂��ʒu�̕����A�d�q�̕��d�ׂƌ��q�j�̐��d�ׂ̊Ԃ̐Ód���͂������B���̂��߁A��������܂ň��������̂͂��傫�Ȏd�����K�v�ƂȂ�B���̂悤�Ȃ��Ƃ��A���̋O���ɓ����Ă���d�q��������ł���Ƃ����B�j
e) sp �����̒��f�i��N: �܂��� ��N+�� �܂��� ��N+�| �Ȃǂ̍\�����l����j�����������̗�F CH3CN �ȂǁB
sp2 �����̒��f�i��N(:)�| �܂��� ��N+�� �Ȃǂ̍\�����l����j�����������̗�F NO3- �ȂǁB�i1.57 b �̍\�������Q�Ɓj
sp3 �����̒��f�i��N(:)�| �܂��́A��N+�� �Ȃǂ̍\�����l����j�����������̗�F NH3, NH4+�ȂǁB
f) ��������̕��d�ׂ��A�R�̎_�f��Ŕ�Ǎ݉��ł���Ɏ_�C�I���̕����A�Q�̎_�f��Ŕ�Ǎ݉����鈟�Ɏ_�C�I����������ł���B�]���āA�Ɏ_�̕������Ɏ_�������_�ł���B
1.59
��1.24 �̋L�q���悭�ǂݍl���邱�ƁB���́i���W�j���Q�Ƃ��邱�ƁB
�܂��A�֘A���āA1.65�́i���W�j�̍����Q�Ƃ��Ă��������B
�i��j
���́i���W�j�Ŏ������v�Z�ł����炩�Ȃ悤�ɁApH 5.5 �̗n�t���ŁA99 % �ȏオ�_�^����邱�Ƃ��ł���̂́ApKa �� 7.5 �����傫�Ȏ_�ł���B�����菭�������_ pKa �� 6.5 �̎_�́A�� 9 % ���𗣂��ċ�����������B�c�� 91 %�́A�_�^�ł���B�܂��A�M�Ɏ_�̋������グ�ApKa 5.5 �ɂ���ƁA���� 50 % ����������A�c��̔��� 50 % ���_�^�����BpKa 4.5 �̎_�́A91 % ���_�𗣂��ċ�������̍\���ƂȂ�BpKa 3.5 �̎_�ł́A99 % ���_�𗣂���B
�]���āA�_�^�Ƃ��Ĉ���ɑ��݂ł��鉻�����́A�_�� pKa �� 7.5 �����傫����_�ł���B
b, e, f
a) �́A�� 15 % ���_�^�Ƃ��đ��݂��Ă��邪�A�c�� 85 % �͋�������Ƃ��đ��݂���B
�i���W�j
�_ HA ���𗣕��t�ɂ�����̂Ƃ���B
HA ���� H+ + A-
�_�𗣕��t�萔�i�_���x�萔�j Ka �́A�����B
| Ka = | [ H+ ] | [ A- ] |
| [ HA ] | ||
���A���n�t�� pH �i�]���� [H+]�j���w�肷�邱�Ƃ��l���悤�B
pH ���A��L�_�� pKa �Ɠ������ƒu���ƁA
pH = pKa
[H+] = Ka
�ł���B
������A�_���x�萔 Ka �̎��̒��ɑ������B
| Ka = | [ H+ ] | [ A- ] | = [H+] |
| [ HA ] | |||
����āA���ӂ� [H+]�Ŋ����
| Ka/[H+] = | [ A- ] | = 1 |
| [ HA ] |
���� pKa �����_���ApKa �Ɠ��� pH �̗n�t�Ƃ����Ƃ��A[ A- ] �� [ HA ] ���������Ȃ�Ƃ������_�́A���ʂ��_�𗣂��������� A- �̌`�ƂȂ邱�Ƃ������B�c��̔��ʂ͎_ HA �̌`�̂܂ܗn���Ă���B
pH �������āA���f�C�I���Z�x [H+] ���グ�Ă��ƁA���V���g���G�̌����i���t�ړ��̌����j�ɂ��A�������� A- �͎_�^ HA �ɂȂ�B�t�ɁApH ���グ�āA���f�C�I���Z�x [H+] �������Ă��ƁA���V���g���G�̌����i���t�ړ��̌����j�ɂ��A�_ HA �́A�������� A-�ɂȂ�B
����ɂ��Ă��A�ȉ��̂悤�Ɍv�Z���Ă������B
pH ���A��L�_�� pKa ���P�������ƒu���ƁA
pH = pKa - 1
[H+]/10 = Ka
�ł���B
��Ɠ��l�ɑ���A���ό`����ƁA
| Ka/[H+] = | [ A- ] | = 1/10 |
| [ HA ] |
���̏����ł́A���t���� [ A- ] �� [ HA ] �� 1�F10 �ł���B 1/(1+10) = 9.09 �Ȃ̂ŁA�_�S�̂� �� 9 % ���𗣂��Ă���B
�X�ɗn�t���_���ɂ��āApH ���A��L�_�� pKa ���Q�������ƒu���ƁA���l�ɁA
| Ka/[H+] = | [ A- ] | = 1/100 |
| [ HA ] |
���Ȃ킿�A���̏����ł́A���t���� [ A- ] �� [ HA ] �� 1�F100 �ł���B 1/(1+100) = 0.0099 �Ȃ̂ŁA�_�S�̂� �� 1 % ���𗣂��Ă���B
���� pKa �����_ HA ���A���� pKa �l���Q�ȏ㏬���� pH �̗n�t�ɂƂ����Ƃ��A�قƂ�ǂ� HA �̌`�ŗn���A�𗣂��� A- �i��������j���Ƃ�̂́A1 % �����ł���B�܂��A���l�ɁA���� pKa �����_ HA ���A���� pKa �l���Q�ȏ�傫�� pH �̗n�t�Ƃ����Ƃ��A�قƂ�ǂ� �������� A- �̌`�ŗn���A�_�^ HA ���Ƃ�̂́A1 % �����ł���B
1.60
1.59 �Ɠ��l�ɍl����B1.59�́i���W�j�̍����Q�Ƃ��邱�ƁB
�i��j
a) pKa = 4.5 �̃J���{���_
pH �� 2.5 ��菬�����Ƃ��́A99 % �ȏオ�_�^�ł���BpH �� 2.5 ���x���珙�X�Ɏ_�𗣕��t����������̑��ɂ���n�߂�BpH 3.5 �ł͋�������^�̊������� 9 % �ł���ApH 4.5 �ł͔��ʂ���������ɂȂ�BpH 4.5 �ȏ�ł́A��������̕��������Ȃ�ApH 5.5 �ł́A��������̊����� 91 % �ɒB����BpH 6.5�ȏ�̉���n�t�ł́A99 % �ȏオ��������Ƃ��đ��݂���B
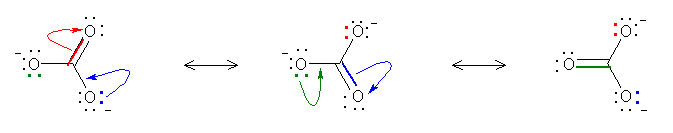
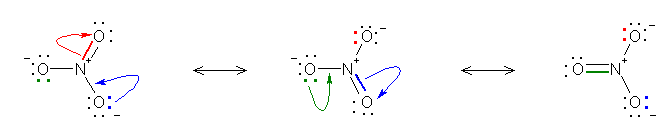
pH = 1�F �قƂ�ǂ��d�C�I�����ł���_�^
pH = 3�F �啔���i76 %�j���d�C�I�����ł���_�^�A�ꕔ�i24 %)�͓d�ׂ�����������^�B
pH = 5�F �ꕔ�i24 %�j���d�C�I�����ł���_�^�A�啔���i76 %)�͓d�ׂ�����������^�B
pH = 7, 10, 13�F �قƂ�ǂ��d�ׂ�����������^�B
b) pKa �� 9 �� RNH3+
pH = 1,3,5,7�F �قƂ�ǂ��d�ׂ����_�^ RNH3+
pH = 10�F �ꕔ�i24 %�j���d�ׂ����_�^�A�啔���i76 %)�͓d�C�I�����ł��鋤������^ RNH2�B
pH = 13�F �قƂ�ǂ��d�C�I�����ł��鋤������^ RNH2�B
c) �A���R�[���ApKa = 15
pH 1,3,5,7,10,13�F �قƂ�ǂ��d�C�I�����Ȏ_�^ R-OH
pH �� 14 �܂ŏグ�Ă��ƁA�ꕔ�i9 %�j��������^ R-O- �������邱�Ƃ��ł���B
�� �v���g�������`���A���R�[���� pKa �� -2.5 �i���ȏ� p54) �ł���̂ŁApH 0 �̎_���n�t�ł��A�_�^�ő��݂ł���̂� 1 % �ȉ��ŁA�قƂ�ǂ͋�������̃��^�m�[���Ƃ��ėn���Ă���B
1.61-1.70
1.61
1.59 �Ɠ��l�ɍl����B1.59�́i���W�j�̍����Q�Ƃ��āApH ���ƂɁA�J���{�L�V��A�A�����j�I��i�v���g���������A�~�m��j�̎_�𗣕��t���l����B
�i��j
�J���{�L�V��A�A�~�m��̏�Ԃ� pH ���ƂɎ����B
pH �� 0.34 �����̏ꍇ
-CO2H
-NH3+
pH �� 0.34
99 % �� -CO2H, 1 % �� -CO2-
-NH3+
pH �� 1.34
91 % �� -CO2H, 9 % �� -CO2-
-NH3+
pH �� 2.34
50 % �� -CO2H, 50 % �� -CO2-
-NH3+
pH �� 3.34
9 % �� -CO2H, 91 % �� -CO2-
-NH3+
pH �� 4.34
1 % �� -CO2H, 99 % �� -CO2-
-NH3+
pH �� 4.34 �` 7.69 �i���j
-CO2- �� 99 % �ȏ�
-NH3+ �� 99 % �ȏ�
pH �� 7.69
-CO2-
99 % �� -NH3+, 1 % �� -NH2
pH �� 8.69
-CO2-
91 % �� -NH3+, 9 % �� -NH2
pH �� 9.69
-CO2-
50 % �� -NH3+, 50 % �� -NH2
pH �� 10.69
-CO2-
9 % �� -NH3+, 91 % �� -NH2
pH �� 11.69
-CO2-
1 % �� -NH3+, 99 % �� -NH2
pH �� 11.69 ����
-CO2-
-NH2
a) pH 7.3 �ɂ����ẮA��́i���j�̗̈�ł���B�]���āAH3N+-CH(CH3)-CO2- �̍\�����Ƃ�B
���̍\���̂悤�ɁA�ЂƂ̕��q���ɁA���d�ׂƕ��d�ׂƂ����킹�����q�̂��Ƃ��u�o���C�I���vzwitterion �ƌĂԁB�u�����C�I���vamphoteric ion�A�܂��́A�u�o�ɃC�I���vdipolar ion �̌ꂪ�[�Ă���ꍇ������B�܂��A�u���q�����vinner salt �ƌĂԂ��Ƃ�����B
���̍\���ɂ����āA���q�S�̂Ƃ��Č���Ɠd�C�I�����ł���B
b) �ǂ̒u������d�ׂ������Ȃ��A���Ȃ킿�AH2N-CH(CH3)-CO2H �̍\�����Ƃ�悤�� pH �̗̈�͂Ȃ��B
c) �i���j�Ŏ����� 4.34 �` 7.69 �� pH �̈�ł́A�قƂ�ǑS�Ă��o���C�I���Ƃ��đ��݂��Ă���A�A���j���͑S�̓I�ɓd�C�I�����ł���B�J���{�L�V��A�A�~�m��̂����ꂩ�������̏�Ԃł���悤�Ȃ��̂� 1 % �����ł���BpH �� 1 ���� 2 ����āA1 % �� 0.1 %, 0.1 % �� 0.01 % �ɂȂ����Ƃ���ő吨�ɉe�����Ȃ����A���Ɍ����ɓ�����Ȃ�ApH = 6.02�i6.015 ���l�̌ܓ������j�ŁA�J���{�L�V��d�C�I�ɒ����ɂȂ��Ă��镪�q�̊����ƁA�A�~�m��d�C�I�ɒ����ɂȂ��Ă��镪�q�̊��������S�Ɉ�v����B
pH = 6.02 �ɂ����ẮA
-CO2H : -CO2- = 1 : 106.02-2.34
�ł��邩��A-CO2H �̏�Ԃ����A���j���̊����́A2 �~ 10-4�i0.02 %�j�ł���B�܂��A���l�ɁA
-NH2 : -NH3+ = 1 : 109.69-2.34
�ł��邩��A-NH2 �̏�Ԃ����A���j���̊������A2 �~ 10-4�i0.02 %�j�ł���B
�֑��Ȃ���v�Z���Ă����ƁApH = 7.02 �ɂ����ẮA-CO2H �̏�Ԃ����A���j���̊����́A0.002 %, -NH2 �̏�Ԃ����A���j���̊����� 0.2 % �ł���B
�i���W�j
�J���{�L�V��� pKa �� 2.34 �ƁA�|�_�ipKa = 4.76�j�ɔ�ׂĎ_���x�������B���̃A�~�m�_���A������� pKa �� 2 �O��ł��邱�Ƃ��m���Ă���B����́Aα �ʂɌ������Ă��� -NH3+ ��̓d�q�����I�U�N���ʂɂ����̂ł���Ɨ������Ă悢�B-NH3+ ��́A�d�C�A���x�̍������f�����Ɠ����ɁA���ɉדd���Ă���B���̂��߁A�����d�q��������ł���B
�i���W�Q�j
�₢�ł́A�v���g�������ꂽ�A�~�m��� pKa�i�_���x�萔�A�_�𗣒萔�j���^�����Ă���B�A�~���̂悤�ɁA�d�C�I�ɒ����Ȃ��̂�����^�ł���ꍇ�ApKb�i����x�萔�A����𗣒萔�j���p������ꍇ������̂ŁA�o���Ă����Ƃ悢�B�i�������A�������Ȃ��悤�ɒ��ӁB�j
���ɐ����̔������l����ꍇ�A���������� pKb �́A��������̋����_�� pKa �Ƃ̊ԂɎ��̊W�����藧�B
pKa + pKb = 14
R-NH3+ �� pKa �� 9.69 �ł���̂ŁAR-NH2 �� pKb �� 4.31 �ł���B
1.62
1.59 �Ɠ��l�ɍl����B1.59�́i���W�j�̍����Q�Ƃ��邱�ƁB
���ȏ��́u62b �̉v�́A���ƈ�v���Ă��Ȃ��ł��ˁB��蕶�́A�u10�{�傫���̂́v�ŁA������u100�{�傫���̂́v�Ƃ����Ƃ��̓������������Ă��܂��B
�i��j
�܂Ƃ�
pH = pKa �̂Ƃ��A�_�^�Ɖ���^�� 1:1 �ł���B�_�^�Ɖ���^�̊����́ApH �� 1 �ω����邲�Ƃ� 100:1, 10:1, 1:1, 1:10, 1:100 �ƁA�����10�{���ω�����B
�_���A�v���g�� H+ ���������`���A��������ł��邩��ApH �������i�A���J�����j���ŁA����^��������BpH ���Ⴂ�i�_���j���ł́A�_�^��������B
a) pH �� 10.4 �̂Ƃ��B�i100�{�́A102 �ł��邩��ApH �� pKa ���� 2 �����A���J�������ł���Ƃ��������B�j
b) pH �� 2.7 �̂Ƃ��B
c) pH �� 6.4 �̂Ƃ��B
d) pH �� 7.3 �̂Ƃ��B
e) pH �� 5.6 �̂Ƃ��B
1.63
1.59 �Ɠ��l�ɍl����B1.59�́i���W�j�̍����Q�Ƃ��邱�ƁB
�i��j
1.62 �̉�Ɏ������Ԏ��̂܂Ƃ߂�������x��ނ��ƁB
a) 1�F pH �� 4.9
2 : pH �� 10.7
b) 1�F pH �� 6.9�ȏ�
2 : pH �� 8.7�ȉ�
1.64
1.59 �Ɠ��l�ɍl����B1.59�́i���W�j�̍����Q�Ƃ��邱�ƁB
�i��j
50 % ������ApKa �Ɠ����ApH �� 10.4
�Ȃ��A1.61 �́i���W�Q�j�ɉ�������upKb�v���g���ƁA��蕶�͎��̂悤�ɏ�����������B
�upKa �� 10.4 �̃A�~���̃v���g�����́i�A�~���̋����_�j�� 50 % ���v
�upKb �� 3.6 �̃A�~���� 50 % ���v
1.65
��1.25 �̋L�q���悭�ǂނ��ƁB
pH �����߂邽�߂ɂ́AHenderson-Hasselbalch ���i���ȏ� p67)�i���o�͂ƂĂ��ȒP�I���W�̍����Q�Ɓj��p����Ƃ悢�B
�i��j
���̊ɏՉt���́A�|�_����ѐ|�_�i�g���E���𐅂ɗn�����Ă����Ă���̂ŁA�n�t���ɂ́A�\���ȗʂ� CH3CO2H, CH3CO2- �i����� Na+�j���܂܂��B���̂Q�̔����i���j���l������B
CH3CO2- + H+ ���� CH3CO2H
CH3CO2H + OH- ���� CH3CO2- + H2O
�����̕��t�ɂ��A�n�ɐV���ɏ��ʂ� H+ �� OH- ��������ꂽ�Ƃ��A���V���g���G�̌����i���t�ړ��̌����j�ɂ��A������ꂽ H+ �� OH- ������������ɕ��t�������B���̂��߁AH+ �� OH- �Z�x�̏㏸�́A�V���Ɍn�ɉ�����ꂽ�ʂ��̂��̂��������Ə������Ȃ�B���̂��߁ApH �ω����ɂ₩�ɂȂ�B
�i���jH+ ����� OH- �Ƃ̔������A�ʂ̕��t���Ƃ��ď����Ă��邪�A�������t�����E�����ւ��āA��x�J��Ԃ��ď����Ă���ɂ����Ȃ��̂͂������肾�낤���B�]���āA���̕��t���݂̂������Ώ\���ł���B
CH3CO2- + H+ ���� CH3CO2H
���ʂ̎_��������ƁA���V���g���G�̌����ɂ��A���̕��t���E�ɂ���A���ʂ̉����������ƁA���V���g���G�̌����ɂ��A���̕��t�͍��ɂ����B
�i���W�j
Henderson-Hasselbalch ���̓��o�i�ƂĂ��ȒP�ł��B�����╪�q����̊W���ԈႦ�Ȃ��悤�ɁA���̓s�x�A���o����̂��ǂ���������܂���ˁB�j
�_ HA ���𗣕��t�ɂ�����̂Ƃ���B
HA ���� H+ + A-
�_�𗣕��t�萔�i�_���x�萔�j Ka �́A�����B
| Ka = | [ H+ ] | [ A- ] |
| [ HA ] | ||
| �@ = | [ H+ ] | �~ | [ A- ] |
| [ HA ] |
�i�Q��ڂ̂悤�Ɏ��ό`�����̂́ApH�i= -log10[ H+ ] �j�����肾��������������ł��B�j
�����ŁA���ӂ̏�p�ΐ����Ƃ�A������ς��܂��B
| -log10 Ka = | -log10[ H+ ] | - log10 | [ A- ] |
| [ HA ] |
����āA
| pKa = | pH | - log10 | [ A- ] |
| [ HA ] |
| �@ = | pH | + log10 | [ HA ] |
| [ A- ] |
�������o���G�[�V����������B
pH �����߂邽�߂̎��ό`�F
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
pKa �Ƃ���ʂ����u�Ă� pH �̗n�t���̃C�I���g��������߂邽�߂̎��ό`�F
| pKa - pH = | log10 | [ HA ] |
| [ A- ] |
�i���̎��́A�_�^�Ɖ���^�̔䗦�ƁApKa �� pH �̍��̊W�Ƃ��ǂ߂�B1.59 �̔��W�̍����������Ă݂Ă��������B�j
�i���W�Q�j
�͂��߂� pH 7 �������Ă��� 60mL �̏����̒��ɁA0.1 mol/L �̐��_���i�g���E���n�t��H�����Ă����ƁA���}�̂悤�ɂP�H������������ pH �͑傫���ω����Ă��܂��B

���}�́A0.1 mol/L �̐|�_ 60 mL �̒��ɁA0.1 mol/L �̐��_���i�g���E���n�t��H�����Ă������Ƃ��̓H��Ȑ��ł���B�����t�߂ł́A��͂�P�H�O��̍��ɂ��ApH �����ɑ傫���ω����Ă���B
�������Ȃ���A�H��ʂ� 20 ���� 40 mL �t�߂ł́A���_���i�g���E���̓H���ʂ̑����ɂ�� pH �̑����́A��r�I�A�ɂ₩�ł���B

���̓H��ʂ̗̈�̂悤�ɁA�i�_��j��������ʉ����Ă��ApH ���傫���͕ω����Ȃ��悤�ȗ̈�̑g���������̂��A�ɏՉt�Ƃ����B��ʂɂ́A��_���Ƃ��̉���n�t�Ƃ������̂������B�|�_�̔��ʂ𒆘a�����_�ɂ����ẮA�_�Ƃ��̉��ʂ��܂������̂Ɠ������B
���̗̈�ŁA�n�t�� pH �����߂邽�߂ɂ́AHenderson-Hasselbalch �������L�̂悤�ɕό`�������̂�p���邱�Ƃ��ł���B
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
�i��̓I�Ȍv�Z��j
�|�_�́A��_�� pKa = 4.76 �ł���B
��_�Ȃ̂ŁA���a����Ă��Ȃ��|�_�́A���̂قڑS�ʂ� CH3CO2H �̌`�Ő��ɂƂ��Ă���A�𗣂��Ă���̂́A�i�g���E�����ɂȂ��Ă���ʂ݂̂ł���ƈ������Ƃ��ł���B��
�H��� 20 mL �̂Ƃ��A�|�_�� 1/3 �����a����Ă���ACH3CO2H �� CH3CO2Na �̔䂪 2:1 �ł���B�]���āA
�@[HA] / [A-] = 2/1
Henderson-Hasselbalch ���ɑ������B
pH = pKa - log10(2)
�@= 4.76 - 0.30
�@= 4.46
�H��� 30 mL �̂Ƃ��A�|�_�� 1/2 �����a����Ă���ACH3CO2H �� CH3CO2Na �̔䂪 1:1 �ł���B�]���āA
�@[HA] / [A-] = 1/1
Henderson-Hasselbalch ���ɑ������B
pH = pKa - log10(1)
�@= 4.76 - 0
�@= 4.76
�H��� 40 mL �̂Ƃ��A�|�_�� 2/3 �����a����Ă���ACH3CO2H �� CH3CO2Na �̔䂪 1:2 �ł���B�]���āA
�@[HA] / [A-] = 1/2
Henderson-Hasselbalch ���ɑ������B
pH = pKa - log10(1/2)
�@= 4.76 - (-0.30)
�@= 5.06
��̌v�Z�Ⴉ����킩��悤�ɁA�ɏՉt�̊�{�́A��_�Ƃ��̉��� 1�F1 �ō������Ă�����́i��_�̔��ʂ𒆘a�������́j�ł���B
- log10([HA]/[A-]) = 0 �ƂȂ邩��ł���B
�܂��A[HA]/[A-] �̔䂪���܂�傫���Ȃ����x�A���悻 5 ���� 1/5 �͈̔́i��̓H��Ȑ��ł́A�H��ʂ� 10 mL ���� 50 mL�ApH �� pKa�}0.7�j���z����ƁA�H��Ȑ��̌`���琅�_���i�g���E�����P�H���₵���Ƃ��̃O���t�̌X�������X�傫�߂ɂȂ肻���ł���B
�Ȃ��A��ʓI�ɊɏՉt���A��_�Ƃ��̉��ō쐬����̂́A�� �̉��肪���������ꍇ�̂݁AHenderson-Hasselbalch ����p���� pH ���v�Z�ł��邩��ł���B
���Ƃ��A���_�ɐ��_���i�g���E����H�������ꍇ�̓H��Ȑ������Ɏ����B

�|�_�̏ꍇ�Ɠ��l�ɁA�H��� 20 ���� 40 mL �̗̈�ł͐��_���i�g���E���̂킸���ȑ����ɑ��āApH �͋}���ɂ͕ω����Ă��Ȃ��B
�������Ȃ���A����ɑ��� Henderson-Hasselbalch ����p���� pH �����߂悤�Ƃ���Ƒ傫�Ȍ��Ɍq���肩�˂Ȃ��B
�i�Ԉ�����v�Z��j
���_�� pKa = -7 �ł���B
�H��� 30 mL �̂Ƃ��A���_�� 1/2 �����a����Ă���AHCl �� NaCl �̔䂪 1:1 �ł���B�]���āA
�@[HA] / [A-] = 1/1
Henderson-Hasselbalch ���ɑ������B
pH = pKa - log10(1)
�@= -7 - 0
�@= -7
�H��Ȑ�����ǂݎ�������悻�� pH �� 1.48 �ŁA���̌v�Z���ʂƈ�v���Ă��Ȃ��B
���_�͋��_�Ȃ̂ŁAHCl �̌`�Ő��ɂƂ����A�قƂ�ǂ��𗣂��� H+ �� Cl- �̌`�Ő��ɗn���Ă���̂ł���B���̂��߁A[HA] / [A-] = 1/1 �̕�������� �Ȃ̂ł���B�ipH = 1.48 ��^���邽�߂ɂ́A[HA] / [A-] = 3.3 �~ 10-9 �ł���B�j
1.66
�d�q�������́i���C�X����G���f�A�_�f�A�n���Q���Ȃǁj����A���C�X�_�i�z�C�I���A�P�Q���A�P�R�����f�̂悤�ɉ��������I�N�e�b�g�����Ȃ����́A�J�ڌ��f�̂悤�ɓ��k�O���id�O���Ȃǁj���g���ēd�q������邱�Ƃ��ł�����́j�Ɍ������ċȂ��������������B
�i��j
a)
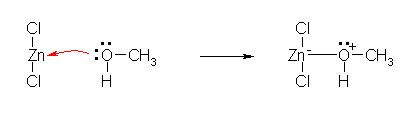
b)
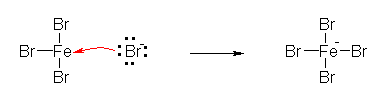
c)
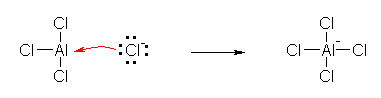
1.67
HO- �̋����_�ł��� H2O�ipKa = 15.7�j���������_�́ABrønsted - Lowry �̎_�Ƃ��ē����AHO- �� H+ ��^���邱�Ƃ��ł���B
�d�q�s���̕��ʁi�z�C�I���A�P�Q���A�P�R�����f�̂悤�ɉ��������I�N�e�b�g�����Ȃ����́A�J�ڌ��f�̂悤�ɓ��k�O���id�O���Ȃǁj���g���ēd�q������邱�Ƃ��ł�����́j������ꍇ�́A���C�X�_�Ƃ��ē������Ƃ��ł���B
�i��j
HO- �̋����_�ł��� H2O �́ApKa = 15.7 �̒l�����B
a) CH3OH �́A���Ƃقړ��� pKa = 15.5 �̒l������ Brønsted - Lowry �̎_�ł���B���̂��߁A���̕��t��������B
CH3OH + HO- ���� CH3O- + H2O
�킸���� CH3OH �̕��������_�Ȃ̂ŁA���̕��t�͂킸���ɉE�ɌX���B���t�萔�́A1015.7-15.5 = 100.2 = 1.6 �ł���BCH3OH �Ƃقړ��ʂ� OH- �������Ă��A�A���R�[���̔��ʒ��x������������ɂȂ�Ȃ��B���n�t�ł���ꍇ�ɂ́A��L���t���̉E�ӑ�Q���ɐ�������A���̔Z�x�������i���̊���ł���ꍇ�ɂ́A55.5 mol/L�j�̂ŁA���̌��ʂɂ�蕽�t�����i���������j�Ɉړ����邽�߁A���̒��x�̕��t�萔�ł́A���^�m�[���� CH3O- �ł͂Ȃ��ACH3OH �Ƃ��đ��݂���ʂ̕��������Ƒ����Ȃ邾�낤�B
b) NH4+ �́ApKa = 9.4 �� Brønsted - Lowry �̎_�ł���AHO- �̋����_�ł��� H2O �i pKa = 15.7 ) �Ɣ�ׂċ����_�ł���B���̂��߁A���̔�����������B�i�_������ł́A�����_���������āA�ア�_�������鑤�ɕ��t�������B�j
NH4+ + HO- �� NH3 + H2O
�����ɂ́A��L���������t�����ł��邪�A���̕��t�萔�� 1015.7-9.4 = 106.3 �ƁA���ɑ傫�Ȓl�ł���n�}�̐��̔Z�x�i55.5 mol/L = 101.744 mol/L �j���l�����Ă��A�����͂قƂ�NJ��S�ɉE�Ɂi���������Ɂj�i�s����B
c) CH3NH3+ �́ApKa = 10.7 �� Brønsted - Lowry �̎_�ł���AHO- �̋����_�ł��� H2O �i pKa = 15.7 ) �Ɣ�ׂċ����_�ł���B���̂��߁A���̔�����������B
CH3NH3+ + HO- �� CH3NH2 + H2O
�����ɂ́A��L���������t�����ł��邪�A���̕��t�萔�� 1015.7-10.7 = 105.0 �ƁA���ɑ傫�Ȓl�ł���n�}�̐��̔Z�x�i55.5 mol/L = 101.744 mol/L �j���l�����Ă��A�����͂قƂ�NJ��S�ɉE�Ɂi���������Ɂj�i�s����B
d) BF3 �́A�z�E�f�����d�q���U���������Ă��炸�ALewis �_�Ƃ��ē����B
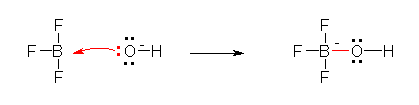
Brønsted - Lowry �̎_�|������Ƃ͂��ƂȂ�ALewis �̎_�̔����ɂ́A��������A�����_�Ƃ������T�O�͓��Ă͂߂��Ȃ��B�i���̔������A�����ɂ͕��t�ƂȂ�͂��ł��邪�A�����_�ł́A���̕��t�萔���c�_����悤�ȍޗ����Ȃ��̂ŁA�P�ɏ�L�������i�s����Ƃ��Ă����݂̂Ƃ���B�j
e) CH3+ �́A�Y�f�����d�q���U���������Ă��炸�ALewis �_�Ƃ��ē����B
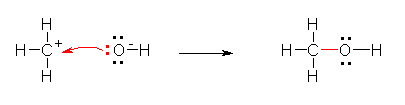
f) �J�ڋ����̃n���Q�������́A���k�� d �O�����g���ēd�q������邱�Ƃ��ł���̂ŁALewis �_�Ƃ��ē����B
g) AlCl3 �́A�A���~�j�E�������d�q���U���������Ă��炸�ALewis �_�Ƃ��ē����B
h) CH3CO2H �́ApKa = 4.76 �� Brønsted - Lowry �̎_�ł���AHO- �̋����_�ł��� H2O �i pKa = 15.7 ) �Ɣ�ׂċ����_�ł���B���̂��߁A���̔�����������B
CH3CO2H + HO- �� CH3CO2- + H2O
�����ɂ́A��L���������t�����ł��邪�A���̕��t�萔�� 1015.7-4.8 = 1010.9 �ƁA���ɑ傫�Ȓl�ł���n�}�̐��̔Z�x�i55.5 mol/L = 101.744 mol/L �j���l�����Ă��A�����͂قƂ�NJ��S�ɉE�Ɂi���������Ɂj�i�s����B
1.68
1.13 �Ɠ��l�ɍl���Ă��������B
�i��j
a) carbonic acid, �Y�_
b) carbonate, �Y�_�C�I��
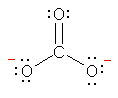
c) methanal, ���^�i�[���A���p�� formaldehyde, �z�����A���f�q�h
d) hydrazine, �q�h���W��
e) methanamine (methyl amine)
f) methanediazonium, ���^���W�A�]�j�E��
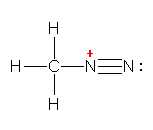
g) carbon dioxide, ��_���Y�f
h)
�� h) �� hydroxylamine �q�h���L�V���A�~�� ���琅�f�C�I������ꂽ�`�ł���B�i1.15 ���Q�Ƃ̂��Ɓj
�� f) �́A���̍\����������悤�Ɏv���邪�A�悭����ƁA�Q�̒��f�̂����E���Ŕ����q�i�I�N�e�b�g�j�����Ă��Ȃ��B�i�ŊO�k�̓d�q�����W�ɑ��肸�A�U�����Ȃ��B�j���̂��߁A��ɋ������\���̕����d�v�ł���B
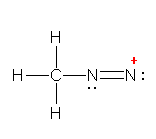
1.69
�d�q�z�u���l���A���S���q�ɂ��āA�Ǘ��d�q�̗L���i����т��̐��j�Aσ �����̐��𐔂��Ĕ��f����B
�i��j
a) sp3 �����ŁA���l�ʑ̌^�B
b) sp2 �����ŁA�O�����ʌ^�B
c) sp3 �����ŁA���l�ʑ̌^�B
d) sp2 �����ŁA�O�����ʌ^�B���ȏ� p40 �Q�ƁB
e) sp3 �����ŁA���l�ʑ̌^�B
f) sp2 �����ŁA�O�����ʌ^�B
g) sp �����ŁA�����^�B
h) sp3 �����ŁA���l�ʑ̌^�B
i) sp3 �����ŁA���l�ʑ̌^�B
1.70
�J���{�J�`�I���A�J���o�j�I���A�J���x���Ȃǂ̍\���͏��O���čl����B�܂��A
a) ��d�����͖������̂́A�V�N���v���p���͏��O���čl���邱�ƁB
b) �Y�f�́Asp2 ���������ꍇ�A�c���� p �O���ɂ��d�q���P����B���ꂪ���L�����i��̓I�ɂ� π �����j�Ɋ֗^���邽�߂ɂ́Asp2 �Y�f�͗אڂ��Ă��Ȃ���Ȃ�Ȃ��B
c) �Y�f�́Asp ���������ꍇ�A�c�����Q�� p �O���ɂ��d�q���P������Bb) �Ɠ��l�ɍl����B
�i��j
a) propane CH3CH2CH3
b) propene CH3CH=CH2
c) but-1-yne CH3CH2C��CH
but-2-yne CH3C��CCH3
1.71-1.80
1.71
1.32 �̃q���g���Q�Ƃ��Ă��������B
�i��j
a) N-methylmethanamine (dimethyl amine) �� C-N-H �̌����p�ɂ��Đu����Ă���B���̒��f�́A�R�{�� σ �����iN-CH3 �����~�Q�AN-H �����~�P�j�ƁA���f��̌Ǘ��d�q�Ƃ����B����炪�݂��ɔ�������̂ŁA���l�ʑ̌^�̍\�������B�]���āAC-N-H �̌����p�́A���悻 110�x�ł���B
b) N-methylmethanamine (dimethyl amine) �� C-N-C �̌����p�ɂ��Đu����Ă���B���̒��f�́A�R�{�� σ �����iN-CH3 �����~�Q�AN-H �����~�P�j�ƁA���f��̌Ǘ��d�q�Ƃ����B����炪�݂��ɔ�������̂ŁA���l�ʑ̌^�̍\�������B�]���āAC-N-C �̌����p�́A���悻 110�x�ł���B
c) ���̃W���`���A�����j�E���C�I���̒����̒��f�́A�S�{�� σ �����iN-CH3 �����~�Q�AN-H �����~�Q�j�����B���̂��߁A���l�ʑ̌^�̍\���������AC-N-C �̌����p�́A���悻 110�x�ł���B
d) methoxymethane (dimethyl ether) �� C-O-C �̌����p�ɂ��Đu����Ă���B�_�f�́A�Q�{�� �� �����iO-CH3 �����~�Q�j�ƁA�_�f��̂Q�̌Ǘ��d�q�����̂ŁA���l�ʑ̌^�̍\�������B����āAC-O-C �̌����p�́A���悻 110�x�ł���B
e) methanol (methyl alcohol) �� C-O-H �̌����p�ɂ��Đu����Ă���B�_�f�́A�Q�{�� �� �����iO-CH3 �����~�P�AO-H �����~�P�j�ƁA�_�f��̂Q�̌Ǘ��d�q�����̂ŁA���l�ʑ̌^�̍\�������B����āAC-O-H �̌����p�́A���悻 110�x�ł���B
f) methanal (formaldehyde�j�� H-C-H �̌����p�ɂ��Đu����Ă���BC=O �̍\���������A���̕����́Aσ ������ π �����ɂ��ł��Ă���B�]���āA�Y�f��Ō݂��ɔ����������̂́A�R�{�� σ �����iC-H �����~�Q�AC-O �����j�ł���B���̂��߁A���̒Y�f�͐��O�p�`�^�̍\���������Ă���BH-C-H �̌����p�́A���悻 120�x�ł���B
g) BF4- �C�I���̒����̃z�E�f�́A-1 �̌`���d�ׂ����B����́A���d�q�̐����i�d�C�I�����ł���z�E�f�́A���d�q���R���Ƃ�̂Łj�S�ł��邱�Ƃ������Ă���A���^���Ȃǂɂ�����Y�f�i�d�C�I�����ȒY�f�͉��d�q���S���Ƃ�j�Ɠ����ł���B�����āA���^���Ɠ��l�ɐ��l�ʑ̍\�����Ƃ�B����́A�z�E�f���S�{�� σ �����iB-F �����~�S�j�������ƂƑΉ����Ă���B���̂��߁AF-B-F �̌����p�́A���悻 110�x�ł���B
h) ethanenitrile (acetonitrile) �� C-C-N �̌����p�ɂ��Đu����Ă���B�V�A�m��i-C��N�j�̒Y�f-���f�Ԃ́A�O�d�����ł���Aσ �����P�{�� π �����Q�{�Ƃ���ł��Ă���B���̂��߁A�V�A�m��Y�f�́A�݂��ɔ����������Q�{�� σ �����iCH3-C �����ƁAC-N �����j�������A�����^�ƂȂ�B�]���āAC-C-N �̌����p�́A���悻 180�x�ł���B
i) 1.32(b) �Ɠ����Bethanamine �̂P�ʁi�A�~�m��̌����ʒu�j�̒Y�f�́A�S�{�� �Ќ����iC-CH3 �����~�P�AC-H �����~�Q�AC-NH2 �����~�P�j�������A���l�ʑ̌^�̍\�������B����āAC-C-N �̌����p�́A���悻 110�x�ł���B
1.72
����C�I��Mn+�̓d�q���́A�����ł���ꍇ���n�������Ȃ��B�i���l�ɉA�C�I���̏ꍇ�́A�����̏ꍇ��艿�������������B�j
���������āA���q�ԍ� m �̌��q mM ���琶�����C�I���AMn+�̊���Ԃɂ�����d�q�z�l�́A���q�ԍ���n�������������q�Am-nX �Ɠ����ɂȂ�B
���q�ԍ��́A���̒ʂ�B20Ca�A18Ar�A12Mg
�d�q�z�u�͎����\�̃u���b�N�ɑΉ����Ă��邱�Ƃ��Ăюv���o���Ă������B
�i��j
�d�q�z�u�́A���̒ʂ�
20Ca : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2
20Ca2+ : (1s)2(2s)2(2p)6(3s)2(3p)6
18Ar : (1s)2(2s)2(2p)6(3s)2(3p)6
12Mg2+ : (1s)2(2s)2(2p)6
20Ca2+ �̑��d�q���� 18 �ł��邩��A18Ar �Ɠ����d�q�z�u�����B�܂��A12Mg2+ �̑��d�q���� 10 �ł��邩��A10Ne �Ɠ����d�q�z�u�����B��K�X�Ɠ����d�q�z�u�i�k�\���j�����C�I���́A����ȃC�I���ł���B
�i���W�j
�����ŁA�u����ԁv�Ƃ����p�ꂪ�A�\�������̏��Ɂi�G�l���M�[�̒Ⴂ���Ɂj�d�q��z�u�������̂��w���Ă��邱�Ƃ��v���o���Ă������B���̏������щz���ăG�l���M�[�̍����O���ɓd�q�������Ă���i�G�l���M�[�̒Ⴂ�Ƃ���ɓd�q���l�܂��Ă��Ȃ��O�����c���Ă���j�悤�Ȕz�u�́A�u��N��ԁv�ƌĂ��B
1.73
��蕶���C�~�t�ł����c
�u�ɐ����傫���Ȃ鏇�v���ƁA�������ق�����傫���Ȃ鏇�ɂȂ�ׂ܂���ˁA���ʁB�ł��A�J�b�R�̒��́A�u���Ȃ킿�i���j�ł��ɐ��̑傫���������ŏ��Ɂv�Ǝw�����Ă���A�������Ă��܂��B
�J�b�R�̒��̒��߂����������߁A�{�����u�ɐ��̑傫�����̂��珇�Ɂv�Ɠǂݑւ��ē����Ă��������B
�d�C�A���x�̍���p���܂��B
�i��j
�J�b�R�̒��̒��߂��������A�{�����u�ɐ��̑傫�����̂��珇�Ɂv�Ɠǂݑւ��ĉ���B
a) C-F > C-O > C-N
b) C-Cl > C-Br > C-I
c) H-O > H-N > H-C
d) C-N > C-H > C-C
d) �ȊO�͎����\�ɂ����錳�f�̈ʒu�W�݂̂��瓚������͂��Bd) �͕\1.3 �ɖ߂��Đ��l���m�F����ƁAΔEN(C-N) = 0.5, ΔEN(H-C) = 0.4 �ł���B
1.74
��1.20�A��1.21 �������ǂݕԂ����ƁB
����Ƃ��ċ����i���d�ׂ����艻����Ă��Ȃ��j�� �����_�͎ア�B
�i��j
a) ������A�قȂ�����̌��f�Ԃł̔�r�ł́A��艺���̌��f�Ɍ����������f�̕����_���x�������BH2S �� H2O �ł́A��҂̕����ア�_�ł���B�����̋�������ɂ��čl����Ȃ�AHS- ���� HO- �̕����A��苭������ł���B
b) ���������̌��f�Ԃł̔�r�ł́A���E���̓d�C�A���x�̍������f�̌����������f�̕����_���x�������B���̂��� R �����ʂȂ�� R-OH ���AR-NH2 �̕����ア����ł���B�����̋�������ɂ��čl����Ȃ�AR-O- ��� R-NH- �̕�����������ł���B
c) �@ �����_�̍\�����l����ƁACH3OH �̋����_�� CH3OH2+�ACH3O- �̋����_�� CH3OH �ł���BpKa �Ŕ�r��������炩�Ȃ悤�ɁACH3OH2+ �̕����_���x�������B�]���āACH3OH �̕����ACH3O- ���ア����ł���B
c) �A CH3OH �� CH3O- �Ŕ�r�����Ƃ��A�O�҂͓d�C�I�����A��҂͕��ɑѓd���Ă���BH+ �͐��d�ׂ����̂ŁACH3O- �Ƃ́A�Ód���͂ň����������߁A��苭���������邱�Ƃ��ł���B�܂�ACH3O- �̕����d�C�I�ɒ����ł��� CH3OH ���� H+ �����₷���B���Ȃ킿�ACH3O- �̕�����������ł���B
��L �@�A�A �͌��Ǔ������Ƃ������Ă����ł����B
d) ������A�قȂ�����̌��f�Ԃł̔�r�ł́A��艺���̌��f�Ɍ����������f�̕����_���x�������BHCl �� HBr �ł́AHCl �̕����ア�_�ł���B���Ȃ킿�ACl- �̕��� Br- ������������ł���B
1.75
1.13 �Ɠ��l�ɍl���Ă��������B
�i��j
Kekulé �\���i���ȏ� p21�j�ł́A��������i�u���W�v�j�ŕ\���B�܂��A�Ǘ��d�q�͏ȗ��ł���i�����Ă��ǂ��B�j
�܂��A�`���d�ׂ������q������ꍇ�́A�`���d�ׂ͏ȗ��ł��Ȃ��B
�Ȃ��A���i�\�����̃��[���ł́AC �̌��f�L���ƁA���� C ��̐��f�i����т��̌������������W�j�͏ȗ������B
�ȉ��AKekulé �\���ƍ��i�\���Ŏ����B
a) ethanal ���p�� acetaldehyde
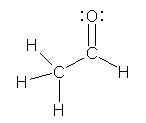
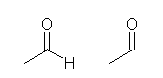
�A���f�q�h��(-CHO)�����i�\�����ŏ����ہA���̂悤�ɏ������Ƃ��ł��邪�A�E�̂悤�ɒY�f��̐��f���ȗ����ĕ\���ꍇ������B
b) methoxymethane (dimethyl ether)
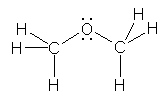
c) ethanoic acid, ���p�� acetic acid, �|�_
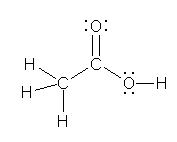
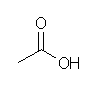
d) 2-methylpropan-2-ol (tert-butyl alcohol)
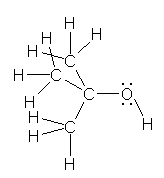
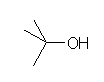
e) 3-hydroxybutanenitrile
f) 2,2,4,5-tetramethylhexane
�� ���Kekulé �\���ŁAd)�Af) �ł́A�P�ɕ`��̓s����AC-H �������������Ă���悤�ɕ`����Ă��܂����A�������邱�Ƃ��K�{�ł͂���܂���BKekulé �\���ł͒Y�f���̂S�{�̌����p�̕����ŕ`���ꍇ�������ł����A��������܂��Ă���킯�ł͂���܂���B���܂�s���R�ł͂Ȃ��悤�ɕ`����Ă���A�����̏������������Ă���A�����}�Ƃ݂Ȃ��Č��\�ł��B
1.76
1.09 �Ɠ��l�ɁB
�i��j
�����ł́A1.9 �Ɠ��l�� δ+�Aδ- �̋L����p���ď������A���Ŏ����Ă��悢�B���̏ꍇ�Aδ+ ���� δ- �̕����ɖ��������ꍇ�́A���̂����ہi�o���_�̂Ƃ���j�ɂ́A�Z���������������邱�Ƃ�Y��Ȃ��悤�ɂ���B�i���ȏ� p13 �Q�Ɓj
a) H3Cδ+-Brδ-
b) H3Cδ--Liδ+
c) HOδ--Nδ+H2
d) Iδ+-Brδ-
e) H3Cδ+-Oδ-H
f) (CH3)2Nδ--Hδ+
1.77
�Ǘ��d�q�𐔂����Ƃ��Ȃ����ƁB
�i��j
a) sp2 �����B
b) �Q�g�̌Ǘ��d�q������Bsp2 �����B
c) �Q�g�̌Ǘ��d�q������Bsp3 �����B
d) �P�g�̌Ǘ��d�q������Bsp �����B
e) �P�g�̌Ǘ��d�q������Bsp2 �����B
f) �Q�g�̌Ǘ��d�q������Bsp3 �����B
1.78
a) d) �͒������q�Ƃ��čl���Ă��������B
b) c) �́A�������q�Ƃ��čl���邱�Ƃ͂ł��Ȃ��ł��B��������P���̗z�C�I���Ƃ��Ă��A�P���̉A�C�I���Ƃ��Ă��������Ƃ��\�ł����A�����Ƃ�����ӂꂽ�\���Ƃ��āAb) �͗z�C�I���Ac) �͉A�C�I���Ƃ��ď����Ă݂Ă��������B
�i��j
a)
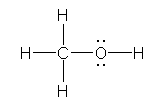
b)
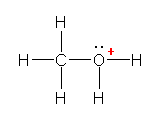
c)
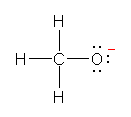
d)
1 .79
a) �ł́A�^����ꂽ Ka �����ď��ɂȂ�ׂ�B
b),c) �ł́A��1.21 �̋L�q��������x�Q�Ƃ��邱�ƁB
�i��j
pKa �͏����������AKa �͑傫�����������_�ł���B
a) �i�����_�j CH3CH2CHClCO2H �� CH3CHClCH2CO2H �� CH2ClCH2CH2CO2H �� CH3CH2CH2CO2H �i�ア�_�j
b) �������� R-CO2-�ɂ����āA�d�C�A���x�̍������q���Aσ ������ʂ��ĉA�C�I���̕��d�ׂ������A��ɍ݉����邱�Ƃň��艻��������B���Ȃ킿�A�d�q�����I�ȗU�N���ʁiI���ʁj�������B
c) �J���{�L�V��Ƃ̊Ԃ� σ �����̐��������邲�ƂɁA���̌��ʂ��������Ȃ�B�]���āA�J���{�L�V��� α �ʂ̉��f�̓J���{���_�̎_���x���ł��傫���グ��Bβ �ʁA&gunma; �ʂƉ����Ȃ�ɂ�Ă��̌��ʂ͏������Ȃ�B
1.80
1, 2, 3 �́A�T�^�I�ȒP�����A��d�����A�O�d�����̌������Ŕ��f�ł��邾�낤�B4, 5 �ɂ��ẮAs �� �̊������l���ɓ����K�v������B�i���W�j���Q�Ƃ̂��ƁB
�i��j
�ԂŎ������̂� sp3 �����������q�A�Ŏ������̂� sp2 �����������q�A�Ŏ������̂� sp �����������q�ł���B
�܂��A�w�肳�ꂽ�Q�̌�������Ŏ����A�Z������}���Ɏ������B
a)
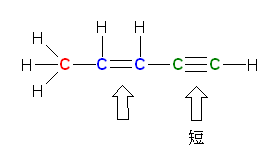
b)
c)
d)
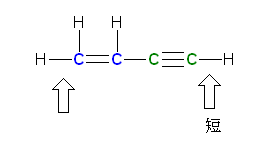
���� C-H �����́A�Y�f�� sp2 �����O���ƁA���f�� 1s �O�����琶���Ă���B�E�� C-H �����́A�Y�f�� sp �����O���ƁA���f�� 1s �O�����琶���Ă���B����āA��� s ���̍��������O�����琶���Ă���E�̌����̕����Z���B
e)
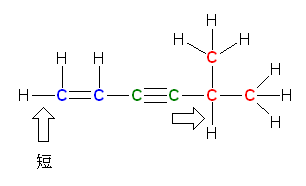
���� C-H �����́A�Y�f�� sp2 �����O���ƁA���f�� 1s �O�����琶���Ă���B�E�� C-H �����́A�Y�f�� sp3 �����O���ƁA���f�� 1s �O�����琶���Ă���B����āA��� s ���̍��������O�����琶���Ă��鍶�̌����̕����Z���B
�i���W�j
sp3 �����O���́A25 % �� s ���������A
sp2 �����O���́A33 % �� s ���������A
sp �����O���́A50 % �� s �������B
s �O���̕����Ap �O���������q�j�ɋ߂��ʒu�ɂ���O���ł���̂ŁA�����O���ԂŔ�r�����ꍇ���Asp3 �� sp2 �� sp �� s �����オ��ɏ]���āA�O������茴�q�j�ɋ߂����Ƃ��킩��B���̂��߁A���q�O�����`������̂Ɏg�p���鍬���O�����Asp3 �� sp2 �� sp �� s �����オ��ɏ]���āA�����������Z���Ȃ�X��������B
1.81-1.90
1.81
��1.24�i�₢�ԍ��ł́A1.59�`1.64�j���Q�Ƃ��邱�ƁB
�i��j
�J�b�R�̒��ɂ́A�ʓr�v�Z�������̌`�̕��q�̊����L�����B
pH = 3
a) CH3CO2H �i98.4 %�j
b) CH3CH2NH3+ (99.9 % �ȏ�j
c) CF3CH2OH (99.9 % �ȏ�j
�@�@������_�����ŁA(a) �͎_�^���ߏ�
�|�|�@�@(a) CH3CO2H �� pKa = 4.8�@�|�|
�@�@�����艖��ŁAa) �͋�������^���ߏ�
pH = 6
a) CH3CO2- �i94.1 %�j
b) CH3CH2NH3+ (99.9 % �ȏ�j
c) CF3CH2OH (99.9 % �ȏ�j
pH = 10
a) CH3CO2- �i99.9 % �ȏ�j
b) CH3CH2NH3+ (90.9 %�j
c) CF3CH2OH (99.9 % �ȏ�j
�@�@������_�����ŁA(b), (c) �͎_�^���ߏ�
�|�|�@�@(b) �� pKa = 11.0, c) �� pKa = 12.4�@�|�|
�@�@�����艖��ŁA(b), (c) �͋�������^���ߏ�
pH = 14
a) CH3CO2- �i99.9 % �ȏ�j
b) CH3CH2NH2 (99.9 %�j
c) CF3CH2O- (97.5 %�j
�Ƃ���ŁA�g���t���I���G�^�m�[���ɂ��ẮACF3CH2OH2+ �̍\���ɂ��Ă��l������K�v�����邾�낤���B
���u���̃G�^�m�[���̃v���g������ CH3CH2OH2+ �� pKa �����ȏ������t�^���Q�Ƃ��āA-2.4 �ł��邩��ACF3CH2OH2+ �� pKa �͂�������������A�����_�^���Ƃ�ɂ������Ƃ����������B���A�₢�̑I�����ɂ����āA�ł��_���ł������ pH = 3 �ɂ����āA�G�^�m�[���Ƃ��̋����_�̔�́A1 : 10-2.4-3�ł���B�]���āA�g���t���I���G�^�m�[���������_�ƂȂ��Ă���ʂ́A�����菭�Ȃ��ƌ��_�ł���̂ŁA����̖₢�͈̔͂ɂ����āA�l�����Ȃ��Ă��悢���Ƃ��킩��B
1.82
��1.21 �̗U�N���ʂɂ��ĎQ�Ƃ��邱�ƁB
b) �̖₢�̈Ӗ��́A�u�����̍\���Ƒ��ΓI�Ȏ_���x�̑召�ɂ��āv��������A�ł���B
�i��j
a) �i�����_�j CCl3CH2OH �� CHCl2CH2OH �� CH2ClCH2OH �i�ア�_�j
b) �����̕��q�ɂ����āA�_�����f�́A���_��̎_�f��̐��f�ł���B�]���āA��������̍\���́ACCl3CH2O- �Ȃǂł���B�d�C�A���x�̍������f���A���̎_�f���瓯������ σ �������͂���Ō������Ă��邪�A���̐����قȂ��Ă���B���f���q����̓d�q�����I�ȗU�N���ʁiI���ʁj�́A���f���������邱�Ƃɂ��d�˂��킳��ċ����Ȃ��Ă��邽�߁A���f�̐��̍ł��������̂Ŏ_���x�������Ƃ������A���f�̐��̌����ɔ����A�_���x�͉������Ă���B
1.83
�܂��Asp2 �Y�f��T�����ƁB
�܂��A�ǂ̖₢�̍\���̑g���A��������ł͖��Ŏ������Y�f���q���Asp2 �Y�f�Ɠ��ꕽ�ʓ��ɂ���悤�ȍ\�����Ƃ点�邱�Ƃ��\�ł���B
�����ł́A�P�����̉��̎��R��]���s�킹�Ă��A��Ɏw�肳�ꂽ�Y�f�� sp2 �Y�f�Ɠ��ꕽ�ʓ��ɂ�����̂�T���ē����邱�ƁB
�i��j
but-2-ene �� 1-methylcyclohexene �������ɍ��v����B
�Ŏ������̂��Asp2 �����Y�f�ł���B�܂��A���� sp2 �Y�f�Ƃ��Ȃ炸���ꕽ�ʓ��ɂ���͈͂��s���N�F�� σ �����Ŏ������B
1.84
���ׂ� Brønsted - Lowry �̎_-������ł���B�������ǂ���ɐi�s���邩�i���t���X�����j�́A�������̎_�A�������̎_�i�������̉���ɑ��鋤���_�j�̑��ΓI�ȋ����ɂ���Č��܂��Ă���B
�i��j
a) �������̎_�́ACH3CO2H (pKa = 4.76�j
�@�������̎_�́ACH3OH (pKa = 15.5�j
�@�����_�͔������A���ア�_��������������ɕ��t���X������A���̔����͐������������Ȃ�B
b) �������̎_�́ACH3CH2OH (pKa = 15.9�j
�@�������̎_�́ANH3 (pKa = 36�j
�@�����_�͔������A���ア�_��������������ɕ��t���X������A���̔����͐������������Ȃ�B
c) �������̎_�́ACH3CO2H (pKa = 4.76�j
�@�������̎_�́ACH3NH3+ (pKa = 10.7�j
�@�����_�͔������A���ア�_��������������ɕ��t���X������A���̔����͐������������Ȃ�B
d) �������̎_�́AHCl (pKa = -7�j
�@�������̎_�́ACH3CH2OH2+ (pKa = -2.4�j
�@�����_�͔������A���ア�_��������������ɕ��t���X������A���̔����͐������������Ȃ�B
c), d) �ł́A�������q�Ԃ̔����Ȃ̂ŁA��Ŏ��������̂ƁA�_�A����̖��������ւ�������������B���̏ꍇ�ɂ��Ă��A��Ɠ��l�Ɍ�������ƁA�����̕��t�́A���������ɑ傫���X�����Ƃ��킩��B�i�����I�ɁA�قƂ�ǐi�s���Ȃ��B�j
1.85
���S���q������ σ �����ƌǗ��d�q�𐔂���B���̂��߂ɂ́ALewis �\����`���Ă݂�Ƃ悢�B
�i��j
���d�������Ȃ�����A���S�̌��q���A���d�q���S�A�T�A�U�̂��̂́A���ׂĐ��l�ʑ̌^�\�����Ƃ�B��, ���Q
���d�q���S�� �� �S�{�̌���
���d�q���T�� �� �R�{�̌����ƂP�̌Ǘ��d�q��
���d�q���U�� �� �Q�{�̌����ƂQ�̌Ǘ��d�q��
�� ���d�������Ȃ�����A��L�u�����v�́A σ �����ƂȂ�B���d�����������A�����̂����̈ꕔ�� π �����ƂȂ�ꍇ�́A�����������d�q�i�����܂��͌Ǘ��d�q�j�̐����S�ł͂Ȃ��Ȃ�̂ŁA���l�ʑ̍\���ł͂Ȃ��Ȃ�B
���Q ���d�q�����S�ȏ�ł��A�I�N�e�b�g�����Ȃ����߈���Ȃ��̂ł͂Ȃ����A��O�Ƃ��āA carbene �J���x�� H2C: �i�Q�{�� σ ���� �ƌǗ��d�q�����j��Anitrene �j�g�����܂��̓i�C�g���� H-N �i�P�{�� σ ���� �ƒ��f��ɂQ�̌Ǘ��d�q�j�̂悤�ȍ\�����łĂ��邱�Ƃ��A�����܂�ɂ��肦��B
���S�̌��q���A�דd�q���R�̂��̂́A�ǂ̂悤�Ȍ������l���Ă��I�N�e�b�g�������Ƃ͂ł��Ȃ����R�̂ł��邪�A�R�{�̌��������B��������� σ �����ł���Ȃ�A���O�p�`�^���l���邱�ƂɂȂ�B
�����Ń��X�g�ɂ�����ꂽ���ꂼ��̍\�����݂Ă����ƁA���̂Q�����O�p�`�^�i���ʓ��R�z�ʌ^�j�̍\�������B
CH3+, BF3 �F ���`���J�`�I���̒Y�f�́A�`���d�� +1 �������Ă���A���d�q�����R�ł���B�z�E�f�����d�q�����R�ł���B��������R�{�� σ �����������Ă���B
�c��́A���ׂĐ��l�ʑ̌^�̍\�������B
H2O �F �_�f�́A�Q�{�� σ �����iO-H �����j�ƁA�Q�̌Ǘ��d�q�����B
H3O+ �F �_�f�́A�R�{�� σ �����iO-H �����j�ƁA�P�̌Ǘ��d�q�����B
NH3 �F ���f�́A�R�{�� σ �����iN-H �����j�ƁA�P�̌Ǘ��d�q�����B
NH4+ �F ���f�́A�S�{�� σ �����iN-H �����j�����B
CH3- �F �Y�f�́A�R�{�� σ �����iC-H �����j�ƁA�P�̌Ǘ��d�q�����B
���R ���W���Q�Ƃ̂���
�i���W�j
�����܂łɊw�K���Ă���g�g�݁i���d�q�A�`���d�ׁALewis�\���AKekulé�\���j�ł͐����ł��Ȃ���O�I�ȕ��q�\���Ƃ��āA�p�o�̂��̂Ɂu�W�{�����Adiborane�v�i���q���AB2H6�j������B
����́A�{���� borane�ABH3 �̓�ʑ̂ł���B
���q�S�̂Ƃ��ēd�ׂ������Ȃ��d�C�I�����̍\���ł��邩��A�z�E�f�̉��d�q�����R�Ƃ��Đ�����ƁA�z�E�f���R�{�̌����������A�ŊO�k�d�q���U�ƂȂ��ăI�N�e�b�g�����Ȃ��\�����l���邱�ƂɂȂ�B
�������A���ۂɊϑ�����Ă���W�{�����̍\���͔��ɓ���ł���B
�O�������N wikipedia �W�{����
�z�E�f���S�{�̌����������Ă���B�܂��A���f���q���Q�{�̌����������Ă���B�iB-H-B �́A�ʏ�͂P�{�̋��L�����œd�q���Q�g�p����̂ɑ��A�R�̌��q�̊Ԃɂ���Q�{�̋��L�����ɑ��d�q���Q�g�p����悤�ȓ���Ȍ����Ȃ̂ŁA�u�O���S��d�q�����v�ƌĂ��B�j
���̂悤�ȍ\����������邽�߂ɂ́A����̂Q�̌��q���A���q�O�����o�������Č����̂��߂̋O��������Ƃ����T�O���z���āA�Q�̃z�E�f�A�U�̐��f�ɑ��ĕ��q�O��������Ă����K�v������B�����ł́A���̈����̏ڍׂ́A���݂̊w�K�͈̔͂���̂ŏȗ����邪�A�u�O���S��d�q�����v�Ƃ������t����킩��悤�ɁA�z�E�f�|���f�|�z�E�f�̂R�̌��q�ɂ܂������čL�������������̕��q�O��������A�����ɓd�q���Q�����Ă���B
�܂��A��L�����N��̐}���݂Ă킩��悤�ɁA�z�E�f���S�{�̌����������Ă���ɂ��ւ�炸�A�����Q�{�� B-H �����ł���̂ɑ��A�c��Q�{�́i��������͂��̓d�q�̖��x���AB-H �Ԃŏ������iB-H-B �����Ƃ��ĂQ�̓d�q�������Ă��邩��AB-H ���ł͒P���ɂ����Δ����j�̂ŁA�����̑傫�����ϓ��ł͂Ȃ��B���̂��߁A���l�ʑ̌^�̌����p����傫������Ă���B
1.86
���ꂼ��̒Y�f���ƂɁAσ �����̐��𐔂��邱�ƁB
�i��j
�ԂŎ������̂� sp3 �����������q�A�Ŏ������̂� sp2 �����������q�A�Ŏ������̂� sp �����������q�ł���B
sp3 �����Y�f�𒆐S�Ƃ��������p�͖�110�x�Asp2 �����Y�f�𒆐S�Ƃ��������p��120�x�Asp �����Y�f�𒆐S�Ƃ��������p��180�x�ł���B
a)
b)
c)
d)
1.87
pKa ���� Ka �����߂�Ƃ��A���d���p���邱�Ƃ����ʂł��邪�Aa) �̂悤�ɁA�ǂ͈̔͂̐����ł��邩���ÎZ�ł���Ƃ悢�B���̂悤�ȌP���́A���d���p�����ꍇ�̃~�X�^�b�`�Ȃǂɂ��ԈႢ���`�F�b�N����̂ɖ𗧂B
��`�����v���o�����ƁB
pKa = -log10( Ka )
���Ȃ킿�AKa = 10-pKa�ł���B
a) ���̂��߁Aa �� -pKa �� b �ł���悤�Ȑ��� a, b ��I��ł��悢�B�i�� pKa = 1.5 �Ȃ� -2 �� -pKa �� -1 �Ƃ����悤�ɁB�j
�i��j
1: Ka 4.0 �~ 10-4 �́A10-4 ���傫���A10-3 ��菬�����B
�]���āApKa �� 3 �� 4 �̊Ԃł���B
�d���p���Čv�Z����ƁApKa = 3.40 �i���x�ɂ��ẮA���L ���Q�Ɓj
2: Ka 22 �́A101 ���傫���A102 ��菬�����B
�]���āApKa �� -2 �� -1 �̊Ԃł���B
�d���p���Čv�Z����ƁApKa = -1.34
3: Ka 6.3 �~ 10-11 �́A10-11 ���傫���A10-10 ��菬�����B
�]���āApKa �� 10 �� 11 �̊Ԃł���B
�d���p���Čv�Z����ƁApKa = 10.20
4: Ka 7.9 �~ 10-10 �́A10-10 ���傫���A10-9 ��菬�����B
�]���āApKa �� 9 �� 10 �̊Ԃł���B
�d���p���Čv�Z����ƁApKa = 9.10
5: Ka 2.0 �~ 10-4 �́A10-4 ���傫���A10-3 ��菬�����B
�]���āApKa �� 3 �� 4 �̊Ԃł���B
�d���p���Čv�Z����ƁApKa = 3.70
�� ���Ƃ��P�̖₢�ɑ��āA3.95 �~ 10-4�A 4.05 �~ 10-4 �̐�����p���Čv�Z����ƁApKa �� 3.3925�c�A3.4034�c �ƂȂ�B�����̍��� 0.01 �Ȃ̂ŁA3.9 �~ 10-4 ��p���Čv�Z���� pKa �̒l�ɂ��ẮA3.3979�c �}0.01 �̐��x�����B�]���āA�����_�ȉ��R���߂Ŏl�̌ܓ����Ď������B
�i���W�j
�Ȃ��A���d�삪�Ȃ��Ă��A���̒l���^�����Ă���A���x�P���ŗ^�����Ă��� Ka �ɂ��Ă͂��ׂČv�Z�ł���B
log10 2 = 0.301
log10 3 = 0.477
log10 7 = 0.699
�i��j
Ka = 5 �~ 10-3 �̂Ƃ��A
pKa = -log10(5 �~ 10-3)
�@= -log10(5) - log10(10-3)
�@= -log10(10/2) - log10(10-3)
�@= -(1-0.301) - (-3)
�@= 2.301
Ka = 8 �~ 10-5 �̂Ƃ��A
pKa = -log10(8 �~ 10-5)
�@= -log10(8) - log10(10-5)
�@= -log10(23) - log10(10-5)
�@= -3log10(2) - log10(10-5)
�@= -3�~0.301 - (-5)
�@= 4.097
1.88
���f���q�̈ʒu�́A�Ód�|�e���V�����}�ɓ����Č����Ă��鍜�i���A���̍\�����Ɣ�r���ĒT�����Ƃ��ł���B
a) �d�q���x�̍����Ƃ��낪�A����̍����Ƃ���ł���B b) �̓����́u�ł���v�ł���B�ł���Ɠ����邾���ł͂Ȃ��A�u�ǂ̂悤�ɂ��ė\���ł��邩�A��ʂł��邩�v���������ƁB
�i��j
�����悻����Ȋ����i��
�Ód�|�e���V�����}�ŁA�Ԃ�������Ă���̂��ł��d�q���x�������A�]���ĉ�������������ł���B
�����̒��f�́A�S���A�����j�E�����ɂȂ��Ă��邽�߁A�Ǘ��d�q���������A����������Ȃ��B�i����ȏ� H+ �����\�͂��Ȃ��B
�Ód�|�e���V�����}�ŐԂ�������Ă��钂�f�́A�Ǘ��d�q���̕��ʓ��ɂłĂ���B���̂��߁A���̈ʒu�� H+ �������Ƃ��Ă��A��� π �d�q�̍L����i��Ǎ݉��j�ɂ͉e�����Ȃ��B
���̒��f�Q�̂����P�́A�אڂ��� π ���������邽�߁Asp2�����ƂȂ�Ap �O���ɓd�q���Q�����Ă���B���� p �O���́A�אڂ��� π �O���Ƌ������Ă���B�����A���̓d�q���g���� H+ ������Ă��܂��ƁA���̈ʒu�� π �̋�������Ă��܂��B���̂��߉�����Ⴂ�B�iπ ���������A���P����A���L���Ɠ����̉�����������Ȃ��B�j
�O���̖͎��}���������B�Ԃ̋O�����A�̕��ʓ��ɓ˂��o���Ǘ��d�q�ŁA������������ʁB�̋O�����A��d�����iπ �����j����� p �O���ƁA����̒Ⴂ���̒��f�� p �O���B�T�� p �O�������ׂē����������ނ��Ă���A����炪���킹�� π ���q�O���������Ă���A�������� π ���q�O���̒��ɂU�̓d�q�������Ă���B
1.89
��1.21 ���Q�Ƃ��邱�ƁB
�i��j
Ka �̒l���傫���قNj����_�ł���B
a) �i�����_�j CH3CH2CHClCO2H �� CH3CH2CHBrCO2H �� CH3CH2CH(OH)CO2H ��
CH3CH2CH2CO2H �i�ア�_�j
b) �J���{�L�V��� α �ʂɌ��������Ƃ��ɁA���f�̕����J���{���_�̎_���x�����߂���ʂ������B����́A�J���{���_�̋�������̕��d�ׂ������Ĉ��艻����d�q�������̗U�N���ʂ��A���_��������f�̕����������Ƃ��Ӗ����Ă���B
�P�Ƃ̌��q�P�����Ŕ�r����A�d�C�A���x�́A�L�f �� ���f �� �_�f�̏��ł��邪�A�����Ō������Ă���u����́A���_��ł���A�_�f�́A�卽�Y�f���ƁA���_��f�Ƃ̗�������d�q��������`�ɂȂ��Ă���B
1.90
���ꂼ��̌��q�̉��d�q�����猈�܂�u�����̐��ƁA�Ǘ��d�q�̐��v���ǂ��ł��邩���l���A��������悤�ɍ\���������グ�Ă����B
b), d) �͑S�̂Ƃ��ēd�C�I�����ł��镪�q�A �������AA+-B- �̂悤�ɁA�������q���ɁA���ƕ��̌`���d�ׂ��������肳������A�S�̂Ƃ��Ă͓d�C�I�����ł����̂ŁA�`���d�ׂ��A�ǂ̌��q��ɂ��Ȃ��Ƃ������Ƃ��Ӗ�����̂ł͂Ȃ��B
a), c) �̓C�I���ł���B
a) �̍\���̂����A���`���� -CH3 �������\�����́A���̒Y�f���S�{�̌����������Ă��邱�Ƃ������Ă���A�`���d�ׂ��Y�f��ł͂Ȃ��A���f���q���ɂ��邱�Ƃ������B
���ꂼ��A�Q�i�ȏ�j�̍\����������̂ŁA���Ȃ��Փx�̍������ł��B����݂�Ƃ����A���ӂ��ēǂ�ł��������B
�� a) �� b) �́A�Y�f�A���f���AC-N-N �̏��ɕ���ł���\�����l���Ă��������Bc) �́A���f����i�O�p�`�̒��_�j�ł͂Ȃ��A���ɕ��\�����l���Ă��������Bd) �͖�蕶�ɗ^�����Ă���悤�� N-N-O �̏��ɕ���ł���\�����l���Ă��������B
�i��j
a) methanediazonium, ���^���W�A�]�j�E��

1.68 (f) �ł����������������悤�ɁA���̍\�������\�ł���B�������Ȃ���A�E���̒��f���I�N�e�b�g�����Ă��Ȃ��̂ŁA���̍\�����̊�^�͏������B

b) diazomethane, �W�A�]���^��
���ׂĂ̌��q���I�N�e�b�g�����悤�ɁA���̂Q�̍\�������������Ƃ��ł���B�i�̂��ɁA�u���v�Ŋw�K����悤�ɁA���̂Q�̍\�����͂ǂ���������x�ɏd�v�������B�j
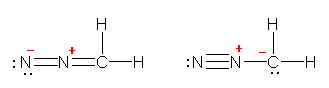
c) azide, �A�W�h�i�A�W�h�C�I���j
���ׂĂ̌��q���I�N�e�b�g�����悤�ɁA���̂Q�̍\�������������Ƃ��ł���B�������Ȃ���A�E���̍\���ł́A�`���d�ׂ��P�̒��f���q��ŏW�����āu2-�v�ƂȂ��Ă���B���̂��߁A�E���̍\���̏d�v�x�͏������B
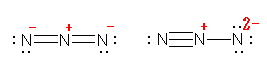
d) ��_���f�A���_�����f�A�C�K�X
���ׂĂ̌��q���I�N�e�b�g�����悤�ɁA���̂Q�̍\�������������Ƃ��ł���Bc) �ŏ������A�W�h�C�I���Ɣ�r���邱�ƁBc) �ł́A�E�̍\���łP�̒��f���q��Ɍ`���d�ׂ��W�����Ă������Ad) �̂��̈��_�����f�ł́A�i���f���q���_�f���q�ɒu����������\���ł���A���f�ɂ���ׂĎ_�f�̕������Ƃ��Ɖ��d�q�����P�������߁A�S�̂Ƃ��Č`���d�ׂ��P�������čς�ł���A�j�E�̍\���ɂ����Ă��A�_�f��̌`���d�ׂ��u1-�v�ōς�ł���B
���_�����f�ɂ����ẮA���̂Q�̍\�����̂ǂ���������x�ɏd�v�������B
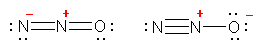
�i���W�j
b) CH2N2 ��g�����Ƃ݂Ȃ��Ȃ�AC-N-N �̕��тł͂Ȃ��AN-C-N �̕��т������̍\�����ʉ��Ƃ��Đ����ƂȂ�܂��B
carbodiimide, �J���{�W�C�~�h
��L�\���̐��f�̕������A���L����ɂȂ����悤�ȃJ���{�W�C�~�h�U���̂́A�u�E���k���܁v�Ƃ��čL���p�����鎎��ł��B�������A��L�\���̖��u���̃J���{�W�C�~�h�́A���ԕ����Ƃ��Ă͒m���Ă���悤�ł����A����ȊO�̂Ƃ���ł͂��܂�o�Ĕ������ĔA�f��^����j���߂��낤�Ǝv���܂��B
1.91-1.101
1.91
Brønsted - Lowry �̎_������̕��t���ǂ���ɐi�s���邩�́A�������̎_�Ɛ������̎_�i�������̉���ɑ��鋤���_�j�̎_���x�̈Ⴂ�Ō��܂�B�����āA���t�萔�̑召�́A�_���x�̈Ⴂ�̑召�Ō��܂�B�i�₢1.47�i���W�P�j�̍����Q�Ƃ���B�j
�i��j
�������̎_�A�������̎_�i�������̉���ɑ��鋤���_�j�̎_���x�̈Ⴂ�̑傫�����̂�T���悢�B
�������̎_ HA1 �̎_���x�萔�i�_�𗣒萔�j�� Ka1�A�������̎_�i�������̉���ɑ��鋤���_�jHA2 �̎_���x�萔�i�_�𗣒萔�� Ka2 �Ƃ����B
HA1 �{ A2- ���� A1- + HA2
��̕��t�����ɂ����镽�t�萔�́A
| Keq = | Ka1 | �i���j |
| Ka2 |
| �@ = | 10-pKa1 |
| 10-pKa2 |
| �@ = | 10(pKa2-pKa1) | �i���Q�j |
�i���j�̎��ό`�̏ڍׂɂ��ẮA�₢1.47�i���W�P�j�̍����Q�Ƃ���B
�]���āA���t�萔�̒l�����߂�ƁA
1a�j�������̎_�� CH3CH2OH�ApKa1 = 15.9
�������̎_�́ANH4+�ApKa2 = 9.4
�������̎_�̕��������ipKa ���������j�̂ŁA���̔����͔��������ɌX���Ă���AKeq �͂P��菬�����B
���Q�̎���p����ƁA
Keq = 109.4-15.9
�@ = 10-6.5
�@ = 3 �~ 10-7
1b) �������̎_�� CH3OH�ApKa1 = 15.5
�������̎_�́ANH4+�ApKa2 = 9.4
�������̎_�̕��������ipKa ���������j�̂ŁA���̔����͔��������ɌX���Ă���AKeq �͂P��菬�����B
���Q�̎���p����ƁA
Keq = 109.4-15.5
�@ = 10-6.1
�@ = 8 �~ 10-7
2a�j�i1 �̂͂��߂̔����Ƌ��ʂ���ˁH�j
�������̎_�� CH3CH2OH�ApKa1 = 15.9
�������̎_�́ANH4+�ApKa2 = 9.4
�������̎_�̕��������ipKa ���������j�̂ŁA���̔����͔��������ɌX���Ă���AKeq �͂P��菬�����B
���Q�̎���p����ƁA
Keq = 109.4-15.9
�@ = 10-6.5
�@ = 3 �~ 10-7
2b�j�������̎_�� CH3CH2OH�ApKa1 = 15.9
�������̎_�́ACH3NH3+�ApKa2 = 10.7
�������̎_�̕��������ipKa ���������j�̂ŁA���̔����͔��������ɌX���Ă���AKeq �͂P��菬�����B
���Q�̎���p����ƁA
Keq = 1010.7-15.9
�@ = 10-5.2
�@ = 6 �~ 10-6
������̔������A�قƂ�ǐ��������͐����Ă��Ȃ��B�S�i�R�H�j�̔������̒��ōł��傫�ȕ��t�萔�����̂́A�G�^�m�[���ƃ��`���A�~���̔����ł���B
1.92
�y���z�u���̉������iClCH=CHCl�j�ɂ͂Q�ِ̈��̂�����B �v�Ƃ����o�蕶�́A�u�����\�����ŕ\������������ɂ͂Q�ِ̈��̂�����B �v�Ɠǂ�ł��������B���Ȃ킿�AClCH=CHCl (1,2-dichloroethene) �̍\�����ŋ��ʂɕ\�����\���̂�������A�Q�ِ̈��́i���ِ̈��́j���l���Ă��������B
�ʒu�ِ��̂ł���CH2=CCl2 (1,1-dichloroethene) �́AClCH=CHCl (1,2-dichloroethene) �ِ̈��̂ł���Ƃ������������܂����A������܂߂čl����ƁA�o�Ɏq���[�����g�ɂ��ẮA�R���ِ̈��̂��l���ɂ���Ȃ�������Ȃ����ƂɂȂ�܂��̂ŁA�����炭�A�o��҂̈Ӑ}�ł͂Ȃ��Ǝv���܂��B
ClCH=CHCl �́A���ȏ� p37 �̃G�e���i�G�`�����jH2C=CH2 ����U�����āA�e�Y�f�ォ�琅�f�̈�������f�ɒu���������\���ł���B�]���āA�g�ݍ��킹�Ƃ��āi��d�����ɑ��ē������̐��f�Q�j�A�܂��́A�i�݂��ɓ�d�����ɑ��ċt�̈ʒu�ɂ��鐅�f�Q�j �̂Q�ʂ肪����B������u�ِ��́v�܂��́u�V�X-�g�����X�ِ��́v�Ƃ����B
�i��j
ClCH=CHCl �̂Q�ِ̊��̂̍\�����������B�܂��A���ꂼ��ɑ��AC-Cl �����̕��ɂ�Ԃ̖��Ŏ������B
�E���̍\���i�g�����X�́j�ł́A�Q�{��C-Cl �����̕��ɂ��݂��ɑł����������B���̂��߁A�o�Ɏq���[�����g�������Ȃ��B���̍\���i�V�X�́j�ł́A�Q�{��C-Cl �����̕��ɂ��݂��ɑł������������Ƃ��Ȃ��B
��}�ł͏ȗ����Ă��邪�AC-H �����ɂ��iC-Cl �����قǂł͂Ȃ��ɂ��Ă��j���ɂ�����B���̕��ɂ��A���l�ɁA�g�����X�̂ł݂͌��ɑł����������B
�y���z�}�͏ȗ����܂����A1,1-dichloroethene �������̕��ɂ͑ł����������܂���̂ŁA�o�Ɏq���[�����g�������܂��B
1.93
�����̗l���i�P�������A���d�������j�ŁA�����p���ǂ��Ȃ�̂����R���l���Ă݂邱�ƁB
�i��j
�O�d�����̒Y�f�� sp ����������Ă���Ƃ���Ȃ�A180�x�̌����p�����ꍇ�Ɉ���ŁA�����菬�����p�x���Ƃ낤�Ƃ���ƁA�Ђ��݂������邽�߁B
�̍\�������邽�߂ɁA�Ƃ邱�Ƃ̂ł���p�x���������̂ł���B
1.94
���̉𗣕��t�ƁA���̕��t�萔�������A���l�̂킩���Ă�����̂������Ă݂邱�ƁB
���̃����Z�x�� 55.5 mol/L �́A���̕��q�ʂ���v�Z�ł���B�܂��A���̃C�I���ς� 10-14 �ł��邱�Ƃ��A�N�B�ɂƂ��Ă͏펯���낤�B�����������l����A���� pKa �����߂�邱�Ƃ�m���Ă������Ƃ͏d�v�ł���B
�i��j
���̉𗣕��t
H2O ���� H+ + OH-
���̉𗣕��t�萔
| Ka = | [ H�{] | [ OH�|] |
| [ H2O ] | ||
�����ɁA�����ɂ����鐅�̃C�I���ς� 10-14 �ł��邱�Ƃ��A
[ H�{]�~[ OH�|] = 10-14
pH + pOH = 14
����āA
�@[ OH�|] = 10-14 / [ H�{]
��������B
�܂��A�����̐��̃����Z�x�� 55.5 mol/L �Ȃ̂ŁA
�@[ H2O ] = 55.5
��������B
| Ka = | [ H�{] | [ OH�|] |
| [ H2O ] | ||
| �@ = | [ H�{] | �~ | 10-14 |
| 55.5 | [ H�{] |
| �@ = | 1 | �~ 10-14 |
| 55.5 |
����āApKa = -log10 Ka �́A15.744 �ƂȂ�B
�i�ʉ��j
�w���̂܂܌v�Z���Ă݂�B��������Ă��邱�Ƃ́A��̌v�Z�Ɠ����B
| Ka = | [ H�{] | [ OH�|] |
| [ H2O ] | ||
���ApKa = pH + pOH - pH2O
�������ApH2O = -log10[ H2O ] = -1.744
����āA
pKa = 14 - (-1.744)
�@= 15.744
1.95
��1.24 �ɉ����čl���邱�ƁBH+ �̂��Ƃ�œd�C�I�����ƃC�I���Ƃ̊Ԃ̕ω����A�G�[�e���A���ւ̗n���₷����ς��邱�Ƃ���A��蕶�Ɏw�肷��n�𐫂��������߂ɂ́A�J���{���_����уA�~�������ꂼ��ǂ�������ԁi�_�Ƃ��̋�������A����Ƃ��̋����_�j�ł��邩���l���A���ŁA���̂悤�ɂȂ邽�߂ɕK�v�� pH �͈̔͂�T���B
�i��j
pKa �� 2 �ȏ㗣�ꂽ pH �ŁA�_�^�A����^�̂�����ƂȂ���̂� 99 % �ȏ�ƂȂ�̂ŁA�����ł͖ڈ��Ƃ��� pKa �} 2 �ŋ���Ď����B
heptanoic acid (pKa = 4.8�j�Ahexan-1-amine�i�����_�� pKa = 10.7�j �́A���n�t���ŁA��Ƃ���
pH �� 2.4 �ȉ��ł́A
R-CO2H�AR-NH3+ �̌`�ő��݂���B
pH �� 6.8 ���� 8.7 �ł́A
R-CO2-�AR-NH3+ �̌`�ő��݂���B
pH �� 12.7 �ȏ�ł́A
R-CO2-�AR-NH2 �̌`�ő��݂���B
�]���āA
a) ���������w�ɗn����̂́ApH �� 6.8 ���� 8.7 ���x�̗̈�ł���B�i���j
b) �J���{���_�����w�ɗn���A�A�~�����G�[�e���w�ɗn����̂́ApH �� 12.7 ���x�ȏ�̗̈�ł���B
c) �J���{���_���G�[�e���w�ɗn���A�A�~�������w�ɗn����̂́ApH �� 2.4 ���x�ȉ��̗̈�ł���B
�i���W�j
�i���j��Ɏ����� pH �̗̈�ł���A�]�T�������ď\���ɖ₢�̏����������ApKa �ɋ߂��̈�� pH �̗n�t��p����ƁA���ۂɂ͂����ƕ��G�ł���B
���Ƃ��ApH = 4.8 �̐��n�t���ŁA�J���{���_�́A���̔��ʂ��_�^�A���ʂ�����^�ƂȂ��Ă���B���̂��߁A������G�[�e���w�ɐG�ꂳ����ƁA���ʂ����ɗn���A���ʂ��G�[�e���ɗn����ƍl���Ă��܂����������A���̂悤�ɒP���ł͂Ȃ��B
�͂��߂ɐ��n�t�݂̂��������Ƃ��āA���ʂ��_�^�A���ʂ�����^�ɂȂ��Ă���悤�Ȍn���A�G�[�e���w�ƐU�荬����ƁA�_�^�̕��q���G�[�e�����ɗn�����ށB���̂��Ƃɂ��A���n�t���ł́A���V���g���G�̌����ɂ��A����^���q���_�^�ɕω����A�_�^�Ɖ���^�����ʂɂȂ�悤�ɕ��t�ړ���������̂ł���B
�܂��A���̂Ƃ��A�_�^�̕��q�� 100 % ���S�ɃG�[�e���w�ɗn����킯�ł��Ȃ��B�����ɂ́A���z���t�i�_�^�̕��q���A���w�ƃG�[�e���w�̂ǂ���ɗn���邩�̕��t�j������B�i�����A���ɁA�_�^�̕��q�� 100 % ���S�ɃG�[�e���w�Ɉڂ�̂��Ɖ��肷��ƁA��L�̐��n�t���̎_�𗣕��t�̈ړ������邱�Ƃɂ��A�ǂ�� pH �̐��n�t������A���ׂẴJ���{���_���G�[�e�����ɗn������ł��܂��Ƃ�����������_�ɂȂ�B�j�i�����l�Ƃ��āA�������_��p�����Ƃ��A���̕��z�W���i�_�^�̒P�ʑ̕��q�̕��z���t�萔�j�� 1/10 �` 10 ���x�͈̔͂̒l�ł���悤�ł��B�j
���m�Ȓl���킩��Ȃ��̂ŁA�܂��A�v�Z���ȒP�ɂ��邽�߂ɁA���ɁA���̕��z�W���� 1 �Ƃ��A���n�t�A�G�[�e���̑̐ς��Ƃ��āA���n�t�� pH �� 4.8 �Ƃ���Ȃ�A���w�Ŏ_�^�̕��q : ���w�ʼn���^�̕��q = 1 : 1�A���A���w�Ŏ_�^�̕��q : �G�[�e���w�Ŏ_�^�̕��q = 1 : 1 �Ƃ����䂪��ɐ��藧���ƂɂȂ�A�G�[�e���w���ɂ̓J���{���_�̑S�ʂ� 1/3 ���n���邱�ƂɂȂ�B
�������A�܂��b�͏I���ł͂Ȃ��B�G�[�e�����ŁA�J���{���_�͂Q���q����Ă��邱�Ƃ��m���Ă���B�Q���q��̂́A�قƂ�ǐ��ɗn���邱�Ƃ͖����̂ŁA�G�[�e���ɗn�����_�^�̕��q���A�P�ʑ̂���Q�ʑ́i��́j�ɂȂ邱�ƂŁA�G�[�e�����̎_�^�i�P�ʑ́j���q������B����ɂ�胋�V���g���G�̌����ɂ��A���w����G�[�e���w�֎_�^�̕��q���n������ł���B���̂��߁A�g�[�^����1/3 ��肸���Ƒ����̗ʂ̃J���{���_���A�G�[�e���ɗn������ł��邱�Ƃ��ł���̂ł���B���̗ʂ́A�G�[�e�����̉���t����ʑ̑��ɑ傫���X���قǁA�傫���Ȃ邱�Ƃ͂������肾�낤�B�܂��A����t�́A�Z�x�������قǓ�ʑ̑��ɕ��t���X���A�Z�x���Ⴂ�ꍇ�͒P�ʑ̑��ɕ��t���X���i���V���g���G�̌����ɂ������ł���j�̂ŁA���ǂ̂Ƃ���A�ǂ������Z�x�Ŏ������邩�ɂ���Ă��A�ǂꂾ���̗ʂ��G�[�e���ɗn����̂��A�Ƃ����l���ω�����Ƃ������ƂɂȂ�B
1.96
�l�����́A1.95 �Ɠ����B���ƁA�W�G�`���G�[�e���Ȃǂ̗L�@�n�}��p���ĕ������邱�Ƃ��ł���B���_����ѐ��_���i�g���E���n�t��p���Đ��n�t�� pH �����邱�Ƃɂ��A�e�������̐����A�L�@���ւ̗n���₷����ω�������B��̓I�ɂǂ̂悤�� pH �ɂ���ƁA�ǂ̕������ǂ̂悤�ɕ����ł���̂����������ƁB
�i��j
pKa �� 2 �ȏ㗣�ꂽ pH �ŁA�_�^�A����^�̂�����ƂȂ���̂� 99 % �ȏ�ƂȂ�̂ŁA�����ł͖ڈ��Ƃ��� pKa �} 2 �ŋ���Ď����B
���ꂼ�ꉻ�����́A��ł���`�i�_�^���A����^���j���BpH ���ƂɎ����B
�������A�N�����x���[���͂��ׂĂ̗̈�ŁA�_�|������������Ȃ��B
pH �� 2.2 ���x��菬�����ꍇ
�@PhCO2H
�@PhNH3+
�@PhOH
�@C6H11PhNH3+
pH �� 6.6 ���� 8.0 ���x�͈̔͂̏ꍇ
�@PhCO2-
�@PhNH2
�@PhOH
�@C6H11PhNH3+
pH �� 12.6 ���x�ȏ�̏ꍇ
�@PhCO2-
�@PhNH2
�@PhO-
�@C6H11PhNH2
�_��������͂��߂�ꍇ�B
���_�_���Ƃ������n�t�ipH �� 2.2�j�ɂ����T��̉�����������A�G�[�e���Œ��o����B���̂Ƃ��A�L�@�w�ɗn�����ނ̂́A�������_�A�N�����x���[���A�t�F�m�[���ł���B���w�ɂ̓A�j�����ƃV�N���w�L�V���A�~�����A���ꂼ�ꉖ�_���̌`�ŗn���Ă���B
�������_�A�N�����x���[���A�t�F�m�[���̗n�����G�[�e���w�́ApH �� 6.6 ���� 8.1���x�̐��n�t�Œ��o����ƁA�������_�݂̂����ƂȂ�A���w�Ɉڂ�B���ɁApH �� 12 ���x���傫���A���J�����̐��n�t�Œ��o����ƁA�t�F�m�[�������Ƃ��Đ��w�Ɉڂ����Ƃ��ł���B�N�����x���[���͍Ō�܂ŗL�@�w�Ɏc��B
�Q��̃A�~�������Ƃ��ĉ����Ă���_���̐��n�t�́A���_���i�g���E���������� pH ������BpH �� 6.6 ���� 8.7 ���x�̊Ԃɂ��Ă��A�A�j�����݂̂�����^�ɂ��ǂ�A�G�[�e���Œ��o���邱�Ƃ��ł���悤�ɂȂ�B�V�N���w�L�V���A�~���͐��n�t���ɉ��_���Ŏc��B
�������͂��߂�ꍇ�B
����Ƃ������n�t�ipH �� 12.6�j�ɂ����T��̉�����������A�G�[�e���Œ��o����B���̂Ƃ��A�L�@�w�ɗn�����ނ̂́A�A�j�����A�V�N���w�L�V���A�~���A�N�����x���[���ł���B���w�ɂ́A�������_�A�t�F�m�[�������Ƃ��ėn���Ă���B
�A�j�����A�V�N���w�L�V���A�~���A�N�����x���[���̗n�����G�[�e���w�́ApH �� 6.6 ���� 8.7 ���x�̐��n�t�Œ��o����ƁA�V�N���w�L�V���A�~���݂̂����ƂȂ�A���w�Ɉڂ�B���ɁApH �� 2.6 ���x���������Ȏ_���̐��n�t�Œ��o����ƁA�A�j���������Ƃ��Đ��w�Ɉڂ����Ƃ��ł���B�N�����x���[���͍Ō�܂ŗL�@�w�Ɏc��B
�������_�ƃt�F�m�[�����n���Ă��鉖��̐��n�t�́A���_�������� pH ������BpH �� 6.2 ���� 8.0 ���x�̊Ԃɂ��Ă��A�t�F�m�[���݂̂��_�^�ɖ߂�A�G�[�e���Œ��o���邱�Ƃ��ł���悤�ɂȂ�B�������_�͐��n�t���Ƀi�g���E�����Ƃ��c��B
1.0 mol/L �̉��_���ApH = 0 �̐��n�t�A1.0 mol/L �̐��_���i�g���E���� pH = 14 �̐��n�t�A������ pH = 7 �̐��n�t�Ƃ��ď�L�̔����܂ɗp���Ă悢�B
pH �����Ăقڒ����ɂ���ߒ��ł́A�قړ��ʂ̉��_�A���_���i�g���E����������悢�̂����A�킸���ł�������ߏ�ɂȂ�ƁApH �͒����̈悩��傫������Ă��܂��̂ŁA���̎��ɂ� pH �������� pH ���[�^�Ȃǂ�p���Ȃ��ƁA���ۂ̎����ł͂��܂������Ȃ��B
1.97
��1.13 ��A���1.27 ���W����B���Ȃ킿�A���q�̃T�C�Y���猋���������܂�B���������قȂ�Ƃ������Ƃ́A�����̋������قȂ�Ƃ������Ƃ��Ӗ�����B
���q�O���_�i���ȏ���1.6�j�ɂ��ẮA�₢ 1.19 �ōs�����c�_���v���o�����B�܂�A���ȏ� p28 �̐}�̂悤�ɁA�������̕��q�O���Ɣ��������̕��q�O��������ꍇ�A�d�q�z�u���A����Ԃ̐��f���q H2 �̂悤�� (������ σ)2 �ł���Ȃ�A���q������ł���B���z�I�ȃw���E���Q���q���q He2 �̂悤�� (������ σ)2(�������� σ*)2 �ƂȂ�ƁA���q�Ƃ��Ă̈��萫�������A���̂Q�̌��q�ɉ𗣂���B���l�ɁA���鉼�z�I�ȕ��q�ɂ��āA�����A(������ σ)1(�������� σ*)1 �Ƃ����d�q�z�u��������Ȃ�A���̕��q�����l�ɕ��q�Ƃ��Ă̈��萫���������ƂɂȂ邾�낤�B
����́A�������� (������ σ)2 �ɂ��镪�q�ɁA������ σ �O���ƁA�������� σ* �̍��ɑ�������G�l���M�[��������iσ�O���̓d�q���A���������� σ* �܂ŗ�N����j���Ƃ��ł���A��������������Ƃ��ĕ��q���𗣂��邱�Ƃ������B
�n��ɓ͂��̈�̔g���̌��́A���f���q�� σ �d�q���N����̂ɏ\���ȃG�l���M�[�������Ȃ����A�L�f���q�� σ �d�q���N���邱�Ƃ��\�ł���B
�i��j
1.98
�₢ 1.47 �i���W�P�j���Q�Ƃ̂��ƁB
Keq = [������]/[������] �Ƃ����\�L�́A�Ȃ�����������˂Ȃ��ł��ȁB
���t�萔�̒�`����AKeq = �������̊e�Z�x�̐� / �������̊e�Z�x�̐� �Ȃ킯�ł����A���̂��Ƃ������Ă���̂��Ǝv���܂��B
�i��j
�₢ 1.47 �i���W�P�j���Q�Ƃ̂��ƁB
1.99
�ɏՉt�̈����ɂ��ẮA�₢ 1.65 �́i���W�Q�j�̍��Ȃǂ��Q�Ƃ��Ă��������B
��蕶�ɁA�u�Y�_�^�Y�_���f�C�I���v�̊ɏՌn�ɂ��čl����A�Ǝw������Ă���B
�Y�_�� H2CO3�A���̋�������ł���Y�_���f�C�I���� HCO3- �ł���B�]���āA�Y�_�ipKa = 6.1�j�̎_�𗣕��t
H2CO3 ���� H+ + HCO3-
���l���邱�ƂɂȂ�B
���̏ꍇ�̗n�t�� pH �́AHenderson-Hasselbalch ����ό`���������ŗ^������B
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
�i��j
�܂��́A�萫�I�����Ă������B
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
���A�����Ė₢1.65�i���W�Q�j�ł���������悤�ɁA�_�̔��ʂ����a����Ă���_�i[HA] = [A-]�̓_�A1.65�i���W�Q�j�̒��a�H��Ȑ��ł́A�A���J���̓H��ʂ� 30mL �̓_�j�ł́ApH �� pKa �ƂȂ�̂ł������B
����́A�B�������� pH ����������A���J�����ł��邩��A��������^�̗ʂ���葽���Ȃ��Ă���͂��ł��邩��A[HA] �� [A-] �ł���B�j
��ʓI�Ɉ����B
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
�ɁA�Y�_�iHA�j�� pKa = 6.1 ��������B
�܂��AHA �� H2CO3�AA- �� HCO3- �ł���B
pH = 7.4 ��^���邽�߂ɂ́A
| 7.4 = | 6.1 | - log10 | [ H2CO3 ] |
| [ HCO3- ] |
�ł��邩��A
| log10 | [ H2CO3 ] | = -1.3 |
| [ HCO3- ] |
�]���āA[ H2CO3 ] : [ HCO3- ] = 1 : 20 �łȂ���Ȃ�Ȃ��B
��L�̔Z�x�䂪�B���ł��Ă�������A�ǂ̂悤�ȉߒ��ŗn�t���쐬���悤���\��Ȃ��B�������Ȃ���A���ۓI�Ȗ����l����ƁA���ɓ�_���Y�f����n���������̂��Y�_�ł��邩��A���̍��Z�x�̒Y�_�n�t���������āA���� 20/21 �ɑ�������ʂ𐅎_���i�g���E���ȂǂŒ��a����̂́A���삪�����������Ȃ��B���Z�x�̒Y�_���f�i�g���E���n�t��p�ӂ��Ă����A���̂����� 1/21 �̗ʂ����_�Ȃǂ̋��_�Œ��a���Ă��̂��ǂ������ł���B
�� ��_���Y�f�͋C�̂ł��邩��A���ʂ𐳊m�ɂ͂���Ƃ�̂��ʓ|�ł���B���ɗn�����Ƃ��A����������_���Y�f�̈ꕔ���n�O�ɓ����Ă��܂����肹���A�S�ʂ��n�������Ƃ��m�F����̂�����B�܂��A�n�t�̉��x�ɂ���ẮA�n��x�����܂�傫���Ȃ��B
1.100
�_ HA �̎_�𗣕��t�萔�i�_���x�萔�j Ka �́A�����B
| Ka = | [ H+ ] | [ A- ] |
| [ HA ] | ||
| �@ = | [ H+ ] | �~ | [ A- ] |
| [ HA ] |
�����ɐ��f�C�I���Z�x [H+] �܂��͐��f�C�I���Z�x�w�� pH ���w�肵�Ă��ƁA[HA] �� [A-] �̔Z�x�䂪���܂�B
���邢�́A���ӂ̑ΐ����Ƃ�X�ɕό`���� Henderson-Hasselbalch �� ��p���Ă��悢�B
�i��j
Henderson-Hasselbalch �������̂悤�ɕό`���ėp����B
| pKa - pH = | log10 | [ HA ] |
| [ A- ] |
����āApKa = 5.3�ApH = 5.7 �Ȃ̂ŁA
| log10 | [ HA ] | = pKa - pH = - 0.4 |
| [ A- ] |
����āA[ HA ] : [ A- ] = 1 : 100.4 = 1 : 2.5
�i�����ŁA�K�� [ HA ] �� [ A- ] �̑召�W���ApH �Ƃ̊W�Ŋm�F�����Ă������B��� log �̑O�̕���������ւ������Alog �̒��̕��q��������ւ��邾���ŁA���̑召�W���t�]���Ă��܂�����A���̊o���ԈႢ�ŊԈ�����������Ă��܂�Ȃ��悤�A����Henderson-Hasselbalch ����p���Ȃ��Ă��A�召�W�����͔��f�ł���悤�ɂ��邱�ƁB���Ȃ킿�A���̏ꍇ�́ApH ���ApKa �����傫���i�A���J�������j�ł��邩��AHA ��� A- �̕����Z�x�������Ȃ��Ă���B�j
a) 1/(1+2.5) = 0.29�B����āA29% �� HA �̌`�ŗn���Ă���B
�i���ApKa �� pH �̍��i5.7-5.3�j���A0.35 ���� 0.45 �̌덷�͈͂����ƍl����ƁAHA �̊����́A26 % ���� 30 % �͈͓̔��̂ǂ����ɂ���Ƃ������ƂɂȂ�B�j
b) �_�� 80 % �� HA �̌`�Ƃ��đ��݂���Ȃ�A[ HA ] : [ A- ] = 4 : 1 �ł���B�iHA �̕��������̂�����ApKa �����������i�_�����́jpH �̗n�t�łȂ���Ȃ�Ȃ��B�j
log104 = 0.6
����āApH = 5.3 - 0.6 = 4.7 �ł���B
1.101
�_ HA �ɂ��āA�S�Z�x�� C �Ƃ����B�����ŁA�S�Z�x�Ƃ́A�𗣑O��̕��q��̔Z�x�̘a�Ȃ̂ŁAC = [HA] + [A-] �ł���B
���_�ipKa��0)�ł���A�ق� 100 % ���𗣂���̂ŁAC = [A-] �ł���B���ɂ��̎_�݂̂�n�������ꍇ�ŁA���̔Z�x�� 1 �~ 10-5 mol/L ����ł���A[H+] = [A-] �Ȃ̂ŁA�n�������_�̗ʂ݂̂��� pH �������ɎZ�o�ł���B
�������A��_�̏ꍇ�́A���ɗn�������_�̂����A�����ꕔ�݂̂��𗣂��Ă���̂ŁA���f�C�I���Z�x���_�̑S�Z�x�ɓ������Ȃ�Ȃ��̂ŁA�_�̉𗣓x���l�����Ȃ��Ă͂Ȃ�Ȃ��B
�_�̉𗣓x�́A��ʂ� α �̕�����p����B���̒l�͈̔͂́A0 �� α �� 1 �ŁA���_�̏ꍇ�́Aα = 1 ����ɐ��藧�Ƃ݂Ȃ����Ƃ��ł���B��_�̏ꍇ�́Aα �̒l�́A�_�̔Z�x�ɂ��ω�����B�i�Z�x���Ⴂ�قǁAα �͑傫���Ȃ�B�j
�_�̑S�ʂ̂����A�𗣂��Ă��銄���� α �Ȃ̂ł��邩��A���̊W������������B
[A-] = C �~ α
[HA] = C �~ (1 - α)
�܂��A���̎_��n�����Ă��Ȃ��ȂǁAH+ �����A���̎�_�݂̂ł���ꍇ�́A
[H+] = [A-] = C �~ α
����������B
�����R�̊W�����A�_�𗣒萔 Ka �̎��ɑ������B
| Ka = | [ H+ ] | [ A- ] |
| [ HA ] | ||
| �@ = | Cα �E | Cα |
| C(1-α) | ||
| �@ = | Cα2 |
| (1-α) |
�����ŁAKa �́A�_�̎�ނ�I�ׂΌ��܂�萔�BC �́A���̎_�̑S�Z�x�i�n�������Z�x�j�ŁA�����������ƂɌ��܂��Ă���萔�Bα �́A0 ���� 1 �͈̔͂ɂ���A���m�̒l�ł���B
�]���āA�㎮�̉E�ӂ̕������Aα �̓������Ƃ��ĉ����Ă��i���̌�����p������Ȃ炸�������ł�̂Łj�A�ߎ���p�����ɁA������ α �����߂邱�Ƃ��ł���B
��_�ŁAα �� 1 �Ɣ�r���ď\���ɏ������iα �� 0.05 ���x�j�ł���ꍇ�ɂ́A���̋ߎ���p���邱�Ƃ��ł���B
α �� 1
�Ȃ̂ŁA1 - α �� 1 �Ƃ݂Ȃ��B ����ƁA
| Ka = | Cα2 |
| (1-α) |
| �@ = | Cα2 |
| 1 |
�]���āA
| α2 = | Ka |
| C |
�i��j
�q���g�̉�����Q�Ƃ���B
α �� 1 �Ƌߎ�����ƁA1 - α �� 1 �Ƃ݂Ȃ����Ƃ��ł��A
| Ka = | Cα2 |
| (1-α) |
| �@ = | Cα2 |
| 1 |
�]���āA
| α2 = | Ka |
| C |
����āAα = ��(Ka/C)
�̊W��p���邱�Ƃ��ł���B
a) α �� 1 �Ƌߎ����邱�Ƃ��l����B
α = ��(Ka/C)
�@= ��(10-4.76)
�@= 10-2.38
�@= 0.0042
���̒l�́A1 �Ɣ�ׂď\���ɏ������̂ŁA1 - α �� 1 �̋ߎ���u�������Ƃ��������������Ƃ��m�F�ł���B
�]���āA
[H+] = Cα
����āApH = 2.38
b) α �� 1 �Ƌߎ����邱�Ƃ��l����B
α = ��(Ka/C)
�@= ��(10-10.7/0.1)
�@= 10-4.85
�@= 0.000014
���̒l�́A1 �Ɣ�ׂď\���ɏ������̂ŁA1 - α �� 1 �̋ߎ���u�������Ƃ��������������Ƃ��m�F�ł���B
�]���āA
[H+] = Cα
����āApH = 5.85
c) Henderson-Hasselbalch ����p����B
| pH = | pKa | - log10 | [ HA ] |
| [ A- ] |
| �@ = | 3.76 | - log10 | 0.3 |
| 0.1 |
����āApH = 3.28
�i���߂����l�ɑ��A�^����ꂽ������ [HA] �� [A-] �ł��邱�Ƃ���A������ pH ���ApKa ��菬�����i�_�����j�͂��ł��邱�Ƃ��m�F���Ă������ƁB�j