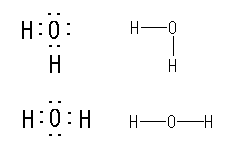
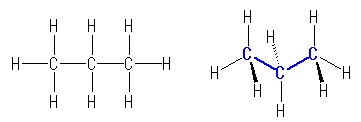
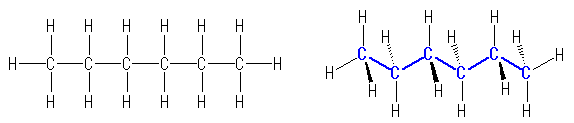
1.00
教科書 p1 の5種類の構造式について、分子の形を以下に示した。
(解答例)
(表示されている構造をクリックすると、3次元分子模型のリンクを開きます。マウスでぐりぐりしてみてください。)
ロフェコキシブ
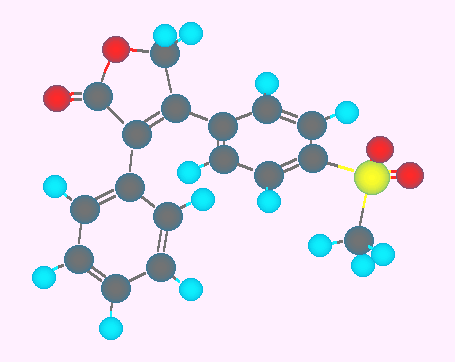
シルデナフィル
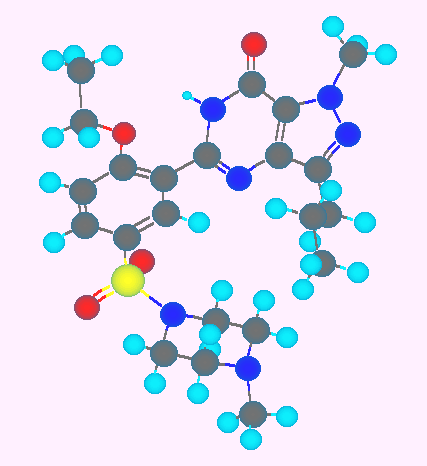
オキシコドン
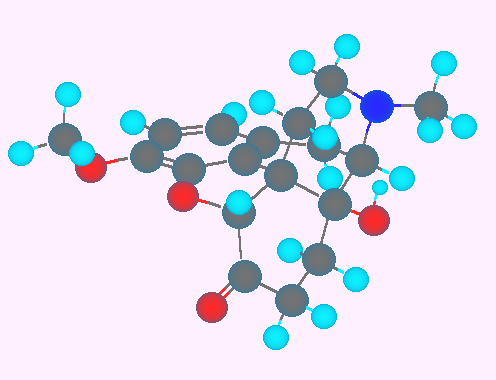
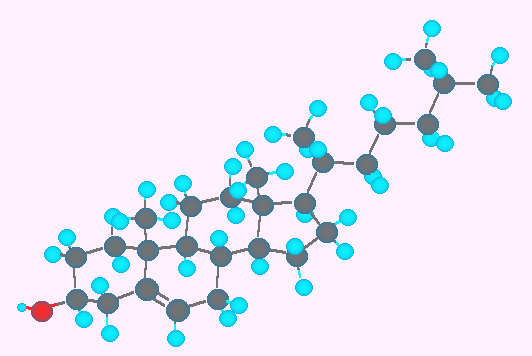
コレステロール
ベンジルペニシリン
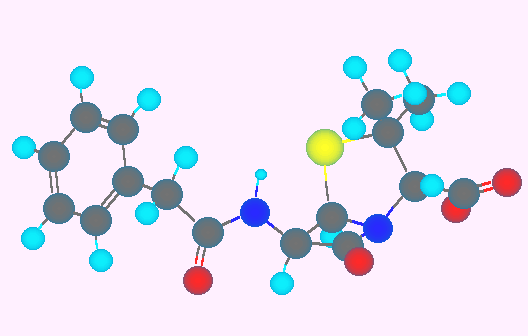
1.01-1.10
1.01
まずは、それぞれの元素の原子番号を周期表で調べること。
教科書 1.3 節、「原子の構造:電子配置」の構成原理に従って電子配置を書くこと。はじめは、教科書 6ページの、図 1.4 のように、各軌道をエネルギーの低い順から並べて描く。なお、このとき、同じエネルギーを持つ複数の軌道(たとえば p は3つ、d は5つ)がある場合は、電子が入る入らないに関わらず全て示すこと。
(解答例)
上図のような電子配置となるから、これを式で表すと次のようになる。
(a) 8O : (1s)2(2s)2(2p)4
(b) 14Si : (1s)2(2s)2(2p)6(3s)2(3p)2
(c) 16S : (1s)2(2s)2(2p)6(3s)2(3p)4
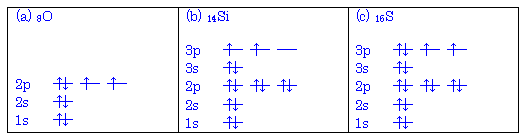
(発展)
構成原理(エネルギーの低い順に軌道に電子が収容される)と周期表の関係を理解するとよい。周期表の元素の位置と電子が最後に収容された軌道の関係を次図に示した。(一部の遷移元素においては例外となる場合がある。また、一般的な周期表にならい、ランタノイド、アクチノイド系列をひとつのマスで表している。)
1.02
まずは、それぞれの元素の原子番号を周期表で調べること。ただし、ここで「セレニウム」は「セレン」とも呼ばれる。見開きの周期表上では「セレン」で表記されている。
次にこれをもとに 1.1 のように電子配置図を描き、最外殻電子を数える。
なお、最後に電子が入った軌道(副殻)が最外殻のものとは限らないことに注意。
(解答例)
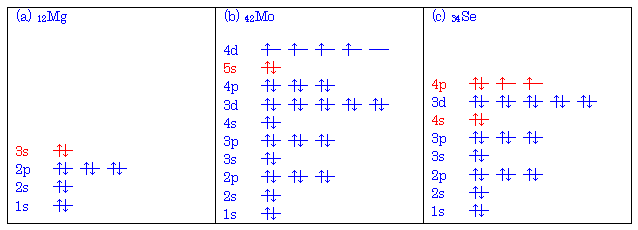
上図のような電子配置となる。赤字は最外殻。式で表すと次のようになる。
(a) 12Mg : (1s)2(2s)2(2p)6(3s)2 従って、2個。
(b) 42Mo : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)10(5s)2(4d)4 従って、2個。(註)
(c) 34Se : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)4 従って、6個。
なお、遷移金属以外については、周期表上の位置(第何族であるか)によっても、最外殻電子の数を読み取ることが可能である。
註(重要):有機化学の教科書の範囲では、上の答えが正解となる。しかし、遷移金属ではこの組み立て原理からの逸脱による例外が生じることがある。42Mo はその例外のひとつで、実際の基底状態における電子配置は次のようになっている。
42Mo : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)10(5s)1(4d)5 (従って、1個。)
この理由は、オクテットの安定性と同様に考える。つまり、(s)2(p)6 のように、同じエネルギーの軌道(副殻)がすべて占有されているのがオクテットで、安定であった。Hund則(教科書 p7、規則3)により、同じエネルギーの軌道には、まずは1つの軌道を1つの電子が占めるように入っていくが、実は、(p)3のような場合や、(d)5のように、同じエネルギーの軌道(副殻)のすべてが半分占有されている状態も、やや安定である。そのため、5s の電子を1つ、エネルギー的には高いはずの 4d に昇位させることで結果的に低いエネルギー状態になっている。(とはいえ、たとえば炭素の基底状態の電子配置を、2s の電子を 2p に昇位させて 、
6C : (1s)2(2s)1(2p)3
と書いた場合には、不正解である。つまり、上の説明はあくまでも例外であり、その例外がすべてに適用されるのではない。)
1.03
図 1.6 を参照すること。
また、クロロホルムの立体構造については、次のリンク先も参照すること。
クロロホルムの3次元模型
なお、上の立体モデルでは、原子のサイズの違い(黄緑色の塩素原子は、白の水素原子よりも大きい)を反映して、結合の長さも異なって表示されている。一般的に、構造式では結合の長さや原子の大きさを厳密に反映させて書く必要はない。(立体的なものを2次元で表現するのだから、すべての結合の長さやすべての結合角を正しく表現することは不可能である。)
(解答例)
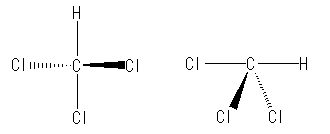
2本の実線は、紙面(モニター面?)上にある。およそ、110〜120度くらいの結合角で描くのが良い。次の左右、いずれも良い例。
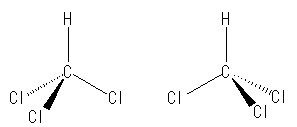
次は、悪い例。2本の実線が一直線上にあると、正四面体構造として読みとれない。
1.04
図 1.6 を参照すること。
くさび型の結合を使って分子を立体的に表すには、炭素原子を中心とした正四面体を頭の中にイメージして描くとよい。 また、エタンの立体構造については、次のリンク先も参照すること。
エタンの3次元模型
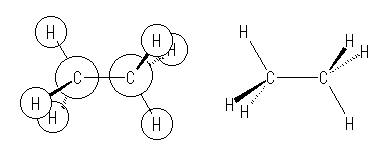
(解答例)
下図左は教科書の立体的な図、これに対応させた通常の表現法は下図右。
1.05
各原子について、周期表の第何族であるかの情報から、あるいは、原子番号とそこから導かれる電子配置から、最外殻電子数を求め、結合の本数を予測せよ。
(解答例)
(a) 32Ge は、6C と同じ14族で、最外殻電子数は4個。従って、4本の共有結合を持つ。17Cl は、17族のハロゲンで、最外殻電子数は7個。従って、3組の孤立電子対をもち、1本の共有結合を持つ。
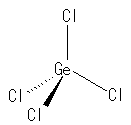
GeCl4
(b) 13Al は、13族で、最外殻電子数は3個。従って、3本の共有結合を持つことができるが、その場合でも閉殻とならない。
AlH3
(c) 6C は14族で、最外殻電子数は4個。従って、4本の共有結合を持つ。
CH2Cl2
ジクロロメタン CH2Cl2 の3次元模型
(d) 14Si は、6C と同じ14族で、最外殻電子数は4個。従って、4本の共有結合を持つ。9F は、17族のハロゲンで、最外殻電子数は7個。従って、3組の孤立電子対をもち、1本の共有結合を持つ。
SiF4
(e) 7N は、15族で、最外殻電子数は5個。従って、1組の孤立電子対をもち、3本の共有結合を持つ。
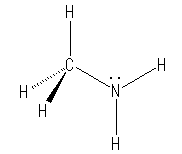
CH3NH2
(b) について、「13族のアルミニウムは3つの価電子を持つから、あと5つの電子を受け取るとオクテットを満たす。そのため、5つの水素原子と結合する。」と考えるのは間違っている。共有結合をするためには、1本の結合ごとにアルミニウムより1つの電子、水素原子より1つの電子を供出しあわなければならない。つまり、価電子の数が共有結合の最大数となる。(5本の共有結合をとるということは、1本の結合ごとに2つの電子を共有しているわけで、最外殻に10個の電子を持つことを示す。)
1.06
各原子について、周期表の第何族であるかの情報から、あるいは、原子番号とそこから導かれる電子配置から、最外殻電子数を決める。2つの隣接した原子間で1つずつ電子を出しあって共有結合を形成する。ルイス構造を描く時は、それぞれの電子がどの原子由来であるかに気をつけること。
15族の原子は、1組の孤立電子対と3本の共有結合を、
16族の原子は、2組の孤立電子対と2本の共有結合を、
17族の原子は、3組の孤立電子対と1本の共有結合を持つ。
特に間違いがちなのが、ハロゲン(17族元素)の孤立電子対を書き忘れてしまうパターンなので、気をつけること。
(解答例)
(a) 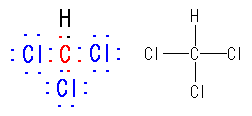
(b) 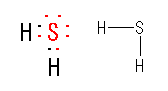
(c) 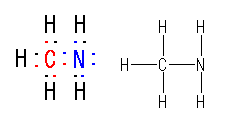
(d) 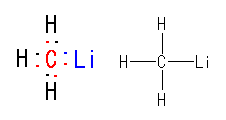
(発展)
たとえば、水 H2O のルイス構造式(点電子構造式)を描く場合、やケクレ構造式(線結合構造式)を描く場合、上のどちらでも間違いではない。
これは、sp3 混成した原子から出ている4本の結合(や、孤立電子対)は、正四面体の頂点方向にでているが、どの2つを選んでもその2つの間の位置関係は同じであるからである。(正方形だと、隣接している場合と、対角線上にある場合の2通りがあるが、正四面体の頂点はどの2つをとっても隣接している。)
とはいえ、水の分子が直線ではなく、折れ曲がった分子であることを強調するためには、上のような書き方が適している。
1.07
炭素は、最外殻に4つの電子をもち、4本の共有結合を持つことができる。一方、水素は最外殻に1つの電子を持ち、結合は1本である。
(解答例)
2つの炭素同士が1つずつ電子を出し合って、炭素−炭素結合をつくったとすると、結合に使える残りの電子は6個しかないから、水素との間であと6本までしか結合を作れない。従って、C2H7 は不可能である。
1.08
結合角は、中心の原子の混成状態から予測できる。
sp3 混成の原子を中心とした結合角は約109度。
sp2 混成の原子を中心とした結合角は約120度。
sp 混成の原子を中心とした結合角は約180度(直線)。
プロパン の3次元模型
(解答例)
3つ炭素はすべて、sp3 なので、C−C−C の結合角は、およそ 109 度であるので、右の構造式で描いたような形である。また、すべての H−C−H の結合角も、同じようにおよそ 109 度である。
1.09
1.08 と同様に考える。
ヘキサン の3次元模型
(解答例)
6つ炭素はすべて、sp3 なので、C−C−C の結合角は、およそ 109 度である。また、すべての H−C−H の結合角も、同じようにおよそ 109 度である。
1.10
各原子の混成状態や、その原子を中心とした結合等は以下のように判別することができる。
| シグマ結合と孤立電子対の数の和 | 混成状態 | 例(下線部の炭素) | 結合角 |
|---|---|---|---|
| 4 | sp3 | CH4 | 約109度(正四面体型) |
| 3 | sp2 | CH2=CH2 | 約120度(正三角形型) |
| 2 | sp | CH≡C-CH3, H2C=C=CH2 | 約180度(直線型) |
単結合はσ結合からなっており、二重結合はσ結合とπ結合から出来ている。三重結合は1本のσ結合と2本のπ結合から出来ている。
「結合角」とは、1つの原子を中心にして、そこから出ている2本の結合が成す角度のことである。従って、「二重結合の結合角」は120度である、というような表現は正しくないことに注意せよ。正しくは「(二重結合に関与している原子を中心とした)2本の結合が作る角度」は120度である、などと言わなければならない。
プロペン の3次元模型
(解答例)
線結合構造で描けば、次のようになる。
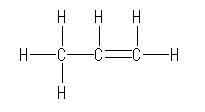
二重結合に関与した2つの炭素は、単結合(σ結合)が2本と二重結合(σ結合とπ結合)1本を持つから(合計で3本のσ結合を持つので)、sp2 混成である。従って、隣接したこれら2つの炭素は、同一平面内にそれぞれ3本の結合が出ており、その結合角は 120 度である。また、メチル基の炭素は、4本の単結合を持つからsp3 混成である。この炭素を中心とした結合角は、すべておよそ 109 度である。
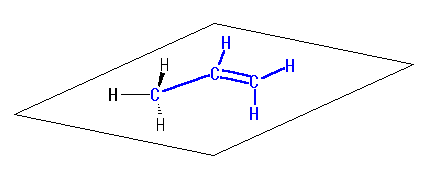
ヒントに示したリンクの3次元模型を使って確認すること。
1.11-1.20
1.11
1.10 と同様に考える。
1,3-ブタジエン の3次元模型
(解答例)
すべての炭素、水素を元素記号で示し、線結合構造で描けば、次のようになる。
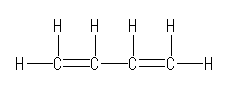
以下のいずれかの書き方でも、骨格構造式として正しい表記である。
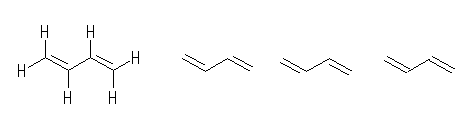
4つの炭素は、いずれも、単結合(σ結合)が2本と二重結合(σ結合とπ結合)1本を持つから(合計で3本のσ結合を持つので)、sp2 混成である。これら2つの炭素は、同一平面内にそれぞれ3本の結合が出ており、その結合角は 120 度である。
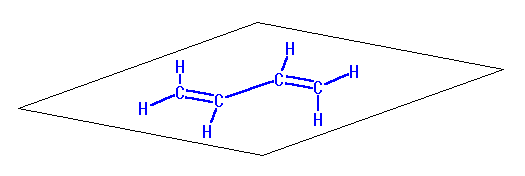
(発展)
解答に示したような結合角の条件を満たすだけであれば、炭素2−炭素3間の単結合の周りの自由回転により、たとえば次のような構造の分子も考えられる。
非平面型 1,3-ブタジエン の3次元模型
しかしながら、実際には、ヒントに示した3次元構造のように、全体として平面になった形の方が安定である。これは、以下のように説明される。
1,3-ブタジエンのように、二重結合と単結合が交互に並んでいる場合、これらの二重結合は「共役」しているという。または「共役二重結合」であるという。1,3-ブタジエンのような「共役ジエン」において、二重結合に挟まれた単結合には、部分的な二重結合性が生じている。このため、この単結合は他の単結合より若干距離が短く、また、2つの二重結合がつくる平面は共通の同一平面内に固定されることになる。このため、1,3-ブタジエンの場合、構成している4つの炭素と6つの水素は全て同一平面内にある。
その他の共役ジエンの構造や性質については、教科書14章で詳細を学習する。また、「ベンゼン」も、共役二重結合を持つ例であるが、ベンゼンの場合は「芳香族」で、15章、16章でその詳細を学習する。
また、同じ「ブタジエン」であっても、二重結合の位置が異なることにより分子の形は大きく変化する。1,2-ブタジエンは、隣接した二重結合「集積二重結合」を持つタイプの化合物である。二重結合に挟まれた炭素の混成状態を考えると、次の分子の形が説明できるはずである。
1,2-ブタジエン の3次元模型
1.12
混成状態については、1.10 のヒントの表を参照すること。
アスピリン の3次元模型
(解答例)
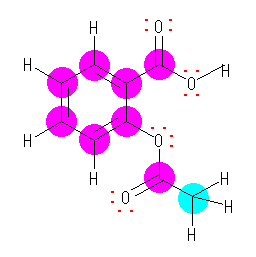
ピンクで示した炭素は、すべて、単結合(σ結合)2本と二重結合(σ結合とπ結合)1本を持っている。従って、(合計で3本のσ結合を持つので)sp2 混成である。水色で示した炭素は、4本の単結合を持つから、sp3 混成である。アスピリン分子中の4つの酸素は、いずれも2対ずつの孤立電子対を持つ。
なお、上図では結合の数を見やすくするために線結合構造式で描いている(すべての水素を省略せずに示している)が、もちろん、骨格構造式で分子構造を示す場合には、そのルールに則っていれば、水素の省略を行ってもかまわない。
1.13
1.10 と同様に考える。
プロピン の3次元模型
(解答例)
線結合構造で描けば、次のようになる。
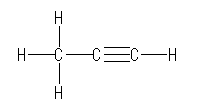
三重結合に関与した2つの炭素は、単結合(σ結合)が1本と三重結合(σ結合と2本のπ結合)1本を持つから、(合計で2本のσ結合を持つので)sp 混成である。従って、3つの炭素と、sp 混成炭素から結合している末端の水素は、同一直線上にある。また、メチル基の炭素は、4本の単結合を持つからsp3 混成である。この炭素を中心とした結合角は、すべておよそ 109 度である。
1.14
「ある原子に期待される構造」とは、結合や孤立電子対がどのような方向にあるかを意味しており、すなわち「その原子がどのような混成状態であるか」がわかればよい。
1.06, 1.12 などと同様に考えよ。また、混成状態については、 1.10 のヒントも参照すること。(炭素以外の原子も同じ表から判断することが可能である。)
(解答例)
図中、灰色は炭素、赤は酸素、青を窒素、濃い桃色はリン、黄は硫黄、水色は水素である。また、孤立電子対は薄い桃色の球として表現されている。
(a) 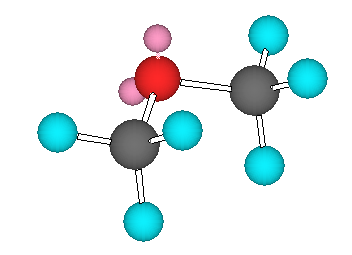
ジメチルエーテル の3次元模型
ジメチルエーテル中の酸素は、2本の単結合(σ結合)と2対の孤立電子対を持っており、sp3 混成である。従って、メチル基の炭素と同様に、正四面体の対称性をもつような形をしている。
(b) 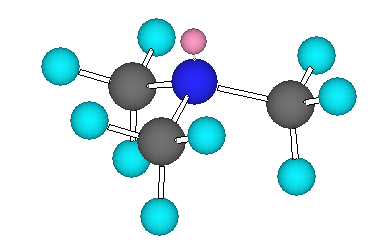
トリメチルアミン の3次元模型
トリエチルアミン中の窒素は、3本の単結合(σ結合)と1対の孤立電子対を持っており、sp3 混成である。従って、メチル基の炭素と同様に、正四面体の対称性をもつような形をしている。
(c) 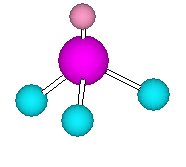
ホスフィン の3次元模型
窒素と同族のリンは、最外殻に5つの電子を持つ。従って、PH3 の化合物中で、リンは3本の単結合の他に1対の孤立電子対をもち、sp3 混成である。従って、メチル基の炭素と同様に、正四面体の対称性をもつような形をしている。
(d) 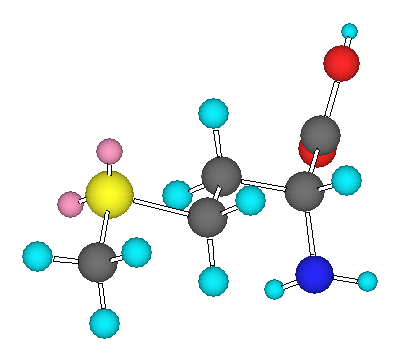
メチオニン の3次元模型
酸素と同族の硫黄は、最外殻に6つの電子を持つ。従って、メチオニン中で、硫黄は2本の単結合の他に2対の孤立電子対をもち、sp3 混成である。従って、メチル基の炭素と同様に、正四面体の対称性をもつような形をしている。
なお、上図では書き加えていないが、窒素上にも1組、2つの酸素上にもそれぞれ2組の孤立電子対がある。
1.15
テキストp25の「骨格構造式の規則」を参照のこと。(また、1年の「総合物作り体験」で「分子・物質・エネルギー」のテーマの第1回目で分子模型を組む際に学んだことも思い出すこと。)
・線の両端や線の交点には炭素原子が存在する。
・省略されているのは、炭素に結合した水素のみである。
・炭素は4本の結合を持つ。
以上のルールを守れば、水素は数えられる。
アドレナリン の3次元模型
エストロン の3次元模型
(解答例)
それぞれの炭素と結合した水素を数える際に注意すべきことを幾つかあげておく。
・ベンゼン環上の骨格構造式でなにも置換基の描かれていない部位には、水素が1つある。
・それ以外の炭素について、3本の結合の交点(ベンゼン環もここに含めて考えることも可能であることは、言うまでもない)の炭素には、水素が1つ結合している。
・2本の結合の交点の炭素には、水素が2つ結合している。
・結合を表す価標の末端はメチル基を表し、水素が3つ結合している。
・ケトン基の炭素のように、4本の結合がすべて他の原子との結合に使われている炭素には、水素は結合していない。
・エストロンの二つのシクロアルカン環の縮合した架橋位のような場所の3級炭素の水素を数え忘れたりしがちである。
通常は省略される水素もすべて書き込んだ構造式と分子式は以下の通り。
(なお、わざわざ挙げるまでもないが、ベンゼン環の二重結合の位置が1つずつずれているものでも、同じ構造式であるとみなしてよい。)
(a) 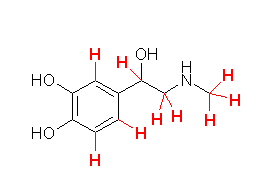
C9H13NO3
(b) 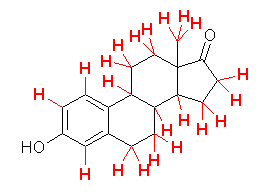
C18H22O2
(発展)
構造式から分子式を読み取る際、次のことを知っておくと便利である。
窒素原子を奇数個含む分子は、奇数個の水素を持ち、それ以外は偶数個の水素を持つ。これは、酸素や炭素は4本の(偶数の)結合を持つのに対し、窒素が3本の(奇数の)結合を持つことから生じる。
1.16
それぞれの原子の持つ結合の数を間違えないようにする。与えられた炭素や窒素などの数を満たすように、まず適当な構造を自分で描いてみて、その構造中の水素の数を数え、与えられた式と合っているかどうかを確認する。与えられた式の方が水素の数が2つ少ないようであれば、分子に多重結合をひとつ加える(単結合を二重結合にする、または、二重結合を三重結合にする)か、または、分子に環の構造を一つ加える。このようにして、分子式を満たす構造をつくる。(水素の数が一つだけ違うという場合は、どこかが間違っているので、式を見直すか、水素を数え直すか、構造式を書き直すかしてみる。)
骨格構造式を描く際、炭素以外の原子上の水素、ならびに、強調のために C と明記した炭素上の水素は、省略することができないので注意すること。この際、たとえば水酸基であれば、
(解答例)
(a)
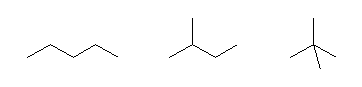
直鎖アルカンと分枝アルカンで、これらの化合物は骨格異性体である。化合物名は、左より
pentane
2-methylbutane
2,2-dimethylpropane
(b)
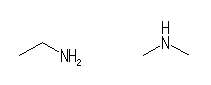
1級のアミンと2級のアミンの違いがある。これらの化合物名は、左より
ethylamine
dimethylamine
(c)
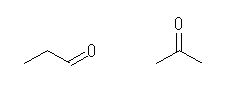
炭素−酸素二重結合(カルボニル)を持つものとしては、アルデヒドとケトンの官能基異性体が存在する。左より、
propanal
propan-2-one (or acetone)
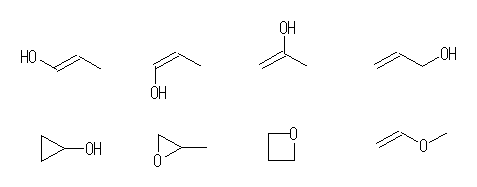
その他にも、炭素−炭素二重結合や環状構造を持つものとしては、アルコールとエーテルもある。二重結合を含むアルコールは位置異性体と幾何異性体を含む。これらの化合物名は、上段、左より
(E)-prop-1-en-1-ol
(Z)-prop-1-en-1-ol
prop-1-en-2-ol
prop-2-en-1-ol
下段左より
cyclopropanol
propylene oxide (or 1,2-epoxypropane)
oxetane
methyl vinyl ether (or methoxyethene)
(d)
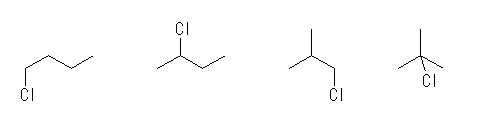
直鎖アルカンに対する塩素の位置異性体2種と、分枝アルカンに対する位置異性体の2種類が考えられる。化合物名は左より、
1-chlorobutane
2-chlorobutane
1-chloro-2-methylpropane
2-chloro-2-methylpropane
なお、1.16(c) の解答に関して、教科書(マクマリー第7版第1刷)下巻の巻末付録の解答には不備があります。まあ、数えれば判る話なのですが、C3H6O の分子式の構造を例示せよ、という問題に対し、解答例のひとつとして C2H4O の分子式を持つ ethanal の構造を挙げています。これは単純にミスですので、皆さんが学習していない、なにか神秘的なものが存在するわけではありません (^^;
1.17
それぞれの原子の持つ結合の数を間違えないように数えれば判断できる。
(解答例)
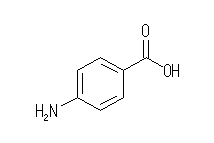
p-aminobenzoic acid
ベンゼン環上の二重結合の位置は、2通りに書けるうちのどちらでもよい。
また、カルボキシ基は、省略して -CO2H または -COOH と書いてあっても可。(-CHO2 というカルボキシ基の書き方は無い。)
骨格構造式を描く上で、ベンゼン環に結合したアミノ基を上図のように左にむけて描く場合には、H2N- となっていることに注意。( NH2- ではない。)教科書 p25 下段の説明参照。
また、骨格構造式を書くとき、炭素以外の原子(酸素、窒素など)および、明示的に示した炭素に結合した水素は省略できないので気をつけること。
1.18
それぞれの原子が、何本の結合を持つことができるかを考えて、それに矛盾しないようにすること。
C(炭素) 4本の結合
N(窒素) 3本の結合と1対の lone-pair
O(酸素) 2本の結合と2対の lone-pair
コニイン の3次元模型
アラニン の3次元模型
(解答例)
ここでは、骨格構造式で示す。骨格構造式の書き方やルールについては教科書の25頁等を参照のこと。)
(a) coniine (2-propylpiperidine)
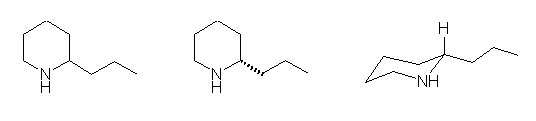
上のいずれの描き方でもよい。真ん中の構造式では、窒素の隣の炭素からでているプロピル基(-CH2CH2CH3)が、6員環の面の上下のどちらにあるのかを、楔型の結合で表している。(この図では、紙面の奥側にむかっている結合を表すため、破線の楔型を用いている。)右の構造式のように、6員環の立体的な構造をなるべく反映させるような方法で描画をしてもよい。
(b) alanine (2-aminopropanoic acid)
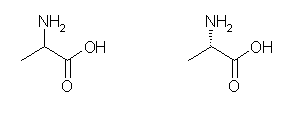
炭素とのみ結合している酸素は、二重結合を持つことに注意する。
1.19
1.18 に同じ。
クエン酸 の3次元模型
(解答例)
多重結合は、分子内に3つあるカルボニル基(C=O)に含まれ、また、孤立電子対は全ての酸素上に(それぞれにつき2対ずつ)存在する。
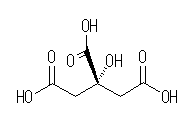
(発展)
citric acid (クエン酸)のIUPAC名は、 2-hydroxypropane-1,2,3-tricarboxylic acid
または、 3-carboxy-3-hydroxypentanedioic acid
枝分かれの無い炭素鎖が直接2つ以上のカルボキル基と結合する場合、上記のように置換式で命名する。主鎖はなるべくカルボキシ基が多く結合するように選び、直接結合していないカルボキシ基は、carboxyalkyl- で示す。
1.20
原子の混成状態は、1.10 のヒントに載せた表に基づいて判断すること。問題文に指示はないが、まずはアセトアミノフェンの構造式を書くこと。
アセトアミノフェン の3次元模型
(解答例)
炭素原子の混成状態:
ベンゼン環を構成する炭素 sp2
アミド基のカルボニル炭素 sp2
末端のメチル基の炭素 sp3
孤立電子対を持っているのは、すべての窒素および酸素原子。
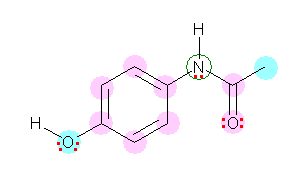
上図中、ピンクで示した原子 → sp2混成、 水色で示した原子 → sp3混成
(発展)
解答例の構造において、緑の丸をつけた窒素は、3本の結合と1対の孤立電子対を持つので、1.10 のヒントに載せた表からは、sp3混成であるように考えられるが、分子の3次元構造を確認してもわかるように、120度の結合角を持つ平面内3配位の構造をもつ。すなわち、sp2混成となっている。これは、1.10 の表からの例外であるが、隣接した位置に多重結合(ベンゼン環とカルボニル)があり、その p 軌道と同じ方向を向いた p 軌道が孤立電子対を格納することで、分子が平面性を持ち、分子全体に電子雲が広がることができるようになるためである。この考え方は、詳しくは「分子軌道」で学ぶ。
1.21-1.30
1.21
「構造を完成させよ」=「構造式を正しく書け」と解釈してよい。1.18 や 1.19 と同様に考える。特に、各原子のもつべき結合の数より、二重結合を見落とさないようにする。
アスパルテーム の3次元模型
(解答例)
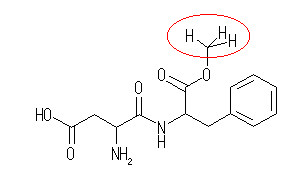
多重結合は、上の構造式を参照すること。(ベンゼン環内に3箇所、アミド基、エステル基、カルボン酸基の中のカルボニル基(C=O)が3箇所。)
教科書の問題の図では、炭素の影になっていて見落としやすいのが、構造式中に赤で印をつけた位置の3つめの水素であるので気をつけること。
上の構造式では注意点を述べるためにメチル基を省略せずに記しているが、骨格構造式のルールに則って書くならば、下のようになる。1.16のヒントも参照すること。
(発展)
aspartame (アスパルテーム)は、2つのアミノ酸(一般式 H2N-CHR-CO2H)、アスパラギン酸(R = CH2CO2H)とフェニルアラニン(R = CH2Ph)とを含む。
L-aspartyl-L-phenylalanine methyl ester
1.22
遷移元素以外は、その元素が、周期表の上で第何族であるかで判断できる。または、原子番号よりその原子の基底状態の電子配置をすべて書き出してみてもよい。
第4周期以降の元素において、電子の収容される軌道のエネルギー順については、1.1 の発展に示した図も参照すること。
なお、原子番号は以下の通りである。
(a) 30Zn, (b) 53I, (c) 14Si, (d) 26Fe
(解答例)
(a) 30Zn : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10 荷電子の数:2個
(b) 53I : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)6(5s)2(4d)10(5p)5 荷電子の数:7個
(c) 14Si : (1s)2(2s)2(2p)6(3s)2(3p)2 荷電子の数:4個
(d) 26Fe : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)6 荷電子の数:2個
1.23
遷移元素以外は、その元素が、周期表の上で第何族であるかで判断できる。または、原子番号よりその原子の基底状態の電子配置をすべて書き出してみてもよい。
第4周期以降の元素において、電子の収容される軌道のエネルギー順については、1.1 の発展に示した図も参照すること。
なお、原子番号は以下の通りである。
(a) 19K, (b) 33As, (c) 13Al, (d) 32Ge
(解答例)
(a) 19K : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)1
(b) 33As : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)3
(c) 13Al : (1s)2(2s)2(2p)6(3s)2(3p)1
(d) 32Ge : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)2
1.24
それぞれの原子が何本の結合を持つかを考える。
(d) は2つの解答が可能。
(解答例)
(a) 窒素は1対の孤立電子対と3本の結合を持つ。酸素は2対の孤立電子対と2本の結合を持つので、(-OH) は、酸素からの1本の結合の寄与があるから、窒素に結合するべき水素原子の数は 3−1=2である。従って、正しい分子式は、NH2OH
(b) アルミニウムは3本の結合を持つ(孤立電子対はもたず、オクテットを満たさない)。塩素(-Cl) は3対の孤立電子対と1本の結合を持つので、1つの塩素原子あたりアルミニウムとの間に1本の結合の寄与があるから、結合するべき塩素原子の数は 3である。従って、正しい分子式は、AlCl3
(c) 炭素は4本の結合を持つ。フッ素(-F)、塩素(-Cl)ともに3対の孤立電子対と1本の結合を持つので、1つのハロゲンあたり炭素との間に1本の結合の寄与があるから、フッ素が2つ結合しているので、結合するべき塩素原子の数は4−2=2である。従って、正しい分子式は、CF2Cl2
(d) 炭素は4本の結合を持つ。酸素は2対の孤立電子対と2本の結合を持つのだが、
(1) この酸素(=O)の2本の結合とも炭素との間にあると考えると、炭素に結合するべき水素原子の数は4−2=2である。従って、正しい分子式の1つめは、CH2O (ホルムアルデヒド)
(2) また、この酸素(-O-)の2本の結合が、炭素と水素の間にあると考えると、炭素原子は残り3本の結合が水素原子と結合し、酸素原子からも1つの水素原子が結合する。従って、もう1つの正しい分子式は、CH4O (メタノール)
1.25
電荷的に中性な窒素原子は、価電子が5個であるため、化合物中で、3本の共有結合と1対の非結合電子対(孤立電子対)をもつ。
(解答例)
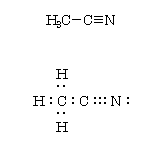
アセトニトリルは図上のような結合様式をもつ。これをルイス(点電子)構造で表すと、図下のようになる。窒素電子は炭素との間の三重結合の他、孤立電子対を持つ。
化合物中の窒素原子が最外殻にもつ電子の数:8
結合性の電子:6、非結合性の電子:2(孤立電子対)
(ただし、「価電子」は5。炭素との共有結合(シグマおよびパイ)により3つの電子をもらい、八偶子(オクテット)を満たしている。)
1.26
1.10 のヒントに挙げた表を参照すること。
(解答例)
メチル炭素の混成状態 sp3(4本のシグマ結合を持つので)
シアノ基(-CN)の炭素の混成状態 sp(2本のシグマ結合を持つので)
窒素の混成状態 sp(1本のシグマ結合と孤立電子対を持つので)
1.27
塩化ビニル C2H3Cl の構成元素のうち、水素と塩素は結合を1本しか持たないから、複数の結合を持つのは炭素のみである。そこで、まず炭素を可能な方法で並べてみる。炭素と炭素の間が単結合だとすると、この2つの炭素に対し6本の結合がでることになるが、水素と塩素の合計数が4しかない。つまり、あまった結合分は、炭素と炭素の間で二重結合になっていると理解することができる。
なお、塩化ビニルは、「1-クロロエテン (1-chloroethene)」の慣用名である。(ビニル基は、「エテニル基」(=エテンから水素を一つ除いた、二重結合を持つアルキル基)の慣用名。)従って、エテン(二重結合をもつ炭素数2のアルケン)の一つの水素を塩素に置換したものが、塩化ビニルである。
(解答例)
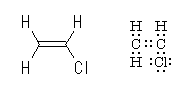
図左に骨格構造式を、図右にでは、対応したルイス構造を示した。
ルイス構造においては、塩素が3対の孤立電子対を持っていることに注意。
1.28
すべての原子について、価電子の数を確認すること。特に正や負に帯電した原子では、中性の原子に比べて価電子の数が+1または−1であることに注意せよ。
価電子が5個以上の原子には、すべて孤立電子対がある。
(解答例)
各原子の価電子数と孤立電子対の関係は以下の通り。
窒素(価電子5個):3本の結合と1対の孤立電子対
酸素(価電子6個):2本の結合と2対の孤立電子対
硫黄(価電子6個):2本の結合と2対の孤立電子対
負電荷をもつ酸素(価電子7個):1本の結合と3対の孤立電子対
従って、構造式中に描き込むと次のようになる。
(a) 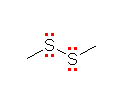
(b) 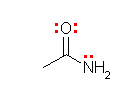
(c) 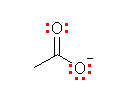
(発展)
問いの答えと直接関係あるわけではないが、(a)の化合物名は、「ジメチルスルフィド」ではなく、「ジメチルジスルフィド」です。
1.29
「分子式」は、分子を構成する原子の種類と数を表した化学式。C, H, O, N の順で表し、これ以外の原子はアルファベット順で表す。
なお、「示性式」は、有機化合物の中から官能基をとりだして、化合物の特徴を表した式。たとえばエタノールを C2H5OH と表すなど。
アセチルサリチル酸 の3次元模型
ビタミンC の3次元模型
ニコチン の3次元模型
α-グルコース の3次元模型
(解答例)
(a) C9H8O4
(b) C6H8O6
(c) C10H14N2
(d) C6H12O6
1.30
「原子価の規則」価電子の数から決まってくる、各原子のとれる結合の数(と孤立電子対の数)は、以下の通り。
水素 :1本の結合
炭素(価電子4):4本の結合
窒素(価電子5):3本の結合(と1対の孤立電子対)
酸素(価電子6):2本の結合(と2対の孤立電子対)
臭素(価電子7):1本の結合(と3対の孤立電子対)
以上の規則に矛盾しないような骨格を考える。
2本以上の結合を持つ原子を鎖状、または分岐した鎖状にならべる組み合わせを考えるとよい。(結合が1本しかない原子は、分子鎖の末端にしかならないから。)
また、このとき、複数の結合をもつ原子間がすべて単結合のみであるものとして原子を並べてみたときに、水素など結合が1本の原子の数が不足する場合がある。この場合は、複数の結合をもつ原子のつくる骨格のいずれかに多重結合があるか、環状になっている。
(解答例)
(a) (CH3-CH2-CH3)
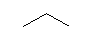
propane
(b) (CH3-NH2)
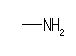
methylamine (or methanamine)
(c) (CH3-O-CH3 と CH3-CH2-OH)
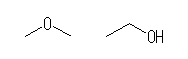
dimethyl ether,
ethanol
(d) (CH3-CH2-CH2Br と CH3-CHBr-CH3)
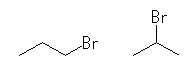
1-bromopropane,
2-bromopropane
(e) (CH3-CHO と CH2=CH-OH と CH2(*)-CH2-O-(*)(←(*) 同士で結合した三員環))
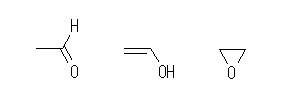
ethanal, vinyl alcohol, oxirane (or ethylene oxide, or 1,2-epoxyethane)
(f) (CH3-CH2-CH2-NH2 と CH3-CH2(NH2)-CH3 と CH3-CH2-NH-CH3 と (CH3)3N
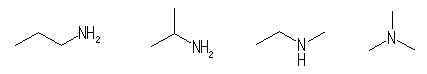
propylamine (or propanamine), isopropylamine ethylmethylamine trimethylamine
1.31-1.40
1.31
各原子の混成状態は、1.10 のヒントに挙げた表を参照し、シグマ結合と孤立電子対の数の和より判断することができる。
プロパン の3次元模型
2-メチルプロペン の3次元模型
ブタ-1-エン-3-イン の3次元模型
酢酸 の3次元模型
(解答例)
(a) CH3-CH2-CH3 の3つの炭素とも、sp3 混成である。
(b) (CH3)2C=CH2 の下線炭素は、sp2 混成、メチル基の炭素は sp3 混成である。
(c) CH2=CH-C≡CH の、三重結合に関与した下線炭素は sp 混成、それ以外の2つの炭素は sp2 混成である。
(d) CH3-C(=O)-OH の、メチル基炭素は sp3 混成、下線のカルボニル炭素は sp2 混成である。また、酸素についても見ておくと、下線のカルボニル酸素は sp2 混成、水酸基酸素は sp3 混成である。
(酸素原子については、それぞれ2対の孤立電子対を持つため、シグマ結合の数にこれを足してから、上記表に従い判断する。)
1.32
各炭素の混成状態等については、1.10 のヒントに挙げた表を参照すること。
「全体としてどのような形をしているか」という問いに対しては、それぞれの結合角がどうであるか、また構成要素である原子が空間内でどのような配置になっているか(同一平面内、一直線上、3次元的、その場合は3角錐や正6面体(立方体)の頂点に原子があるなど)を簡潔に述べる。
ベンゼン の3次元模型
(解答例)
すべての炭素、および水素は同一平面内にあり、炭素は正6角形の頂点に位置する。各炭素は、sp2 混成であり、結合角はすべて120度である。
ヒントにリンクした3次元模型でも確認すること。
1.33
結合角は、中央の原子の混成状態によって決まる。各原子の混成状態等については、1.10 のヒントに挙げた表を参照すること。
グリシン の3次元模型
ピリジン の3次元模型
乳酸 の3次元模型
(解答例)
(a) カルボン酸の炭素原子は、3本のシグマ結合を持つので、sp2 混成。従って、O=C-OH の結合角は約120度。
(b) ピリジンの窒素原子は2本のシグマ結合と1対の孤立電子対をもつ。sp2 混成で、結合角は約120度。孤立電子対は、ピリジンの正六角形の骨格と同じ平面内で、炭素−水素結合と同じように円の半径方向外側に向かってでている。ベンゼンの構造と比較すること。
(c) 乳酸の水酸基のねもとの炭素は、4本のシグマ結合をもつ。従って、sp3 混成で、結合角は約109度。
1.34
教科書 25ページの規則に従って骨格構造式に変換する。
(1.16 ヒント再掲) 骨格構造式を描く際、炭素以外の原子上の水素、ならびに、強調のために C と明記した炭素上の水素は、省略することができないので注意すること。この際、たとえば水酸基であれば、
(解答例)
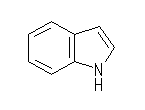
(a) indole , 窒素上の水素は省略することができないことに注意する。
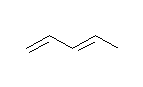
(b) 1,3-pentadiene
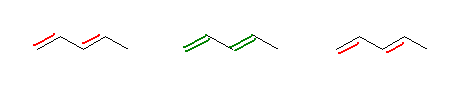
なお、この問題に限ったことではないが、二重結合の2本目に書き足す結合の位置は以下のいずれでも可。(見た目と好みで使い分けてよい。)
(c) 1,2-dichlorocyclopentane
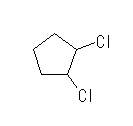
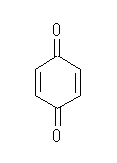
(d) benzoquinone
1.35
教科書 25ページの規則によれば、骨格構造式において表記上省略されているのは「炭素に結合した水素」のみである。従って、(多重結合も含めて数えて)4本未満の結合しか描かれていない炭素は、その残りの数の水素と結合していることになる。
(解答例)
各炭素に付く水素の数は、この解答例においては省略するが、各自の解答における水素の合計数が、分子式における水素の数と合致していることを確認しておくこと。
(a) 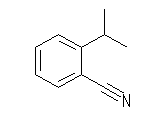
C10H11N
(b) 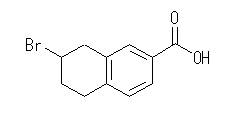
C11H11O2Br
(c) 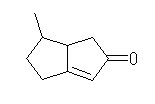
C9H12O
(発展)
これらの分子の名称は、以下の通り。
(a) 2-isopropylbenzonitrile
(b) 7-bromo-5,6,7,8-tetrahydronaphthalene-2-carboxylic acid
(c) 6-methyl-4,5,6,6a-tetrahydro-1H-pentalene-2-one
1.36
電荷的に中性な分子では、
sp3 炭素は、4本の単結合を持つ。
sp2 炭素は、2本の単結合と1本の二重結合を持つ。
sp 炭素は、1本の単結合と1本の三重結合、または二本の二重結合をもつ。
与えられた条件を満たす構造の分子は、いくつもある。炭素の数の上限を定めなければ無限にあるとも言える。これらの中から、最も単純な構造のものを挙げればよい。
2つの sp2 混成炭素で、1本の二重結合を作れる。2つの sp 混成炭素では1本の三重結合を作れる。
(解答例)
一例のみを示す。
(a) 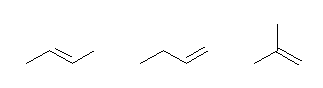
but-2-ene, but-1-ene, 2-methylpropene
(b) 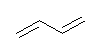
buta-1,3-diene
二重結合の位置が隣接した buta-1,2-diene では条件に合致しない。
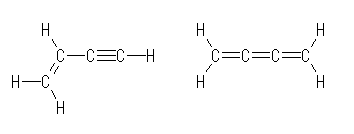
(c) 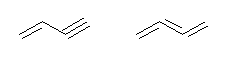
but-1-en-3-yne, buta-1,2,3-triene
上の表記では、炭素の位置に誤解を生じないよう、180度の炭素の結合角も、直線を反映させずに曲げて書いている。もともと3次元である分子を2次元で表記する時点でいくらかの不正確さは免れることができないので、構造式上のみかけの結合角が分子の実際の結合角を反映させていない場合があることは、暗黙の了解として認められる。特に、右の化合物は、4つの炭素が一直線上にならぶ構造をもった分子である。
これは、三重結合の両端の炭素、ならびに、二重結合2本に挟まれた炭素は、いずれも2本のσ結合と2本のπ結合をもち、結合角が180度となるよう sp 混成をとるからである。なお、結合角に配慮して線結合構造で示すと、次図のようになる。
1.46 の解答例に上げた図も参照すること。
1.37
(a) は、問題 1.5 と同様に考えればよい。
(b) および (c) では、(a) とは逆に水素の数が、炭素の数から予測されるよりも少ない。このとき、単結合だったところを二重結合にすることで、分子式の水素の数を減らすことができるが、水素の数は2個単位でしか減らせないことに注目するとよい。
(解答例)
(a) 炭素は価電子を4つ持つから、4つの水素との間で化合物 CH4 をつくることはできるが、CH5 はつくらない。
(b) 分子内に、環構造も二重結合もどちらも持たない場合、2つの炭素、1つの窒素からは、たとえば aminoethane CH3CH2NH2 の分子式として、C2H7N となる。ここから2つの水素を除いて二重結合や環構造を導入すると、C2H5N となってしまい、C2H6N の分子をつくることはできない。
(c) 臭素は7つの荷電子をもち、1本の共有結合をもつから、結合の様式は水素と同じであるので、C3H5Br2 の代わりに C3H7 について考えてもよい。
3つの炭素からは、たとえば propane CH3CH2CH3 の分子式として、C3H8 となる。ここから2つの水素を除いて二重結合や環構造を導入すると、C3H6 となってしまい、C3H7 の分子をつくることはできない。従って、C3H5Br2 の分子もつくることができない。
1.38
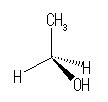
分子の立体構造と、くさび形線を用いた表現については、教科書 1.4 節、9頁の図を参照すること。問題 1.4 も参照のこと。
(解答例)
ethanol の酸素に直結した炭素(次式下線: CH3−CH2−OH )上には、2つの水素、1つのメチル基( −CH3 )、1つの水酸基( −OH )をもつ。下図中で、これら4つの置換基をどの位置に置いても構わない。
1.39
与えられた分子式 C4H4O5 から、「3つの >C=O と2つの -O-H 」部分を構成する原子を差し引くと、炭素×1、水素×2である。
与えられた条件を満たし、かつ、各原子の結合の数に矛盾しない構造は、8種類書くことができる。これらの中から問題文に従って2つを描けばよい。なお、解答となる構造の中に、炭素−炭素二重結合は含まれない。
もちろん物質の名称を「オキサロ酢酸」と限定してしまった場合には、構造は唯一に決めることができる。(この問題では、オキサロ酢酸の構造が未知であるものとして解答してよい。)
(解答例)
次の中から2つが描かれていればよい。(これら8種類の描き方は、下記(発展)を参照のこと)
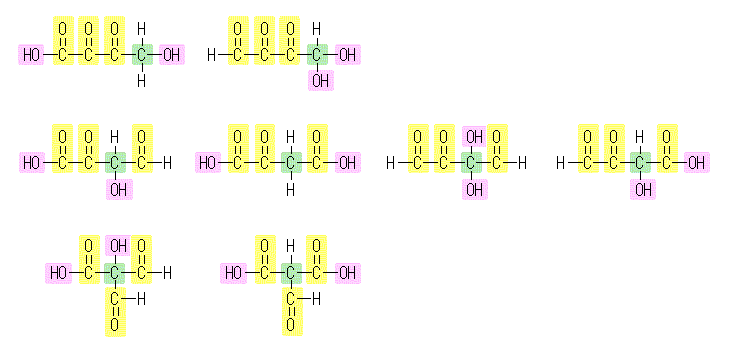
オキサロ酢酸の系統名は、2-オキソブタン二酸 ( 2-oxobutanedioic acid ) で、その示性式は HOOC-CH2-CO-COOH である。上図では、中段左より2つめ。
(発展)
すべての可能性を探るためには、次の手順で考えればよい。
与えられた分子式は、 C4H4O5 で、かつ、3つのカルボニル基 C=O を持つ。分子式より、この分子の不飽和度(教科書 6.2 節参照。分子内にある二重結合や、環構造の数)を求めると(あるいは分子式を満たす構造をひとつ書いてみると類推できるように)3であるから、同じ分子式を満たすためには、すでに分子内にカルボニル基に由来する二重結合が3つあるので、分子内に環構造は持たない。
また、5つある酸素はすべてカルボニル基、または水酸基に使用されるから、エーテル酸素を含まない。
従って、この分子に可能な炭素の並びは、4つの炭素が一列に順に並んでいる( n-butane の骨格)か、または3つの炭素が一列にならび、その2番目の炭素から分岐している( 2-methylpropane の骨格)かのいずれかである。
これら炭素4つのうち、3つをカルボニル基にすることで、基本となる4つの炭素と3つの酸素の位置のパターンを3種類生じさせることができる。
さらに炭素の結合可能な場所に、水酸基を2つ導入すると、その位置の組み合わせにより、全部で8種類の構造を書くことができる。
ただし、このうちの2種類については、分子内にカルボキシ基を持たない。(カルボン酸ではない。)
1.40
1.39 に比べて単純な分子を扱っているので、与えられた条件からほぼ唯一の分子の構造を指定できるはずである。
なお、孤立電子対は、価電子が5以上の原子(この問いでは、窒素と酸素)上にあるから、価電子数を確認すること。
(a) 分子式より3つの炭素を含むが、この内の2つは炭素−炭素二重結合を形成し、もう一つは窒素との間で三重結合を形成している。(炭素は4本までしか結合できないから、同一の炭素で兼ねることはできない。)窒素は、3本までしか結合できないから、炭素−窒素三重結合した部分は、炭素側から他の部分に結合するしかない(シアノ基: −C≡N )。
(b) 「ふたつの炭素に結合した酸素 C−O−C」なので、酸素は、2本の結合をもつが、この両端が炭素となっている。3つ目の炭素は、もう一つの炭素から結合する。
(c) 「鎖状に」4つの炭素が並んでいるのだから、「 C−C−C−C 」の形。
(d) 6個の炭素を「環状に」並べる。正六角形の頂点に炭素を置き、辺を炭素−炭素結合とする。
(解答例)
(a) 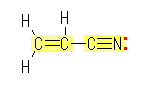
(b) 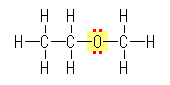
(c) 
(d) 
(a) および (b) は、図中、赤で示したように、それぞれ窒素上に1対、酸素上に2対の孤立電子対を持つ。
1.41-1.50
1.41
カリウムメトキシドは、水酸化カリウム( KOH )と同様、カリウムイオンを与える。
教科書の2章、第1節「極性共有結合:電気陰性度」も参照すること。
(解答例)
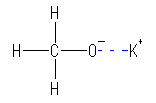
図で点線で示した、酸素−カリウムの結合は、2つの元素の電気陰性度に大きな差があるためイオン結合性となる。
1.42
1.10 のヒントの表をもう一度確認すること。1.36 のヒントのように考えてもよい。
ただし、次のように覚えてはいけない。(下のどこが間違いか、確認せよ。)
(間違い)単結合の炭素は sp3、二重結合に関与した炭素は sp2、三重結合に関与した炭素は sp。
プロカイン塩酸塩 の3次元模型
ビタミンC の3次元模型
(解答例)
次に骨格構造式で表された図(省略されている水素を補うことを忘れないこと)において、ピンクで表した炭素、窒素、酸素は、それぞれ「σ 結合の数(単結合の数+多重結合の数)+孤立電子対の数」が3であるから、sp2 混成である。水色で表した炭素、窒素、酸素は、それぞれ「σ 結合の数+孤立電子対の数」が4であるから、sp3 混成である。
(a) 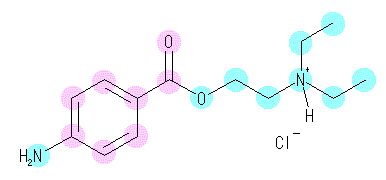
(b) 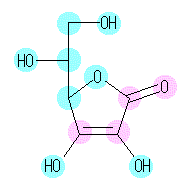
なお、ヒントの(間違いを確認せよ)は、CH2=C=CH2 のような分子では、中央の炭素は sp 混成であるから、二重結合に関与していても、必ずしも sp2 ではないことである。
(発展)
(a) で与えられている構造式は、厳密には「プロカインの塩酸塩」または「塩酸プロカイン」である。この構造式で、右側の窒素が正の形式電荷を持っているが、単に「プロカイン」と表記した場合は、この窒素が中性で、かつ、水素がひとつ少ない構造となる(H+が抜ける)。また、その電荷を補償する塩化物イオン Cl-もなくなる。
1.43
1.42 と同様に考えること。
ピリドキサールリン酸 の3次元模型
(解答例)
次に骨格構造式で表された図(省略されている水素を補うことを忘れないこと)において、ピンクで表した炭素、窒素、酸素は、それぞれ「σ 結合の数(単結合の数+多重結合の数)+孤立電子対の数」が3であるから、sp2 混成である。水色で表した炭素、酸素、リンは、それぞれ「σ 結合の数+孤立電子対の数」が4であるから、sp3 混成である。
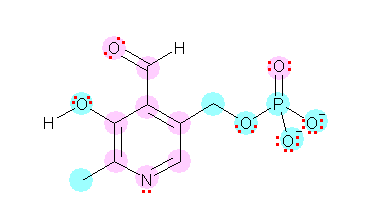
なお、結合角は、
sp2 の混成状態の元素を中心とした場合は、約120度、
sp3 の混成状態の元素を中心とした場合は、約109度である。
1.44
教科書の図に示されているように、もし cyclopentyne が存在するなら、炭素−炭素三重結合を含む5員環をもつ分子となる。この三重結合に関与する炭素の混成状態と、それから予想される結合角を考えること。
(解答例)
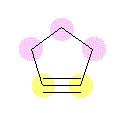
cyclopentyne の骨格構造式を示した。ピンクで表した炭素は、それぞれ4本の σ 結合を持つから、sp3 混成である。これに対し、黄色で表した炭素は、2本の σ 結合と(三重結合中の)2本の π 結合を持つから、sp 混成である。
sp 混成炭素は 180 度の結合角を持つ状態が安定であるので、5員環の中に組みこまれた sp 混成炭素は、結合角の歪みを持つことになる。(正五角形として、内角は 108°である。)このため、cyclopentyne は安定に存在できない。
1.45
与えられた文に、あきらかな誤りが含まれるのではない。教科書 1.11 節を参照しながら、エテンの 結合性 π 分子軌道について述べている短文で、記述が不足であると考えられる部分はどこかを指摘すればよい。
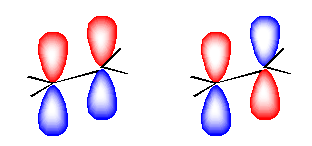
(解答例)
「エテンの 結合性 π 分子軌道は、二つの p 原子軌道が側面から 加法的な組み合わせで 重なった結果である。」
教科書 24 ページ、図 1.18 参照。
なお、次図において、左が2つの p 軌道が「加法的に」重なりあう様子、右が2つの p 軌道が「減法的に」重なりあう様子を、それぞれ模式的に表したもの。
以下、「加法的」「減法的」ということばの意味と、L.C.A.O の考え方について、少しだけ踏み込んで説明する。なお、L.C.A.O とは、Linior Combination of Atomic Orbital のこと、すなわち「原子軌道の線形結合」により分子軌道を作る考え方である(線形結合とは、加法と減法(足し算と引き算)と考えてください)。
まず、ここでは2つの 1s 軌道(原子軌道)から、σ 軌道(分子軌道)を作る様子を模式的に示している。それぞれ、赤と青の丸が 1s 軌道の空間的な形を示していて、その右側の波は、この位相を上と下で表している。
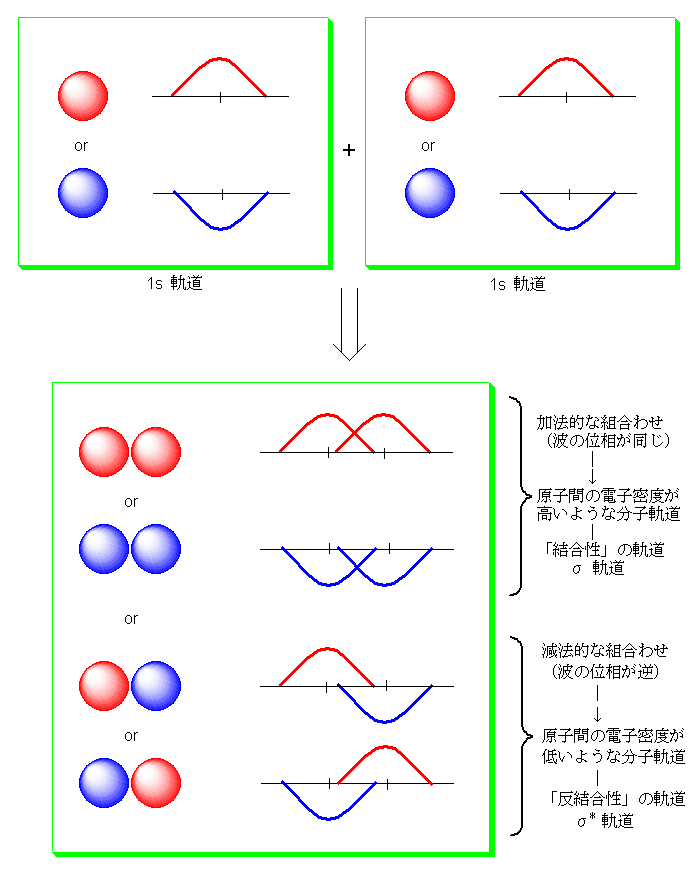
1s 軌道(原子軌道)は、それぞれ赤と青の2つの位相(ある瞬間に波がどちら向きの振幅を持っているか)のどちらでも表すことができる。従って、2つの 1s 軌道(原子軌道)の組み合わせとしては、全部で4通り、赤−赤、青−青、赤−青、青−赤 があり得る。赤−赤、青−青の組み合わせの場合は、2つの原子軌道の波の位相が同じだから、原子と原子の間の位置でも波は強めあう。そのため、2つの原子核の間に電子がいることになり、すなわち原子核同士を結合させる働きをもつ。(結合性 π 分子軌道)
その一方で、赤−青、青−赤の組み合わせになるような場合には、2つの原子軌道の波の位相が逆だから、原子と原子の間の位置では波は弱めあう。そのため、原子核の間には電子な不在で、原子核より結合の外側に電子が多くいるような形になり、すなわち、原子核同士を反発させるような働きを持つ。(反結合性 π 分子軌道)(または、π* 分子軌道)
教科書 p24 の図1.18 のあわせて参照すること。
1.46
中央の炭素の混成状態については、1.10 のヒントを参照すること。決して「二重結合に関与する炭素だから sp2 」といった正しくない認識で結論しないように。
混成状態が判ったら、教科書の図1.14 や 図1.16 などのような、軌道の空間的な配置を示した図を参照しながら、分子の構造を考えること。
なお、「軌道の様子を示せ」というのは、教科書の 図1.14 や 図1.16 に倣って図示せよ、という意味である。
(解答例)
アレン CH2=C=CH2 では、中央の炭素は、2本の σ 結合と(2本の二重結合中の)2本の π 結合を持っているので、「 σ 結合の数+孤立電子対の数」は2で、sp 混成である。
末端の炭素は、3本の σ 結合と(二重結合中の) π 結合を持っているので、「 σ 結合の数+孤立電子対の数」は3で、sp2 混成である。
アレンの3つの炭素の軌道を下図に模式的に示した。
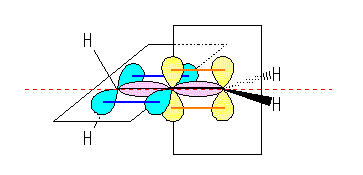
ピンクで示しているのは、左右の炭素の sp2 軌道と、中央炭素の sp 軌道の重なりによって生じる σ 結合である。中央炭素は、2つの p 軌道(青と黄)を持っており、これらは直交した方向にでている。末端の炭素は、それぞれ1つの p 軌道(青および、黄)を持っており、中央の炭素の p 軌道と横方向から重なるようにして π 結合を生じる。従って、2つの π 結合は、互いに直交した2つの面内に広がっている。ゆえに、2つの末端炭素から結合している4つ水素は、同一平面内にはない。
分子模型でアレンを組んでみた。こんなかんじ。

青と緑の軌道板は、それぞれの p 軌道に由来した π 分子軌道。
1.47
1.46 と同様に考えよ。
(解答例)
二酸化炭素 O=C=O では、中央の炭素は、2本の σ 結合と(2本の二重結合中の)2本の π 結合を持っているので、「 σ 結合の数+孤立電子対の数」は2で、sp 混成である。
末端の酸素は、(二重結合中の)1本の σ 結合と1本の π 結合、および2対の孤立電子対を持っているので、「 σ 結合の数+孤立電子対の数」は3で、sp2 混成である。
二酸化炭素の炭素および酸素の持つ軌道を下図に模式的に示した。1.43 で描いたアレンと同じ構造であることに注意せよ。
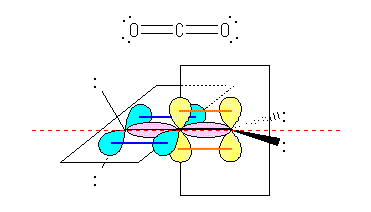
ピンクで示しているのは、左右の酸素の sp2 軌道と、中央炭素の sp 軌道の重なりによって生じる σ 結合である。中央炭素は、2つの p 軌道(青と黄)を持っており、これらは直交した方向にでている。末端の酸素は、それぞれ1つの p 軌道(青および、黄)を持っており、中央の炭素の p 軌道と横方向から重なるようにして π 結合を生じる。従って、2つの π 結合は、互いに直交した2つの面内に広がっている。ゆえに、2つの末端酸素の4対の孤立電子対は、同一平面内にはない。
1.48
化合物中で共有結合を形成し、電気的に中性な原子が最外殻において閉殻構造を満たしたときに、孤立電子対をもつためには、もともと最外殻に5つ以上の電子が入っていることが条件である。すなわち、窒素、酸素、ハロゲンなどがその代表である。
混成状態については、1.10 のヒントを参照すること。
カフェイン の3次元模型
(解答例)
caffeine の骨格構造式を示した。すべての酸素は孤立電子対を2対、すべての窒素は孤立電子対を1対もつ。また、ピンクで表した炭素は4本の σ 結合を、ピンクで表した窒素は3本の σ 結合と孤立電子対を、それぞれ持つから、sp3 混成である。これに対し、水色で表した炭素、酸素、窒素は、二重結合を持つからその中に π 結合を1つ持ち、 σ 結合と孤立電子対の数の和が3であるから、sp2 混成である。
問題の図中、矢印でしめされている原子(図中、赤フォントで示した)は、すべて sp2 混成である。
(発展)
1.20 と同様に、1.10 のヒントの表からの例外がある。解答例の構造において、緑の丸をつけた3つの窒素(環内で二重結合の関与した窒素を除く3つの窒素)は、すべて3本の単結合と1対の孤立電子対を持つので、1.10 のヒントに載せた表からは、sp3混成であるように考えられるが、分子の3次元構造を確認すると平面内3配位の構造をもつことがわかる。すなわち、sp2混成となっていると考えるのが妥当である。隣接した位置のカルボニル基や環骨格内の二重結合の p 軌道と同じ方向を向いた p 軌道が窒素の孤立電子対を格納することで、分子が平面性を持ち、分子全体に電子雲が広がることができるようになるためである。
1.49
C+ は、電子配置だけみれば、ホウ素 B と同じであることに注意。
(a) 中性の炭素は、価電子(最外殻電子)を4つ持つ。価電子殻(最外殻)に電子を1つ余分に持つと、マイナスの電荷を帯びた炭素( C− )となり、逆に価電子殻(最外殻)の電子が1つ少なければプラスの電荷を帯びた炭素( C+ )となる。
(b) s や p の副殻にある1つの価電子と、他の原子(水素など)からの電子1つとが共有結合をつくる。この際、すべての C−H 結合が等価になるためには、炭素は混成状態になる必要がでてくる。逆にいえば、他原子とのシグマ結合の形成に係わらない電子や軌道は、混成しないといえる。
(c) 混成状態がわかれば、その軌道の出ている方向が判る。
また、この結果でてくる形は、このカルボカチオンについて考えれば、C−H 結合の共有結合電子同士が互いに最も遠い距離になるような配置である。
(解答例)
(a) 中性の炭素原子、6C は、電子配置(1s)2(2s)2(2p)2 で、4つの価電子をもつ。価電子を1つ失うと、原子は正のイオンとなるから、6C+ の価電子は3つである。
(b) 6C+ は、基底状態で(1s)2(2s)2(2p)1 の電子配置であるから、まず、3本の等価なシグマ結合をつくるために 2s 電子を 2p 軌道に昇位させると (1s)2(2s)1(2p)2 の電子配置となる。3つある 2p 軌道のうち、1つは空である。電子の入っている軌道 (2s)1(2p)2 だけで混成するので、sp2 混成となる。この炭素は、混成していない p 軌道を1つ持つが、この軌道に電子は入っておらず、空のままである。
(c) 従って、カルボカチオンは平面内に3本の結合が、結合角 120度で出ている。これは、3本の結合が空間内で互いになるべく離れた位置に来ようとして生じる構造である。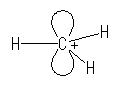
1.50
C− は、電子配置だけみれば、窒素 N と同じであることに注意。
1.49 と同様に考える。また、答えを 1.49 と対比させておく必要がある。
(解答例)
(a)(b) 中性の炭素原子、6C は、電子配置(1s)2(2s)2(2p)2 で、4つの価電子をもつ。新たに価電子を1つ得ると、原子は負のイオンとなるから、6C- の価電子は5つで、電子配置は (1s)2(2s)2(2p)3 となる。この電子配置は、3価の窒素 7N と同じであるから、カルボアニオン CH3- の構造は、アンモニア NH3 の構造と相同である。
(c) 3本の σ 結合と、孤立電子対1対を持つから、sp3 混成である。
(d) 3本の σ 結合と孤立電子対が空間内で互いに一番離れた配置となるから、正四面体の対称性をもつ。
1.51-1.56
1.51
炭素の4つの価電子のうち、2つが水素との間で共有結合を形成するのに使用され、2つが結合を形成せずに残っているのがカルベンである。この残りの2つの電子が1つの軌道に対をなして入っているときは、「2本の σ 結合と1対の非共有電子対をもつ」原子と同じ混成を持つことになる。一方、これら2つの電子が別の2つの軌道を占めていく時には、分子内にあきらかに存在する「 σ 結合数+孤立電子対の数」は、2であるが、1つずつ電子の入った軌道が、σ 結合数と離れようとして孤立電子対のように振る舞うか、あるいは、σ 結合との間にほとんど空間的な反発の無い空の軌道のように振る舞うかによって、炭素の混成状態と、従って分子の形が変わってくる。
(解答例)
1) 結合に関与しない2つの電子が、1つの軌道に入る場合:
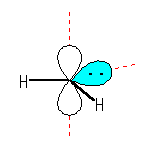
白で示したのは p 軌道、水色で表したのは sp2 混成軌道である。
結合に関与しない2つの電子が1つの軌道の中に逆向きのスピンで対となって入って孤立電子対を形成する場合には、炭素の持つ「 σ 結合の数+孤立電子対の数」が3であるから、sp2 混成となる。そして、この孤立電子対と2本の C−H 結合が互いに反発しあい、120度の結合角となる。中心炭素は、3つの sp2 混成軌道と直交した方向を向いた空の p 軌道を一つ残しているが、空なので、他の軌道との間の反発はない。この分子の多重度は1(一重項)である。
2) 結合に関与しない2つの電子が、それぞれ異なる軌道に入る場合:
Hund の法則(2つ以上のエネルギーの等しい軌道に電子が入る場合、まず、すべての軌道に同じスピンの向きで電子が1つずつ入っていく)により、結合に関与しない2つの電子は同じスピンの向きを持つので、三重項、である。
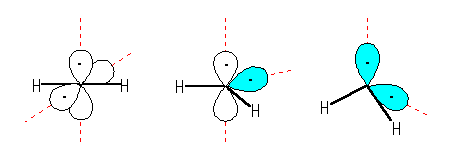
左より sp 混成、sp2 混成、sp3 混成の炭素を用いて三重項カルベン CH2 を表そうとした場合。
ただし、白で示したのは p 軌道、水色で表したのは sp2 および sp3 混成軌道である。
不対電子とσ 結合の共有電子対との間にさほど大きな反発が無い場合には、空間内で互いに最も離れようとするのは2本の σ 結合だけで、「 σ 結合の数+孤立電子対の数」は2であって sp 混成を生じる(上図、左端)。このとき、カルベン CH2 は直線構造を持つ。この場合、結合に関与しない2つの電子は、2つの直交した p 軌道に入る。実際に、直線構造をした三重項カルベンが実験的に知られている。
さまざまな理由で分子の構造に制約が加えられたときなど、曲がった三重項カルベンも存在することが知られている。この場合には、上図中央のように sp2 混成軌道および p 軌道に不対電子が1つずつ入るか、または上図右端のように2つの sp3 混成軌道に不対電子が入るかのいずれかで考えることができる。ただし、これらを区別することができるような情報は、ここでは示されていない。
1.52
炭素は4本のシグマ結合を持つことができるという観点から、4つの炭素を並べる方法について考えると、途中で分岐せず直線的に並んでいる場合と、途中で枝分かれする場合がある。
(解答例)
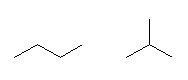
butane, 2-methylpropane
炭素の並び方が異なる。これらは骨格異性体である。
(発展)
異性体は、同じ分子式でありながら異なる性質を示す(=別の)物質のこと。
炭素の並び方が異なる骨格異性体は、構造異性体(教科書 78ページ)のうちのひとつである。
1.53
分子式 C3H6 は、プロパン propane, C3H8 よりも水素が2つ分少ない。プロパンから2つの水素を取り除くことを考えると、そのパターンに2種類あることに気付く。
(解答例)
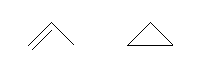
propene, cyclopropane
左は二重結合を持ち、右は環構造を持つ。これらは骨格異性体である。
1.54
炭素は4本のシグマ結合を持つことができ、酸素は2本のシグマ結合を持つことができる。これに留意して、2つの炭素および1つの酸素の並び順について、どのようなものがあるか考えればよい。
(解答例)
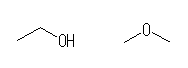
ethanol, dimethyl ether
左はアルコール、右はエーテルである。これらは官能基異性体である。
(発展)
上2問と同じように構造異性体であるが、炭素以外の原子を含めた部分において結合の順序が異なっているこれらは、骨格異性体とは呼ばれない。化合物の化学反応性を決めるような分子の部分構造(アルコール類においては -OH、エーテル類においては、-O- )を官能基と呼ぶ。非常におおざっぱな言い方をすれば、官能基が異なる異性体であるということは、骨格異性体のときよりも性質の差が大きいということを意味している。
1.55
二重結合をもつ最も単純な分子、エテン ethene, C2H4 は、4本の C−H 結合を持っている。この分子に対し、炭素をあと2つ持たせるための炭素の並び方については、4種類の異なる方法がある。(二重結合の「シス−トランス異性体(教科書 6.4 節参照)」を区別しない場合には、3種類となる。)
(解答例)
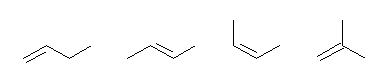
but-1-ene, trans-but-2-ene, cis-but-2-ene, 2-methylpropene
左のものと中央2つとは、二重結合の位置が異なる位置異性体である。
中央2つは、二重結合についたアルキル基の配置が異なっており、立体異性体(幾何異性体)である。
右のものは、左のもの3つと炭素の並びが異なっており、構造異性体である。
1.56
混成状態については、1.10 のヒントに挙げた表などを参照すること。
(c) 「構造の類似性」は、まずは構造式の上から探せばよい。発展の項も参照のこと。
イブプロフェン の3次元模型
ナプロキセン の3次元模型
アセトアミノフェン の3次元模型
(解答例)
以下の構造式中、sp2 混成状態をとる原子をピンクで、sp3 混成状態をとる原子を水色で示した。アセトアミノフェンの緑の丸で囲んだ窒素は、3次元構造より sp2 混成をとっていると考えるほうが妥当である(1.20 発展の項参照)。
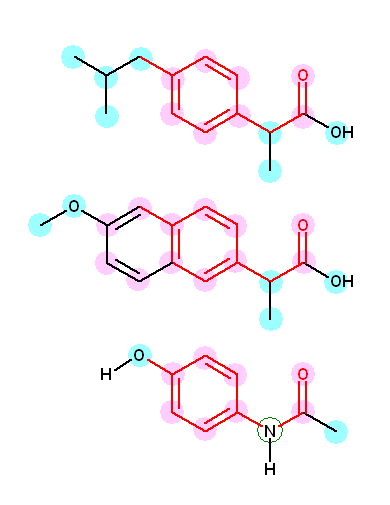
従って、(a) 、(b)
イブプロフェン:sp2 炭素7個、sp3 炭素6個。
ナプロキセン:sp2 炭素11個、sp3 炭素3個。
アセトアミノフェン:sp2 炭素7個、sp3 炭素1個。
(c) 構造式中の類似点を、上図において赤で示した。すなわち、いずれもベンゼン環をもち、ひとつ原子をおいてからカルボニル基(C=O)がある。
(発展)
構造の類似した物質が、類似した薬理作用を示すことがあるのは、生体内でその物質が酵素などと相互作用を示す様式が似ているためであると考えられる。ただし、骨格構造式の上で似ているように見えても、それだけで判断することはできない。原子の種類、立体的な構造、分子中の電子密度などが異なることにより振る舞いが全く異なることも考えられる。