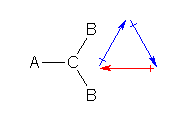
1.01-1.10
1.01
原子核は、「+1の正電荷をもつ陽子」と「電気的に中性である中性子」とからできている。陽子の数が、原子核のもつ正の電荷の総数であるため、イオン化していない原子は、原子核中の陽子の数と同じだけの電子を周囲にもつことになる。この原子核中の陽子の数が、元素の種類を決め、原子番号とよばれる。中性子の数は元素の種類ごとにほぼ決まっているが何種類かの値をとりうるものがある。中性子の数が異なっても、陽子の数が同じであるならば、同じ種類の元素である。原子質量は変わるので、これらは同位体の関係にあるという。記号の左肩に書かれている原子の質量数は、結局のところ(電子の重さはほとんど無視できるほど小さく、原子核の重さだけで決まるから)陽子の数と中性子の数の和になっている。
(解答例)
16O : 陽子 8 個、中性子 8個
17O : 陽子 8 個、中性子 9個
18O : 陽子 8 個、中性子 10個
(注意)
なお、試験で同じ問題を出題した場合、教科書の巻末の略解のような記述(8+8)では、正解としない。(問題文の、いくつの陽子と中性子が含まれているか、という問いに対して、指示にきちんと答えていないため。)
1.02
加重平均(存在割合の重みを考慮した平均)をとることになりますから、35の質量数の同位体が75%、37の質量数の同位体が25%であるなら、計算式は次のようになります。
(35×0.75) + (37×0.25)
実際には、問題文に与えられている精密な値を用いて計算することになります。
(解答例)
35.453
原子質量の単位は amu です。(教科書 p5。問題のすぐ上参照。)
(注意)
教科書の巻末の略解では、計算した数値にミスプリントがあります。
1.03
原子の最外殻にある電子は、「価電子」とよばれる。(教科書)
(解答例)
5B : 3 個。
7N : 5 個。
8O : 6 個。
9F : 7 個。
1.04
a) 電子配置は、原子番号をもとに、構成原理に従い機械的に配置する。
または、その元素が周期と族の番号からも、電子配置を書くことができる。たとえば、ヨウ素(I)は、第5周期の第17族(ハロゲン族)であるから、(K殻)2(L殻)8(M殻)18(N殻)18(O殻)7の形となる。(ここで、M殻の 3d 軌道は、4s → 3d → 4p の順であるべきだから、埋まっているので、(M殻)18。また、N殻の 4d 軌道も、5s → 4d → 5p なので埋まっているが、4f 軌道は、6s → 4f → 5d → 6p の順なので電子が入っていないため、(N殻)18 である。)
ただし、電子配置を書くとき、軌道(1s, 2s …)のエネルギーの順序は正しく書くこと。
b) a) で求めた電子配置から数えてもよいが、周期表のどの位置にある元素か(第何族なのか)がわかれば、答えもおのずとわかる問いである。
(解答例)
a. 電子配置をきちんと書くと次の通り。
17Cl :
(1s)2(2s)2(2p)6(3s)2(3p)5
35Br :
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)5
53I :
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10(4p)6(5s)2(4d)10(5p)5
※ ここでは、式で示したが授業で板書したように、軌道を示す横線と配置する電子を示す上下の矢印とで電子配置を書く方式もある。フント則を反映させて電子配置を書くためには、後者の方法を用いるなどが必要となる。
b. いずれについても、7つ。
1.05
元素名が周期表のどの位置にあるかを確認させるのが狙いの問題であるから、周期表を見て探せ。
たとえば臭素は、最外殻がM殻であるから、内殻とは K殻とL殻のことである。
(解答例)
いずれも同族元素であり、周期表では同じ縦の列内で上下の位置に属する。同族元素同士は、価電子数が等しい。
a) 炭素(内殻電子2個、価電子4個)、ケイ素(内殻電子10個、価電子4個)
b) フッ素(内殻電子2個、価電子7個)、臭素(内殻電子18個、価電子7個)
c) 窒素(内殻電子2個、価電子5個)、リン(内殻電子10個、価電子5個)
d) マグネシウム(内殻電子10個、価電子2個)、カルシウム(内殻電子18個、価電子2個)
1.06
さがせ。19番目くらい。
(解答例)
価電子は1個。最外殻の 4s 軌道に電子が1つだけ入っている(不対電子である)。
1.07
電気陰性度の差が大きい = 結合の極性が大きい(結合が大きく分極している) = 部分電荷 δ+ や δ- の値が大きい。
電気陰性度の数値については、プリントを参照するか、教科書 p13 の表1.3 を参照してください。
ちなみに、a) H-CH3 では、水素-炭素の結合についてきかれています。右の-CH3 (メチル基)の水素は、この問いを考える上で無視してOKです。他も一緒です。
(解答例)
結合の両端にある原子について、教科書p13、表1.3より電気陰性度(ElectroNegativity)を読み取って、その差をとる。これを、ΔEN として数値を示すことにする。
a)
H-CH3
EN(H) = 2.1
EN(C) = 2.5
∴ ΔEN = 0.4
Cl-CH3
EN(Cl) = 3.0
EN(C) = 2.5
∴ ΔEN = 0.5
従って、後者、Cl-CH3 の結合の方がより大きく分極しており、大きな極性をもつ。(※)
b)
H-OH (ΔEN = 1.4), H-H (ΔEN = 0)
従って、H-OH の結合の方が大きく分極しており、大きな極性をもつ。
c)
H-Cl (ΔEN = 0.9), H-F (ΔEN = 1.9)
従って、H-F の結合の方が大きく分極しており、大きな極性をもつ。
d)
Cl-Cl (ΔEN = 0), Cl-C3 (ΔEN = 0.5)
従って、Cl-C3 の結合の方が大きく分極しており、大きな極性をもつ。
(※)たとえば、a) の答えだが、分極の程度(電気陰性度の差)は、0.4 と 0.5 であまり大きな差がないようにも思える。しかし、H-CH3 では、炭素側に δ- (負の部分電荷)を持つのに対し、Cl-CH3 では、炭素側にδ+ (正の部分電荷)を持つ。分極の向きが全く逆であることにも注意が必要である。
1.08
1.7 と同じ考え方です。電気陰性度の差が大きい = 結合の極性が大きい(結合が大きく分極している) = 部分電荷 δ+ や δ- の値が大きい。
(解答例)
教科書 p13、表1.3より、電気陰性度の差(ΔEN)をもとめると、
Na-I (ΔEN = 1.6)
Li-Br (ΔEN = 1.8)
Cl-Cl (ΔEN = 0)
K-Cl (ΔEN = 2.2)
a) KCl, b) Cl2
1.09
結合は、炭素−酸素間です。この2つの元素の電気陰性度を調べること。教科書の解等に書かれた解説も参照のこと。
(解答例)
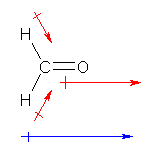
電気陰性度を調べると、炭素よりも酸素の方が大きいことがわかる。そのため、炭素側に正の部分電荷(δ+)があり、酸素側に負の部分電荷(δ-)があるような「極性の向き」をもつ。部分電荷は、その原子の右肩(イオンの電荷と同じ位置。例:Mg2+)に記すようにする。
H3Cδ+-Oδ-H
1.10
1.9 と同じように考えること。
(解答例)
結合の両端にある原子2つについて考え、電気陰性度の小さい元素に δ+ を、電気陰性度のより大きい元素に δ- を付加すればよい。
この問いでは、電気陰性度の大小の相対的な関係が問われている。表 1.3 に戻って具体的な数値を確認しなくても、この問いに挙げられた組の元素では、電気陰性度の大小関係が判断できなくてはならない。
a) HOδ--Hδ+
b) Fδ--Brδ+
c) H3Cδ+-Nδ-H2
d) H3Cδ+-Clδ-
e) HOδ--Brδ+
f) H3Cδ--Liδ+
g) Iδ+-Clδ-
h) H2Nδ+-Oδ-H
電気陰性度の順は、およそ、F > O > N 〜 Cl > C > H > 金属。第二周期元素(F, O, N, C )は、右に行くほど電機陰性度が大。
b), g) は、周期表の縦の位置関係で理解すること。( F > Cl > Br > I の順、上に行くほど電気陰性度が大。)
1.11-1.20
1.11
(重要)教科書 p14 中ほど、双極子モーメントを求める式の下2〜3行目にかけての文章は、次のように訂正しておいてください。
(誤)極性結合における電荷間の距離は、10-8 cm であるから、電荷と距離の積は、…
(正)極性結合における電荷間の距離が、10-8 cm であるとするなら、電荷と距離の積は、…
電荷間の距離は、その2つの原子の間の結合長であったり、陽イオン、陰イオンの半径の和だったりしますから、いつも決まっているものではありません。
なお、(授業でもコメントしましたが)電子の電荷(電気素量)を 4.8×10-10 [esu] として覚えておくよりも、電気素量の電荷×1Å で決まる双極子モーメントの大きさが 4.8 D であると覚えておくことを推奨します。(結局覚えるべき数値は、ほぼ一緒ですが。)
求められるべき電荷の大きさは、絶対値として(esu単位で、または C 単位で)算出することを求められることはほぼありません。電気素量に対する割合として算出することになります。なので、「電荷の大きさ × 電荷間の距離」で双極子モーメントが求まる = 双極子モーメントは、電荷の大きさに比例し、電荷間の距離にも比例する という関係を使うとよいです。
また、教科書の解等のところに「フッ素原子上の部分負電荷は、全電荷の 0.24 倍と計算できる」とありますが、ここで ”全電荷”という言葉は、電気素量(電子1個がもつ ”全電荷” ← 部分電荷ではなく)という意味です。フッ素と炭素の両方の部分電荷を足したもの(δ+ = 0.24+ と δ- = 0.24- を足すと零になってしまうのですが)を全電荷と言っているわけではないです。
(解答例)
炭素、フッ素の各原子が(部分的に)正、負に帯電している状態を考えて、その電荷間の距離は結合距離と等しいという前提で考える。
「フッ素が完全に負に帯電している場合には」(仮定をたてて計算する。)
C-F 結合が、完全に、イオンの対 C+ と F- になっている場合には
Q の値として、電子1個分の電荷(電気素量)を使うから、
「その双極子モーメントは…」
μ = Q × r の式に、
Q = 4.80 × 10-10 esu
r = 1.39 Å(= 1.39 × 10-10 m = 1.39 × 10-8 cm)
を代入して、単位を換算すると、教科書の式の通りで、6.67 D になる。
以上が教科書の解説で行われている計算であるが、次にように計算してもよい。
電子1個分の電荷(電気素量)が 1Å離れた位置にあるとき、その双極子モーメントの大きさは、4.80 D であった。今、電荷間の距離が 1.39 Åなので、(μ = Q × r の式より、電荷の大きさが同じなら、双極子モーメントは距離に比例するから、)
4.80 × 1.39/1 = 6.67
「(実測の)双極子モーメントが 1.60 D であることを用いると、」
電荷間の距離 r が固定であるとするなら、μ = Q × r で計算されるべき μ の値が 6.67 D より小さい値になっているのは、電荷 Q が、電子1個分の電荷より小さかったためである。
従って、この分極の割合を求めるための計算式は、
1.60 / 6.67 = 0.24
部分電荷の大きさは、電子1個分の電荷(電気素量)の 0.24 倍である。
(あまり、こういう書き方はしないが、無理やり書くなら、「 C0.24+− F0.24-」という意味。)
(発展)
双極子モーメントについて、大事なところをもういちど箇条書きにしておきます。
・双極子モーメントは、実測により決定できる量です。
・双極子モーメント μ は、μ = Q × r の式で表すことができます。Q は電荷の大きさ、r は電荷間の距離です。
・r = 1 Å、Q が電子と同じ電荷(電気素量)のとき、μ = 4.8 D です。
従って、ある物質(分子)の双極子モーメント μ の値がわかっているとき
・電荷の大きさ Q がわかれば、電荷間の距離 r を計算することができます。
・電荷間の距離 r がわかれば、電荷の大きさ Q を計算することができます。
実際には、電荷間の距離 r は、分子の構造(結合距離など)と関連付ける場合が多いです。電荷の大きさは、電子1個単位ではなく(電気素量の整数倍の値ではなく)、その 20 % だとか、50 % だとかの半端な値になる場合が多いです。
原子核や分子の骨格に沿って広がっている電子は、点として存在するのではなく、ある確率分布で、雲のように非局在化して存在しているためです。
なお、この教科書は、単位系の扱いがやや特殊ですね。計算結果として出てくる数値が単純になるためではあるものの、電荷量に [esu] 単位を用いたり、1 Å を 1×10-10 m と書く代わりに、1×10-8 cm と書いてみたり。もちろん、後者は、cgsガウス単位系を意識しているため、SI単位系(国際単位系)とは異なり、長さの基本単位に cm を持ってきているからなのですが。
単位系についてきちんと習熟してからであれば、いろいろな単位系を用いてももちろんよいのですが、はじめのうちは話を単純にするために、基本となる SI単位系のみを使うようにしたほうがよいでしょう。SI単位系では、長さの基本単位は m です。
「電気素量」は「電荷素量」と書く場合もあるようです。
1.12
もちろん、「電荷の大きさ(Q) × 電荷間の距離(r)」で双極子モーメント(μ)が求まるので、その一方が大きくても、もう一方が小さければ、積が小さくなるケースはありえるわけです。そのことを、具体的な数値に基づき説明することになります。p14 の表1.4 に、双極子モーメントの値があります。電荷の大きさ(原子上にある部分電荷の大きさ = 分極の大きさ)は、電気陰性度の差に依存することを思い出すこと。
(解答例)
電荷×距離の関係で求められる双極子モーメント μ は、大×長 のとき、最も大きくなる。H-Cl と H-F を比較すると、小×長 と 大×短 の組み合わせなので、どちらが大きくなってもおかしくありません。
問題文に結合距離のデータが示されているわけではないが、調べてみると、rH-F = 0.92 Å、rH-Cl = 1.28 Å となっており、約1.4倍です。この値と、教科書 p14、表1.4 に与えられている双極子モーメント μ をもとに相対的な電荷量(電気素量に対する割合)を計算してみると、次のような値になります。
QH-F = (1.7/0.92)/4.8 = 0.39
QH-Cl = (1.1/1.28)/4.8 = 0.18
カッコの中、双極子モーメントを結合長で割った結果で出てくるのは、同じ電荷を 1 Å の距離に置いたときの双極子モーメントの大きさです。この距離で電気素量の電荷があった場合には 4.8 D となるので、比をとることで電荷の大きさ(電気素量に対する割合)を求めています。
電気陰性度の差を調べると、H-Cl では、ΔEN = 0.9、H-F では、ΔEN = 1.9 と約2倍でした。これは上で求めた相対的な電荷量の比とほぼ一致します。
以上のように、H-F では、距離が 1.4倍短くても、部分電荷の量が2倍程度に大きいため、双極子モーメントが大きくなっているということがわかります。
1.13
ここでは、静電ポテンシャル図をみながら分子の分極の様子を判断できることを求めています。それぞれの問いは、静電ポテンシャル図がなくても電気陰性度の表から答えられるのですが、図との関連で答えるのがよいでしょう。
b で「水素原子の大きさ」を問題にしていますね。原子の大きさは、原子核の周囲にいる電子が広がっている空間の大きさで決まります。すなわち、原子核の周囲にいる電子の量が少ない(部分正電荷をもっている)場合には、電気的中性である場合よりも原子の大きさが小さくなり、逆の場合(部分負電荷をもっている)には、電気的中性である場合よりも原子の大きさが大きくなります。
c は、色から判断してください。
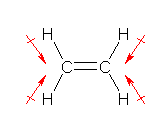
(解答例)
a) 極性をもつ化合物は、静電ポテンシャル図において、正の部分(青)と、負の部分(赤)が生じている。従って、LiH と HF である。
b) 原子の大きさは、原子核の周囲の電子雲の大きさで決まる(教科書 p4 〜 p5 参照)。そのため、Hδ+ と Hδ- では、より周囲の電子が多い Hδ- の方が大きくなる傾向にある。
LiH では、赤い部分が水素である。Hδ- に帯電しているので、中性の水素原子(H-H における水素原子)より大きくなっている。HF では、青い部分が水素である。Hδ+ に帯電しているので、中性の水素原子より小さくなっている。
c) 色から判断できる。水素の位置がもっとも青くなっているので、HF である。
静電ポテンシャル図において、どの位置にどの元素があるのかが示されていない場合、元素の電気陰性度の大小から、分極の方向を予め予測してから静電ポテンシャル図を見る必要がある。
1.14
形式電荷がどこにあるかを問われている場合、ルイス構造がかけなくてはいけません。各原子が、何本の共有結合を持っているのか、孤立電子対を何対持っているのか、により(その化合物の構造で、その原子が示す)価電子数が決まるからです。
また、電子密度を問うところでは、静電ポテンシャル図を見て判断してください。
なお、問題の第1文目に書かれている内容は、授業でコメントしたとおりの内容ですね。「形式電荷が正(+)だからといって、同じ分子内の形式電荷を持たない原子よりも電子密度が低いというわけではない」「形式電荷が負(−)だからといって、同じ分子内の形式電荷をもたない原子よりも電子密度が高いというわけではない」
調べるべき静電ポテンシャル図は、問題文のすぐ上にあるものです。
(解答例)
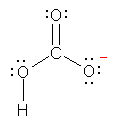
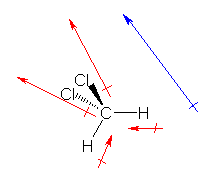
a) 水酸化物イオン HO- の電子構造を示すと次図のようになる。
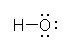
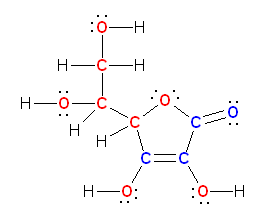
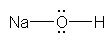
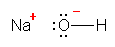
酸素は、水素との共有結合でひとつ、周囲の3対の孤立電子対で6つ、合計7つの価電子をもっている。一方、酸素原子は、価電子数6で中性となるから、HO-においては、酸素原子の価電子がひとつ多く、酸素原子が形式電荷「-1」をもっている。
b) 水酸化物イオンの静電ポテンシャル図(教科書 p17) を確認すると、水素は黄緑、酸素は赤となっていて、酸素側の方がより陰性となっていることがわかる。分子全体で「-1」価のイオンであるため、分子内では相対的に正に分極しているものの水素上に青色は見当たらない。
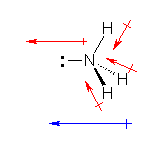
c) オキソニウムイオン H3O+ の電子構造を示すと次図のようになる。
酸素は、水素との共有結合で3つ、周囲の孤立電子対で2つ、合計5つの価電子をもっている。酸素原子は、価電子数5で中性となることから、オキソニウムイオンにおいては、酸素原子の価電子がひとつ少なく、酸素原子が形式電荷「+1」をもっている。
d) 静電ポテンシャル図をみると、分子全体で「+1」の電荷をもつイオンであることから、全体的に青く見えるが、その中でも相対的に青色の薄い部分を探すと、酸素上でやや青が薄いことがわかる。これは、イオン全体とすると(正の電荷をもち)電子が不足しているながら、電気陰性度の高い酸素側に電荷が偏っていることを示す。
ここで整理しておくべきことは、次の点である。
また、イオンがもつ電荷は、表面電荷の絶対値として現れる。従って、中性の水における酸素より、オキソニウムイオンの酸素の方が、より陽性(静電ポテンシャルマップで青色)になっている。したがって、オキソニウムイオン(の酸素原子)が、正電荷をもつイオンとしてはたらくこともあり得ることを示唆する。
しかしながら、分子内の分極は、分子内での相対的な電気陰性度の大小で決まっている。すなわち、「酸素原子が、+1 の形式電荷をもつからといって、オキソニウムイオンを構成するほかの原子(水素)よりも正に分極しているわけではない。」形式電荷は、分子全体の電荷をケクレ構造式の規則に従って構造を書く際、どの原子に電荷をわりあてるかを「形式的に」決めるだけであることを示す。
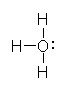
もちろん、孤立電子対は価電子2つとして数えるのに対し、共有結合は価電子1つとして数えるのであるから、上のように1から電子構造を書き下さなくても、次図のように中性の水分子から、オキソニウムイオンや水酸化物イオンが生じることを考えても、形式電荷がどこに描かれるべきかは判断できるだろう。
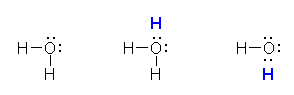
図で、青い H は、水素原子(プロトン)(または、水素イオン、H+) を表す。
(発展)
ある原子がもともと最外殻にもつ電子の数(価電子数、第1族の場合は1、第2族の場合は2、第3族の場合は3…)が、結合の数や孤立電子対の数を決めた。たとえば、酸素は、価電子数が6で、2本の結合と2対の孤立電子対をもった。
ところが、オキソニウムイオン H3O+ の酸素のように、アンモニア窒素と同じように3本の結合と1対の孤立電子対をもつためには、酸素の価電子の数が、窒素と同じ5である必要がある。すなわち、中性の酸素原子から電子をひとつ奪うことでこの電子状態を達成できる。そのとき、酸素の「形式電荷は+1である。」
すなわち、結合の本数と孤立電子対の数のパターンだけから、形式電荷を見出すことが可能である。
実際の H3O+ というイオンの場合、この酸素だけではなく結合した3つの水素の上にも部分的に正電荷が広がっているのであるが、形式電荷を考える場合は、「水素の形式電荷はゼロで、酸素の形式電荷が+1である」と数える。つまり、形式電荷とは、分子の骨格の中にある電子を、かならずいずれかの原子に帰属させてしまう考え方で、Lewis 構造(点電子構造)に対応したものとなる。
1.15
まず、すべての原子について価電子を数えよ。ただし、化合物(分子の構造)中の原子の価電子とは、
1) 孤立電子対(非結合電子対)は、2個と数える。
2) 共有結合は、1本につき1個と数える。(二重結合は2個、三重結合は3個)
次に、その元素が中性原子であるときに本来もつ価電子の数と比較する。
同じであるなら形式電荷はない。
(解答例)
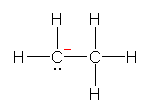
a) 酸素原子の価電子が5個となっており、1個少ない。従って、「酸素が+1の形式電荷をもつ。」
b) 炭素原子の価電子が5個となっており、1個多い。従って、「炭素が−1の形式電荷をもつ。」(カルバニオンである。)
c) 窒素原子の価電子が4個となっており、1個少ない。従って、「窒素が+1の形式電荷をもつ。」
d) 窒素原子の価電子が4個となっており、1個少ない。また、ホウ素原子の価電子が4個となっており、1個多い。従って、「窒素が+1の形式電荷をもち、ホウ素が−1の形式電荷をもつ。」
※ 文章で書かずに、構造式中に「+」や「−」の記号を書き込む方法で示してもよい。
(発展)
なお、b) で、炭素が3本の結合をもっていても、孤立電子がない場合には、電気的に中性なホウ素原子と同じ電子配置であり、形式電荷は「+1」となることに注意するべし。
酸素、窒素の場合は、形式電荷が+1であるか、−1であるかによって共有結合の本数に違いがあるので、共有結合の本数から形式電荷を判断できるのですが、炭素の場合は、共有結合の本数が3本の場合には、形式電荷も孤立電子対も書かれていない構造式では判断できないということです。
1.16
平易な分子の Lewis 構造を書くためには、それぞれの元素が、第何族であるか、従って価電子数がいくつであるかを覚えていないといけない。とはいえ、教科書 p18 の図(窒素および炭素について、電気的中性、形式電荷1+、形式電荷1−などのときのルイス構造)のような整理の仕方も平行して覚えておくと便利である。(覚えるほどのことでもなく、構造式をいくつか書いているうちに当たり前になるレベルですが。) 水(H2O)だとか、エタン(CH3CH3)だとかは、この方法で問題なく書ける。
この問題では、少し込み入ったものについて問われている。まず教科書の p18-19 の範囲を読んでみてください。
a),b) は、教科書の解答例を参考にして解く。
なお、c) 以下も同様に考えて解くことができるが、たとえば、
c)、d) では、エタン C2H6 の構造を参考にするとよい。
e) は、メタンアミン CH3NH2 の構造を参考にするとよい。
f) は、Na+とOH- に分けて考えてもよいが、水 H2O の構造を参考にできる。
g) これは、炭酸 H2CO3 の共役塩基(H+ がはずれたもの)である。
また、分子全体として−1の電荷をもつので、電気陰性度の高い酸素にこの分の形式電荷を割り当てるとするなら、
電気的に中性な水素が1本しか結合をもたないこと、
電気的に中性な炭素が4本の結合をもつこと、
電気的に中性な酸素が(2対の孤立電子対と)2本の結合をもつこと、
ただし、形式電荷が−1である酸素は、ハロゲンと同じ電子配置になるので、(3対の孤立電子対と)1本の結合をもつこと、
などの情報からも、構造を書き上げることができるはずである。
h) 分子として中性であるから、まずは全部の原子が中性で形式電荷をもたないものとして結合の本数を決めることができる。
(解答例)
各族元素の結合のパターンとして、第1族、第2族、第13族、第14族は、非結合電子対なしで共有結合が1本、2本、3本、4本。第15族は非結合電子対1対+結合3本、第16族は非結合電子対2対+結合2本、第17族は非結合電子対3対+結合1本というのは、覚えてしまいましょう。(授業で板書しましたね。)
それぞれの元素の結合の数と孤立電子対の数に注意して構造を組み立てていってください。水素、炭素、窒素、酸素について、用いることができるパーツを次図に挙げておきます。
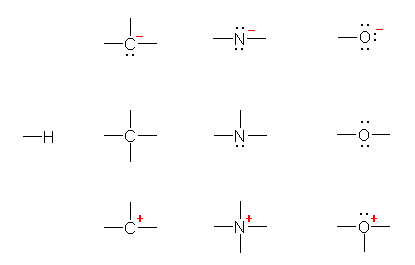
ただし、2本以上の結合は単結合2本であったり、二重結合1本であったりといった変更は許されるものとする。
これらを用い、各元素上の形式電荷の和が分子やイオン全体の価数と一致するように描いた点電子構造(Lewis 構造)を以下に示す。
a)
b)
c)
d)
e)
f)
ただし、ナトリウムと酸素は、電気陰性度の差が非常に大きいため、共有結合というより、ほぼ完全なイオン結合であると解釈することができる。そうすると次図になる。
g)
h)
(発展)
d) では、 C+ をもつ構造(カルボカチオン)を描かざるを得ない。カルボカチオンの C+ は、価電子が3つしかないため、どうしてもオクテットを満たすことはできない。これは、一部のホウ素の化合物(BH3)や、一部のアルミの化合物(AlH3)などと同じである。
なお、カルボカチオンは、オクテットを満たしていないため、孤立電子対をもつ物質(たとえば、水の酸素、塩化物イオン、アミンの窒素、…)とすぐに反応してしまう傾向がある。反応性が高すぎるので、水や油などの身の回りの様々な物質とは異なり、特殊な条件下でないと長時間安定に存在できないと考えてもよいだろう。
しかしながら、今後、いろいろな有機化学反応について学習する中で、反応の途中に(過渡的に)経由する重要な構造としてカルボカチオンを考える場合がでてくることもあり、馴染んでおかなければならない。
1.17
C2H6O の分子式をもつのは、dimethyl ether と、ethanol の2種類の異性体です。
C3H8O の分子式をもつのは、ethyl methyl ether と、propan-1-ol、propan-2-ol の3種類の異性体です。
(解答例)
(重要)問題では「Lewis 構造」が指定されているにも関わらず、教科書の巻末の略解では、酸素上にある孤立電子対(非結合電子対)が描かれていません。
したがって、これは、Lewis 構造であると認められません。教科書と同じ図を書いた場合、試験では不正解になります。
a) C,C,O の3つの原子の並びを考えると、(原子が3つしかないため、枝分かれを考えることはできないので)酸素が端にあるか中央にあるかの2通りが考えられる。
または、propane CH3CH2CH3 について、1級または2級の炭素を酸素に置換して得られる構造を考えてもよい。
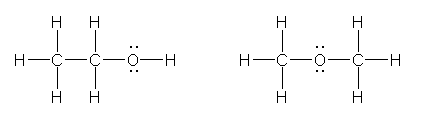
ethanol (ethyl alcohol), methoxymethane (dimethyl ether)
b) C,C,C,O の4つの原子の並びを考える。枝分かれがない場合は、酸素が端にあるか内側にあるかの2通りが考えられる。枝分かれがある場合、酸素は結合を2本しかもたないので、枝分かれの位置には酸素が来ないことを考えると1通りしかかけない。
または、C4H10 の骨格異性体 butane と 2-methylpropane について、1級または2級の炭素を酸素に置換して得られる構造を考えてもよい。
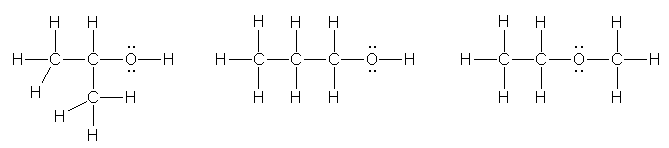
propan-2-ol (isopropyl alcohol), propan-1-ol (propyl alcohol), methoxyethane (ethyl methyl ether)
※ 命名は、置換命名法のあとに、カッコの中に基官能命名法をもちいたものを示した。
1.18
孤立電子対をもつのは、第15族、第16族、第17族の元素である。有機化合物の中で注意しなければいけないのは、主に、酸素(、硫黄)、窒素(、リン)、ハロゲンである。
(解答例)
※ 問い1.17 とは異なり、教科書巻末の答えも正しいです(^_^ 妙なコメントですが。
a) 形式電荷をもたない窒素は、価電子数5なので、3本の結合と1対の孤立電子対をもつ。
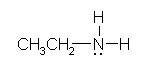
ethanamine (ethyl amine)
b) 形式電荷をもたない窒素は、価電子数5なので、3本の結合と1対の孤立電子対をもつ。
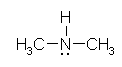
N-methylmethanamine (dimethyl amine)
c) 形式電荷をもたない酸素は、価電子数6なので、2本の結合と2対の孤立電子対をもつ。
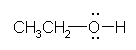
ethanol (ethyl alcohol)
d) 形式電荷をもたない酸素は、価電子数6なので、2本の結合と2対の孤立電子対をもつ。
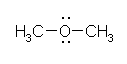
methoxymethane (dimethyl ether)
e) 形式電荷をもたない塩素は、価電子数7なので、1本の結合と3対の孤立電子対をもつ。
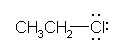
chloroethane (ethyl chloride)
f) 形式電荷をもたない酸素は、価電子数6なので、2本の結合と2対の孤立電子対をもつ。また、形式電荷をもたない窒素は、価電子数5なので、3本の結合と1対の孤立電子対をもつ。
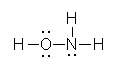
(hydroxylamine)
※ 命名は、置換命名法のあとに、カッコの中に基官能命名法をもちいたものを示した。
(発展)
f) の hydroxylamine ヒドロキシルアミンは、「アンモニア」や「水」と同様、無機物の分類です。また、この名称は、「水酸基+アミン」として組み立てられた名称ではなく、「ヒドロキシルアミン」がひとつの完成された慣用名です。(そのため、水酸基に相当する(現在のルールで)正しい「ヒドロキシ」ではなく、古い言い方に相当する「ヒドロキシル」が使われています。)なぜ、NH3 をなぜアンモニアというのか悩まないのと同じように、H2NOH は、考慮の余地なく「ヒドロキシルアミン」であるとしか言い様のないところです。ネット上などで「ヒドロキシアミン」と書かれている場合がありますが(私の理解している限り)これは、誤りです。
1.19
簡略構造式は、枝分かれのある構造も、なるべく1行内に(タイプライターでタイプできるような形で)書くものである。教科書 p22 の表 1.5 の対応表をよくみておくとよい。特に、ケクレ構造式において主鎖の上下方向に伸ばすような側鎖の分岐も、カッコを用いて1行内に書いていく方法なので、カッコの使い方に慣れるようにしよう。
ただし、カッコには2種類の使い方があることに注意。
1つ目、カッコ内を一つの置換基として明示ことにより、カッコの次に来る別の基がカッコの前の炭素上にあることを明示するもの。例 CH3CH(CH3)CH2CH3 2-methylbutane
2つ目は、同じ構造を繰り返すときに用いるもの。例 CH3(CH2)3CH3 pentane
特に後者では、-CH2- というユニットが3回繰り返されているだけであって、同じ炭素に-CH2 という基が3つ付いているのではない。もし二価基である=CH2 があることを明示したい場合には、CH3C(=CH2)CH2CH3 などと書くべきだろう。あるいは、紛らわしい場合には簡略構造式を用いず、骨格構造式で書けばよい。
※ かならずしも、すべてを1行内に書かないと簡略構造式であるといえないわけではない。
※ 簡略構造式は、環の構造を示したり、分子の立体構造を示したりするのは得意ではない。
(解答例)
教科書の巻末のように書いてもOKです。
ここでは、1行にすべて書くものを例として示します。
a) CH3CH2CH2Cl
さらに、同じ繰り返し単位 -CH2- をカッコでくくり、次のように書くことが可能。
CH3(CH2)2Cl
図の右側(塩素側)から書き始めて、次のようにしても可。
ClCH2CH2CH3
b) 分子内にエステル結合をもっている。この部分を真面目に書くと
CH3C(=O)OCH2CH3
となる。これは、カッコ内の (=O) の構造が、左から2番目の炭素から結合しており、さらに、同じ炭素(左から2番目の炭素)に、カッコに続いて示されている -OCH2CH3 が結合していることを示す。
ただし、エステル結合は、次のいずれの方法で書くことも可能。
CH3CO2CH2CH3
CH3COOCH2CH3
また、同じ分子について、図の右側(エチルエステル側)から簡略構造を書くと、次のようにも書ける。
CH3CH2OC(=O)CH3
または、CH3CH2OCOCH3
エステル結合が、その左右を入れ替えることができない非対称な構造であるから、次のように書いてはいけない。
× CH3CH2CO2CH3
× CH3CH2COOCH3
(これらの書き方では、酢酸エチルの代わりに、プロパン酸メチルの構造を表してしまう。)
c) CH3CH2C(=O)N(CH3)CH2CH3
図の右側(N上のエチル基側)から書き始めると、
CH3CH2N(CH3)C(=O)CH2CH3
d) CH3CH2CN
図の右側(シアノ基側)から書き始める場合は、
NCCH2CH3
とする。
メチル基であれば、CH3- と書いても、-CH3と書いてもよい。右に価標を書く場合には、H3C-と書くこともできる。これは、水素が1本しか結合を持たないため、どの書き方をしても炭素が結合の価標を持つことが明らかだからである。ところが、R-C≡N (ニトリル)では、(やや特殊であるが、その異性体として R-N+≡C:- (イソニトリル)の構造があるので、)「CN」をひとつにまとめて CN-CH2CH3 と書くことができない。
※ 教科書では例示がないが、直鎖のアルキル基を省略して、メチル基であれば -Me、エチル基であれば -Et といった表記、または -C2H5、また、プロピル基であれば -Pr、または -n-C3H7 となる場合もある。直鎖でなくとも、慣用名をもつ分岐アルキル基の場合は、その慣用名に応じた略号を用いることが可能である。
物質名は、次の通り。
a) 1-chloropropane (propyl chloride)
b) ethyl ethanoate
エタン酸(ethanoic acid)の慣用名である「酢酸(acetic acid)」を用いる場合は、
ethyl acetate
稀に、基官能命名法を用いて、ethanoic acid ethyl ester (または、acetic acid ethyl ester)とする場合もある。
c) N-ethyl-N-methylpropanamide
d) propanenitrile
※ b) のエステルの構造は、図で見てわかるように左右非対称な結合様式である。従って1R-CO2-2R で表される構造を、2R-CO2-1R と書いてはいけない。左に2Rが来るように書きたければ、2R-OC(=O)-1Rと書く。
1.20
問い16のヒントをみてください。
(解答例)
a) 第17族元素である、塩素。化合物 a の中にある。
b) 第16族元素である酸素。単結合2本なのか、二重結合1本なのかは問わない。化合物 b の中に2箇所、化合物 c の中に1箇所ある。
c) 第15族元素である窒素。化合物 c の中に1箇所、化合物 d の中に1箇所ある。
d) 第14族より左側の元素すべて。化合物中の、すべての水素、すべての炭素。
1.21-1.30
1.21
問題 19 と同じ考え方。孤立電子対をもつ、酸素、窒素、ハロゲンに注意せよ。
a) ではR-N(CH2)2CH3 と書かれている。この場合は、(CH2) が完結した1価のアルキル基ではないことに注意する。したがって、R-N に結合しているのは、(CH2) 基が2つとCH3基なのではない。CH2CH2CH3基である。
d) の構造 R-CHO は、アルデヒド R-CH(=O) である。
(解答例)
骨格構造式のルールに則った書き方で示しておく。炭素の位置に(第2級であれば)-CH2- などと書き込むのは、可。ただし、炭素の元素記号「C」を書き込んでおいて、その炭素上に結合した水素を省略するのは不可。(たとえば第2級の炭素の位置を -C- とのみ書くのは不可。a) の例で言うなら、C-NH-C-C-C ではダメ、ということです。そこまで書いたら、中途半端にせず、Kekulé 構造として、一切の省略をせずに書いてください。)
※ 問題文の指示により、孤立電子対は、全て示さなければいけない。
※ Kekulé 構造に従い、C-H 結合まで省略せず、すべて書くのが本来の問題の意図かもしれないですね。
a)
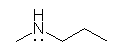
N-methylpropanamine (methyl propyl amine)
b)
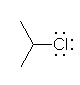
2-chloropropane (isopropyl chloride)
c)
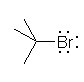
2-bromo-2-methylpropane (tert-butyl bromide)
d)
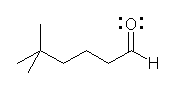
5,5-dimethylhexanal
※ a) 〜 c) の命名のカッコの中は、基官能命名法に従ったものです。
1.22
・1s 軌道、2s 軌道、3s 軌道 … は、電子雲が、いずれも同じ球の対称性を持つ。2s、3s では、動径節があり、より外側(原子核より遠い位置)にまで広がった電子雲をもつ。
・p軌道は、2p、3p、4p…のいずれも、動径節を無視すると、単純に2つの団子を串に刺したような形、あるいは、亜鈴(ダンベル)のような形といわれることもあります。やはり、主量子数が大きいほど外側(原子核より遠い位置)にまで広がった電子雲を持ちます。
(解答例)
軌道の外形は、だいたい次のような感じで書いてしまうことが多い。
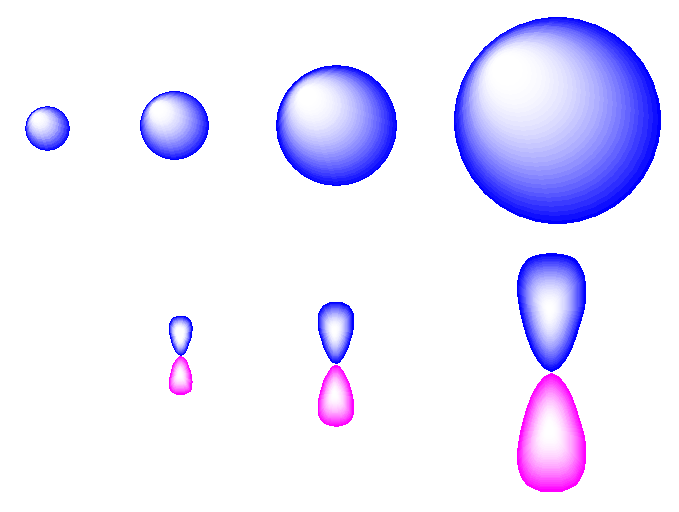
上の4つが、左より 1s, 2s, 3s, 4s、下の3つが左より 2p, 3p, 4p である。
2s, 2p には、節が1つある。2s は表面からだけでは判らないが、動径節となっている。また、3s, 3p はそれぞれ節を2つ、4s, 4p はそれぞれ節を3つもつ。
いま、節も反映させながら、電子雲の密度まで考慮して書くと次のような感じになる。

(発展)
ここでは定性的な説明にとどめているが、定量的に議論するには、量子化学の知識が必要となる。「動径分布関数」は、ある軌道に入っている電子が原子核からどの距離にどのような確率で存在するのかをグラフに表したものである。
「動径分布関数」をキーワードとして検索で表示された、岡山理科大学の若松先生のウェブページ(ここ。外部へのリンクです。新しいウィンドウを開きます。)には、動径分布関数のグラフなどがまとめられているので、興味のある向きはご覧になられるとよいと思う。
一番下の図(r と P(r) の関係のグラフ)から、およそ次のようなことが読み取れる。
・電子が90%程度以上存在する領域を図示すると、1s軌道より2s軌道は2倍程度の大きさになり、3s軌道は2s軌道の2倍程度の大きさになる。
・2s軌道に入っている電子は、そのほとんどは1s軌道の外側に分布している。
・同様に、3s軌道に入っている電子は、そのほとんどが2s軌道の外側に分布している。
・2s軌道と2p軌道を比べると、電子の存在位置は、ほぼ同じであるが、2sよりも2pの方がわずかに近い傾向にある。これは、M殻の軌道についても同様のことが言え、ほぼ同じであるが、3d < 3p < 3s の順となっている。
特に最後の点は、有機化学などを学ぶ際に、漫画的に描かれた軌道図を用いている時、たとえば2sと2p軌道では、2p軌道の方が(方向性があるため、)外に大きく(長く)広がった図を書いたりしがちであることを考えると、注意しておくほうがよいかもしれない。
1.23
He2+ という分子イオンについては、
・ヘリウム原子が水素原子と同様、1s 軌道を使って分子軌道を作っていくこと。
・教科書 p28の図1.4のように作図された MOダイアグラムにおいて、σ と σ* ができるところまでは、H2 分子と同様であること。
・H2 分子では、これらの分子軌道(MO)に、合計2つの電子が入っていったのに対し、He2+ という分子イオンでは、合計3つの電子が入ること。
がわかる。ここより、分子イオンがバラバラの原子に分かれてしまうほうが安定なのか、分子イオンをつくるほうが安定なのかを類推する。
下の(発展)に、He2 分子について述べておくので、これを参考にして考えること。
(解答例)
下、発展の項に続き、He2+ という分子イオンについて考える。そのMOダイアグラムは、ヘリウム原子が分子を作ることのできる距離まで近づいたとき、2つの 1s 軌道から 1σ と 1σ* 軌道をつくるところまでは同じである。しかしながら、今度は、全部で4つの電子ではなく、3つの電子が入っている状態を考えることになる。従って、次図のようになる。
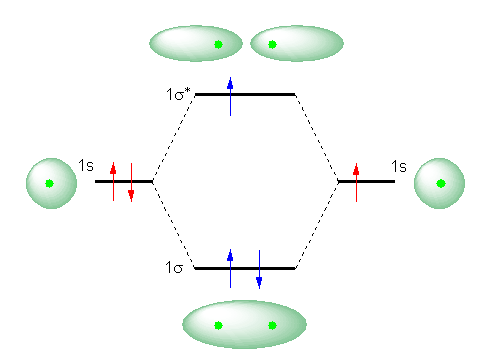
ここで、ばらばらの2つの原子でいる場合(ただし、一方は2つの電子をもち、電気的に中性な単原子分子、もう一方は、He+ という陽イオンとなる。このときの電子配置を赤の矢印で示す)のエネルギーと、分子を作る距離に原子があり、分子軌道をつくっている場合の電子配置(青矢印の電子配置)のエネルギーとを比較すると、分子イオンをつくることにより(1σ軌道に入ることで)安定化できる電子が2つあるのに対し、1σ* に入って不安定化する電子は1つしかないから、トータルでは安定となることが期待される。(ただし、水素分子 H2 で生じているような電子配置に比べると、安定化の総和は半分であるということになるが。)
そのため、He2+ という分子イオンは、安定に存在することができると考えられる。
(発展)
電気的に中性なヘリウム原子は、1s に2つの電子をもつ。そのため、まず、He2 という(電気的に中性の)ヘリウム2原子分子を考えると、そのMOダイアグラムは、次のようになる。
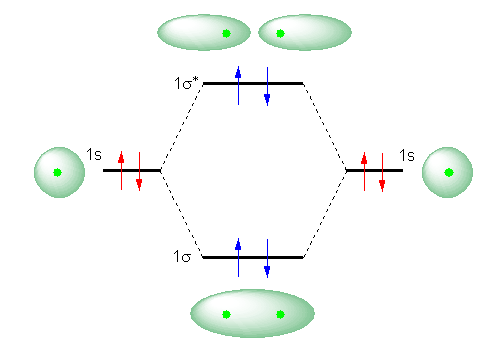
この図において、赤の矢印で示された4つの電子は、それぞれヘリウム原子の 1s 軌道に入っている。すなわち、2つのばらばらの原子として存在しているときの電子配置を表す。
また、この 1s 軌道は、2つの原子が、分子をつくることのできるような距離まで近づくと、相互作用して、1σ と 1σ* 軌道をつくる。このようにして生じた分子軌道に、計4つの電子をいれてやると、上図、青の矢印で示したような電子配置となる。(原子において、構成原理に従い、低いエネルギーの原子軌道から順に2つずつ電子が配置された。同じように、分子においても、低いエネルギーの分子軌道から順に2つずつ電子が配置される。)
ここで、ばらばらの2つの原子でいる場合(赤矢印の電子配置である場合)のエネルギーと、分子を作る距離に原子があり、分子軌道をつくっている場合の電子配置(青矢印の電子配置)のエネルギーとを比較すると、1σ軌道に入ることで安定化した分のエネルギーが、1σ* に入って不安定化することにより、完全に打ち消されてしまい、トータルとして正味の得が全くない状態であることがわかる。
そのため、He2 という2原子分子は、単原子分子 He が2つある状況と比べて、特に安定化されない。これにより、He2 という2原子分子は安定に存在できない。
1.24
p 軌道の伸びた方向からの重なりは、結合の軸の周りに、円筒型の対称性をもつような分子軌道を与えるから、σ 軌道(反結合性の場合は、σ* 軌道)を与える。
p 軌道が横から重なる場合は、原子の結合を含む平面が節面となり、面の上下で波動関数の符号が逆転するような対称性分子軌道として、π 軌道(反結合性の場合は、π* 軌道)を与える。
教科書 p28 図1.4、p29 図1.5、p35 図1.11 などを参照すること。
(解答例)
a) p 軌道が横から重なり、π 軌道となる。隣り合う2つの p 軌道が接しあう位置で位相が逆(波動関数の符号に対応した青と緑が対の色となっている)の関係であり、2つの軌道が接する領域に節面(波動関数で絶対値が0となるようなところ、軌道の模式図においては、青色から緑色に切り替わる境界となる面)ができ、反結合性の軌道を与える。従って、π*
b) p 軌道が横から重なり、π 軌道となる。隣り合う2つの p 軌道が接しあう位置で位相が同じ(波動関数の符号に対応した青と緑が、同色間で接している)関係であり、この2つの軌道の接している領域(2つの原子の間)での波の可算的な強めあいを生じ、結合性の軌道を与える。従って、π
c) p 軌道(または、sp3 などの混成軌道)の伸びた方向から s 軌道と重なっている。この軌道の重なりは、2つの原子核を結ぶ線の回りに円筒型の対称性をもつので、σ 軌道となる。2つの軌道の位相の関係は、2つの原子核の間、2つの軌道の接する位置に節面ができてしまう関係であることから、反結合性の軌道を与える。従って、σ*
d) c) と同様、この2つの軌道の重なりは、2つの原子核を結ぶ線の回りに円筒型の対称性をもつので、σ 軌道となる。2つの軌道は同じ色同士(波動関数の符号が同じ同士)で重なる関係であることから、波の強めあいが生じ、結合性の軌道を与える。従って、σ
1.25
1) プロパンの構造を、Kekulé 構造で書き、まず、「10個の」共有結合を確認すること。
2) 教科書、p34 図1.10 と同様のことを考えればよい。
ここまでで十分に解答できるはずだが、解説がてら書き加えておく。
3) 共有結合の両端の原子がもつ軌道について考える。たとえば、H-H という分子では、それぞれの水素原子の 1s 軌道(原子軌道)が、σ 軌道(分子軌道)を形成する。
4) もっと厳密には、2つの原子軌道(2つの水素原子に由来する 1s 軌道と 1s 軌道)からは、2つの分子軌道(結合性の σ 軌道 と 反結合性の σ* 軌道)ができる。さらに、結合性の分子軌道(結合性の σ 軌道)に電子が2つ入り、ばらばらの原子の状態より安定になる。すなわち「結合が生じる」。
5) 炭素と水素、炭素と炭素の間の結合でも、上と同様のことにより、結合性の分子軌道が生じている。(および、結合性の分子軌道と同時に、反結合性の分子軌道も生じている。)
6) この問いで訊かれているのは、それぞれの原子のどの軌道が、共有結合(結合性の分子軌道)を形成しているのか、ということである。
7) 「結合性の」分子軌道を形成している2つの原子軌道と、「反結合性の」分子軌道を形成する2つの原子軌道は、区別して考える必要はない。(なぜなら、2つの原子軌道が「結合性」「反結合性」の2つの分子軌道を形成するからである。)
(解答例)
3つある炭素原子は、いずれも4本の σ 結合をもっている。従って、sp3 混成の状態である。
2本ある炭素−炭素結合は、それぞれの炭素原子の sp3 - sp3 の重なりによって形成される。
8本ある炭素−水素結合は、炭素原子の sp3 と、水素原子の 1s 軌道の重なりによって形成される。
(発展)
VSEPR(原子価殻電子対反発)理論
(「σ 結合数 + 孤立電子対の数」が分子の対称性を決める)は、有機分子のみならず、無機化合物などの構造を予測するのにも用いられている。(図は、 http://www.uwplatt.edu/~hamiltoj/chem114/ より引用)
1.26
・p 軌道の形と sp3 混成軌道の形を見比べてみてください。
・ここでは、結合が強い = 2つの軌道の同位相間の重なりが大きいと考えてみましょう。
(解答例)
炭素の p 軌道を用いて水素との間で結合を作ろうとすると、p 軌道のもつ電子雲の半分は、水素原子と反対側にあることなる。すなわち、炭素の p 軌道と水素の s 軌道では軌道に大きな重なりが見越せない。
これに対し、sp3 混成軌道はもとの p 軌道よりも一方側に大きく偏った電子雲を持っている。この位置で水素の s 軌道と重なっていく場合、p 軌道の場合よりもずっと大きな重なりが期待できる。このため、より強い共有結合(エネルギー的により安定な分子軌道)を形成すると考えられる。
1.27
まず、sp2 炭素を探すこと。sp2 炭素は、平面三配位をとり、3本の共有結合が同一平面内にくるからである。
なお、ここでは、単結合の回りの自由回転を行わせても、常に指定された炭素が sp2 炭素と同一平面内にくるものを探して答えること。
a) は、but-2-ene 、b) は pent-2-ene である。
(解答例)
青で示したのが、sp2 混成炭素である。また、この sp2 炭素とかならず同一平面内にある範囲をピンク色の σ 結合で示した。
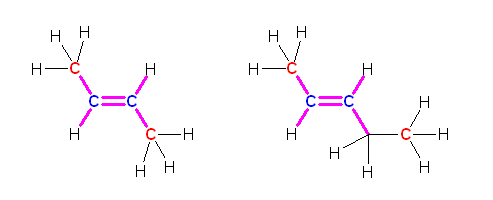
従って、a) but-2-ene は、問題文に示された構造中の2つの sp3 炭素は、常に sp2 炭素のつくる平面内にある。
一方、b) pent-2-ene では、1位の炭素は常に sp2 炭素のつくる平面内にあるものの、5位の炭素は、C4-C5 結合軸の自由回転により同一面内に留まらない。
1.28
たとえば、教科書のp33。
あと、すべての軌道は保存される。
(解答例)
sp3 :1つの s 軌道と3つの p 軌道の混成により生じる。計4つの軌道から、4つ生じる。
sp2 :1つの s 軌道と2つの p 軌道の混成により生じる。計3つの軌道から、3つ生じる。
sp :1つの s 軌道と1つの p 軌道の混成により生じる。計2つの軌道から、2つ生じる。
1.29
教科書、問題に併せて示されている解答例をよく参照すること。
1 は、アルデヒドの構造をもつ。
4 は、物質名ではシアン化水素(別名、青酸)である。H を R(アルキル基)に置換すると、ニトリルの構造である。
sp3 炭素上の結合角、およそ 109.5 度は、およそ 110 度と書いても差し支えない。sp2 炭素上の結合角 120 度と区別できていればよい。実際の分子は、室温付近では、構造式のようにある決まった構造のみをとるのではなく、常に変形し、振動している。構造式や混成状態から予測される分子の形とは、平均的な構造のことである。(なので、0.5度きざみの精確な角度を問題にする必要はない。)
(解答例)
中央の炭素は、3本の σ 結合(2本の C-H 結合、1本の C-O 結合)をもつ。さらに、1本の π 結合(C-O 結合)をもつ。従って、反発に関わる電子対の数は、( σ 結合と孤立電子対なので)3である。よって、 sp2 混成で、結合角は、120度。
2)
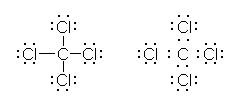
中央の炭素は、4本の σ 結合をもち、sp3 混成である。結合角はおよそ 110 度。
3)
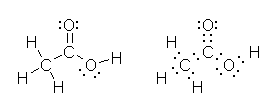
カルボキシ基(-CO2H)の炭素は、3本の σ 結合( C-H 結合、C-C 結合、および C-O 結合)をもつ。さらに、1本の π 結合(C-O 結合)をもつ。従って、反発に関わる電子対の数は、( σ 結合と孤立電子対なので)3で、 sp2 混成で、結合角は、120度。
メチル基(-CH3)の炭素は、4本の σ 結合をもち、sp3 混成である。結合角はおよそ 110 度。
4)
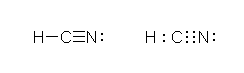
シアノ基(-C≡N)の炭素は、2本の σ 結合( C-H 結合、C-N 結合)と、2本の π 結合(C-N 間に2本)をもつ。炭素原子は、sp 混成で、結合角は、180度。
1.30
教科書 pp 40-41 を見よ。
(解答例)
a) メチルカチオンの炭素は、3本の σ 結合と空の p 軌道を持ち、sp2 混成。従って、H-C-H の結合角は、120°(炭素と3つの水素は同一平面内にある。)。
b) メチルラジカルの不対電子は、p 軌道内にある。(孤立電子対と比べて反発が小さいため。)そのため、sp2 混成で、H-C-H の結合角は、120°である。
c) メチルカルボアニオン(メチルアニオン)は、3本の σ 結合の他に孤立電子対があり、これらが互いに反発する。従って、sp3 混成で、H-C-H の結合角は、約 110°である。
1.31-1.40
1.31
教科書、問題文の上に、アンモニウムイオンの静電ポテンシャル図が示されている。陽イオンであるから、全体的に電子は少なくなっていて、青っぽい図となっているが、その中でも相対的に電子の密度の高い領域は、青 → 緑 → 黄 → 橙 → 赤 となっていく。
形式電荷は、窒素上に 「+」が存在していることとの対比をすることがこの問題の意図である。
(解答例)
窒素の価電子は4つとなり、窒素が「+」の形式電荷をもつ。もし、この形式電荷が実際のイオンの電荷の位置を表すのであるならば、水素上の電子密度はメタンなどの場合と同じで、窒素上のみ電子密度が下がることになるだろう。
しかしながら、静電ポテンシャル図を確認すると、窒素上でより電子密度が高く、水素上の方が電子密度が低くなっている。原因は、水素と窒素の電気陰性度の違いによるものである。窒素の方が電気陰性度が高い。すなわち、全体として電子密度が下がっている中で、水素側よりも窒素側に電子が偏る構造を持っている。
1.32
・極性が大きいということは、ある軸方向の両端で電荷密度の差が大きいということである。
(解答例)
メタンでは、全体がほぼ一様の電荷密度を持つように見える。水素のある位置でわずかに青に近い色になっているのは、水素と炭素の電気陰性度の差に由来し、水素側にわずかに δ+ を帯びているからである。メタンは、分子構造の対称性の関係で、分子全体としては分極を持たない。
アンモニア、水では、窒素、酸素の孤立電子対のある位置(水素の無い位置)で赤く染まっており、電荷密度が上がっていることがわかる。一方、アンモニア、水ともに水素のある位置では青くなっており、大きな正の部分電荷 δ+ が生じていることがわかる。よく見比べてみると、水の方が水素の青色の領域が広い。これは、N-H 結合よりも O-H 結合の方が原子の電気陰性オの差が大きく、大きく分極していることに対応している。
従って、最も大きな極性をもつのは、水分子、ほとんど分極していないのがアンモニアである。
1.33
教科書の解説を読んでください。
ここでは、H3O+ が、アンモニア NH3 と同じように3本の σ 結合と1対の孤立電子対をもつことに注意して答える。
VSEPR では、正四面体型の対称性をもつことで、109.5°の結合角をもつものの、孤立電子対は、σ 結合より強い反発をもつので、結合角は、水<アンモニア<メタンの順となっていることに注意する。
悪い例:私が思った(より小さく、)アナタが思った(より大きい。)
悪い理由。思う、感じる、は客観的ではない。
(解答例)
メタンと同じ 109.5°(より小さく)、水の結合角である 104.5°(より大きい。)
1.34
原子の大きさは、周期表上の位置で予測できる。周期が大きいほど(最外殻が、K、L、M、N…と外側になるに従って)大きくなり、同一周期内であれば原子番号が大きいほど原子サイズは小さくなる。
(解答例)
結合長は、
a) Cl2 < Br2
b) C-F < C-Cl < C-Br
結合に使われる価電子殻が外側のものであるほど、結合が弱くなる傾向があるので、結合の強さの順は、
a) Cl2 > Br2
b) C-F > C-Cl > C-Br
1.35
結合が短い = 結合が強い。
より外側の価電子を用いて結合しているほど、軌道の重なりが小さくなる傾向があります。これは、教科書 p46 の図を見て理解してください。
そのため、「外側の価電子を用いて結合している」=「結合の長さが長い」=「結合が弱い」という関係が成り立ちます。
原子の大きさは、異なる周期の元素で比べると、周期の大きい方が(周期表上で、下の段にある方が)大きい。これは、より外側にある殻(K殻、L殻、M殻、N殻…)に価電子があるからである。
また、同じ周期の元素で比べると、原子番号の小さい方が大きい。これは、電気陰性度のところで説明したのと同じ理屈で、価電子が感じている内殻(たとえば、価電子がN殻の電子である場合には、M殻まで)に遮蔽された原子核の電荷は、第1族では+1、第2族では+2、と原子番号とともに大きくなるので、価電子をより強く引き付けるからである。
(解答例)
1) 塩素は第3周期の元素だが、ヨウ素は第5周期の元素で、ヨウ素の方が大きい。そのため、
a) 結合が長いのは、C-I
b) 結合が強いのは、C-Cl
2) 炭素は第2周期の元素だが、塩素は第3周期の元素で、塩素の方が大きい。そのため、
a) 結合が長いのは、C-Cl
b) 結合が強いのは、C-C
2) 塩素は第3周期の元素だが、フッ素は第2周期の元素で、塩素の方が大きい。そのため、
a) 結合が長いのは、H-Cl
b) 結合が強いのは、H-F
1.36
まずは、構造式を書いてみること。
ただし、d) N2 は、無機化学などの授業とは扱いが異なっているので注意すること。
(解答例)
a) 四塩化炭素
炭素は4本の σ 結合を持つ。従って、炭素は sp3 混成軌道をもち、Cl-C-Cl の結合角は、約110°。
b) 二酸化炭素
炭素は2本の二重結合をもつ( O=C=O )。炭素は、2本の σ 結合を持つ。2本の π 結合は、電子対としての反発に数えない。そのため、炭素は sp 混成軌道をもち、結合角が 180°の直線型分子である。
炭素が sp 混成をしているため、炭素には2つの p 軌道が混成せずに残っている。これが、左右それぞれの酸素の p 軌道の間で π 結合を形成する。
酸素は、1本の σ 結合、2対の孤立電子対をもつ。また、電子対としての反発に数えない π 結合を1本もっている。そのため、sp2 混成をもつものとして扱ってよい。
c) メタン酸(慣用名:蟻酸、ギ酸)
ギ酸は、カルボン酸でありながら、カルボキシ基の一部がホルミル基を形成している。カルボニル C=O の両端に、水素とヒドロキシ基が結合した構造 H-C(=O)-OH である。炭素は、3本の σ 結合を持ち、sp2 混成で、結合角は 120°となる。混成せずに残された p 軌道は、カルボニル酸素との間の π 結合を形成する。
カルボニル酸素は、1本の σ 結合、2対の孤立電子対をもち、sp2 混成として扱ってよい。また、水酸基酸素は、2本のσ 結合と2対の孤立電子対をもつので、sp3 混成。C-O-H の結合角は、sp3 混成の正四面体型から予測すると約110°である。しかし、孤立電子対の関与する反発は、σ 結合間の反発より大きめであるため、C-O-H の結合角はこれよりやや小さめとなる。水分子と同程度であると考えるなら、この結合角はおよそ105°となる。
d) 窒素
窒素分子 N2 を、混成を使って考えるならば、:N≡N:という構造で表してもよい。この場合は、それぞれの窒素原子が sp 混成をしており、2つの窒素原子間の σ 結合と孤立電子対とに使われるとみなす。ただし、無機化学などの教科書では、等核二原子分子の分子軌道による説明では混成を用いない。
e)
ホウ素が13族元素なので、価電子がもとより3つしかなく、3本の σ 結合をもつのみで、オクテットは満たさない。そのため、ホウ素は sp2 混成をもち、1つの p 軌道が空のまま残されている。結合角 F-B-F は 120°で、平面三角形型の分子となっている。
1.37
酸素や窒素についても、炭素の場合と同じように「σ結合数 + 孤立電子対数」を数えて、4なら sp3、3なら sp2、2なら sp というように判断してよい。
※ ただし、分子の形が先にありきである。(問い1.40 も参照のこと)
(解答例)
教科書の解説文も参照してください。
a) この酸素は、2本の σ 結合、2対の孤立電子対をもつので、sp3 混成である。
b) この酸素は、1本の σ 結合、2対の孤立電子対をもつので、sp2 混成である。混成せずに残された p 軌道は、sp2 炭素の p 軌道との間に π 結合を形成する。
c) この窒素は、1本の σ 結合、1対の孤立電子対をもつので、sp 混成である。
(発展)
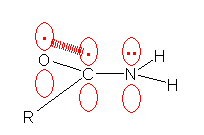
(※)孤立電子対は、場合によっては σ との反発に数えないケースもでてくる。たとえば、R-CO-NH2 アミド(タンパク質のペプチド結合も同じ)の窒素のように、窒素の隣接位にカルボニル基がある場合などでは、窒素上の孤立電子対が他の3本の σ と反発を起こして sp3 混成をとる代わりに、sp2 混成の平面3配位となり、孤立電子対は p 軌道に入り、隣接する π 系と共役する場合もある。
また、アンモニア NH3 は、窒素上に孤立電子対があるために、平均的な構造では窒素の sp3 混成に由来した三角推(正四面体が歪んだ形)をとるが、室温付近では、 次の式で表すような反転が頻繁におきていることが知られている。この途中では遷移状態として平面3配位の構造を経由している。(原子核を持たない孤立電子対だからこそ可能なことである。アンモニウムイオン NH4+では、このような反転は起きない。)
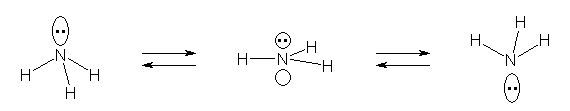
1.38
「軌道間の重なりが大きい」という言葉を正しく理解するためには、量子化学など、他の科目の学習をまたなければならないが、ここでは「軌道間の重なりが大きい」=「結果として生じる結合が、より強い」と解釈して答えてよい。
(解答例)
二重結合は、単結合の二倍の強さ未満であることからも判るように、σ 結合の方が π 結合よりも強い。これは、σ 結合の方が軌道間の重なりが大きいことに起因している。
(発展)
結合の強さは、大雑把に言って、C-C の σ 結合1本あたり 400 kJ/mol、π 結合1本あたり 200 kJ/mol 程度と考えておいてよい。(1桁程度しか精度がないが。)
この結合の強さとは、2つの原子核により結合電子対が束縛されているときの束縛の強さでもある。σ 結合の結合電子対は2つの原子核を結ぶ軸上に多く存在しているのに対し、π 結合の結合電子対は2つの原子核を結ぶ軸の上および下の空間に多く存在している。電子の位置から2つの原子核までの距離は、従って σ 結合電子の方が近く、π 結合電子の方が遠い。そのため、σ 結合電子の方が強く束縛されている。
1.39
ここでは単純に、距離と結合の強さの関係を考えてみること。結合長については、二重結合と単結合で比較した場合、どうであったかを考えること。
(解答例)
sp2-sp2 の重なりで生じる C-C σ 結合の結合長(典型例として、H2C=CH2 の 133 pm )の方が、 sp3-sp3 の重なりで生じる C-C σ 結合の結合長(典型例として、H3C-CH3 の 154 pm )よりも短く、よって、強い。
より短い結合でより強くなるのは、共有結合の電子対が、原子核により強く束縛されるためである。
発展に示した s 性の割合で議論するならば、より s 性の高い sp2 混成軌道の方が、s 性の低い sp3 混成軌道よりも短い結合長の結合を生成する。
(発展)
s 性の割合を議論に用いる場合がある。
sp3 混成軌道は、25 % の s 性をもち、
sp2 混成軌道は、33 % の s 性をもち、
sp 混成軌道は、50 % の s 性をもつ。
s 軌道の方が、p 軌道よりも原子核に近い位置にある軌道であるので、混成軌道間で比較した場合も、sp3 → sp2 → sp と s 性が上がるに従って、軌道がより原子核に近いことがわかる。そのため、分子軌道を形成するのに使用する混成軌道が、sp3 → sp2 → sp と s 性が上がるに従って、結合距離も短くなる傾向がある。
1.40
酸素、窒素、ハロゲンに注意して解答せよ。
(解答例)
caffeine
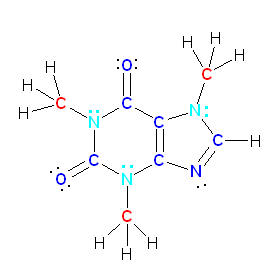
上のカフェインの構造式中、赤で示したのが sp3 混成をもつ原子、青で示したのが sp2 混成をもつ原子である。
水色で示した窒素は、3本の σ 結合と孤立電子対をもつため、ここまでの学習内容に沿って考えると、sp3 混成をしていると考えて当然である。しかしながら、実際には、これらの窒素は、sp2 混成をとり、残った p 軌道に孤立電子対を入れた構造をとる。これは、これらの窒素に隣接して sp2 混成の原子があるためである。これにより、窒素の p 軌道が単独で存在するのではなく、隣接した原子上の p 軌道と π 結合性の相互作用をして分子軌道を形成するためである。これは、カフェインの3次元モデルを見てみることで、該当する窒素が、平面3配位をとることからも確認できる。
カフェイン の分子の3次元模型
1.41-1.50
1.41
まずは、Kekulé 構造に書き直してみるとよいだろう。
単結合: σ 結合
二重結合: σ 結合と π 結合
三重結合: σ 結合と2本の π 結合
酸素、窒素は、それぞれ孤立電子対があることを見落とさないこと。
注目している原子核の周囲の反発する電子対は、σ 結合と孤立電子対であるから、その和が4の場合(sp3)、3の場合(sp2)、2の場合(sp)で考える。
(解答例)
赤で示したのが sp3 混成をもつ原子、青で示したのが sp2 混成をもつ原子、緑で示したのが sp 混成をもつ原子である。
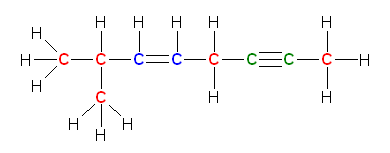
a) 7-methyloct-5-en-2-yne
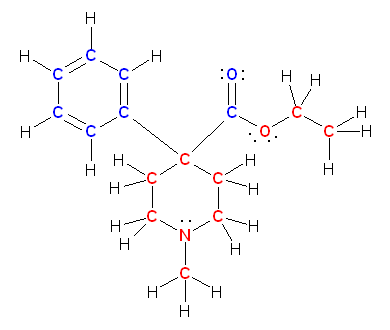
b) demerol
prozac
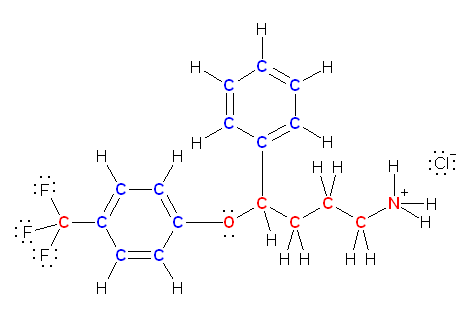
c) アンモニウム塩の構造をもつ。窒素と塩素。
1.42
「A-B-C の結合角」とは、中央の原子 B について、B-A 軸と B-C 軸が作る角度のことである。(数学の記号で、角ABC と書いたときに示すものと同じ。)
多重結合は、σ 結合と π 結合からできている。このうち、結合角に影響を与えるのは、σ 結合である。σ 結合と孤立電子対が互いに反発しあう。この互いに反発しあうものの数が4の場合は、正四面体型に、3の場合は正三角形型に、2の場合は直線型になる。
そのため、「A-B-C の結合角」は、原子 B の混成状態で判断できる。sp3 混成ならば約 110°、sp2 混成ならば 120°、sp 混成ならば 180°となる。
(解答例)
a) 形式電荷 +1 をもつ窒素は、価電子数4で、電気的に中性な炭素と同じである。中央の窒素上には、4本の σ 結合(N-CH3 結合×2、N-H 結合×2)があり、正四面体型の構造をもつ。よって、C-N-C の結合角は、およそ 110°である。
b) ethanamine のアミノ基の窒素は、3本の σ結合(N-CH3 結合×1、N-H 結合×2)と孤立電子対1対をもち、正四面体型の構造をもつ。よって、C-N-H の結合角は、およそ 110°である。
c) N-methylmethanamine (dimethyl amine) の H-C-N の結合角について訊かれている。窒素上のメチル基炭素(2つあるが、どちらも同じである)は、4本の σ 結合(C-H 結合×3、C-N 結合×1)をもつので、正四面体型の構造をもつ。よって、H-C-N の結合角は、およそ 110度である。
d) methoxymethane (dimethyl ether) の H-C-O の結合角について訊かれている。酸素上のメチル基炭素(2つあるが、どちらも同じである)は、4本の σ 結合(C-H 結合×3、C-O 結合×1)をもつので、正四面体型の構造をもつ。よって、H-C-O の結合角は、およそ 110度である。
1.43
1) まず、分子の双極子モーメントは、各結合の双極子モーメントのベクトルとしての和である。(次図:C-H 結合3本に由来する双極子モーメントの和は、赤の太線で描いた矢印に相当する。これと、C-F 結合に由来する双極子モーメント、青矢印 の和が、1.847 D である。 )
2) C-F 結合は、両化合物に共通である。
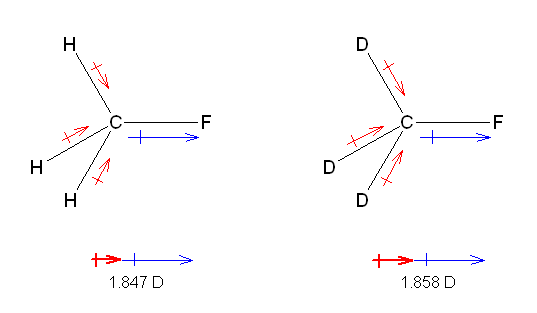
3) C-H 結合と、C-D 結合はほとんど同じ長さであると仮定してよい。そのため、結合に由来する双極子モーメントの大きさは、原子上の部分電荷の大きさに比例する。
(解答例)
2) C-F 結合は、両化合物に共通である。故に CD3F で、分子の双極子モーメントがより大きくなっているのは、赤の太線の矢印が長くなっている、すなわち、C-H 結合よりも、C-D 結合の方が大きな分極を持つ(故に双極子モーメントが大きい)ということである。
3) ここで、C-H 結合と C-D 結合 の結合長がほとんど変わらないとしてよい(※)。そうすると、結合のもつ双極子モーメントの大きさは、電気陰性度の差に由来した部分電荷の大きさに由来する。
つまり、H も D も、炭素 C より電気陰性度は小さく、C に対して電子を与えるのであるが、その効果は、H−C よりも D-C の方が大きい。つまり、D の方がより電気陰性度が小さい(電気的に陽性である)。
※ 本来、結合長を話題にせずにこの問いには答えられないはずである。ここで仮定した C-H 結合と C-D 結合はほとんど同じ長さであるというのは正しいが、厳密に見ると、C-D 結合の方が 1 % 程度短くなっていることが知られている。
1 % という差は、実験の結果から得られる C-H 結合と C-D 結合に由来する双極子モーメントの大きさの差の程度より小さいし、また、C-D の方が結合が短いという事実は、もし同じ部分電荷をもつ場合には双極子モーメントが小さくなる方に働くのであるから、結論としての「実験結果から、CH3F の H よりも、CD3F の D の方がより大きな正の部分電荷をもつ」という内容は変わらない。
つまり、もし、H-D という分子があるならば、Hδ--Dδ+ と分極することを意味している。
1.44
静電ポテンシャル図は、p42, p43 を参照すること。
形の違い:NH3 は、3本の σ 結合 N-H と、孤立電子対があり、孤立電子対は σ 結合よりも他の電子対との反発が大きいのであった。これに対し、 NH4+ は、4本の σ 結合 N-H がすべて等価である。
色の違い:色は、電荷密度を表している。
(解答例)
アンモニア NH3 は、3本の N-H σ 結合と、1組の孤立電子対をもつから、分子全体としては正四面体型の対称性をもつものの、電荷の分布は、正四面体型の対称ではない。静電ポテンシャル図において、孤立電子対のある辺りが濃い赤になっており、水素は、より電気陰性度の高い窒素に結合しているため、相対的に正に帯電しているので、青が濃くなっている。(三角錐の対称性となっており、分子は双極子モーメントをもつ。)
アンモニウムイオンは、4本の N-H σ 結合をもち、メタンと同じで、正四面体型の構造をもち、電荷の分布も正四面体型の対称性を示す。(分子は、結合の分極が互いに打ち消され、分子全体としては双極子モーメントをもたない。)
分子全体として正の1価に帯電しているため、全体として中性分子よりも正側(青側)に偏っている。形式電荷は、窒素上に +1 があるものの、結合の分極は、H(δ+)−N(δ-)であるから、相対的には窒素側ではなく、4つの水素側でより青色が濃い。
イメージ図
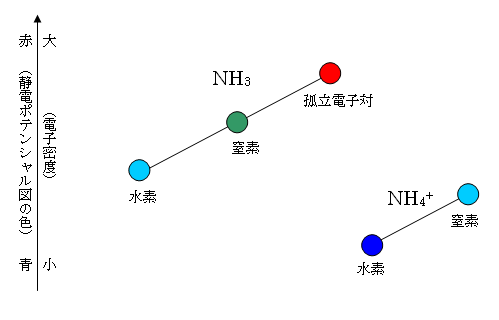
アンモニウムイオンでは、全体が正に帯電している分、上図において全体的に下方に描かれるが、水素−窒素の上下関係(電気陰性度によってきまっている)は、入れ替わらない。
1.45
いずれも2種以上の元素を含むので、すべての結合には電気陰性度の差に由来して分極がある。それぞれの分子の構造を考慮し、分極が打ち消されるものはどれかを考えよ。
8つのうち4つが該当する。
単に記号を挙げるだけではなく、なぜ双極子モーメントが0になるか(各結合に由来する分極が、どのような対称性の関係から、どのように打ち消されるのか)をきちんと説明できること。
(解答例)
原子間の電気陰性度の差に由来する結合の分極を赤で示した。また、分子全体としては、この各矢印のベクトル和になるので、その和がゼロにならないものについては、ベクトル和を青の矢印で示した。(ただし、矢印の長さは、正確ではないです。)
a) 双極子モーメントがゼロである。
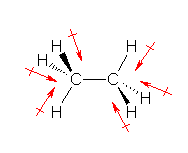
6本の C-H 結合における分極が、分子の対称性の関係から互いに打ち消しあうため。発展の項に書いた扱いを参照すると、2つのメチル基 -CH3 ごとに、3本の C-H 結合に由来する分極の和をとってやると、これが左右で打ち消しあう関係になっていることがわかると思う。
b)
4つの原子がすべて同一平面内にある構造であるが、結合の分極は打ち消されない。
c)
C-H 結合、C-Cl 結合の長さの違いを除けば(正)四面体型の構造であるが、分極は打ち消されない。
d)
窒素が3本の σ 結合以外に孤立電子対ももつため、平面3配位ではなく、三角錐型の分子である。孤立電子対も含めて考えるならば(正)四面体型と言ってもよい。上の構造図では、(あまり一般的ではない書き方であるが)孤立電子対も価標で示している。
e) 双極子モーメントがゼロである。
6つの原子がすべて同一平面内にある構造である。左右2本ずつの C-H 結合による分極が、互いに打ち消しあうので、分子全体とすると分極がない。
f)
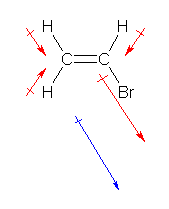
e の構造から、1本の C-H 結合が C-Br 結合になったもの。e と同様に、6つの原子がすべて同一平面内にある構造であるが、分極が打ち消されない。
g) 双極子モーメントがゼロである。
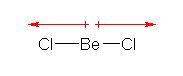
ベリリウムが直線型2配位となるから、2本の Be-Cl 結合に由来する分極が互いに打ち消しあう。
h) 双極子モーメントがゼロである。
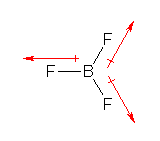
平面3配位、正三角形型の分子となる。3本の B-F 結合に由来する分極が互いに打ち消しあう。
(発展)
いま、平面3配位の化合物(たとえば、CH3+)、および、正四面体型4配位の化合物(たとえば、CCl4)があったとする。中心原子に結合しているものがすべて同じであるとするならば、対称性の関係から、分子の電荷の偏りはなく、分子全体としての双極子は持っていないことは容易に理解できるであろう。
次に、平面3配位の化合物を、CAB2、正四面体4配位の化合物を、CAB3 としよう。そして、それぞれの結合に対し、C-A の方向、および C-B の方向に、次図のような分極が生じているものとする。
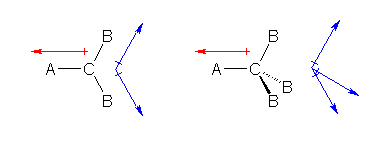
ここで、AとBが実は同じ元素であったと考えると、赤の矢印と青の矢印は向きは(結合の伸びている方向に沿っていて)異なるものの、同じ長さであることになる。このとき、AとBが実は同じ元素であった場合には対称性の関係より、分子全体としては電荷の偏りがないのであるから、赤の矢印と青の矢印のベクトルの総和は、ゼロでなければならない。つまり、上図において、青の矢印のベクトルの和は、赤の矢印と向きが逆で長さの同じベクトルを与える。
(もちろん、たとえば左の3配位の場合は、次図のような作図によってでも、全く同じ内容を説明することができる。)
1.46
ルイス構造を書けという問題であるから、分子の骨格と、どこに孤立電子対があるかが判る必要がある。形式電荷をもたずに孤立電子対がもつのは、酸素、窒素、ハロゲンである。
ここに挙げられているような分子やイオンは、実はありふれているものなので、慣れてくると構造はすぐにわかるものであるが、以下に構造を考えるべきヒントを書いておこう。
a 炭酸である。2つの水素原子は、いずれも酸素から結合している。
b 炭酸イオンである。a の炭酸の構造から H+ を2つとも酸解離の形でとったもの。
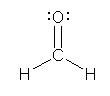
c ホルムアルデヒドである。炭素と酸素の間に二重結合があり、水素は炭素に結合している。
d 二酸化炭素である。O=C=O の構造をもつ。
(解答例)
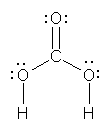
a) carbonic acid, 炭酸
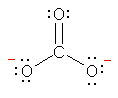
b) carbonate, 炭酸イオン
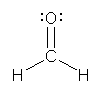
c) methanal, メタナール、慣用名 formaldehyde, ホルムアルデヒド
d) carbon dioxide, 二酸化炭素
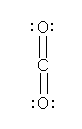
1.47
a 「非極性共有結合」= 極性をもたない(分極していない)共有結合 = 電気陰性度が同じ値をもつ原子間の共有結合 = 同種の原子間の共有結合
b 電気陰性度の差が大きいほど、その結合の分極は大きくなり、その極限としてイオン結合がある。およその目安として、電気陰性度の差が 2 以上あるとイオン結合である場合が多いとされている。ここでは、イオン結合に最も近いものときかれているので、それぞれの分子の中にあるすべての種類の共有結合について検討し、電気陰性度の差が最も大きいものを答えればよい。
(解答例)
a) ethane, CH3-CH3 は、同種の元素間の結合(C-C)をもつ。この結合は、非極性である。(C-H 結合は、極性である。)
b) 各分子の中の共有結合と電気陰性度の差(ΔEN)を挙げると、次のようになる。
methanamine
C-H(ΔEN = 0.4)
C-N(ΔEN = 0.5)
N-H(ΔEN = 0.9)
ethane
C-C(ΔEN = 0)
C-H(ΔEN = 0.4)
fluoromethane
C-H(ΔEN = 0.4)
C-F(ΔEN = 1.5)
methanol
C-H(ΔEN = 0.4)
C-O(ΔEN = 1.0)
O-H(ΔEN = 1.4)
以上の結果より、最も電気陰性度の差が大きく、従ってイオン結合性が大きいのは、C-F 結合で、次いで、O-H 結合がこれに続く。
ただし、これらは(示された選択肢の中では)「イオン結合の極限に最も近い」とはいえ、電気陰性度の差は2より小さいことから、イオン結合ではないと判断してよい。分子の性質を調べれば、そのあたりがはっきりする。イオン結合をしているものは、一般に沸点、融点ともにとても高い。(食塩 NaCl の場合、融点が800℃付近である。)これに対し、フルオロメタン CH3-F はフロンガスの一種で、沸点が-78.2℃ と低い。メタンの沸点が -161.5℃であることを考えると、極性共有結合をもつことで沸点が上がっていることもわかる。
(発展)
解答例に書いた解説の発展として、水も極性の高い O-H 結合があるので、(メタンに比べてフルオロメタンの沸点が高いのと同様に)沸点が高いのであると考えるかもしれない。しかし、水の高い沸点を説明するためには、結合が極性をもつからというだけでは不充分であり、水素結合の寄与を説明しなければならない。(1年で使用する「化学」の教科書にも、水やアンモニア、フッ化水素では、水素結合により相対的に沸点が高くなっているという説明があるはずです。)
1.48
電子配置を考え、中心原子について、孤立電子対の有無(およびその数)、σ 結合の数を数えて判断する。
(解答例)
a) sp3 混成で、正四面体型。
b) sp2 混成で、三方平面型。
c) sp3 混成で、正四面体型。
d) sp2 混成で、三方平面型。教科書 p41 参照。
e) sp3 混成で、正四面体型。
f) sp2 混成で、三方平面型。(すべての炭素とも)
g) sp 混成で、直線型。
h) sp3 混成で、正四面体型。
i) sp3 混成で、正四面体型。
j) sp2 混成で、三方平面型。(炭素、酸素とも)
1.49
カルボカチオン、カルバニオン、カルベンなどの構造は除外して考えることにしよう。また、
a) 分子内に二重結合は無いので条件を満たすようにも見えるが、シクロプロパンは除外して考えること(発展の項参照)。
b) 炭素は、sp2 混成をもつ場合、残った p 軌道にも電子が1つ入る。これが共有結合(具体的には π 結合)に関与するためには、sp2 炭素は隣接していなければならない。
c) 炭素は、sp 混成をもつ場合、残った2つの p 軌道にも電子が1つずつ入る。b) と同様に考えよ。
(解答例)
a) propane CH3CH2CH3
b) propene CH3CH=CH2
c) but-1-yne CH3CH2C≡CH
but-2-yne CH3C≡CCH3
(発展)
シクロプロパンは、3つの炭素が正三角形の頂点上にあり、すべての C-C-C の結合角が、60度です。いずれの炭素も、σ 結合を4本(C-C 結合×2本、C-H 結合×2本)をもつことから sp3 混成と判定する条件を満たすが、そもそもsp3 混成とは、正四面体型の対称性(結合角はすべて約110度)を説明するために導入した概念であり、60度の結合角を説明できるものではありません。
そのため、今回の問いのような場合には、シクロプロパンは特殊ケースとして除外しておくのが無難です。
現時点での学習の程度を超えるので、あとであらためて出てくるまで待ってもらっても良いのですが、シクロプロパンの炭素の結合を説明するための方法にはいくつかあります。
1) 教科書 p143 の扱い:シクロプロパンの炭素は、実は sp3 混成を持ち、C-C 結合を作る際に、不充分な軌道の重なりしかもつことができない分子である。そのため、C-C 結合は通常の σ 結合とは異なり、2つの原子を結ぶ直線上ではなく、正三角形の少し外側にはみ出た位置に存在しており「曲がった結合」「バナナ結合」などと呼ばれる。(クールソンモデル)
2) 炭素は、いずれも sp2 混成を持っている。この sp2 軌道のうち2本は、C-H 結合 を形成する。残りのもうひとつの sp2 軌道は、正三角形の中央を向くように飛び出し、正三角形の中央でその3つが重なることで変則的な結合(擬 σ 結合)をとる。また、混成せずに残された p 軌道は隣の炭素との間で、やはり変則的な結合(擬 π 結合)をとる。(ウォルシュモデル)(たとえばここ:外部のページです)
3) 炭素の2本の C-H 結合は sp2 混成軌道を用いるが、C-C 結合は sp5 混成軌道を用いて、1) と同様の曲がった結合を形成している。
最後のところで変なものがでてきましたね。sp5 ?はじめて聞きましたね。そもそも炭素の 2p 軌道は5つもありません。授業では、s ひとつと p 3つが混成して、4つの sp3 軌道を作る、と扱いました。その結果、sp3 軌道は、25 % の s 性と、75 % の p 性を持つわけです。sp5 も、 s ひとつと p 5つから作った場合と同じ割合で s と p が混ざっている混成軌道であると考えてください。
大事な原則のひとつに「軌道はすべて保存される」とありました。では、確認してみましょう。
sp2 混成軌道 → 1/3 の s 性、2/3 の p 性。これが2本。
sp5 混成軌道 → 1/6 の s 性、5/6 の p 性。これが2本。
s 性は、1/3 + 1/3 + 1/6 + 1/6 で 100 % になっています。
p 性も、2/3 + 2/3 + 5/6 + 5/6 で 300 %(すなわち3つの p 軌道分)になっています。
1.50
1.42 のヒントを参照してください。というか、a) の問題は、1.42 a) と同じじゃないですか。
(解答例)
a) 形式電荷 +1 をもつ窒素は、価電子数4で、電気的に中性な炭素と同じである。中央の窒素上には、4本の σ 結合(N-CH3 結合×2、N-H 結合×2)があり、sp3 混成をとり、正四面体型の構造をもつ。よって、C-N-C の結合角は、およそ 110°である。
b) methanol の酸素は、3本の σ結合と2対の孤立電子対をもつ。sp3 混成をとり、正四面体型の構造をもつ。よって、C-O-H の結合角は、およそ 110°であることが予測される。しかし、孤立電子対間の反発がより大きいため、もう少し結合角が小さくなり、水と同程度の 105°程度となる。
c,d) N-methylmethanamine (dimethyl amine) の窒素は、3本の σ 結合(N-C 結合×2、N-H 結合×1)と孤立電子対をもつので、sp3 混成をとり、正四面体型の構造をもつ。C-N-H の結合角は、およそ 110°であることが予測される。しかし孤立電子対と結合の反発がより大きいため、結合角はやや小さくなり、アンモニアと同定度の 107°程度となる。C-N-C 結合も同じく 107°程度となる。
1.51-1.60
1.51
周期表を見て、原子番号確認すること。
b,d は、原子イオンについて問われている。「2+」のイオンでは、原子番号よりも2つ電子が少ないことに留意すること。
「基底状態の電子配置」…最も安定な電子配置。つまり、構成原理(積み上げ原理)に従った電子配置のことです。
(解答例)
a) 12Mg : (1s)2(2s)2(2px)2(2py)2(2pz)2(3s)2
b) 20Ca2+ : (1s)2(2s)2(2px)2(2py)2(2pz)2(3s)2(3px)2(3py)2(3pz)2
c) 18Ar : (1s)2(2s)2(2px)2(2py)2(2pz)2(3s)2(3px)2(3py)2(3pz)2
d) 12Mg2+ : (1s)2(2s)2(2px)2(2py)2(2pz)2
特に、Ca2+ と Ar は同一の電子配置である。
原子軌道のエネルギーを縦軸にとった図としても書くことができるようにしておいてください。
1.52
46 と同様に、分子の構造と孤立電子対の有無を確認せよ。
a すでに学習した置換命名法では、methanamine である。別名(基官能命名法)では methyl amine ともいう。アミノ基(-NH2)がメチル基上にある。
b 亜硝酸である。水素は、酸素上に結合している。
c ヒドラジンの名称をもつ分子である。H2N-NH2 の構造をもつ。
d ヒドロキシルアミン H2N-OH より、酸素上のプロトンが解離した構造である。
(解答例)
a) methanamine (methyl amine)
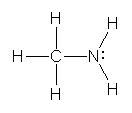
b) nitrous acid, 亜硝酸
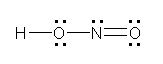
c) hydrazine, ヒドラジン
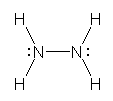
d)
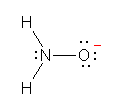
※ d) は hydroxylamine ヒドロキシルアミン から水素イオンが取れた形である。(1.18 を参照のこと)
1.53
1.54
極性が大きい = 分極が大きい = 電気陰性度の差が大きい。
この問いは、一見して全ての電気陰性度の数値を覚えているか、表を見ながらでないと解けないように思うかもしれない。しかし、この問題のうち、d 以外は、周期表の位置に対する電気陰性度の傾向(右、上ほど大きい)だけ判っていれば正解できる問題である。
(解答例)
a) C-F > C-O > C-N
b) C-Cl > C-Br > C-I
c) H-O > H-N > H-C
d) C-N > C-H > C-C
d) 以外は周期表における元素の位置関係のみから答えられるはず。d) は表1.3 に戻って数値を確認すると、ΔEN(C-N) = 0.5, ΔEN(H-C) = 0.4 である。
1.55
46 と同様に、分子の構造と孤立電子対の有無を確認せよ。
a アセトアルデヒド(慣用名)、エタナール ethanal である。-CHO の部分はアルデヒド基で、炭素酸素間は二重結合、水素は炭素上に付く構造である。
b これは、dimethyl ether である。水 H2O の水素をメチル基に置き換えた構造。
c エタン酸、慣用名は酢酸である。
(解答例)
以下、共有結合を価標として表した。なお、比較のために骨格構造式による構造も併せて示した。(孤立電子対の書かれていないものは、Lewis構造として認められないので注意すること。)
a) ethanal 慣用名 acetaldehyde
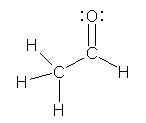
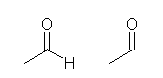
アルデヒド基(-CHO)を骨格構造式で書く際、左のように書くことができるが、右のように炭素上の水素を省略して表す場合もある。
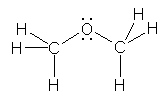
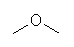
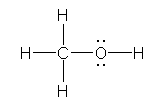
b) methoxymethane (dimethyl ether)
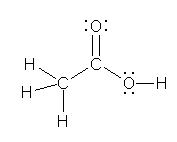
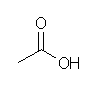
c) ethanoic acid, 慣用名 acetic acid, 酢酸
(発展)
もういちど、重要な構造の書き方についてまとめておこう。
Kekulé 構造(教科書 p21)では、結合を線(「価標」)で表す。また、孤立電子対は省略できる(書いても良い。)
また、形式電荷をもつ原子がある場合は、形式電荷は省略できない。
Lewis 構造では、結合は、価標または点の対で表す。孤立電子対は省略してはならない。
形式電荷をもつ原子がある場合は、省略せずに示すことが望ましい。(すべての電子を「点」として書き込んでいるため、形式電荷が示されていなくても判別可能であるが、私は、書くべきであると判断する。)
骨格構造式のルールでは、C の元素記号と、その C 上の水素(およびその結合を示す価標)は省略できる。ただし、元素記号 C を書き込んだ炭素については、その上に結合した水素でも明示しなければならない。
1.56
孤立電子対を数え落とさないこと。
(解答例)
a) sp2 混成。
b) 2組の孤立電子対がある。sp2 混成。
c) 2組の孤立電子対がある。sp3 混成。
d) 1組の孤立電子対がある。sp 混成。
e) 1組の孤立電子対がある。sp2 混成。
f) 2組の孤立電子対がある。sp3 混成。
1.57
1.42 のヒントを参照すること。
(解答例)
a) methanal (formaldehyde)の H-C-H の結合角について訊かれている。C=O の構造をもつが、この部分は、σ 結合と π 結合によりできている。従って、炭素上で互いに反発しあうのは、3本の σ 結合(C-H 結合×2、C-O 結合)である。そのため、この炭素は sp2 混成し、正三角形型の対称性を持っている。H-C-H の結合角は、およそ 120°である。
b) BF4- イオンの中央のホウ素は、-1 の形式電荷をもつ。これは、価電子の数が(電気的中性であるホウ素は、価電子数3をとるので)4であることを示しており、メタンなどにおける炭素(電気的中性な炭素は価電子数4をとる)と同じでsp3 混成し、正四面体構造をとる。これは、ホウ素が4本の σ 結合(B-F 結合×4)をもつことと対応している。そのため、F-B-F の結合角は、およそ 110°である。
c) ethanenitrile (acetonitrile) の C-C-N の結合角について訊かれている。シアノ基(-C≡N)の炭素-窒素間は、三重結合であり、σ 結合1本と π 結合2本とからできている。そのため、シアノ基炭素は、互いに反発しあう2本の σ 結合(CH3-C 結合と、C-N 結合)をもち、sp 混成しており、直線型となる。従って、C-C-N の結合角は、およそ 180°である。
d) ethanamine の1位(アミノ基の結合位置)の炭素は、4本の σ結合(C-CH3 結合×1、C-H 結合×2、C-NH2 結合×1)をもち、sp3 混成して正四面体型の対称性をもつ。よって、C-C-N の結合角は、およそ 110°である。
1.58
結合の分極の向きを問題にしているのであるから、その結合の両端に位置している元素の電気陰性度を確認して解答せよ。
(解答例)
ここでは δ+、δ- の記号を用いて書くが、矢印で示してもよい。その場合、δ+ から δ- の方向に矢印を書く場合は、矢印のしっぽ(出発点のところ)には、短い線を交差させることを忘れないようにする。(教科書 p13 参照)
a) H3Cδ+-Brδ-
b) H3Cδ--Liδ+
c) HOδ--Nδ+H2
d) Iδ+-Brδ-
e) H3Cδ+-Oδ-H
f) (CH3)2Nδ--Hδ+
1.59
酸素と窒素に注意する。結合の本数にも注意する。
a) d) は中性分子として考えて書くことができます。
b) c) は、中性分子として考えることはできないです。いずれも1価の陽イオンとしても、1価の陰イオンとしても書いてつじつまを合わせることが可能ですが、もっともありふれた構造(酸素、窒素ともにオクテットを満たしている構造)として、b) は陽イオン、c) は陰イオンとして書いてみてください。
なお、形式電荷の範囲は(1+ から 1− まで)で考えればよい。
酸素の場合
形式電荷 1+ のとき(価電子数が5個)=3本の共有結合 + 孤立電子対1
形式電荷がないとき(価電子数が6個)=2本の共有結合 + 孤立電子対2
形式電荷 1− のとき(価電子数が7個)=1本の共有結合 + 孤立電子対3
となっている。
窒素の場合
形式電荷 1+ のとき(価電子数が4個)=4本の共有結合 + 孤立電子対0
形式電荷がないとき(価電子数が5個)=3本の共有結合 + 孤立電子対1
形式電荷 1− のとき(価電子数が6個)=2本の共有結合 + 孤立電子対2
となっている。
結局、結合の本数より、価電子数がいくつのパターンであるかを認識することで、形式電荷までわかることになる。
なお、原理的には形式電荷として上記の範囲(1+から1−まで)を超えた構造を書いても、つじつまあわせは可能である。たとえば、「酸素(形式電荷4+、価電子数2)、2本の共有結合、孤立電子対0」としたり、「酸素(形式電荷2+、価電子数4)、2本の共有結合、孤立電子対1」としたりしても、つじつまは合っている。とはいえ、そのような構造は、非常に不安定なので、考慮してはいけない。(発展の項も参照)
(解答例)
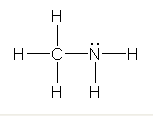
a)
b)
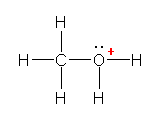
c)
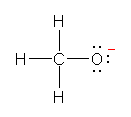
d)
(発展)
形式電荷として上記の範囲(1+から1−まで)を超えた構造を考慮しない理由。
原子から電子を1つ奪うことで1+のイオンになる。同じ原子から2つ目の電子を奪い、2+のイオンにするためには、第1段階目のイオン化に必要なエネルギーよりもずっと大きなエネルギーが必要である。第1段階目のイオン化では、中性のところから電子を引き離せばよいだけであったのに対し、第2段階目のイオン化では、すでに正電荷をもつところから、負電荷をもつ電子を引き離さなければならないので、この間の静電引力に打ち勝たなければいけないからである。ましてや、第3段、第4段のイオン化では更に大きなエネルギーが必要となる。
1.60
1, 2, 3 は、典型的な単結合、二重結合、三重結合の結合長で判断できるだろう。
4, 5 については、s 性 の割合を考慮に入れる必要がある。(発展)を参照のこと。
6 については、ハロゲン(Br, Cl)の結合に使われている軌道を考慮せよ。
(解答例)
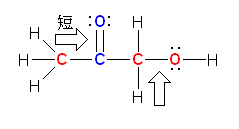
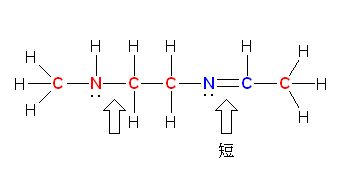
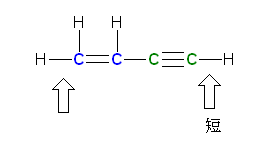
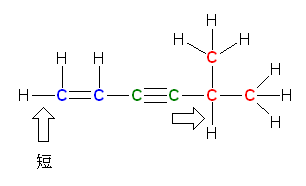
赤で示したのが sp3 混成をもつ原子、青で示したのが sp2 混成をもつ原子、緑で示したのが sp 混成をもつ原子である。
また、指定された2つの結合を矢印で示し、短い方を図中に示した。
a)
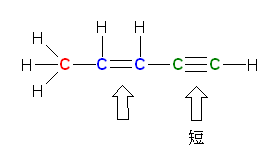
単結合 > 二重結合 > 三重結合 の順に結合長は短くなる。
b)
c)
d)
左の C-H 結合は、炭素の sp2 混成軌道と、水素の 1s 軌道から生じている。右の C-H 結合は、炭素の sp 混成軌道と、水素の 1s 軌道から生じている。よって、より s 性の高い混成軌道から生じている右の結合の方が短い。
e)
左の C-H 結合は、炭素の sp2 混成軌道と、水素の 1s 軌道から生じている。右の C-H 結合は、炭素の sp3 混成軌道と、水素の 1s 軌道から生じている。よって、より s 性の高い混成軌道から生じている左の結合の方が短い。
f)
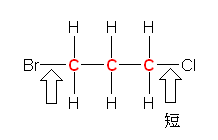
臭素は、第4周期の元素で N 殻の軌道を使って結合している。そのため、第3周期元素で M 殻の軌道を使って結合している塩素より、結合長が長くなる。
(発展)
sp3 混成軌道は、25 % の s 性をもち、
sp2 混成軌道は、33 % の s 性をもち、
sp 混成軌道は、50 % の s 性をもつ。
s 軌道の方が、p 軌道よりも原子核に近い位置にある軌道であるので、混成軌道間で比較した場合も、sp3 → sp2 → sp と s 性が上がるに従って、軌道がより原子核に近いことがわかる。そのため、分子軌道を形成するのに使用する混成軌道が、sp3 → sp2 → sp と s 性が上がるに従って、結合距離も短くなる傾向がある。
1.61-1.70
1.61
σ結合の数を数えよ。
(解答例)
a) prop-1-yne
1位炭素、2位炭素は、sp混成。この炭素を中心とする結合角は 180°である。また、3位炭素はsp3混成をとり、H-C-H などは 110°の結合角をもつ。
b) prop-1-ene
1位、2位炭素は、sp2混成。この炭素を中心とする結合角は 120°である。また、3位炭素はsp3混成をとり、H-C-H などは 110°の結合角をもつ。
c) propane
すべての炭素は、sp3混成をとり、すべての結合角は約 110°である。
d) buta-1,3-diene
4つの炭素ともすべてsp2混成をとっている。2つの二重結合が同じ方向を向くことによる安定化(共役が広がる効果によるもの)があるので、実は4つの炭素ならびに6つの水素がすべて同一平面内にある構造をとる。結合角はすべて 120°である。
1.62
簡略構造式(教科書によっては「短縮構造式」)で書かれた構造から骨格構造式が書けることを確認せよ。その上で、酸素、窒素、ハロゲン等上の孤立電子対を落とさぬようにする。
構造の理解の一助とするため、各構造に対応する命名を与えておく。
a) 2-methylpropan-2-ol
b) 3-hydroxybutanenitorile
c) 2,2,4,5-tetramethylhexane
(解答例)
以下、共有結合を価標として表した。なお、比較のために骨格構造式による構造も併せて示した。(c のように、本来孤立電子対を持たないものを除き、孤立電子対の書かれていないものは、Lewis構造として認められないので注意すること。)
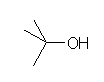
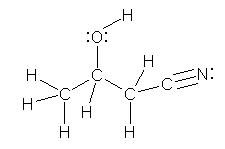
a) 2-methylpropan-2-ol (tert-butyl alcohol)
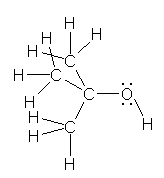
b) 3-hydroxybutanenitrile
c) 2,2,4,5-tetramethylhexane
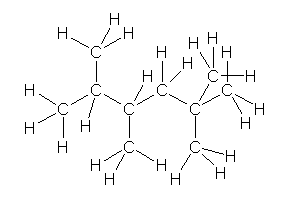
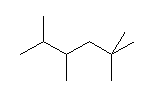
※ 上の構造式で C-H の結合を省略せずに示すとき、単に描画の都合上、結合が交差しているように描かれていますが、交差することが必須ではありません。Kekulé 構造では炭素回りの4本の結合を直角の方向で描く場合も多いですが、これも決まっているわけではありません。あまり不自然ではないように描かれていれば、結合の順序さえあっていれば、同じ図とみなして結構です。
1.63
C-Cl 結合や C-Br 結合が双極子モーメントをもつ。分子全体の双極子モーメントは、各結合の双極子モーメントのベクトルの和として考えてよい。正確に議論するためには、C-H 結合の寄与も考えるべきだが、ここでは炭素−ハロゲン結合にのみ注目してもよい。
(解答例)
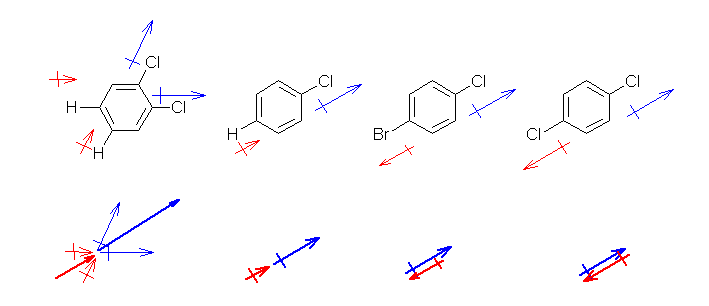
1,4-dichlorobenzene では、2本の C-Cl 結合が 180°逆の向きにでているため、その分極は互いに打ち消し合う。(C-H 結合の分極も、互いに打ち消しあう。)そのため、双極子モーメントは持たない。
1-bromo-4-chlorobenzene では、C-Cl 結合と C-Br 結合の分極が打ち消しあうが、その大きさに若干の差があるため、完全にゼロにならず、わずかに双極子モーメントが残る。
chlorobenzene では、C-H 結合と C-Cl 結合で、分極の向きが同じなので、これに由来した双極子モーメントを持つ。
1,2-dichlorobenzene では、60°の方向に向いた2本の C-Cl 結合がある。ベクトルの和をとると、元のベクトルの√3倍(1.73倍)になる。C-H 結合2本についても同様である。従って、chlorobenzene よりも大きな双極子モーメントを持つ。
<
問題には示されていないが、1,3-dichlorobenzene では、120°の方向に向いた2本の C-Cl 結合がある。ベクトルの和をとると、元のベクトルと同じ大きさになる。そのため従って、chlorobenzene と同程度の大きさの双極子モーメントを持つと考えられる。
1.64
3次元模型を確認して、窒素がどのような立体を持っているか確認してみてください。
ニコチンの分子の3次元模型
(解答例)
6員環(ピリジン環)に含まれる窒素は、孤立電子対の他に、2本の σ 結合と、1本の π 結合を持っている。従って、この窒素は sp2 混成をしており、混成せずに残った p 軌道が、隣接の炭素との間で π 結合を形成している。孤立電子対は、環の側面方向(環の回転軸に対して垂直な放射方向、環の C-H などと同じように外を向いた方向)に突き出した sp2 軌道に入っている。そのため、このピリジン環は、ベンゼンと同じように平面構造を持っている。
もうひとつの窒素は5員環に含まれている。この窒素は、孤立電子対の他に、2本の σ 結合を持っており、アンモニアと同じように sp3 混成をしており、三角錐型の構造をもつ。孤立電子対は、この三角錐の頂点の方向に突き出した sp3 混成軌道中に入る。
1.65
問い 1.15 などと同じように考える。
(解答例)
左から順に
3本の σ 結合と孤立電子対があり、炭素の荷電子数は5。従って、形式電荷は「−1」。メチルアニオンである。なお、この孤立電子対は、sp3 混成軌道に入っている。
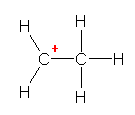
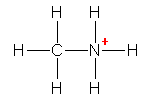
3本の σ 結合があり、炭素の荷電子数は3。従って、形式電荷は「+1」。メチルカチオンである。
3本の σ 結合と不対電子があり、炭素の荷電子数は4。従って、形式電荷は「0」。メチルラジカルである。なお、この炭素は、sp2 混成しており、不対電子は p 軌道に入っている。
2本の σ 結合と孤立電子対があり、炭素の荷電子数は4。従って、形式電荷は「0」。このような分子種を、カルベンと呼ぶ。
左側の炭素は、3本の σ 結合と、1本の π 結合を持ち、荷電子数は4。従って、形式電荷は「0」。右側の炭素は、3本の σ 結合と孤立電子対をもち、価電子数は5。従って、形式電荷は「−1」である。なお、この孤立電子対は、sp2 混成軌道に入っている。
左側の炭素は、3本の σ 結合と、1本の π 結合を持ち、荷電子数は4。従って、形式電荷は「0」。右側の炭素は、3本の σ 結合をもち、価電子数は3。従って、形式電荷は「+1」。右側の炭素は、sp 混成 をしている。残った p 軌道の一方は、隣接炭素との間の π 結合の生成に使用される。もう一方の p 軌道は、空のままである。(分子の形が、エテンとはかなり異なるので注意すること。)
左側の炭素は、3本の σ 結合と、1本の π 結合を持ち、荷電子数は4。従って、形式電荷は「0」。右側の炭素は、3本の σ 結合と不対電子をもち、価電子数は4。従って、形式電荷は「0」である。メチルラジカルにおいて、不対電子は、結合電子対との反発が不充分で p 軌道に入ったことを考えると、この分子種においても、不対電子が p 軌道に入っている可能性が高い。その場合、右側の炭素上で互いに反発する結合電子対は、2本の σ 結合のみとなるから、右側の炭素の混成状態は sp であると考えられる。
1.66
sp2 混成原子のまわりの3本の結合は同一平面内にある。しかし、sp3 混成原子があると、4本の結合がすべて同一平面内にあるわけではない。
ethene エテン( H2C=CH2 )の構造を考えてみるとよい。2つの炭素と4つの水素は同一平面内にある。
(解答例)
a) この2つの sp3 炭素は、sp2 炭素2つとは同一平面内にはない。シクロヘキセン環の、メチル基の結合している位置の炭素は、二重結合の作る同一平面内にあるが、この炭素が sp3 混成であるから、メチル基炭素は面よりも手前、または奥側のいずれかである。(この構造式では、その違い(=立体)を区別していない。)
b) 同一平面内にある。二重結合を形成している2つの炭素が sp2 混成をしており、そこから伸びた結合の先にある2つの炭素なので。
c) 同一平面内にある。二重結合を形成している2つの炭素が sp2 混成をしており、そこから伸びた結合の先にある2つの炭素なので。
1.67
a) の問いは、「sp3 混成原子をもつ化学種はどれか」と読み替えるか「孤立電子対を持たない sp3 混成原子をもつ化学種はどれか」と読み替えるかで答えが変わる。たとえば水分子 H2O の酸素は、sp3 混成であるが、結合角は、孤立電子対間の反発がより大きいために105°程度である。
(解答例)
a) sp3 混成をもつものは、H2O、H3O+、NH3、NH4+、CH3-である。この中で、厳密に109.5°の結合角をもつと期待されるのは、同じσ結合を4本もつ NH4+ のみである。
b) sp3 混成をもつものは、CH3+ と BF3である。これらは、いずれも 120°の結合角をもつ。
1.68
問い 1.60 の4), 5) などと同様に考える。1.60 の(発展)の項を参照すること。
(解答例)
CH3CH2Cl (1-chloroethane)の C-Cl 結合は、炭素の sp3 混成軌道(s 性 25 %)を使っている。これに対し、CH2=CHCl (1-chloroethene) の C-Cl 結合は、炭素の sp2 混成軌道(s 性 33 %)を使っている。
s 性の割合が大きいほど、結合は短くなる傾向があるから、1-chloroethane の C-Cl 結合の方が長い。
1.69
出題に不備あり(解説が誤っており、事実と反している)。
塩素は、炭素と比べて電気陰性であるため、C-Cl 結合は大きく分極する。ただし、分子全体の双極子モーメントの大きさを知りたい場合、塩素の数だけにとらわれてはいけない。分子全体として、4本の結合がもつ分極のベクトルの和を考える必要がる。
英語版問題の解き方の解説には、「クロロホルムでは電子求引的な基である塩素が3本結合しているので、塩素との結合が2本であるジクロロメタンよりも、大きな双極子モーメントを持つ」と書いてある。しかし、これは、誤りであると思われる。
(解答例)
(発展)の項を参照してください。
(発展)
「Organic Solvents」4th Edition, J.A.Riddick et.al, JOHN WILEY & SONS, Inc. (1986).
に依ると、クロロメタン、ジクロロメタン、トリクロロメタン(クロロホルム)の双極子モーメントは、次の値でした。
CH3Cl : 1.87 D (気相中)
CH2Cl2 : 1.14 D (液相中)
CHCl3 : 1.15 D (ベンゼン溶液中)
測定条件が揃っていないので、精確な比較はできませんが、実験事実としてジクロロメタンとクロロホルムは、ほぼ同じ双極子モーメントを持つと結論してよいと思われます。
さて、次の図を見てください。
1.45 の(発展)でも述べたように、メタン CH4 や四塩化炭素 CCl4 が、4本の σ 結合がそれぞれ分極しているにも関わらず、対称性から4本の結合に由来する双極子モーメントのベクトルが打ち消しあうことから、その3本のベクトルの和は、もう1本のベクトルと同じ大きさで相対することを考えます。また、結合角 120°で2本の結合がある場合、そのベクトルの和は(作図から明らかになりますが、)同じ大きさのままで、2本の結合の中間の方向を向きます。
以上のように考えると、上記の図からは、クロロメタン、ジクロロメタン、トリクロロメタン(クロロホルム)ともに、すべてほぼ同じ双極子モーメントを持つはずであることが結論されるはずです。
ジクロロメタンでは、正四面体を想定して、結合角がおよそ 110°であるものとすると、C-Cl 結合2本に由来するベクトルの和は、やや大きくなると考えるべきかもしれません。しかし、塩素が水素より大きいため、結合角は110°より開いているかもしれません。(文献値がみつかりませんでした。)同様の事はクロロホルムについても言えます。従って、あまり詳細な議論は、ここでは意味がないでしょう。
実測データから、ジクロロメタンとクロロホルムの双極子モーメントはほぼ同じ大きさであると言ってよさそうですし、そのことは上の図で説明できそうなのですが、クロロメタン(気相中)の双極子モーメントだけがジクロロメタンやクロロホルムの値と比べてかなり大きいという事実は、上の図だけではうまく説明できません。
以下、根拠(参考書の記述や文献値)は何も持っていないのですが、C-Cl 結合が1本しかない場合と、2本以上の場合、電気陰性度の違いによって誘起される炭素上の部分正電荷の大きさに差があるのかもしれません。2本目の C-Cl 結合を考える場合、1本目の C-Cl 結合によってすでに炭素上に正電荷が生じていますから、中性の炭素よりも見かけ上電気陰性度が高くなっている、という説明です。
同様に、クロロメタンの炭素は、ジクロロメタンの炭素やクロロホルムの炭素に比べてより多くの C-H 結合から電子が流れ込んできている効果があるため、より大きい負の部分電荷を帯びている(電子を与えやすい)、すなわち中性の炭素よりも見かけ上電気陰性度が低くなっているとも言えます。
その両者があいまって、トリクロロメタンよりも、クロロメタンでの分極が大きくなっているということです。
ここでは、「電気陰性度というのはさまざまな分子において平均的に求められた値であり、異なる分子では、電気陰性度の差が同じからと言っていつも同じ大きさの分極の寄与を与えるわけではない」という立場に立脚しています。また、分子全体の双極子モーメントは、結合のもっている双極子モーメントのベクトルの和だけではない要因がある、と言っていることになります。このような考え方は、2年生で履修すべき範囲を超えますので、参考程度にしておいて結構です。
※ 溶媒の極性という観点からは、双極子モーメント以外に、誘電率などの値も影響します。話はもっと複雑になります。ここでは割愛。なんなすみません。;-p
1.70
【註】「次の化合物(ClCH=CHCl)には2つの異性体がある。 」という出題文は、「次の構造式で表される化合物には2つの異性体がある。 」と読んでください。すなわち、ClCH=CHCl (1,2-dichloroethene) の構造式で共通に表される構造のうちから、2つの異性体(立体異性体)を考えてください。
位置異性体であるCH2=CCl2 (1,1-dichloroethene) は、ClCH=CHCl (1,2-dichloroethene) の異性体であるという条件を満たしますが、これも含めて考えると、双極子モーメントについては、3つの異性体を考慮にいれなければいけないことになりますので、おそらく、出題者の意図ではないと思います。
ClCH=CHCl は、教科書 p37 のエテン(エチレン)H2C=CH2 から誘導して、各炭素上から水素の一方を塩素に置き換えた構造である。従って、組み合わせとして(二重結合に対して同じ側の水素2つ)、または、(互いに二重結合に対して逆の位置にある水素2つ) の2通りがある。これを「幾何異性体」または「シス-トランス異性体」という。
(解答例)
ClCH=CHCl の2つの幾何異性体の構造を示した。また、それぞれに対し、C-Cl 結合の分極を赤の矢印で示した。
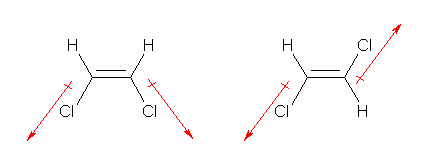
右側の構造(トランス体)では、2本のC-Cl 結合の分極が互いに打ち消しあう。そのため、双極子モーメントを持たない。左の構造(シス体)では、2本のC-Cl 結合の分極が互いに打ち消しあうことがない。
上図では省略しているが、C-H 結合にも(C-Cl 結合ほどではないにしても)分極がある。この分極も、同様に、トランス体では互いに打ち消しあう。
【註】図は省略しますが、1,1-dichloroethene も結合の分極は打ち消しあいませんので、双極子モーメントをもちます。
1.71-1.80
1.71
結合の様式(単結合か、多重結合か)で、結合角がどうなるのが自然か考えてみること。
(解答例)
解答例その1) 三重結合をもつ炭素は、180°の結合角で安定となるのに対し、環の構造があるため、180°の結合角を取れない。
つまり、混成状態から予想される結合角よりも小さい(場合によっては大きい)結合角をとらないといけないことによる「結合角ひずみ」が生じている。
解答例その2) 三重結合炭素の2本の π 結合が隣接した2つの炭素の p 軌道同士により生じているなら、炭素は sp 混成を取っていなければならない。2つの sp 混成軌道のうち、ひとつは三重結合を形成している C-C 間の σ 結合に使用される。もうひとつの sp 混成軌道は、隣接位の CH2 との間での σ 結合をするのに使われるはずであるが、sp 混成軌道が突き出している方向と、結合しようとしている方向が合致しない。そのため、隣接位の CH2 の sp3 混成軌道との重なりが小さくなるため、結合が弱くなる。
解答例その3) 三重結合炭素の結合角は、分子の環の構造より 120°くらいであることが規定されてしまう。そのため、この炭素は、sp 混成ではなく、sp2 混成を取っていると考えられる。2本の π 結合のうち1本は、混成せずに残された p 軌道が互いに重なって生じている(これは、通常の π 結合である)が、もう1本の π 結合は、2つの三重結合炭素より、環の側面方向に sp2混成軌道が、平行ではなく120°の開きをもって突き出していることを利用して、擬似的な π 結合となっているものであると考えられる。当然、軌道間の重なりは、平行ではないことから小さくなっており、この3本目の(擬似的な)π 結合は、2本目の π 結合よりもかなり弱いと考えられる。
解答例1が一番わかりやすいかな。分子の形が先にありきで混成状態を選ぶことができるはずであるという立場を守ると、解答例3のように答えることになります。
(発展)
英語版「問題の解き方」の解説では、上の3つ挙げた解答例のうち、「その2」に沿った説明をしています。この説明が純粋に正しいとするならば、「三重結合に隣接した単結合の部分が弱い」という結論に至りますが、その結論は間違いです。
1.72
結合の双極子モーメントは、結合の分極の大きさ(部分電荷の大きさ、電気陰性度の差に由来する)と、結合長の積であったことを思い出すこと。
この問題は、1.12 との対比になっています。H-Cl と H-F を比較すると、H-F の方が大きな双極子モーメントを持っていたにも関わらず、C-Cl と C-F を比較すると、大小関係が逆になっているわけです。
ただし、発展のところで計算してみせたように、1.12 と同じ考え方だけでは、(現在の知識の範疇では)この逆転現象は、実は説明できません。
(解答例)
電荷×距離の関係で求められる双極子モーメント μ は、大×長 のとき、最も大きくなる。C-Cl と C-F を比較すると、小×長 と 大×短 の組み合わせなので、どちらが大きくなってもおかしくありません。
(発展)
問題文に結合距離のデータが示されているわけではないが、調べてみると、rC-F = 1.39 Å、rC-Cl = 1.78 Å という数値がありました。これを元に結合長を比べると、C-Cl 結合は、C-F 結合の約 1.3 倍です。
次に、電気陰性度の差を調べると、C-Cl では、ΔEN = 0.5、C-F では、ΔEN = 1.5 と約3倍でした。
以上を総合して、問い 1.12 と同じ議論をしようと試みるとき、H-F では、距離が 1.3倍短くても、部分電荷の大きさがそれ以上にフッ素で大きい(ΔEN が3倍と大きいので)ため、C-F 結合の方が大きな双極子モーメントを持つという結論に達します。
しかしながら、これは問題文にも書かれている通り、実験結果とは一致しません。
実験結果は、μH3C-Cl = 1.94 D、μH3C-F = 1.82 D と案外差が小さいだけではなく、フッ素より塩素の場合に大きくなっているのです。実際には、これらの双極子モーメントの大きさは、純粋に C-Cl および C-F 結合だけに依って決まるのではなく、反対側にある3本の C-H 結合の分極の寄与も考えるべきです(※)。このことをさしひいても、
部分電荷の大きさが電気陰性度の差に比例するという仮定は、いつも正しいわけではない(他の要因も働きうる)ということです。
実際、ブロモメタン、ヨードメタンの双極子モーメントの数値も、μH3C-Br = 1.79 D、μH3C-I = 1.64 D となっています。もし電気陰性度の差だけが部分電荷の大きさを決めるのであれば、炭素-ヨウ素結合は分極していないことになってしまいます。他の要因とは何か、ということは基礎有機化学の範疇では説明できませんし、現在、私自身、自信をもった正解を持ち合わせていませんので、省略します。
(※)非常に大雑把な見積もりとして、3本の H-C 結合に由来する分子の双極子モーメントへの寄与を、0.4 D とします(1本分の C-H 結合による双極子モーメントと同じと置いています。これは、メタンの対称性を考えれば、3本の結合の双極子ともう1本の結合の双極子が釣り合っていることから結論できます。)分子として観測される双極子モーメントから、この値を引いた残りが C-ハロゲン結合に由来すると考えて、ハロゲン上の部分電荷を概算すると、(電気素量に対する比で)QF = 0.22、QCl = 0.18、QBr = 0.15、QI = 0.12 となり、電気陰性度の高い方が強く分極する傾向にあるところまでは正しそうです。問い1.12 で調べた ΔEN と部分電荷の大きさとの関係と比較したとき、どちらかというと、炭素と結合したフッ素で部分電荷が思いの他小さいというよりも、塩素、臭素、ヨウ素となるにつれて、炭素と結合しているときの分極の大きさが電気陰性度の差よりも強くでているように見えます。
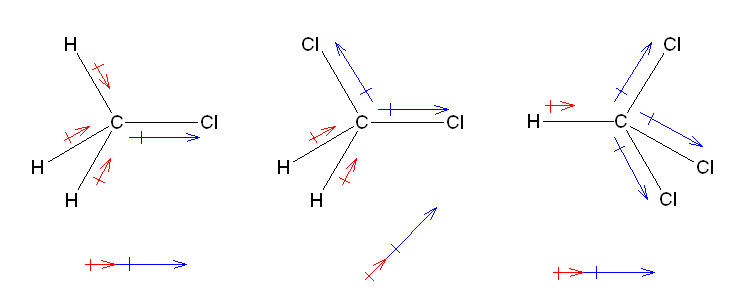
結合距離、双極子モーメントの数値の出典:「はじめて学ぶ大学の有機化学」化学同人、深澤義正 他。p83、表5。
1.73
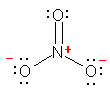
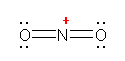
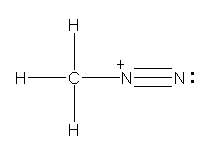
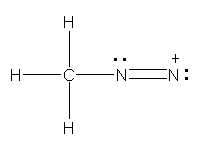
少々難易度の高い設問かもしれない。
a) CH3 は、通常のメチル基。単結合により、窒素原子と結合している。その窒素上には、もう1つの窒素原子が結合する。価電子数は、一方の窒素で5、もう一方の窒素で4となる。
b) やはり複数の構造を書くことができるが、ここでは、次のロジックに合う1つの構造を書けばよい。
CH2 の炭素が形式電荷をもたない構造であるためには、炭素と窒素の間に二重結合が必要である。分子全体としては電荷をもたない分子である。
ここで、「両窒素原子の価電子を5個、5個として書き、かつ最大の結合の数を4本以下に抑えるようにする。」ことを考える。(窒素から5本の結合を書くことになるため、窒素間に三重結合をとることはできない。また、窒素間に二重結合を書くと、価電子が5個でなければならないから、炭素と二重結合した窒素上に、ペアを作らない電子が残ってしまうことになり、安定構造として不適格である。)カッコ内の除外により、窒素間の結合は、単結合であることになる。右側の窒素は、価電子5という条件より、孤立電子対を2つ持つことになる。これで価電子数と形式電荷でつじつまは合う。しかし、右側の窒素が結合1本+孤立電子対2という、オクテットを満たしていない(最外殻電子の和が6個しかない)状況になるため、適切な構造ではないことがわかる。
そこで、「両窒素原子の価電子を4個、6個として書き、形式電荷を 1+ と 1− であることにする」ことで構造を書くことを試みること。これが正解の構造となる。
c) NNN の順のならびを考える。三角形の環は作らない。c)、d) ともに、各原子がオクテットを満たすように価電子を配置していくことで正解が得られるはずである。最外殻電子が8を越えない(結合数と孤立電子対の数の和が4を超えない)ように注意すること。
(解答例)
a)
上が、すべての原子がオクテットを満たしている。下では、右側の窒素ではオクテットを満たしていないため、構造の重要度は低い。
b)
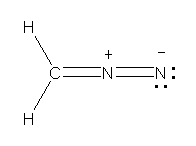
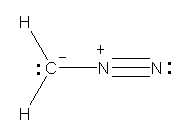
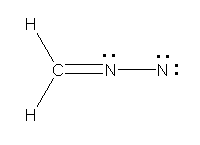
上2つが、すべての原子がオクテットを満たしている。一番下の構造は、ヒントの文章ではじめに述べたもの。右側の窒素ではオクテットを満たしていないため、構造の重要度は低い。2番目の構造は、炭素をアニオンにする(価電子5価で、形式電荷が1−、オクテットを満たしている)ことを思いつかないと書けないかもしれないが、条件を満たしていることを確認されたし。
別解がありました。次の構造も同じ分子式 CH2N2 に対する正しい構造です。
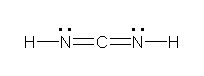
c)
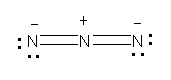
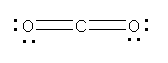
この構造は、次の二酸化炭素と同じ電子構造であることに気付くとよい。
d)
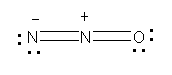
c のN3- や二酸化炭素とも同じ電子構造である。