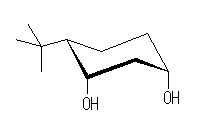
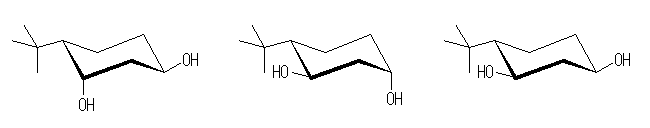
3.01-3.10
3.01
また、「官能基名」と、「その官能基を持つ化合物の一般名」を混同しないこと。
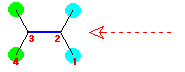
(解答例)
教科書の例解は、官能基名を示さずに、その官能基を持つ化合物の一般名(ケトン、エステル、アルコールなど)を与えており、「官能基を示せ」との問いに対して必ずしも適切でないと判断できる部分もある。注意されたし。
(a) 1-cyclohexenecarboxamide
二重結合(赤)(二重結合を持つので、シクロアルケンの誘導体である。)
カルボニル基(青)(ケトン基ではない。)
アミド結合(緑)(-CONH2 まで含めてアミド基としてもよい。)
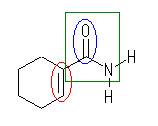
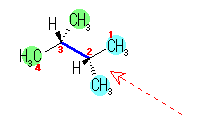
(b) 2-pyrrolidinecarboxylic acid
アミン(桃)(2級のアミンである。N 上のアルキル部分まで考えて、アミノ基と呼んでも良い。)
カルボニル基(青)(ケトン基ではない。)
カルボキシ基(茶)(カルボキシ基を持つので、カルボン酸である。なお、カルボキシ基は -OH 部分を持つが、官能基として水酸基を持つという言い方はあまりしない。)
(c) methyl 5-methyl-3-oxo-5-hexenoate
二重結合(赤)
カルボニル基(青)(左側のカルボニル基は、ケトン基と呼んでも良い。)
エステル結合(橙)(この図では、メチルエステルである。)
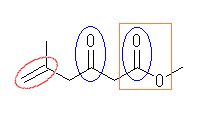
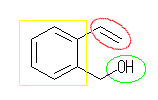
(d) 2-vinylbenzylalcohol
二重結合(赤)(-CH=CH2 は、ビニル基である。)
水酸基(黄緑)(アルカンに水酸基が結合しているので、アルコールである。)
芳香環(黄)(芳香環(ベンゼン環は、芳香環の中の1種)を持つので、アレーンである。また、ベンゼン環中にも二重結合が存在するが、その二重結合は、わざわざ官能基として取り上げる必要はない。)
3.02
(解答例)
示された官能基を持つような分子には、さまざまなものがある。ここでは、その中の数例のみを示す。
(a) CH3OH(メタノール)
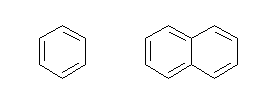
(b) 下図(左はベンゼン、右はナフタレン)
(c) CH3CO2H(エタン酸(慣用名:酢酸))
(d) CH3NH2(メチルアミン)、(CH3)NH
2(ジメチルアミン)
(e) CH3COCH2NH2(1-アミノ-2-プロパノン):下図左。
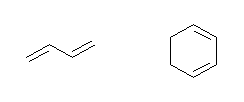
(f) CH2=CH-CH=CH2(1,3-ブタジエン):
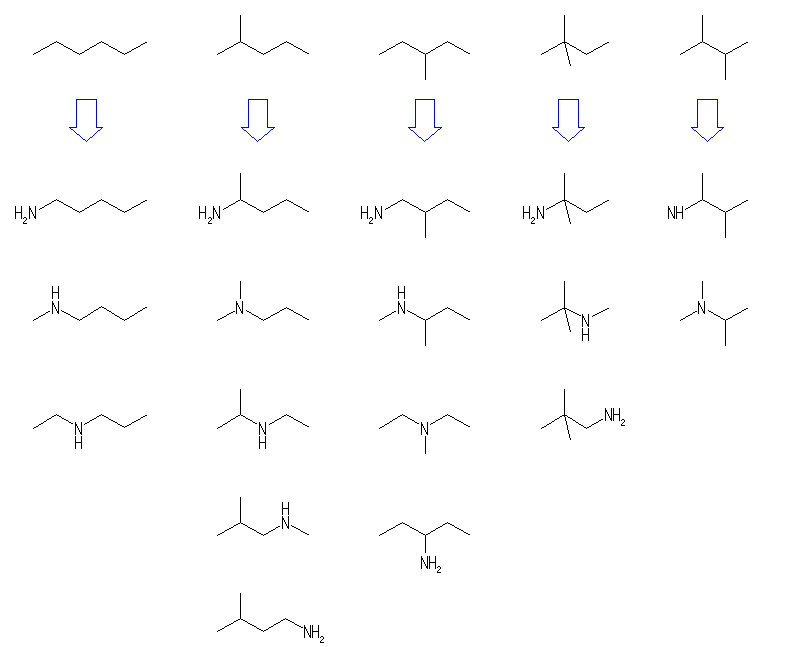
下図右(1,3-シクロヘキサジエン)や、CH2=C=CH2(1,2-プロパジエン)などでも良い。
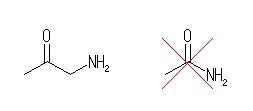
(e) 上図右の CH3CONH2(エタンアミド(慣用名:アセトアミド))は、1-アミノ-2-プロパノンよりも更に単純な構造であるが、カルボニル基(C=O)の両側ともがアルキル基ではないので、ケトンではない。またアミノ基に結合しているのがアルキル基ではないので、アミンでもない。
3.03
(解答例)
(骨格構造式で示す。)
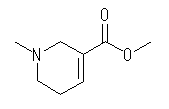 分子式は、C8H13NO2
分子式は、C8H13NO2
arecoline (アレコリン)のIUPAC名は、methyl 1-methyl-1,2,5,6-tetrahydropyridine-3-carboxylate である。
3.04
まず、主鎖の炭素数が6のもの、次に主鎖の炭素数が5のもの、というように順に探すと見落としがない。
(解答例)
(骨格構造式で示す。下図の通り。)
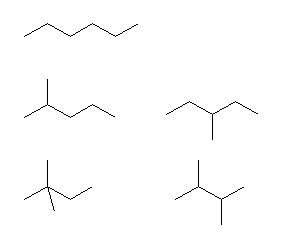 なお、名称は次の通り
なお、名称は次の通り
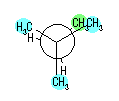
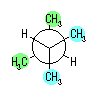
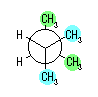
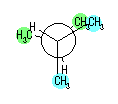
hexane,
2-methylpentane, 3-methylpentane,
2,2-dimethylbutane, 2,3-dimethylbutane
3.05
(a) メチルエステル(-CO2CH3)を持つものと仮定し、分子式からこの部分を差し引くと、C3H7 となることから、示性式で表すと、C3H7-CO2CH3、C2H5-CO2C2H5、 CH3-CO2C3H7、 H-CO2C4H9、の4種の可能性がある。メチル基とエチル基は直鎖アルキル基しか存在しないが、プロピル基とブチル基には分枝した構造の異性体が存在することにも注意する。
全部で9種類のエステルの異性体が存在する。
(b) シアノ基(ニトリル基)(-C≡N)を持つので、これを分子式から差し引くとC3H7 となることから、示性式は、C3H7
(解答例)
(a) 以下9種のうちより2つ。
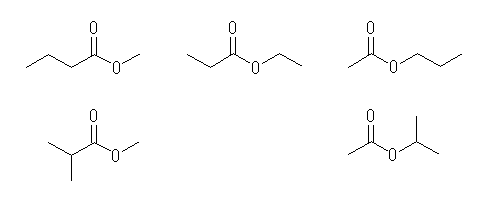
methyl butanoate, ethyl propanoate, propyl acetate,
methyl 2-methylpropanoate, isopropyl acetate
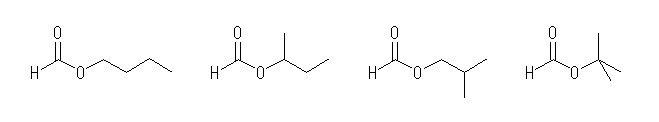
butyl formate, sec-butyl formateisobutyl formatetert-butyl formate
(b) プロパンの異なる位置にシアノ基が置換した構造は、以下の2つ。
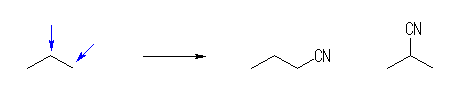
butanenitrile, 2-methylpropanenitrile
3.06
(a) 水酸基を持つのだから、示性式は C3H7-OH である。水酸基を水素に置き換えたアルカン C3H8 について骨格異性体を全て探しだし、それぞれを母核とするアルコールについて水酸基を置換する際の位置異性体をすべて探す。
(b) 臭素を水素に置き換えたアルカン C4H10 について骨格異性体を全て探し、それぞれを母核とするブロモアルカンについて臭素を置換する際の位置異性体をすべて探す。
(解答例)
(a) プロパン C3H8 には、骨格異性体は存在しない。その内の一つの水素を水酸基に置き換えたものは、次図の通り2種である。
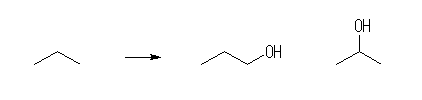
1-propanol, 2-propanol
(b) ブタン C4H10 には、骨格異性体は2種存在する。それぞれの一つの水素を臭素に置き換えたものは、次図の通り4種である。
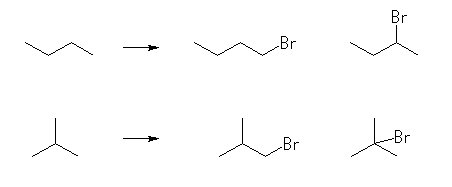
1-bromobutane, 2-bromobutane,
1-bromo-2-methylpropane, 2-bromo-2-methylpropane
3.07
(解答例)
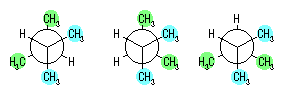
ペンタン C5H12 には、骨格異性体は3種存在する。それぞれの一つの水素を取り除きアルキル基としたものは、次図の通り8種である。
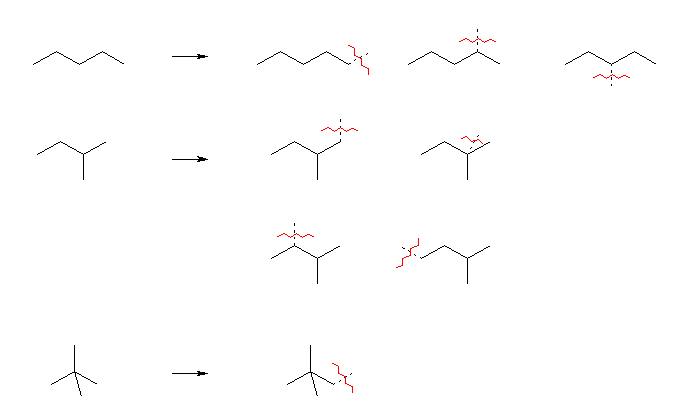 アルキル基の名称は以下の通り
アルキル基の名称は以下の通り
pentyl,*1
1-methylbutyl,
1-ethylpropyl,
2-methylbutyl,
1,1-dimethylpropyl,*2
1,2-dimethylpropyl,
3-methylbutyl,*3
2,2-dimethylpropyl*4
註:
*1 「 n- 」をつけて直鎖アルキルであることを示しても良い。(例:n-pentyl )
*2 慣用名では、 tert-pentyl
*3 慣用名では、 isopentyl
*4 慣用名では、 neopentyl
(炭素5のアルキル基で慣用名が許されるのは上記3種のみ。また、これらのアルキル基の慣用名称は、その誘導体を作ることを許さない。( phenyl基( −C6H5 )からはその誘導体として例えば 2-chlorophenyl 基を作ることができるが、chloroisopentyl 基などのような複合的な名称の部分として用いることはできない。))
3.08
(解答例)
骨格構造で示された図中の炭素原子のうち、赤で囲んだものが1級、青で囲んだものが2級、緑で囲んだものが3級、黄で囲んだものが4級である。
(a)  (b)
(b)  (c)
(c) 
3.09
教科書83ページの脚註にもあるように、水素に対して第1級、第2級、第3級といった分類をすることはあまり一般的ではない。
(解答例)
解答の詳細は省略。
3.08 の解答で第1級炭素に結合した水素が第1級水素、第2級炭素に結合した水素が第2級水素、第3級炭素に結合した水素が第3級水素である。第4級炭素は4本のC−C結合を持ち水素と結合しないから、第4級水素というものは存在しない。
3.10
(a) 2つの第3級炭素以外に炭素を持たないようなアルカンは存在しないので、適宜、第1級や第2級の炭素を補って考えればよい。
(b) イソプロピル基の構造は −CH(CH3)2 である。(教科書82ページの図3.3も参照のこと)
(c) もちろん、(a) と同様に第1級などの炭素を補って考えればよい。
このような問題では、自分で書いてみた構造式が条件を満たしているかどうか、問題 3.08 と同様の方法で確認してみることが重要である。
(解答例)
図のうち、左端のものが最低の炭素数で与えたもの。ただし(b)については下の解説を参照すること。また図の中あるいは右は指定されていない級数の炭素を追加したもの。これらでも条件を満たしているので正解とされる。
(a) 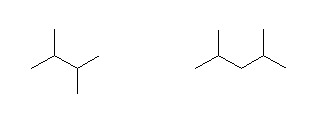
2,3-dimethylbutane, 2,4-dimethylpentane
(b) 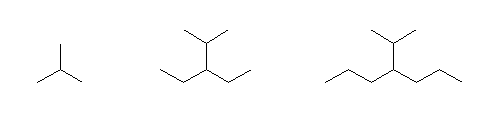
2-methylpropane, 3-ethyl-2-methylpentane, 4-isopropylheptane*1
(c) 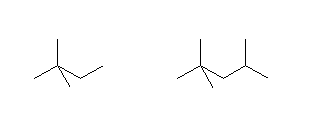
2,2-dimethylbutane, 2,2,4-trimethylpentane
註 *1 isopropyl基は慣用名で、システム的な名称では 1-methylethyl基となる。したがってこの分子は
(b) 左端の分子は、置換基(イソプロピル基)を中心に考えると、その置換基が母核としてのメタンに付いていることになり(すなわち、
なお、シクロプロパンにイソプロピル基が置換したもの( isopropylcyclopropane )が、アルカンおよびシクロアルカンの中で、イソプロピル基を名称の中に含む最低の分子である。その他、分子内に二重結合や他の置換基がある場合も命名上で元となる主鎖として一番長い炭素鎖以外が選ばれる場合があり、少ない炭素数のものでもイソプロピル基を置換基として命名することになることもある。(例:2-isopropyl-1,3-butadiene )
註 *2 教科書p85 命名規則 段階2 b) 「長さの等しい二つの違った炭素鎖が存在する場合は、母体になるべく多くの分枝点があるものを選ぶ」より。
3.11-3.20
3.11
(a) C5H12 は、一般式 CnH(2n+2) に従うので飽和のアルカンである。その骨格異性体には、主鎖の炭素数が5のもの、4のもの、3のものが存在する。
(b) 〜 (d) 主鎖がどこであるとすると一番長くなるか。またその番号は(左右の)どちらから振る方が置換基の位置番号が若くなるか。
なお、(CH3)2CH− や、(CH3)3C− という構造式は次の構造に対応している。
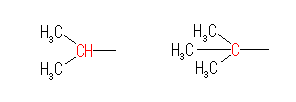
(解答例)
(a) 
pentane,
2-methylbutane,
2,2-dimethylpropane
(b) 〜 (d) では、問題文中で同じ行内で書かれている部分を黄色の背景で示した。これらの構造の中で一番長い炭素鎖は、赤で示された部分(他の等価な取り方があるものもある)である。
(b) 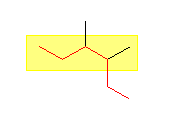
3,4-dimethylhexane
(c) 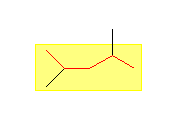
2,4-dimethylpentane
(d) 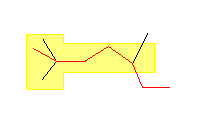
2,2,5-trimethylheptane
複雑な化合物の命名については、単純なアルカンの命名に優先する規則がある。(授業でやったとおり。)教科書下巻、巻末付録Aを参照すること。その概要を以下にまとめておく。
- 主基(一番優先される官能基)を決める。これが名前の接尾語の部分を決める。
- 主鎖(母体の炭化水素)を見つける。このとき、単純なアルカンでは連続した最も長い炭素鎖を見つけるのであるが、一般的には次の順に決める。
- (主官能基数)主基が最多の鎖を第1優先とする。
- (多重結合数)上でひとつに決まらない場合、多重結合(二重結合と三重結合を区別しない)の数が最大になるものを選ぶ。
- (鎖の長さ:炭素数)上でひとつに決まらない場合、連続した炭素鎖の長さが長いものを選ぶ。
- (二重結合の数>三重結合)上でひとつに決まらない場合、二重結合の数が多いものを選ぶ。
- (主基の位置)上でひとつに決まらない場合、主基の位置番号が最小となるような炭素鎖を選ぶ。
- (多重結合の位置)上でひとつに決まらない場合、多重結合の位置番号が、組として最小(はじめに出てくる番号が最小、同じ場合には次にでてくる番号がより小さい、…)となる鎖を選ぶ。
- (側鎖の数)上でひとつに決まらない場合、接頭辞で表される置換基の数(アルキル基の場合には、母体上の分岐点。ハロゲンなども含めて、側鎖の置換基の数)が最多の鎖を選ぶ。
- (側鎖の位置)上でひとつに決まらない場合、接頭辞で表される置換基の位置番号が、組として最小(はじめに出てくる数字が最小、同じ場合には次にでてくる番号がより小さい、以下同じように)となる鎖を選ぶ。
- (小さい側鎖の炭素原子数)註上でひとつに決まらない場合、側鎖の炭素原子数を小さい方から比べ、差が見つかったところの側鎖の炭素原子数が大きいものを選ぶ。
- 上でひとつに決まらない場合、側鎖の分岐が最小のものを選ぶ。
このルールによれば、次の化合物は
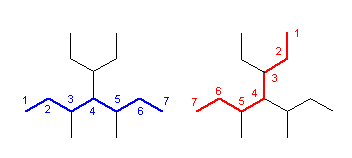
炭素数7の主鎖を2通り選べるが、側鎖の数はいずれも3で等しい。側鎖の位置もいずれも3、4、5位で等しい。従ってこのルールの適用となる。一方の選び方では、側鎖の炭素数が(1、1、5)であるのに対し、もう一方の選び方では側鎖の炭素数が(1、2、4)となる。そこで、2番目に小さい側鎖の炭素原子数で差がみられたので、ここでより大きい後者を選ぶ。すなわち、
× 4-(1-ethylpropyl)-3,5-dimethylheptane
○ 3-ethyl-5-methyl-4-(1-methylpropyl)heptane
ということになる。なお、(1-methylpropyl) 基の慣用名は sec-butyl 基である。
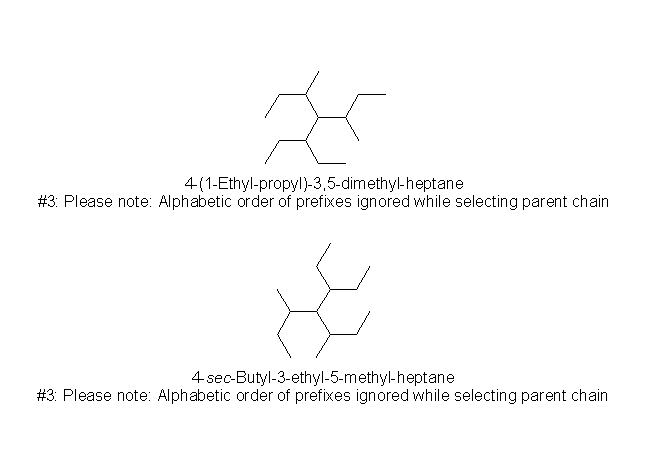
なお、市販の化学構造式描画ソフトである ChemDraw などでは、構造式を書いて名前を表示させる機能がついているが、必ずしも正確ではない。以下は(書き方が異なるだけで)同じ分子に対し、この命名機能を用いたときに2通りの名前が表示されている例。(上記ルールによれば、図上方の命名は間違いで、図下方の命名が正しい。)
3.12
(解答例)
下図の通り。なお、下図において主鎖の炭素の左から右へ番号を振った。
(a)  (b)
(b)  (c)
(c) 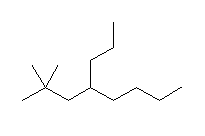 (d)
(d) 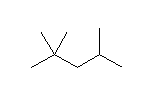
3.13
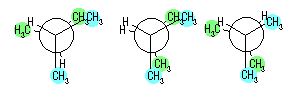
(解答例)
(3.07 の解答より 再掲)
 pentyl,*1
1-methylbutyl,
1-ethylpropyl,
pentyl,*1
1-methylbutyl,
1-ethylpropyl,
2-methylbutyl,
1,1-dimethylpropyl,*2
1,2-dimethylpropyl,
3-methylbutyl,*3
2,2-dimethylpropyl*4
註:
*1 「 n- 」をつけて直鎖アルキルであることを示しても良い。(例:n-pentyl )
*2 慣用名では、 tert-pentyl
*3 慣用名では、 isopentyl
*4 慣用名では、 neopentyl
3.14
(解答例)
 骨格構造式は、左図のようになる。
骨格構造式は、左図のようになる。
主鎖は炭素数7のヘプタンに4つのメチル基が置換している。番号は図の右から振ると 3,4,5,5- となるが、左から振ると 3,3,4,5- となり(初めの数字は3で同じだが、2番目の数字が4と3で比べて)より小さくなる。
3,3,4,5-tetramethylheptane
3.15
(a) 母核は炭素6のシクロアルカンである。
(b) 母核は炭素5のシクロアルカンである。置換基はメチル基とプロピル基だが、どちらを先に数えても番号が同じに付く場合には、アルファベット順の先のものを優先する。(教科書93-94ページ シクロアルカンの命名規則「規則2-a)」)
(c) シクロアルカン部分の炭素数は4、アルカン部分の炭素数が5なので、シクロアルキル基の結合したアルカンとして命名する。(教科書93ページ シクロアルカンの命名規則「規則1」)
(d) 母核は炭素10のシクロアルカンである。置換基はブロモ基とエチル基だが、どちらを先に数えても番号が同じに付く場合には、アルファベット順の先のものを優先する。(教科書93-94ページ シクロアルカンの命名規則「規則2-a)、b)」)
(e) 母核は炭素6のシクロアルカンで、置換基はメチル基とイソプロピル基。イソプロピル基はアルファベット順で数える際には(pではなく)iでカウントする。(システム的な複合置換基の命名法(:教科書97ページ下部)においては、イソプロピル基は、1-メチルエチル基となる。)
(f) この系は、置換基の種類に関係なく、番号が小さくなるように番号を一意に振ることができる。なお、置換基 tert−ブチル基は、アルファベット順で数える際には(tではなく)bでカウントする。また、tert−ブチル基はシステム的な複合置換基の命名法では、1,1-ジメチルエチル基となる。またその際は、アルファベット順で数える時には(複合置換基名の中に含まれる倍数接頭語も含めて名前としてカウントするから)(mではなく)dでカウントする。
(解答例)
(a) 1,4-dimethylcyclohexane (b) 1-methyl-3-propylcyclopentane (c) 3-cyclobutylpentane (d) 1-bromo-4-ethylcyclodecane (e) 1-isopropyl-2-methylcyclohexane or 1-methyl-2-(1-methylethyl)cyclohexane (f) 4-bromo-1-tert-butyl-2-methylcycloheptane or 4-bromo-1-(1,1-dimethylethyl)-2-methylcycloheptane
3.16
(解答例)
構造式は以下の通り。
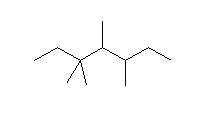
(a)  (b)
(b)  (c)
(c) 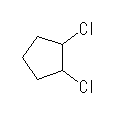 (d)
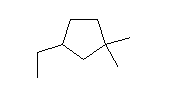
(d) 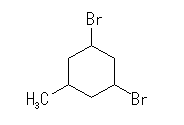
なお、(a) は左右とも同じものを表す図である。(b) の右は 1-ethyl-1-propylcyclobutane であり、シクロブチル基のついたアルカンではない。
(c) は、シス、トランスの指定がないから立体的な区別を意識せずに構造式を書いてよい。もし指定がある場合は、教科書 3.8 節を参考にして、楔型の結合の価標を用いて書く。
3.17
(解答例)
の構造を持つので、番号は( 1,3,3- よりも小さくなるように)1,1,3- と一意的に決まる。置換基はエチル基とジメチル基なので、アルファベット順でエチル(e)、ジメチル(m)の順。従って
3-ethyl-1,1-dimethylcyclopentane
3.18
立体配置異性体(シス−トランス異性体)の決め方としては、2つの同じ置換基や、注目している2つの置換基が、シクロアルカン環の上下(または手前と向こう)の同じ方向にでていれば cis 体、逆の対であれば trans 体である。(あくまでも、2つの置換基の間の関係を表すものだから、立体を表す cis- や trans- の記号は特定の置換基につけるものではないから、はじめに書く。発展の項も参照のこと。)
(解答例)
(a) trans-1-chloro-4-methylcyclohexane (b) cis-1-ethyl-3-methylcycloheptane
(発展)なお、単環式化合物における立体配置異性体(シス−トランス異性体)を表す記名法のルールは次のようになっている。
- cis, trans は化合物名の前におく。
- 立体配置異性が2箇所以上あるときは、c-t に略してもよい*1。
- 立体配置以外の要因によって環の位置番号が決められないときは、cis の番号を優先する*1。
- 3つ以上の置換基のあるときは、位置番号の最小の置換基を基準とし、その番号に r ( reference の略)をつけ、他の置換基はこれと比較して c, t の記号で示す*2。
*1
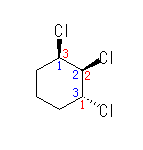
1位と2位の塩素間はシス、1位と3位の塩素間はトランスである。
立体配置異性体を区別しないならば、「
*2
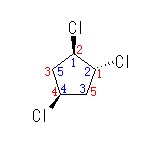
1-2位はいずれにしてもトランスであるが、1-4位の間が(優先の)シスになるよう、青字のように1位の炭素を指定する。
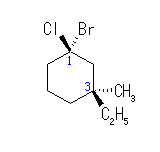
3位の2つの置換基(エチル基とメチル基)の一方のみを参照であるブロモ基との配置を指定することで、立体配置異性体を区別できる。(なお、この化合物における環の位置番号は、置換基のアルファベット順が優先して決められている。)
3.19
(b) 教科書下巻に与えられた略解答において、構造式が間違っているので注意すること。(第6版、第2刷)
(解答例)
(a) 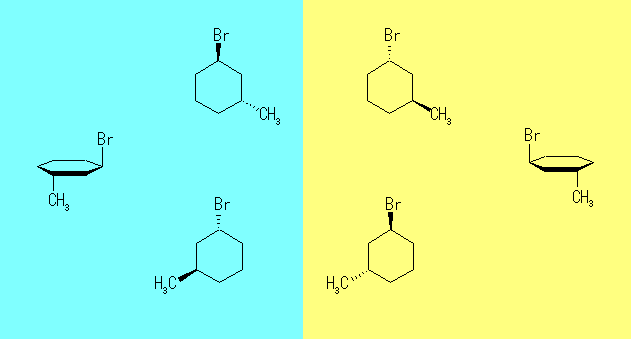
上のいずれで書いてもよい。水色の背景の左3点はいずれも互いに全く同じ構造を、黄色の背景の右の3点もいずれも互いに全く同じ構造を示す。左のものと右のものは、光学異性体である。(鏡に写してはじめて空間内で重ね合わせることができる。)
(b) 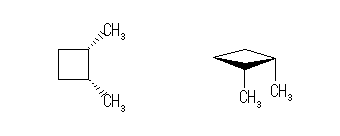
左右のいずれで書いてもよい。光学異性体は存在しない。
(c) 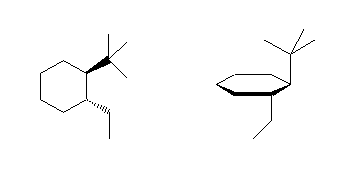
左右のいずれで書いてもよい。(左右とも同じ構造である。)(a) と同様に光学異性体が存在するが、ここではその一方のみを示している。
3.20
次のリンク先をクリックして3次元モデルをPC上でグリグリ回してみよう。立体的な様子がよくわかると思う。
(a) の分子の3次元模型
(b) の分子の3次元模型
(解答例)
(a) 2つのメチル基はともにシクロペンタン環のつくる平面に対して下方に位置している。したがって、
cis-1,2-dimethylcyclopentane
(b) ブロモ基はシクロブタン環のつくる平面より上方に位置し、メチル基も同平面よりも上方に位置している。したがって、
cis-1-bromo-3-methylcyclobutane
3.21-3.30
3.21
骨格構造式を描き、官能基をマルで囲んで、官能基名を記すこと。官能基名と、その官能基をもつ化合物の一般名とはきちんと区別すること。
(a) 主に3種の官能基をもつ。
(b) 主に3種の官能基をもつ。
特に (b) の構造式を書く際に、問題で与えられている立体的な図では陰に隠れて見えていない水素原子があるので、落とさないように気をつけること。
(解答例)
官能基名に続くカッコ内は、その官能基を持つ化合物の一般名。
(a)
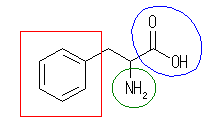 phenylalanine, C9H11O2N
phenylalanine, C9H11O2N
芳香環(アレーン):赤
アミノ基(アミン):緑
カルボキシ基(カルボン酸):青
(b)
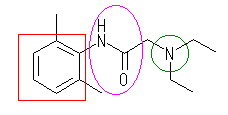 lidocaine (リドカイン), C14H22ON2
lidocaine (リドカイン), C14H22ON2
芳香環(アレーン):赤
アミン窒素(アミン):緑
アミド結合(カルボン酸アミド):桃
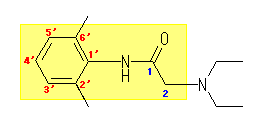
lidocaine (リドカイン)の別名は、 2-(diethylamino)-2',6'-dimethylacetanilide である。番号の付け方は下図参照。(図中、黄色背景が命名上の母核となっている acetanilide (N-phenylethanamide)である。
3.22
(a) と (c) はアルカンの命名法に従う。教科書 pp 84−87。
(b) と (d) はシクロアルカンの命名法に従う。アルカンの命名法との大きな違いは、母体を探す部分である。教科書 pp93−94。またこの二つに対しては、二つの置換基のつきかたによる立体配置(シス−トランス)を区別して記すこと。教科書 pp95−97、および 問題 3.18 の(ヒント)および(発展)を参照すること。
(解答例)
(a) 3,3,5-trimethylheptane
(b) trans-1-ethyl-3-methylcyclopentane
(c) 2,2,4-trimethylpentane
(d) cis-1-chloro-3-methylcyclohexane
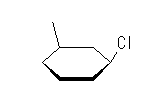
3.23
注目している置換基と、同じ炭素に結合している水素との上下関係に注目すると、次のようになる。6員環の作る平均的な面よりも、赤(下)、青(上)、緑(上)。上どうし、下どうしならシス配置、上と下ならトランス配置である。
(解答例)
赤−青:トランス 赤−緑:トランス 青−緑:シス
(発展)3つの置換基の位置から、番号は一意的にきまり、色名をそのまま置換基名とすると
1-blue-2-green-4-redcyclohexane
となるが、立体配置異性体を区別するためには、問題 3.18 の(発展)を参考にして、
r-1-blue-c-2-green-t-4-redcyclohexane
と命名する。
3.24
(a) 主に3種の官能基をもつ。
(b) 主に2種の官能基をもつ。
(c) 主に2種の官能基をもつ。その内の一つはカルボニル基を内包する。
(d) 主に2種の官能基をもつ。
(e) 主に2種、3箇所の官能基をもつ
(f) 主に2種の官能基をもつ。
(解答例)
(a)
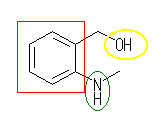
芳香環(アレーン):赤
アミノ基(アミン):緑
水酸基(アルコール):黄
(b)
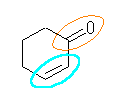
二重結合(シクロアルケン):水色
カルボニル基(ケトン):橙
(c)
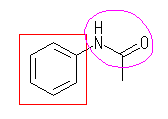
芳香環(アレーン):赤
アミド結合(カルボン酸アミド):桃
(d)
アミノ基(アミン):緑
カルボキシ基(カルボン酸):青
(e)
二重結合(シクロアルケン):水色
カルボニル基(ケトン):橙
(f)
三重結合(アルキン):紫
クロロカルボニル基(カルボン酸塩化物):茶
(a) (2-methylaminophenyl)methanol
or 2-(methylamino)benzyl alcohol (benzyl alcohol は、PhCH2OH の慣用名)
or 2-hydroxymethyl-N-methylaniline (aniline は、PhNH2 の慣用名)
(b) 2-cyclohexen-1-one
(c) N-phenylethanamide
or N-phenylacetamide
or acetoanilide
or acetylaminobenzene
(d) alanine (慣用名)
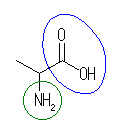
or 2-aminopropanoic acid
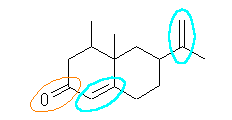
(e) 4,4a-dimethyl-6-isopropenyl-4,4a,5,6,7,8-hexahydro-3H-naphthalene-2-one
or 5,6-dimethyl-8-(1-methylvinyl)bicyclo[4.4.0]dec-1-ene-3-one
「hydro」は、水素原子の付加を示す接頭語。hexahydrobenzene で cyclohexane のこと、decahydronaphthalene で decalin となる(デカリンの語末に e は無い)。
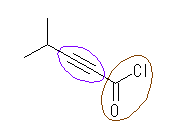
(f) 4-methylpentynoyl chloride
3.25
分子式を満たすような構造をとりあえず一つ書いてみるとよい。同じ分子式を持つ分子同士は、かならず分子内の(多重結合数+環構造の数)が一定になる。
(a) 与えられた分子式は CnH(2n+2) の一般式に従うので、飽和なアルカンである。
(b) 酸素は2本の結合を持つことを考慮して分子の構造を書くと、分子内に二重結合が一箇所、または環状構造が一箇所あることがわかる。
(解答例)
以下の中から、指定された数を解答すればよい。ここでは、光学異性体を除いてすべての構造を挙げた(と思う)。
(a)
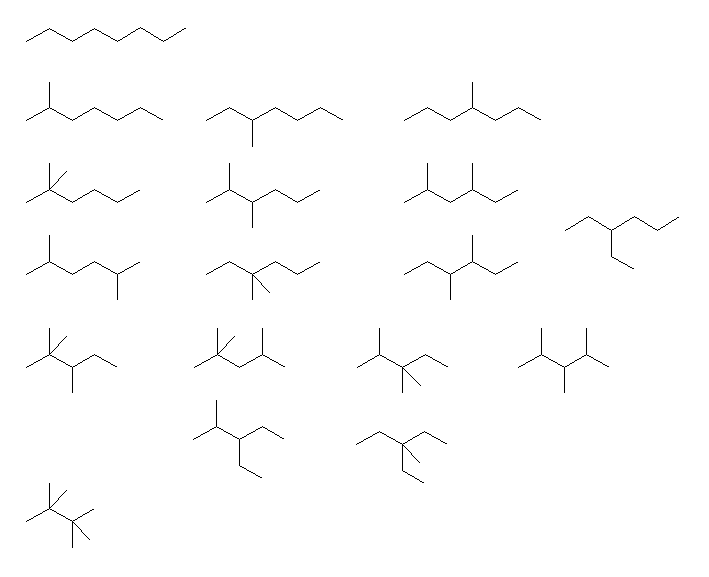
上より順に,
octane,
2-methylheptane, 3-methylheptane, 4-methylheptane,
2,2-dimethylhexane, 2,3-dimethylhexane, 2,4-dimethylhexane,
2,5-dimethylhexane, 3,3-dimethylhexane, 3,4-dimethylhexane, 3-ethylhexane,
2,2,3-trimethylpentane, 2,2,4-trimethylpentane, 2,3,3-trimethylpentane, 2,3,4-trimethylpentane,
3-ethyl-2-methylpentane, 3-ethyl-3-methylpentane,
2,2,3,3-tetramethylbutane
(b)
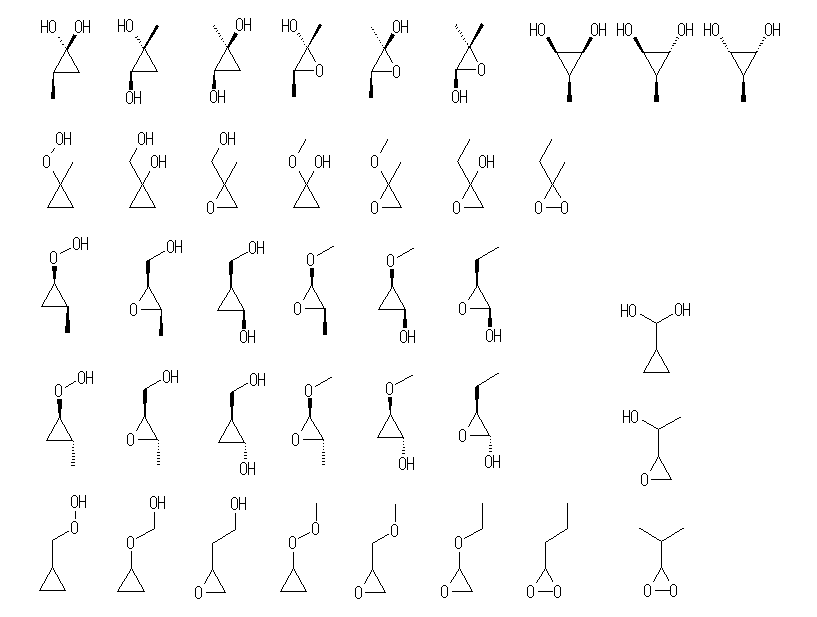
数が多いので、名称は省略。
練習のために、なるべく全ての可能性を考えてみる。
(a) 異性体はすべてで18種類、存在する。
命名時の母体となる(分子内で連続した一番長い)炭素鎖数で分類すると、
8のもの 1種
7のもの 3種
6のもの 7種 (エチル基を持つもの1種を含む)
5のもの 6種 (エチル基を持つもの2種を含む)
4のもの 1種
が存在する。
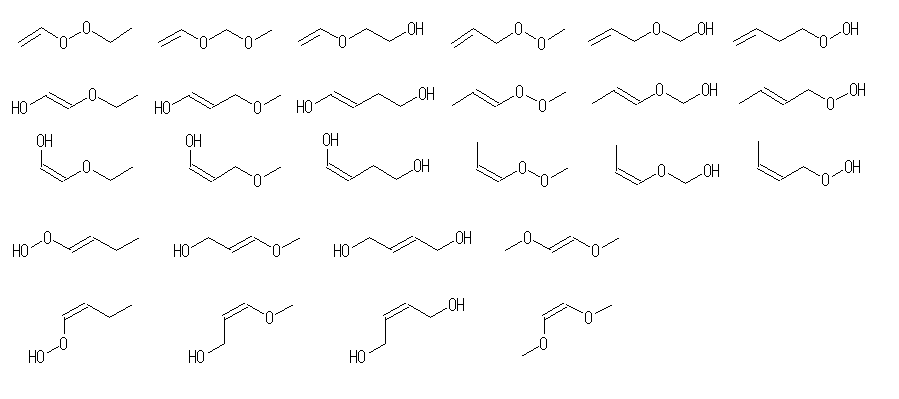
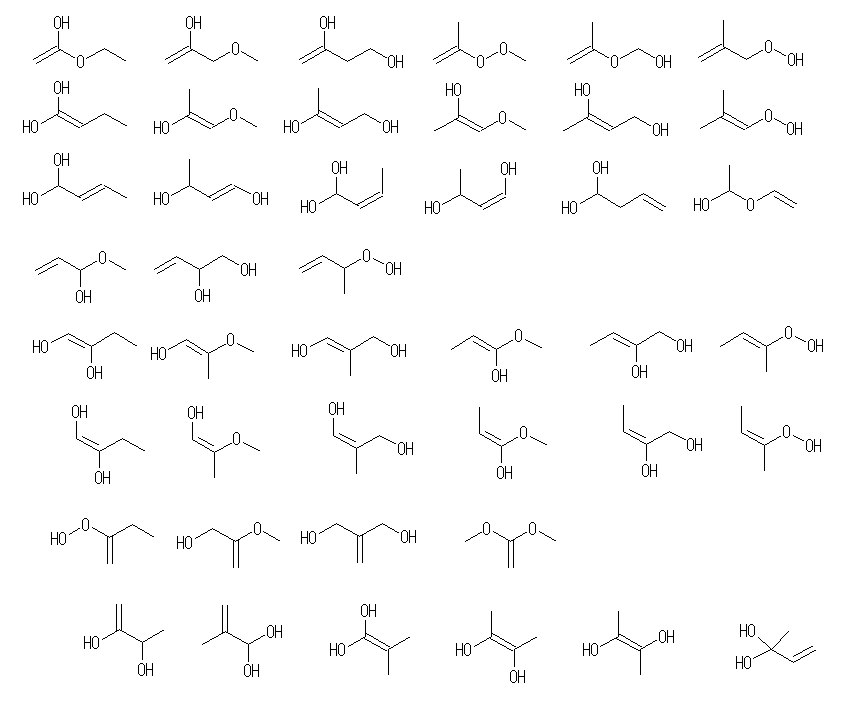
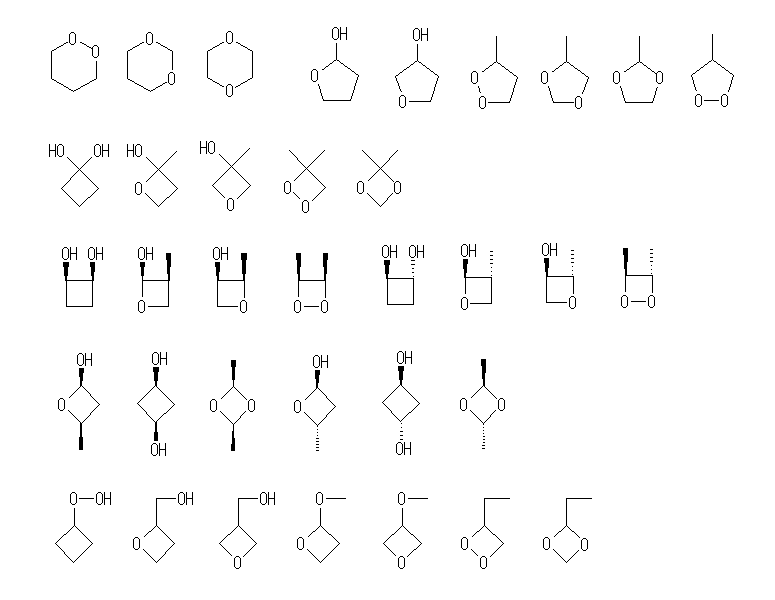
(b) 異性体は159種類(数え間違いあったらごめんなさい)存在する。(二重結合の幾何(シス−トランス)異性体、環の立体配置(シス−トランス)異性体はともに別の構造として数え、光学異性体は区別しないものとする。)
官能基ごとに分類(カッコ内は分類した官能基以外の酸素の形態とする)すると、
カルボニル基を含むもの 17種類
カルボン酸 2種
エステル 4種
ケトン(水酸基) 3種
ケトン(エーテル結合) 1種
アルデヒド(水酸基) 5種
アルデヒド(エーテル結合) 2種
C=Cを含むもの48種類(幾何異性体21種を含めると69種類)
アルケン(水酸基×2) 18+8種
アルケン(エーテル結合+水酸基) 15+6種類
アルケン(エーテル結合×2) 3+1種類
アルケン(−OOR) 4+1種類
アルケン(−OOH) 8+3種類
環状構造のもの56種類(立体配置異性体17種を含めると73種類)
シクロアルカン(水酸基×2) 9+6種 (4員環(3+2)、3員環(6+4))
シクロアルカン(エーテル結合+水酸基) 3+1種
シクロアルカン(−OOR) 1種
シクロアルカン(−OOH) 4+1種
Oを1つ含む環(水酸基) 17+6種 (5員環(2)、4員環(7+3)、3員環(8+3))
Oを1つ含む環(エーテル結合) 6+1種
Oを2つ含む環 16+2種 (6員環(3)、5員環(4)、4員環(6+2)、3員環(3))
なお、(b) のような問題に対して、「すべての場合」を考えるためには、以下のようなアプローチがおそらく有用であろう。
- まず、C6H12 のすべての骨格異性体を挙げる。
- 二重結合もつものすべて(幾何異性体を除いて13種類)を探すため、まず C6H14 のすべての骨格異性体を挙げる。5種類ある。それぞれについて、一箇所の単結合を二重結合に交換する。
- 次に、環の構造をもつものすべて(立体配置異性体を除いて11種類)を探すため、環の構造が6員環、5員環、4員環、3員環の順に調べる。
- 二重結合もつものすべて(幾何異性体を除いて13種類)を探すため、まず C6H14 のすべての骨格異性体を挙げる。5種類ある。それぞれについて、一箇所の単結合を二重結合に交換する。
- 次に24種類のそれぞれの構造について、任意の2箇所の炭素を酸素に交換し、すべての可能性を調べる。
- 最後に121種類のそれぞれの構造について、立体異性体(幾何異性体、立体配置異性体、光学異性体)があるものはどれか、調べる。
3.26
このような問題のように全ての異性体の構造を描かせる場合では、思いついたものから描くのではなく、系統的に探す必要がある。命名時の母体となる(分子内で連続した一番長い)炭素鎖数で分類しながら探すとよい。
(解答例)
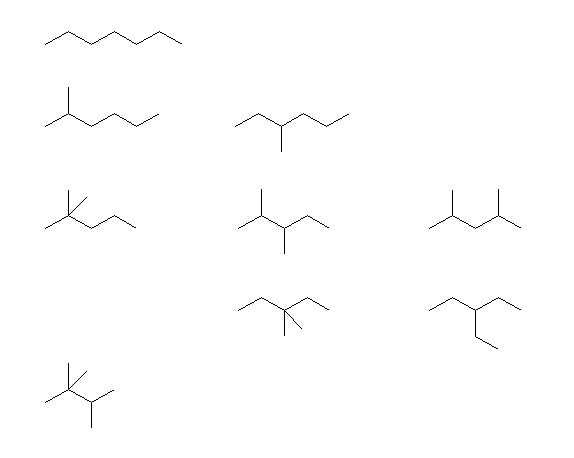
上より順に,
heptane,
2-methylhexane, 3-methylhexane,
2,2-dimethylpentane, 2,3-dimethylpentane, 2,4-dimethylpentane,
3,3-dimethylpentane, 3-ethylpentane,
2,2,3-trimethylbutane
3.27
・回転させたり、裏返したりといった操作で互いに重ね合わせることができるもの
・任意の炭素を中心とした結合の方向を入れ替えて、炭素鎖の曲がり方を変えることで互いに重ねあわせることができるもの
は同じ構造である。
(解答例)
(a) 3つとも同じ構造である。
(b) 左の2つは同じ構造だが、右端は異なる。
(c) 右の2つは同じ構造だが、左端は異なる。
(a) を骨格構造式に直すと、次図のようになる。
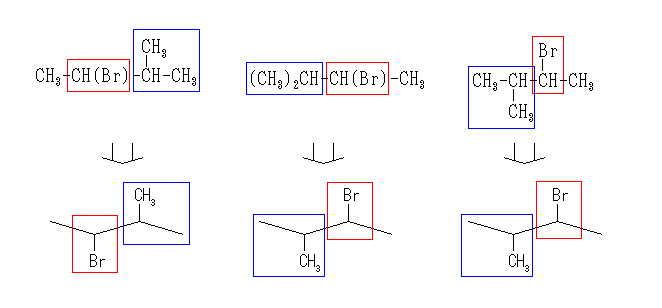
2-bromo-3-methylbutane
(b) 1,2-dihydroxybenzene と 1,3-dihydroxybenzene
(c) を骨格構造式に直すと、次図のようになる。
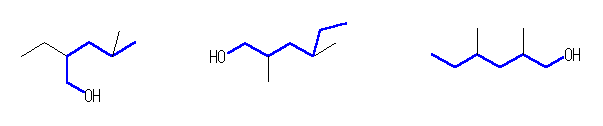
2-ethyl-4-methylpentanol と 2,4-dimethylhexanol
3.28
分子式を満たすような構造をとりあえず一つ書いてみるとよい。同じ分子式を持つ分子同士は、かならず分子内の(多重結合数+環構造の数)が一定になる。
C4H10O は、分子内に二重結合も環構造も全くもたない分子であることがわかる。2本の単結合をもった酸素を含む官能基は、水酸基またはエーテル結合であるから、この分子はアルコールまたはエーテルであると考えられる。
アルコールについては、まず、対応するアルカン、C4H10の構造異性体をすべて描き、それぞれの異性体について、一つの水素を水酸基に置換する、という手順で考えるとよい。
エーテルについては、エーテル結合の左右の炭素の数の小さいものが1である(すなわちメチルエーテル構造=メトキシ基( -O-CH3 )をもつ)もの、2である(すなわちエチルエーテル構造=エトキシ基をもつ)もの、というように順に考えればよい。
メトキシ基( -O-CH3 )をもつ C4H10O をすべて系統だてて探すためには、「 C4H10O 」−「 -O-CH3 」+「 -H 」=「 C3H8 」の構造異性体をすべて描き、それぞれの異性体について、一つの水素をメトキシ基に置換する、という手順で考えるとよい。(この計算式は、C4H10O 分子の中のメトキシ基 -O-CH3 を、水素 -H に置き換えるとどのような分子式になるか、ということに対応している。)
(解答例)
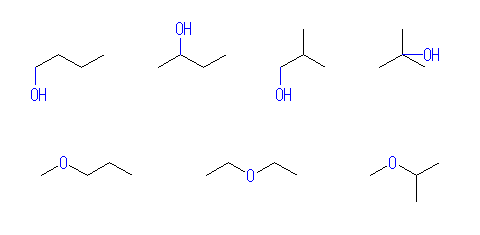
1-butanol, 2-butanol, 2-methyl-1-propanol, 2-methyl-2-propanol,
(n-butyl alohol, sec-butyl alohol, isobutyl alohol, tert-butyl alohol,)
methyl propyl ether, diethyl ether, isopropyl methyl ether
分子式を満たすような構造をとりあえず一つ書いてみなくても, C4H10O が、分子内に二重結合も環構造も全くもたない分子であることは判断できる。すなわち、酸素は2本の結合を持つのだから、形式的には C−H 結合の間に酸素を挿入すれば、水素の数の増減なしに、たとえば アルカン R−H をアルコール R−O−H に変換することができてしまう。つまり、これはある分子式の分子のもつ不飽和度を判断するためには、酸素の数は全く無視して( C4H10O の代わりに C4H10 を用いて)アルカンの一般式にあてはめて考えて構わないことを示す。
3.29
(a) 適当なアルカンを考え、そのうちの一箇所のメチレン(−CH2−)をカルボニルに変えればよい。ただし、末端の炭素の場合はアルデヒドになってしまい、ケトンではないので注意する。
(b) 官能基の表よりアミドの構造を確認し、炭素数が全部で4になるように適宜アルキル基の長さ等を調整する。
ただし、窒素上には任意の数のアルキル基を配しても構わないが、窒素上にアシル基( R-CO- )を2つ持つ場合には、アミドではなくイミドと呼ばれるので注意する。
(c) 官能基の表よりエステル結合の構造を確認し、炭素数が全部で5になるように適宜アルキル基の長さ等を調整する。
ただし、R-CO2- の右側に水素がくると、エステルではなくカルボン酸となるので注意する。
(d) 芳香環からアルデヒド基が直結しているものを指す。分子内に芳香環を持っていても、アルデヒド基との間に脂肪鎖がある場合には脂肪族アルデヒドとして扱われる。
(e) 適当なエステル構造を描き、そのうちの一箇所のメチレン(−CH2−)をカルボニルに変えればよい。ただし、R-CO2-CO-R' の構造となる場合は、酸無水物であるのでケトエステルとは呼ばない。
(f) 適当なアルカンを描き、適当な位置にアミノ基と水酸基を置換する。(ただし、一般的にはそれぞれ異なる炭素上に置換する。)
(解答例)
以下の例のほか、(環状構造や)多重結合を持つものも解である。
(a) 以下の構造より、任意のひとつを答える。
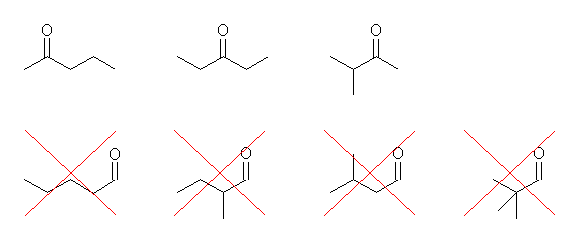
下段は、同じカルボニル基を持つが、ケトンではなくアルデヒド。
(b) 以下の構造より、任意のひとつを答える。
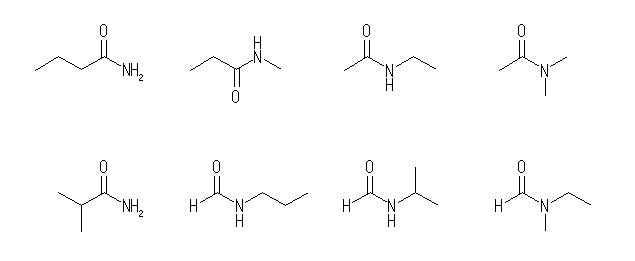
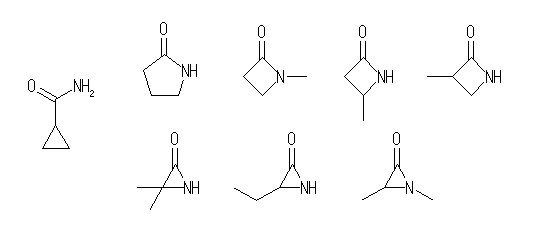
なお、下図(左端以外)のような環状のアミド類は「ラクタム」と呼ばれる。
(c) 以下の構造より、任意のひとつを答える。
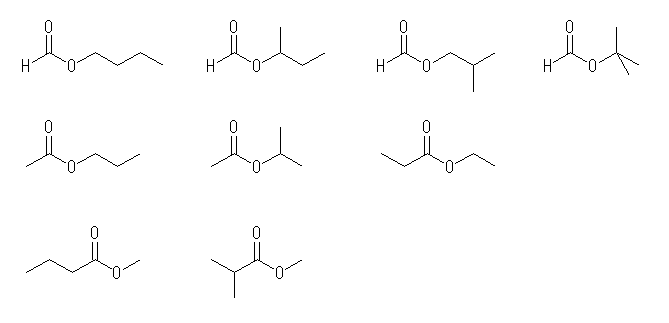
なお、最下図のような環状のエステル類は「ラクトン」と呼ばれる。
(d) 例 benzaldehyde
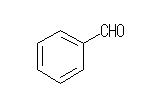
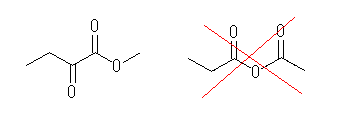
(e) 例 methyl 2-oxobutanate
(f) 例 ethanolamine
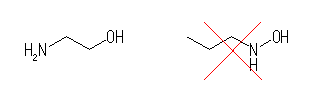
右のような構造(窒素上に水酸基が置換したもの)は、ヒドロキシルアミンである。
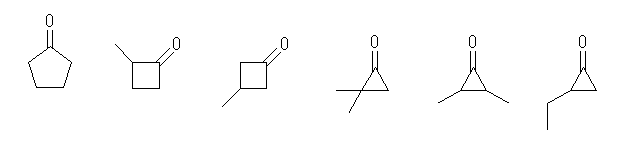
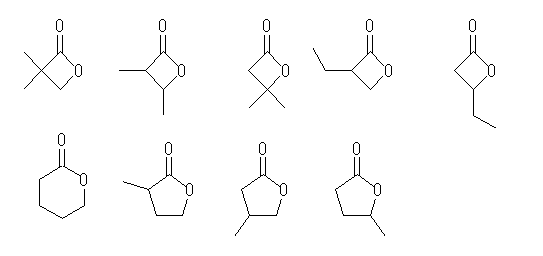
(a) 炭化水素部分が飽和な構造のみを持つものを考えるものとする。
環構造を持たない異性体は、3種類存在する。
この全てを挙げるためには、C5H12 の骨格異性体すべてを考え、任意のメチレン (−CH2−)をカルボニル(−C(=O)−)に変える。
または、カルボニル基を中心におき、その左右に適当なアルキル基をその合計の炭素数が4となるように配す。
環状構造を持つものは、(立体配置異性体は除き、またシクロアルキル基を持つ1種類をふくめて)7種類存在する。
(b) 炭化水素部分が飽和な構造のみを持つものを考えるものとする。
窒素上にアルキル置換基を持たない(すなわち −CONH2 構造を持つもの)異性体は2種類存在し、窒素上にアルキル置換基を持つものでは、(メタンアミド、すなわちホルムアミド類も含めて)さらに6種類が存在する。
(c) 炭化水素部分が飽和な構造のみを持ち、環の構造を持たないもののみを考えるものとする。
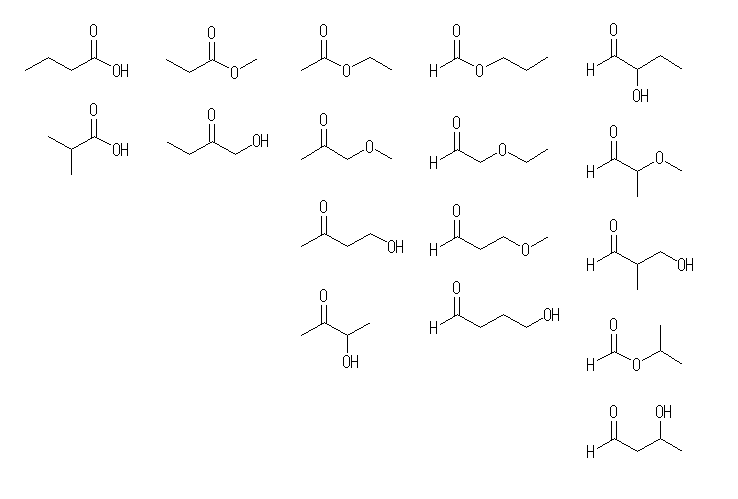
メタン酸(すなわちギ酸)の誘導体も含めると、全部で9種類となる。
なお、環状のエステルは特にラクトンという名称で表されることもある。
3.30
いずれも、下のように考えて構造を書いてみたのち、分子式が与えられたものと同じであるかどうか、確認してみること。水素の数が2個多いのであればどこかに二重結合または環の構造を増やす、などする。
(a) R-CO-R' の与えられた分子式 C4H8O より、ケトン基(カルボニル基、-CO- )を引き算すると、 R-R' に対して C3H8 となり、アルカンの一般式となることより、両アルキル基 R, R' 部分は飽和で、その炭素数の合計は3であることが判る。このような条件を満たす化合物は一通りのみである。
(b) R-CN の与えられた分子式 C5H9N より、シアノ基( -CN )を引き算して水素を足すと、R-H に対して C4H10 となり、アルカンの一般式となることより、アルキル基 R の部分は飽和であることが判る。R-H 、 C4H10 の骨格異性体2種のそれぞれについて、任意の水素をひとつシアノ基に置換する方法で R-CN のすべての異性体を探すことができる。全てで4種類の異性体が存在する。
(c) OHC-R-CHO の与えられた分子式 C4H6O2 より、2つのアルデヒド基(ホルミル基、-CHO )を引き算し、2つの水素を足すと、H-R-H に対してC2H6 となり、アルカンの一般式となることより R の部分は飽和であることが判る。エタン C2H6 の二つの水素をアルデヒド基で置換する方法は、位置の違いにより2種類存在する。
(d) R-Br の与えられた分子式 C6H11Br より、臭素を水素に置換した場合の R-H の分子式は C6H12 であり、アルカンの一般式に比較して水素の数が2個少ない。問題の題意より、これはアルケンである。すなわち、炭素数6のアルケンをすべて描き、さらにそのそれぞれについて、任意の水素をひとつを臭素に置換する方法で R-Br のすべての異性体を探すことができる。
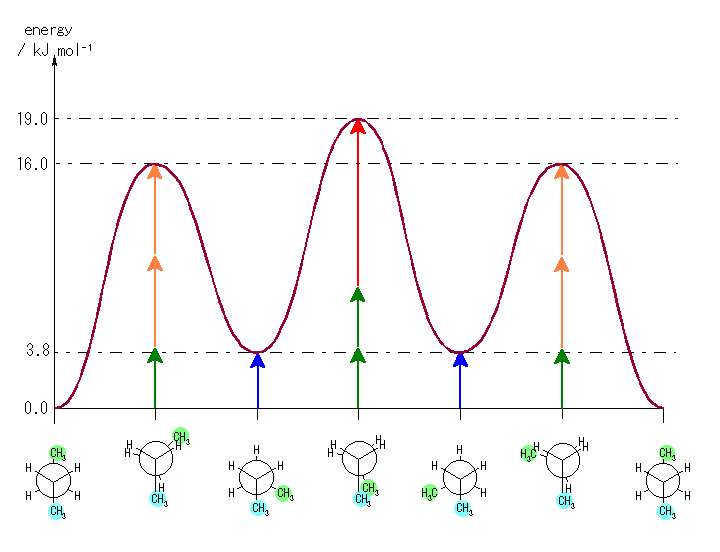
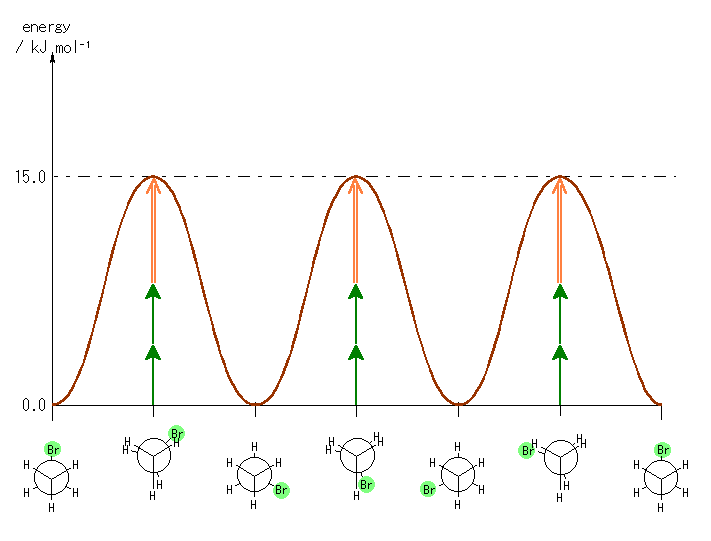
幾何異性体を区別しないものとしてかぞえて、C6H12 のアルケンは13種類存在し、R-Br は 56種類存在する。
(e) 5種類の異性体が存在する。主鎖の炭素数が6のもの、5のもの、…の順に数えるとよい。
(f) 立体配置異性体を数えないものとし、12種類の異性体が存在する。環状の部分の炭素数が6のもの、5のもの、…の順に数えるとよい。
(g) 幾何異性体を数えないものとし、6種類の異性体が考えられる。( C=C=C のような構造をもつ3種類を含む。)
(h) ケトアルケンであるから、分子内にケトン基と炭素炭素二重結合が含まれる。この二つの官能基が隣接して R-C=C-CO-R' となっていても構わないが、隣接している場合は特に、二重結合の位置を特定するために α,β-不飽和ケトンという名称で呼ばれる。R-CO-R' の与えられた分子式 C5H8O より、ケトン基(カルボニル基、-CO- )を引き算すると、 R-R' に対して C4H8 となり、両アルキル基 R, R' 部分の一方のみに二重結合があり、これらの炭素数の合計は4であることが判る。R, R' 部分の炭素数が3+1である場合、2+2である場合、と分けて考えるとよい。すべてで4種類の異性体の可能性が考えられる。
(解答例)
下に示す中より適当な構造を1つ示す。
(a)
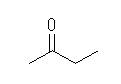
2-butanone
(b)
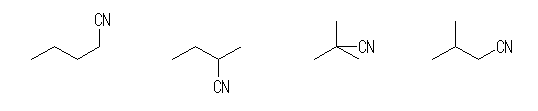
pentanenitrile, 2-methylbutanenitrile, 2,2-dimethylpropanenitrile, 3-methylbutanenitrile
ニトリル類の命名は、教科書778ページ。
(c)
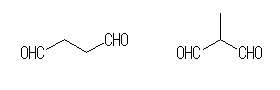
butanedial, 2-methylpropanedial
(d)
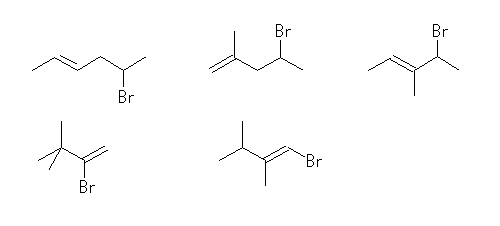
5-bromo-2-hexene, 4-bromo-2-methyl-1-pentene, 5-bromo-3-methyl-2-pentene,
2-bromo-3,3-dimethyl-1-butene, 1-bromo-2,3-dimethyl-1-butene
臭素置換体の母核となる C6H12 の異性体は、C6H14 より派生させた13種類。これらのそれぞれについて、任意の位置の水素を臭素に置換する。対称ではない位置を赤い矢印で示した。
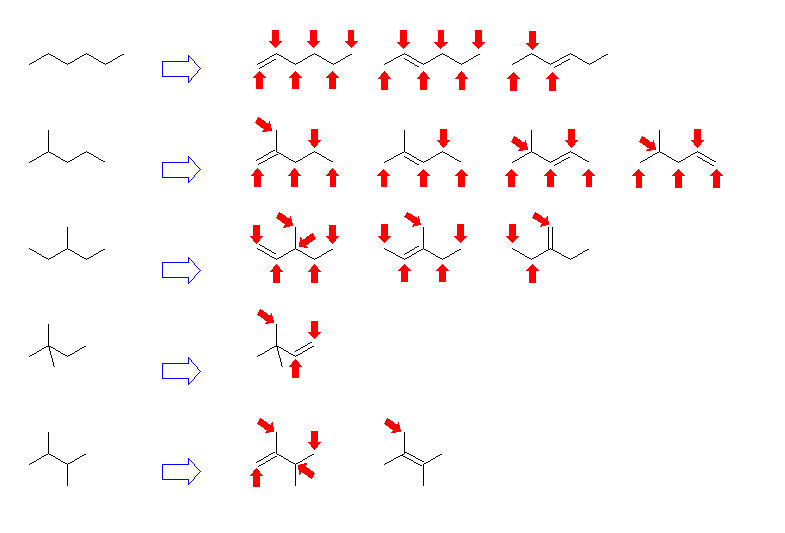
(e)
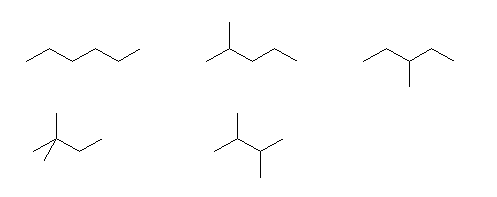
hexane, 2-methylpentane, 3-methylpentane,
2,2-dimethylbutane, 2,3-dimethylbutane
(f)
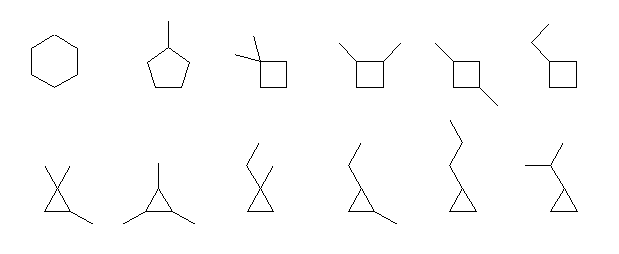
cyclohexane,
methylcyclopentane,
1,1-dimethylcyclobutane,
1,1,2-trimethylcyclopropane,
1,2,3-trimethylcyclopropane,
1-ethyl-1-methylcyclopropane,
1-methylethyl 基は isopropyl 基として命名してもよい。
(g)
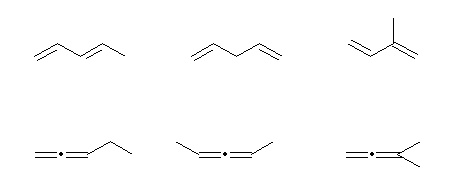
1,3-pentadiene, 1,4-pentadiene, 2-methyl-1,3-butadiene,
1,2-pentadiene, 2,3-pentadiene, 3-methyl-1,2-butadiene
上の段、左端と右端に共通している部分構造( C=C-C=C )は「共役二重結合, conjugated double bond」と呼ばれる。
下の3つに共通している部分構造( C=C=C )は、「集積二重結合, cumulative double bond」と呼ばれ、この構造を持つ化合物を総称して「クムレン, cumulene」と呼ぶ。
最小のクムレンである propadiene, H2C=C=CH2の慣用名である「アレン, allene」を用い、その同族列名として「クムレン」の代わりに「アレン」が用いられることもある。
(h)
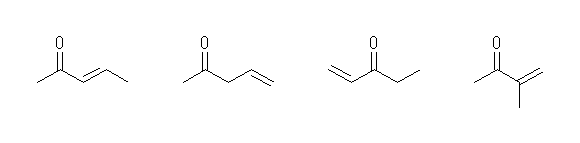
3-penten-2-one, 4-penten-2-one, 1-penten-3-one, 3-methyl-3-buten-2-one
複雑なケトンの命名法は、教科書715ページ。
3.31-3.40
3.31
いずれも、下のように考えて構造を書いてみたのち、分子式が与えられたものと同じであるかどうか、確認してみること。
(a) R-OH の与えられた分子式 C4H10O より、水酸基を水素に置き換えると、 R-H に対して C4H10 となり、アルカンの一般式となる。すなわちこのアルコールは多重結合等を含まない。このアルカンの骨格異性体をすべて探したのち、それぞれについて任意の水素を水酸基で置換する方法で、R-OH のすべての異性体を探すことができる。与えられた条件に対し、4通りのアルコールが存在する。
(b) 与えられた分子式 C5H13N が R-NH2 の構造を持つものと考えて、アミノ基を水素に置き換えると、R-H に対して C5H12 となり、アルカンの一般式となる。すなわちこのアミンは多重結合等を含まない。これは、N上にアルキル基が複数あるような(第2級、または第3級の)アミンでも同様に判定できる。(R-NH を R-NHCH3 に変換するのは、形式上、N-H 結合の間に(CH2)を挿入することであり、アルカンの一般式 CnH(2n+2) の n を1増加させるだけである。)
ところで、この分子式のアミンをすべて見つけるためには以下の2つの考え方がある。
まず、第1級アミン(R-NH2)、第2級アミン(R-NH-R')、第3級アミン(RR'R"N)の順にそれぞれの異性体をすべて探す方法について説明する。
与えられた分子式 C5H13N が第1級アミン R-NH2 の構造を持つものと考えて、アミノ基を水素に置き換えると、R-H に対して C5H12 となる。すなわち、炭素数5のアルカンの骨格異性体をすべて探したのち、それぞれについて任意の水素をアミノ基で置換する方法で、R-NH2 のすべての異性体を探すことができる(8種類)。次に第2級アミンの構造を持つものとする。2つのアルキル基の炭素数が、1+4、2+3 のそれぞれの場合について考えればよい(6種類)。同様に、第3級アミンの構造を持つものとした場合には、3つのアルキル基の炭素数が1+1+3、1+2+2 のそれぞれの場合について考えればよい。
次の考え方として、炭素と窒素を含めた原子の並び方に注目して分ける方法を説明する。
上と同様の考察により、分子内に多重結合がないことが判ったので、炭素数と窒素数をあわせて6だから、まず、炭素数6のアルカンの骨格異性体をすべて探すことにする。これらのアルカンの任意の第1級の炭素を窒素に置き換えると、炭素数5の第1級アミンが得られる。炭素数6のアルカンの任意の第2級の炭素を窒素に置き換えると、炭素数5の第2級アミンが得られる。炭素数6のアルカンの任意の第3級の炭素を窒素に置き換えると、炭素数5の第3級アミンが得られる。第4級の炭素は、窒素には置き換えられない。(窒素は形式電荷を持たない中性原子である場合には、3本しか結合を持たないため。)
慣れてくると後者の方が速く答えに辿り着くかもしれない。この方法を、(a) に適用するには、炭素数5のアルカンの骨格異性体をすべて探したのち、その中の任意の第1級炭素を酸素に置き換えた場合が炭素数4のアルコールのすべての異性体である。また、任意の第2級炭素を酸素に置き換えた場合は同じ炭素数のエーテルのすべての異性体となる。(→ (f) )
(c),(d) アルデヒド、ケトンはともにカルボニル基を持つ物質である。R-CO-R' の与えられた分子式 C5H10O より、カルボニル基、-CO-を引き算すると、 R-R' に対して C4H10 となり、アルカンの一般式となることより、両アルキル基 R, R' 部分は飽和で、その炭素数の合計は4であることが判る。
R および R' に関して、どちらも炭素数が1以上である場合(R と R' の炭素数 1+3 または 2+2)はケトン、どちらか一方が水素の場合(0+4)はアルデヒドである。
また、次のように考えてもよい。炭素数5のアルカン(すなわち C5H12 )のすべての骨格異性体を探しだし、その第1級の炭素をカルボニル基の炭素に置換する( R-CH3 → R-(C=O)H )と、アルデヒドが生じる。また第2級の炭素の炭素をカルボニル基の炭素に置換する( R-CH2-R' → R-(C=O)-R' )と、ケトンが生じる。(いうまでもないが、第3級、第4級の炭素ではこの種の置き換えはできない。)
(e) R-CO2-R' の与えられた分子式 C4H8O2 より、エステル結合部分 -CO2- を引き算すると、R-R' に対して C3H8 となり、アルカンの一般式となることより、両アルキル基 R, R' 部分は飽和で、その炭素数の合計は3であることが判る。ただし、アミンやエーテル、ケトン等で同様の考察をしたときとは異なり、R と R' は等価ではない。また、R の炭素数は0でも良いが、R' の炭素数が0の時は、エステルではなくカルボン酸となることに注意する。すなわち、R と R' の炭素数 0+3 または 1+2 または 2+1 のそれぞれの場合がある。(カルボン酸についても合わせて検討する場合は、3+0 も含める。)
ここで、(b) 〜 (d) の後半部分で解説してきたような、炭素、窒素、酸素の原子の種類を無視した時の並び方に注目する分類の方法も適用できないわけではない。3.25 (b) の「発展」に添って考え、エステルやカルボン酸になりうるものはどれかを見つければよい。
(f) R-O-R' の与えられた分子式 C4H10O より、エーテル結合酸素 -O- を引き算すると、R-R' に対して C4H10 となり、アルカンの一般式となることより、両アルキル基 R, R' 部分は飽和で、その炭素数の合計は4であることが判る。R と R' の炭素数 1+3 または、2+2 について検討すればよい。( 0+4 はアルコールを与える。)
または、(b)のヒントの後半をみよ。
(解答例)
(a) 以下の4通り。
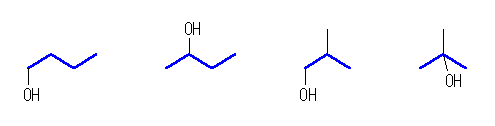
左より、butan-1-ol, butan-2-ol, 2-methylpropan-1-ol, 2-methylpropan-2-ol
(b) 以下の17通り。
1級のアミン
2級のアミン
3級のアミン
ヒントを参照に、以下のように探してもよい。
(a),(f) これらのエーテルとアルコールは官能基異性体である。
(b) のヒント後半のように考えると、次図のようになる。
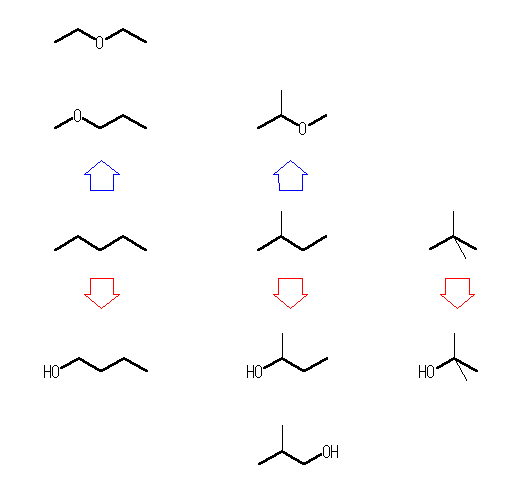
エーテル(青矢印側) 左 diethyl ether, methyl propyl ether, 中 isopropyl methyl ether
アルコール(赤矢印側) 左 butan-1-ol, 中 butan-2-ol, 2-methylpropan-1-ol, 右 2-methylpropan-2-ol
(c),(d) これらのケトンとアルデヒドは官能基異性体である。
ヒント後半のように考えると、次図のようになる。
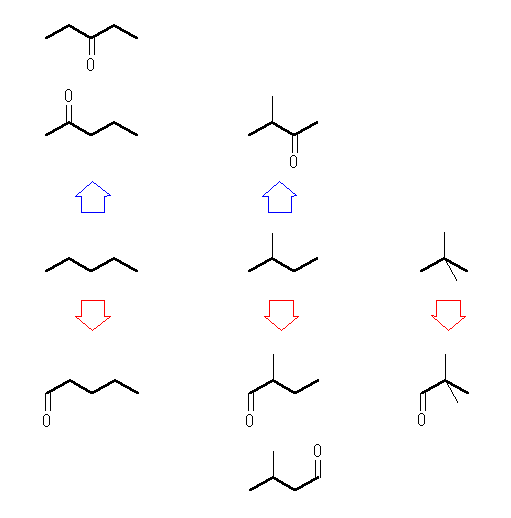
ケトン(青矢印側) 左 pentan-3-one, pentan-2-one, 中 3-methylbutan-2-one
アルデヒド(赤矢印側) 左 pentanal, 中 2-methylbutanal, 3-methylbutanal, 右 2,2-dimethylpropanal
(e) 以下の4通り。
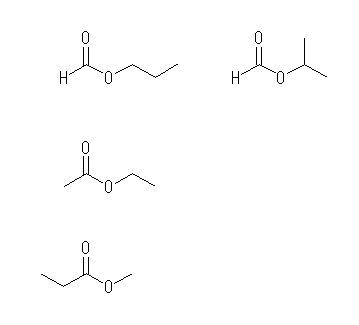
上段 メタン酸(methanoic acid)、慣用名:ギ酸(formic acid)のエステル。左から、propyl formate, isopropyl formate
中段 エタン酸(ethanoic acid)、慣用名:酢酸(acetic acid)のエステル。ethyl acetate
下段 プロパン酸(propanoic acid)、慣用名:プロピオン酸(propionic acid)のエステル。methyl propionate
3.32
(a), (b), (c) それぞれ、第1級、第3級、第2級炭素に水酸基、シアノ基、ハロゲンが結合した分子を描く。これらの置換基は本質的に1本の結合に対して置換するものであり、アミン類における窒素とは異なる。このため、3.31 (b) のヒントにでてきたように、第何級のアミンという表現の場合では、級の使いかたが若干異なるので注意すること。
(d) 「第1級アルコールであり、同時に第2級アルコールである」ような分子は、最低でも2つ以上の水酸基を持たなければならない。
(e) イソプロピル基(分枝アルキル基の一つの慣用名)の構造については、教科書の87ページを参照すること。3.10 (b) も参考にせよ。もちろんこちらの問いでは、アルカンでなく他の官能基を併せ持っていても良い。とはいえ、イソプロピル基の構造の上に更によけいな置換基を付けた場合には「イソプロピル基」ではなくなるので注意すること。
(f) 3.8 などを参照せよ。
(解答例)
(a) 水酸基が、第1級炭素に結合しているようなもの。
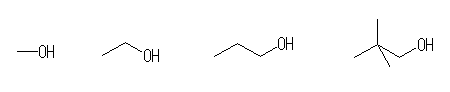
methanol, ethanol, propanol, 2,2-dimethyl-1-propanol
(b) シアノ基が、第3級炭素に結合しているようなもの。
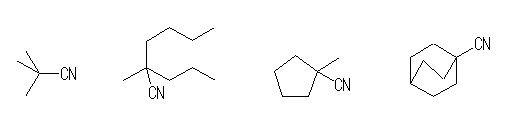
2,2-dimethylpropanenitrile, 2-methyl-2-propylhexanenitrile,
(c) 臭素が、第2級炭素に結合しているようなもの。
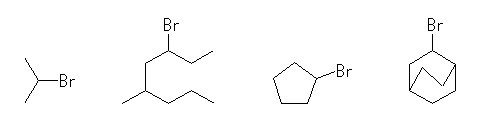
2-bromopropane, 3-bromo-5-methyloctane, bromocyclpentane, 2-bromobicyclo[2.2.2]octane
(d) 2つ(以上)の水酸基があり、それぞれ第1級および第2級炭素に結合しているようなもの。
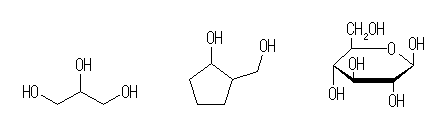
1,2,3-propanetriol (glycerol), 2-hydroxymethyl-1-cyclopentanol, glucose
(e) 化合物中の名称中にイソプロピル基が含まれるためには、以下の条件を満たす必要がある。イソプロピル基(炭素数3)が、それと炭素数が同じか、それより大きい炭素数のシクロアルカンに結合したもの。または、芳香環などに結合したもの。アミンの窒素上にイソプロピル基がある場合もありうる。
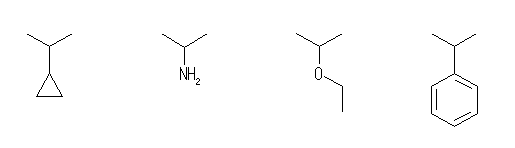
isopropylcyclopropane,
isopropylamine,
ethyl isopropyl ether,
isopropylbenzene
アルカンの一部としてイソプロピル基の構造を持つ場合は、主鎖の選び方により名称中にイソプロピル基が含まれない場合も生じるので、命名規則を参照すること。
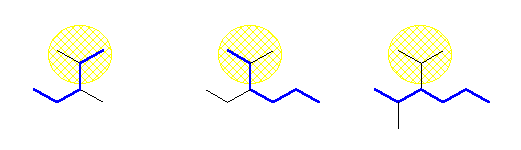
2,3-dimethylpentane,
3-ethyl-2-methylhexane,
3-isopropyl-2-methylhexane
(f) 第4級炭素を1つ以上含むもの。
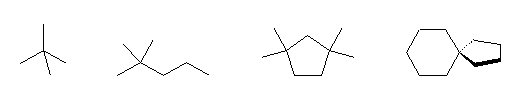
2,2-dimethylpropane,
2,2-dimethylpentane,
3.33
もし母核を n-C5H12 の骨格異性体も含むものとするならば、更に5種類の異性体が存在する。
(解答例)
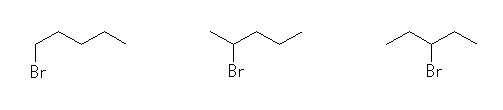
1-bromopentane,
2-bromopentane,
3-bromopentane
これ以外の C5H11Br
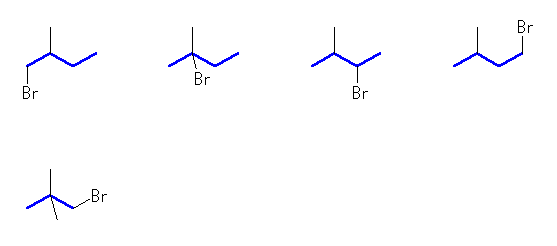
1-bromo-2-methylbutane,
2-bromo-2-methylbutane,
2-bromo-3-methylbutane,
1-bromo-3-methylbutane,
1-bromo-2,2-dimethylpropane
3.34
(解答例)
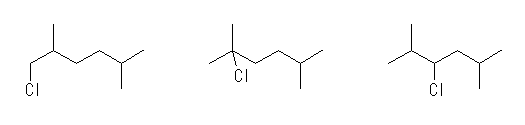
1-chloro-2,5-dimethylhexane,
2-chloro-2,5-dimethylhexane,
3-chloro-2,5-dimethylhexane
3.35
この問いで与えられているのは、官能基ではなく、ある官能基をもつ化合物の一般名である。
ケトン基(もしくは両側にアルキル基の結合したカルボニル基)を持つものがケトンであり、シアノ基を持つものがニトリル、そして、カルボキシ基を持つものがカルボン酸である。
(解答例)
(a) sp2 (b) sp (c) sp2
3.36
(解答例)
(a) C8H16 ; isopropylcyclopentane (b) C10H16 ; 1,2,3,4,5,6,7,8-octahydronaphthalene, or dehydrodecaline, or bicyclo[4.4.0]dec-1(6)-ene (c) C13H16O ; cyclohexyl phenyl ketone
3.37
(解答例)
(a) 炭素数8で、不飽和度(二重結合または環構造の数の和)が1のものはすべて C8H16 の分子式を持ち、3-36(a) の異性体である。
(例)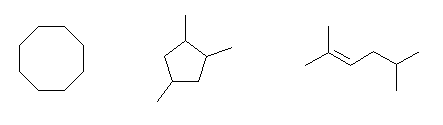
cyclooctane,
1,2,4-trimethylcyclopentane
2,5-dimethyl-2-hexene
(b) 炭素数10で、不飽和度3のものはすべて C10H16 の分子式を持ち、3-36(b) の異性体である。(なお、左端が二重結合の位置異性体、右二つは骨格異性体となる。)
(例)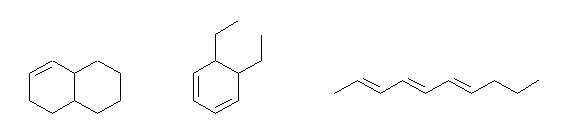
1,2,3,4,4a,5,6,8a-octahydronaphthalene, or bicyclo[4.4.0]dec-2-ene,
5,6-diethyl-1,3-cyclohexadiene
2,4,6-decatriene
(c) 不飽和度は6。アルデヒド、ケトン、アルコールのそれぞれが考えられる。
(例)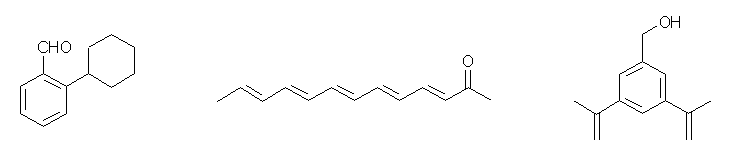
2-cyclohexylbenzaldehyde
3,5,7,9,11-tridecapentaene-2-one
(3,5-diisopropenylphenyl)methanol
3.38
(a) 与えられた分子式、条件文に合致する構造異性体は全部で5種類存在する。その中で「ビアセチル」の名称に相当するものは唯1つである。「ビ」は倍数接頭語であり、「アセチル acetyl 」は、酢酸( acetic acid )から派生したある部分構造に対する名称である。これより類推せよ。
(b) この分子式と「多重結合をもたない」という条件文より、該当する構造は唯一つに決めることができる。(発展)の項も参照のこと。
(c) 与えられた分子式および条件文より、該当する構造は唯一つに決めることができる。
(解答例)
(a) 環や炭素−炭素多重結合を持たないのだから、炭素−酸素二重結合が分子内に2つある。このような条件に合うのは、次の5種の構造。
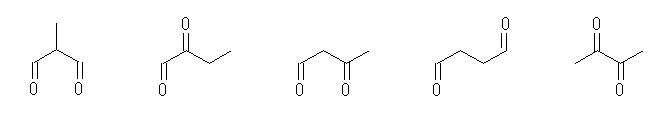
2-methylpropanedial,
2-oxobutanal,
3-oxobutanal,
butanedial,
2,3-butanedione
このうち、「ビアセチル, biacetyl」(慣用名)は、右端の構造である。
酢酸(acetic acid)から誘導される置換基として、アセチル基 CH3C(=O)- があるが、これが2つ向かいあって付いた構造を持っていることが名称の由来である。
(b) 分子式より不飽和度は1。多重結合がないのだから、環構造を1つ持つことが判る。多価の元素は、炭素と窒素で併せて3つだから3員環である。
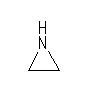
(c) 与えられた分子式より、不飽和度は0。分子内に多重結合や環構造は持たない。また、それぞれの炭素に対し水酸基があるということから、3つの酸素はすべて水酸基を構成し、エーテル結合も持たない。このため、プロパンを母体とした次の構造であることが判る。
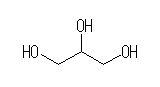
(b) -NH2 はアミノ基で、これを持つ化合物はアミンである。炭素−窒素間が二重結合となった=NH はイミノ基で、これを持つ化合物はイミンである。また、異なる2つの炭素を架橋する -NH- も、イミノ( imino )またはエピイミノ( epimino )で命名してもよい。
3.39
(解答例)
(a) 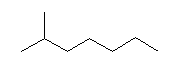 (b)
(b) 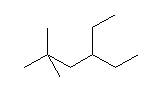 (c)
(c) 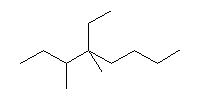 (d)
(d) 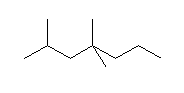 (e)
(e) 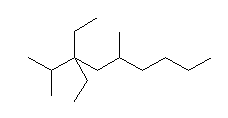 (f)
(f) 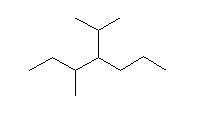
3.40
(解答例)
数例のみを示す。
(a) 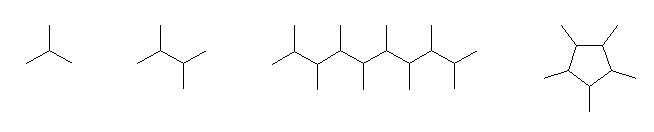
2-methylpropane,
2,3-dimethylbutane,
2,3,4,5,6,7,8,9-octamethyldecane,
1,2,3,4,5-pentamethylcyclopentane
(b) 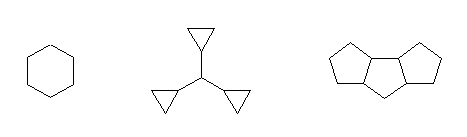
cyclohexane,
tricyclopropylmethane,
tricyclo[6.3.0.02,6]undecane
(c) 
cyclobutane,
spirobicyclopropane,
hexane,
1,3-dimethylcyclohexane
3.41-3.50
3.41
教科書83ページの脚註にもあるように、水素に対して第1級、第2級、第3級といった分類をすることはあまり一般的ではない。
(解答例)
(a) 第1級水素を持たないためには、第1級炭素を持たないか、第1級炭素上を何かで完全に置換しておけばよい。
cyclohexane,
1,1,1,3,3,3-hexabromo-2-(tribromomethyl)propane,
hexanedioic acid (adipic acid)
(b) 第1級水素と第3級水素しか持たないので、骨格を構成するのは、第1級、第2級および(もともと水素を持たない)第4級炭素からなる。
2-methylpropane,
2,2,3,4,4-pentamethylpentane,
1,1,2,3,3,4-hexamethylcyclobutane
3.42
(e) では、「同じ官能基」を通常通りにホルミル基(アルデヒド基)と考えると、該当する解は存在しない。官能基としてカルボニル基を考える(すなわち、アルデヒド基とケトン基を区別しない)場合のみ解があり得る。
(解答例)
複数の異性体を持つものは、数例のみ示した。互いに異性体であるためには、炭素数をはじめとして、分子式が同じデアル必要があるので注意すること。
(a) ハロゲンを官能基として持つハロアルカンについて考える。位置異性体としては、次の3つ。
1-bromo-2-methylbutane,
2-bromo-2-methylbutane,
2-bromo-3-methylbutane
その他の骨格異性体が多種あり。
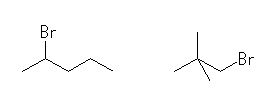
2-bromopentane,
1-bromo-2,2-dimethylpropane
(b) エーテル結合を持つシクロアルカンを考える。
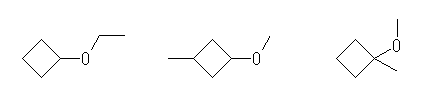
ethoxycyclobutane,
1-methoxy-3-methylcyclobutane,
1-methoxy-1-methylcyclobutane
(c) シアノ基の位置異性体は、次の1種のみが存在する。
2-methylpropanenitrile
(d) 水酸基を持つシクロアルカンを考える。
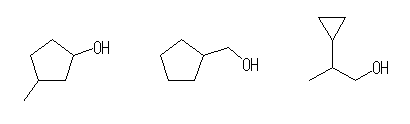
3-methylcyclopentanol,
cyclopentylmethanol,
2-cyclopropyl-1-propanol
(e) カルボニル基の位置異性体は次の通り。ただし、アルデヒド基とケトン基を区別する場合には、これらは同じ官能基を持つとは言えない。
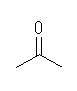
2-propanone (acetone)
(f) フェニル基(芳香環)を持つカルボン酸は、次の3種が考えられる。(これらは互いにメチル基の位置異性体である。)
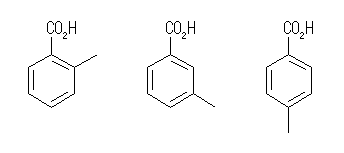
2-methylbenzoic acid (o-toluic acid),
3-methylbenzoic acid,
4-methylbenzoic acid
3.43
(解答例)
シクロアルカンの置換基の立体配置を示すためには、シクロアルカンを構成する炭素をすべて紙面の上におき、置換基を「くさび型の結合」を用いて表す方法と、シクロアルカンを構成する炭素を紙面に垂直な面内におき、置換基を「上」と「下」に示す方法とがある。
(a) 破線の左右は、対掌体(光学異性体)である。
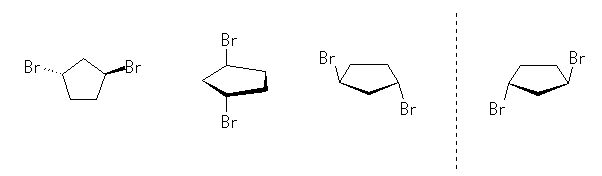
(b) 光学異性体は存在しない。
(c) 破線の左右は、対掌体(光学異性体)である。
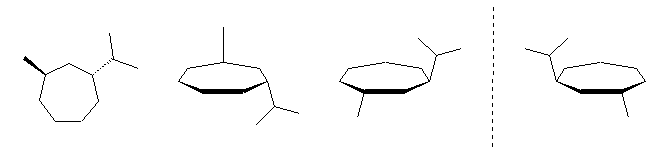
(d)
3.44
(解答例)
次の色分けで示した。第1級(黄)、第2級(緑)、第3級(青)、第4級(赤)。
(a)  (b)
(b)  (c)
(c) 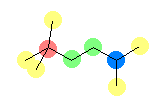 (d)
(d)  (e)
(e)  (f)
(f) 
3.45
(3.46 の問いにはあきらかに (a) 〜 (g) は不要であるから、おそらく、教科書の印刷の時点で、1行ずれているのだろう。「つぎの」とは、3.46 の問題文の後にある (a) 〜 (g) のこととして問題を解くこと。)
アルカンの命名法は、教科書 pp 84-87 を参照すること。
(解答例)
(a) 2-methylpentane (b) 2,2-dimethylbutane (c) 2,3,3-trimethylhexane (d) 5-ethyl-2-methylheptane (e) 3,3,5-trimethyloctane (f) 2,2,3,3-tetramethylhexane (g) 5-ethyl-3,5-dimethyloctane
3.46
(解答例)
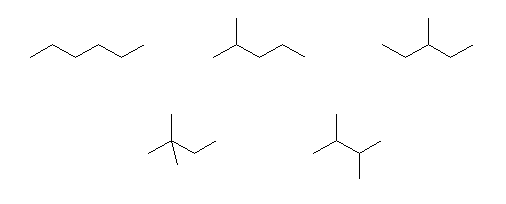
n-hexane,
2-methylpentane,
3-methylpentane,
2,2-dimethylbutane,
2,3-dimethylbutane
3.47
(a), (b), (e) は、主鎖の選び方に間違いがある。
(c), (d), (f) は、番号のつけ方に間違いがある。
(解答例)
与えられた名前に添った構造(主鎖を水平に描き、左端から番号をとった位置に置換基を置いた)と、その化合物の正しい名称(正しい主鎖は青線で示した)を記す。
(a) 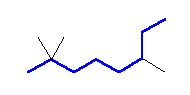
2,2,6-trimethyloctane
(b) 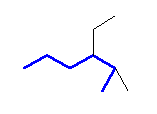
3-ethyl-2-methylhexane
(c) 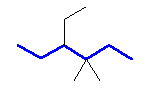
4-ethyl-3,3-dimethylhexane
(d) 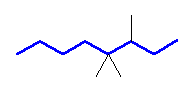
3,4,4-trimethyloctane
(e) 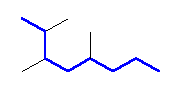
2,3,5-trimethyloctane
(f) 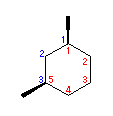
cis-1,3-dimethylcyclohexane
3.48
(解答例)
数例のみ示す。
(a) 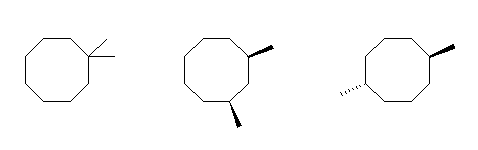
1,1-dimethylcyclooctane,
cis-1,3-dimethylcyclooctane,
trans-1,5-dimethylcyclooctane
(b) 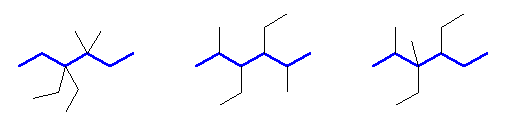
3,3-diethyl-4,4-dimethylhexane,
3,4-diethyl-2,5-dimethylhexane,
3,4-diethyl-2,3-dimethylhexane
エチル基は、3位または4位のいずれかでないと、主鎖がヘキサンではなくなってしまう。
(c) 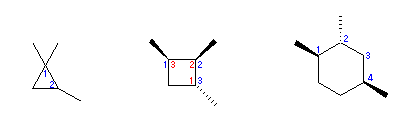
1,1,2-trimethylcyclopropane,
1,c-2,t-3-trimethylcyclobutane,
r-1,t-2,c-4-trimethylcyclohexane
立体配置を考慮しないと環の炭素の番号が決まらない場合は、cis の番号を優先する(上記中央の例)。問い 3.18 の発展の項を参照のこと。
(d) 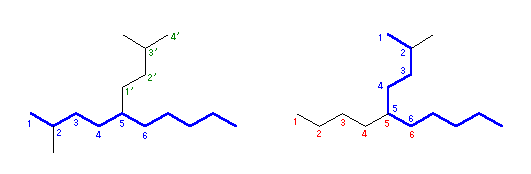
(左) 2-methyl-5-(3-methylbutyl)decane
右のような構造では、炭素鎖が同じ長さの時は分岐が多くなるように主鎖をとるから、5-butyl-2-methyldecane となる。
3.49
(解答例)
(a) methylcycloheptane (b) cis-1,3-dimethylcyclopentane (c) trans-1,2-dimethylcyclohexane (d) trans-1-isopropyl-2-methylcyclobutane (e) 1,1,4-trimethylcyclohexane
3.50
(解答例)
| 赤−青 | トランス配置 |
| 赤−緑 | シス配置 |
| 赤−黒 | トランス配置 |
| 青−緑 | トランス配置 |
| 青−黒 | シス配置 |
| 緑−黒 | トランス配置 |
3.51-3.61
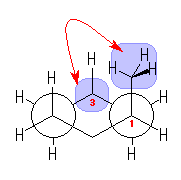
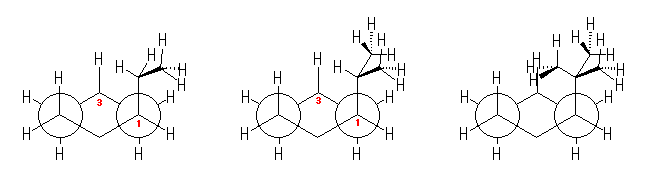
3.51
なお、環の上下全体をひっくり返すと重なる構造もあるので、重複して数えないように注意すること。
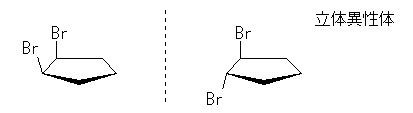
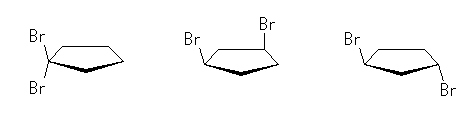
(解答例)
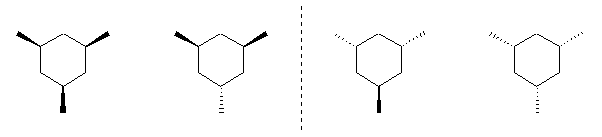
2つ。
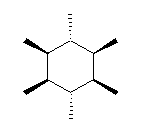
シクロヘキサン環を120度回転させると、1位、3位、5位は互いに重なる位置にあり、すべて同じメチル基がついているから、立体配置異性体については、環の構成炭素がなす平均的な平面よりも上方に置換したメチル基の数に注目して3個、2個、1個、0個と分類すると、下図のようになる。ここで、面の上方、下方には絶対的な区別はないから、破線の左の2つと、破線の右の二つは互いに区別されない。(環の上下をひっくり返すと重なる。)
3.52
原子の並び順が異なるものは、すべて構造異性体である。すなわち、結合の切断と新たな結合の生成という操作を経ないと互いに同一にならないものである。構造異性体の中には、骨格の構造の異なるもの(骨格異性体)、アルデヒドとケトン、アルコールとエーテルのように官能基の種類の異なるもの(官能基異性体)、官能基や置換基の種類や数は同じでもその位置の異なるもの(位置異性体)がある。
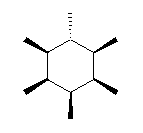
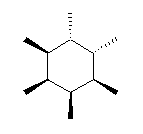
立体異性体は、二重結合の軸の周りの回転をすれば互いに重ねあわせることができるもの(シス−トランス異性体:幾何異性体)、環についている置換基の上下の配置を入れ替えれば互いに重ねあわせることができるもの(シス−トランス異性体:立体配置異性体)、「右手」と「左手」のように、鏡に映した構造と重ねあわせることができるもの(光学異性体:対掌体ということもある。「掌」は手のひらの意味)などがある。
(解答例)
(a) 構造異性体。
シスとトランスの差があるが、そもそも臭素の置換している位置が異なっているので、立体異性体ではなく、位置異性体である。位置異性体は、構造異性体のうちのひとつ。
(cis-1,3-dibromocyclohexane の立体異性体は、trans-1,3-dibromocyclohexane である。)
(b) 構造異性体。
2,5,5-trimethylpentane は、IUPAC 命名法に従えば 2,5-dimethylhexane である。したがって、2,3-dimethylhexane とは、メチル基の位置異性体である。あるいは、互いに骨格異性体である。位置異性体も骨格異性体も、構造異性体のうちのひとつ。
(c) 同一化合物。
cis-1,3-dichlorocyclopentane
単結合の軸の周りの回転により異なる空間配置を持っている分子同士を、配座異性体(立体異性体のうちのひとつ)として互いに区別することがある。(4章を参照。)しかし、室温では、配座異性体は互いに入れ替わってしまうため、分けて考える必要がない場合も多い。
3.53
(解答例)
1,2-dibromocyclopentane
の構造異性体のうち、位置異性体は以下の3つ。
1,1-bibromocyclopentane,
cis-1,3-bibromocyclopentane,
trans-1,3-bibromocyclopentane
また、骨格異性体には、シクロアルカンの構造を持つものと、二重結合をもつアルケンがあり得る。そのうちに2例を以下に示す。
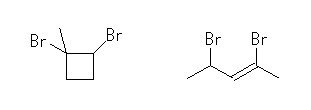
1,2-bibromo-1-methylcyclobutane,
2,4-dibromo-2-pentene
3.54
(解答例)
cis-1,3-dimethylcyclobutane
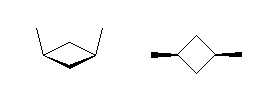
(左右とも同じ構造を表す。)
3.55
(解答例)
一番下に示した構造図のうち、2 〜 4 の3つがこたえ。( 2 の代わりに 2' などでも良い。)
3つの置換基の間にある2つ*のシス、トランスの立体配置の組み合わせが異なる4種が互いに立体配置異性体である。これらをすべて書き出すためには、シクロヘキサン環上の一つの置換基を固定して考え、残りの2つの置換基の立体配置(シスまたはトランス)を入れ替えた組をつくるとよい。
註*:3つ置換基があれば、置換基どうしの関係は3箇所存在するが、2つが決まれば残りの1つは自動的に決まる。
ここでは、1位にあるイソプロピル基を固定することにする。(他の2つのどちらかを固定してもよい。)
一番下にしめした構造図のうち、青破線より上の段の4つ。
| 1-isopropyl 基 | 2-hydoroxyl 基 | 4-methyl 基 | |
| menthol 1 | 下 | 上 | 上 |
| − | trans | trans | |
| 2 | 下 | 上 | 下 |
| − | trans | cis | |
| 3 | 下 | 下 | 上 |
| − | cis | trans | |
| 4 | 下 | 下 | 下 |
| − | cis | cis |
なお、シス、トランスの関係は同じままで(すなわち同じ立体配置異性体であるが)、空間的に重ね合わせることのできない光学異性体(鏡像異性体、対掌体)が存在する。下の構造図の青破線をはさんだ関係。
| 1-isopropyl 基 | 2-hydoroxyl 基 | 4-methyl 基 | |
| 1' | 上 | 下 | 下 |
| − | trans | trans | |
| 2' | 上 | 下 | 上 |
| − | trans | cis | |
| 3' | 上 | 上 | 下 |
| − | cis | trans | |
| 4' | 上 | 上 | 上 |
| − | cis | cis |
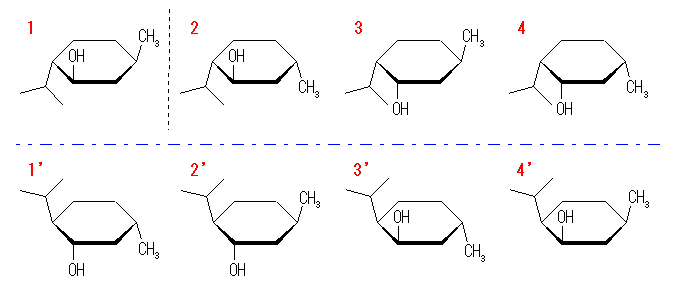
IUPAC 名は、青破線の上下とも、左より
t-2-hydroxy-r-1-isopropyl-t-4-methylcyclohexane, t-2-hydroxy-r-1-isopropyl-c-4-methylcyclohexane, c-2-hydroxy-r-1-isopropyl-t-4-methylcyclohexane, c-2-hydroxy-r-1-isopropyl-c-4-methylcyclohexane
(発展)また、ここで描かれた4種類の立体配置異性体のそれぞれに対して、3.52 (c) や 3.60 のような光学異性体が存在する。このため、メントールの「立体異性体」は全部で8種類存在する(解答例中の解説参照)。
メントールの3次元模型
3.56
(b) 水酸基の付け根の炭素が2級であるようなアルコールとして考える。ただし、注目している炭素についているアルキル基のみならずカルボキシ基も数えることにする。
(解答例)
(a) ヒントを参照のこと。C2H6O 骨格は青で示した。
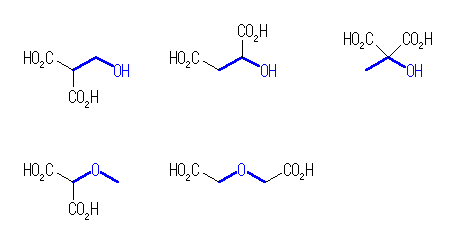
炭酸エステルの構造(
 )を持つ以下の2つを挙げてもよい。
)を持つ以下の2つを挙げてもよい。
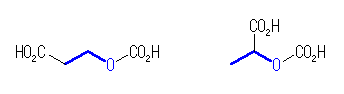
(b) 上図のうち、上段、中央の構造。( 2-hydroxybutanedioic acid )
3.57
(解答例)
この結果生じると期待されるような、2つの環が一つの炭素を共有しているようなものは、スピロ炭化水素と呼ばれることがある。
"スピロ結合"とは、2つの環が1個の炭素を共有するとき、その原子による連結をいう。この2環による共有原子を "スピロ原子" と呼ばれる。
スピロ炭素は sp3 混成をしており、スピロ結合した2つの環は互いに直交している構造を持つ。
スピロビシクロプロパンの3次元模型
(環式化合物で、炭素数が同数の非環式直鎖炭化水素の名称に cyclo- をつけたのと同様に)2つの脂環式環の monospiro 化合物は、炭素数が同数の非環式直鎖炭化水素の名称に spiro- をつける。このとき、各環のスピロ原子と連結する炭素の数を小さい順にピリオドでつなぎ、 [ ] で括って、spiro と炭化水素名との間に書く。
従って、この問いで生じる化合物の名称は、 spiro[2.2]pentane である。
または、 spirobicyclopropane としてもよい。
なお、単に bicyclopropane とした場合は、次のような「スピロ炭素をもたない」化合物となる。
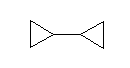
1,1'-bicyclopropyl or 1,1'-bicyclopropane
(cf. 3-38)「ビアセチル ( biacetyl ) と同様の命名法である。同じ環式炭化水素2つからなる環集合は、対応する環式炭化水素名(e.g. cyclopropane)、またはその環式炭化水素の基名(e.g. cyclopropyl)に、bi- をつける。番号は、対応する基または炭化水素と同様につけ、一方の環にはプライム(「 ' 」のこと。よくダッシュといわれるやつ。)をつける。直結点の原子の位置番号(上の名称での「1,1'-」のこと)は、名称の前にいれる。
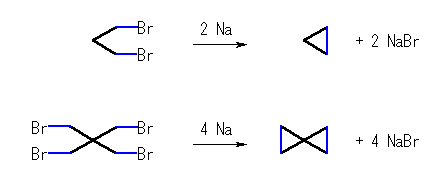
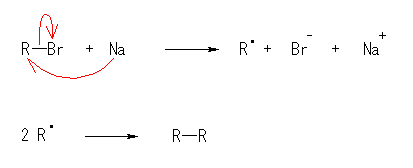
反応には、形式的に金属ナトリウムからの電子移動を含む。その結果、ナトリウム陽イオンと臭化物イオンが生じる。ハロアルカンから生じたラジカル種(不対電子を持つ)は、速やかに二量化して、炭素炭素結合を生じる。下図参照。ここで、いままで曲がった矢印で電子対の動きを表したが、矢尻が片方しかない曲がった矢印で1つだけの電子の移動を表している。
3.58
(解答例)
1,3,5-trioxacyclohexane
だけが、与えられた条件を満たす化合物である。
まず、分子式より、分子内には二重結合または環の構造が1つだけある。カルボニル基は持たないので、二重結合があるとすれば、それは炭素−炭素二重結合であるが、このような場合、すべての水素が等価になるような対称性の高い構造を描くことができない。
もし、カルボニル基を持っても良いのであれば、次のような構造において、すべての水素が等価となる。
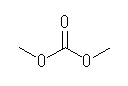
dimethyl carbonate, 炭酸ジメチル
環の構造を持つもので、対称性の高いものには、1,2,3-cyclohexanetriol のような構造も考えられるが、水酸基水素と炭素の水素が区別され等価ではない。
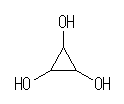
1,2,3-cyclohexanetriol
炭素原子の酸化数に注目することも、このような問題を解く上で役立つ。酸化数とは、炭素原子に結合している陰性原子(酸素、窒素、ハロゲン)の数であり、すなわちアルコールやモノハロゲン化アルキルの水酸基やハロゲンの結合した炭素においては1、アルデヒドやケトンのカルボニル基炭素においては2、カルボン酸やエステル、酸アミド、シアノ基などの炭素においては3である。
ホルムアルデヒド H2C=O の炭素においては、酸化数2であるが、解答例に示した 1,3,5-trioxacyclohexane についても、すべての炭素の酸化数が2である。
これに対し、炭酸ジメチルにおいては、エステル中心の炭素は酸化数が4、メチル基の炭素の酸化数は1である。また、1,2,3-cyclohexanetriol においてはすべての炭素の酸化数が1である。
3 H2C=O ←→ トリオキサン
の三量化平衡においては、炭素の酸化数は変化しない。炭素の酸化数が変化するためには、一般に酸化還元を伴う反応が必要である。
3.59
(解答例)
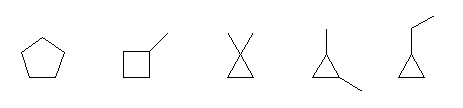
cyclopentane,
1-methylcyclobutane,
1,1-dimethylcyclopropane,
1,2-dimethylcyclopropane,
1-ethylcyclopropane
1,2-dimethylcyclopropane には、シス、トランスの立体配置異性体が存在する。
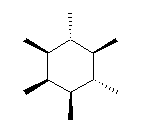
3.60
実際に3次元模型を表示して、グリグリ動かしてみて、重ね合わせることが可能かどうかやってみよう。
左の trans-1,2-dimethylcyclopentane の3次元模型
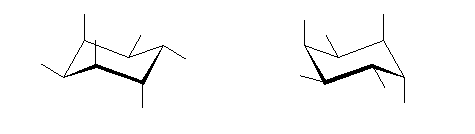
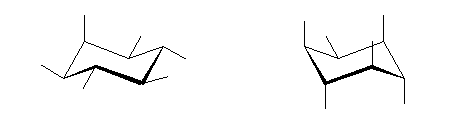
右の trans-1,2-dimethylcyclopentane の3次元模型
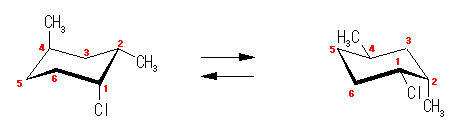
(解答例)
これら2つの構造は、空間内の平行移動や分子全体の回転の操作のみで互いに重ねあわせることができず、右手と左手のような関係にある。このようなものは互いに光学異性体(鏡像異性体、対掌体)であるという。
3.61
(解答例)
1) 結合角歪みによる説明: シクロヘキサンの構成炭素を同一平面内においた正六角形の構造であるとすると、C-C-C 結合角は120度になってしまい、sp3 混成から予想される109.5度よりも大きい。教科書の図に与えられた左の構造のように、炭素原子が平面の上下に逃げることにより結合角が小さくなることができる。そのため、同一平面にあるよりも、折れ曲がった構造の方が安定である。
2) この折れ曲がりは、C-C 単結合の軸のまわりの回転によって実現される。このような空間的な原子の配置のことを、立体配座という。立体配座は、室温付近では分子のもつエネルギーによりお互いに入れ替わることができるものが多い。(教科書4章、106ページ)
3) シクロヘキサンの、この図に与えられた左の構造は、「いす型配座」と名付けられており、一番重要な寄与をしている。
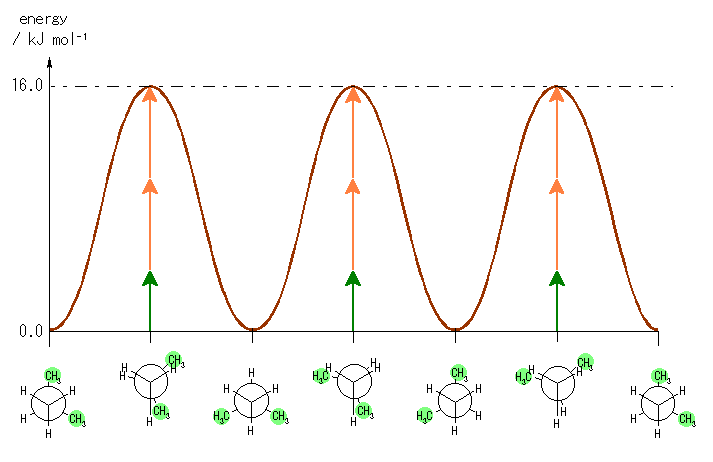
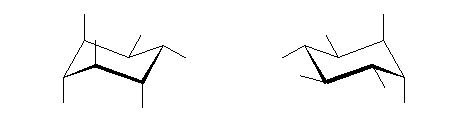
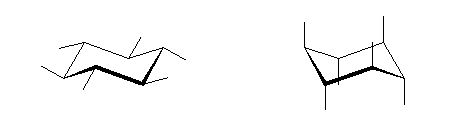
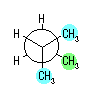
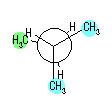
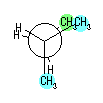
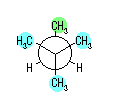
4) 教科書 §4.8 および、§4.9 で扱うように、シクロヘキサンの立体配座の中で、いす型配座では、すべての隣りあった2つの炭素原子において、結合した水素が互いに一番はなれた構造(ねじれ型配座)となっているために安定である。
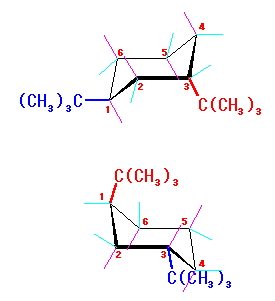
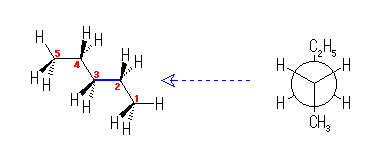
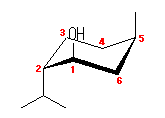
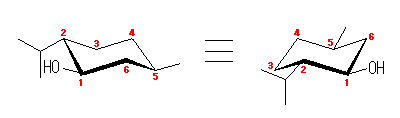
 左が最も安定な配座、右が最も不安定な配座(の中のひとつ。)
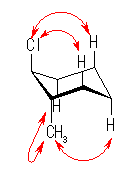
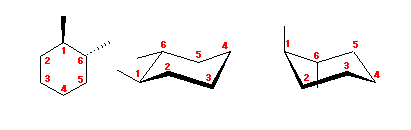
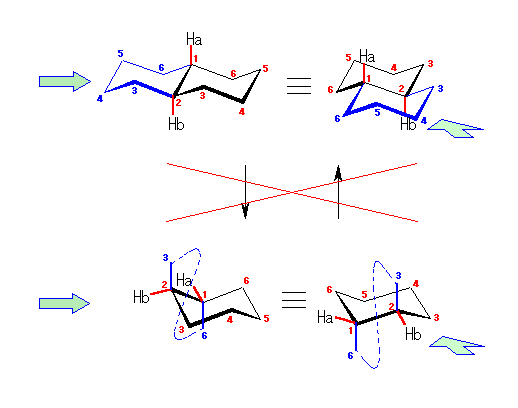
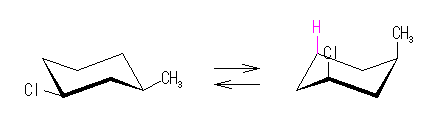
左が最も安定な配座、右が最も不安定な配座(の中のひとつ。)
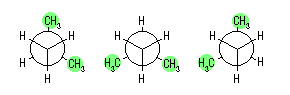
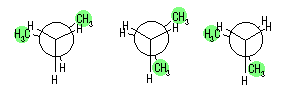
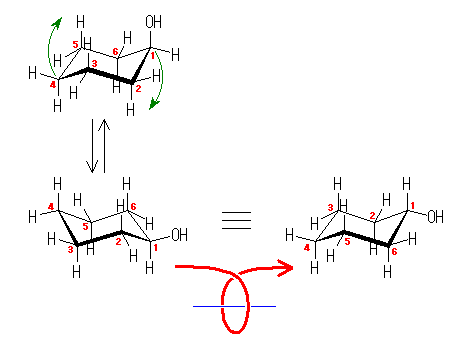
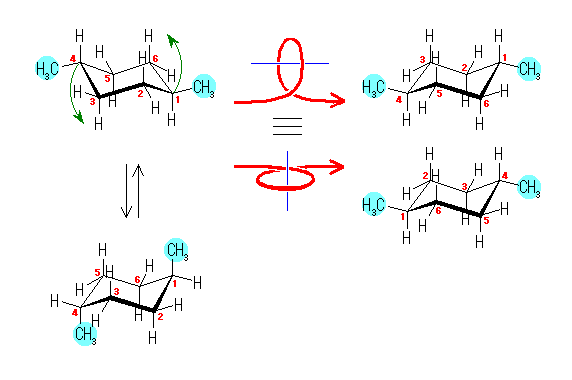
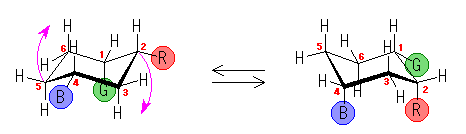
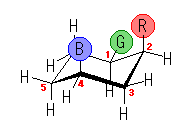
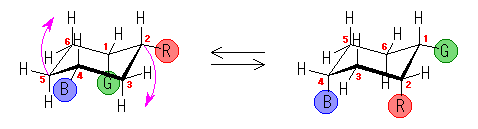
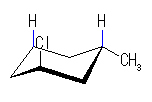
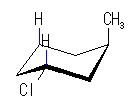
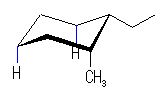
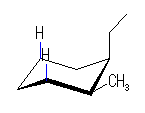
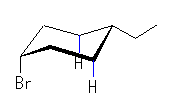
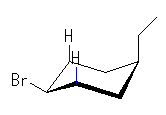
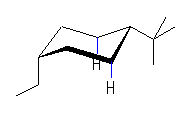
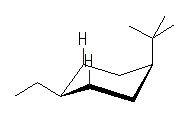
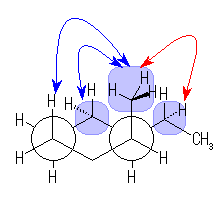
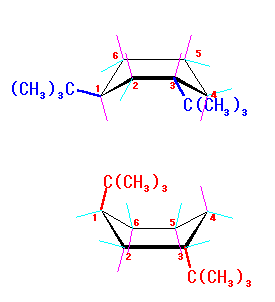
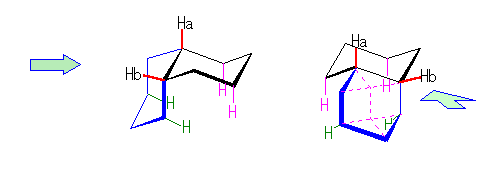
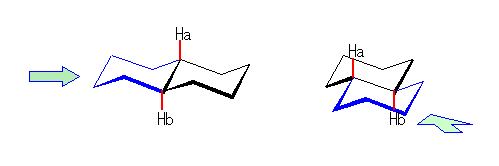




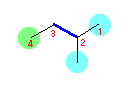
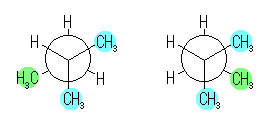
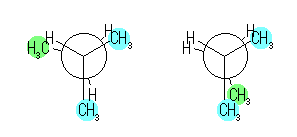
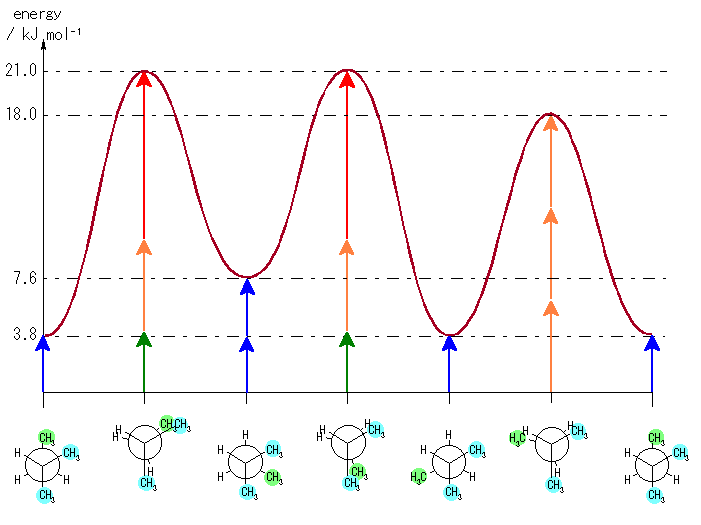
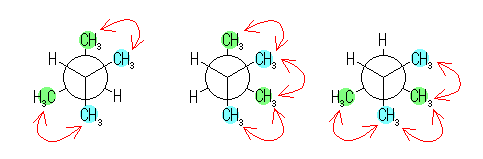
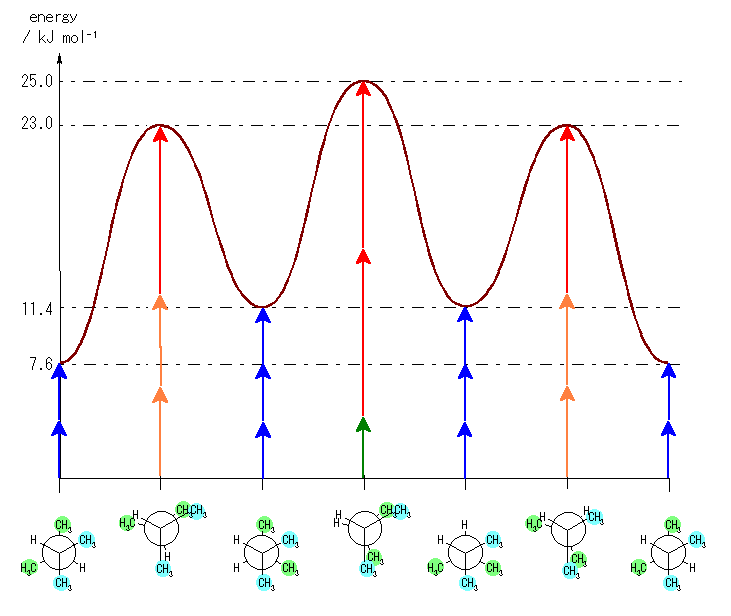
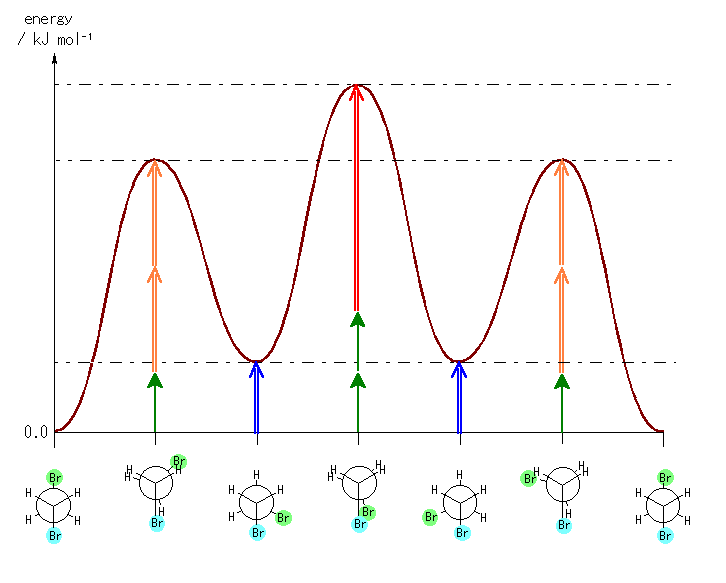
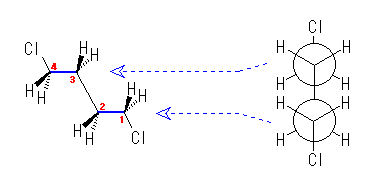
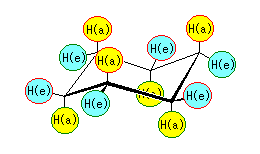
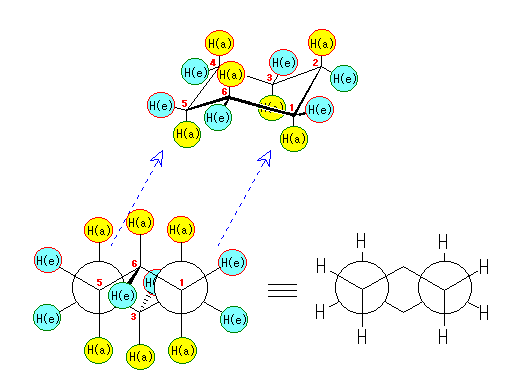
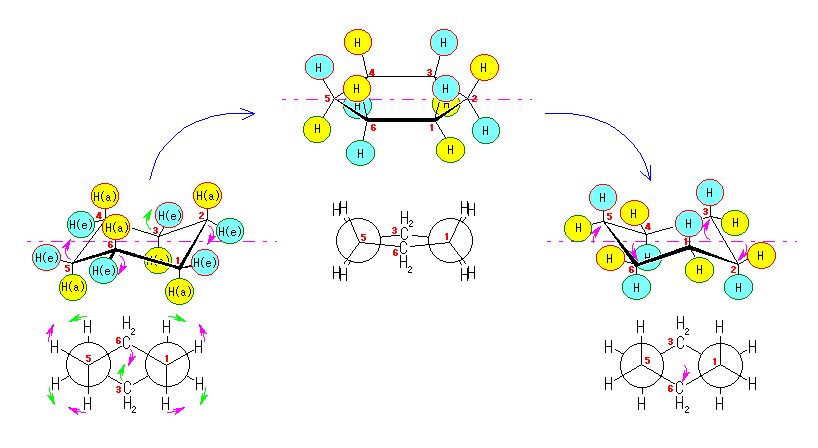
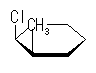
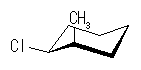
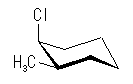
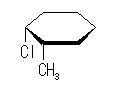
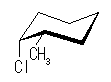
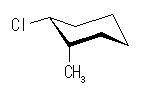
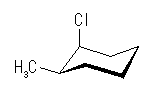
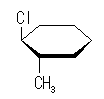
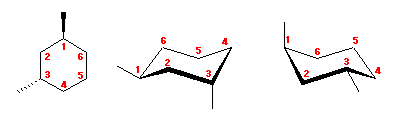
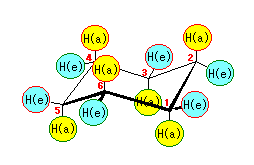 シクロヘキサンの環を構成する炭素に1から6までの番号を振り、それぞれに結合した水素(環の上方、および環の下方)について、ある「いす形配座」におけるアキシャルとエカトリアルの関係を表にまとめると、以下のようになる。
シクロヘキサンの環を構成する炭素に1から6までの番号を振り、それぞれに結合した水素(環の上方、および環の下方)について、ある「いす形配座」におけるアキシャルとエカトリアルの関係を表にまとめると、以下のようになる。

 と描くこともできる。
と描くこともできる。
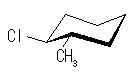
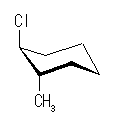
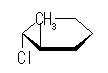
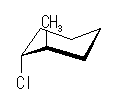
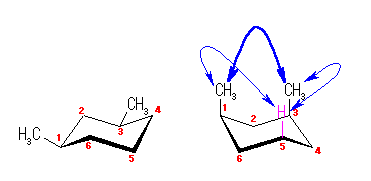
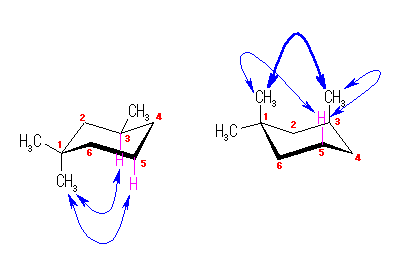
 ある置換基がアキシャル位にあるときの、水素1つとの間の 1,3-ジアキシャル相互作用の大きさは、教科書 p126 の表4.2 に与えられている。
ある置換基がアキシャル位にあるときの、水素1つとの間の 1,3-ジアキシャル相互作用の大きさは、教科書 p126 の表4.2 に与えられている。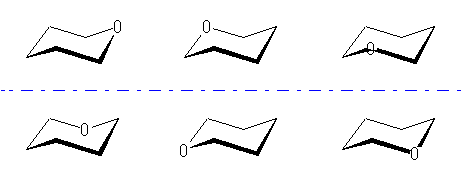
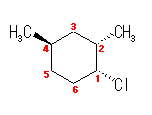
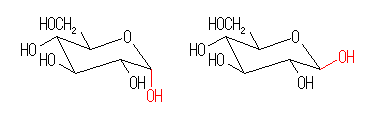
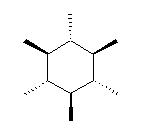
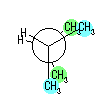
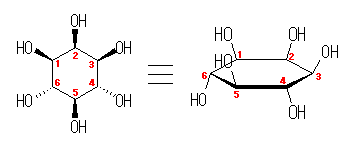
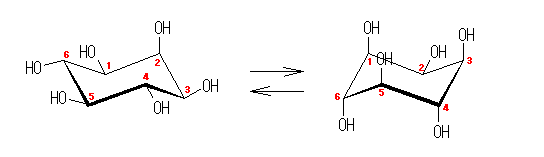
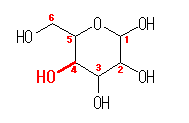 都合上(教科書(下)での、糖類の構造式と一致させる目的で)、ここでは教科書とはガラクトースの絵を左右反転して示している。また、環の命名法とは異なった規則により(酸素には番号を振らずに)炭素骨格に1〜6の番号を振っている。
都合上(教科書(下)での、糖類の構造式と一致させる目的で)、ここでは教科書とはガラクトースの絵を左右反転して示している。また、環の命名法とは異なった規則により(酸素には番号を振らずに)炭素骨格に1〜6の番号を振っている。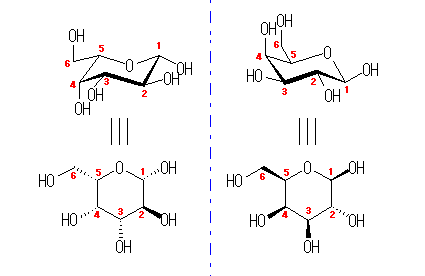
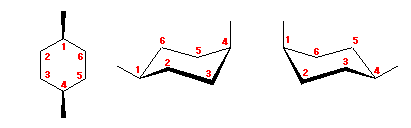
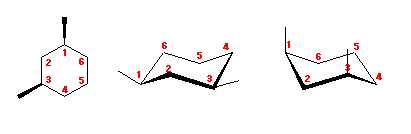
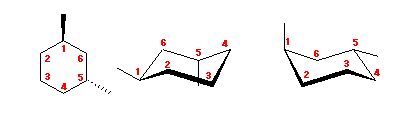
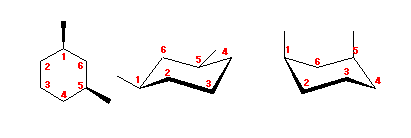
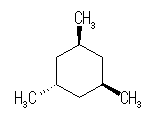
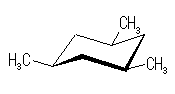
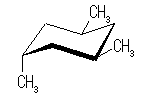
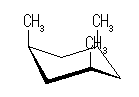

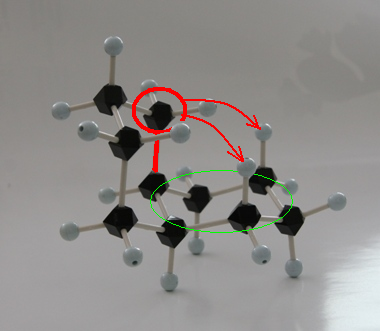
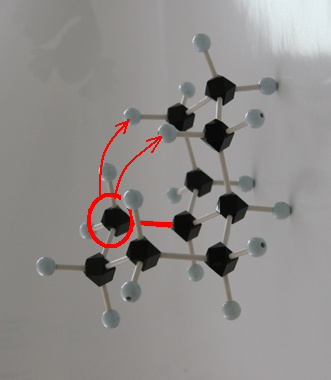
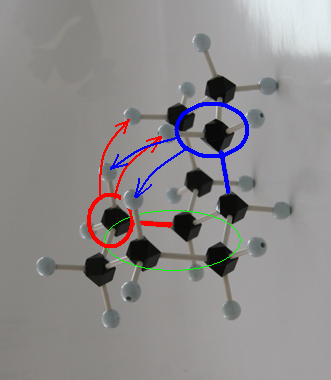
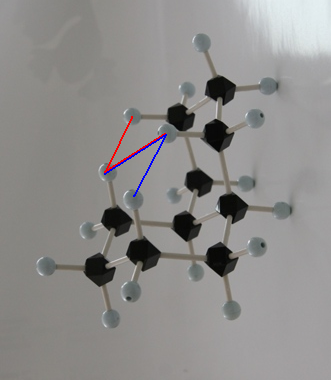
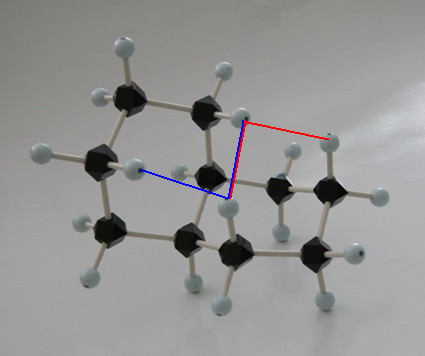
 trans-decaline
trans-decaline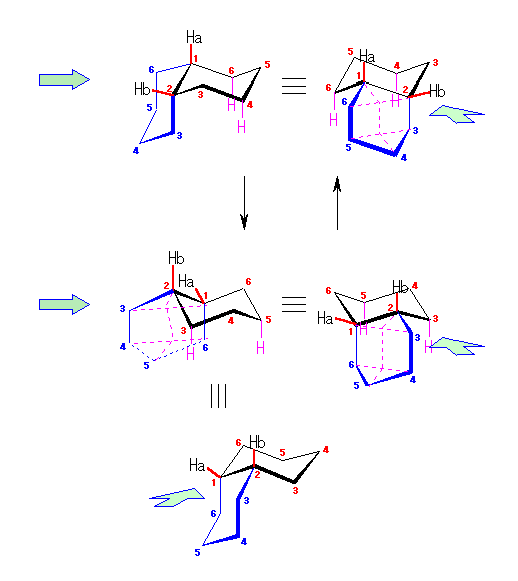 cis-decaline
cis-decaline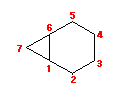
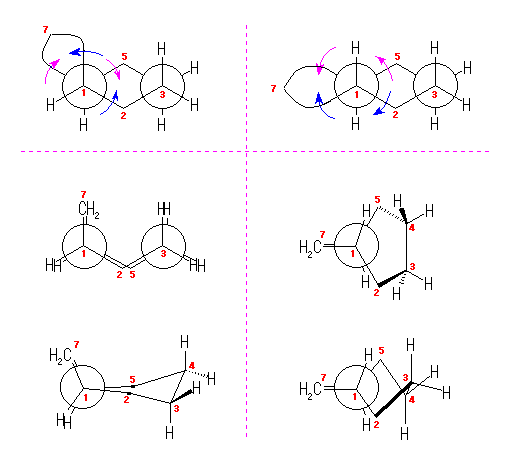
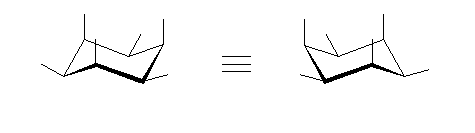
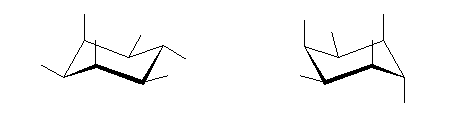
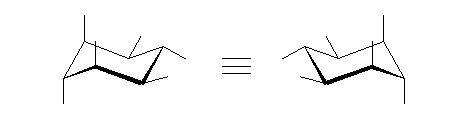
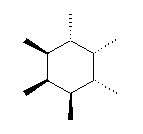
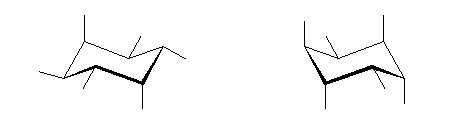
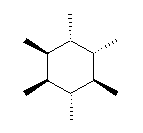
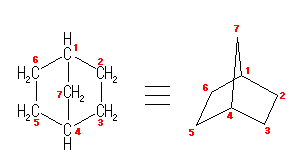
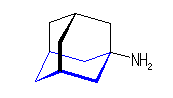
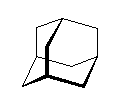 1) この化合物の骨格は、3箇所に切れ目をいれることにより、完全に環構造をなくすことができるので、「三環式炭化水素, tricycloalkane」である。
1) この化合物の骨格は、3箇所に切れ目をいれることにより、完全に環構造をなくすことができるので、「三環式炭化水素, tricycloalkane」である。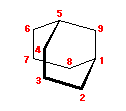 2) 「一番短い橋」を取り除いた、二環式炭化水素である左の化合物は、4.49(発展)で述べたルールにより、bicyclo[3.3.1]nonane と命名される。
2) 「一番短い橋」を取り除いた、二環式炭化水素である左の化合物は、4.49(発展)で述べたルールにより、bicyclo[3.3.1]nonane と命名される。