5.01-5.10
5.01
教科書 pp141-142 の解説をきちんと読むこと。
(解答例)
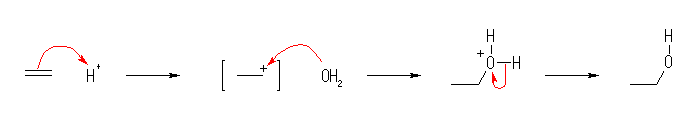
(a) 置換 : -Br が -OH に置換されている。
(b) 脱離 : 水が脱離してオレフィン(アルケン)が生じている。
(c) 付加 : 二重結合に水素が付加している。
5.02
すべての水素に反応するチャンスがある。異なる位置の水素で置換反応が起こると、異なる生成物(位置異性体)が生じる。
なお、考えられる生成物は5種類。
(解答例)
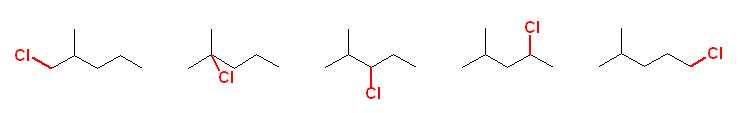
生成物の名称は、図左より以下の通り。
1-chloro-2-methylpentane,
2-chloro-2-methylpentane,
3-chloro-2-methylpentane,
2-chloro-4-methylpentane,
1-chloro-4-methylpentane
メチル基の位置番号が、塩素との関係で2または4になっていることに注意。また、2位のメチル基が塩素化されたものは、1位の位置で塩素化されたものと同じ構造であることに注意。
5.03
(解答例)
ネオペンタン(2,2-dimethylpropane)は、ただ1種類の水素しか持たないから、位置選択性に関係なく、モノ塩素化生成物は1種類しか存在しない。
つまり、ペンタンをラジカル塩素化しても、モノクロロ体として次図の3種類が生じてしまうということ。
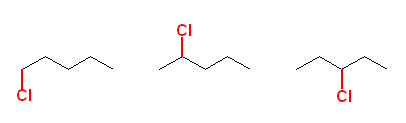
そのため、1-chloropentane(図、左端)のみが欲しい場合の合成法としては、混合物で得られたものを分離しなければならないために適当であるとはいえない。(すべての水素が同じ確率で反応すると考えると、1-chloropentane は、モノクロロ体生成物のうち、50%にすぎない計算となる。)
5.04
これらの分子種、あるいは生じるイオンのうち、正の部分電荷を持つ部分があるものは求電子試薬として、負の部分電荷を持つ部分があるものは求核試薬としてはたらくことができる。実際にそのどちらとしてはたらくかというのは、反応の相手や条件によって決まる。また、両方としてはたらく場合も考えられる。
(解答例)
(a) 二重結合に対する付加反応では、H+ が求電子試薬として反応し、生じたカルボカチオンに対して Cl- が求核試薬としてはたらく。(反応条件等により、両方としてはたらくことが可能。)
(b) アミン窒素は孤立電子対を持つので、ルイス塩基であり、求核試薬として反応することができる。(求核試薬としてはたらく。)
(c) チオールの硫黄は孤立電子対をもち、アルコールの酸素と同様に負の部分電荷を持つ。このため、この部分で求核試薬としてはたらくことができる。また、硫黄に結合した水素は(電気陰性度の高い元素に結合した水素に共通の性質として)正の部分電荷をもち、従って酸性度の高い水素である。この部分は求電子性の反応を示すことができる。(反応条件等により、両方としてはたらくことが可能。)
(d) カルボニル基は、(アルデヒド、ケトン、エステル、カルボン酸誘導体のそれぞれについて共通に)炭素が正に、酸素が負に分極している。このカルボニル基に共通した反応として一般に、正に分極した炭素上で求核攻撃を受ける(=求電子試薬としてはたらく)。(単に分極だけを考えれば、負に分極した酸素が求核試薬としてはたらくこともありえるが、実際に知られている反応から考えて、そのような例はあまり重要ではない。)(反応条件等により、両方としてはたらくことが可能であるが、主に求電子種としてはたらく。)
個々の例については上のようであるが、まあ、大雑把なまとめとして次のように考えておこう。
求電子試薬:正電荷を持つもの、正の大きな部分電荷を持つもの(ハロゲンや、酸素など、電気陰性の原子に結合している炭素や水素)、特に、酸素やハロゲンに結合した酸性の水素をもつもの。また、中性ではあるがオクテットを満たしていないルイス酸であるもの。
求核試薬:負電荷を持つもの、負の大きな部分電荷を持つもの、中性ではあるがπ電子を持つもの、および窒素、酸素上の孤立電子対を持つもの。ただし、カルボニル基や、シアノ基は酸素、窒素上に孤立電子対を持つが、求核種としてより、求電子種としての働きの方がより重要である。
5.05
静電ポテンシャルマップでは、青いところは電子不足、赤い部分が電子豊富であることを示していた。また、ホウ素は3族の元素であるから、中性の原子で価電子が3であった。
(解答例)
ルイス構造は、ここでは省略。(ホウ素は3本の結合をもち、それ以外の電子対等をもたないので、オクテットを満たさないルイス酸である。また、フッ素は結合に関与する以外の3つの孤立電子対を持つ。)
ホウ素はポテンシャルマップから読みとれるように電子不足の原子となっており、求電子試薬としてはたらくことができる。
5.06
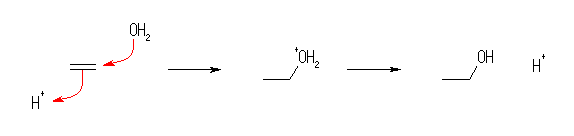
オレフィンとハロゲン化水素の極性付加反応では、プロトン(水素イオン)が求電子試薬としてはたらき、二重結合(の π 電子)に付加し、カルボカチオンを与え、ひきつづいてハロゲン化物イオンがそのカチオン中心と静電的に(つまり、 Cl- などが求核試薬としてはたらいて)結合する。
(解答例)
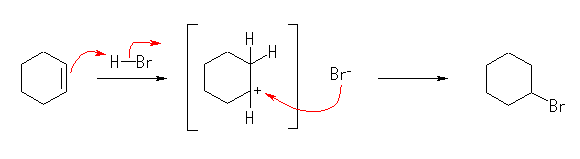
HBr との反応 : 1-bromocyclohexane,
HCl との反応 : 1-chlorocyclohexane
5.07
非対称な二重結合にプロトンが付加する際、二重結合に関与した2つの炭素のどちらに結合するかにより、カルボカチオンに2種類の構造が考えられることに注意する。
(解答例)
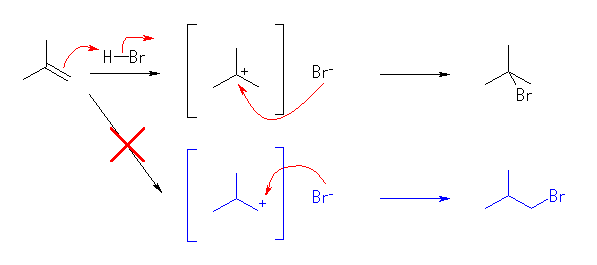
生成物の構造から考えて、カチオン中心に臭化物イオンが結合していくのであるから、上記反応式の上で示した3級のカルボカチオンが生じている。下で示したカルボカチオンは1級であるから、3級のカルボカチオンよりも生じにくい。
5.08
矢印をもちいた表記については、教科書 pp143-150 などをじっくり読むこと。
(解答例)
以下に示す図において、曲がった矢印の位置(出発点、矢印の先の点)、生成物の構造や電荷の有無について注意すること。
また、図をみながら、曲がった矢印で表される電子の動きによって、どの結合や電子対が無くなり、代わりにどこに結合や電子対が生じているのかを確認すること。
(a) 
(b) 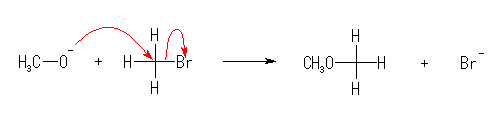
(c) 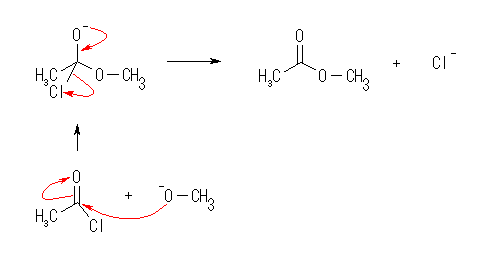
5.09
・電子対から原子への矢印では、そこに結合が新たにできる。
・結合からの矢印では、そこの結合が1本減る。(二重結合からは単結合、単結合は切れる。)
・矢印の先では結合が1本増えるか、矢印の先の原子が電子を受け取り価数が増える。
(解答例)
ethylene (ethene) が生じる。
5.10
教科書 pp156-160 を熟読すること。
(解答例)
反応のギブス自由エネルギー変化が負(発エルゴン的)である反応は、平衡が成立した場合に正反応が進行する側に偏り、反応に有利である。したがって、 -44 kJ/mol の反応。
5.11-5.20
5.11
反応物 ←→ 生成物
の反応において、平衡定数 Keq は、[ 生成物 ] / [ 反応物 ] で与えられた。
(解答例)
平衡定数の式から明かなように、平衡定数が大きい(分母が小さく、分子が大きい)方が生成物よりに傾いており、より発エルゴン的である。したがって、1000 の場合。
5.12
教科書 158 ページを熟読すること。
A ←→ B
の平衡が成り立つとき、ボルツマン分布の式より、[B]/[A] = exp ( −ΔE/RT ) である。ここで、この左辺は平衡定数 Keq に等しい。また、右辺中 ΔE はギブスの自由エネルギーで考えるから、Keq = exp ( −ΔG/RT ) と書ける。これを式変形すると、ΔG = −RT ln ( Keq ) の関係となる。この式を用いると良い。( ln は e を底とする、自然対数。)
自然対数の値を求めるためには、関数電卓などを用いること。
気体定数 R の単位 (J / K mol) に注意すること。( kJ ではない。)
(解答例)
T = 298 (K), R = 8.3145 (J / K mol) を用いて計算する。
なお、慣例にしたがって eA のような、e のべき乗は、 exp ( A ) と表した。また、ln ( B ) は B の自然対数(底は e )である。
(a) Keq = 1000 のとき、
ΔGo = −RT ln ( Keq ) = − 8.3145 × 298 × 6.908 (J / mol) = −17.1 kJ/mol
(b) Keq = 1 のとき、
ΔGo = −RT ln ( Keq ) = − 8.3145 × 298 × 0 (J / mol) = 0 kJ/mol
(c) Keq = 1/1000 のとき、
ΔGo = −RT ln ( Keq ) = − 8.3145 × 298 × −6.908 (J / mol) = +17.1 kJ/mol
(d) ΔGo = −40 kJ/mol のとき、
Keq = exp ( −ΔGo / RT ) = exp ( +40×103 / (8.3145 × 298) ) = 1.03 × 107
(e) ΔGo = 0 kJ/mol のとき、
Keq = exp ( −ΔGo / RT ) = exp ( 0 / (8.3145 × 298) ) = 1
(d) ΔGo = +40 kJ/mol のとき、
Keq = exp ( −ΔGo / RT ) = exp ( −40×103 / (8.3145 × 298) ) = 9.75 × 10−8
5.13
どの結合が切れ、代わりにどの結合ができたかに注目する。教科書 pp160-162 参照。
ある分子の特定の化学結合に対し、その結合解離エネルギーが +A kJ/mol であるということは、結合を均一に開裂させてばらばらの状態にするのに必要なエネルギー(あるいは仕事と言い換えても同じ)が +A kJ/mol であることを意味する。すなわち、その結合が「結合している状態」は「切れている状態」にくらべて +A kJ/mol だけ安定である(つまり低いポテンシャルエネルギーをもつ)ことを意味する。この状態のポテンシャルエネルギーは、結合解離エネルギーの符号を変えて −A kJ/mol である、と表現してよい。
したがって、反応系で切れる結合の結合解離エネルギー(の和)が +A kJ/mol、生成系で生じた結合の結合解離エネルギー(の和)が +B kJ/mol であるならば、反応に伴うポテンシャルエネルギー差(エンタルピー差、ΔH )は、(−B)−(−A) で計算される。
(解答例)
ΔHo = [(−293)+(−366)] − [(−438)+(−193)] = −28 (kJ/mol)
となり、負の値であるから発熱反応であるが、教科書 p161 より、メタンと Cl2 の反応では ΔHo = -102 (kJ/mol) に比べると発熱量は少ない。
5.14
5-13 のヒントを参照。
(解答例)
(a) ΔHo = [(−436)+(−234)] − [(−339)+(−298)] = -33 (kJ/mol)
(b) ΔHo = [(−335)+(−432)] − [(−351)+(−449)] = 33 (kJ/mol)
5.15
反応速度は、アレニウスの式、 k = A × exp ( − ΔG‡ / RT ) で与えられる反応速度定数に比例する。ここでは、前指数項 A の大小は問わないものとして考えることにする。
(解答例)
アレニウスの式において前指数項 A が共通であるならば、反応の活性化エネルギー ΔG‡ が小さい反応ほど、その反応速度が速い。従って、ここでは +45 kJ/mol の活性化エネルギーを持つ反応の方が、+70 kJ/mol の活性化エネルギーの反応よりも速い。
ただし、以下の点を気をつける。
・同じ温度での比較であること。もし温度が違えば活性化エネルギーの大小だけでは反応の速さを議論できない。
・同じような反応であること。異なる種類の反応は、異なる A の値を持つことがあり、その場合も活性化エネルギーの大小だけでは反応の速さを議論できない。
・逆反応について考えなくてもよい系であること。可逆反応の場合は、生成物の量がごく少ない(したがって逆反応がほとんど進まない)初期の反応速度で比較していること。逆反応の割合が増えてきて、遂に平衡が成り立つ時点では、見かけ上は反応が進まない。(見かけ上、反応物と生成物の量が変化しない。)
・また、この平衡に達する点がどのあたりかという情報は、反応の活性化エネルギー ΔG‡ からは得られない。平衡定数と関連するのは、反応の自由エネルギー変化 ΔHo だけである。
5.16
吸エルゴン過程では反応の自由エネルギー変化が正であり、発エルゴン過程では反応の自由エネルギー変化が負である。自由エネルギー変化が正であるということは、反応前よりも反応後の方が高い自由エネルギーを持つことに相当する。
(解答例)
(例)
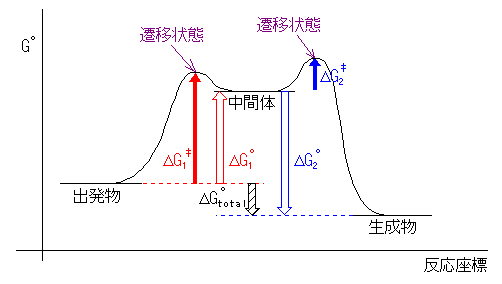
第一段階が吸エルゴン過程なので「出発物(反応物)」より「中間体」の方がエネルギーが高く、また、第二段階が発エルゴン過程なので「中間体」より「生成物」のエネルギーが低い。(遷移状態に相当する山の高さは、一つめと二つ目でどちらが高くても構わない。)
ΔGototal は正でも負でも良い。
5.17
以下のそれぞれの反応について、教科書 p161 の結合解離エネルギーの表より、反応の前後のエンタルピー差 ΔHo を求めることができる。
(開始反応) Cl−Cl → 2 Cl・
(成長−1) CH4 + Cl・ → CH3・ + H−Cl
(成長−2) CH3・ + Cl−Cl → CH3−Cl + Cl・
(停止反応) CH3・ + ・Cl → CH3−Cl など
(解答例)
2つの成長反応について、反応エンタルピー差を求めると、以下の値となる。
(成長−1) CH4 + Cl・ → CH3・ + H−Cl
ΔHo1 = +6 kJ/mol
(成長−2) CH3・ + Cl−Cl → CH3−Cl + Cl・
ΔHo2 = −108 kJ/mol
したがって、全反応では、ΔHototal = ΔHo1 + ΔHo2 = −102 kJ/mol
厳密には、ΔHo と ΔGo は( TΔS だけ)異なるが、これらがほぼ等しいものとして定性的なポテンシャルエネルギー図とすることができる。ただし、これだけの条件では活性化エネルギーに関する情報を全くもたない。そこで、教科書 p164 の記述を参考とする。
p146「一般に多くの有機反応は 40〜150 kJ/mol の範囲の活性化エネルギーを持っている。 …中略… 活性化エネルギーが 80 kJ/mol 以下の反応は室温またはそれ以下でも起こり、これより高いエネルギーの場合には加熱が必要となる。 …」
アルカンの光塩素化反応は、室温でも十分に速く進行するから、比較的小さな活性化エネルギーを持つ反応である。これらを考えあわせて、作図したのが下図である。
(例)
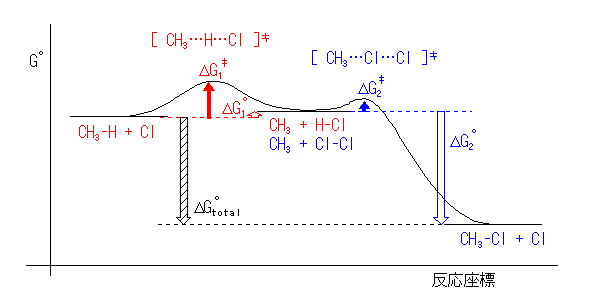
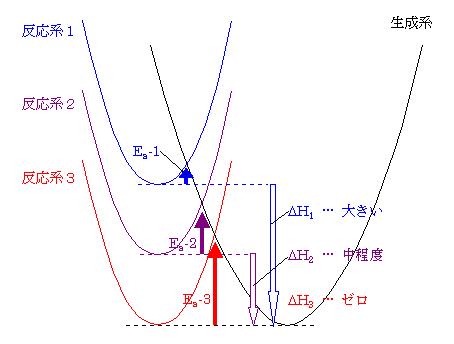
反応の活性化エネルギーは、同種の反応の間では、反応エネルギー差との間に相関があることが経験的に知られている。おおざっぱにまとめると、発熱反応においては、発熱量が多いほど(反応エネルギー差が大きいほど)活性化エネルギーは小さくなる傾向にあると言える。これをまとめたのが右図である。
すなわち、経験的に、より発熱的である反応は(平衡が生成物よりに偏るだけではなく)反応速度も大きく、より反応が進行しやすい傾向にある。
5.18
「つぎのハロゲン化アルキルは、2つの異なるアルケンに HBr が付加して得られる。」という問いの文は、「2つの異なるアルケンに、別々に HBr が付加したとき、それぞれが同じハロゲン化アルキルを生じる(A + HBr → 図の生成物、B + HBr → 図の生成物) 」という意味。「2つのアルケンと HBr からハロゲン化アルキルが生じる(A + B + HBr → 図の生成物)」という意味ではないです。念のため。
アルケン(二重結合を持つ不飽和炭化水素)へのハロゲン化水素の付加反応では、隣接したふたつの炭素上に、水素とハロゲン原子が結合を作る。したがって、生成物の臭素の位置より、もとのアルケンにおける二重結合の位置を類推することが可能である。
(解答例)
反応の位置選択性(二重結合の左右の炭素のどちらに臭素が、どちらに水素が結合するかの選択性)を考えなければ、下図のように、1-pentene、2-pentene のいずれも 2-bromopentane を形成しうる。
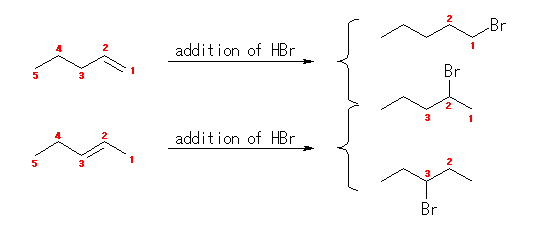
カルボカチオン中間体を経由する反応では、より安定な(級数のおおきい)カルボカチオンを好むから、1-pentene からは 2-bromopentane のみを主生成物として与え、2-pentene からは 2-bromopentane と 3-bromopentane とを生じる。
この図にあたえられた生成物が経由するカルボカチオンは、上より、1級、2級、2級である。
5.19
まずは図より、カルボカチオンの構造の中で、形式電荷が +1 となっている炭素を探す。教科書の5章で何度にもわたってでてきたアルケンへの臭化水素の極性付加反応においては、二重結合部分のπ 電子が H-Br に対して求核的にはたらき、隣接した炭素の一方上にこの臭化水素由来の水素が結合し、もう一方の炭素上に形式電荷が生じる。次に、カルボカチオン上に臭化物イオンが結合していく。したがって、5.18 と同様にカルボカチオンの正電荷を担っている炭素に臭素が結合した生成物となる。
(解答例)
反応の位置選択性(二重結合の左右の炭素のどちらに臭素が、どちらに水素が結合するかの選択性)を考えなければ、下図のように、methylenecyclohexane、1-methylcyclohexene のいずれも(この問いに示された)共通のカルボカチオン中間体を経由し、1-bromo-1-methylcyclohexane を生じる。
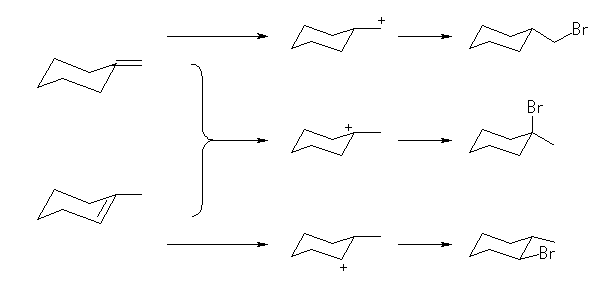
カルボカチオン中間体を経由する反応では、より安定な(級数のおおきい)カルボカチオンを好むから、いずれの出発物質からも 1-bromo-1-methylcyclohexane を主生成物として生じる。
5.20
電子不足(青) → 正の部分電荷(δ+) → 求電子性
電子豊富(赤) → 負の部分電荷(δ−) → 求核性
(解答例)
いずれも酸素原子付近は電子密度が高い(図で赤に近い色となっている)ことから、求核性を示すと考えられる。問い (a) では、ホルムアルデヒドの炭素についてきいている。ここは電子密度が低く、図では青くなっている。求電子性を示す。
5.21-5.30
5.21
(a) はじめの状態から、増えれば正、減れば負である。数値としては、最後の状態からはじめの状態を差し引く。(0から10に増えた場合には、差は10−0=+10、5から−3に減った場合には、差は−3−5=−8、というように。)図中に描くには、はじめの状態の高さから最後の状態へ向けた矢印で描く。(反応の自由エネルギー変化に注目する場合、はじめの状態と最後の状態のみできまり、途中の山の高さ(活性化エネルギ−)には依存しない。)
(b)(c) 「一つの段階」の反応では、ひとつの山(遷移状態)を越える。
「一つの段階」に対する反応エネルギー図の例として、教科書 163 ページの図 5.5 を参照。
(解答例)
図は省略、教科書 163 ページの図 5.5 を参照のこと。
(a) 正である。
(b) 2段階。
(c) 途中で2つの遷移状態を経由する。
5.22
(a) ひとつ山を越えたあとのそれぞれの谷が中間体である。「中間体の数+生成物につき1」(=越えるべき山の数)が反応の段階数である。
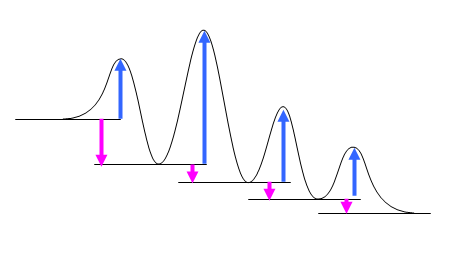
(b) は、ピンクの矢印が(下向きに)長いものが、最も発エルゴン的。(c) は、青い上向きの矢印(活性化エネルギー)の一番大きなものが、最も遅いと考えられる。
(解答例)
教科書の図から判断する。正確に判断したければ、ものさしをあててみてください。
(a) 4段階(1つの段階は、ポテンシャルエネルギーの谷からはじめ、山を越えて次の谷底までの部分)
(b) 最も発エルゴン的な反応とは、反応自由エネルギー変化(それぞれの段階ごとの始状態(谷底)と終状態(次の谷底)のエネルギー差:上図でピンクの矢印)が負で一番大きい段階である。それぞれの段階での反応自由エネルギー変化はいずれもほぼ同じ大きさである。(強いて言えば、若干1番目の過程が大きく発エルゴン的かもしれない。)
(c) 越えなければ山が一番高いところ(麓の低いところから登る)の段階が、一番遅い反応となると予想される。強いていえば、2番目?(ただし、「アレニウスの式における前指数項による影響はほとんど無視できる」=「活性化エネルギーが低い反応ほど反応速度が大きい」ものと仮定した。この仮定に関係する詳細は、5.15 のヒントおよび解答例を参照のこと。)
5.23
官能基を構成するそれぞれの原子の電気陰性度から決まる。
(解答例)
a) シアノ基(−C≡N) 。窒素上に δ− が生じるように分極する。
b) エーテル結合(−O−)(または、メトキシ基、−OMe)、酸素上に δ− が生じるように分極する。
c) カルボニル基(>C=O)(または、ケトン基)、および、エステル結合(−(C=O)-O−)。いずれも酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
d) カルボニル基(>C=O)×2個。カルボニル酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
e) 二重結合(C=C)、アミド(−CONH2)。酸素および窒素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
f) ホルミル基(−CHO)(または、アルデヒド基)。酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
5.24
出発物質(反応物質)と、生成物質の構造をくらべ、どこが変化しているかについて考える。
(解答例)
a) 置換。−Br が、−CN で置換された。
b) 脱離。隣接した炭素から水素と水酸基が、水分子として脱離した。
c) 付加。cyclopentadiene と 3-butene-2-one とが反応して結合を作るが、なにも抜け落ちる部分がない。
d) 置換。水素がニトロ基(−NO2)で置換された。
5.25
このような問題は、該当する単語の意味が判らないとき、教科書末尾の索引を引き、該当するページおよびその付近の内容を参照すること。
(解答例)
(解答例、省略)
5.26
このような問題は、該当する単語の意味が判らないとき、教科書末尾の索引を引き、該当するページおよびその付近の内容を参照すること。「中間体」は、「反応中間体」でエントリーされている。遷移状態については教科書 162 〜164 反応中間体については教科書 165 〜166 にかけての解説を参照。
(解答例)
遷移状態は、反応の途中で経過しなければならないうちで、一番エネルギーの高い(エネルギー的に極大であるような)状態のことである。いくら温度を下げるなどしてもすぐに、よりエネルギーの低い状態に変化してしまうから、原理的に取り出したりすることはできない。
反応中間体は、多段階の反応の経路の途中で、短期間生成する(すぐに次の反応により変化してしまう)物質である。エネルギー的には極小である。一般的には難しいことが多いが、原理的には単離も可能である。たとえば、極端に温度を下げるなどする。
5.27
(解答例)
Keq < 1 より、ΔGo > 0 で吸エルゴン過程である。
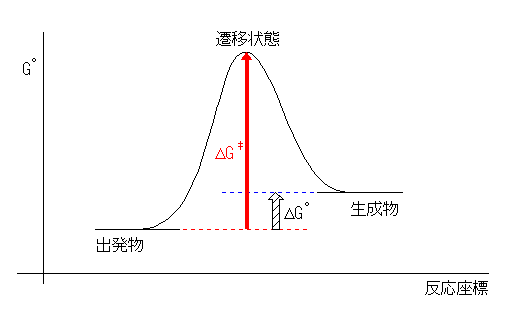
Keq < 1 なので、出発物より生成物の方が少ない。つまり、生成物のエネルギーは出発物のものよりも高い。
5.28
(解答例)
Keq > 1 より、ΔGototal < 0 で発エルゴン過程である。

Keq > 1 なので、出発物より生成物の方が低い。また、中間体は出発物や生成物よりもエネルギーが高い。以上の関係を満足していれば、他はどのように描いてもよい。たとえば、一つ目の山と二つ目の山は、どちらが高くても構わない。
5.29
(解答例)
(例)
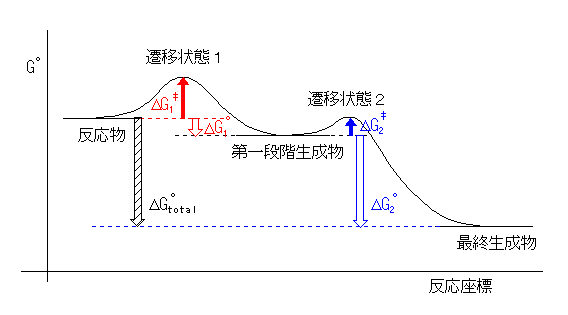
発エルゴン過程なので、ΔGototal < 0 である。また、
第二段階の方が、第一段階よりも速いから、
ΔG‡1 > ΔG‡2 の関係がある。ここで、5.17 の(発展)を応用すると、2段階とも発エルゴン過程である場合、更に ΔGo1 < ΔGo2 であることが予想できる(が、確定というわけではない)。
なお、この図では第一段階生成物(中間体)を、反応物(出発物)よりも低く書いているが、5.28 に描いたようなエネルギー図でも構わない。
5.30
(解答例)
(図は省略)
Keq = 1 なので、ΔGo = 0 である。すなわち、反応系と生成系が同じポテンシャルエネルギーを持つ。活性化エネルギーの高さは任意で構わない。一般的には 40〜150 kJ/mol の範囲(教科書 p146)。
5.31-5.40
5.31
(解答例)
(a) ΔHo = [(−293)+(−498)] − [(−380)+(−366)] = −45 (kJ/mol)
(b) ΔHo = [(−339)+(−432)] − [(−436)+(−351)] = +16 (kJ/mol)
5.32
(解答例)
(a) (Cl2) ΔHo = [(−338)+(−432)] − [(−420)+(−243)] = −107 (kJ/mol)
(b) (Br2) ΔHo = [(−285)+(−366)] − [(−420)+(−193)] = −38 (kJ/mol)
(c) (I2) ΔHo = [(−222)+(−298)] − [(−420)+(−151)] = +51 (kJ/mol)
相対的には、より自由エネルギー変化が負で大きな反応ほど進みやすい。ここでは ΔHo を計算しているが、この大小関係がそのまま ΔGo に反映すると考えて良いほどの差がみられており、エタンのハロゲン化の進み易さ(平衡に達したときの生成物の割合の多さ)の順は、Cl2 > Br2 > I2 である。( I2 に至っては吸エルゴン過程である。)
反応の速さは、活性化エネルギーの議論をせずには比較することはできないが、5.17 の (発展) を応用すると、アルカンのハロゲン化は、塩素を用いたときが一番速い(活性化エネルギーが小さい)ことが結論できる。
5.33
(解答例)
ΔHo =
[(−293)×2] − [(−376)+(−193)] = −17 (kJ/mol)
ethane のラジカル臭素化により bromoethane を生じる場合の値(5.32-b)に比べて、発熱量が小さい。
(5.32-b) ΔHo = [(−285)+(−366)] − [(−420)+(−193)] = −38 (kJ/mol)
その一つの要因として、5.32-b では生成する H−Br の結合解離エネルギー(赤字で示した)が、CH3−Br の結合解離エネルギー(293 kJ/mol)よりかなり大きいこと、つまり 5.32-b の方がより安定な生成物を与えていることによる影響であると考えられる。
5.17の(発展)で考察したように、一般的により発熱的である反応の方が活性化エネルギーも小さくなり速く進行すると考えられるから、この反応エンタルピー差を考えると、ethane のラジカル臭素化では、これらの生成物を与える2つの反応が競争しておきたとしても、 bromomethane を与える反応の方が bromoethane を与える反応より遅いため、主生成物として bromoethane が得られると考えられる。
5.34
アルカンのラジカル塩素化(教科書 pp 144-145)を熟読すること。
(解答例)
アルカンのラジカル塩素化反応は、「開始反応」「成長反応」および「停止反応」から成り立っている。このうち、開始反応は紫外線などのエネルギーにより塩素分子が均一的に開裂して塩素ラジカルを生じる段階であり、光が照射されている間は定常的に塩素ラジカルの供給源としてはたらく。一方、成長反応は光の照射を必要とせず、塩素ラジカルを触媒として反応が進行する。成長反応では、開始反応で生じた塩素ラジカルは消費されず、従って塩素ラジカルは停止反応のみで消費され、その濃度はゆっくりと減少する。
そのため、光を遮断したあとも、あらたには塩素ラジカルが供給されないので、停止反応により徐々に消費され反応は遅くなるが、はじめに開始反応により生じた塩素ラジカルは、いきなりはなくならずに、成長反応を触媒するため塩素化反応はゆっくりと進行する。
5.35
R−H + Cl−Cl → R−Cl + H−Cl
の反応について、結合解離エネルギーの表から反応エンタルピー差を計算すればよい。
(解答例)
第1級水素:CH3CH2−H
ΔHo = [(−338)+(−432)] − [(−420)+(−243)] = −107 (kJ/mol)
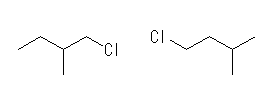
1-chloro-2-methylbutane, 1-chloro-3-methylbutane
第2級水素:(CH3)2CH−H
ΔHo = [(−339)+(−432)] − [(−401)+(−243)] = −127 (kJ/mol)
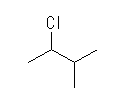
2-chloro-3-methylbutane
第3級水素:(CH3)3C−H
ΔHo = [(−330)+(−432)] − [(−390)+(−243)] = −129 (kJ/mol)
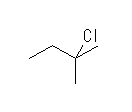
2-chloro-2-methylbutane
3つの値は、比較的似ているが、わずかに1級よりも2級、3級で反応が起きやすいという結果になっている。
5.36
(解答例)
5.35 の解答例参照
5.37
問題 5.3 のヒントや解等例を参照してください。
(解答例)
(a), (c), (f)
問題 5.3 で pentane をラジカル塩素化すると3種の混合物になると解説したように、一般的に、ラジカル塩素化は反応の位置選択性が乏しく、塩素化の対象となるアルカンに区別できるような水素(分子を回転させたりしても重ね合わせることができないような水素)があると、それぞれから生じるモノクロロ体は単一とはならない。
5.38
no hint
(解答例)
(a) ΔHo = +243 (kJ/mol)
(b) ΔHo = (−432) − (−438) = +6 (kJ/mol)
(c) ΔHo = (−351) − (−243) = −108 (kJ/mol)
(b) と (c) の合計:ΔHototal = −102 kJ/mol
(d) ΔHo = +243 (kJ/mol)
(e) ΔHo = (−351) − (−438) = +87 (kJ/mol)
(f) ΔHo = (−432) − (−243) = −189 (kJ/mol)
(e) と (f) の合計:ΔHototal = −102 kJ/mol
これらのエネルギー関係を、反応エンタルピー変化をそのまま反応自由エネルギー変化におきかえて模式的に示したのが下図である。より不安定な水素ラジカルを生じる経路(e, f)ではなく、安定なメチルラジカルを生じる経路(b, c)で反応が進む。
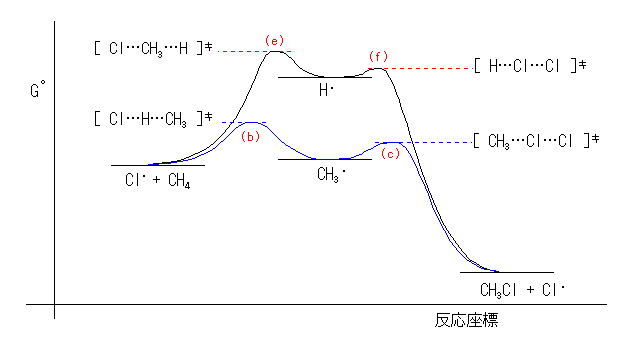
5.39
(解答例)
解答例をみながら、ひとつの矢印ごとに、どこの電子が移動してどこに結合が生じたりしたのかを確認すること。
(a)
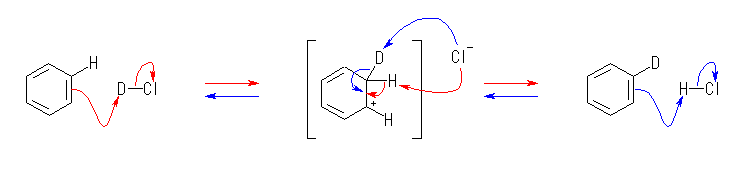
(b)
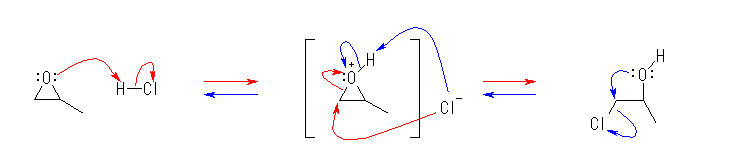
5.40
(解答例)
解答例をみながら、ひとつの矢印ごとに、どこの電子が移動してどこに結合が生じたりしたのかを確認すること。
(a)
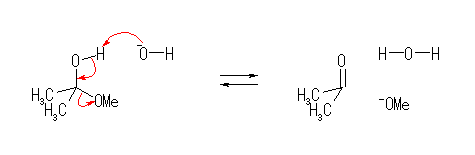
(b)
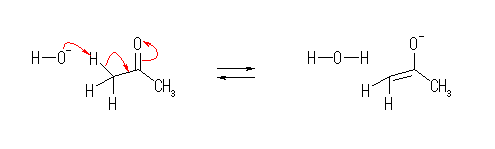
あらためて言うまでもないが、図中の -OMe は、-OCH3 を意味する。
5.41-5.50
5.41
(a) 平衡定数の定義は、教科書 p157 に書かれている。
(b) 室温で反応がゆっくりおこることから、活性化エネルギーの大きさをどの程度と見積もるかについては、教科書 p164 の記述を参考にすること。
教科書 p164 「一般に多くの有機反応は、40〜150 kJ/mol の範囲の活性化エネルギーをもっている。 … 中略 … 活性化エネルギーが 80 kJ/mol 以下の反応は室温またはそれ以下でも起こり、これより高いエネルギーの場合には加熱が必要となる。」
(c) 「定量的な」エネルギー図を描くためには、活性化エネルギーの大きさの他、反応エネルギー変化も知る必要がある。後者は、平衡定数が既知であれば、そこから計算できる。
なお、ある反応に伴うエネルギー差とは、始めの状態に対して最終的にどうなったのか(上がったのか、下がったのか)ということなので、符号が意味をもつ。従って、反応のエネルギー図の中に「反応エネルギー(差)」や、「活性化エネルギー」を書き込む場合に、この符号も含めて書き込む必要がある。すなわち、大きさを表すだけの両矢印(⇔)ではなく、方向性を持った矢印で表さなければならない。
(解答例)
(a) Keq = [生成物] / [出発物] = 0.70 / 0.30 = 2.33
(b) ΔG‡ は、およそ 80 kJ/mol 程度と考えられる。(ヒント参照)
(c) ΔGo = −RT ln ( Keq ) = −8.3145 × 298 × 0.847 J/mol = −2.1 kJ/mol の値を用いる。
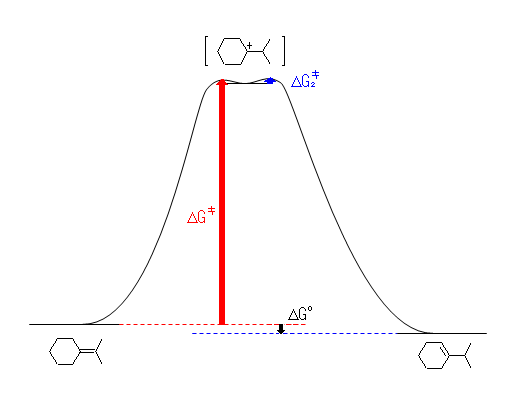
カルボカチオン「中間体」は、厳密には遷移状態ではないから、エネルギーの極小点として描くのが正しい。図中、青で示した活性化エネルギー(中間体であるカルボカチオンが生じたあと、生成物に変化する段階の活性化エネルギー)は、赤のものよりずっと小さいから速やかに反応するため、赤で示した活性化エネルギーが反応全体の速度を決める。別の表現を使うなら、カルボカチオンを生じる過程が律速段階である。従って、(b)のおよそ 80 kJ/mol という値は、赤の矢印に相当する高さである。
厳密には正しいわけではないが、全体としてのエネルギー関係を大まかに捉えるための近似として、中間体と遷移状態にほとんど差が無いという仮定をしてしまうことがある。これにより、図を簡略化することができる(次図)。ただし、この簡略化した図は、あくまでも上で描いたような「正しい」図が理解できることを前提として用いなければならない。
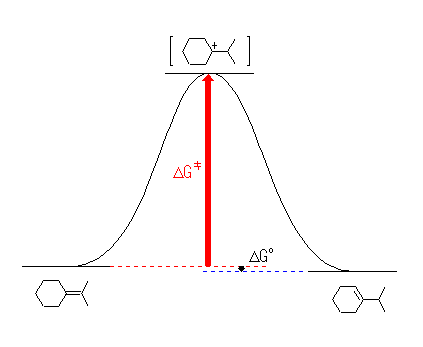
5.42
(解答例)
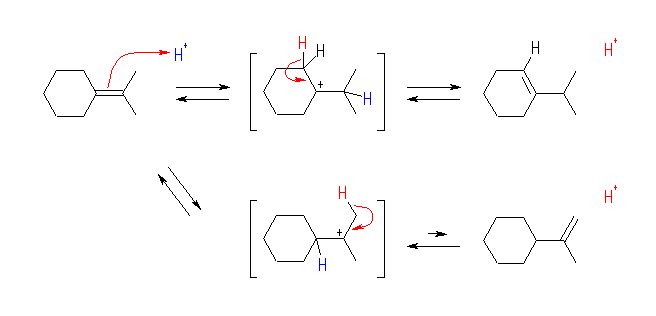
isopropylidenecyclohexane へのプロトン付加により、いずれも3級である2種類のカルボカチオンが生じる。下段のカルボカチオンからは、isopropylidenecyclohexane へ戻る過程(左)と、isopropenylcyclohexane を生じる過程(右)が考えられる。しかし、二重結合に多くのアルキル基の置換したアルケンの方が安定であるため、2置換の isopropenylcyclohexane を生じる(右)のではなく、isopropylidenecyclohexane へ戻る(左)のが主となる。(教科書 pp384- 386 では、アルキル置換基の数とアルケンの安定性に関連した、Zaitsev 則について述べられている。これは、ハロゲン化アルキルからの脱離反応によりオレフィンを得る際の位置選択性について述べた一般則である。)
alkane より水素を一つ除いて遊離原子価のある(結合する余地を残す)炭素をもつものが alkyl 基であった。(例: methane → methyl, ethane → ethyl)
語尾が -yl の1価のアルキル基から、その同一の遊離原子価炭素から水素を、さらに1つまたは2つ取り除いてできる置換基(2価基、3価基)は、語尾を -idene, idyne とする。
| 炭素数 | 1価基 | 2価基 | 3価基 |
|---|---|---|---|
| 1 | −CH3, methyl | =CH2, methylene * | ≡CH, methylidyne |
| 2 | −CH2CH3, ethyl | =CHCH3, ethylidene | ≡CCH3, ethylidyne |
| 3 | −CH2CH2CH3, propyl | =CHCH2CH3, propylidene | ≡CCH2CH3, propylidyne |
| (2) | −CH=CH2, vinyl | =C=CH2, vinylidene | − |
| (3) | −CH(CH3)2, isopropyl | =C(CH3)2, isopropylidene | − |
5.43
5.41 を参照のこと。
(解答例)
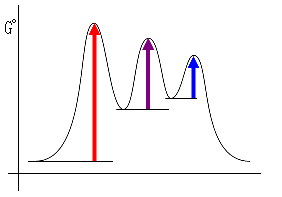
(a) 第1段階は第2段階より遅く、第2段階は第3段階よりさらに遅いので、活性化エネルギーの大小関係は、以下のようになる。
ΔG‡1 > ΔG‡2 > ΔG‡3
ここで、反応は室温でゆっくり進行するのだから、これらの中で一番大きな値であるような 活性化エネルギーは、およそ 80 kJ/mol 程度と考えられる。
また、平衡定数はおよそ1であるから、ΔGototal = −RT ln ( Keq ) = 0 kJ/mol で、出発系と生成系のエネルギーは、ほぼ同じである。
(b)
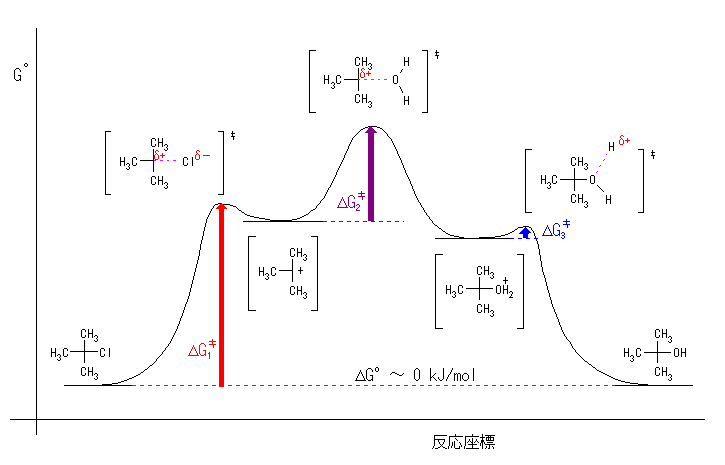
図中の遷移状態でピンクの破線で示したのは、結合ができはじめ、あるいは切れはじめの状態を表している。この図では、二番目の中間体のエネルギーの方が、最初の中間体のエネルギーよりわずかに低く描かれているが、現段階では、2つの中間体のうちどちらが安定であるかという情報は無いので、どちらで描いてもよい。
たとえば、次のような形でも,
ΔG‡1 > ΔG‡2 > ΔG‡3
を満たし、かつ、平衡定数がおよそ1であること(ΔGototal = −RT ln ( Keq ) = 0 kJ/mol)と合致する。
5.44
(解答例)
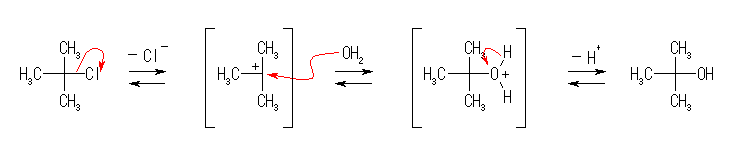
教科書の問いでは、2番目の中間体からプロトンが脱離する段階は、別の水分子がルイス塩基としてはたらき、H+ ではなく、H3O+ の形で脱離するように表記している。その場合は、水分子の酸素の孤立電子対から発し、脱離すべき水素へ向かう曲がった矢印を追加する。
5.45
ΔGo = ΔHo - TΔSo の関係式(教科書p158)を用いる。単位中にでてくる kJ と J を混同しないように注意する。
(解答例)
ΔGo = ΔHo - TΔSo = (−75 [kJ/mol]) − 298 [K] × (+54 [J/K mol])= −91.1 kJ/mol
ΔHo、ΔGo ともに負であるから、発熱的で、発エルゴン的である。
5.46
(解答例)
Keq = exp ( −ΔGo / RT ) = exp ( −91.1×103 / (8.3145 × 298) ) = 9.29 × 1015
5.47
(解答例)
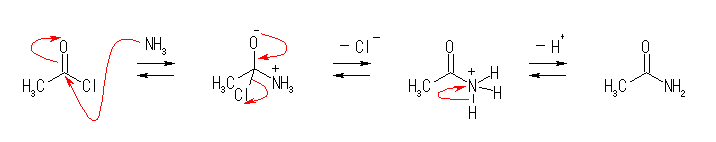
開裂する結合と生成する結合については、各自確認しておくこと。ここでは詳細は省略。
5.48
(解答例)
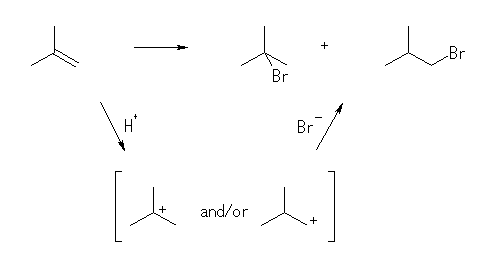
組み合わせとしては、2-bromo-2-methylpropane および 1-bromo-2-methylpropane とが生じる可能性がある。しかし、反応機構を考えると、中間体としてカルボカチオンを経由するために、より安定なカルボカチオン(3級のカルボカチオン)から生じる 2-bromo-2-methylpropane が主生成物となると考えられる。
5.49
(解答例)
5.48 の解答例に併せて示した。
5.50
(解答例)
エテンへの臭化水素の付加の機構を、図 5.4 にならって示すと次のようになる。
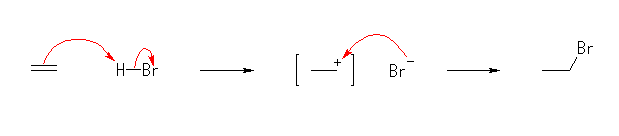
この図では、(比較的不安定で、3級のカルボカチオンに比べると生じにくい)1級のカルボカチオンが生じてから臭化物イオンによる求核攻撃がおきるように描いているが、次のように(臭化水素由来の)水素イオンの付加と臭化物イオンによる求核攻撃がほぼ同時に起きると考えて図を描くこともできる。
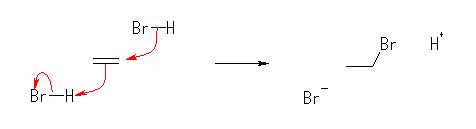
エテンへの水和反応の機構も、上と同様に描くことができる。