17.01-17.10
17.01
(解答例)
17.02
(解答例)
17.03
(解答例)
17.04
(解答例)
17.05
(解答例)
17.06
(解答例)
17.07
(解答例)
(発展)
(c) α,β-不飽和カルボニル化合物中のカルボニル基のみを選択的に還元する目的では、アルデヒドやケトンであっても、一般的に NaBH4 よりも LiAlH4 を用いる。詳細は、17.49(発展)を参照のこと。
17.08
(解答例)
17.09
(解答例)
17.10
(解答例)
(17.01-17.10 は、現在準備中です。)
17.21-17.30 (20-26, 34)
17.21, 20
まずは骨格構造式で書き直してみるとよい。赤い球が酸素を表す。
多官能性有機化合物の母体または基本となる名前は、優先度の最も高い基(主官能基)が非環状鎖の一部である場合は、主官能基の数が最大になる最も長い炭素鎖を母体とする。主官能基が環についていれば、母体としてその環系を用いる。そのほか、母体の選択の詳細、命名法の詳細については巻末付録A(下巻)を参照すること。
立体についても正しく命名することができる必要がある。
(解答例)
(a) 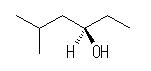
(R)-5-methyl-3-henxanol
(R)-5-methylhenxan-3-ol
(b) 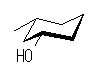
cis-3-methylcyclohexanol
(c) 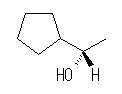
(S)-1-cyclopentylethanol
(d) 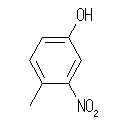
4-methyl-3-nitrophenol
17.22
次表のような、酸化と還元の関係について考えよ。
| 酸化数 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| CH4 | CH3OH 1o-alcohol | HCHO aldehyde | HCO2H | CO2 |
| CH3CH3 | CH3CH2OH 1o-alcohol | CH3CHO aldehyde | CH3CO2H | -- |
| (CH3)2CH2 | (CH3)2CHOH 2o-alcohol | (CH3)2CO ketone | -- | -- |
| (CH3)3CH | (CH3)3COH 3o-alcohol | -- | -- | -- |
| (CH3)4C | -- | -- | -- | -- |
すなわち、アルデヒドを還元すると、1o-alcohol が得られ、ケトンを還元すると、2o-alcohol が得られるが、エステルやカルボン酸を還元しても 1o-alcohol が得られる。
(解答例)
(a) (S)-5-methyl-2-hexanol
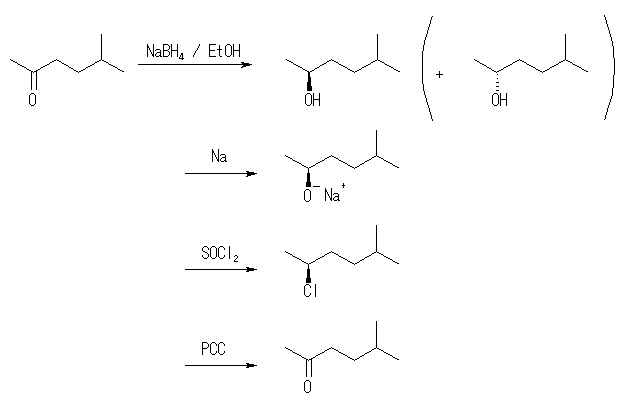
(b) (S)-3-methyl-1-pentanol
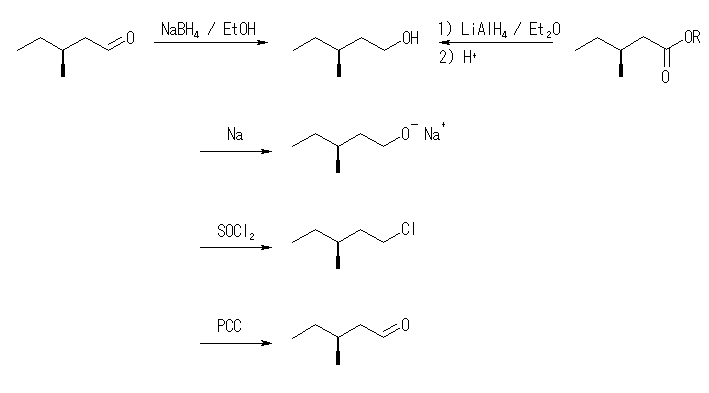
不斉なアルコールである (a) の前駆体カルボニル化合物は、ヒドリドがカルボニルを含む面のどちら側から攻撃するかにより、(R) 体、および (S) 体のいずれかが生じる。このような面のことを「プロキラル( prochiral )面」とよび、sp2-カルボニル炭素を中心として、3つの配位子(2つのアルキル基とカルボニル酸素)が、上から見て右回りになっている方の面を Rectus 面、左回りになっている方の面を Sinister 面と呼ぶ。
このような化合物を「均一な」場で還元しても、通常は2つの立体異性体の等量混合物を与える。
(発展2)
第6版「問題の解き方」では誤っているが、アルコールと塩化チオニル(SOCl2)の反応では、アルコール中の水酸基が塩素に置換される際、立体反転ではなく立体保持となる。これは SNi と呼ばれる特殊な反応機構によるものである。
17.23, 21
(a) 〜 (d) は、アルコールに特有な反応、(e) は芳香環に特有な反応である。立体についても考慮すること。(c)、(d) については、17.22 の解答例および(発展2)を参照すること。
(解答例)
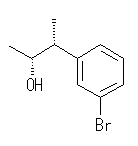
与えられた試薬と (1R,2R)-1-(3-bromophenyl)-2-propanol の反応における生成物の構造を示す。
(a) 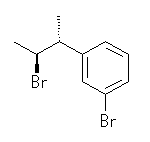
(b) 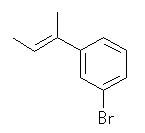
(c) 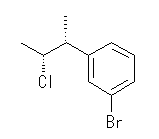
(d) 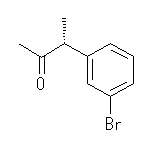
(e) 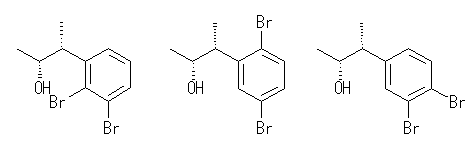
(b) 脱離反応はアンチの立体で生じるから、解答例のような E 体が主生成物として得られる。これは、次のような Newman 投影式を書いて考えると理解しやすいだろう。黄色で着色されたアンチの立体関係にある -H と -X が脱離する。ただし、ここで -X はプロトン化された水酸基( -OH2+ )で、脱離種は水。
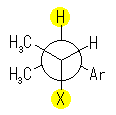
(c) アルコールと塩化チオニル(SOCl2)の反応では、アルコール中の水酸基が塩素に置換される際、立体反転ではなく立体保持となる。これは SNi と呼ばれる特殊な反応機構によるものである。
(e) 臭素、アルキル基ともに芳香族求電子置換反応に対してオルト、パラ配向性の置換基である。( M効果で電子供与効果があるため。なお、ハロゲンはI効果としては電子吸引基であるから、ハロゲンはオルト、パラ配向性でありながら反応を遅くするグループである。)
17.24, 22
章末の反応のまとめを参照せよ。(a)、(b) はヒドリドによるカルボニル求核反応、(c) はグリニヤル試薬によるカルボニル求核反応である。ただし、アルデヒド、ケトンに対する反応とエステルに対する反応では、反応性に違いがある他、反応する求核種のモル等量に違いがある。
(解答例)
基本的にエステルと求核種との反応では、1等量目の求核攻撃では -OEt が脱離し、系内でケトンを生じるため、ひきつづいて2等量目の求核攻撃が起きる。ここでは、脱離基がないため、求核付加となり、H3O+ との反応によりプロトン化を受ける。
(a) 反応しない。理由については、(発展)の部分に記述。
(b) 4-methyl-1-pentanol
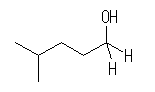
(c) 3-ethyl-6-methyl-2-heptanol
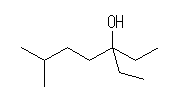
アルミニウムもホウ素も13族で、価電子数が3であるから、AlR3、BR3 ともにオクテット(八偶子)を満たさず、ルイス酸である。アルミニウムヒドリド AlH4- も、 ボロヒドリドBH4- も、これらルイス酸に、ヒドリド( H:- )が配位した形であると理解できる。ホウ素とアルミニウムでは、周期表で上にあるホウ素の方が、より電気陰性度が大きいため、配位したヒドリドをより強く安定化する。このため、ヒドリド供与体としての反応性は、ボロヒドリドよりアルミニウムヒドリドの方が高い。
他方、カルボニル化合物の求核反応の受けやすさは、カルボニル炭素上の正の部分電荷の大きさで変化する。アルデヒド、ケトンは、カルボニル基に水素やアルキル基が結合しているのに対し、エステルではアルコキシ基が結合した形である。アルコキシ基はパイ電子系に対してM効果により電子供与基としてはたらくから、分極したカルボニルの炭素上の正の部分電荷をうち消すようにはたらく。このため、エステルはアルデヒド、ケトンより反応性が低い。厳密な話をすれば、アルキル基も弱い電子供与基としてはたらく。(級数の違いによるカルボカチオンの安定性、置換基の数の違いによるオレフィンの安定性などを思い出すこと。)このため、アルデヒドとケトンを比較した時には、ケトンの方が若干反応性に劣る。
ヒドロホウ素化ナトリウムでは、アルデヒド、ケトンのように反応性の高い(カルボニル炭素上に大きな正の部分電荷がある)物質のみがヒドリド還元を受ける。水素化リチウムアルミニウムでは、アルデヒド、ケトンの他、エステルやカルボン酸もヒドリド還元することができる。
17.25, 23
このケトンは、sec-butyl 基に不斉炭素と、カルボニル基にプロキラル炭素を持つ。(非対称なケトンは、ヒドリド還元により不斉炭素を生じる。このような炭素がプロキラルであるという。17.22 の(発展)も参照のこと。)
(解答例)
sec-butyl 基の不斉炭素のまわりの立体は、隣接するカルボニルにおいて求核付加反応がおこっても保持されるから、問題に与えられたように光学活性なケトンから出発した場合、反応の種類に依らず生成物も光学活性であることが予想される。
次に、このカルボニル求核付加の反応についてだが、求核種による攻撃が、Rectus 面から生じるか、Sinister 面から生じるかにより、異なった立体異性体が生じるが、面が区別されない均一の場においては、これらの攻撃が等確率でおきるため、生じる不斉炭素に関してラセミ体を与えると考えられる。しかしながら、ここに与えられた物質では、隣接炭素が不斉であるから、Rectus 面と Sinister 面は異なった環境にあり、求核攻撃は等確率とはならないと予想される。この問題において、次図に示すいずれの生成物が主となるかは、単純には判断できないが、カルボニル基に隣接した sec-butyl 基が安定な配座をとった時に、より立体的に遮蔽される側の面からの求核攻撃が抑制され、空いている側からの攻撃がより多く起こると予想できる。
なお、生じる2つの生成物は分子内に2つの不斉炭素を持つジアステレオマーである。
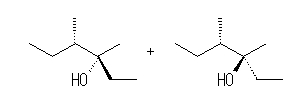
(3R,4S)-3,4-dimethyl-3-hexanol, (3S,4S)-3,4-dimethyl-3-hexanol
17.26, 24
命名法については、p619 〜 (5版においてはp624〜)を復習すること。
(解答例)
2価アルコールになったとき、1価アルコールでは語尾に -ol が来るために省略されていた語幹の e が復活してから(母音で始まらない)-diol が付くことに注意せよ。
(a) 2-methyl-1,4-butanediol
(b) 3-ethyl-2-hexanol
(c) cis-1,3-cyclobutanediol
(d) cis-2-methyl-4-cyclohepten-1-ol, cis-2-methylcyclohept-4-en-1-ol
(e) cis--3-phenylcyclopentanol
(f) 3-bromo-4-hydroxybenzenecarbonitrile, 3-bromo-4-hydroxybenzonitrile, 3-bromo-4-cyanophenol
17.27, 25
まず、与えられた組成式より不飽和度を計算すると、0であることより、分子内に多重結合も環構造も持たないことがわかる。そこで、炭素数5の飽和アルカン、すなわちペンタンの骨格異性体をすべて書き出し、次に、これらの構造中のいずれかの水素を水酸基で置換することにより「すべての C5H11-OH のアルコールの異性体」を書くことができる。
なお、光学異性体を除いて8種類の異性体が存在する。
(解答例)
(*) を付したものは、不斉炭素をもつ。
pentane から派生するアルコール:
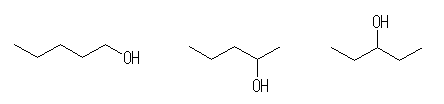
1) 1-pentanol
2) 2-pentanol (*)
3) 3-pentanol
2-methylbutane から派生するアルコール:
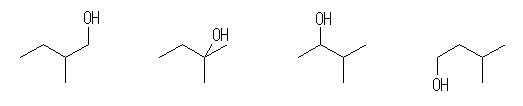
4) 2-methyl-1-butanol (*)
5) 2-methyl-2-butanol
6) 3-methyl-2-butanol (*)
7) 3-methyl-1-butanol
2,2-dimethylpropane から派生するアルコール:
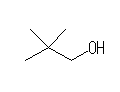
8) 2,2-dimethyl-1-propanol
17.28, 26
アルコールを1級、2級、3級に分類して考える。17.22 のヒントも参照のこと。
(解答例)
酸性での CrO3 による酸化では、1級アルコールからはカルボン酸が、2級アルコールからはケトンが生じる。3級アルコールは反応しない。
1級アルコール:
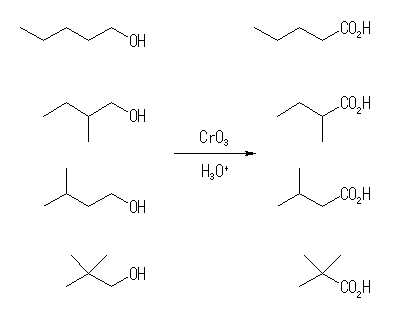
生成物の名称は、上より
pentanoic acid
2-methylbutanoic acid
3-methylbutanoic acid
2,2-dimethylpropanoic acid
2級アルコール:
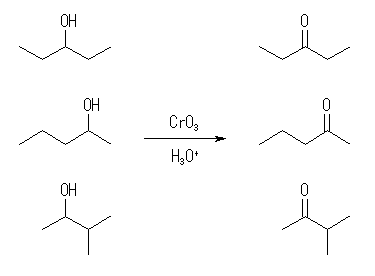
生成物の名称は、上より
3-pentanone
2-pentanone
3-methyl-2-butanone
17.29
bombykol の系統名、(10E,12Z)-10,12-hexadecadien-1-ol よりその構造を書く。E, Z 表記については、6章を参照のこと。
(解答例)
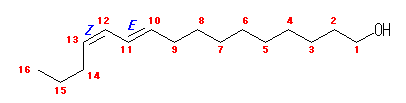
17.30, 34
(a), (b), (d) に関しては、17.22、17.23 と同様、また、(c) に関しては、17.28 と同様。
(解答例)
構造式は省略
(a) 1-bromopentane
(b) 1-chloropentane
(c) pentanoic acid
(d) pentanal
17.31-17.40 (27-37)
17.31, 27
2-phenylethanol の構造は次の通り。
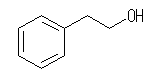
まず、出発物と反応物の両方の構造を書いてみて、どこでどのような反応が起きているのかを確認する。これに相当する同じ反応の例を、章末の「反応のまとめ」などより探すこと。その際に、教科書のセクション番号を確認して、その部分を復習しておくこと。
(d), (f) の2つの反応では、炭素数が1つ減少していることに注意。
(解答例)
反応条件と、概要のみを記す。(各自ノートに学習する際は、条件のみではなく、出発物質および生成物の構造、多段階反応の場合には中間体の構造も併せ書く癖をつけること。)
次の例以外にも進行するものもあるが、これまでに学んだ教科書の記載例を中心に学ぶこと。
(a) POCl3, pyridene : 3級アルコールではないので、硫酸酸性ではなく、こちらの条件とした。オキシ塩化リン POCl3 で水酸基を塩素に置換し、ひきつづき同じ反応容器中で、ピリジンを塩基として脱離反応を進行させる。
(b) PCC / CH2Cl2
(c) CrO3 / H3O+
(d) KMnO4 / H3O+ : 芳香族化合物の側鎖の酸化。
(e) (a)の条件により styrene とした後、H2 / Pd : オレフィンの接触水素化。
or 1) TsCl, 2) LiAlH4 : 水酸基を脱離基(-OTs)に変換したのち、ヒドリドによる求核置換。脱離基にする反応は、(h) の条件によるハロゲン化でも可。
(f) (a)の条件により styrene とした後、1) O3, 2) Zn / AcOH : オゾンによる酸化開裂。
or (d)の条件により benzoic acid とした後、1) EtOH / H+, 2) LiAlH4, 3) H3O+, 4) PCC / CH2Cl2 : benzyl alcohol を経由し、PCC による酸化。エステル化の段階は省略も可能。
(g) (a)の条件により styrene とした後、H2SO4 : オレフィンへの水和。オキシ水銀化法を用いてもよい。
(h) PBr3
17.32, 28
17.31 と同様、まず、出発物と反応物の両方の構造を書いてみて、どこでどのような反応が起きているのかを確認する。
(c) の反応では、芳香族求電子置換による臭素化反応を用いるが、その際の配向性に注意すること。
(d) の反応では、炭素数が増えている。炭素炭素の結合が生成する反応は比較的種類が限られるので、整理して覚えておくこと。
(解答例)
反応条件と、概要のみを記す。(各自ノートに学習する際は、条件のみではなく、出発物質および生成物の構造、多段階反応の場合には中間体の構造も併せ書く癖をつけること。)
(a) PCC / CH2Cl2
(b) 1) KMnO4 / H3O+, 2) EtOH / H+, 3) LiAlH4, 4) H3O+ : 芳香族化合物の側鎖の酸化を行い、生じた安息香酸をエステル化、ヒドリド還元。エステル化の段階は省略可能。
(c) 1) KMnO4 / H3O+, 2) Br2 / FeBr3 : 側鎖の酸化よりも臭素化を先に行うと、アルキル基のオルト、パラ位に臭素化がおきてしまう。
(d) (a) の条件により acetophenone (acetylbenzene, 1-phenylethanone) としたのち、1) MeMgBr, 2) H3O+ : グリニヤル反応は、カルボアニオン等価体によるカルボニル基への求核攻撃によって炭素炭素結合を形成することができる。この生成物は、他にも次図のようなスキームで合成可能である。
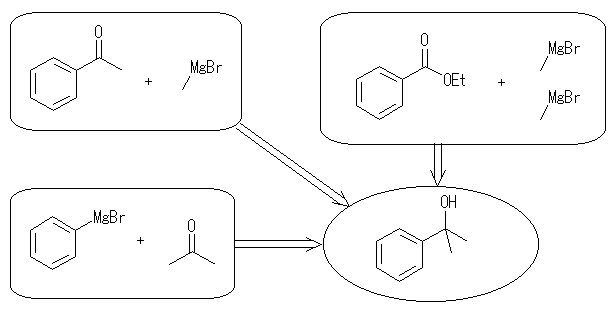
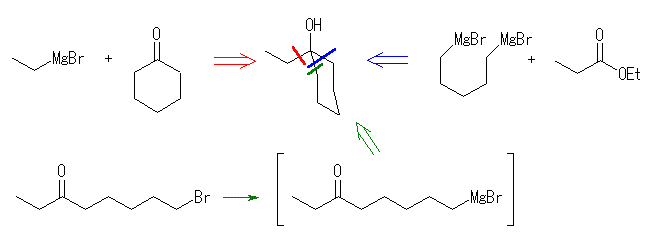
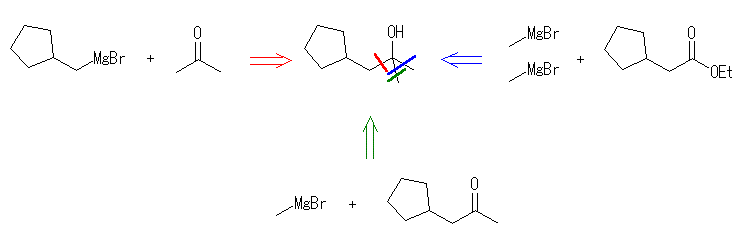
17.33, 29
ケトンやアルデヒドとグリニヤル試薬 RMgX の反応では、1等量のグリニヤル試薬が反応し、水酸基の根元にアルキル基 R が1つ導入されるが、エステルとグリニヤル試薬 RMgX の反応では、2等量のグリニヤル試薬が反応し、水酸基の根元に同じアルキル基 R が2つ導入されることにも注意する。
(解答例)
(a) 2-butanol
propanal + methyl magnesium bromide
ethanal + ethyl magnesium bromide
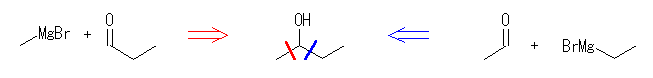
(b) 2-phenyl-2-propanol
acetophenone ( methyl phenyl ketone ) + methyl magnesium bromide
acetone ( 2-propanone ) + phenyl magnesium bromide
ethyl benzoate + 2eq. of methyl magnesium bromide
(c) 2-methyl-2-propen-1-ol
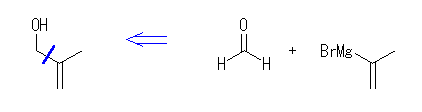
formaldehyde ( methanal ) + 2-propen-1-yl magnesium bromide
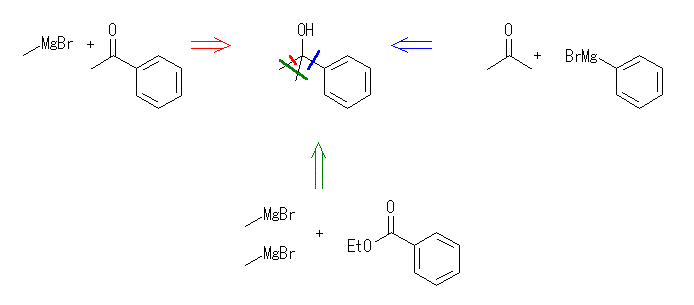
(d) triphenylmethanol
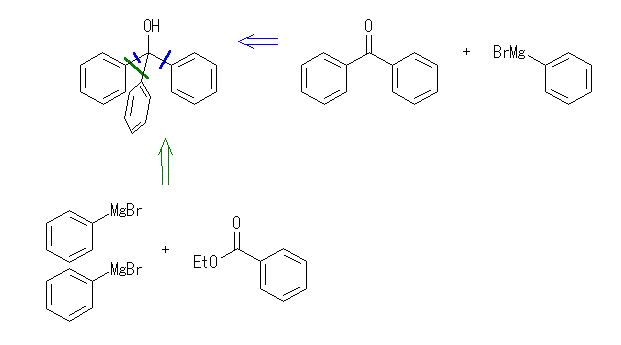
benzophenone ( diphenyl ketone ) + phenyl magnesium bromide
ethyl benzoate + 2eq. of phenyl magnesium bromide
(e) 5-bromo-2-pentanol
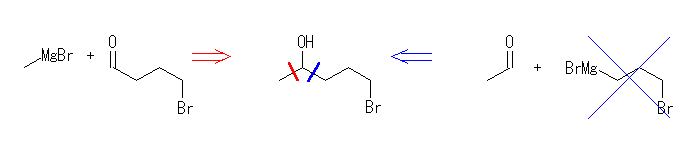
4-bromobutanal + methyl magnesium bromide
1,3-dibromopropane より 3-bromopropyl magnesium bromide のみを選択的に生じさせることができない(2箇所ともがグリニヤル試薬化されたようなものも生じてしまう可能性がある)ため、上図、青矢印のルートは通常考えなくてよい。
ここで、カルボニル化合物とグリニヤル試薬、またはヒドリドとの反応でアルコールを生じる反応を、生成物のアルコールの級数ごとにまとめておく。
1級のアルコール:アルデヒドやエステルのヒドリド還元、または、ホルムアルデヒドとグリニヤル試薬の反応で得られる。
2級のアルコール:ケトンのヒドリド還元、または、アルデヒドとグリニヤル試薬の反応で得られる。
3級のアルコール:ヒドリド還元では得られない。ケトンとグリニヤル試薬の反応、または、エステルと2等量のグリニヤル試薬の反応で得られる。
17.34, 30
1) アルコールは強塩基で処理すると、酸として振る舞い、H+ を放出する。
水素化ナトリウム NaH は、Na+ + H- のように書くことができる。すなわち、この反応において、アルコール由来の H+ と、水素化ナトリウム由来の H- から、気体の水素 H2 が発生する。その結果として生じるものは、ナトリウムアルコキシド Na+O-R である。
2) アルコキシド RO- は、求核剤として振る舞い、ハロゲン化アルキルとの間で求核置換反応( SN2 )する。
以上を、電子の動きを表す矢印を用い、反応機構として記すこと。
(解答例)
上記ヒントのうち、1) の反応において、ヒドリド H- は、還元剤ではなく、塩基としてはたらいている。また、2) の求核置換反応が分子内で起きるとき、THF が生じる。
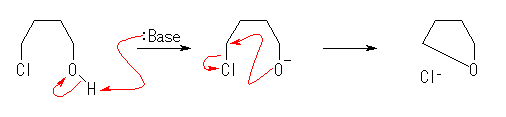
17.35, 31
あるカルボニル化合物を還元して、あるアルコールが得られるとするならば、そのアルコールを酸化すればもとのカルボニル化合物になると考えられる。
17.22 ヒントで挙げた表、および 17.33 (発展)を参照すること。
1級アルコールは、アルデヒド、またはカルボン酸やエステルを還元して得られる。また、2級アルコールはケトンを還元して得られる。3級アルコールは、カルボニル化合物の還元では得られない。(グリニヤル反応で得ることは可能である。)
(解答例)
下記スキームにおいて、X は、脱離基( -OEt などのとき、エステル。 -OH の時、カルボン酸)、スキーム下の命名においては、エチルエステルとして命名した。
(a) 2,2-dimethyl-1-hexanol
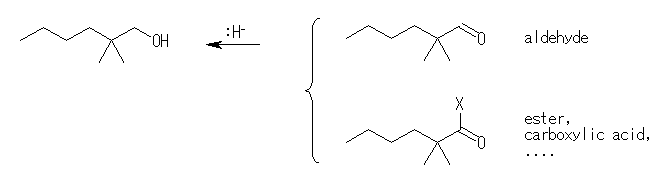
2,2-dimethylhexanal,
ethyl 2,2-dimethylhexanoate
(b) 3,3-dimethyl-2-butanol
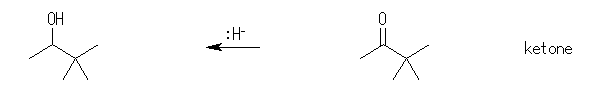
3,3-dimethyl-2-butanone
(c) 1-cyclohexyl-1-propanol
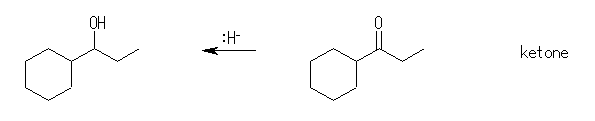
1-cyclohexyl-1-propanone
(d) cyclopentylmethanol
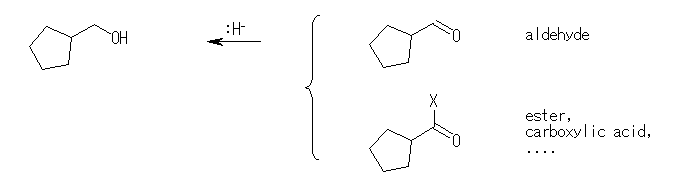
cyclopentanecarbaldehyde ( cyclopentylmethanal ),
ethyl cyclopentanecarboxylate
(d) 解答例のようなアルデヒドやカルボン酸、エステルの命名法は、教科書 19、20、21章の他、巻末付録 表 A-2 の官能基の命名法を参照しておくこと。
17.36, 32
いずれも、二重結合から単結合への変換である。a) では、炭素−炭素二重結合のみを単結合にしており、b) では、炭素−酸素二重結合(カルボニル)の部分のみを単結合にしている。これらは、いずれも還元反応である。しかしながら、同じ二重結合といっても、電子の分布には大きな差がある。(教科書 3.1 官能基:静電ポテンシャルマップにより、官能基を大きく3つに分類したことを参照すること。)炭素−炭素二重結合は、π 電子により、求電子反応をうけやすくなっているのに対し、カルボニル基は大きく分極し、炭素上で求核攻撃を受ける。
a) アルケンの反応については、7.7(アルケンの還元:水素化)を思い出すこと。このときの条件下では、芳香環は還元されなかった(アリールアルキルケトンの還元の項も参照)。芳香環の水素化については、16.11(芳香族化合物の還元)を参照すること。
(解答例)
(a) ロジウム( Rh )を触媒として用いた接触水素化。( H2 / Rh-C )
パラジウム( Pd )を触媒として用いた場合、通常、芳香環(ベンゼン環)の二重結合は還元されない。
(b) ヒドリド還元( LiAlH4 / Et2O )、または、ボラン還元( BH3 / THF )。
ヒドリド還元剤でも、NaBH4 を用いたのでは反応が進行しない。
b) の反応は、ヒドリド還元、ボラン還元のいずれでも選択的に進行する。
ヒドリド( H- )は、求核的にカルボニルの炭素に攻撃するが、電子豊富な炭素−炭素二重結合には反応しない。
一方、電子不足種である BH3 は、求電子的な反応をするから、炭素−炭素二重結合に対してもヒドロホウ素化反応をすることができるが、より電子豊富なカルボニル酸素に対し、より速く反応する。
17.37, 33
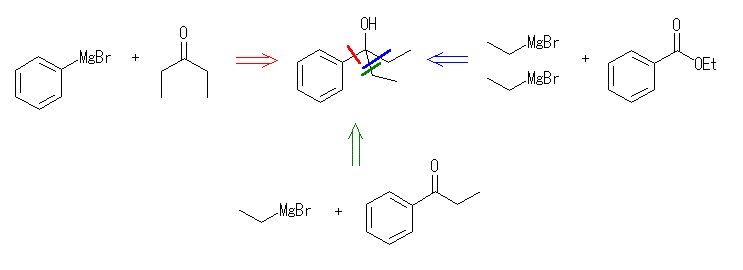
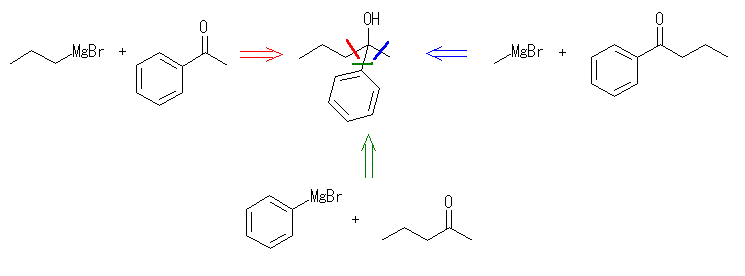
17.33 と同様に考えること。
カルボニル化合物に対するグリニヤル試薬の反応では、炭素炭素結合が生成される。生成物の構造から考える場合は、どの結合が新たに生成したのかで分類して考えるとよい。
ケトンやアルデヒドとグリニヤル試薬 RMgX の反応では、1等量のグリニヤル試薬が反応し、水酸基の根元にアルキル基 R が1つ導入されるが、エステルとグリニヤル試薬 RMgX の反応では、2等量のグリニヤル試薬が反応し、水酸基の根元に同じアルキル基 R が2つ導入されることにも注意する。
(解答例)
(a) 2-methyl-2-propanol
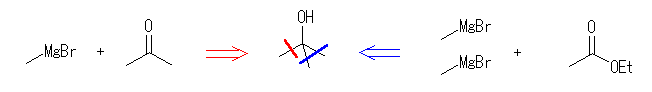
等しい3つの置換基がついた3級アルコールの場合、上のような切断のパターンが考えられる。
(b) 1-ethylcyclohexanol
緑で示した分子内にケト基をもつグリニヤル試薬は、すぐに分子内で反応してしまうため単離は難しいと考えられる。
(c) 3-phenyl-3-pentanol
切断のパターンは、(b) と同じ。
(d) 2-phenyl-2-pentanol
すべて異なる3つの置換基がついた3級アルコールの場合、上のような切断のパターンが考えられる。(a) の場合と比較してみること。
(e) 2-(4-methylphenyl)ethanol
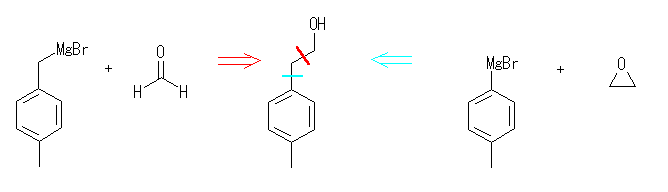
1級のアルコールなので、「グリニヤル試薬とカルボニル化合物の反応」という面では、ホルムアルデヒドとの反応のみが考えられる。水色の切断パターンでは、エチレンオキシド(カルボニル化合物では無い)との反応となるので、題意には合わないので解答例としては余分である。
(f) 1-cyclopentyl-2-methyl-2-propanol
切断のパターンは、(a)、(c) と等しい。
グリニヤル試薬(RMgX)とホルムアルデヒド(H2C=O)との反応は、グリニヤル試薬の前駆体であるハロゲン化アルキル RX より、炭素の1つ長いアルコール RCH2OH を得ることになる。アルコールは容易にハロゲン化アルキルに変えることが可能であるし、逆に、ハロゲン化アルキルも容易にアルコールに変換できる。すなわち、炭素伸長反応 RX → RCH2X として捉えることができる。
同様の反応として、カルボニル化合物ではないが、グリニヤル試薬(RMgX)とエチレンオキシド(エポキシド C2H4O )との反応により、2つ炭素鎖の伸びたアルコール RCH2CH2OH を得ることができる。
17.38, 35
3,3-dimethyl-2-butanol から骨格構造(炭素の並び方)を保持したまま脱水させようとすると、水酸基(ここでは、酸性条件下で脱離基 -O+H2 となっている)に隣接した炭素のうち水素を持つものは 1 位の1級炭素だけであるから、3,3-dimethyl-1-butene が生じるはずである。
骨格の転位は、カルボカチオンに特有の反応である。そのカルボカチオンが生じる過程についてもきちんと押さえておくこと。SN1、および E1 反応においては、中間体にカルボカチオンを生じると考えられているが、SN2、E2 反応においてはこれらは生じない。この反応では、どの位置に、何故カルボカチオンが生じているのか、整理しておくこと。
反応物と生成物の構造をよく比較し、3,3-dimethyl-2-butanol から 2,3-dimethyl-2-butene が生じる際に、どの部分の骨格が変化しているのかをきちんと押さえること。カルボカチオンの骨格転位については、教科書 6.12 「求電子付加の気候に対する証拠:カルボカチオンの転位」 を復習せよ。正電荷を帯びた炭素(カチオン中心炭素)と隣接した位置の炭素から、ヒドリド( H: )や、メチル基( H3C: )、フェニル基( C6H5: )などが、シグマ結合に係る電子対ごと移動してくる反応がおきる。この原動力は、生じるカルボカチオンがより安定であることという場合が多い。
(解答例)
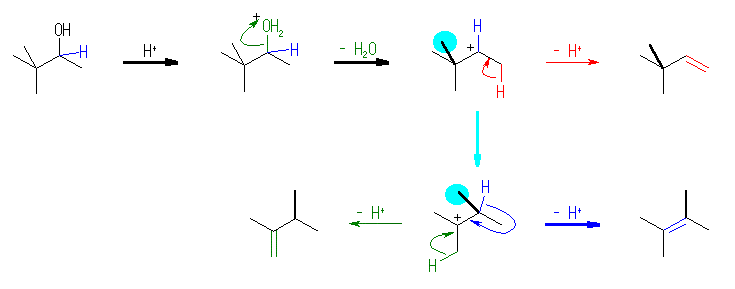
骨格転位が起きていることより、反応は、カルボカチオン中間体を経由する E1 機構で進行すると考えられる。上図、水色で示したメチル基が、隣接したカチオン中心炭素に移動することにより、2級のカルボカチオンは、より安定な3級のカルボカチオンとなる。生じたカルボカチオンより、プロトンを脱離することで、アルケンを生じる。プロトンの脱離時には、遷移状態の構造はアルケンに近いと考えられるため、そのエネルギーも生成物のアルケンが安定である経路の方が低い。そのため、緑の経路で 2,3-dimethyl-1-butene を生じるのではなく、青の経路で 2,3-dimethyl-2-butene を生じる。(より多置換で安定なアルケンを生じる。)
17.39, 36
反応物と生成物の構造をよく比較し、2,2-dimethylcyclohexanol から 1,2-dimethylcyclohexene ならびに isopropylidenecyclopentane が生じる際に、どの部分の骨格が変化しているのかをきちんと押さえること。カルボカチオンの骨格転位については、6.12 を復習せよ。正電荷を帯びた炭素(カチオン中心炭素)と隣接した位置の炭素から、ヒドリド( H: )や、メチル基( H3C: )、フェニル基( C6H5: )などが、シグマ結合に係る電子対ごと移動してくる反応がおきる。本問題の場合は、より長いアルキル基の形で転位している。このような反応により、環の員数が変化するので、合成的に重要な類似の反応も多い。
(解答例)
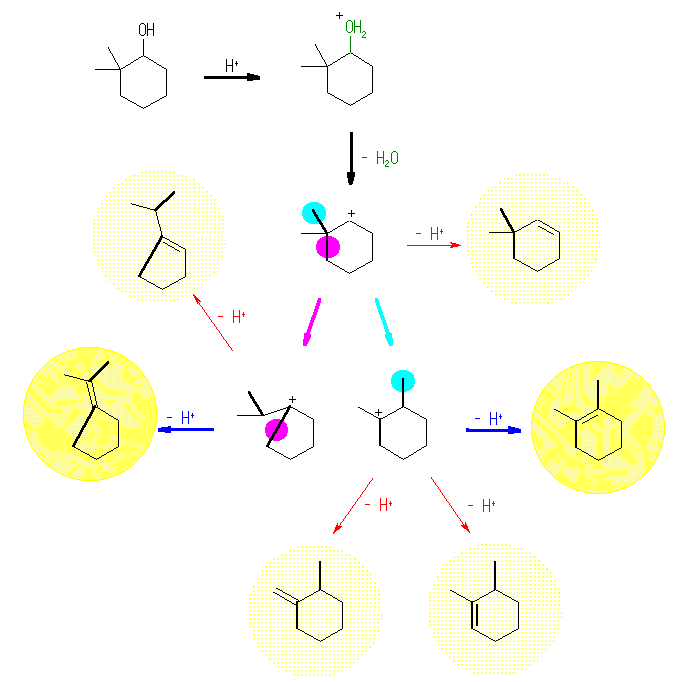
骨格転位が起きていることより、反応は、カルボカチオン中間体を経由する E1 機構で進行すると考えられる。上図、水色で示したメチル基が、隣接したカチオン中心炭素に移動することにより、2級のカルボカチオンは、より安定な3級のカルボカチオンとなる。このカルボカチオンより主に生成するアルケンは、1,2-dimethylcyclohexene である。上図、桃色で示したアルキル基(環の構成の一部)が、隣接したカチオン中心炭素に移動することにより、2級のカルボカチオンは、やはり、より安定な3級のカルボカチオンとなる。このカルボカチオンより主に生成するアルケンは、isopropylidenecyclopentane である。
isopropylidenecycloalkane という命名は、5章の章末問題等、すでに学習済みの内容であるが、命名規則について再掲しておく。
alkane より水素を一つ除いて遊離原子価のある(結合する余地を残す)炭素をもつものが alkyl 基であった。(例: methane → methyl, ethane → ethyl)
語尾が -yl の1価のアルキル基から、その同一の遊離原子価炭素から水素を、さらに1つまたは2つ取り除いてできる置換基(2価基、3価基)は、語尾を -idene, idyne とする。
| 炭素数 | 1価基 | 2価基 | 3価基 |
|---|---|---|---|
| 1 | −CH3, methyl | =CH2, methylidene * | ≡CH, methylidyne |
| 2 | −CH2CH3, ethyl | =CHCH3, ethylidene | ≡CCH3, ethylidyne |
| 3 | −CH2CH2CH3, propyl | =CHCH2CH3, propylidene | ≡CCH2CH3, propylidyne |
| (2) | −CH=CH2, vinyl | =C=CH2, vinylidene | − |
| (3) | −CH(CH3)2, isopropyl | =C(CH3)2, isopropylidene | − |
17.40, 37
(c), (d) は1段階ではなく、複数段階を経て合成する。ただ、いずれも典型的な分子の誘導である。(a) や (b) で合成されたカルボニル化合物や、アルケンの代表的な反応と、それにより誘導される種々の生成物の構造についてまとめてみることが、このような問題を解けるようになる方法である。
(解答例)
(a) アルコールの酸化(教科書 17.8 節を参照)
2級アルコールなので、どのような酸化剤を用いてもよい。(1級アルコールの場合は、アルデヒドまでの酸化にとどめるか、カルボン酸まで酸化するかで試薬を選ぶことになる。)
PCC / CH2Cl2 、CrO3 / H3O+ など。
(b) アルコールの脱水(教科書 17.7 節を参照)
2級アルコールなので、酸触媒での脱水には厳しい条件が必要である。穏やかな条件で脱水するための条件は、ピリジン中の塩化ホスホリルを用いる方法である。問題 17.12 参照。
POCl3 / pyridine, 0 ℃
(c) カルボニル化合物とグリニヤル試薬による3級アルコールの合成
(a) の条件で生じた cyclopentanone に、methyl magnesium bromide , CH3MgBr を反応させるとよい。
(c') アルケンへの水和によるアルコールの合成
目的のアルコールは3級であるから、安定なカルボカチオンを経由し、水の付加によりアルコールを生じるオキシ水銀化法(または、酸触媒による水和)が適している。原料として用いることができるアルケンは、1-methylcyclopentene または、methylenecyclopentane のいずれでもよい。
1-methylcyclopentene は、(c) で生じさせた 1-methylcyclopentanol より脱水で合成可能であるが、1-methylcyclopentanol の合成法としては本末転倒である。methylenecyclopentane は、wittig 反応(教科書 19.12 節を参照)により、cyclopentanone およびリンイリド( Ph3P+-CH2- )とから合成できる。
(d) アルケンへの水和によるアルコールの合成
(c) で生じさせた 1-methylcyclopentanol からの脱水により合成した 1-methylcyclopentene を原料にすることを考えると、オキシ水銀化法(および酸触媒による水和)では、より安定なカルボカチオンを経由するため、3級のアルコールである 1-methylcyclopentanol が得られる。これとは逆の位置選択性で水和させるため、ヒドロホウ素化反応を用いると良い。ヒドロホウ素化反応の立体選択性は、シン付加であるため、trans-2-methylcyclopentanol のみが得られる。
(d') エポキシドの開環によるアルコールの合成(教科書 18.7 節を参照)
1,2-epoxycyclopentane に methyl magnesium bromide, CH3MgBr を反応させると、グリニヤル試薬が3員環を構成する炭素に背面より求核攻撃し、選択的に trans-2-methylcyclopentanol のみを与える。
1,2-epoxycyclopentane は、(b) により生じさせた cyclopentene を過酸で処理することにより得られる。
類似の条件として、1-methyl-1,2-epoxycyclopentane にヒドリドを付加させることを考えると、通常の中性(またはアルカリ性)条件下では SN2 的に、立体的に空いている炭素に求核攻撃するから、主として 1-methylcyclopentanol が得られると考えられる。酸性条件下、プロトン化されたエポキシドは SN1 的に、アルキル置換基の多い側の炭素に求核攻撃を受けるが、プロトン( H+ )とヒドリド( H- )を共存させることはできない。(互いに反応して H2 を生じてしまう。)
(d") カルボニル化合物のヒドリド還元によるアルコールの合成
2-methylcyclopentanone をヒドリド還元することにより 2-methylcyclopentanol が得られるが、通常の均一溶液中での反応では、立体特異性が無いため、trans-体と cis-体の混合物になってしまうと考えられる。
17.41-17.50 (38-47)
17.41, 38
(a), (c) の試薬は酸である。3級アルコールと酸の反応では、SN1 and/or E1 反応が起きる。Br- は、求核種としてはたらくが、HSO4-(や、SO42-)は、ほとんど求核種としてはたらかない。
(b) は塩基である。17.34 のヒントも参照すること。ただし、この問題では分子内での反応が起きるような官能基は持たない。
(d) 17.8 を参照のこと。類似の反応を示す試薬はさまざまであるが、クロム(Cr6+ → Cr3+)系のものでは、CrO3, Na2Cr2O7, PCC などが代表的なものである。
(解答例)
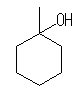
1-methylcyclohexanol は、3級アルコールである。
(a) 求核置換反応 1-bromo-1-methylcyclohexane
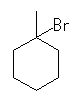
まず、水酸基がプロトン化され( -OH2+ )、中性の水が脱離する。続いて(または、協奏して)臭化物イオンによる求核攻撃が起きる。
(b) 酸塩基反応 sodium 1-methylcyclohexanolate
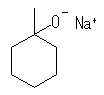
ヒドリドが塩基として働き、酸性度の高い水素を引き抜く。上記ナトリウム塩以外に、水素( H2 )が生じる。
(c) 脱離反応 1-methylcyclohexene
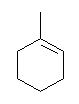
(a) と同様にまず水酸基がプロトン化される( -OH2+ )。中性の水が脱離すると、3級のカルボカチオンとなる。求核種がないので、続いて溶媒である水が弱い塩基として働き、カルボカチオンよりプロトンを脱離させ、アルケンを生じる。この際、より安定な多置換アルケンを与える。下の構造の methylenecyclohexane は、主生成物にならない。
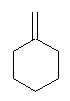
(d) 反応しない。
3級アルコールは、sodium dichromate では酸化されない。
Na2Cr2O7 の各原子について、酸化数を確認しておこう。Na+ イオンとなるから、Na は +1 である。また、酸化物をつくっている酸素は -2 であるから、Na2Cr2O7 という中性の電荷の分子に対し「+2(Na×2) -14(O×7) + Cr×2 = 0」であるから、Cr の酸化数は +6 である。これは、CrO3 における酸化数と等しいことが確認できる。
(発展2)
アルコールの金属塩はアルコキシド(alkoxide)、アルコラート(alcoholate)と呼ばれる。これらは一般に、接尾辞 -ol に代えて、接尾辞 -olate オラートを用いて命名する。RO- 置換基に短縮名が認められている場合、置換基の短縮名の -oxy を -oxide としたアニオンの短縮名(methoxide メトキシドなど)が認められている。
IUPAC命名法において、アルコキシ基のうち短縮形が認められているのは、次の9つ。
methoxy, ethoxy, propoxy, butoxy, pheoxy, (以上5つは置換基をのせて誘導体として命名することができる。例 bromomethoxy など。)
isopropoxy, isobutoxy, sec-butoxy, tert-butoxy
17.42, 39
まずは、系統名より、構造を書いてみること。
ベンゼンを出発物質とするのだから、水酸基、メチル基、イソプロピル基をそれぞれ導入しなければならない。これらの置換基を導入(ベンゼン→フェノール、ベンゼン→トルエン、ベンゼン→クメン)するための方法について、整理して列挙しておく。
次に、置換基を導入する順序を考えながら、それぞれの置換基の示す配向性に注意してどのような位置に次の置換基が導入されるかを考えながら試行錯誤する。例えば次の段落。
フェノールは、水酸基が共鳴によりパイ電子系に対して強い電子供与効果( +R 効果、または +M 効果)を示すから、芳香族求電子置換反応に対して強いオルト・パラ配向性を示す。もし、はじめにベンゼンをフェノールにしてしまったなら、残りの2種のアルキル基は水酸基のオルトおよびパラ位に導入されることになると予想できる。
アルキル基も水酸基に比べると弱いながら、パイ電子系に対して共鳴による電子供与効果を示すから、オルト・パラ配向性であることに注意せよ。
(解答例)
以下のスキームに従って合成することができる。
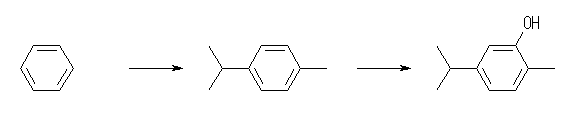
benzene より 4-methyl-1-isopropylbenzene の合成は、Friedel-Crafts アルキル化反応を用いる。教科書 16.3 節参照。メチル基とイソプロピル基の導入の順は、任意である。いずれもアルキル基はオルト・パラ配向性であるが、2つ目の置換基は、立体的な要因からパラ位に導入された生成物が主となると予想される。ただし、Friedel-Crafts アルキル化反応では、出発物質である無置換の benzene よりも、モノアルキル化された基質の方が反応性に富んでいる(Friedel-Crafts アルキル化反応は、芳香族求電子反応であるから、電子供与基であるアルキル基が導入された基質の方が活性化されている。)ため、はじめのモノ置換体を得るところでは必ず混合物が得られるため、蒸留などなんらかの方法で目的物を分取する必要がある。
次の 4-methyl-1-isopropylbenzene より carvacrol の合成は、ベンゼン環のスルホン化と、それに引き続くアルカリ溶融により達成できる。教科書 17.10 節「フェノールの製法と用途」参照。(水酸化ナトリウムでの溶融では、フェノールのナトリウム塩になるから、酸処理することでフェノールが遊離される。)アルキル基は芳香族求電子反応に対してオルト・パラ配向性であるから、スルホン化反応は置換基の電子的効果からは制御されないが、メチル基とイソプロピル基の立体障害効果により、メチル基側で起きると予想できる。芳香環のスルホン化反応については、教科書 16.2 節後半を参照。
17.43, 40
Diesl-Alder 反応は、15章で学習済みである。「有機反応の復習」(16章と17章の間)の復習表1「1.アルケンへの付加」の h) 付加環化反応で、ジエンとエン(ジエノフィル)の反応の形式について整理しておくこと。
上記の例でも、ジエノフィルとしてはたらいているエンはカルボニルに隣接した構造をしている点が、本問題とも共通であることに留意する。なお、ベンゾキノンは、分子内に炭素−炭素二重結合が2箇所あり、2分子のジエンと Diesl-Alder 反応することが可能である。
(解答例)
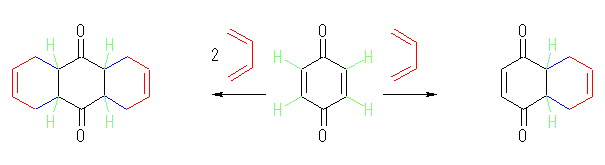
青で示された結合は、反応の進行に伴い、ベンゾキノンの炭素−炭素二重結合、およびブタジエンの炭素−炭素二重結合のそれぞれから電子が供給されて生じている。
反応機構の詳細については、16章と17章の間の「有機反応の復習」において、「C. ペリ環状反応」および、下巻 30章を参照すること。
17.44, 41
フェノールの酸性度については、教科書 17.3 「アルコールとフェノールの性質:酸性度と塩基精度」を参照し、フェノキシドアニオンの安定性で議論せよ。置換基効果とその大きさについては、芳香族求電子置換反応に対する影響について述べた 教科書 16.5 「置換芳香環における置換基効果」 などを参照すること。
「芳香族求電子置換反応に対する影響」と「フェノキシドアニオンの安定性に対する影響」を同じように考えて良い理由は何であるかを、自分なりに整理しておくこと。
(解答例)
強い電子吸引性基が置換するほど、フェノキシドアニオンが安定となる。共鳴を用いたこの説明については、教科書 17.3 節「アルコールとフェノールの性質:酸性度と塩基性度」を参照せよ。
methoxy 基は電子供与性基(孤立電子対をもつ酸素の共鳴効果による)であるので、4-methoxyphenol の酸性度が一番低い。続いて、無置換の phenol、4-fluorophenol、4-cyanophenol の順となる。フッ素は、共鳴効果としては電子供与基である(そのために、求電子置換反応に対してオルト・パラ配向性を示す置換基である)が、誘起効果の方が勝り、電子吸引基として働く(そのため、求電子置換反応に対しても不活性化基となり、無置換のものより反応が遅い)。
17.45, 42
nitromethane
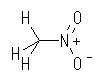
より生じたアニオンは、次のような共鳴式で表される。
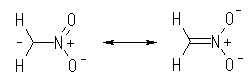
炭素よりも酸素の方が電気陰性度が大きいから、カルバニオンである左の極限構造よりも、右の極限構造の寄与の方が大きい。この反応では、ニトロメタンアニオンが求核剤としてはたらくときに、負電荷を持つ酸素で求核攻撃をしている。
(解答例)
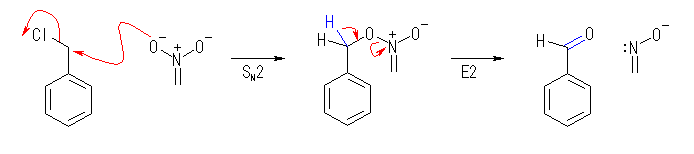
この反応は、人名により、 Hass - Bender Carbonyl Synthesis と呼ばれることがある。
Hass, H. B.; Bender, M. L., J. Am. Chem. Soc., 1949, 71, 1767.
17.46, 43
17.22 (発展)を参照すること。また、17.25 のようにジアステレオマーを生じた系についても参照すること。
NaBH4 によるケトンの還元の反応機構は、ヒドリドによるカルボニルへの求核付加によるものである。このヒドリドによる求核攻撃の際に、プロキラル面( Rectus 面と Sinister 面)が区別されるかどうかを考えればよい。
(解答例)
均一系での反応では、プロキラル面( Rectus 面と Sinister 面)は区別されないから、不斉炭素は生じるが、ラセミ混合物となる。
17.47, 44
まず、生成物の構造を書け。前問同様、17.22、17.25 を参照すること。
ただし、カルボニル炭素は、17.22、17.25、および 17.46 と同様にプロキラルであるが、この問題では、ここに Me- による求核付加が起きたとき、生成物中のこの炭素が不斉とはならない(同じメチル基を2つ持つため)ことに注意しなければならない。
(解答例)
(S)-3-methyl-2-pentanone のカルボニル炭素(2位の炭素)は、プロキラル中心であるが、メチル基が置換しているので、ここに Me- による求核付加が起きて3級アルコールが生じても、この2位の炭素は不斉ではない。しかしながら、光学活性な出発物質の3位の炭素が不斉であるが、この部分の立体は2位の炭素上での反応の前後で保存されるため、生成物もまた光学活性である。
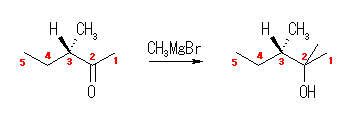
17.48, 45
まず、出発物質と生成物の構造を見比べて、どこでなにが起きているのかをあきらかにする。それは、アルキル基の転位と酸性条件下のアルコールからの脱水である。
17.38、17.39 を参照すること。
(解答例)
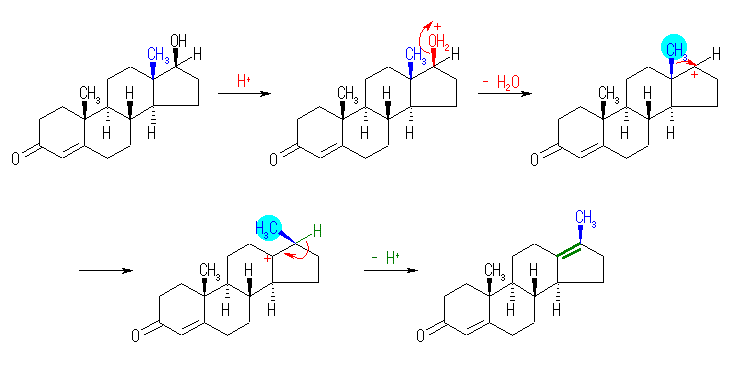
17.49, 46
構造式を見比べることにより、どこで何が起きているのかに気付くこと。17.36 と同様、ここでは炭素−炭素二重結合の還元(水素化)と、アルコールとケトンの間の変換(酸化・還元)である(教科書 17.8 節を参照)。選択的な反応とするためにはどのような試薬が用いられるか。
(解答例)
(a) 2級アルコールからケトンへの酸化反応
PCC / CH2Cl2, or CrO3 / H3O+ など。
(b) ケトンからアルコールへの還元
1) LiAlH4 / Et2O
2) H3O+
ケトンの還元であるから、NaBH4 も選択肢になりうるが、これについては(発展)の項を参照すること。
(c) 2級アルコールからケトンへの酸化反応、および、炭素−炭素二重結合の接触水素化
1) PCC / CH2Cl2, or CrO3 / H3O+ など。
2) H2 / Pd-C
ただし、1) と 2) の順は、逆でも良い。
(d) ケトンからアルコールへの還元、および、炭素−炭素二重結合の接触水素化
1) NaBH4 or LiAlH4 / Et2O
2) H3O+
3) H2 / Pd-C
ただし、1), 2) と 3) の順は、逆でも良い。
α,β-不飽和カルボニル化合物( C=C-C=O )における炭素−炭素二重結合は、その他の炭素−炭素二重結合とは若干異なる反応性を示すことがある。
通常、NaBH4 や LiAlH4 などのヒドリド還元剤は、炭素−炭素二重結合に影響を与えずにカルボニル基を還元(カルボニル炭素の正の部分電荷に対し、ヒドリドが求核的に攻撃)するが、α,β-不飽和カルボニル化合物のカルボニル基に共役した炭素−炭素二重結合は、基質の種類や反応の条件等によってはこれらのヒドリド還元剤により還元され、飽和のアルコールを与えることがあることが知られている(カルボニル基も還元される)。これは、カルボニル基に共役することで、炭素−炭素二重結合が分極しているためである。(関連して、教科書 19.14 節「α,β-不飽和アルデヒドおよびケトンに対する共役求核付加」も参照。)この他にも、同様に炭素−炭素二重結合が分極するようなエナミン( enamines )や、1,1-diarylethenes でも、ヒドリド還元剤により炭素−炭素二重結合が還元される例が知られる。
カルボニル基に共役した炭素−炭素二重結合の還元は、LiAlH4 よりも NaBH4 で、(いつも起きるわけではないが、)より起きやすいことが知られている。LiAlH4 では、このような「二重の」還元が起きる例は少ない。従って、α,β-不飽和カルボニル化合物中のカルボニル基のみを選択的に還元する目的では、アルデヒドやケトンであっても、一般的に NaBH4 よりも LiAlH4 を用いる。
17.50, 47
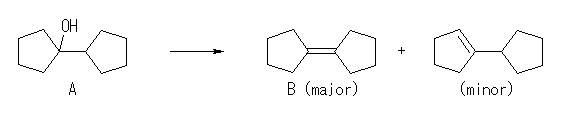
A と B の分子式を比較すると、希硫酸による A から B への反応は、脱水であることが判る。このような反応を起こす含酸素化合物 A は、アルコールで、B は少なくともその脱水によって生じた二重結合を持つ。二重結合(アルケン)とオゾンの反応については、教科書 7.8 「アルケンの酸化:ヒドロキシ化と開裂」を参照すること。
(解答例)
解答する際には、構造のはっきりしているところから逆に反応を辿るとよい。
「 B は、オゾン処理、ついで酢酸中亜鉛で還元すると cyclopentanone のみを与える」ことより、下スキームのように、B は bicyclopentylidene である。
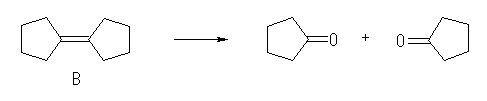
「 A を希硫酸により脱水することにより B を生じる」ことから、A の構造は、B に水和させた構造である。また、この脱水反応の際には、多置換アルケンである B が主生成物として得られるが、右のような cyclopentylcyclopentene が副生成物として得られると考えられる。
17.51-17.60 (48-57)
17.51, 48
trans-2-methylcyclopentanol の構造は次の通りである。
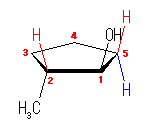
生成物が 3-methylcyclopentene であるということは、脱水反応において、水酸基とともに脱離しているプロトンは、いずれの炭素からであるかを、実験結果として整理する。
次に、この反応が syn 脱離であるならば、図中の赤い色で示したプロトンとの間で脱離を起こす可能性がある。また、anti 脱離であるならば、図中の青い色で示したプロトンとの間で脱離を起こす可能性がある。実際に観測されているのは、どちらか。それぞれの脱離において生成する可能性のあるシクロアルケンについて、その安定性も考慮して議論する。
(解答例)
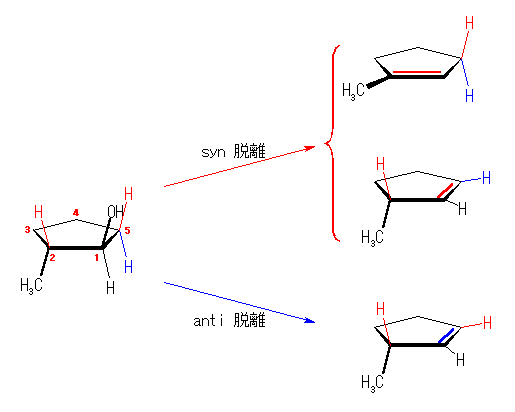
もしこの脱離が syn でも進行するならば、上のスキームに示したように赤い色で示したプロトンとの間で脱離が起こるから、1-methylcyclopentene と 3-methylcyclopentene を生成する可能性がある。この2つのシクロアルケンは、二重結合に置換したアルキル基の多い前者でより安定であるから、主生成物は 1-methylcyclopentene となるはずである。
この反応が anti で進行するならば、上のスキームに示したように赤い色で示したプロトンとの間で脱離が起こるから、3-methylcyclopentene を生成する。これは、実験事実と合致している。
従って、この脱水反応の立体化学は、anti である。
17.52, 49
多段階での反応( A → B → C → … → Y → Z )を考える必要がありそうな場合は、迷路を出口から辿るように、合成ルートを逆に辿り、最終生成物から考えはじめる。まず、自分の知っている範囲の中から、最終生成物を与える反応( Y → Z )を考えるようにする。次に、この反応における出発物質を与えるような反応( X → Y )を考える。これをくり返して、ベンゼンおよび炭素数6以下のアルコールからの反応( A → B )に辿り着けばよい。
最終生成物 Z を与えることのできる反応を3つ知っていたなら、Y1, Y2, Y3 を3つともノートに書く。これらを与えることのできる反応を、それぞれ3つずつ知っていたなら、X の候補は9つとなる。このように、最終生成物 Z から始めて、そこに辿りつく可能性のある合成ルートは樹状に広がっていく。いくつかの枝は、自分の知識の範囲では合成ができないものから出発することになっても構わない。いずれか一つでも出発点に辿りつければよい。また、このような問題において、答えは必ずしも1つとは限らない。むしろ複数の経路で合成できるものが普通である。
(解答例)
スキーム中では、繁雑になるので反応条件は省略したが、解答作成にあたっては、それぞれの反応条件も把握しておく必要がある。スキーム中では、炭素数の増える反応は枠で囲んで示した。
(a)
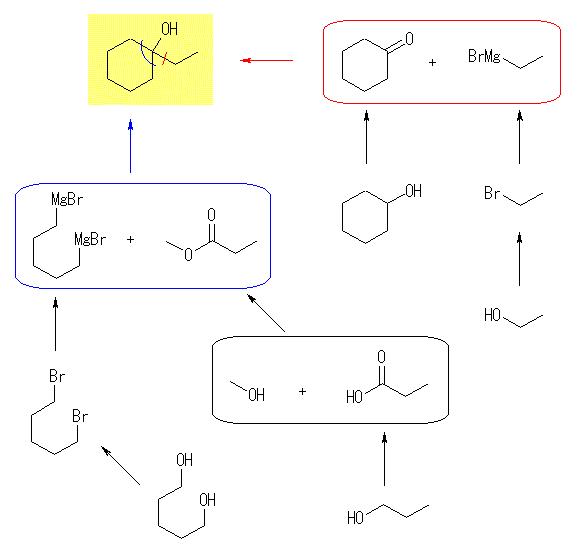
3級のアルコールなので、カルボニル化合物の還元では得られない。カルボニル化合物に対するグリニヤル試薬の求核付加反応の例を2ルート示した。黒枠の、エステルの合成については、教科書 21.3 節を参照。
(b)
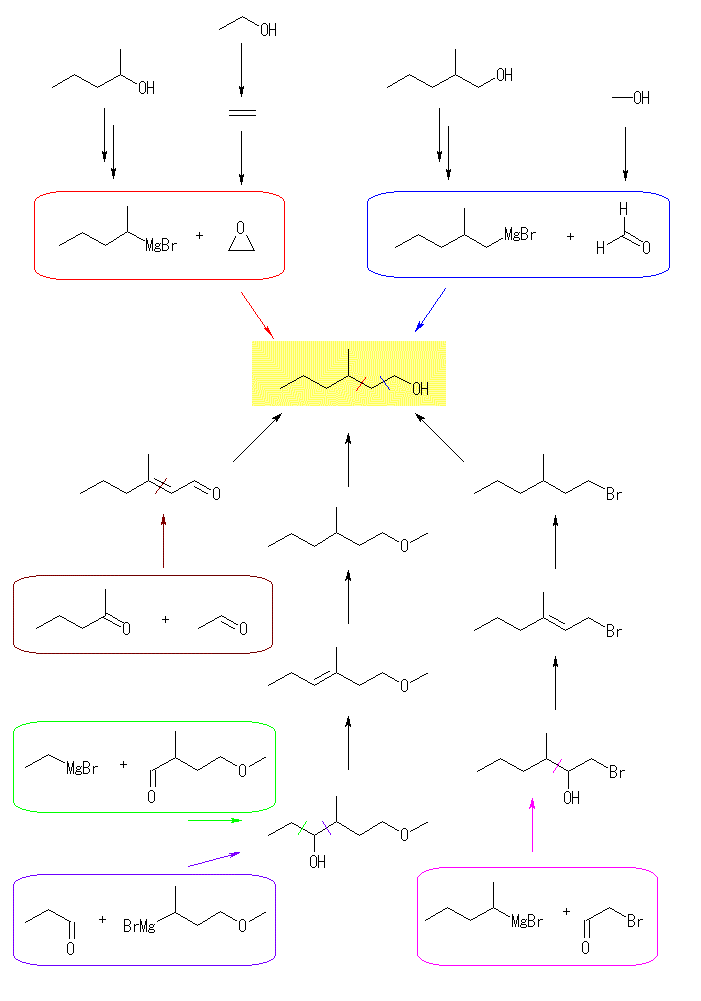
グリニヤル試薬とホルムアルデヒド、エチレンオキシドの反応による炭素鎖伸長反応が青、および赤で示した反応である。グリニヤル試薬は、対応するアルコールより、ハロゲン化アルキルを経由して合成可能である。また、エチレンオキシドの合成については、教科書 18.7 節を参照。
アルコールを、対応するカルボニル化合物の還元で得る方法を考えたのが、茶色のルートである。2-pentanone と ethanal (いずれも対応するアルコールの酸化で得られる)は、アルドール縮合反応(教科書 23.2 節、23.4 節を参照)により、3-methylhex-2-enal を与える(茶色枠)。実際には、2種のカルボニル化合物からアルドール反応させようとすると、4種の生成物が生じてしまうため、あまり良いルートではない。
アルコールを、対応するハロゲン化アルキルの加水分解で得るルートは、桃色でその一例を示した。炭素数の増加反応では、グリニヤル試薬とアルデヒドの付加反応を用い、一旦生じた水酸基は二重結合としたのち、接触水素化で還元してしまうようにした。これにより、新たに生じさせる炭素−炭素結合の位置を、最終生成物中の水酸基の位置に係わらず、自由に選択できるようになる。2-bromoethanal は、ethanol の酸化で得た ethanal を酸性条件下で臭素化することにより得ることができる。
アルコールは、エーテルの酸開裂によっても合成することができる。分子内に水酸基を持つグリニヤル試薬は生じさせることができないが、アルキルオキシ基(エーテル結合)を持つグリニヤル試薬なら問題なく生じさせることが可能となる。そのため、紫枠のような反応ルートも可能となる。紫枠内のグリニヤル試薬の原料となるハロゲン化物は、3-buten-1-ol を原料としてエーテル合成(教科書 18.3 節参照)したのち、ここで得られた 1-methoxy-3-butene に臭化水素を付加させると得られる。緑枠内のようなアルデヒドは、3-methyl-3-nutene-1-ol を原料としてエーテル合成し、ここで得られた 1-methoxy-3-methyl-3-butene のヒドロホウ素化により末端位に水酸基を導入し、PCC で酸化するなどして合成する。
(c)
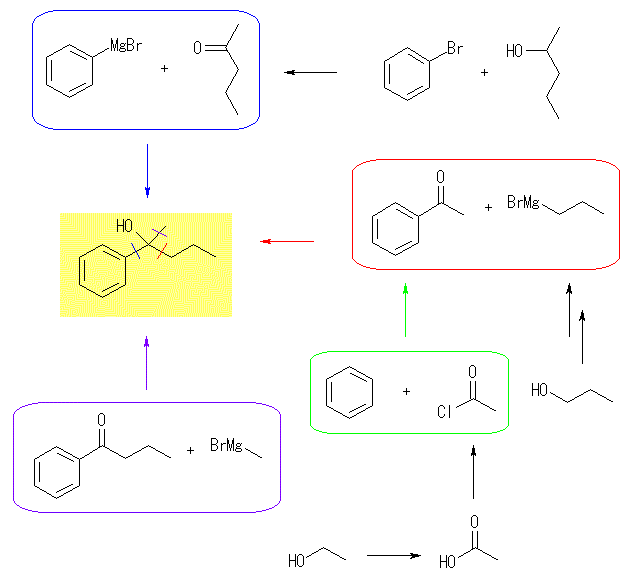
3級のアルコールなので、カルボニル化合物の還元では得られない。カルボニル化合物に対するグリニヤル試薬の求核付加反応を考えるとよい。青枠のように、アルコールの酸化で得られるようなカルボニル化合物との反応の他に、黄緑および紫の枠のような芳香族ケトンとアルキルグリニヤルの反応も考えられる。芳香族ケトンは、ベンゼンに対する Friedel-Crafts アシル化で合成することが可能であるが、その際のアシルクロリド(カルボン酸ハロゲン化物)は、カルボン酸経由で対応するアルコールから合成可能である。
(d)
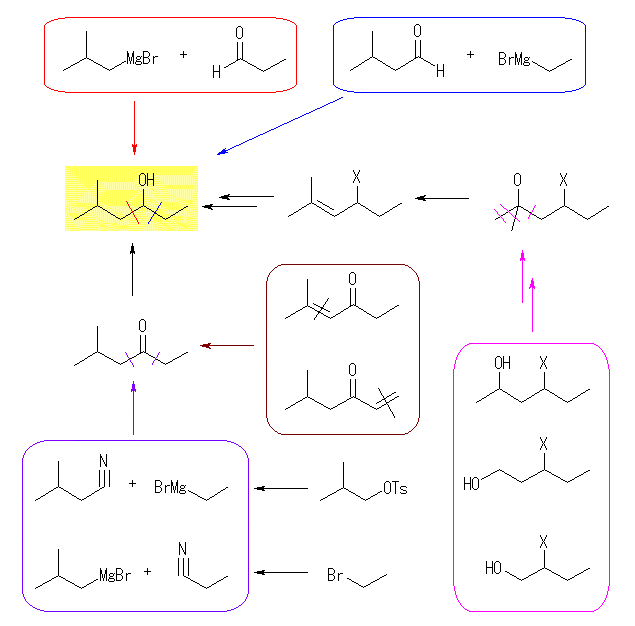
2級のアルコールは、対応するアルデヒドとグリニヤル試薬の反応から得られる(赤、および青)ほか、対応するケトンのヒドリド還元によっても得られる。このケトンは、アルドール縮合によっても対応するものが得られる(茶色)が、(b)のときと同様、混合物が得られるため良いルートではない。また、ニトリル類とグリニヤル試薬の反応によってもケトンが得られる(紫色)。ニトリル類は、炭素数の一つ少ないアルコールを、アルキルハライドやトシラートに変換したのち、シアン化物イオン( CN− )で求核置換させることで得られる。
(b)と同様に、アルコールを、対応するハロゲン化アルキルの加水分解やエーテルの酸開裂によって合成することを考えると、桃色の枠(X は、ハロゲン、またはアルキルオキシ基など)で囲んだようなアルコールから数段階で合成することができると考えられる。
17.53, 50
まず、出発物質と生成物の構造を比較して、どの置換基がどの炭素からどの炭素の上へ転位しているのか、整理すること。
炭素骨格が転位しているので、カルボカチオンを経由しているはずである。3級アルコールを酸で処理しているのであるから、はじめに水酸基がプロトン化を受け、-O+H2 となり脱離するところから反応は始まる。
(解答例)
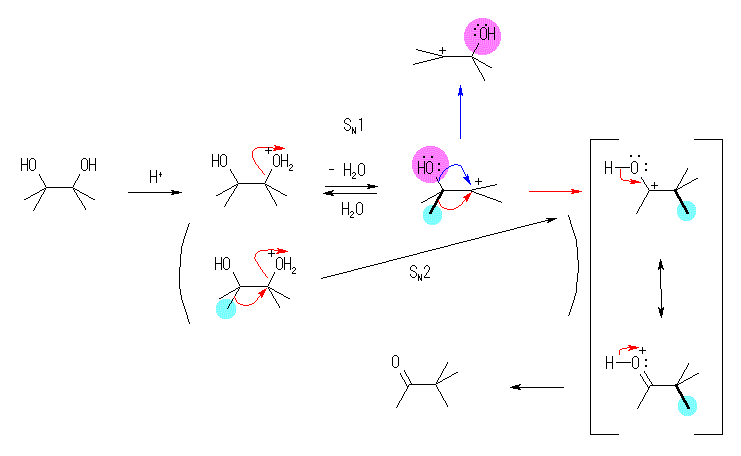
この転位反応を、分子内の求核反応として捉えるならば、脱離基が(プロトン化をうけた)水酸基、求核種はとなりの炭素から転位してくるアルキル基である。
pinacol は、3級アルコールだから、プロトン化を受けたあと、SN1 的に脱水してカルボカチオンを生じる。
このカルボカチオンに、水が求核的に付加すると原料に戻り、水酸基が転位(青矢印)しても構造は変わらない。メチル基が転位して生じるカルボカチオンは、その正電荷が水酸基の付け根にあるので、プロトン化を受けたケトンと共鳴関係にある。これよりプロトンを失うと生成物である 3,3-dimethyl-2-butanone ( pinacolone ) を生じる。
上のスキームでは、アルキル基の転位と水酸基からの脱プロトン化が順に起きているように表現されているが、これらが協奏的に起こることにより、アルキル基の転位が起きやすくなっていると考えることもできる。
17.54, 51
教科書 4.11 「一置換シクロヘキサンの立体配座」、4.12 「二置換シクロヘキサンの配座解析」を参照すること。
(解答例)
tert-butyl 基は、反転可能なシクロヘキサンでは必ずエカトリアル位にくるから、trans-4-tert-butylcyclohexanol と、cis-4-tert-butylcyclohexanol は、それぞれ、次の配座をとる。
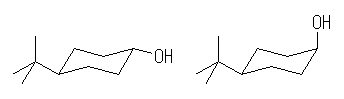
従って、一般則に従い、アキシャルアルコールであるcis-体で速く酸化される。
17.55, 52
17.52 と同様に、逆合成の手法で考える。
(解答例)
いくつかのルートが考えられる。
1つは、cyclohexanone に、グリニヤル試薬( cyclohexyl magnesium bromide )を反応させ、生じるアルコールの脱水により bicyclohexylidenen とする反応である(スキーム中段)。
cyclohexanone をアルカリ性条件下、エノラート(教科書 22章 参照)としたのち、アルドール縮合(教科書 23.2 〜 23.4 節 参照)させることで、2-cyclohexylidenecyclohexanone とし(スキーム下段)、ヒドリド還元によりアルコールへ変換、さらに、臭素化、グリニヤル試薬として水などのプロトンソースと反応させることにより水酸基を還元する手法により目的生成物を合成可能である。
また、bromocyclohexane をリンイリドに変換したのち、カルボニル化合物と反応させてアルケンを得る Wittig 反応(教科書、19.12 節参照)(スキーム上段)によっても、目的のアルケンを得ることが可能である。
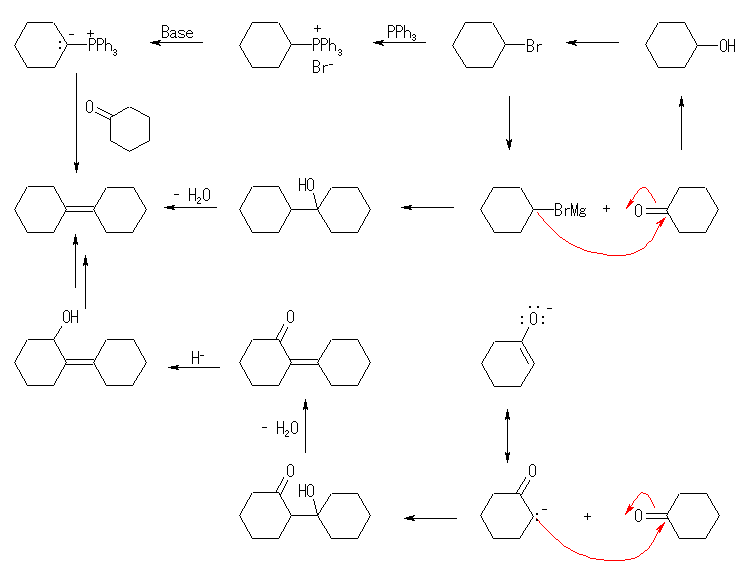
17.56, 53
教科書 17.8 「アルコールの酸化」の終わりあたりにまとめられている、クロム酸エステル中間体を形成する、アルコールの酸化反応の反応機構を参考にしながら、この反応機構での生成物(教科書では「カルボニル生成物」と記載)が、酢酸エチルであるような式を書いてみること。この式と、問題文であたえているヒント(「アルデヒドとアルコールの間の可逆反応」で与えられた式)とを見比べること。
(解答例)
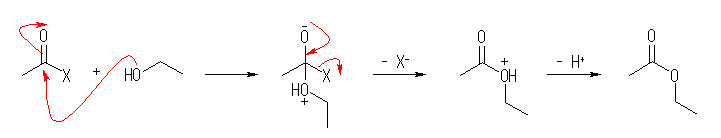
カルボン酸無水物、カルボン酸ハロゲン化物など、カルボニル炭素上に脱離基( -X )を有するカルボニル化合物は、アルコールと反応して、カルボニル求核置換反応により、エステルを生成する。その反応は、上のスキームのようになる。これと比較して、アルデヒド、ケトンなどのカルボニル化合物は、カルボニル炭素上に脱離基をもたないから、カルボニル求核付加までは進行しても、カルボニル求核置換反応は起こさない。(ヒドリドが脱離するような、下スキームのカッコ中の反応は起きない。)
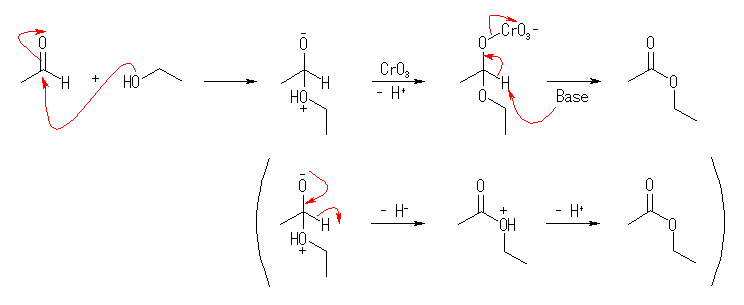
1分子のアルコールがアルデヒドに求核付加したものは、ヘミアセタールである。このヘミアセタールが、三酸化クロムと反応すると、教科書 17.8 節のスキームに従って、クロム酸エステル中間体を形成し、ここからのクロム酸の2分子脱離によりカルボニル化合物(ここでは、目的とするエステル)が得られる。
17.57, 54
該当する反応条件は、それぞれ複数のこたえが考えられる場合もある。いずれかを答えればよいが、自分の整理としてはいろいろな場合についてまとめておくと良い。
(解答例)
反応条件の例のみを示す。
(a) ヒドリド還元の場合、LiAlH4 / Et2O または、NaBH4 / EtOH のいずれも可。
BH3 / Et2O によっても還元できる。
(b) HBr または PBr3 など。
(c) Mg / Et2O でグリニヤルとした後、ホルムアルデヒド ( H2C=O ) と反応させる。
(d) PCC / CH2Cl2 で酸化。他にも可能な条件はいくつかあるが、酸性の CrO3 など、カルボン酸まで酸化されてしまうものと区別すること。
(e) グリニヤル試薬 ( PhCH2MgBr ) による求核付加。つづいて、グリニヤル試薬との反応で生じたアルコラートをアルコールにするため、弱酸で処理(条件としては、H3O+ と書かれる)。
(f) ピリジン中、塩化ホスホリル ( POCl3 ) による脱水。
(17.58-17.60 は、現在準備中です。)