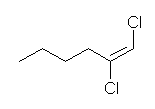
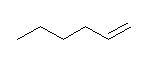
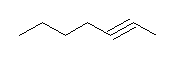
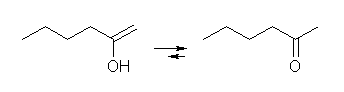
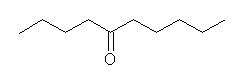
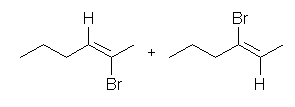
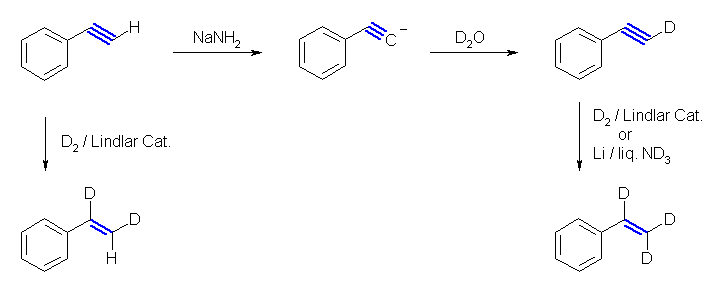
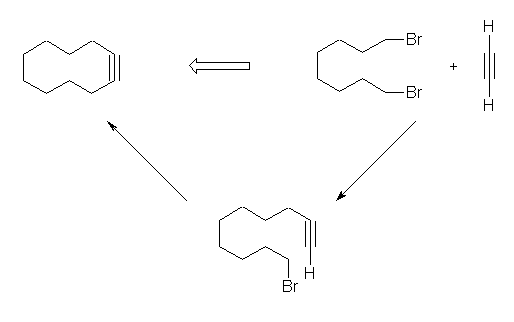
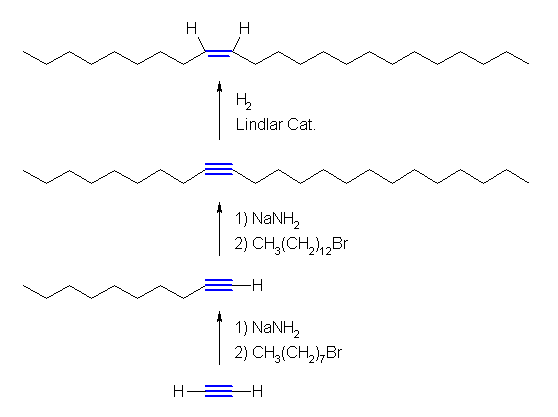
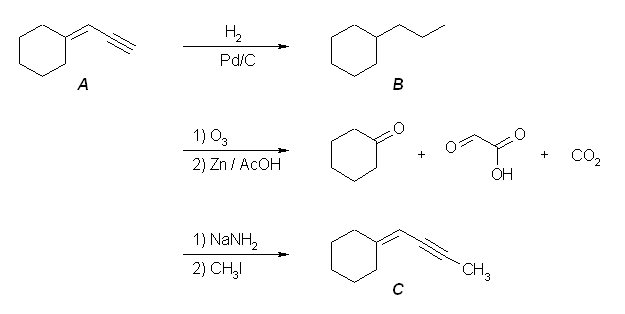
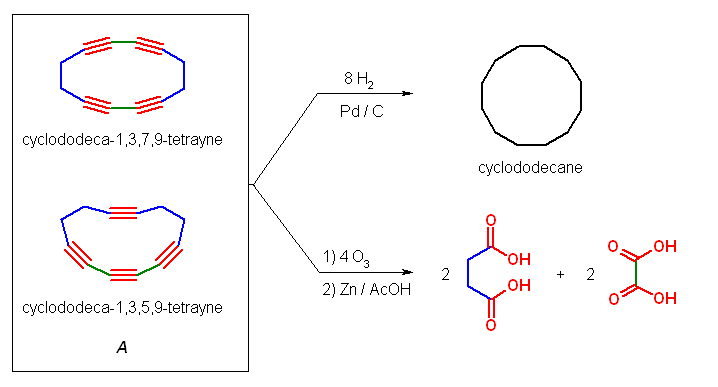
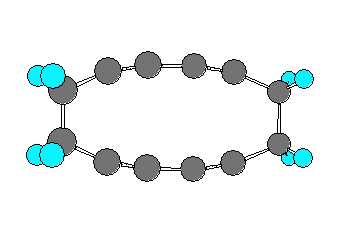
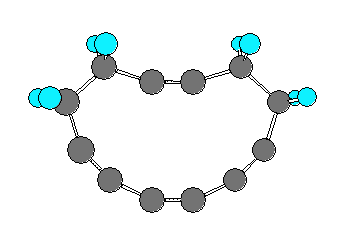
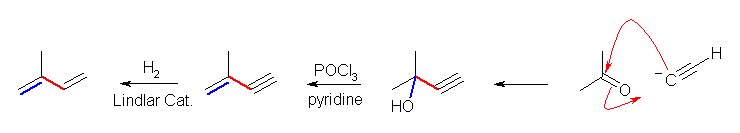
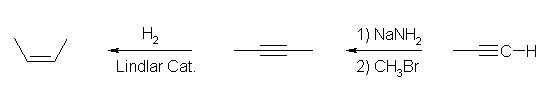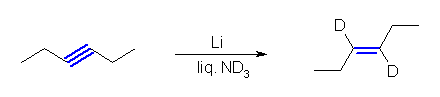7.01-7.10
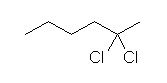
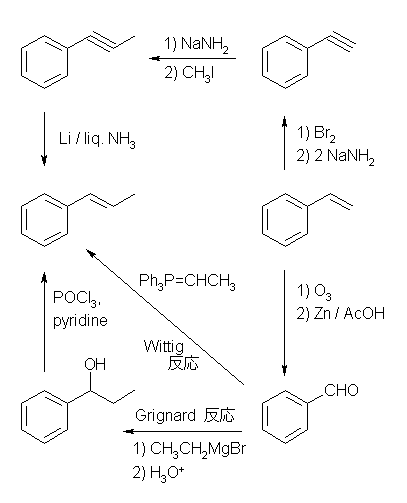
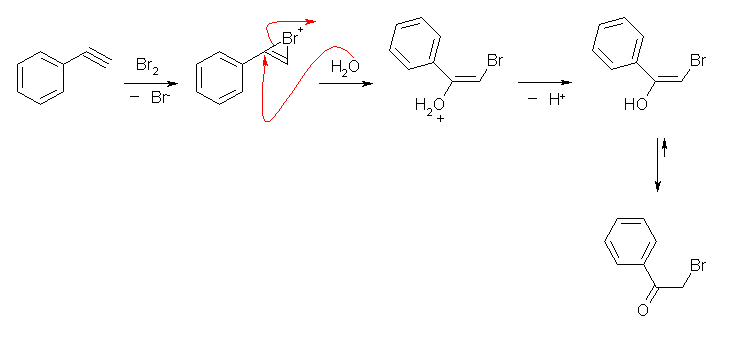
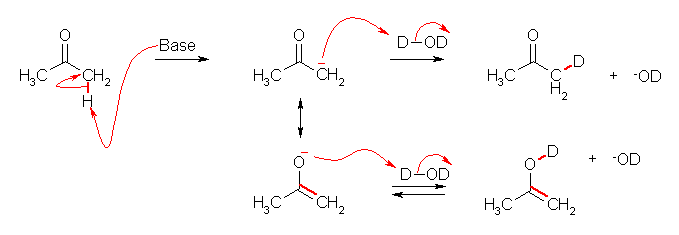
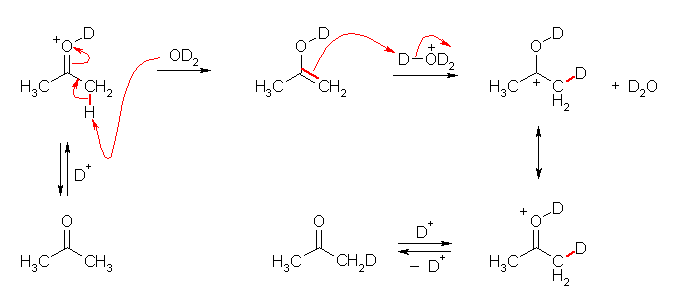
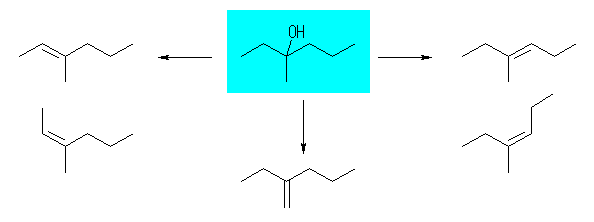
7.01
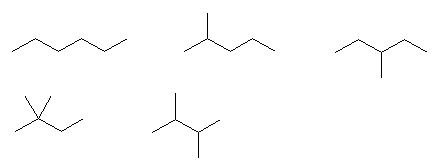
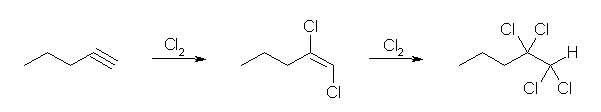
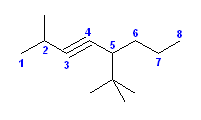
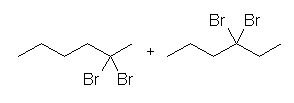
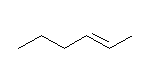
2級以上のハロゲン化アルキルは、ハロゲンの結合した炭素と隣接した炭素が2つ以上ある。これをアルカリで処理すると、隣接した炭素の水素との間で脱離が起き、アルケンの混合物を与える。
(解答例)
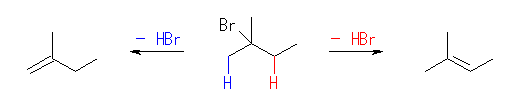
2-methyl-1-butene または 2-methyl-2-butene が生じる可能性がある。
ハロゲン化アルキルからの、塩基によるハロゲン化水素の脱離反応における電子の動きは次図の通り。
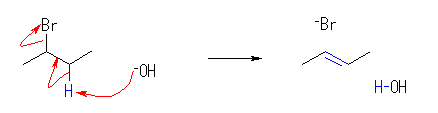
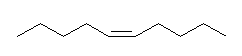
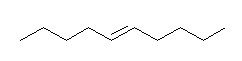
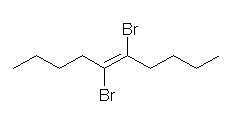
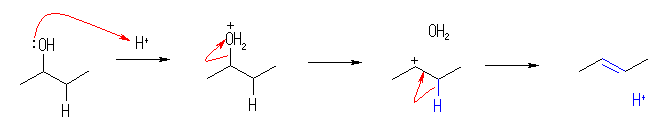
7.02
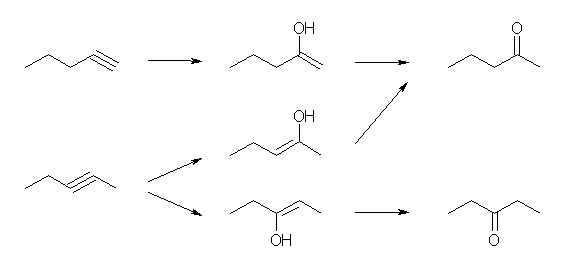
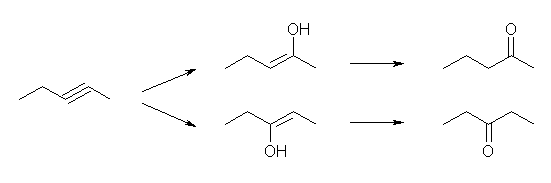
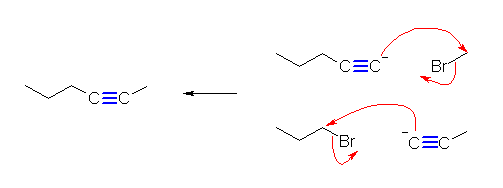
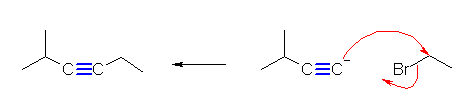
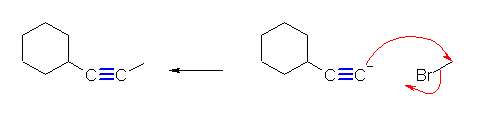
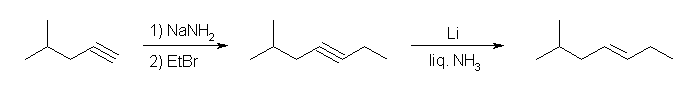
(解答例)
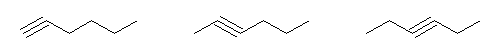
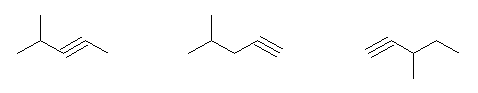
(E)- および (Z)-3-methyl-2-hexene、2-ethyl-1-pentene、(E)- および (Z)-3-methyl-3-hexene の5種類。
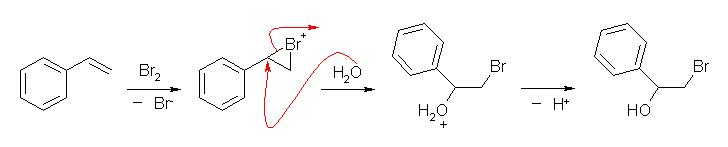
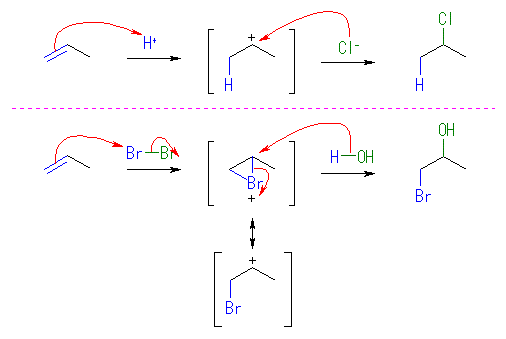
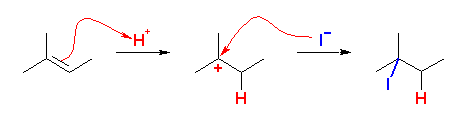
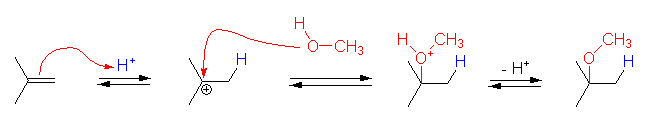
水酸基の酸素の孤立電子対(ルイス塩基)に、プロトンが配位すると R-OH から R-OH2+ が生じる。OH- は脱離基としての性質をあまりもたないから、R-OH から R+ が生じる反応は起きにくいが、H2O は脱離しやすいので、R-OH2+ からは容易に R+ を生じる。こうして生じたカルボカチオンがプロトンを失うと(アルケンにプロトンが付加してカルボカチオンが生じる反応の逆反応)アルケンを生じる。
7.03
(解答例)
アンチ付加なので、シクロアルケンに対しては、トランス体を与える。
すなわち、立体選択性があり、アンチ付加である。
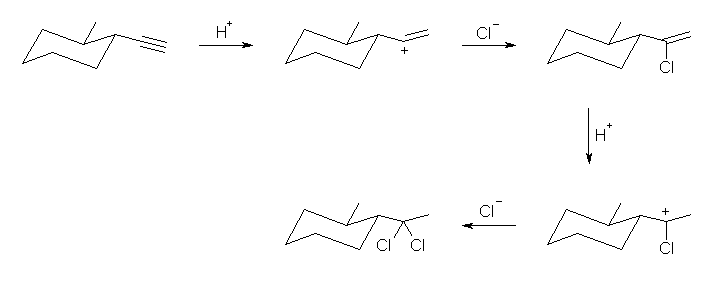
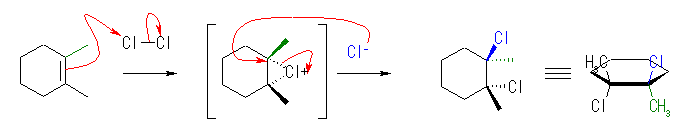
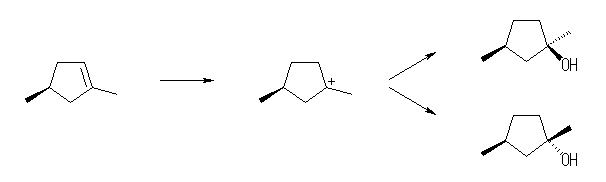
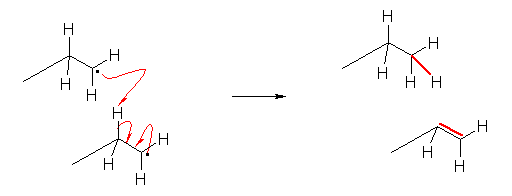
7.04
前問と比較して考えること。ハロゲン化水素との反応では、プロトンの付加によりカルボカチオン中間体を経由する。正電荷をもつ炭素は、sp2 混成をもち、平面3配位構造となっているから、ハロゲン化物イオン(求核種)は、その面の上下のいずれからでも攻撃できる。すなわち、形式としてアンチ付加とシン付加の両方が半々の割合でおこる。
(解答例)
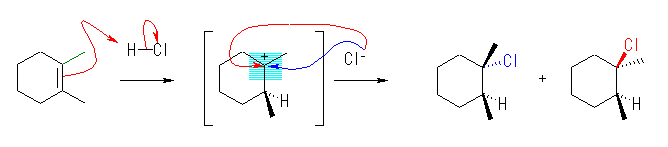
上図のような反応機構で進行する。中間体のカルボカチオンが平面構造をもち、塩化物イオンの反応が面の上下から(ほぼ)等しい確率でおこるため、生成物に立体選択性がみられないと考えられる。
上図において、生成物中の2つのメチル基が、それぞれシス配置にあるものとトランス配置にあるものが生じている。
すなわち、位置選択性があり、マルコフニコフ則に従う。しかし、立体選択性はなく、アンチ付加、シン付加の区別がなく両方がおきる。
7.05
NBS は、臭素(Br2)を少量ずつ系中で発生する試薬である。したがって、アルケンと Br2 との反応でジブロモ体を得たときと同じ中間体を経る。この3員環ブロモニウムイオンが(臭素の濃度が低いため、別の臭素分子や、他の分子で反応して生じた臭化物イオンなどと反応する前に)より高濃度で存在する水と反応する時に、ブロモヒドリンが生じる。教科書 p221 を参照。
(解答例)
ブロモニウムイオンを経由するので(教科書 p221 図7.2を参照)、立体選択性としては、アンチ付加で臭素と水酸基が、隣接する炭素に付加する。位置選択性としては、より級数の高い炭素上に水酸基が置換する(マルコフニコフ配向)。
生成物の構造は下図のようになる。
反応機構を、図 7.2 にならいそれぞれ書いてみること。上のヒントにも述べたように、NBS は、それ自身が反応に直接関与するのではなく、臭素(Br2)を少量ずつ系中で発生する試薬である。
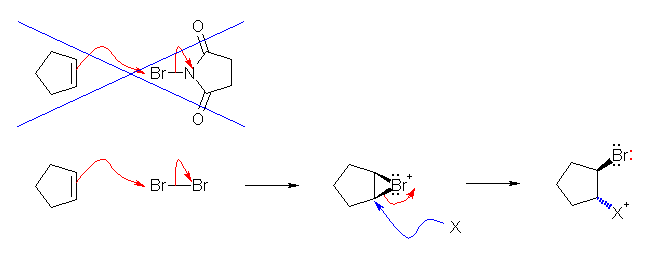
上図において、X は、水分子(H2O)で、酸素の孤立電子対が求核性を示す。生じるのは、プロトン化したアルコール(R-O+H2)なので、さらにプロトンを放出すると、中性のアルコール(R-OH)になる。
7.3 〜 7.5 の解答で示した構造は、それぞれ光学異性体をもつ。すなわち、これらの鏡像異性体も同じ確率で(混合物として)生じているはずである。ただし、鏡像異性体同士は、偏光に対する以外の物性が変わらないので、特に意識して区別する場合以外は断らないこともある。
(発展2)
DMSOなどの高極性溶媒中の水分子は、水分子同士の水素結合がない分、求核性が強い。従って、ハロヒドリンを作るときには、水中で低濃度の臭素と反応させるより、DMSO中に水を加えたものを溶媒として選択することがある。
7.06
7.5 でも示されたが、ブロモヒドリン生成の反応機構を書いてみること。そして、臭化水素の付加反応(マルコフニコフ配向に従う)と対比してみること。
(解答例)
ブロモニウムイオンは、臭素が3員環で結合している2つの炭素のうち、よりカルボカチオンが安定化をうけるような炭素の方に正電荷が非局在化していると考えられる。すなわち、カルボカチオン中間体を仮定した時と同じ生成物を与える。
マルコフニコフ則は、カルボカチオンの安定性により位置選択性がでることを示すのだから、ハロヒドリン生成反応においても同じ配向性であると言える。
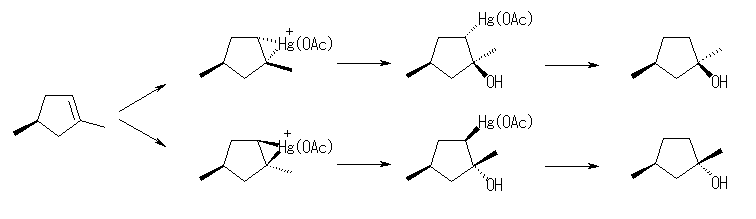
7.07
(解答例)
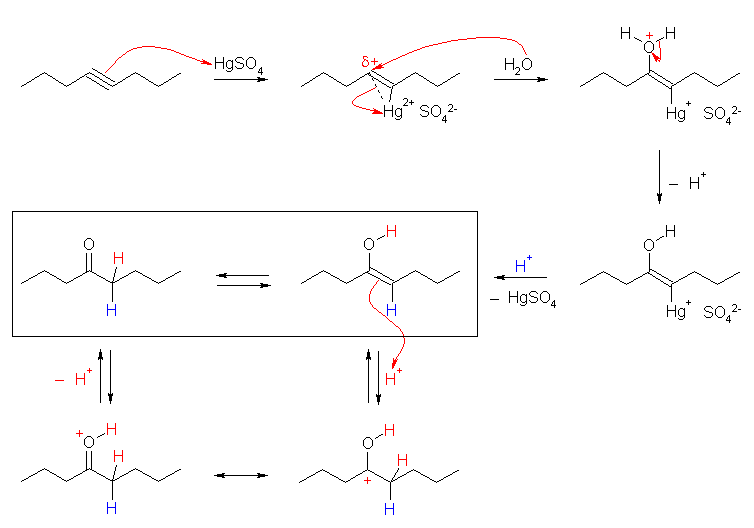
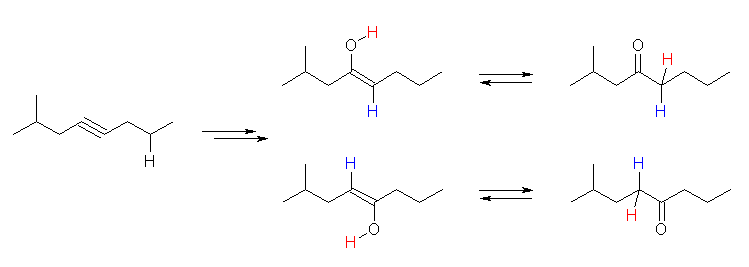
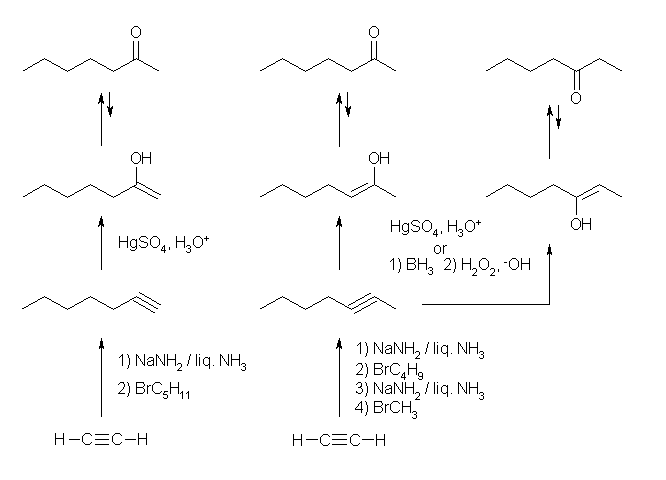
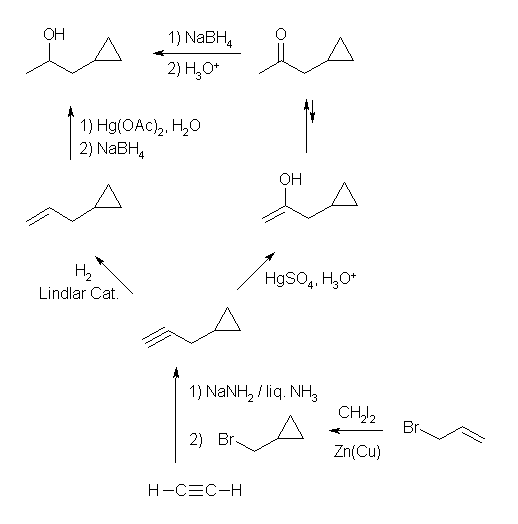
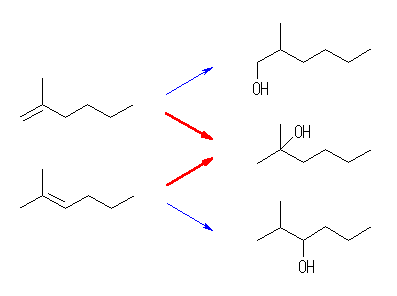
オキシ水銀化法では、マルコフニコフ配向性に従うから、3級や2級のアルコールが生じやすい。
(a) 1-pentene から 2-pentanol
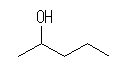
1-pentanol を生じるためには、より不安定な1級のカルボカチオンを通る必要がある。
(b) 2-methyl-2-pentene から 2-methyl-2-pentanol
2-methyl-3-pentanol を生じるためには、より不安定な2級のカルボカチオンを通る必要がある。
7.08
(解答例)
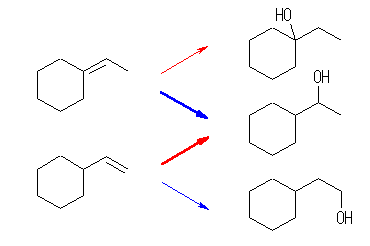
下図で、赤矢印は「オキシ水銀化法」による水和で生じるアルコール、青矢印は「ヒドロホウ素化法」によって生じるアルコール。
(a) 2-methyl-2-hexanol
(b) 1-cyclohexylethanol
7.09
ヒドロホウ素化反応(と、続く酸化反応)で得られるのは、アルコールである。このときの位置選択性に関しては、オキシ水銀化法とくらべて逆の配向性である。
立体的により混み合いの少ない炭素にホウ素が結合し、その位置が水酸基になるからである。
(解答例)
(a) 2-methylpentan-3-ol
(b) 1-cyclohexylethanol
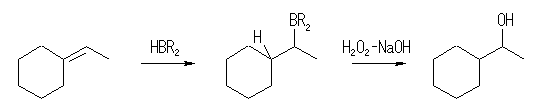
7.10
最終的に、二重結合に -H と -OH が付加する形であるから、水酸基の結合した炭素を含む二重結合を考える。このとき、位置選択性により望むアルコールが得られる場合とそうでない場合がある。7.9 のヒントを参照。
(解答例)
(a) 3-methyl-1-butene
(b) 2-methyl-2-butene
(c) methylenecyclohexane
ヒドロホウ素化とそれに続く酸化によって得られるアルコール合成(逆マルコフニコフ配向)は青矢印で、オキシ水銀化法によるアルコール合成(マルコフニコフ配向)は、赤矢印で示した。
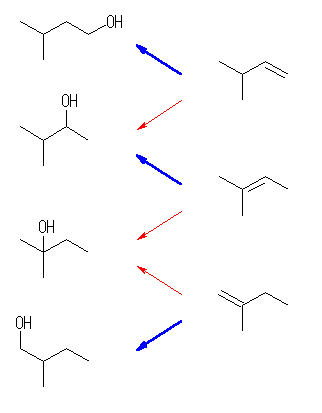
7.11-7.20
7.11
ヒドロホウ素化とそれに続く酸化でアルコールを与えるのだから、位置選択性に関しては逆マルコフニコフ配向である。同じ配向性でありながら、シクロアルカンの置換基(メチル基)のでている方向と同じ面方向からヒドロホウ素化がおきるか、逆の面方向からヒドロホウ素化がおきるかにより生成物が異なる。
(解答例)
逆マルコフニコフ配向での水和により、2,4-dimethylcyclopentanol の2種の立体配置異性体が得られる。
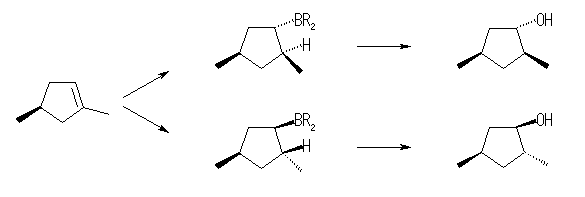
二重結合の炭素は、sp2 混成をしており、平面形3配位の構造を持つ。その面の上下(すなわち、π 電子のでている方向)からボラン(またはジアルキルボラン)がシン付加したのち、立体を保持したままホウ素が水酸基に置き換えられる。この際のメカニズムの詳細については、7.9(a) の解答例を参照のこと。
また、同じ出発物質に対して、カルボカチオン経由の水和反応、またはオキシ水銀化法では、いずれもマルコフニコフ配向での水和となり、1,3-dimethylcyclopentanol の2種の立体配置異性体が得られる。
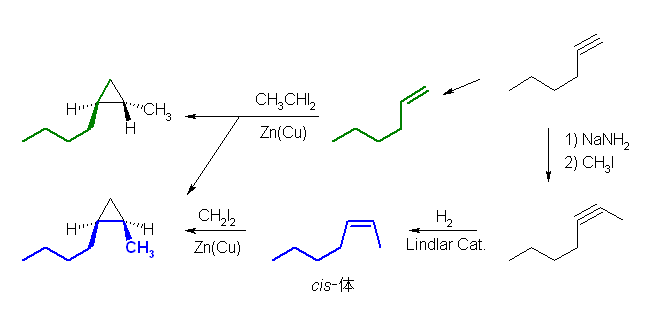
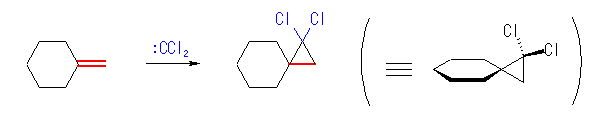
7.12
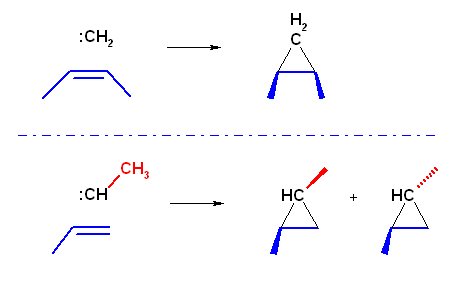
(a) は、ジクロロカルベン( :CCl2 )の発生条件である。
(b) は、Simmons-Smith 反応で、形式的にカルベン( :CH2 )が発生したものとして考えてよい。
(解答例)
(a) 1,1-dichlorospiro[5.2]octane
(b) 1-isobutyl-2-methylcyclopropane
(or 1-methyl-2-(2-methylpropyl)cyclopropnane )
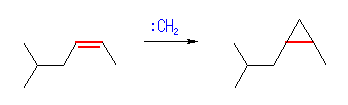
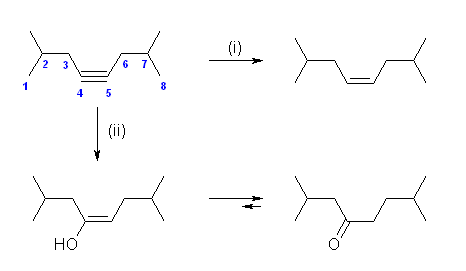
出発物質の 5-methyl-2-hexene の立体が E 体だった場合は、生成物が trans 体に、逆に出発物質が Z 体だった場合には生成物が cis 体になる。
7.13
二重結合の炭素は、sp2 混成をしており、平面形3配位の構造を持つ。接触水素化では、その面の上下(すなわち、π 電子のでている方向)から水素がシン付加する。
(解答例)
(a) 2-methylpentane
(b) 1,1-dimethylcyclopentane
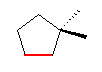
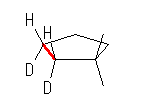
この問題に与えられた出発物質からは、水素のシン付加、アンチ付加ともに同じ生成物を与えるから、水素付加反応における立体を区別して考える必要はないが、水素を重水素( D2 )などに替えることにより、この区別を明かにすることができる。たとえば、(b) からの生成物は、次図のように、2つの重水素原子( D ) がシス配置になった生成物のみが生じる。
7.14
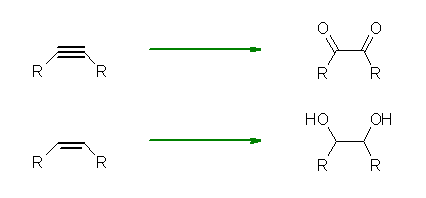
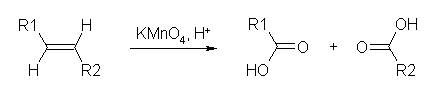
cis-1,2-diol を合成するためには、一般的に、KMnO4 (冷・アルカリ性)を用いるか、OsO4 で処理したのち、NaHSO3 で還元する。いずれも、環状エステル構造の中間体を経由してシン付加となる。また、二重結合1モルに対し、試薬も1モル等量必要となる。
いずれも同じ生成物を与え、二重結合に関与していた2つの炭素に水酸基が結合した化合物が得られる。
(解答例)
(a) 1-methylcyclohexene から。
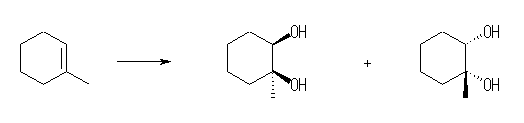
1-methylcyclohexane-1,2-diol
この反応では、シン付加のみがおきるという意味で立体選択性はあるが、その付加が面のどちらからおきるかという面選択性はない。そのため、上で示したような2つの光学異性体の混合物になるはずである。
(b) 2-methyl-2-pentene から。

2-methylpentane-2,3-diol
この反応でも面選択性はない。そのため、上図中に、* の記号で表した不斉炭素(4つの結合がいずれも異なる炭素)の持つ4本の結合同士の幾何配置(立体化学)は、あり得る2種類の両方が等量ずつ生じる(ラセミ体)。(←詳細は、9章を参照のこと)
(c) 1,3-butadiene、または、2-butene-1,4-diol から。
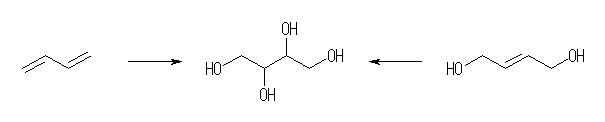
1,2,3,4-butanetetraol
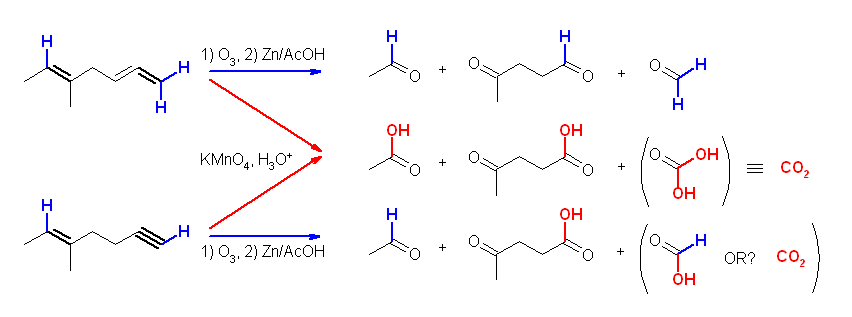
KMnO4 を用いた場合、酸性ではより酸化力が強く、酸化開裂生成物を与えるので注意すること。(オゾン酸化との生成物の比較でまとめておく。)
trans-1,2-diol を合成するためには、エポキシドに対して水酸化物イオンを求核攻撃させる方法をとるとよい。(講義での板書を参照のこと。)
7.15
アルコールを酸化して生じるカルボニル化合物についての表を思い出しておこう。
| 酸化数=1 | 酸化数=2 | 酸化数=3 | 酸化数=4 | |
|---|---|---|---|---|
| (1級アルコール) | CH3OH | H2C=O | HCO2H | H2CO3 ( = CO2 + H2O ) |
| 1級アルコール | CH3CH2OH | CH3CHO | CH3CO2H | - |
| 2級アルコール | (CH3)2CHOH | (CH3)2C=O | - | - |
| 3級アルコール | (CH3)3COH | - | - | - |
(アルコールの水酸基の結合した炭素の酸化数=1、
アルデヒド・ケトンのカルボニル炭素の酸化数=2、
カルボン酸のカルボキシ炭素の酸化数=3)
上表からも、(かなり強い条件にしない限り)ケトンはそれ以上酸化されないが、アルデヒドはカルボン酸まで酸化されうることがわかる。
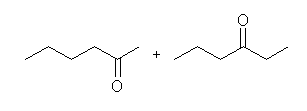
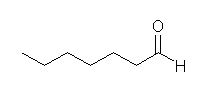
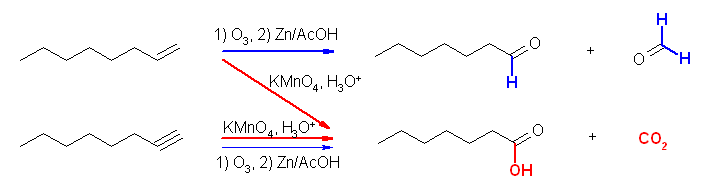
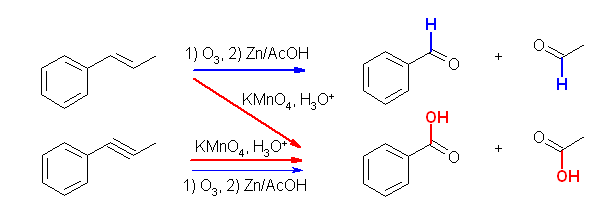
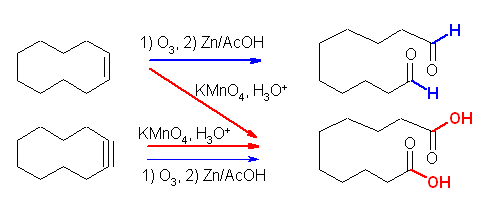
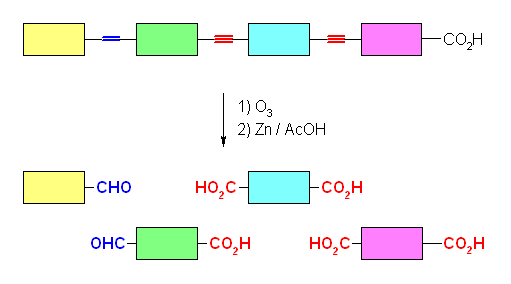
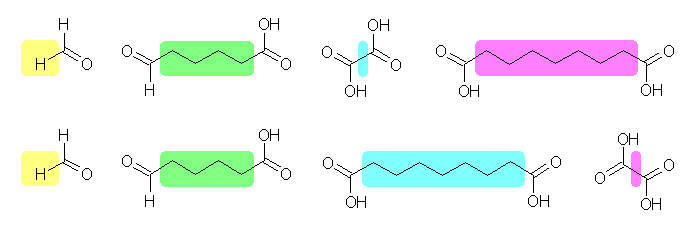
酸性 KMnO4 は、かなり強い酸化条件で、ケトンとカルボン酸を与えるのに対し、オゾン酸化したのち亜鉛で処理した場合には、ケトンとアルデヒドが得られる。
(解答例)
(a) 6-oxoheptanoic acid
(b) 6-oxoheptanal
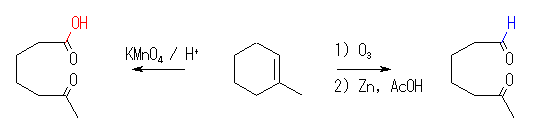
7.16
7.15 の反応を逆に考えればよい。
(解答例)
(a) 2-methylpropene をオゾン分解。
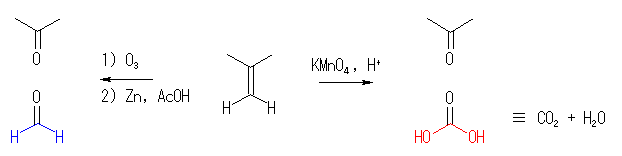
(b) 3-hexene (E 体、または Z 体のどちらでも)をオゾン分解。
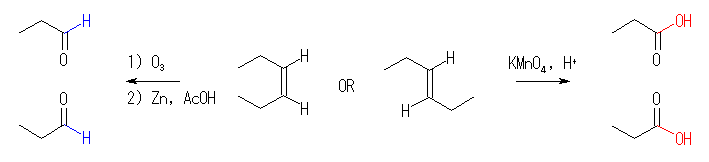
なお、問題に「2 mol の」プロパナールを与えるとあるが、この「2 mol の」の部分がなくても同じ答えである。
7.17
教科書 p241 の表7.1 にまとめられているように、ポリエチレンに代表されるアルケンポリマーは、ポリマーの主鎖中に2つの炭素ごとの繰り返しがあるものが多い。これは、モノマーとして置換基を有するエチレン(エテン)類を使用するからである。
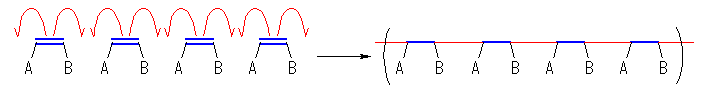
なお、反応機構を描く際に、ラジカル重合反応では「電子対」ではなく1つずつの電子が動く。(このため、閉殻構造ではない、ラジカル種が関与することになる。)このような場合には、矢印は矢尻が片方だけのものを使うことに注意せよ。
(解答例)
(a) 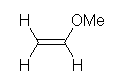
methyl vinyl ether
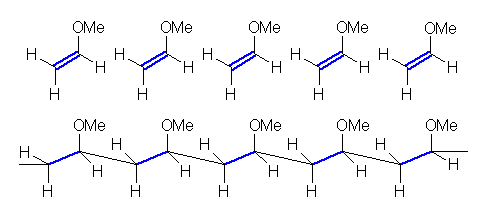
(b) 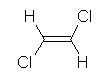
1,2-dichloroethene の幾何異性体(シス/トランス)は、どちらでもよい。
7.18
(解答例)
なお、ラジカル種同士が結合して単結合をつくる反応も、停止段階のひとつである。
上の2つの図において、矢印はすべて「電子対」ではなく「1つの電子」の動きを表すので、矢印の頭は斜め線が片方にしかでていない矢印(カタカナの「レ」のような形)であることに注意すること。
7.19
(解答例)
7.20
(i) 酸性 KMnO4 、(ii) O3 と、引きつづいての Zn/AcOH の処理は、いずれも二重結合の酸化開裂反応となる。教科書 7.8 節参照。
(解答例)
(i) 酸性 KMnO4 では、ケトンとカルボン酸を、(ii) O3 と、引きつづいての Zn/AcOH の処理では、ケトンとアルデヒドを生じる。
(a) 2,5-dimethylhept-2-ene
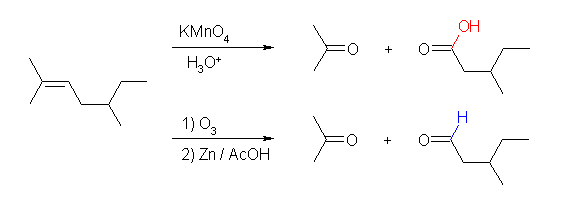
acetone とともに、酸性 KMnO4 処理では 3-methylpentanoic acid を、Zn/AcOH 処理を伴うオゾン開裂では 3-methylpentanal を与える。
(b) 3,3-dimethylcyclopentene
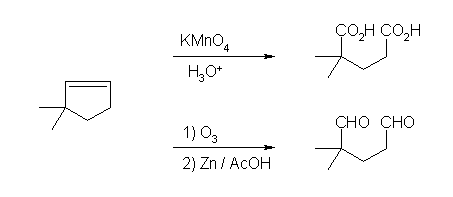
酸性 KMnO4 処理では 2,2-dimethylpentanedioic acid を、Zn/AcOH 処理を伴うオゾン開裂では 2,2-dimethylpentanedial を与える。
7.21-7.30
7.21
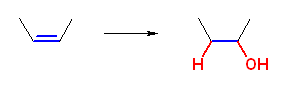
アルケンへの水和は、上の模式図のように進行する。したがって、生成物から考えるときは、水酸基が二重結合の一方の炭素である。ヒドロホウ素化反応と、オキシ水銀化法では、反応の位置特異性が異なる。
(解答例)
(a) 2,3-dimethylpentan-3-ol は3級のアルコールで、水和によりこのアルコールを潜在的に与えることができるアルケンは3種存在する。
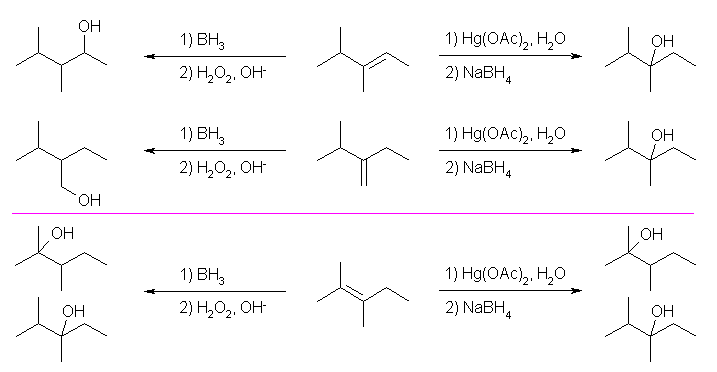
3,4-dimethylpent-2-ene は、オキシ水銀化法で3級のアルコール 2,3-dimethylpentan-3-ol を与える。ヒドロホウ素化反応では、2級のアルコール 3,4-dimethylpentan-2-ol を与える。
2-ethyl-3-methylbut-1-ene は、やはりオキシ水銀化法で3級のアルコール 2,3-dimethylpentan-3-ol を与える。ヒドロホウ素化反応では、1級のアルコール 2-ethyl-3-methylbutan-2-ol を与える。
最後に、2,3-dimethylpent-2-ene は、二重結合の炭素がどちらも2つのアルキル置換基をもつから、2種の3級アルコールの混合物を与えてしまう。このため、2,3-dimethylpentan-3-ol を得る目的では、好ましくない。
(b) 3,3-dimethylcyclopentanol は、潜在的には2種のアルケンから合成可能である。
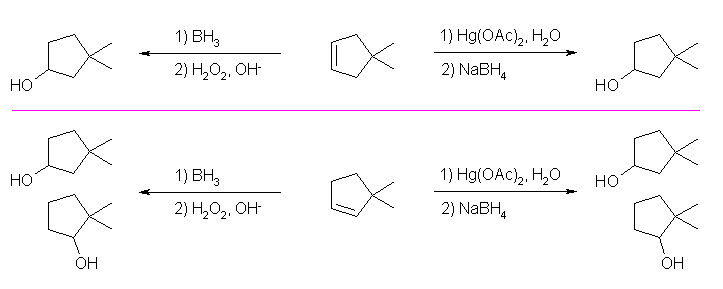
4,4-dimethylcyclopentene は、二重結合炭素のどちらに水酸基が結合しても同じアルコール 3,3-dimethylcyclopentanol を与えるのに対し、3,3-dimethylcyclopentene では、水和により、2種のアルコール2種類を与えてしまう。後者から得られる2種のアルコールはどちらも2級なので、ヒドロホウ素化反応、オキシ水銀化反応のいずれを用いても位置選択性は(ほとんど)生じないと考えられる。
7.22
7,7-ジメチルビシクロ[2.2.1]ヘプタ-2-エン
この問題で与えられるアルケン(上のリンクにより3次元模型を表示)は、二重結合に対して左右対称の構造であるから、水和反応の位置選択性により異なる生成物を与えるわけではない。
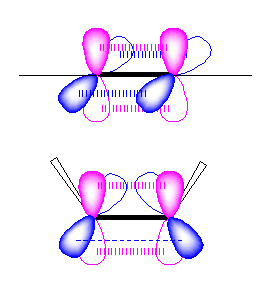
ヒドロホウ素化の反応機構については、教科書 7.5 節、図 7.6 を参照のこと。
二重結合の π 軌道(2つの二重結合炭素の sp2 軌道がつくる平面に垂直、上下の方向にでている p 軌道からつくられる)の方向からボラン BH3 が近づき、水素と -BH2 基がシンの立体で付加する。従って、ボランが同じ位置選択性で反応する場合でも、シグマ結合のつくる面の上下のいずれかから近づいてきて反応するかにより、異なる立体の異性体が生じることが考えられる。
(解答例)
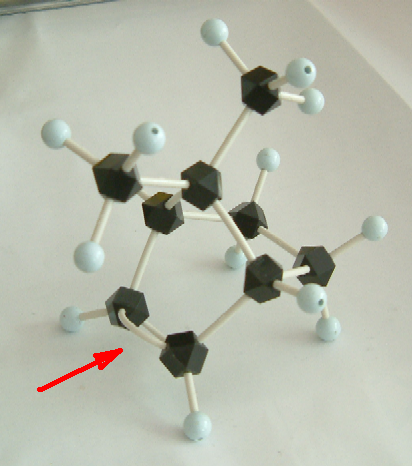
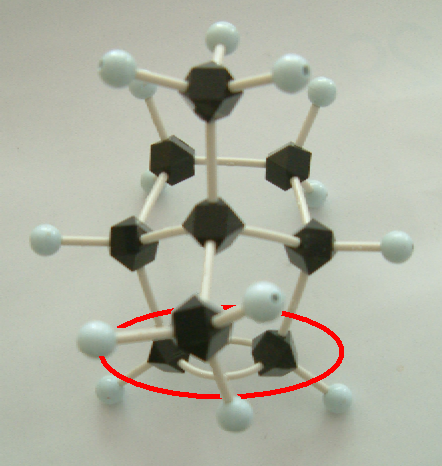
下の写真を見てわかるように、2つのメチル基は二重結合を覆うように突き出している。そのため、ボランが二重結合に求電子的に反応しようとするとき、立体的に空いているほうからのみ近づくことができる。そのため、一方の生成物のみが得られる立体特異的な反応である。
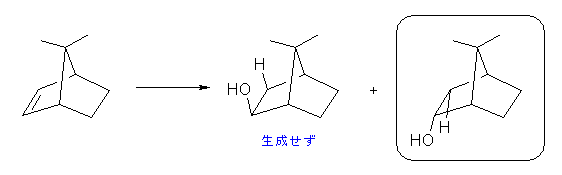
このアルケンの分子模型の写真(side view and top view)
本問題で与えられているアルケンは、7,7-dimethylbicyclo[2.2.1]hept-2-ene である。二環系化合物の命名は、問題 4.49 および 4.54 の発展の項を参照すること。
bicyclo[2.2.1]heptane 骨格は、norbornane とよばれ、二重結合を持つ bicyclo[2.2.1]hept-2-ene は、norbornene とよばれる。
なお、ノルボルネンは、開環メタセシス重合によるポリマーの原料として使用される。
以下、外部リンク。
Norbornene, Polynorbornenes → http://en.wikipedia.org/wiki/Norbornene
開環重合 → http://ja.wikipedia.org/wiki/開環重合
メタセシス → http://ja.wikipedia.org/wiki/メタセシス反応
7.23
(解答例)
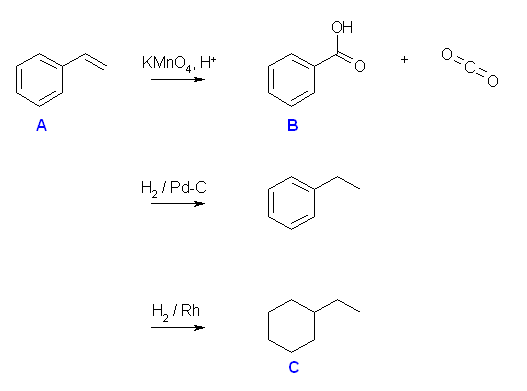
(a) 接触水素添加。位置特異性:なし。立体特異性:シン付加(ただしこの問題では、反応の立体特異性により生成物の構造は変わらないので考慮しなくてもよい)。生成物は ethylbenzene 。
(b) 臭素化。位置特異性:なし。立体特異性:アンチ付加(3員環であるブロモニウムイオンを経由するため。この問題では、反応の立体特異性により生成物の構造は変わらない)。生成物は、(1,2-dibromoethyl)benzene
(c) HBr の付加。位置特異性:マルコフニコフ付加(より安定なカルボカチオン中間体を経由する)。立体特異性:なし(この反応で中間体となるカルボカチオンは、sp2 混成で平面型3配位であるから、その炭素の立体的な情報を失う。詳細は、11章「SN1 反応」を参照のこと。生成物は、(1-bromoethyl)benzene
(d) オスミウム酸化。位置特異性:なし。立体特異性:シン付加(ただしこの問題では、反応の立体特異性により生成物の構造は変わらないので考慮しなくてもよい)。生成物は、1-phenyl-1,2-ethanediol
(e) 接触重水素添加。位置特異性:なし。立体特異性:シン付加(ただしこの問題では、反応の立体特異性により生成物の構造は変わらないので考慮しなくてもよい)。生成物は ethylbenzene 。
生成物の構造を下にまとめてしめす。
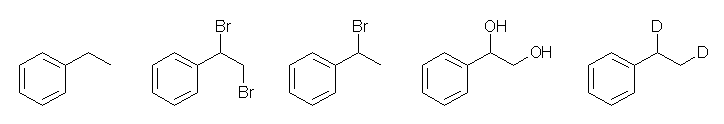
7.24
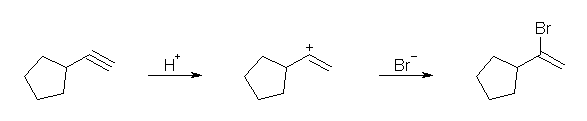
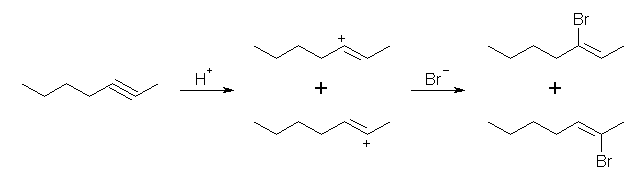
(c) ただ1種類に決まる。 (d) マルコフニコフ配向での塩化水素の付加反応であるから、生成物の塩素の結合した炭素の位置に相対的に安定なカルボカチオンを生じることができるようなアルケンが原料である。
(e) オキシ水銀化法は、同じくマルコフニコフ配向性である。生成物の水酸基の結合した炭素の位置に相対的に安定なカルボカチオンを生じることができるようなアルケンが原料である。
(解答例)
(a) 2-methylhexane
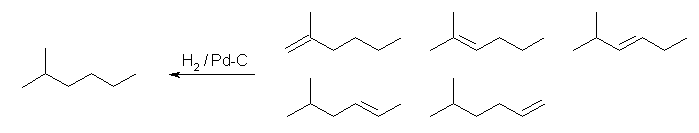
2-methyl-1-hexene, 2-methyl-2-hexene, 2-methyl-3-hexene
5-methyl-2-hexene, 5-methyl-1-hexene から合成できる。
(b) 1,1-dimethylcyclohexane
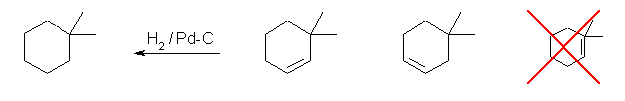
3,3-dimethylcyclohexene, 4,4-dimethylcyclohexene から合成できる。一番右のように、炭素から5本の結合を書いてはいけない。
(c) 2,3-dibromo-5-methylhexane
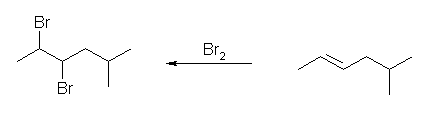
5-methyl-2-hexene から合成できる。
(d) 2-chloro-3-methylheptane
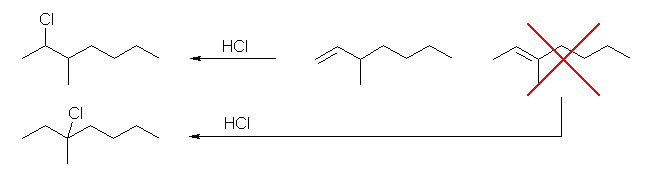
3-methyl-1-heptene から合成できる。3-methyl-2-heptene からは、より安定な3級のカルボカチオンを経由し、3-chloro-3-methylheptane を与える。
(e) 2-pentanol
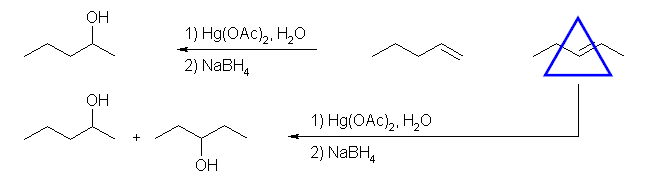
1-pentene から合成できる。2-pentene からは、同じ程度に安定な2級のカルボカチオンが2種類生じうるから、2-pentanol と同時に 3-pentanol を与える。
7.25
(a) オゾン酸化開裂(後処理に亜鉛を使っているから、ケトンとアルデヒドを生じる。)
(b) 酸性条件なので、酸化開裂(ケトンとカルボン酸を生じる)条件。冷、アルカリ性だと四酸化オスミウムとの反応と類似となる。
(c) ヒドロホウ素化反応。オキシ水銀化法との対比において、位置特異性に特に注意すること。
(d) オキシ水銀化法。ヒドロホウ素化反応との対比において、位置特異性に特に注意すること。アルケンへの水和反応では、酸触媒と水を用いた場合、カルボカチオンが骨格転位を起こすことがある。オキシ水銀化法では、同じ位置特異性をもつがカルボカチオンではなくマーキュリニウムイオン中間体を経由するから、骨格転位は起きない。
(解答例)
(a) 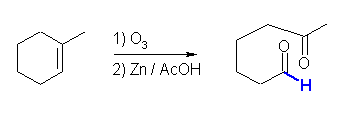
(b) (a)と同じ出発物質と反応させれば、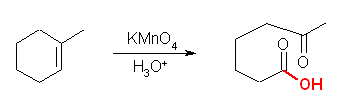
cyclohexene との反応なので、
(c) 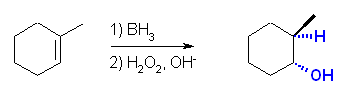
位置選択性は逆マルコフニコフ配向、立体選択性はシン。
(d) 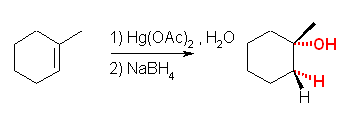
位置選択性はマルコフニコフ配向、立体選択性はシン。
7.26
(解答例)
(a) 1) OsO4, 2) NaHSO3, H2O など。
冷アルカリ性 KMnO4 でも同じ反応をする。
(b) 1) BHR2, 2) H2O2, OH- (ヒドロホウ素化反応)、または、
1) Hg(OAc)2, H2O, 2) NaBH4 (オキシ水銀化法)など。
(位置特異性を考えなくて良いから、どちらの反応条件も用いることができる。)
(c) CHCl3, NaOH (ジクロロカルベンを生じさせる条件。)
(d) H2SO4, 加熱 (カルボカチオンを生じさせ、脱プロトン化:二重結合への水和反応の逆反応)、または、
POCl3 / pyridine (ピリジン溶媒中、リン酸エステルに変換し、そのまま脱離させる:教科書17章、17.7節にこの反応条件が書いてあります。)、または、
1) TsCl, 2) base (トシル化後、塩基による脱離反応)などが用いられる。
(e) 1) O3, 2) Zn/AcOH (オゾン酸化。)
(f) 1) BHR2, 2) H2O2, OH- (ヒドロホウ素化反応:逆マルコフニコフ配向の反応なので。)
ただし、(b) および (f) の答えにおいて BHR2 は、ボラン BH3 または、9-BBN など。
9-BBN(9-BoraBicyclo[3.3.1]Nonane)は、cyclooctadiene とボランにより生成される。
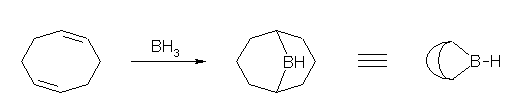
7.27
(解答例)
水酸基と重水素(-D)が、シクロペンタン環の同じ面側に結合し、trans-2-methylcyclopentanol の重水素化体を生じる。
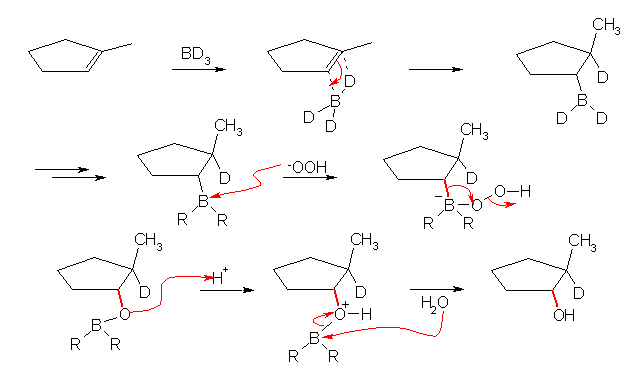
7.28
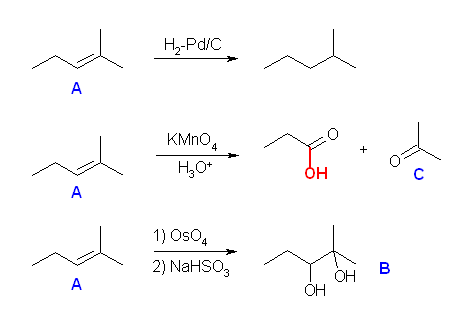
(解答例)
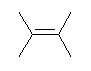
2,3-dimethyl-2-butene
7.29
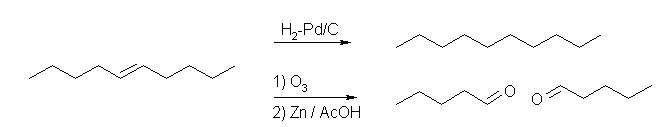
「接触水素化で1モルの水素と反応する」→分子内に二重結合が1つだけ存在する。
「オゾン分解で単一の生成物を与える」→ 問題 7.28 を参照。
(解答例)
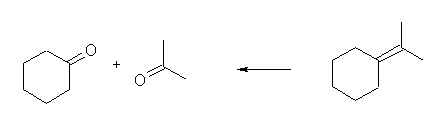
5-decene
7.30
(解答例)
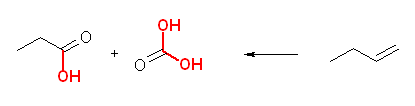
(a) 1-butene, 末端の =CH2 は、炭酸を与える。炭酸は、二酸化炭素を水に溶かして生じる酸であるから、二酸化炭素と同等として考えてよい。
(b) 2-methyl-2-hexene
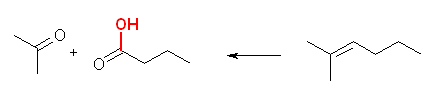
(c) isopropylidenecyclohexane
7.31-7.40
7.31
「(パラジウムを用いる)接触水素化では、1モルの水素とだけ反応する」→二重結合を1つだけ持つ。(ベンゼン環のようなものは例外)
「オゾン酸化で生じるカルボニル化合物がジケトン、 C10H16O2 」→ オゾン酸化で、分子が2つのフラグメントには分かれていない。すなわち、環の一部の二重結合が酸化開裂している。また、アルデヒドではないことから、二重結合の2つの sp2 炭素は、いずれもアルキル基で置換されており、4置換のアルケンである。
(解答例)
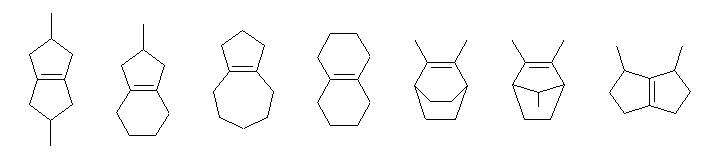
(a) 化合物 A(分子式 : C10H16)の不飽和度は、3と計算される。ベンゼン環は、それだけで不飽和度が4必要であり、この分子中にはない。また、与えられた条件より、接触水素化される二重結合が1箇所だけであるから、あとの不飽和度2は、環の構造に由来するはずである。
(b) オゾン酸化でジケトンを生じることから、4置換のアルケンであるが、このことから最低6個の炭素を必要とする。化合物 A、B の構造は、これらのことと、「環を2つもつこと」「ジケトン B が対称であること」などを考慮すると、化合物 A の構造として、次のようないくつかが可能性として考えられる。(歪みの大きい3員環や4員環は除いて考えた。また、ジケトン B の「対称であること」の意味のとり方によっては、一番右の構造のように、「2つのカルボニル基は異なるが、それぞれカルボニル基の左右のアルキル基は対称となる」ものも考えることができるだろう。(これ以外のものからは、「2つのカルボニル基が同じ環境になるようなもの」である。もちろん、これら両方の条件を満たすものもある。)
(c) 上の左端の化合物を例として、反応式を示す。
7.32
(解答例)
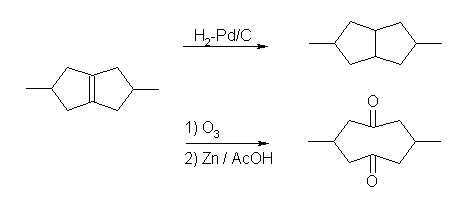
化合物 A(分子式 : C6H12)の不飽和度は、1と計算される。接触水素化により1モルの水素を吸収するから、この不飽和度は二重結合に由来する。
酸性 KMnO4 での処理により、炭素数6の炭化水素、化合物 A は、2つのフラグメントになり、その一方は、炭素数3のプロパン酸である。従って、もう一方のフラグメント、化合物 C も炭素数が3である。化合物 C はケトンであると指定しているから、炭素数を併せて考慮すると、acetone のみが該当する。
以上を元に化合物 A の構造が確定するので、これをオスミウム処理して生じるジオール B の構造も対応して決まる。
反応式を以下に示した。
7.33
(解答例)
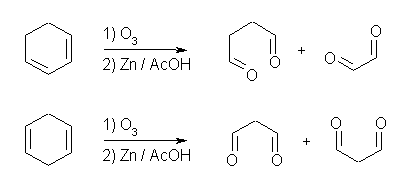
オゾン酸化と、引きつづいての亜鉛処理によって、1,3-cyclopentadiene からは butanedial と ethanedial の2種のジアルデヒドが生じる。これに対し、1,4-cyclopentadiene からは propanedial のみが生じる。
酸性 KMnO4 を用いると、それぞれ対応するジアルデヒドの代わりにジカルボン酸が得られる。
7.34
「希硫酸による処理で、分子式が H2O だけ小さなアルケンを与える」→ 酸性条件下脱水するということは、化合物 A にはどのような官能基を持っていたのか?
「炭素数が10である アルケン B は、オゾン開裂により、炭素数が5の cyclopentanone のみを与える」→ アルケン B が二重結合に対して対称だったため、一種の生成物を与えたと考えられる。
(解答例)
化合物 B の分子式は C10H16 の不飽和度は、3と計算される。オゾン開裂により2つの対称なフラグメント(シクロペンタノン)に分かれるということは、化合物 B には二重結合が1箇所のみ。すなわち、残りの不飽和度2は環構造に由来することになる。→ 化合物 B は、環を2つもち、二重結合で対象なアルケン, bicyclopentylidene 。
化合物 A は、希硫酸により脱水できるアルコール。主生成物(より多置換のアルケン)として、化合物 B を与える。
以上を考えると、次のように書くことができる。
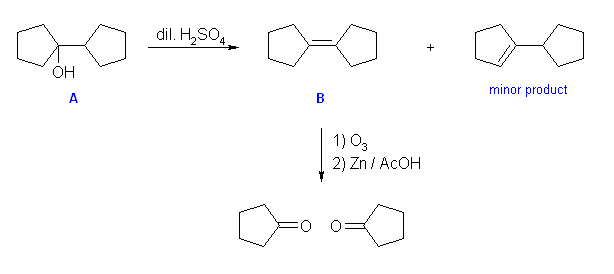
A: bicyclopentyl-1-ol ( or 1-cyclopentylcyclopentanol)
B: bicyclopentylidene
7.35
(解答例)
反応機構を次図に示した。
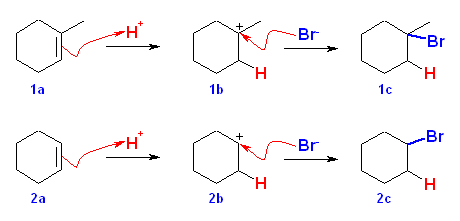
ここで、反応中間体はカルボカチオンである。cyclohexene より生じる2級のカルボカチオンより、1-methylcyclohexene より生じる3級のカルボカチオンの方がずっと安定である。これを考慮して、反応のポテンシャルエネルギー曲線を作成すると、定性的に次図のようになると考えられる。
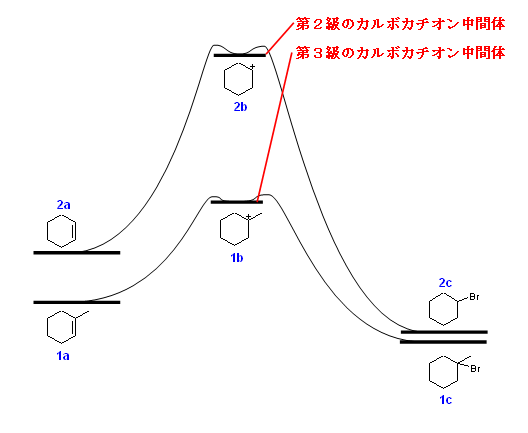
原料のアルケンも、多置換であるほうが若干安定であることを反映させて作図した。反応中間体が安定であるということは、反応の活性化エネルギーが小さいということを示す。すなわち、反応が速く進行する。したがって、HBr の極性付加は、1-methylcyclohexene に対しての反応の方が、cyclohexene に対してよりも速い。
7.36
Simmons-Smith 反応の反応種は I-CH2-ZnI であるが、形式的には、カルベン CH2 の反応だと考えてよい。教科書 7.7 節を参照のこと。
(解答例)
(a) 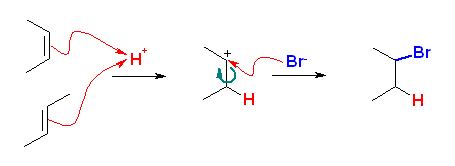
本来、マルコフニコフ則の位置特異性を持つが、この反応では対称なため考えなくてよい。シス、トランスのいずれの 2-butene に対しても、プロトンが付加して生じるカルボカチオンは、もともと二重結合だったところが単結合となり自由回転できるから、区別のない同一のカルボカチオンを生じる。
(b) 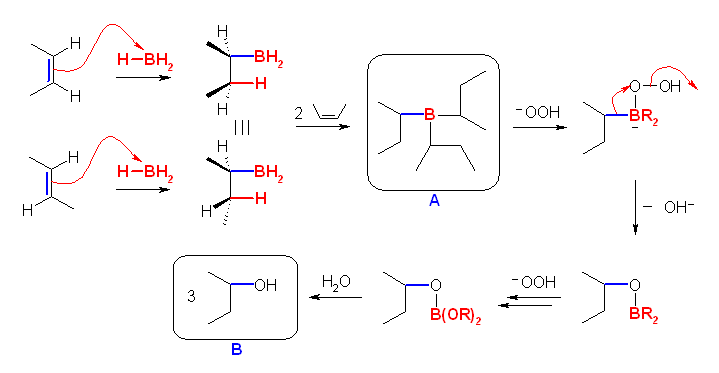
本来、逆マルコフニコフ則の位置特異性を持つが、この反応では対称なため考えなくてよい。ボラン BH3 の付加は、シンの立体特異性であるが、シス、トランスのいずれの 2-butene に対しても、生成物は(付加した炭素の一方が CH2 となるから)同一である。(図では示していないが、二重結合の面のどちらから付加が起きるかについての選択性(面選択性)は無いから、生成物は、ホウ素の結合した不斉な炭素に由来する光学異性体の等量混合物となる。)
ボラン BH3 は、1分子で3分子のアルケンと反応することができるので、A の構造は上図のようになる。
BR3 の、塩基性の過酸化水素での処理では、ホウ素上の酸化とホウ素上のアルキル基が酸素上に転位することにより、ホウ酸エステル B(OR)3 を生じる。これが加水分解されると、アルコール ROH が3分子と、ホウ酸 B(OH)3 を生じる。
(c),(d) 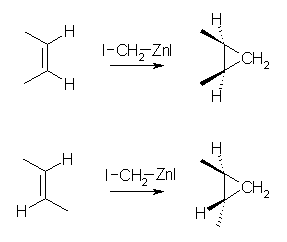
カルベンの付加は、シンの立体特異性で進行する。従って
cis-2-butene からは、cis-1,2-dimethylcyclopropane のみが生じ、
trans-2-butene からは、trans-1,2-dimethylcyclopropane のみが生じる。
7.37
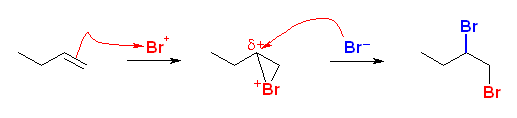
(解答例)
(a),(b) 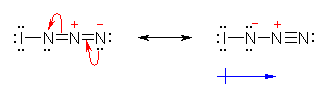
(c) 臭素の付加と同じようにマルコフニコフ配向性をもつならば、より置換基の多いほうの炭素(1-butene への付加の場合では、2級の炭素:3員環の中間体において、よりカルボカチオン的性質の強い炭素)に付加するのが求核種であるから、N3 の部分の方が負に帯電していることがわかる。
このことは、共鳴構造式からも理解できる。共鳴構造式において1番目と3番目の窒素上に負の形式電荷がある。このことは1番目と3番目の窒素が(ともに)負に帯電していることを示す。
7.38
「オゾン分解で〜のみを与える」 → 二重結合に対して対称な構造である。
この問題では、環状の構造を考えるとよい。
(解答例)
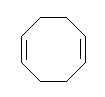
1,5-cyclooctadiene
7.39
1,1-diiodoethane は、diiodomethane の一つの水素をメチル基に置き換えたものとして捉えれば、この反応は理解しやすい。
シクロヘキセンと diiodomethane からできるシクロプロパン環を持つ化合物は、同時にシクロヘキサン環をもつ。このときの立体配座を考えればシクロプロパン環として付加したカルベン炭素からの2つの水素が非等価であることがわかる。次の写真( bicyclo[4.1.0]heptane の分子模型)ではこのことを強調するため、赤と青の球でこの水素を表している。
![7-39 bicyclo[4.1.0]heptane.png](./bicyclo[410]heptane.png)
(解答例)
上のヒントとも対応してみてください。
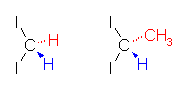
左端は、diiodomethane を用いた Simmons-Smith 反応によって生じる bicyclo[4.1.0]heptane
中央および右端は、1,1-diiodoethane を用いた Simmons-Smith 反応によって生じる 7-methylbicyclo[4.1.0]heptane
7-位のメチル基が、シクロプロパン環を基準面として考えて、シクロヘキサンとシス側(青色で表現)に出ているものと、トランス側(赤色で表現)に出ているものとが区別される。
7.40
(b) 立体選択性に注意すること。
(c) 分子内に、オゾン開裂の基質となる二重結合が2箇所ある。
(d) 立体選択性に注意すること。
(解答例)
以下に、与えられた反応条件での主生成物の構造を示す。別の観点から、示された生成物を与えるような反応条件についても考えてみるとよい勉強になる。(ただし、ここまでで学習していない内容を必要としたり、多段階の反応が必要な場合もありうる。)
(a) 次のように反応し、マルコフニコフ配向性で生成物を与える。もし、問いのような生成物が必要な場合は、逆マルコフニコフ配向での付加が必要であるから、ヒドロホウ素化反応をつかって 3-methyl-2-butanol としたのち、ハロゲン化物へ変換するなどしなくてはならない。
(b) 次のように反応し、シンの立体化学で付加反応がおこる。もし、問いのようにトランス体の 1,2-ジオールが必要であれば、過酸などを用いてエポキシドとしたのち、水酸化物イオンによる求核的な環開裂反応をさせるなどする。(エポキシドについては、教科書18章を参照のこと)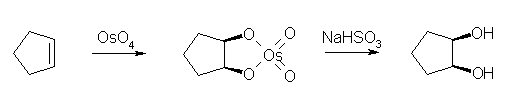
(c) 図のように、モルオゾニド、オゾニドを経由して2分子の 1,3-propanedial を生成する。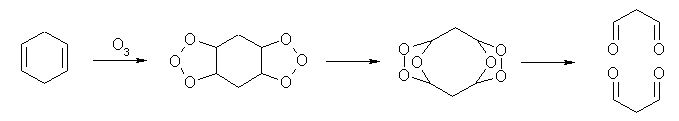
(d) ヒドロホウ素化反応は、次の機構で示されるような多段階の反応であるが、トータルとしてシンの立体化学で付加反応がおきる。従ってメチル基と水酸基は互いにトランスの位置関係のものしか得られない。もし、問いのような立体のアルコールが必要な場合は、水酸基をトシル化するなどして脱離基に変換したのち、水酸化物イオンによる SN2 反応をするなどしなければならない。(求核置換反応のひとつである SN2 反応については、教科書11章を参照のこと)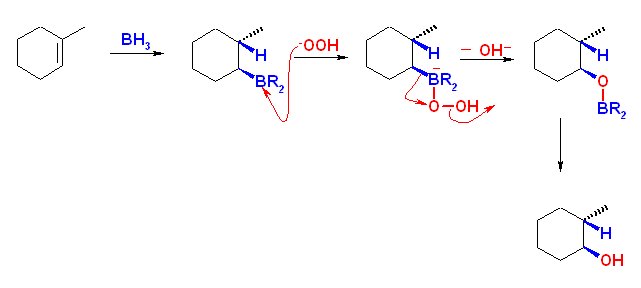
7.41-7.50
7.41
まずは、位置選択性に関係なく水和により問いのようなアルコールを与えるような原料のアルケンとしてどのような可能性があるかを調べ、ついで、そのすべてについて位置選択性(や立体選択性)を適用して検討すること。
(解答例)
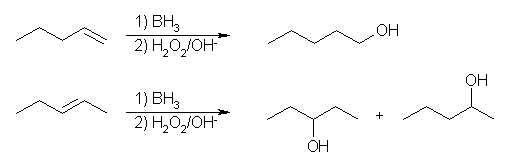
(a) 水和により 2-pentanol を与えるアルケンとしては、1-pentene と 2-pentene の2種類が可能性として考えられるが、ヒドロホウ素化では、1-pentene からは 1-pentanol のみが生じ、2-pentene からは、どちらの炭素の置換の度合いもおなじだから、2-pentanol と 3-pentanol の混合物が得られる。
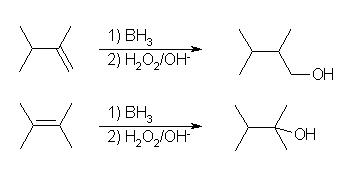
(b) 水和により 2,3-dimethyl-2-butanol を与えるアルケンとしては、2,3-dimethyl-1-butene と 2,3-dimethyl-2-butene の2種類が可能性として考えられるが、ヒドロホウ素化では、2,3-dimethyl-1-butene からは 2,3-dimethyl-1-butanol のみが生じる。2,3-dimethyl-2-butene からは、どちらの炭素の置換の度合いもおなじだが、左右対称だから、2,3-dimethyl-2-butanol のみが生じる。
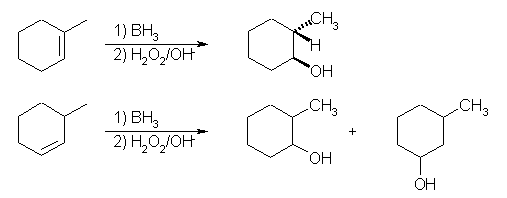
(c) 水和により 2-methylcyclohexanol を与えるアルケンとしては、1-methylcyclohexene と 3-methylcyclohexene の2種類が可能性として考えられるが、ヒドロホウ素化では、1-methylcyclohexene からは、2-methylcyclohexanol のみを生じるが、シンの立体化学で付加するはずだから、トランス体となる。3-methylcyclohexene からは、どちらの炭素の置換の度合いもおなじだから、2-methylcyclohexanol と 3-methylcyclohexanol (どちらも、シス/トランスの混合物)の両方が得られる。
(d) 水和により 1-methylcyclohexanol を与えるアルケンとしては、methylenecyclohexane と 1-methylcyclohexene の2種類が可能性として考えられるが、ヒドロホウ素化では、methylenecyclohexane からは、2-cyclohexylethanol のみを生じる。1-methylcyclohexene からは、2-methylcyclohexanol (トランス体)のみが得られる。
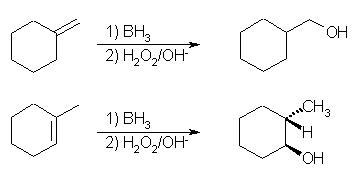
7.42
(解答例)
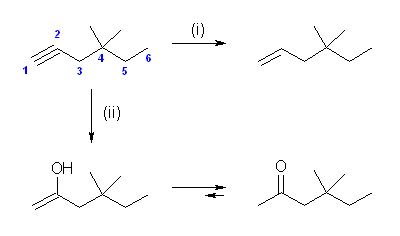
(a) Simmons-Smith 反応を用いる。ethene を用いる場合、1,1-diiodo-2-methylpropane との反応になる。3-methyl-1-butene を用いる場合、1,1-diiodomethane との反応になる。後者が標準的な反応である。
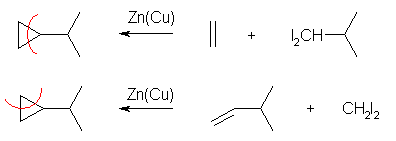
(b) dichlorocarbene との反応なので、CHCl3-KOH の系を用いる。アルケンとしては、cycloheptene を用いればよい。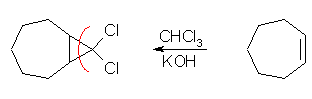
7.43
思い出せない反応がある場合は、章末の「反応のまとめ」を参照して探すこと。
(解答例)
いずれも二重結合での反応である。
A) 臭素の付加は、アンチの立体化学で進行する。これは、ブロモニウムイオン中間体を経由するからである。
B) 臭化水素の付加は、マルコフニコフ則に従った位置選択性で進行する。これは、カルボカチオン中間体を経由するからである。
C) 四酸化オスミウムを用いた水酸化は、シンの立体化学で進行する。これは、環状オスミウム酸エステル中間体を経由するからである。
D) ヒドロホウ素化反応では、逆マルコフニコフ則に従い水和が進行する。また、反応の立体化学はシン付加となる。
E) Simmons-Smith 反応ではシクロプロパン環ができる。
7.44
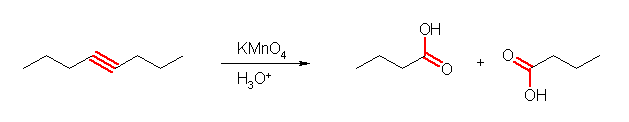
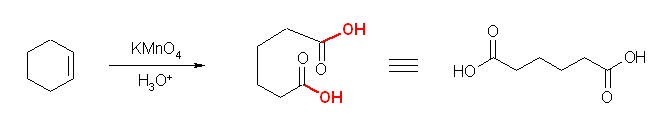
酸性 KMnO4 との反応では、二重結合の位置での酸化開裂がおきる。
(解答例)
不飽和度は、1。酸化開裂が起きる位置、1箇所のみ二重結合をもつ。
CH3(CH2)12CH=CH(CH2)7CH3 → CH3(CH2)12CO2H + HOC(=O)(CH2)7CH3
7.45
(解答例)
7.46
(解答例)
7.47
(解答例)
7.48
(解答例)
7.49
この問題で「環状ブロモエーテル」を与えるということは、分子内の反応を示唆している。
(解答例)
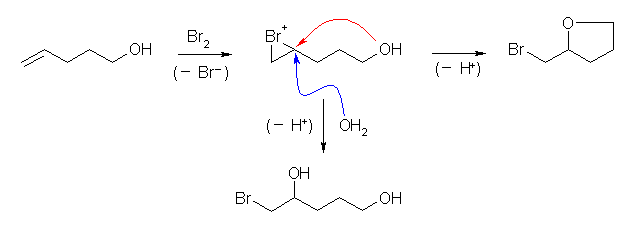
ブロモニウム中間体に対し、水が(分子間の)求核反応するとブロモヒドリンを生じるが、分子間の反応よりも(5、6員環を生じるような、”ちょうど良い位置”に分子内の求核グループである水酸基がある場合は)分子内の反応の方がずっと速く起きる。このためブロモヒドリンは生じずに、2-(bromomethyl)tetrahydrofuran のみを生じる。
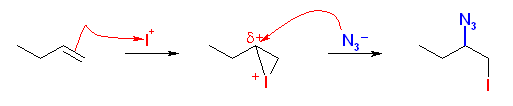
ブロモニウムイオン中間体に対する求核反応は、(正電荷をもつ3員環なので、プロトン化をうけたエポキシドなどと同じように)環がひらいて完全なカルボカチオンになっているわけではないが、安定なカルボカチオンと同じ位置、すわなちマルコフニコフ配向にしたがってより置換基の多い方の炭素、に求核攻撃が起きることに注意すること。
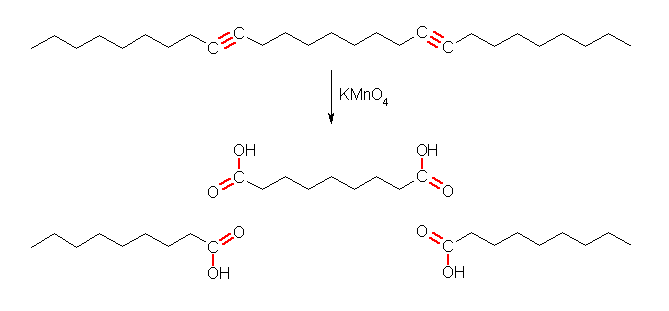
7.50
(a) シクロペンテンは分子内に二重結合をもち、シクロペンタンは分子内に二重結合を持たない。
(b) 2-ヘキセン、ベンゼンともに二重結合を持つが、ベンゼン中の二重結合は芳香環の二重結合であり、孤立した二重結合のような反応性とは異なる。
従って、いずれもアルケンとしての性質を持つかどうかを調べればよい。典型的なアルケンの反応で、化学反応により色の変わるものなどがよく用いられる。
(解答例)
代表的ないくつかの反応のみを示す。
アルケンは、臭素の付加反応をする。アルカンやベンゼンはこの反応をしない。従って、薄い臭素水(臭素による赤褐色を示す)を加えてよく振り混ぜる。アルケンは反応して臭素水が脱色される(臭素が付加反応により消費される)。
希過マンガン酸カリウムの溶液(濃度により、深紫色からピンク色)を加えてよく振り混ぜる。二重結合が過マンガン酸カリウムにより酸化(酸化開裂、または、1,2−ジオールまでの酸化)をうけて、過マンガン酸イオンが消費されることにより脱色される。
また、炭素に担持させたパラジウム触媒を用い、水素の吸収がおきるかどうかを確認してもよい。水素の体積が減じれば、水素の吸収が起きていることになるから、分子内にアルケンがあることがわかる。
7.51-7.59
7.51
(解答例)
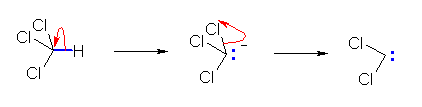
クロロホルムからのジクロロカルベンの生成は、クロロホルムの水素の酸性度が高い(電子吸引性基である塩素の結合により、その共役塩基であるカルボアニオン、トリクロロメタニドアニオンが安定化されるため。)ことに由来する。
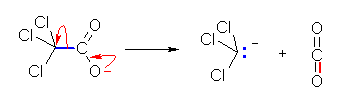
トリクロロ酢酸イオン trichloroacetate ion は、脱炭酸により、同様に安定なトリクロロメタニドアニオンを生成することができる。この脱離反応において、脱離基は安定な中性分子である二酸化炭素である。
トリクロロメタニドアニオンから塩化物イオンの脱離によりジクロロカルベンが生じる反応は、クロロホルム由来、トリクロロ酢酸塩由来のどちらの場合も共通である。
ハロホルム反応の最終段階、すなわちメチルケトンのトリハロ化後の、R-CCX3 の塩基による加水分解(水酸基によるカルボニル求核置換反応)でカルボン酸を生じる過程も、トリハロメタニドアニオンが安定で脱離基としてはたらくために起きる。
7.52
(a) 不飽和度は分子式から求められる。
(b) パラジウム触媒で吸収する水素の量より、多重結合の数がわかる。(二重結合1つにつき水素1モル、および三重結合1つにつき水素2モルを吸収する。)従って、この条件と (a) の不飽和度より、環の数が決定できる。水素を吸収することのできる多重結合が二重結合なのか三重結合なのかは、他の条件(Lindlar 触媒では、水素により三重結合は二重結合に還元される)での反応を見るか、あるいは、酸化開裂のパターンによるなど、他の方法で決めることになる。この問いでは、オゾン酸化での開裂のパターンから、二重結合の数、および (c) の構造がわかる。
(解答例)
(a) (22-16)/2 = 3 だから、不飽和度は3。
(b) 水素を2モル吸収する。従って、不飽和度のうち1は、環によるものである。また、オゾン酸化により分子の2箇所が切れて、ジカルボニル化合物が2つできている。従って、二重結合は2箇所あったことになる。
(c) 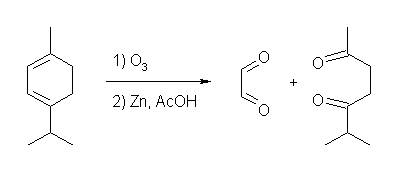
7.53
1,2-ジオールの過ヨウ素酸 HIO4 による酸化開裂は、カルボニル化合物を与える。この反応の機構は、環状過ヨウ素酸エステル中間体を経て起こる。環状過ヨウ素酸エステル中間体の構造については、教科書 7.8 節を参照のこと。
(解答例)
1,2-ジオールの過ヨウ素酸から生じる環状過ヨウ素酸エステル中間体は、炭素−酸素−ヨウ素−酸素−炭素の5員環である。cis-1,2-diol の2つの水酸基は環に対して同じ方向にでているから、容易に5員環の中間体をつくることができる。これに対し、trans-1,2-diol の2つの水酸基が環の上下にでているから、この酸素を含む5員環中間体を形成するためには、炭素の6員環に歪みが生じる。より不安定な(=エネルギーの高い)中間体を経由する過程は、活性化エネルギーが高いということになるわけで、その反応の速度は遅くなる。
過ヨウ素酸エステル中間体の骨格の分子模型図を示す。水素と、ヨウ素から結合した環以外の酸素は省略して示した。赤が酸素、それ以外が炭素およびヨウ素。
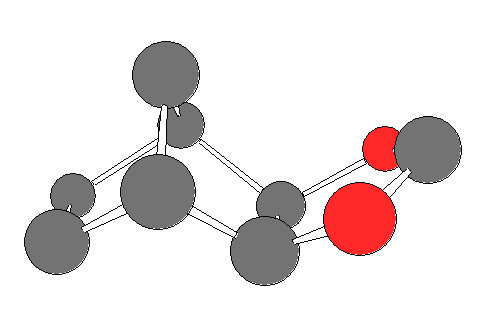
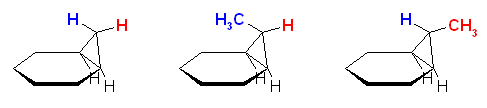
ノルボルナン骨格(ビシクロ[2.2.1]ヘプタン)の中の炭素の6員環部分は舟型の配座だから、cis-体の2つの水酸基は同方向(2つの水酸基の2面角が 0 度)に向いて出ている。従っていずれの環にも余分な歪みを生じずに5員環のエステル中間体を形成することができる。
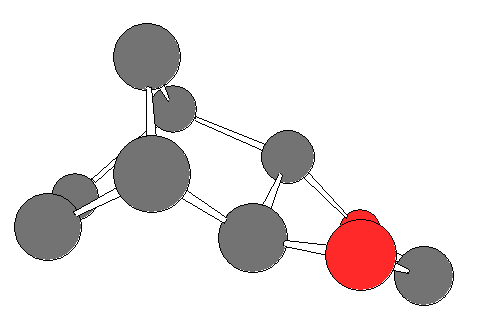
trans-1,2-diol の2つの水酸基は、環の上下にでている。炭素の6員環部分に舟型の配座を固定したままでは、2つの水酸基は2面角が 120 度で突き出すから、5員環のエステル中間体を形成することができない。2つの水酸基の結合した炭素−炭素結合の軸にそってねじれが生じることにより、2つの水酸基の2面角が小さくなり、はじめて5員環のエステル中間体を形成することが可能となる。
7.54
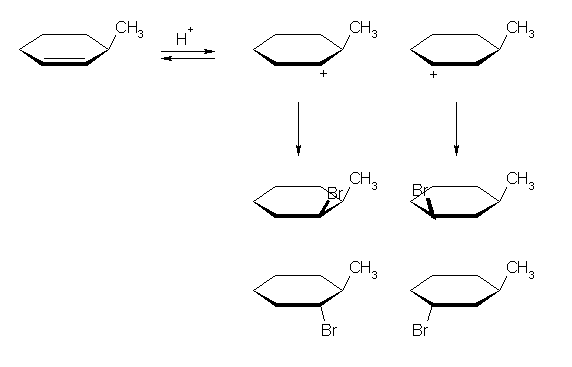
3-bromocyclohexene と HBr の反応で、単一の生成物が生じるということは、上と同様の2種のカルボカチオン中間体を考えたのでは説明がつかない。
trans-1,2-dibromocyclohexane は、cyclohexene と臭素 Br2 の反応での生成物と同じである。
(解答例)
類似の生成物を与える反応として整理しておくならば、アルケンは臭素の付加の中間体としてブロモニウムイオンを経由し、アンチ付加によるトランス体のみを生じる。一方、単純な平面型のカルボカチオン中間体を経由するような、アルケンに対する HBr の付加反応では、立体選択性が生じない。
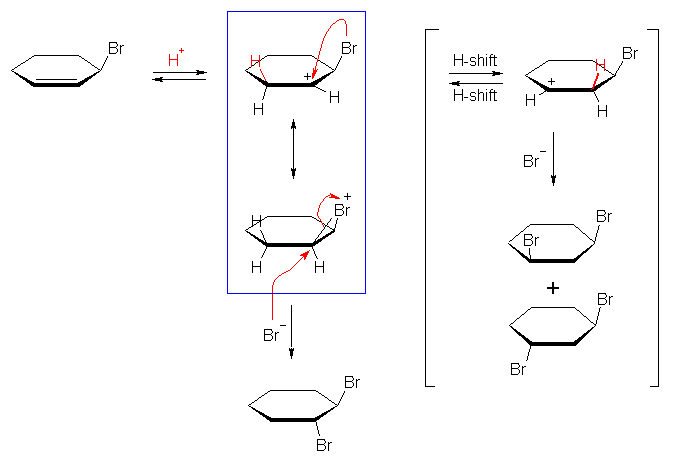
プロトンの付加の段階では、その反応の位置により考えられる2種のカルボカチオンのうち、より安定なカルボカチオンのみが生じる。ここで、アルケンにプロトンが付加したとき、臭素の結合した炭素の隣接した位置に生じるカルボカチオンは、臭素原子のもつ孤立電子対が空のp軌道と相互作用して3員環のブロモニウムイオンを生じる(上図、青枠)。そのため、同じように第2級であるけれども、臭素から遠い位置に生じるカルボカチオン(上図、右のカッコ内の上部)よりも安定である。
このブロモニウムイオンからは、アルケンへの臭素の付加がアンチの立体で進行するのと同様に、trans-1,2-dibromocyclohexane のみを生じる。
(上図において、より不安定なカルボカチオンからは、ヒドリドシフトにより、より安定なカルボカチオンに転位することができるが、そもそも、右上のカッコ内に示したようなカルボカチオンが生じていると考える必要はないし、そのような不安定なカルボカチオンの生成を仮定することは、単一の生成物を与えるという実験事実に反する。)
7.55
(解答例)
出発物質である置換ドデカトリエン酸のエステル、 methyl 3,7,11-trimethyldodeca-2,6,10-trienoate には3箇所の二重結合があるが、2 位の二重結合(次図中、赤で囲み)は隣接した位置に電子吸引性基であるエステル残基が結合しているから、π 電子密度は他の2つの二重結合よりも下がっていると考えられる。6 位、10 位の二重結合は電子的にはほぼ等価であると考えられるが、6 位の二重結合(水色での囲み)は分子の中央近くにあるのに対し、これに比べて、10 位の二重結合(赤色での囲み)は分子の末端近くにあるから、立体的に邪魔が小さいと予想され、ここで求電子的な反応が起きると考えることができる。
従って、オキシ水銀化法と同様に、酢酸水銀が二重結合に対して求電子的に付加してマーキュリニウムイオン中間体を生じるところから、一連の反応が開始される。
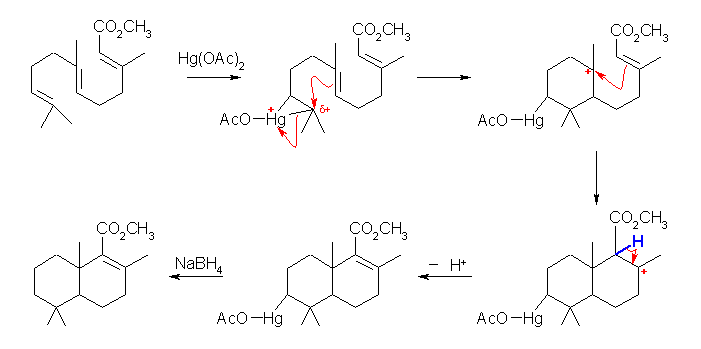
生じた3員環のマーキュリニウムイオン中間体は、より級数の多い方の炭素(11 位の炭素)上で求核攻撃を受ける。分子内の二重結合が求核種としてはたらき、6員環を形成してカルボカチオン(上の反応機構の図、上段右端)を生じる。更に 2 位の二重結合が求核種としてはたらいて、このカルボカチオンに求核付加すると、デカリン骨格をもつカルボカチオン(上の反応機構の図、下段右端)を生じる。このカルボカチオンにおいて、青色で示した 2 位の水素は、隣接位置にエステルのカルボニル基がある。つまり、カルボニル基の β 位の水素であるから、他の位置の炭素に結合した水素よりもずっと酸性度が高い。この酸性水素が脱離して二重結合を生じ、問いに与えられた最終生成物である水銀化合物(下段中央)を生じる。
オキシ水銀化法の最後の段階で、有機水銀化合物を NaBH4 を用いたヒドリド還元してやることで、炭素−水銀結合を、炭素−水素に変換することが可能である。分子内のエステルや二重結合は NaBH4 では還元されないから、2,5,5,8a-tetramethyl-3,4,4a,5,6,7,8,8a-octahydronaphthalene-1-carboxylic acid methyl ester (下段左端)の構造へ容易に誘導することも可能であると予測できる。
7.56
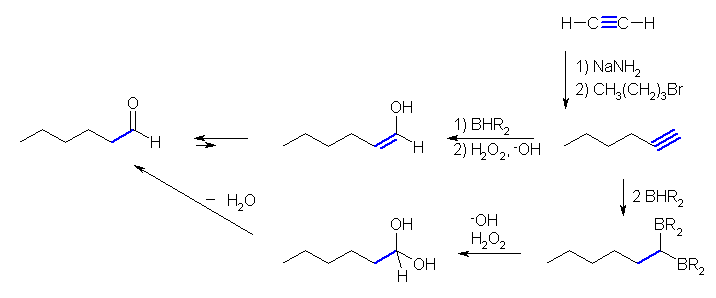
(解答例)
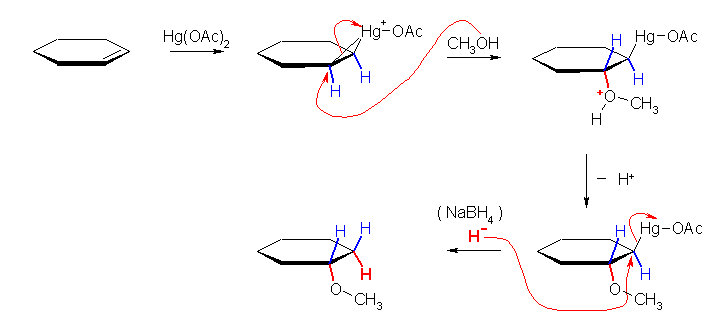
この問題では生成物が対称な構造であるから、位置特異性、立体特異性ともに関係しないが、オキシ水銀化法と同様、マルコフニコフ配向性に従った位置特異的な反応であり、また付加は全体としてシンの立体化学で進行する。
オキシ水銀化法の変法として、マーキュリニウムイオンに対し、水のかわりにアルコールの求核攻撃させる方法は、エーテルの合成法の1つとして教科書 18.4 節に「アルコキシ水銀化法」として示されている。ただし、水よりもアルコールの方が求核性が弱いので、オキシ水銀化法と同様に酢酸水銀を用いるとアセテートイオンによる求核攻撃が副反応としておきてしまう。これを避けるため、一般的にアルコキシ水銀化法では、酢酸水銀のかわりにトリフルオロ酢酸水銀を用いると収率が上がることが知られている。
7.57
アルケンに対してのプロトンの付加は可逆である。(プロトンの付加によりカルボカチオンを生じ、カルボカチオンからのプロトンの脱離によりアルケンを生じる。)ここで、プロトンは π 電子に対し、ルイス酸として配位していると考えることができる。
(解答例)
アルケンへのプロトンの付加によりカルボカチオンを生じる過程で、プロトンはルイス酸として働いていると捉えることができる。また、この反応は、ヒドロホウ素化反応のはじめの段階、すなわちアルケンに対し、ルイス酸性をもつ BH3 が配位していく過程と類似であると考えることができる。
反応温度の高い条件では、この BH3 の二重結合への配位(付加)が可逆であると考えることができるとすると、次の図に示すような形で二重結合が転位することが可能になる。
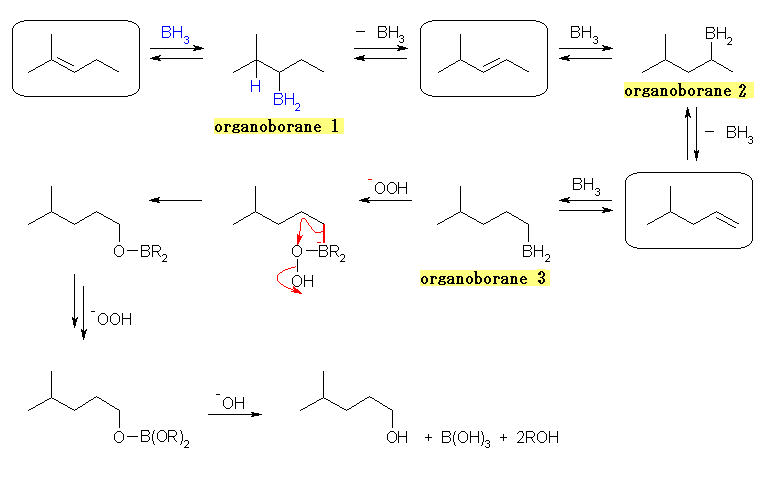
次に、この転位が何故おきるのかについても説明しなければならない。上の過程が可逆で、それにより平衡が成立したとしても、2-methyl-2-pentene からの転位により生じるアルケン、4-methyl-2-pentene および 4-methyl-1-pentene は、それぞれアルキル2置換、アルキル1置換のアルケンであるから、アルキル3置換の 2-methyl-2-pentene に比べて不安定であるから、アルケンの安定性のみを考えた場合、出発原料である 2-methyl-2-pentene が主となるはずだからである。
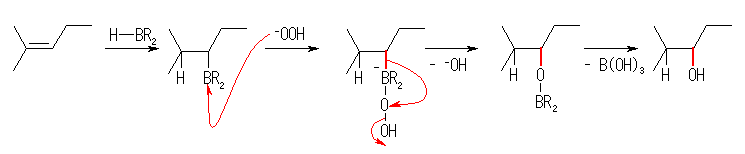
ヒドロホウ素化反応における中間体、有機ホウ素化合物 organoborane の安定性について考えると、ヒドロホウ素化反応においての位置選択性が、より立体障害の小さい炭素にホウ素が結合したことからも類推されるように、第1級の有機ホウ素化合物が一番安定である。この観点から見ると、上図中で organoborane 3 が一番安定である。従って、上図に示された3つのアルケンと3つの有機ホウ素の間で平衡が成立している中から、この organoborane 3 を経由するヒドロホウ素化反応が優先して進行するようになり、4-methyl-1-pentanol を主として生成する。
7.58
(解答例)
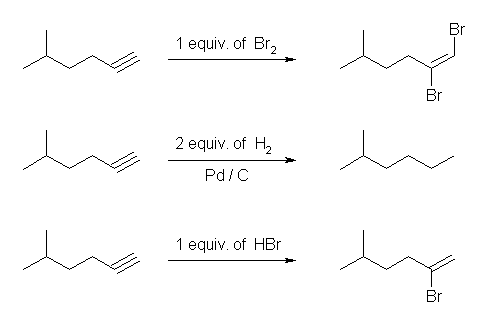
(a) アルケンへの Br2 の付加は、アンチの立体化学で進行する。アルキンに Br2 が付加すると、trans-体の 1,2-ジブロモアルケンが生じる。(もう1等量の臭素が付加すると、1,1,2,2-テトラブロモ体が生じる。)
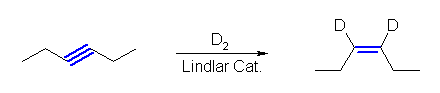
(b) Pd / C を触媒とした接触水素化では、アルキンは2等量の水素を吸収してアルカンまで還元される。Lindlar 触媒を用いると、1等量の水素との反応でアルケンを生じる。接触水素化反応はシンの立体化学で進行するから、末端の位置でないアルキンからはシス体のアルケンとなる。
(c) HBr の付加は、アルケンの場合と同様、アルキンに対してもマルコフニコフ配向性の位置特異性で進行する。
7.59
(解答例)
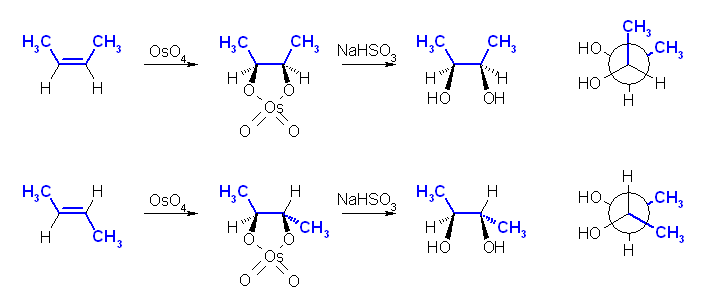
オスミウム酸エステルの形成を経由するヒドロキシ化は、シンの立体化学で進行する。従って、2-butene のシス体から出発した場合とトランス体から出発した場合では、生成物の立体が異なる。生成物の Newman 投影式(反応式に書いた構造を、右からの視点で示したもの)を併せて示した。