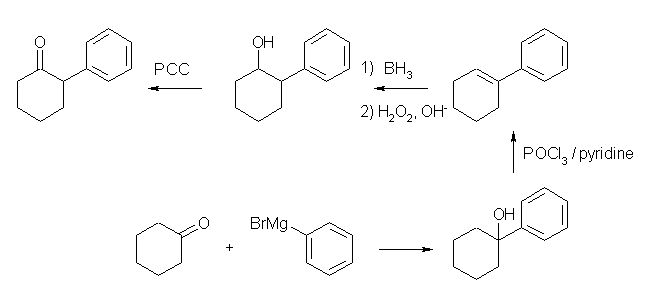
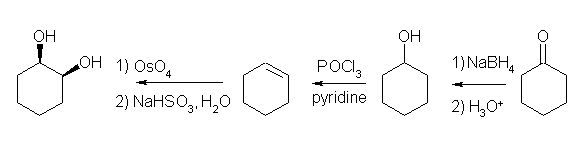
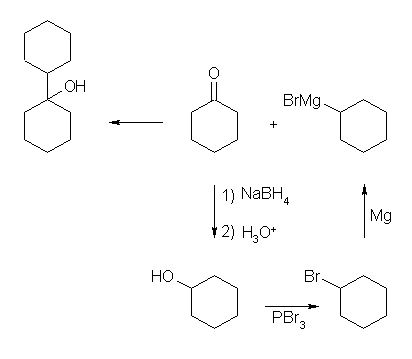
19.01-19.10 (01-10)
19.01, 01
主鎖は、アルデヒドやケトンのカルボニル基を含む部分となることに注意。また、アルキル側鎖よりカルボニル基を優先して炭素鎖に番号をつけること。アルデヒドである場合、またシクロヘキサノンなどのように環状ケトンの場合、カルボニル基に数字をつければ1となるが、命名する場合はわざわざ名前に数字を入れない。詳細は、下巻の巻末付録A「多官能性有機化合物の命名法」を参照すること。次の順に優先順位が下がっていく。カルボン酸 > 酸無水物 > エステル > 酸ハロゲン化物 > 酸アミド > ニトリル > アルデヒド > ケトン > アルコール > フェノール > チオール > アミン > イミン > アルケン、アルキン > アルカン
19.1 節を参照して命名すること。(もちろん、英語で命名できるように!!)
(解答例)
解等のみ示す。
(a) 2-methyl-3-pentanone
(b) 3-phenylpropanal
(c) 2,6-octanedione
(d) trans-2-methylcyclohexanecarbaldehyde
(e) pentanedial
(f) cis-2,5-dimethylcyclohexanone
(g) 4-methyl-3-propyl-2-hexanone
(h) 4-hexenal
19.02, 02
命名法では(側鎖の置換基)+(主官能基を含む主鎖)となっていることを思い出すこと。化合物の名称から、主官能基を含む主鎖が判れば、あとは簡単。
(解答例)
(a) 3-methylbutanal
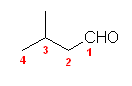
(b) 4-chloro-2-pentanone
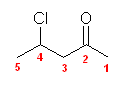
(c) phenylacetaldehyde
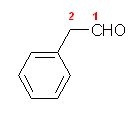
(d) cis-3-tert-butylcyclohexanecarbaldehyde
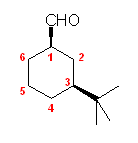
(e) 3-methyl-3-butenal
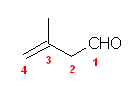
(f) 2-(1-chloroethyl)-5-methylheptanal
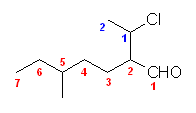
19.03, 03
(a) と (c) は、同じ炭素の数の間での変換を考える。(b) は、炭素の数が6から5へ減る反応。19.2節を参照して考えること。
(解答例)
(a) 1級アルコール(酸化数1)からアルデヒド(酸化数2)への酸化反応。PCC などを酸化剤として用いる。酸性クロム酸のようにより強い条件で酸化すると、カルボン酸にまで酸化されてしまう。
(b) オゾン開裂を用いる。オゾン開裂でアルデヒドを生じさせるためには、オゾンを作用させた後の処理として還元性の条件(酢酸中で金属亜鉛を用いるなど)が必要。酸化性の条件で処理すると、アルデヒドでは止められずカルボン酸を生じる。また、同じアルケンの酸化開裂でも、過マンガン酸カリウムを用いた場合は、カルボン酸となってしまう。なお、どちらの条件でもアルキル置換のアルケンからはケトンを生じる点は同じ。
(c) エステル(カルボン酸誘導体なので、酸化数3)からアルデヒド(酸化数2)への還元反応。還元剤として NaBH4 を用いた場合は、反応しない。( NaBH4は、アルデヒドやケトンのように反応性の高いカルボニル基しか還元できない。)還元剤として LiAlH4 を用いた場合は、反応するが、1級のアルコールまで還元されてしまう。エステルを還元して直接アルデヒドを生じさせるためには、特殊な条件が必要である。還元剤としては、DIBAH (DiIsoButylAluminumHydride) を用い、-78℃ と非常に低温で反応させる必要がある。この問いでは、1段階でアルデヒドを生じる必要はない。LiAlH4 を用いて1級のアルコールとしたのち、(a) と同じように PCC を用いてアルデヒドまで酸化してもよい。
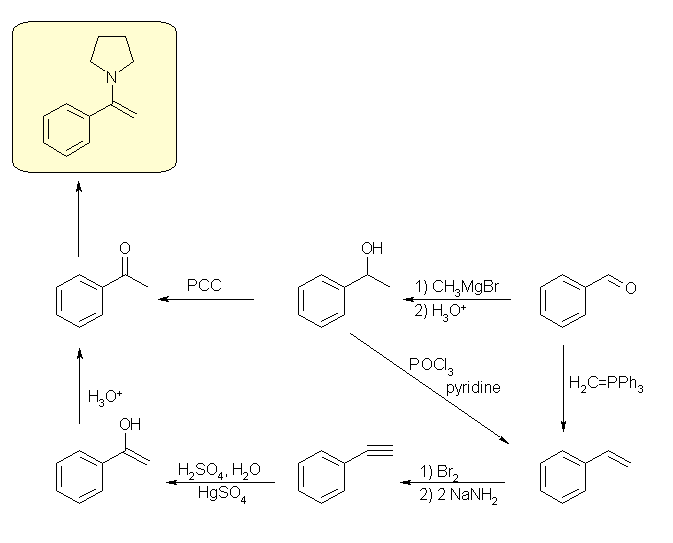
19.04, 04
(a) アルキンの反応をもう一度確認してみること。特に、8.5節を参照。なお、この問いでは、原料が左右対称な 3-ヘキシンなので、水和における位置特異性は考えなくても良い。アルキンの水和では、末端のアルキンでのみ位置特異性がある。
(b) 芳香族求電子置換反応を用いて、ベンゼン環上に置換基をいれていく。2つの置換基をいれていく順序については、配向性を考慮すること。16章を参照すること。
(c) アセトフェノン(慣用名的な命名法。詳細は、発展の項を参照のこと)は、単純にベンゼンから誘導できることは、16章ですでに学んだ。また、ブロモベンゼンはベンゼンに変換することもできる。しかし、ここではブロモベンゼンからベンゼンを経由せずにアセトフェノンとする方法を考えること。最終生成物であるアセトフェノンでは、ベンゼン環とアセチル基が結合しているのだから、どこかでベンゼン環と C2 のユニットを結合させる反応が必要となる。
(d) 1段階では出発物質から目的の生成物は得られない。ケトンの合成の一般的な方法にアルコールの酸化があるから、まず、酸化すると目的のケトンを与えるアルコールを得ることを考えてみること。
(解答例)
(a) アルキンを水和すると、エノールを生じたあと、エノールの互変異性化によりカルボニル化合物を与える。アルケンの水和には、酸触媒があるだけでよいが、アルキンの水和には水銀の塩が必要である。
(b) 塩化アルミなどのルイス酸を触媒とし、塩化アセチルと Friedel-Crafts 反応させ、アセトフェノンとしたのち、臭素化する。臭素化反応では、FeBr3 を触媒として用い、臭素 Br2 を分極させ、Br+ をベンゼン環と反応させるのは、Friedel-Crafts 反応における AlCl33 のはたらきと似ていることに注意。また、臭素は電子吸引性ではあるが、オルト−パラ配向性であるからはじめにブロモベンゼンとするルートは使えない。
(c) まず、ブロモベンゼンをマグネシウムで処理して、グリニヤル試薬とする。グリニヤル試薬は、カルボニル求核反応するから、C2 のカルボニル化合物と反応させることを考える。C2 のケトンは存在しない。C2 のカルボン酸誘導体として、酢酸エステルを用いても、エステルはグリニヤル試薬2等量と反応してしまうから、今回の目的の生成物には近づかない。C2 のアルデヒド、アセトアルデヒドと反応させる。生じた 1-phenylethanol を PCC 等で酸化すれば、目的として acetophenone を得る。
(d) 水和により 2-methyl-1-cyclohexanol を得ることができればよい。反応の位置特異性を考えると、ヒドロホウ素化を用いる必要がある。(酸触媒での水和や、オキシ水銀化法を用いたのでは、マルコフニコフ則により 1-methyl-1-cyclohexanol となってしまう。つづいてこの 2-methyl-1-cyclohexanol を PCC 等で酸化すれば 2-methylcyclohexanone を与える。
ケトンの命名は、基本的な置換命名法(教科書に解説されている方法。接尾語 -one で命名する方法。)のほか、エーテルと同じように基官能名(ケトン)を用いた命名ができる。2-butanone → ethyl methyl ketone、3-pentanone → diethyl ketone となる。また、ベンゼン環がカルボニル基に直結したケトンの場合、1-phenyl-1-alkanone (置換命名法)、alkyl phenyl ketone (基官能名を用いた命名法)などのほか、アシル基に対応する酸名の末尾 -(o)ic acid を -ophenone として命名することが許される。従って、アシル基 CH3CO- 基は、酢酸 CH3CO2H に対応するものだから、酢酸 acetic acid (誘導体を作ってよい慣用名)より acetophenone とすることができる。(酢酸を ethanoic acid とする場合は、ethanophenone となるが、 ethanophenone は用いられない)。この表記法を用いると、1-phenyl-1-propanone の場合、プロパン酸の慣用名 propionic acid から propiophenone となる。プロパン酸の組織名 propanoic acid からは propanophenone となる(この表記も見かけない)。
また、アシル基 R-CO- は、慣用名があるほか、組織的にはカルボン酸誘導体として命名することができる。カルボン酸が -oic acid である場合は、語尾の -oic を -oyl に変えてアシル基名とする。カルボン酸が -carboxylic acid である場合は、語尾を -carbonyl に変えてアシル基名とする。CH3CO- 基のアシル基としての慣用名は acetyl 基。組織名は ethanoyl となる。
以下に IUPAC(1979)で認められたアシル基の慣用名をいくつか挙げておく。(出典:「有機化合物命名のてびき」化学同人、1990年。)
| カルボン酸 | アシル基 | |
| 組織名 | 慣用名 | 慣用名 |
| methanoic acid | formic acid | formyl |
| ethanoic acid | acetic acid | acetyl |
| propanoic acid | propionic acid | propionyl |
| butanoic acid | butyric acid | butyryl |
| pentanoic acid | valeric acid | valeryl |
| 2-methylpropanoic acid | isobutyric acid | isobutyryl |
| 3-methylbutanoic acid | isoveleric acid | isovaleryl |
| 2,2-dimethylpropanoic acid | pivalic acid | pivaloyl |
外部へのリンク:
化合物命名法談義 より、
IUPACガイド(1993)による許容慣用名
19.05, 05
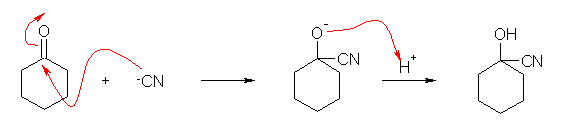
19.7 節にシアノヒドリンの生成についての解説があるから参照すること。
(解答例)
(第6版) 1-hydroxycyclohexanecarbonitrile
(第5版) 2-hydroxy-2-methylpropionitrile
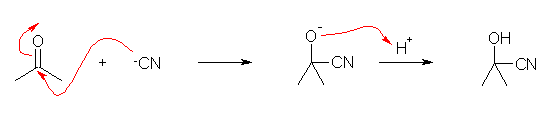
19.06, 06
ニトロ基やメトキシ基がベンゼン環に結合した場合、その π 電子に対してどのような電子的効果を与え、その結果として芳香族求電子反応に対するどのような配向性を持ったのかを思いだすこと。この問題の場合も、カルボニル基の炭素−酸素の二重結合の π 電子の密度が、カルボニル求核反応に影響を与える。(もちろん、カルボニル基にこれらの官能基が直結したとすれば、非常に大きな反応性の差が生じるが、ベンズアルデヒドのフェニル基のパラ位に結合している場合も、フェニル基を通して同じ方向の電子的効果を与える。)
(解答例)
π 電子系に対して、ニトロ基は強い電子吸引性基、メトキシ基は強い電子供与性基としてはたらく。その結果、メトキシ基は芳香族求電子置換反応に対して活性化基としてはたらく。カルボニル基の求核置換反応は、 π 電子密度が低いほど、炭素上の正の部分電荷がより大きくなるから、電子吸引性基であるニトロ基があるほうが反応性が高くなる。
19.07, 07
19.6 節のアルデヒド、ケトンの水和の節を参照すること。
(解答例)
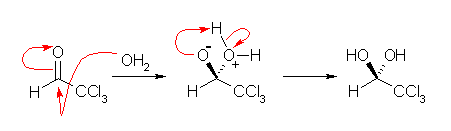
19.08, 08
アルデヒド、ケトンの水和反応が「可逆である」ことが重要。
(解答例)
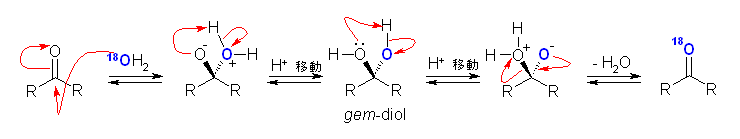
アルデヒド、ケトンの水和により、gem-ジオールを生じる。このとき、18O を含む水で水和が起こると、一方の水酸基はこの 18O を含むことになる。可逆反応により脱水する際、 18O を含む水が抜ける(上の反応式、左側へ)と元のアルデヒド、ケトンを生じるが、通常の 16O を含む水が抜ける(上の反応式、右)と、標識化された化合物、18O を含むアルデヒド、ケトンが生じる。水和反応は、塩基または酸によって触媒されるから、この酸素の交換反応も塩基や酸の存在下で速く進行することになる。
19.09, 09
生成物が得られない場合、2つの要因が考えられる。1つめは反応の速さ、2番目は反応の平衡の位置である。
1つめとして、反応が遅くなってしまう場合。遅くなるためには、途中で越えるべき遷移状態が不安定になっていると解釈することになる。すなわち、立体障害などにより反応がおきない(遷移状態に達することができない)わけである。この場合でも、反応にかかる時間が長くなるがゆっくり進むようなときは、反応の温度を上げるなどすれば目的の生成物を得ることができる場合がある。
次がなんらかの原因により出発物と生成物の相対的な安定性が変化するために、平衡の位置がずれて、生成物を与えなくなるような場合である。たとえば、シアノヒドリンの生成は、水和と同じように「可逆」で平衡が成立している。水和の場合には、平衡がアルデヒドやケトン側に傾いていて、ほとんど gem-ジオールを生じないが、シアノヒドリンの生成反応においては、平衡がシアノヒドリン側に傾いている。水和反応においても、ホルムアルデヒドやトリクロロアセトアルデヒドのような例外においては、相対的に gem-ジオールが安定になるため生成物を得ることができたのと同じように、シアノヒドリンの生成反応においても、なんらかの原因によりシアノヒドリンが相対的に不安定になれば、生成物が得られなくなると考えられる。


cyclohexanone と、それに対応したシアノヒドリン 1-hydroxycyclohexanecarbonitrile の分子模型。
(解答例)
2,2,6-trimethylcyclohexanone と、それに対応したシアノヒドリン 1-hydroxy-2,2,6-trimethylcyclohexanecarbonitrile の分子模型の写真を以下に示した。


シアノヒドリンでは、カルボニル基が水酸基とシアノ基になるから占める体積も増える。上の写真からも判るように、メチル基が立体的にかさばっているため、シクロヘキサノンがシアノヒドリンになるよりも、生成物は相対的に立体歪みの分だけ不安定になる。このため、平衡は、出発物質よりに傾くことになる。
また、シアノ基の攻撃自体も立体的に不利であるから、平衡位置がずれるだけではなく、平衡に至るまでの時間もより長くなっていると考えるのが合理的であると思われる。
19.10, 10
アルデヒドやケトンは、1級アミン、2級アミンと反応としてイミンおよびエナミンを与える。19.9 節参照。
(解答例)
イミン、エナミンの生成の方向へ進行するときの電子の動きを矢印で示した。次の反応機構を参照すること。問題の答えとしては、R1, R2 が水素、エチル基の場合、およびともにエチル基の場合。
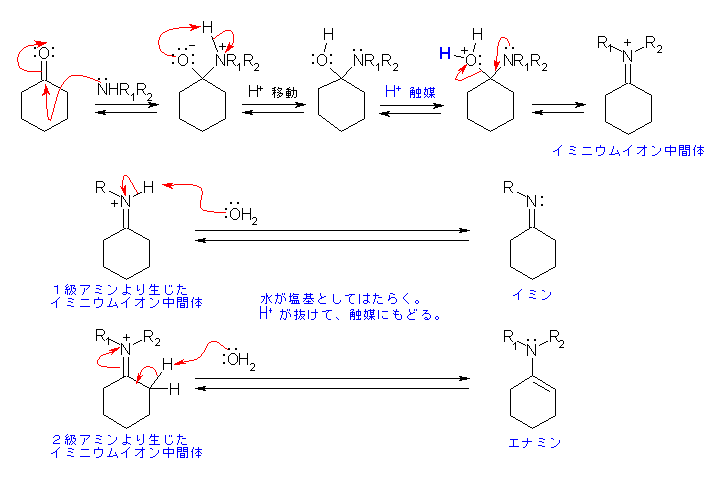
はじめのアミンの付加で、アルコキシド R-O- が生じているが、pH が4〜5前後の弱酸性条件下で反応を行うから、すぐに分子内のプロトン移動によるプロトン化を受ける。分子間反応より、一般に分子内反応の方が速いので、分子内のプロトン移動、触媒によるプロトン化の順で示したが、詳細はあきらかではない。水酸基がプロトン化をうけてはじめて脱離が可能となり、イミニウムイオン中間体となる。
あまり酸性が強いと、大部分のアミンがプロトン化を受けて求核攻撃をできなくなる。また、カルボニル基はプロトン化を受けたほうがずっと求核攻撃を受けやすくなるから、一部のカルボニルがプロトン化を受け、反応が進行すると、平衡がずれて残りのカルボニルがプロトン化を受けるという機構もありうる。(この場合、やはり求核攻撃をしているのは、より塩基性が強く、従って多い割合でプロトン化を受けるアミンのうち、プロトン化せずに残っていたアミンである。)ただし、この図では、プロトン化を受けなくてもアミンによる十分に求核攻撃をうけること、図のうえで窒素はフリーのままで酸素のみをプロトン化させると、不自然であること、より、そのようには描いていない。
イミニウムイオン中間体より、窒素上のプロトンが引き抜かれるとイミンになり、隣接した炭素から抜かれるとエナミンとなる。酸性溶液中での反応だから、塩基は中性の水で、プロトン引き抜きの結果生じるのはオキソニウムイオン。
19.11-19.20 (11-18)
19.11, 11
19.9節を参照すること。
(解答例)
問い 19.10 の解答例と比較すること。イミン、エナミンの加水分解の方向へ進行するときの電子の動きを矢印で示した。
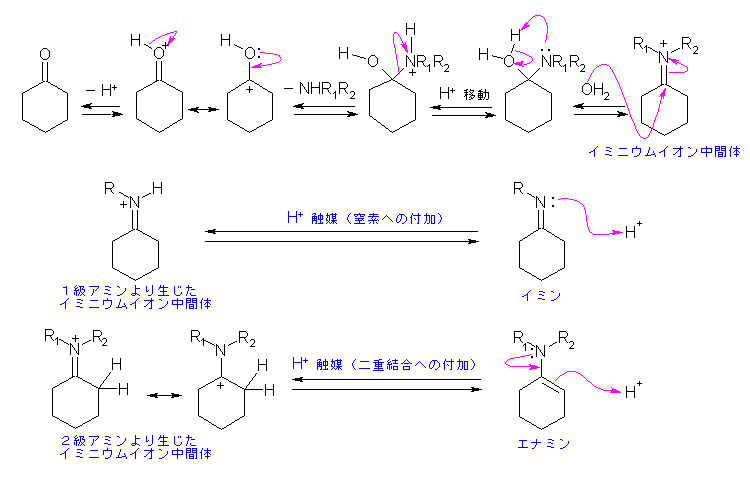
図の右下から左へ、そして上へという順にイミン、エナミンの加水分解が進行する。
イミン、エナミンにプロトンが付加すると、イミニウムイオン中間体にもどる。ここに水が求核的に付加し、窒素がプロトン化を受けるとアミンが脱離可能となる。(アミンは、水よりも更に脱離しにくい。)問い 19.10 と同じように描くなら、アミンの脱離に先立ってプロトンの脱離したアルコキシドとするべきかもしれないが、酸性条件下に生じるのは不自然だから、ここでは、プロトン化ケトンの共鳴混成体を生じるように描いた。
19.12, 12
二重結合(エン)にアミノ基が置換しているから、エナミンである。
(解答例)
エナミンは、ケトンと2級アミンの脱水縮合によって合成できる。pH 4〜5 の条件下、酸触媒で反応を進行させることができる。
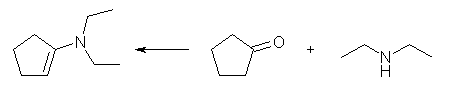
19.13
4-methyl-3-penten-2-one から、(a)〜(c) の化合物を生じる際、どこが反応したのかを見極めるため、次のように構造式を並べて描いてみるとよい。
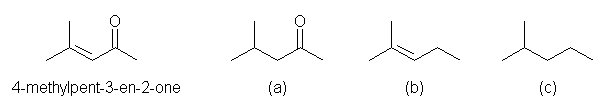 カルボニル基のヒドリドによる還元では、アルコールを生じてしまうから、ほかの還元方法を用いる必要がある。必要な反応をまとめると以下の通り。
カルボニル基のヒドリドによる還元では、アルコールを生じてしまうから、ほかの還元方法を用いる必要がある。必要な反応をまとめると以下の通り。接触水素添加(H2 - Pd/C)では、二重結合が単結合に還元される。カルボニル基は変化しない。(ベンゼン環に直接結合したカルボニル基だけは、例外的に還元される。)
カルボニル基をメチレンまで還元する代表的な反応は、アルカリ性条件でおこなう Wolff-Kishner 反応(H2NNH2, KOH, 高沸点アルコール溶媒)、または、酸性条件でおこなう Clemmensen 還元(Zn-Hg, HClaq)である。後者は水銀を使うので、酸性・アルカリ性のどちらでもかまわない場合は Wolff-Kishner 反応を用いるのが普通である。この条件下、カルボニル基は反応しない。
(解答例)
19.14, 13
図 19.12 にしめされた、アルデヒドやケトンとアルコールの反応の機構を参考にすること。エチレングリコールは、2価のアルコール HO-CH2-CH2-OH である。
すべての段階は、可逆であるから右向きと左向きの矢印を組み合わせて書くこと。(共鳴を示すような、両方に頭のある矢印ではない。)
(解答例)
(図 19.12 の ROH をエチレングリコールに代えて描く。ヘミアセタールを経由し、2段めのアルコールの求核攻撃は分子内で反応する。図は省略)
19.15, 14
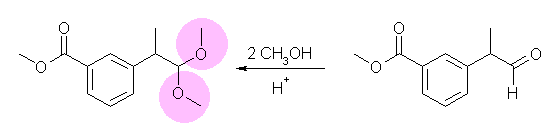
与えられた図の分子は、エステル結合とアセタールの両方を含んでいる。どこがアセタールであるかを識別する。(ヘミアセタールとは異なり、エステル結合は炭素−酸素二重結合(すなわちカルボニル基)を含んでいる。)
(解答例)
同じアルコキシ基(メトキシ基)が2つ結合した炭素が、カルボニル基だった炭素である。したがって、元のカルボニル化合物(アルデヒドであるが、命名上はエステルの方が優先される)は、methyl 3-((R)-1-methyl-2-oxoethyl)benzoate (下図、右)
19.16, 15
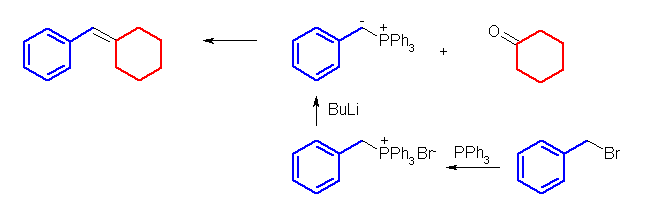
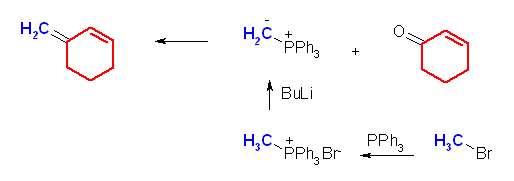
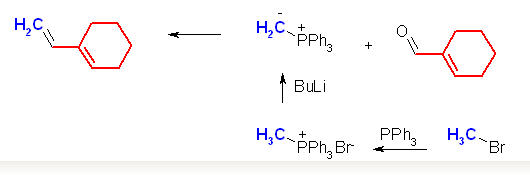
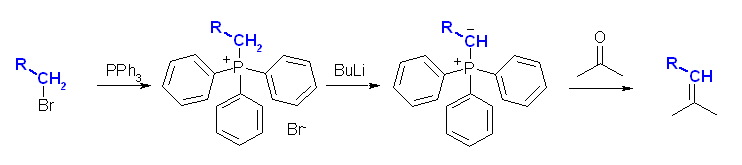
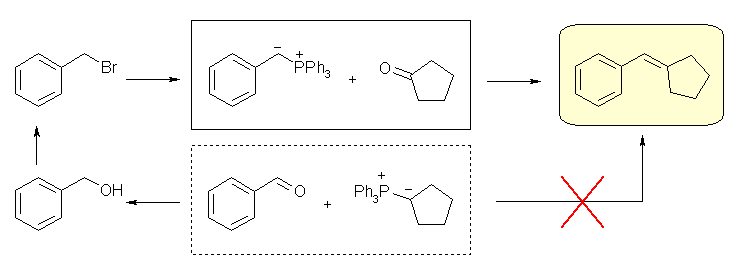
二重結合の部分が Wittig 反応によって新たにできた結合である。Wittig 反応は、4置換アルケンが生じない以外は、かなりの自由度があり、どちらをカルボニル化合物とし、どちらをリンイリドとするかは、原料の入手しやすさで決めてよい。すなわち、このような非対称なアルケンを合成する問題では、ケトンとリンイリドとして、2通りの組み合わせがありうるように見える。実際には、より置換基の少ないほうのパーツをリンイリド由来として合成する。これは、リンイリドを合成する際、ハロゲン化アルキルの SN2 反応を含むからである。(例題 19.3 「解き方」参照)
(解答例)
(a) ethylidenecyclohexane ← cyclohexanone + ethylidenetriphenylphosphorane
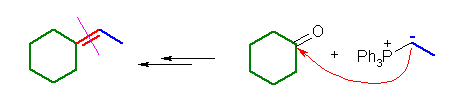
(b) 3-methylenecyclohexene ← cyclohex-2-enone + methylenetriphenylphosphorane
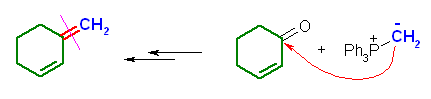
(c) 2-methylhex-2-ene ← acetone + butylidenetriphenylphosphorane
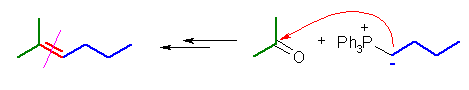
(d) (2-methylpropenyl)benzene ← acetone + benzylidenetriphenylphosphorane
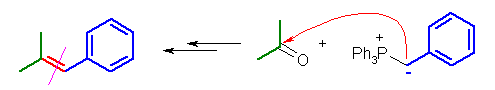
(e) 1,2-diphenylethene ← benzaldehyde + benzylidenetriphenylphosphorane
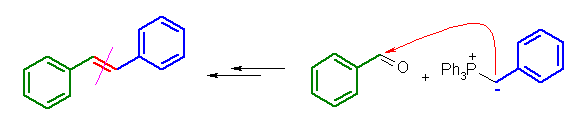
(E) 体と (Z) 体の混合物となると予想される。上図は (E) 体。
Wittig 反応に関連する物質の命名。
3本の結合をもつリン化合物は、phosphine ( PH3 のこと)を母体として、5本の結合をもつリン化合物は、phosphorane ( PH5 のこと)を母体として命名される。すなわち、Ph3P=CH2 は、中心の phosphorane (5本の結合を持つリン)に、3つのフェニル基と、メチレン基を持つから、methylenetriphenylphosphorane となる。
教科書には「リンイリドのことをホスホランとも呼ぶ」と解釈できるような書き方がしてあるが、これは厳密には正しくない。イリドとは、正と負の電荷が隣接した原子上にあるような分子種一般をさすので、「Ph3P(+)−CH2(-)」などである。ホスホランは5本の結合を持つリン化合物である。実際には、リンイリドと呼ばれるものは、リンイリド「Ph3P(+)−CH2(-)」とホスホラン「Ph3P=CH2」の共鳴で表されるような構造をもつ。このため、命名においては「リンイリドとして」ではなく「ホスホランとして」の構造に基づいて命名される。
二価基の命名規則について再掲(17.39 の発展にも記載)。
alkane より水素を一つ除いて遊離原子価のある(結合する余地を残す)炭素をもつものが alkyl 基であった。(例: methane → methyl, ethane → ethyl)
語尾が -yl の1価のアルキル基から、その同一の遊離原子価炭素から水素を、さらに1つまたは2つ取り除いてできる置換基(2価基、3価基)は、語尾を -idene, idyne とする。
| 炭素数 | 1価基 | 2価基 | 3価基 |
|---|---|---|---|
| 1 | −CH3, methyl | =CH2, methylidene * | ≡CH, methylidyne |
| 2 | −CH2CH3, ethyl | =CHCH3, ethylidene | ≡CCH3, ethylidyne |
| 3 | −CH2CH2CH3, propyl | =CHCH2CH3, propylidene | ≡CCH2CH3, propylidyne |
| (2) | −CH=CH2, vinyl | =C=CH2, vinylidene | − |
| (3) | −CH(CH3)2, isopropyl | =C(CH3)2, isopropylidene | − |
19.17, 16
β-ionylideneacetaldehyde と β-carotene の構造を比較して、どの二重結合が Wittig 反応で生じているのかを決める。
(解答例)
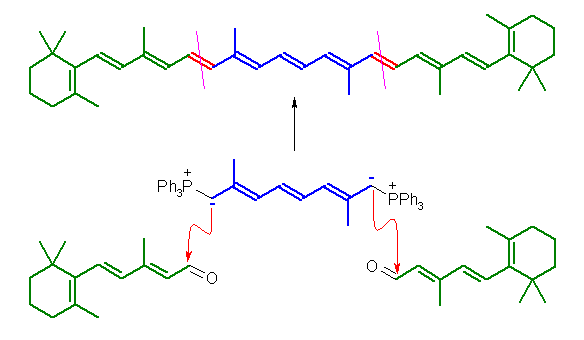
ジイリドは、2,7-dimethyloctane-2,4,6-trienediylidenebis(triphenylphosphorane)
β-ionylideneacetaldehyde の系統的組織名は (2E,4E)-3-methyl-5-(2,6,6-trimethylcyclohex-1-enyl)penta-2,4-dienal
19.18, 17
このアルデヒドは、α 水素を持たないから、アルドール反応はおきない。分子内の Cannizzaro 反応がおきる。19.13 節の解説と図を参照して反応機構を書くこと。
(解答例)
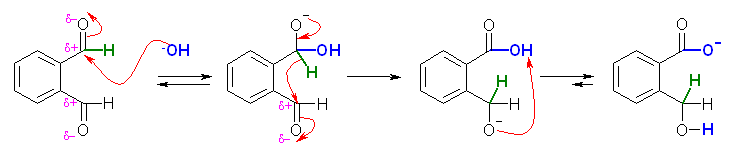
まず、水酸化物イオンが求核的にカルボニル基に付加する。この反応は、カルボニル化合物の水和反応で見たとおり、可逆である。アルデヒドは、通常、カルボニル基に(脱離しにくい)水素しか結合していないから、求核置換ではなく求核付加反応となるのだが、例外的に、(カルボニル基を持つ化合物の中では最も求核反応を受けやすい)アルデヒドがヒドリドの受容体となる Cannizzaro 反応の場合は、ヒドリドが脱離することになる。この2段階目のステップは、非可逆である。(カルボキシ基は、ホルミル基よりずっと求核反応を受けにくい。)ここで、分子内にカルボキシ基とアルコキシドが共存することになるが、カルボン酸とアルコールでは、カルボン酸の方がずっと酸性度が高いから、プロトン移動が起こる。この3つ目のステップは可逆であるが、平衡は大きく右へ傾いている。周囲の水などからプロトンを受け取れば、分子内 Cannizzaro 反応の生成物である o-(ヒドロキシメチル)安息香酸を生じる。
19.19
19.14 節を参照すること。アミンの共役付加などと同じことが起きる。
(解答例)
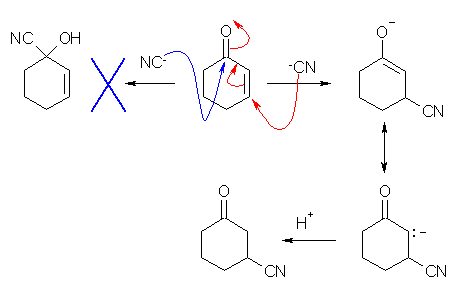
シアン化物イオンがカルボニル基に直接攻撃をすると、水酸基とシアノ基が同じ炭素に結合したシアノヒドリンとなるのだが、2-シクロヘキセノンのような α,β-不飽和ケトンに対しては、シアノ基は共役付加する。このとき生じるエノラートアニオンは上の反応機構で示したような共鳴をもつから、カルボニルの α 位でプロトンをうけとって、β-ケトニトリルを与える。
19.20, 18
問い 9.19 も参照すること。共役付加においては、カルボニル基の β 位への付加となることに着目して、この生成物を与えるような前駆体を考えればよい。
(解答例)
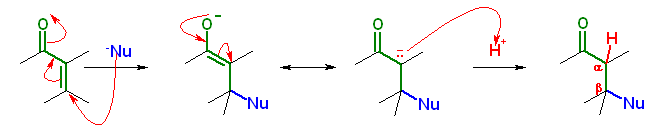
反応機構は、上の図のようになっている。
(a)
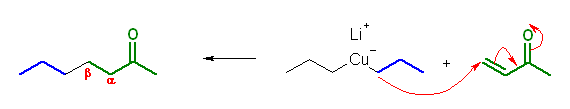
(b)
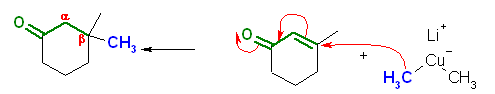
(c)
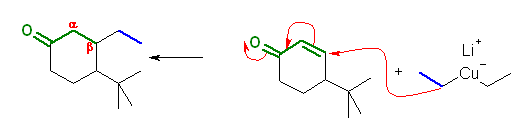
(d)
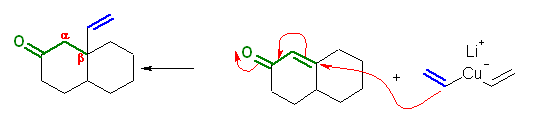
(b) 〜 (d) については、上のような分子内の反応も考えられるが、このような形で Gilman 試薬を調製するのは難しい。(Gilman 試薬は、アルキルリチウムから調製するが、アルキルリチウムは分子内でカルボニル基と反応してしまう可能性がある。)
19.21-19.30 (19-27)
(19.21-19.24 は、分光学の問題なので省略。)
19.25, 22
酸素は赤、窒素は青である。構造式に書き直してみると判りやすいかもしれない。(a) は環状のアセタール、(b) はイミン、(c) はエナミン、(d) は2級のアルコールである。いずれもアルデヒドやケトンから合成できる。
アセタールの生成については、19.11節、イミン、エナミンの生成については 19.9節を参照のこと。また、(d) については、17章を参考にしつつ、同時に 19.8節を参照すること。
(解答例)
(a)
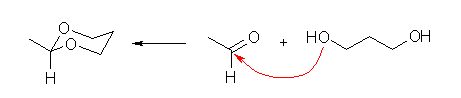
アルデヒドと二価のアルコール(ジオール)を用い、酸触媒で脱水縮合することで環状アセタールを合成することができる。反応は、プロトン化をうけたカルボニル基にアルコールの酸素が求核攻撃するところから始まる。生じたヘミアセタールは、水酸基がプロトン化を受け、求核攻撃を受けやすくなると同時に水の脱離が可能となる。ここに、ジオールのもう一方の酸素が攻撃し、アセタールを生じる。この反応は可逆であるから、系から、生じた水を除く工夫をしてやると反応の平衡位置が生成物よりとなる。
(b)
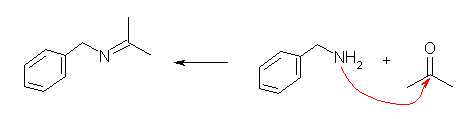
イミンの C=N の二重結合は、カルボニル基由来である。アセトンとベンジルアミンからこのイミンが生じる。
(c)
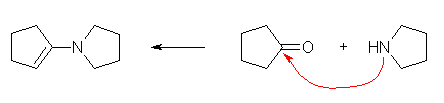
エナミンは、2級アミンとカルボニル化合物の反応で生じる。特にこの5員環のアミン(ピロリジン)は、有機合成においてエナミンを経由したいとき代表的に使われる2級アミンである。エナミンにおいては、C-N の単結合がカルボニル基由来の位置であることに注意して、出発物質を選ぶ。この問いにおいては、シクロペンタノンとピロリジンの反応。
(d)
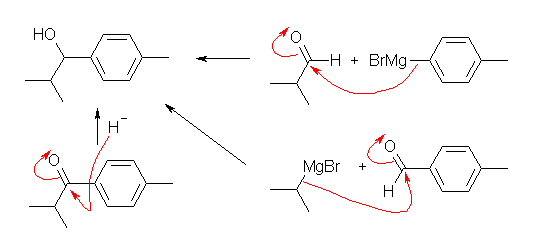
2級アルコールは、ケトンを還元することで得られる。この場合は、カルボニル基に対するヒドリドによる求核攻撃とみなすことができる。還元剤としては、 NaBH4 などが用いられる。NaBH4 を用いる場合は、エタノール等を溶媒として用いることが可能である。また、ヒドリドの反応の後処理として、(アルコキシドをアルコールに戻すために)希酸による処理を行う必要があるが、エタノールのようなプロトン性溶媒を用いた場合は、溶媒がそのままその役割を果たす。LiAlH4 のように強いヒドリド供与性の試薬でも、同じように還元がおきる。LiAlH4 を用いるときは、完全に脱水された非プロトン性の溶媒中で反応を行う必要がある。(そうでないと、LiAlH4 が水や溶媒由来のプロトンと反応してしまうため。)また、反応の後処理として、希酸性水溶液による処理が必要である。
また、2級のアルコールは、アルデヒドとグリニヤル試薬との反応でも生じる。グリニヤル試薬のように金属と結合した炭素は、負に分極しており、求核攻撃可能なカルボアニオン等価体として反応を設計することができる。
19.26, 23
カルボニルに求核試薬が攻撃したときの一般の形は、大体こんな感じ。
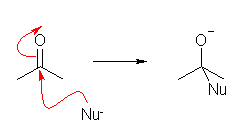
これと図をみくらべてみる。
(解答例)
求核種は5員環のアミン、ピロリジン。ケトンは 3-methyl-2-butanone
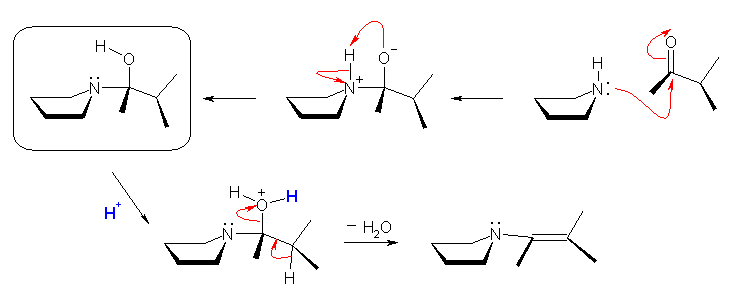
テキストの図は、上の枠内のアミノアルコール。これが酸触媒によって水酸基がプロトン化をうけると、脱離基となる。隣接した炭素のプロトンとともに E2 的に脱離しながら二重結合をつくって生成物を与える。この反応の際、位置的に脱離可能な水素には二種類あるが、より級数の大きい炭素から水素が引き抜かれ、より安定な生成物を与える(ザイツェフ則)。
19.27, 24
分子が、平面的な構造を持っていることを図から読み取ることができる。
(解答例)
(a) 窒素原子は、3本の結合が平面内にあり、互いにおよそ120度の結合角をもった関係にある。すなわち、これは sp2 混成となっている。もうひとつの p 軌道はこの平面とは直交した方向にある。
(b) 3つの sp2 混成軌道は3本のシグマ結合を作っている。孤立電子対は、この平面に直行した方向の p 軌道に入っている。
(c) 窒素の孤立電子の入った p 軌道と、隣接した二重結合の p 軌道は同じ方向を向いている。3つの平行な p 軌道の中に4つの電子が入った状態で、これを共鳴構造として描くと次のようになる。
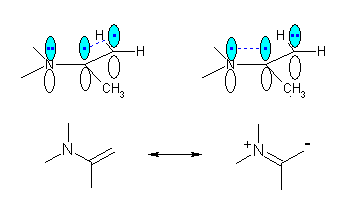
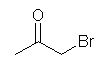
19.28, 25
問い 19.2 と同様に。
(解答例)
(a) bromoacetone; 1-bromo-2-propanone; 1-bromopropan-2-one
なお、acetone は誘導体を作ってよい慣用名。アセトンには水素が1種しかないので、臭素の位置を特定する数字はつけなくてよい。
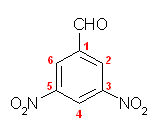
(b) 3,5-dinitrobenzenecarbaldehyde; 3,5-dinitrobenzaldehyde
benzaldehyde は誘導体を作ってよい慣用名。
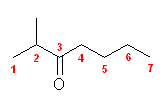
(c) 2-methyl-3-heptanone; 2-methylheptan-3-one
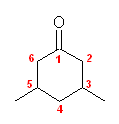
(d) 3,5-dimethylcyclohexanone
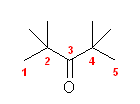
(e) 2,2,4,4-tetramethyl-3-pentanone; 2,2,4,4-tetramethylpentan-3-one
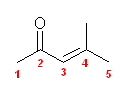
(f) 4-methyl-3-penten-2-one; 4-methylpent-3-en-2-one
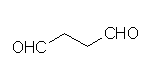
(g) butanedial
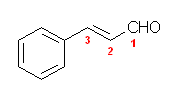
(h) 3-phenyl-2-propenal; 3-phenylprop-2-enal; cinnamaldehyde
cinnamaldehyde (和名 ケイヒアルデヒド、シンナミルアルデヒド)は、誘導体を作ってよい慣用名。ケイヒとは、桂皮つまりシナモンのこと。
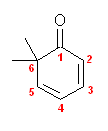
(i) 6,6-dimethyl-2,4-cyclohexadienone; 6,6-dimethylcyclohexa-2,4-dien-1-one
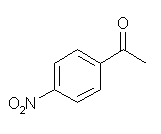
(j) p-nitroacetophenone
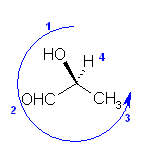
(k) (S)-2-hydroxypropanal; 2-hydroxypropionaldehyde
propionaldehyde は誘導体を作ってよい慣用名。
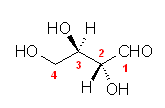
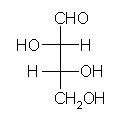
(l) (2S,3R)-2,3,4-trihydroxybutanal
右は、フィッシャー投影法で描いたもの。
19.29, 26
まず、分子式 C5H10O より、不飽和度を求めよ。アルデヒドおよびケトンは、炭素酸素二重結合を含む。これ以外に二重結合や環の結合があるかどうかを判断すること。
(解答例)
不飽和度は1。従って、カルボニル基以外に二重結合は含まれない。環状の構造もない。C5H12 の構造異性体をすべて書き、それぞれの骨格について炭素をカルボニル基にしたものが、今回の問いの答えとなる。
n-pentane から誘導されるもの。
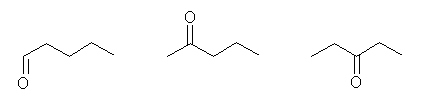
左より pentanal, 2-pentanone, 3-pentanone
2-methylpentane から誘導されるもの。
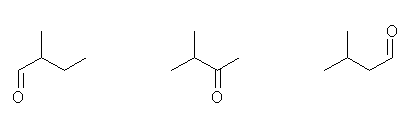
左より 2-methylbutanal, 3-methyl-2-butanone, 3-methylbutanal
2,2-dimethylpropane から誘導されるもの。
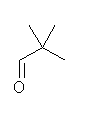
2,2-dimethylpropanal (慣用名: pivalaldehyde)
19.30, 27
19.1 節を参照のこと。ここに与えられた分子は、いずれもアルデヒドまたはケトンとして命名することができるものである。
(解答例)
(a) 3-methylcyclohex-3-enone
カルボニル炭素が1位。次に二重結合の位置をもとに番号をつける。(結果として、アルキル置換基の番号も小さくなっているが、二重結合の位置が優先。)
(b) (R)-2,3-dihydroxypropanal
慣用名:D-glyceraldehyde
(c) 5-isopropyl-2-methylcyclohex-2-enone
2-methyl-5-(1-methylethyl)cyclohex-2-enone
カルボニル炭素が1位。次に二重結合の位置をもとに番号をつける。(結果として、はじめに出現する(番号の小さい方の)アルキル置換基の番号も小さくなっているが、二重結合の位置が優先。)
(d) 2-methylpentan-3-one
(e) 3-hydroxybutanal
(f) 1,4-benzenedicarbaldehyde
p-benzenedicarbaldehyde
慣用名:terephthalaldehyde
IUPAC 系統名のうち、「1,4-」は2つの置換基の(絶対的な)位置での示し方、「p-」は2つの置換基の間の相対的な位置関係での示し方。
19.31-19.40 (28-38)
19.31, 28
(a), (c), (d) は、まず不飽和度を求めること。その上であり得る構造を考える。構造を書いてみたあと、分子式を確認して与えられたものに合致しているかどうかを確認すること。
(解答例)
(a) C6H8O の不飽和度は3。従って分子内に環構造と二重結合があわせて3つある。α,β-不飽和ケトンだけなら、炭素=酸素二重結合と炭素=炭素二重結合があり、不飽和度2に相当する。すなわち分子内に環の構造等があることになる。次図のようなものの中から1つを描けばよい。
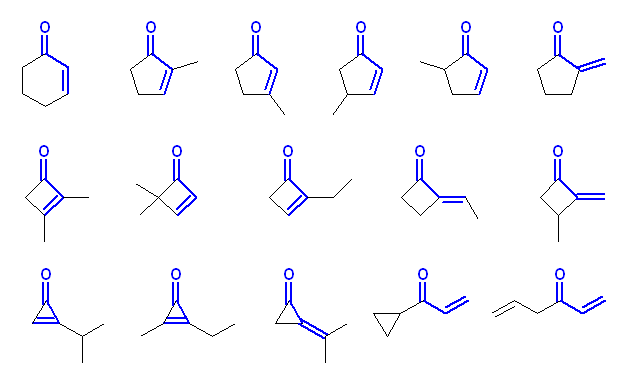
(b) カルボニル基の α 位とは、隣接した炭素のことであるから、1,2-ジケトン構造を含む分子を1つ描けばよい。炭素数が一番小さいものを以下に示す。
(c) C9H10O の不飽和度は5。ただし、フェニル基だけで不飽和度は4あり、またカルボニル基の部分で不飽和度1だから、分子内にベンゼン環とカルボニル基以外の二重結合や環の構造は含まない。
芳香族ケトンであるから、ベンゼン環にカルボニル基が直結している構造を考える。間に -CH2- などが挟まると、フェニル基の結合した脂肪族ケトンとみなすことになる。すなわち、以下に示したものの中から1つを描けばよい。
(d) C7H8O の不飽和度は4。ジエンアルデヒドと指定されているから、二重結合2つとアルデヒドのカルボニル基で不飽和度が3。これ以外に環の構造があると考えればよい。アルデヒドはケトンとは異なり、分子の末端部分にしかこないから、C6H8 の異性体を考え、そのうちの任意の一つの水素を -CHO ホルミル基に置換すればよい。従って、次図のようなものの中から1つを描けばよい。
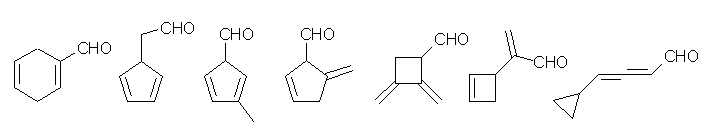
19.32, 29, 30
phenylacetaldehyde (phenylethanal) および acetophenone (1-phenylethanone) の構造は次の図の通り。
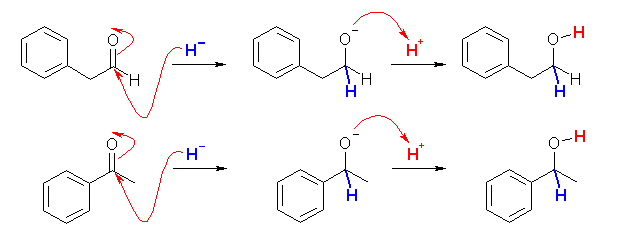
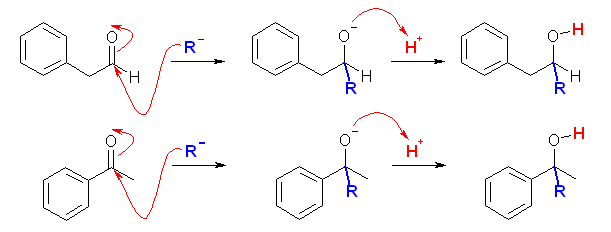
(a) NaBH4 は、アルデヒドおよびケトンをヒドリド還元する。
(b) Tollens 試薬は、アンモニア性の硝酸銀(銀イオン)である。銀イオンが還元されて金属の銀になると、銀鏡が生成される反応である。相手を還元するということは自身は酸化されることになる。アルデヒドは酸化されてカルボン酸を生じるが、ケトンは通常の条件ではこれ以上酸化されない。
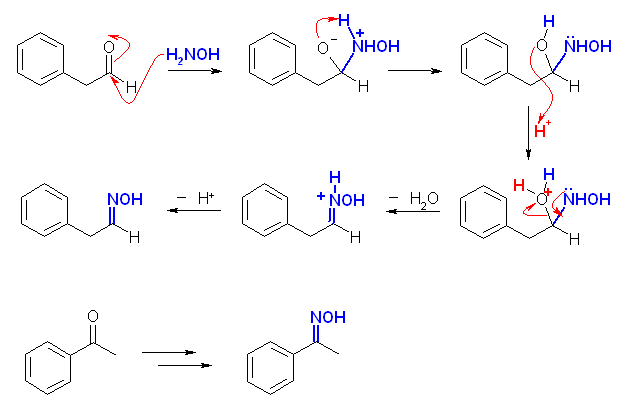
(c) ヒドロキシルアミンとカルボニル化合物の反応で、オキシムが生じる。1級アミンとカルボニル化合物の反応によりイミンが生じる反応と同じ機構を考える。
(d) グリニヤル試薬は、カルボアニオンと同じような求核試薬としてはたらく。
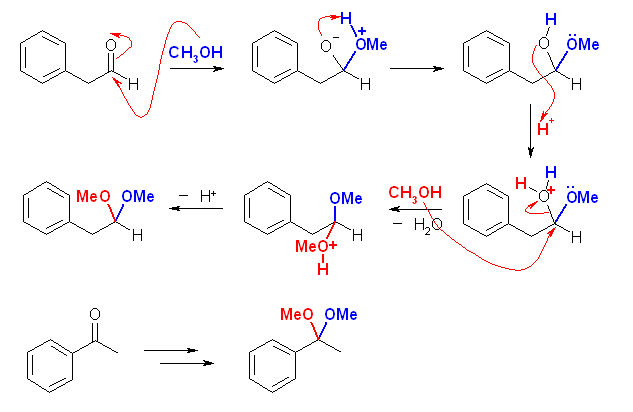
(e) 水和反応では水分子がカルボニル基に対して求核攻撃していったように、アルコール分子の酸素で求核攻撃させることを考える。
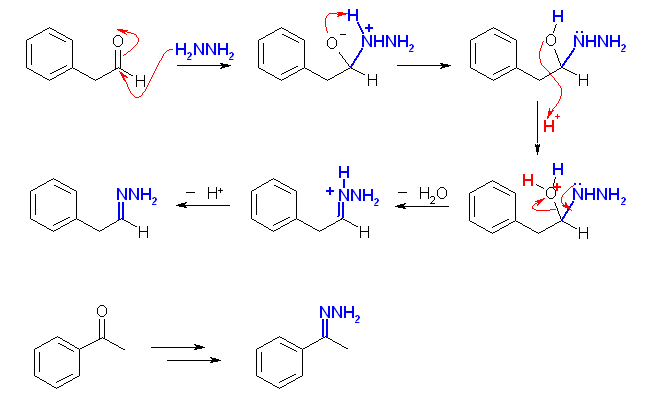
(f) ヒドラジンとカルボニル化合物は、脱水縮合によりヒドラゾンを生成する。KOH などの強塩基のある場合、Wolff-Kishner 反応の条件となる。
(g) Wittig 反応である。
(h) シアノヒドリンを形成する。
(解答例)
(a),(d),(h) の類似性に注目すること。(c),(f) の類似性に注目すること。以下の解答例では、この順に配列した。
(a)
(d)
(h)
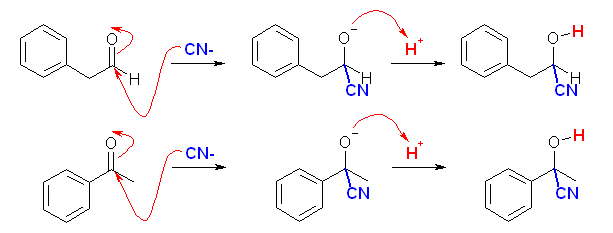
(c)
(f)
(e)
(g)
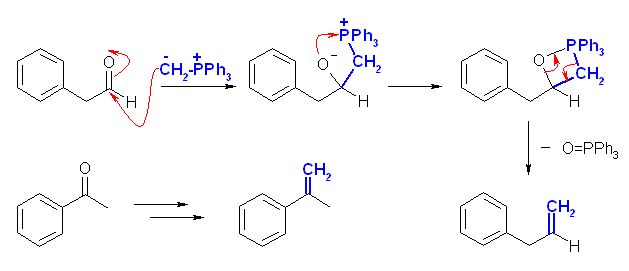
(b)
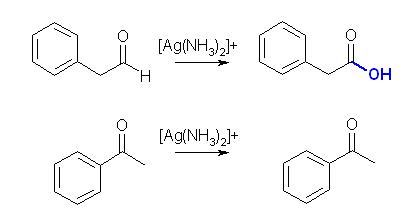
ケトンは酸化されない。
アンモニア性の硝酸銀溶液は、銀イオンにより、アルデヒドを酸化する試薬として用いられる。これは、逆にアルデヒドの検出反応として用いられる(銀鏡反応)。ところで、このような試薬をトレンス試薬というが、場合によってはアンモニアでアルカリ性にするのみならず、NaOH を加えることがある。このような溶液は、長期保存、あるいは蒸発により濃縮のあったような場合、爆発性の窒化銀が生じることがある。
特に水酸化ナトリウムを添加したような場合、硝酸銀の量によっては比較的短時間でも爆発性の窒化銀が生じることがあるとされている。窒化銀は、Ag3N の組成を持ち、黒色の小片で水に不溶の固体。雷銀ともよばれる。溶液中にあっても爆発した事故例がある。(特に、トレンス試薬はアルカリ性であり、容器の破裂や溶液の噴出により目に入ると失明などの恐れがある。)
このような実験を行う際には
・万が一に備え、保護めがねの着用を怠らない。
・実験書に記載された濃度などの範囲を守る。
などを遵守するように気をつけたい。
19.33, 31
2-cyclohexenone の構造と見比べて、どこが反応しているか考える。
(a) カルボニル基のみを選択的にメチレンまで還元している。
(b)、(c) カルボニル基の β 位に置換基が導入されている。
(d) メチル基が新たに導入されている。二重結合等、残っていないから、位置選択性は考えなくてよい。この問題に限っては、2-cyclohexenone ではなく、cyclohexanone でも同じであるとして考えてもよい。
(解答例)
(a) Wolff-Kishner 反応を用いる。1) H2NNH2, 2) tBuOK / DMSO-tBuOH
(b) 共役付加させるため、Gilman 試薬(銅酸リチウム試薬)を用いる。1) LiPh2Cu、2) H3O+
(c) 共役付加で (b) と同じ位置に置換基を導入したのち、置換基をカルボキシ基にしなければならない。(グリニヤル試薬と二酸化炭素のような反応で、直接カルボキシ基を導入することができた。この場合、二酸化炭素の炭素原子に対する求核攻撃で反応がはじまる。すなわち、二酸化炭素は求電子試薬としてはたらいている。共役付加反応では、求核試薬が反応するのだから、二酸化炭素を用いることはできない。)
シアノ基は、加水分解によりカルボキシ基に変換することが可能だから、シアン化物イオンを求核剤として用いる反応が候補の1つとなる。もしシアン化物イオンがカルボニルの β 位に共役付加(1,4-付加)すれば、これを加水分解することで目的の化合物を得る。
共役付加は、アミンや Gilman 試薬で起こりやすいから、Gilman 試薬を用いた場合について考えてみる。カルボン酸は、二重結合の酸化開裂によっても生じたから、この反応を用いることが可能である。すなわち Li(CH2=CH)2Cu により、ビニル基を導入し、つづいてこれを酸性過マンガン酸カリウムなどで酸化開裂させればよい。
(d) カルボニル基や二重結合は、あとから取り去ってしまうことは簡単だから、まずメチル基を導入する方法を考える。1つは、Grignard 試薬, CH3MgBr を用いる方法である。Grignard 試薬は共役付加せずにカルボニル基に直接攻撃して、主として 1-methyl-2-cyclohexene-1-ol を生じる。これを脱水すると 2-methylcyclohexa-1,3-diene などとなるから、これを Pd/C などを触媒として水素添加すればよい。
また、Gilman 試薬 Li(CH3)2Cu を求核剤として用いると、共役付加して 3-methylcyclohexanone を生じる。カルボニル基は Wolff-Kishner 反応で還元できる。
Wittig 反応を用いることも可能である。2-cyclohexenone と methylenetriphenylphosphorane H2C--P+Ph3 の反応により 3-methylenecyclohexene を生じるから、これを Pd/C などを触媒として水素添加すればよい。
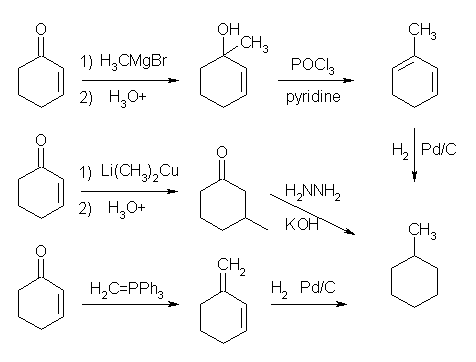
19.34, 32
Wittig 反応では、二重結合ができる。リンイリドには置換基の少ないほうをあてるのが一般的である。
(解答例)
(a)
(b)
(c)
(d)
19.35, 33
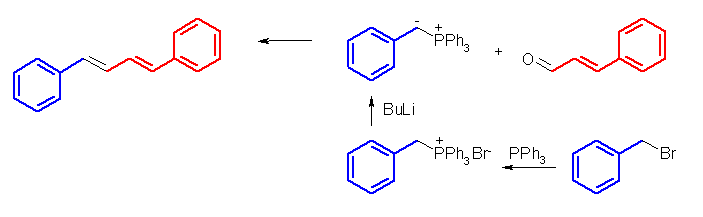
リンイリドの調製の手順を考えてみること。
(解答例)
フェニル基は α 水素を持たないから、ホスホニウム塩を強塩基で処理すると、ハロゲン化アルキル由来のメチレンからのみプロトンが引き抜かれ、上図のようなリンイリドを生じる。
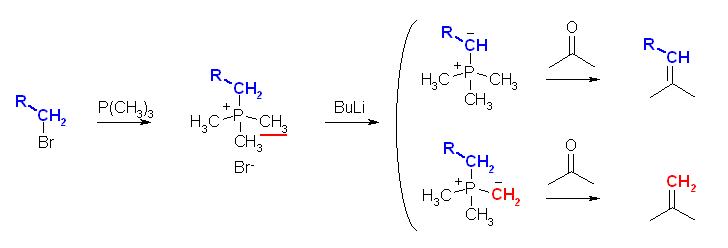
これに対し、トリメチルホスフィンを用いた場合、ホスホニウム塩を強塩基で処理すると、ハロゲン化アルキル由来のメチレン以外に、メチル基にも酸性度の高い α 水素があるため、2種類のリンイリドの混合物を生じる。これがカルボニル化合物と反応すると、目的とするアルケン以外に、メチレン化された化合物ができてしまうことになる。
19.36, 34
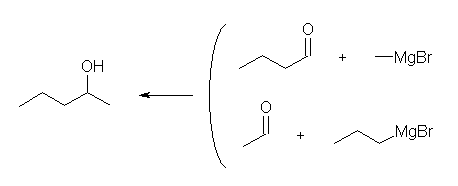
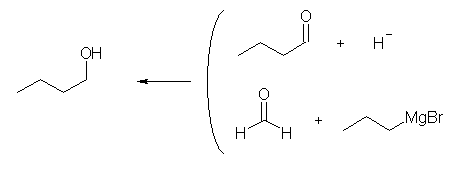
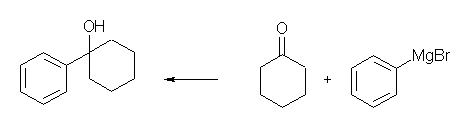
アルデヒドと Grignard 反応では2級のアルコールが、ケトンと Grignard 反応では3級のアルコールが生じる。1級のアルコールは、アルデヒドをヒドリド還元することにより得られるが、 Grignard 反応で1級のアルコールを得るためには、ホルムアルデヒドを用いる必要がある。
(解答例)
(a)
(b)
(c)
(d)
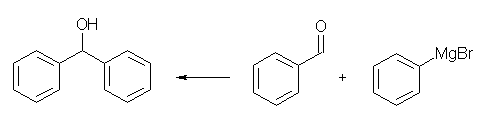
19.37, 35
(a) エーテルの反応性を思い出すこと。主に求核性の強い酸にしか反応しない(求核試薬が反応しているのは、プロトン化を受けたエーテルである)から、アルキル基上にメトキシ基があっても、ハロゲン化アルキルからホスホニウム塩経由でリンイリドを合成するのと同じように合成できる。
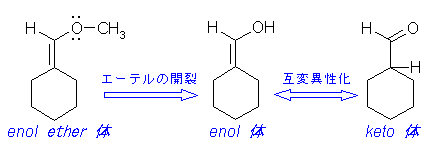
(b) エノールエーテルを開裂して生じるエノール型分子は、互変異性化によりケト型を生じる。(下図)
一般に、酸性での加水分解では、1) プロトンの付加によりカルボカチオンが生じる過程、 2) 水が付加する過程 を含む。それぞれ、どの位置で起きるかを考える。すべて可逆であることに注意して反応機構を書くこと。
(解答例)
(a) リンイリド ((methoxymethylene)triphenylphosphorane) を発生させる反応は、次の通り。ハロゲン化アルキルとして、 bromomethyl methyl ether などを用いる。
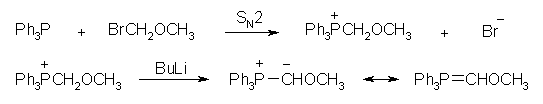
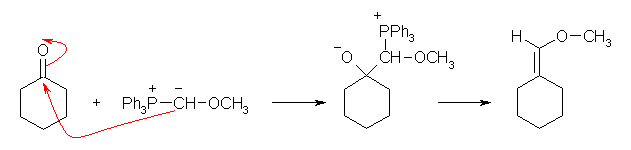
このリンイリドは、cyclohexanone との通常の Wittig 反応によって、(methoxymethylene)cyclohexane を生じる。
(b)
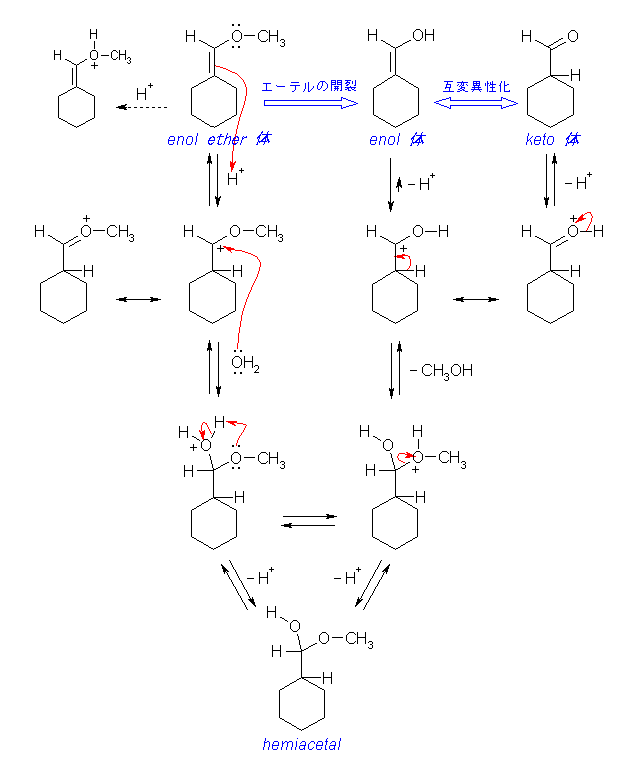
はじめに、enol ether の構造を持つ分子に、酸性条件下、プロトンを付加させることを考える。二重結合の π 電子と、酸素の孤立電子対がプロトン化を受ける位置として考えられるが、二重結合の π 電子がプロトン化を受けた場合は上図のような共鳴が考えられるため、より生じやすいと考えられる。(また、酸素上にプロトン化しても、引き続いて起きる反応がない。二重結合炭素の上では求核置換反応が起きないから。)
生じたカルボカチオンに、求核的に水が付加すると、ヘミアセタールのプロトン化された構造の分子となる。
プロトンがアルコキシ基上に移動し、引き続いて中性のアルコールが脱離して生じるカルボカチオンは、上図のような共鳴を持つ。
keto = enol 互変異性化も、酸触媒によって上図のような機構で進行するが、溶液中では平衡は大きく keto 型に傾いている。
19.38, 36
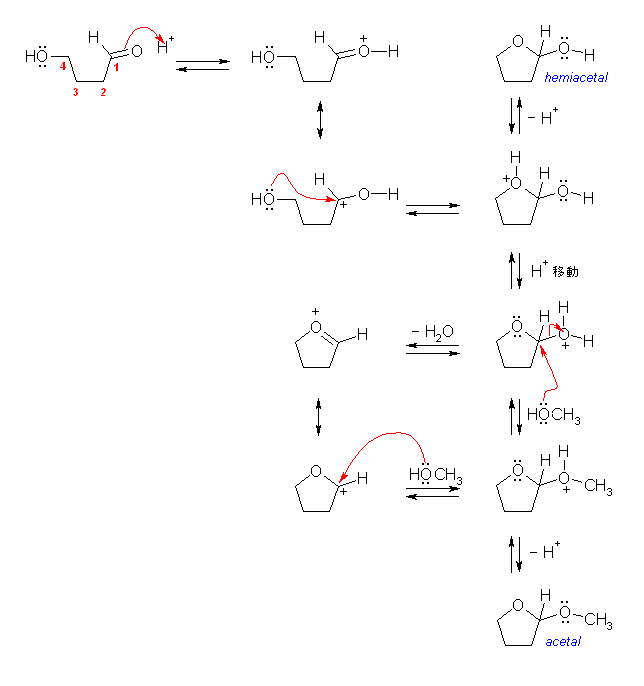
4-hydroxybutanal は、水酸基とアルデヒド基を持つから、酸触媒により、分子内でヘミアセタールを可逆に形成することができる。ヘミアセタールは、通常、平衡がケトン体に傾いている。更にメタノールが存在すれば、アセタールを生じることができる。教科書 19.11 節を参照。反応機構は、図19.12 を参照のこと。
(解答例)
酸触媒によりカルボニル基がプロトン化されると、より求核攻撃をうけやすくなるので、分子内の求核付加により、環状のヘミアセタール(にプロトン化したもの)が生じる。プロトン移動の後、SN2 反応でプロトン化水酸基がメタノールで置換される(または、SN1 的に、中性の水で脱離して生じるカルボカチオンにメタノールが付加する)ことで、環状のアセタールである 2-methoxytetrahydrofuran が生じる。
19.39, 37
求核反応は、ケトンよりもアルデヒドの方が反応しやすい。(ケトンは、カルボニル基に(弱い)電子供与性基であるアルキル基が結合しているからである。(a) は、ケトンが反応せずにアルデヒドのみが反応しているから、試薬の量を1等量にし、更に反応の選択性を上げるために低温で反応するなどすればよいが、(b) では、出発物と生成物を比較したとき、アルデヒド部分がそのまま残り、ケトンのカルボニル基のみが反応している。このようなものについては、保護基が必要である。
(解答例)
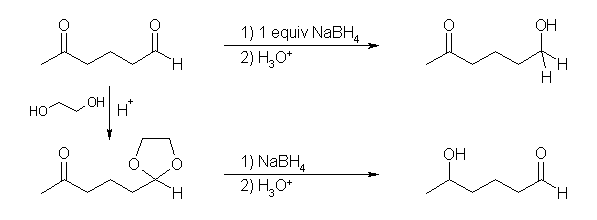
(a) 1等量の NaBH4 で還元すると、ケトンより先にアルデヒドが還元されて 6-hydroxyhexan-2-one を生じる。(過剰の NaBH4 を用いると、ケトンも還元されて、hexane-2,6-diol を副生してしまう。)
(b) 酸触媒と1等量のエチレングリコールを用いて、生成する水を除きながら平衡を生成物側に偏らせながら行うと、アルデヒド部分のみが環状のアセタールとなる。これを NaBH4 で還元したのち、強い酸で処理すると、アセタールの加水分解反応まで進行し、5-hydroxyhexanal が生じる。(NH4Cl 水溶液のように弱い酸を用いて、注意深く扱うと、環状アセタールの部分を残したまま還元生成物であるアルコールを得られるかもしれない。)
19.40, 38
(a) 逆合成の考え方に従い、アルデヒドを生じる反応を考えると、1級アルコールの酸化、二重結合のオゾン酸化開裂、エノールの互変異性化による反応、などが使える可能性がある。
また、出発物から生成物になる過程で、炭素数が1増えている。アルデヒドのカルボニル基を求電子剤として、これに対して求核攻撃をするパターンと、アルデヒドをアルコールに還元してハロゲン化物に変換したのち、グリニヤル試薬として求核試薬として用いるパターンとがありえる。アルデヒドに対する求核試薬としては、グリニヤル試薬、リンイリド(Wittig 反応)、シアン化物イオン(シアノヒドリン生成)などが使える可能性がある。
(b) 逆合成の手法で考える。このエナミンは、ケトンと2級アミンの反応で生じる。さらに、このケトンを合成するためには、(a) と同様に、炭素数が1増えていることから考えること。
(c) Wittig 反応を利用することが可能である。ただし、リンイリドの原料となるハロゲン化アルキルは、一般的に1級のものを用いる必要があることを思い出すこと。
(解答例)
以下に、合成ルートの例とその概略を示す。下記以外にも合成法はあり得る。
(a)
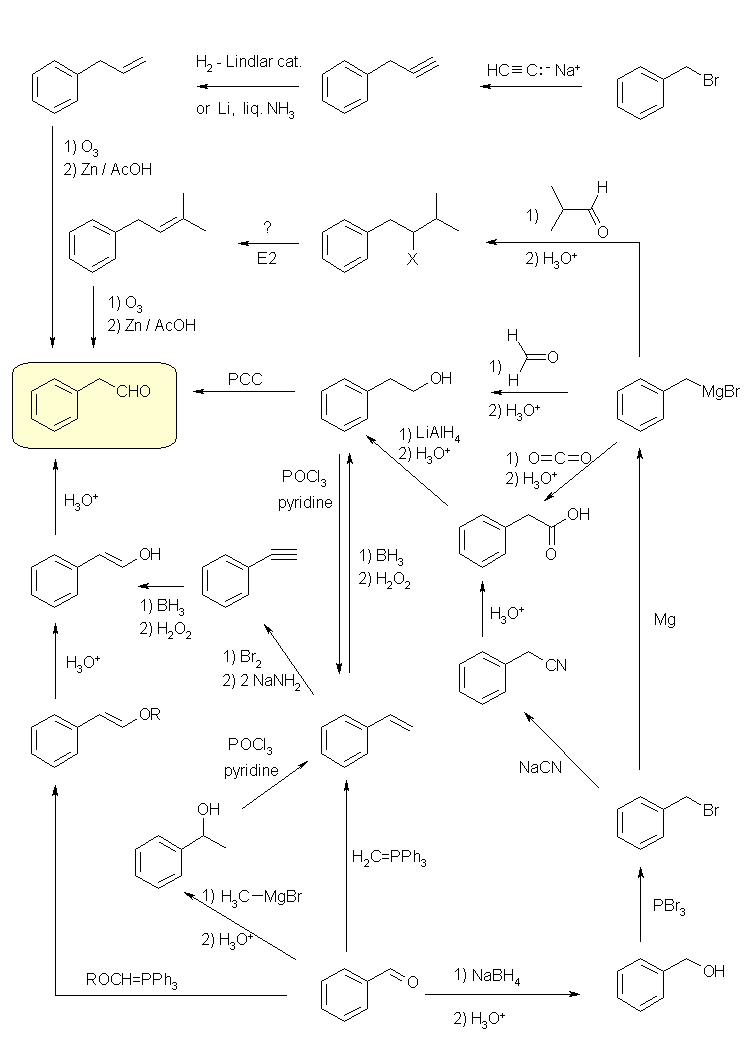
まず、オゾン酸化開裂で目的のアルデヒドとするためには、ベンゼン環の β,γ 位が二重結合となったアルケンを合成する必要がある。上のスキームでは、ベンジルブロミドの臭素を、アセチリドアニオンで求核置換し(教科書 8.8 節)、三重結合を二重結合まで還元(教科書 8.6 節)することが可能である。また、ベンジルブロミドから生じさせたグリニヤル試薬と 2-メチルプロパナールを反応させ、図中 -X で表した水酸基を、ハロゲンやトシラートなどの脱離基に変換後、E2 脱離させることで 2-メチル-4-フェニル-2-ブテンとすることとしている。(ただしこの図の化合物の方が多置換のアルケンであるが、もう一方の脱離生成物 1-フェニル-3-メチル-1-ブテンの方がフェニル基と共役した二重結合で安定であるため、脱離反応の位置選択性は条件等により変わる可能性がある。)
次いで、1級アルコールの酸化(PCCなど)によりアルデヒドを得るためには、2-フェニルエタノールを得る必要がある。これは、スチレンの水和(アンチマルコフニコフ付加とするため、ヒドロホウ素化法を用いる)のほか、ベンジルブロミドから生じさせたグリニヤル試薬とホルムアルデヒドの反応、またフェニル酢酸(や、そのエステル)の還元で得ることが可能である。フェニル酢酸は、ベンジルブロミドの臭素を、シアン化物イオンで求核置換して得られるフェニルアセトニトリルを加水分解すると得られる。(フェニル酢酸、フェニルアセトニトリルなどは、「覚せい剤取締法」などの法律により、製造や所持等に規制がある。)
最後に、エノールの互変異性化でアルデヒドとすることができるが、2-フェニルエテン-1-オール を合成するためには、フェニルアセチレンにヒドロホウ素化法で水和する他、問い 19.37 と同様の方法でメトキシメチレントリフェニルホスホランを用いた Wittig 反応と、それに引きつづく加水分解で得ることができる。
(b)
2級アミンとケトンの反応でエナミンとすることができるから、アセトフェノンを合成する必要がある。アセトフェノンの原料となる 1-フェニルエタノールは、メチルグリニヤルや、メチルリチウムなどの金属試薬とベンズアルデヒドから合成できる。また、(a) と同様にエノールの互変異性化反応でアセトフェノンとするためには、フェニルアセチレンにマルコフニコフ配向となるように水和させればよい。
(c)
ベンズアルデヒドは NaBH4 で還元してアルコールとしたのち、PBr3 による処理などでベンジルブロミドとすることができる。これをトリフェニルホスフィンで処理してホスホニウム塩とした後、BuLi などの強塩基で処理してリンイリドとし、これをシクロヘキサノンと Wittig 反応させる。
19.41-19.50 (39-48)
19.41, 39
カルボンは、分子内に、α,β-不飽和カルボニルおよび二重結合があり、これらの位置が反応部位と考えられる。
(a),(c) Gilman 試薬、アミンは、共役付加生成物を与える。
(d),(g),(h) Grignard 試薬、リンイリドは、α,β-不飽和カルボニル基に対しても、カルボニル炭素へ求核攻撃する。酸性条件下の水やアルコールも同じである。 (b) LiAlH4 によるヒドリド還元では、カルボニル基のみが還元できる。( NaBH4 を用いたときは、飽和のアルコールを与えてしまうことがある。問い 17.49 の(発展)の項を参照のこと。)
(e) パラジウム触媒を用いた接触水素添加反応では、炭素=炭素二重結合のみが反応する。カルボニル基は反応しない(フェニル基に直結しているものを除く)。
(解答例)
(a) 
(b) 
(c) 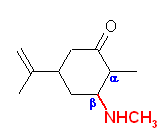
(d) 
(e) 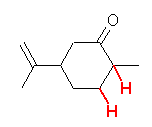
(f) 反応しない。
(g) 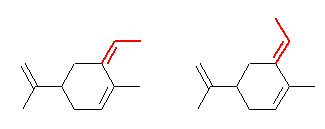
(h) 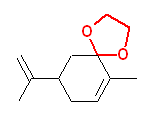
19.42, 40
(ジヒドロキシメチル)ベンゼンは、ベンズアルデヒドの水和によって生じる gem−ジオールである。ただし、(ジブロモメチル)ベンゼンの加水分解(NaOH を用いた求核置換反応)では、一度生じた(ジヒドロキシメチル)ベンゼンが平衡によりベンズアルデヒドとなると考えなくても、直接ベンズアルデヒドを生じる反応機構を書くことができる。
(解答例)
次図のような機構で進行すると考えられる。
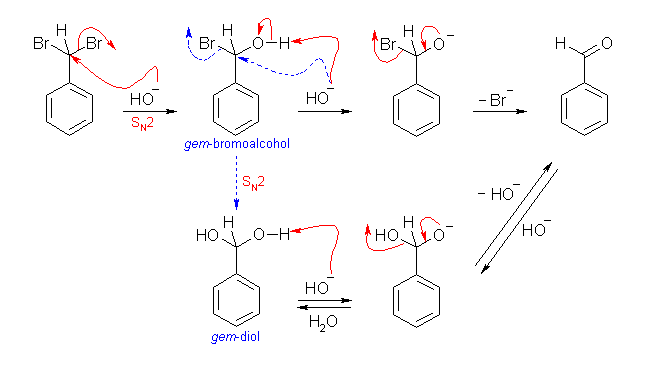
gem-bromoalcohol は、SN2 反応により再度の加水分解を受けて gem-diol になる前に、水酸化物イオンが塩基としてプロトンが引き抜かれ、さらに臭化物イオンが脱離する(HBr の脱離)。これにより、ベンズアルデヒドが生じる。
なお、ケトンやアルデヒドの水和反応は、酸、塩基のいずれでも触媒される。上の反応は、塩基触媒における水和反応の機構と類似である。(図の下段。)
19.43, 41
直接カルボニル基をメチレンに還元する方法として、Wolff-Kishner 反応、Clemmensen 還元、チオアセタールの Raney-nickel による還元などがある。
また、カルボニル基をヒドリド還元してアルコールとしたのち、更にこれを還元する方法として、脱水により二重結合にした後に接触水素添加する、ハロゲン化物やトシラートにしたのちヒドリドでの求核置換、ハロゲン化物を経由してグリニヤル試薬としたのち弱酸で処理する、などがある。
(解答例)
i) Wolff-Kishner 反応
反応が1段階であること、DMSO-tBuOH-tBuOK のような系を用いれば、室温付近で反応できること、などが利点である。アルカリ性であることが必須なので、アルカリに弱い官能基がある場合には使えないことが欠点となる。
ii) Clemmensen 還元
反応が1段階であることが利点である。酸性であることが必須なので、酸に弱い官能基がある場合には使えないことが欠点となる。ただし、この欠点は、Wolff-Kishner 反応と相補的である。また、有害な重金属である水銀を使用する点も欠点である。
iii) チオアセタールの Raney-nickel による還元
中性で反応を進行させることができるのが利点である。Raney-nickel による接触水素化反応で、二重結合が水素添加により単結合になるから、そのような官能基がある場合には使えないことが欠点である。また、チオアセタールとする際に、チオールを用いるが、一般的に低分子のチオールは特有の悪臭を持つ。
iv) カルボニル基をヒドリド還元してアルコールとしたのち、更にこれを還元する方法
水酸基をハロゲンに変換する過程を含む場合、グリニヤル試薬を経由したり、ヒドリドで還元したりする必要があるから、分子内に求核攻撃されやすい官能基がある場合には用いることができない。また、水酸基から脱水して二重結合にした場合、接触水素添加により単結合に還元することになるから、他に多重結合がある場合などには用いることができない。また、全体として複数の過程を必要とする点も欠点とも言える。
19.44, 42
(発展)の項を参照のこと。問い 17.22 では、ヒドリドが求核種であったが、この問いでは、シアン化物イオンが求核種である。
(解答例)
シアン化物イオンによる求核攻撃は、カルボニル基の2つのプロキラル面から同じ確率でおこるから、2つの立体異性体の等量混合物(ラセミ混合物)を与える。従って、生成物は不斉炭素をもつが、光学不活性である。
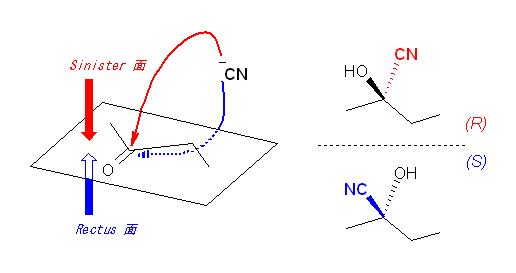
不斉なアルコールの前駆体カルボニル化合物は、ヒドリドがカルボニルを含む面のどちら側から攻撃するかにより、(R) 体、および (S) 体のいずれかが生じる。このような面のことを「プロキラル( prochiral )面」とよび、sp2-カルボニル炭素を中心として、3つの配位子(2つのアルキル基とカルボニル酸素)が、上から見て右回りになっている方の面を Rectus 面、左回りになっている方の面を Sinister 面と呼ぶ。 (問い 17.22 の発展の項、再掲)
19.45, 43
化合物名だけ並べても判りにくい場合は、まず構造式を描いてみること。どこがどのように変化しているかを調べて、適宜必要な反応を考える。すぐに判らない場合は、逆合成の考え方に従う。すなわち、自分の知っている反応の範囲で目的生成物を与える前駆物質を考える。次いで、これを与えることの可能な前駆物質を考える、ということを繰り返し、シクロヘキサノンに辿り着くまでつづける。
(解答例)
(a) 1-methylcyclohexene
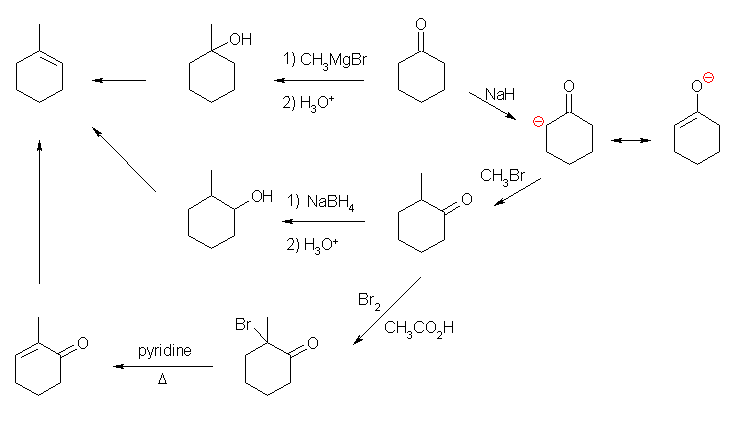
二重結合は、ハロゲン化アルキルやアルコールからの脱離反応で導入することが可能である。とすると、1-methylcyclohexene の前駆物質として、1-methylcyclohexanol または 2-methylcyclohexanol を考えることができる。1-methylcyclohexanol は、cyclohexanone に methyl magnesium bromide や、methyl lithium などを反応させることで得られる。2-methylcyclohexanol は、2-methylcyclohexanone をヒドリド還元で合成することにすると、これは、エノラートを経由したカルボニル基の α アルキル化(教科書の 22 章に詳しい。)を利用することが可能である。また、2-methylcyclohexanone は、酸触媒による α 臭素化(教科書 22.3 節)により、2-bromo-2-methylcyclohexanone としたのち、pyridine 中加熱して、2-methylcyclohex-2-enone とすることができるので、これを Wolff-Kishner 反応でカルボニル基をメチレンまで還元し、目的の 1-methylcyclohexene にすることもできる。
(b) 2-phenylcyclohexanone
カルボニルの α 置換反応は、エノラートイオンが求核種としてはたらくのであるから、ハロゲン化アルキル(や、トシラート)を用いることができるが、ハロゲン化アリールには適用できない。これは、芳香環上での求核置換反応が起きないからである。
2-phenylcyclohexanone を、フェニル基とシクロヘキサン環の間の炭素炭素結合の生成反応は考えにくいので、カルボニル基を水酸基の酸化により合成することを考えると、前駆物質は、2-phenylcyclohexanol である。これは、1-phenylcyclohexene の逆マルコフニコフ配向での水和(ヒドロホウ素化を経由)により合成できる。また、これは、 1-phenylcyclohexanol の脱水(酸による処理、または、ピリジン中オキシ塩化リンによる処理)による得られるから、cyclohexanone と phenyl magnesium bromide を反応させればよい。
(c) cis-1,2-cyclohexanediol
cis-1,2-ジオールは、アルケンに四酸化オスミニウムを処理して得ることができる。
(d) 1-cyclohexylcyclohexanol
3級のアルコールだから、ケトンとグリニヤル試薬の反応で合成する。グリニヤル試薬は、ハロゲン化アルキルより、ハロゲン化アルキルはアルコールより合成できる。
19.46, 44
反応式の通りに変換を行うための「試薬等の反応条件」の間違いを指摘し、正しい試薬等の条件を与えること。
(a) には、2箇所、(b)、(c) には1箇所の間違いがある。
(解答例)
(a) Ag+, NH4OH (Tollens 試薬) は、アルデヒドをカルボン酸に酸化する反応(19.3節参照)。アルコールをケトンに酸化するには、PCC などを用いる。
グリニヤル試薬は、共役エノンに対して、一般的にカルボニルへの攻撃により 1、2-付加生成物を与える。共役付加をさせたい場合は、Gilman 試薬( Li(CH3)2Cu )を用いるとよい(19.14節参照)。
(b) 酸性のクロム酸酸化では、1級アルコールはアルデヒドでとまらず、カルボン酸まで酸化されてしまう。代わりに PCC などを用いる。
ジメチルアセタールを得る反応は、正しい。
(c) シアノヒドリンの反応は、正しい(19.7節参照)。シアノヒドリンの生成では、シアン化物イオンが求核種であるから、HCN 以外に、KCN を加えてその濃度を高くすることにより、より効率よく反応させることができる。
シアノ基 -CN を、-CH2NH2 に変換するのは、ヒドリド還元であるから、LiAlH4 などで処理する。(NaBH4 では不十分である。)シアノ基を酸で処理すると、加水分解によりカルボン酸となると考えられる。
19.47, 45
問い 19.45 のヒントを参照。
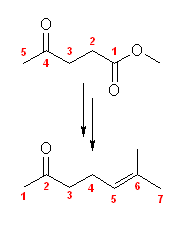
(解答例)
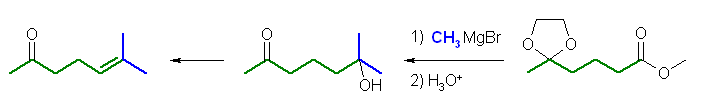
出発原料である methyl 4-oxopentanoate の主鎖炭素を、図中緑色で示した。
Wittig 反応を用いて二重結合をつくることを考えると、反応に関与しないカルボニル基は保護しておく必要がある。アセタールを保護基とした場合、酸で加水分解することで保護基をはずすことができる。この 6-methylhept-5-en-2-one ethylene acetal は、4-oxopentanal のケトン基をアセタール保護したもの ( 3-(2-methyl-[1,3]dioxolane-2-yl)propanal ) と、isopropylidenetriphenylphosphorane との間、または、acetone と環状アセタールを持つリンイリド 4-oxopentylidenetriphenylphosphorane ethylene acetal との間の Witttig 反応で合成することができる。前者でも合成は可能であるが、より級数の小さいリンイリドを用いるためには、後者を選ぶことになる。リンイリドは、対応するハロゲン化アルキルより、ホスホニウム塩を経由して合成するから、エステルを還元して生じた1級のアルコールがその前駆体である。(ただし、アルコールをハロゲン化アルキルに変換する際、酸性でアセタール保護基が外れてしまわないよう、反応条件等に注意しなければならない。)前者の組み合わせで Wittig 反応させる場合は、このアルコールを PCC 酸化により得たアルデヒドが用いられる。
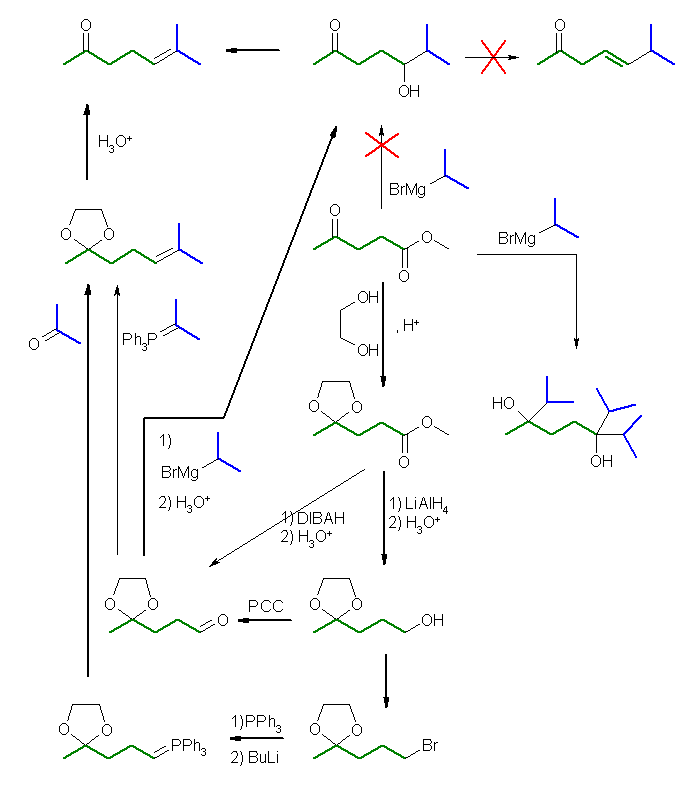
グリニヤル反応を用いる場合、エステルはグリニヤル試薬2等量と反応して1級のアルコールを与えるから、エステル部分を還元し、ひきつづいての PCC 酸化によりアルデヒドに変換したのち、isopropyl magnesium bromide のようなグリニヤル試薬と反応させることが必要である。また、このときも、ケトンのカルボニル基がグリニヤル試薬と反応してしまうから、あらかじめ、環状アセタールなどの保護基を用いる必要がある。
4-oxopentanoic acid のエステルではなく、5-oxohexanoic acid のエステル(の、ケト基をアセタールで保護したもの)であれば、methyl magnesium bromide 2等量と反応して、脱水により目的の 6-methyl-5-hepten-2-one を与えるようなアルコールを与えるので、カルボン酸の炭素鎖を1つ伸長させる反応経路も考えられる。(エステル→アルコール→ハロゲン化物→グリニヤル試薬→ホルムアルデヒドと反応→生じたアルコールをカルボン酸まで酸化→エステル化)
また、Gilman 試薬(有機銅(I)酸リチウム試薬)は、求核性が低く、カルボニル基があっても反応せず、選択的に酸クロリドと反応させることができる。しかし、4-oxopentanoyl chloride と反応させて得られるジケトンは、2つのカルボニル基を(どちらもケトンであり、同じ程度の反応性であるから)選択的に反応させることが難しい。従って、Gilman 試薬との反応の前にケトンのカルボニル基を保護しておく必要がある。
エチレングリコールを用いた環状アセタールの場合、2つの酸素を含む5員環は、1,3-dioxolane という慣用名を持つ。アセトンとエチレングリコールから生じた環状アセタール acetone ethylene acetal は、従って、2,2-dimethyl-1,3-dioxolane と命名も可能である。
19.48, 46
アルコールがチオールになった以外は、カルボニル化合物とアルコールからアセタールができる反応と同様である。19.11 節および、図 19.12 を参照すること。
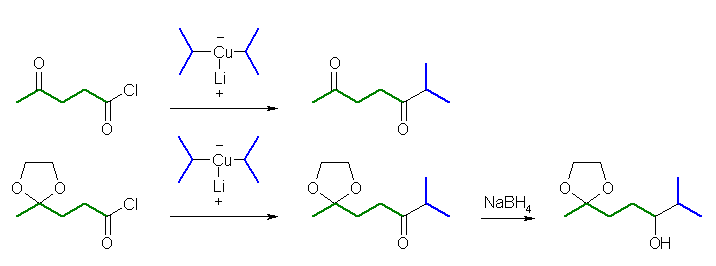
(解答例)
19.49, 47
Wittig 反応のはじめの段階においてはリンイリドが求核種であった。同様に、この反応ではリンイリドの代わりに硫黄イリドが求核種である。Wittig 反応では、イリドの求核攻撃により生じたベタインが4員環の遷移状態を経由してトリフェニルホスフィンオキシドが脱離した。この反応では、何が脱離するかは、生成物の構造から類推できるはずである。
(解答例)
対比できるように、Wittig 反応の機構を併せて示した。
19.50, 48
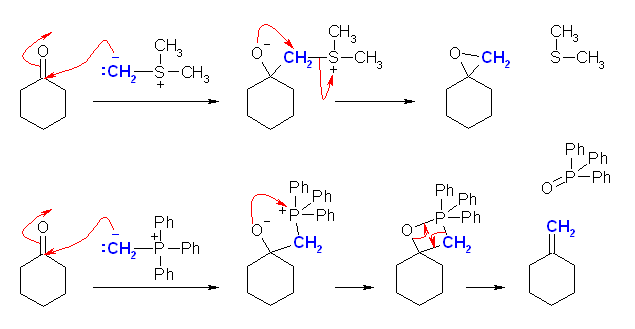
シアノヒドリンの生成が、生成物よりに偏っているとはいえ、可逆な平衡反応であったことを思い出すこと。
(解答例)
アセトンシアノヒドリンは、可逆反応により、脱プロトン化したのち、シアン化物イオンとアセトンを生成すると、そのシアン化物イオンは次にシクロヘキサノンと反応して、可逆にシクロヘキサノンシアノヒドリンを生じる。
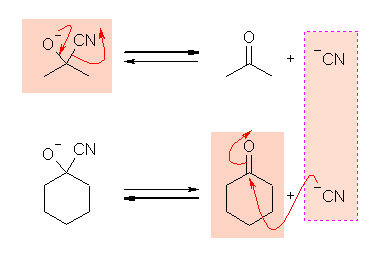
上図では、省略したが、シアン化物イオンがカルボニル炭素への求核攻撃し、次いでプロトン化する過程でシアノヒドリンが生じる。
19.51-19.58 (49-56)
19.51, 49
酸触媒で、二重結合にプロトンが付加してカルボカチオンを生じる。二重結合に対してのプロトン付加の位置は、カルボカチオンの安定性で判断できる。このカルボカチオンにアルコールの酸素が求核的に付加する。(そのまんまを授業でやったよねっ?)
(解答例)
DHP(ジヒドロピラン, dihydropyran)は、酸触媒によりプロトン化を受けて、酸素に隣接した炭素上に正電荷をもつカルボカチオンを生じる。これは、次図で表すような共鳴を持つため安定である。つづいて、アルコールの酸素が求核的に付加し、プロトンが脱離して THP(テトラヒドロピラニル, tetrahydropyran-2-yl)エーテルを生じる。
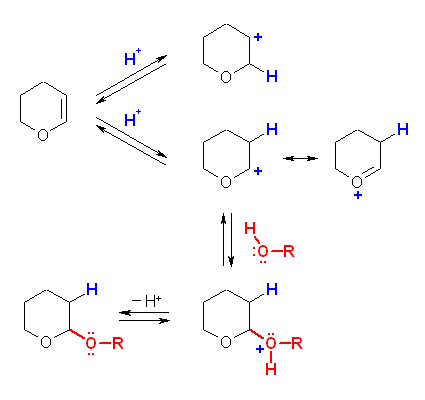
THP-エーテルは、アセタール構造を有しているため、エーテルを切ることのできるような求核性の高い酸(ヨウ化水素酸 HI など)を用いなくても、プロトン供与酸で切ることができる。
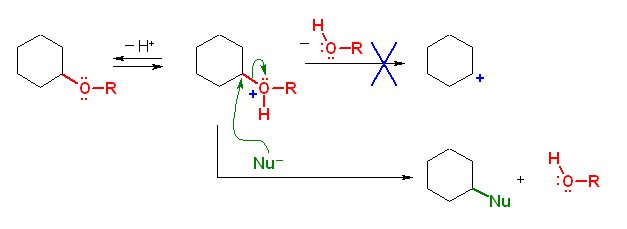
対比のため、エーテルの酸による開裂の機構を示した。エーテル酸素がプロトン化された後、THP-エーテルやアセタール(そして、3級のエーテル)などでは脱離するカルボカチオンが安定であるのに対し、1級および2級のエーテルからは安定なカルボカチオンは脱離しないため、求核剤による攻撃が必要である。(求核攻撃は、上図では便宜的に2級炭素に対しておきているように機構を示したが、より級数の小さな炭素に対して起きる。)
19.52, 50
Wittig 反応では、4置換のアルケンは合成できない。
従って、それ以外の方法を考える必要がある。
(解答例)
グリニヤル反応と、生じたアルコールからの脱水でアルケンを合成する反応を利用する。
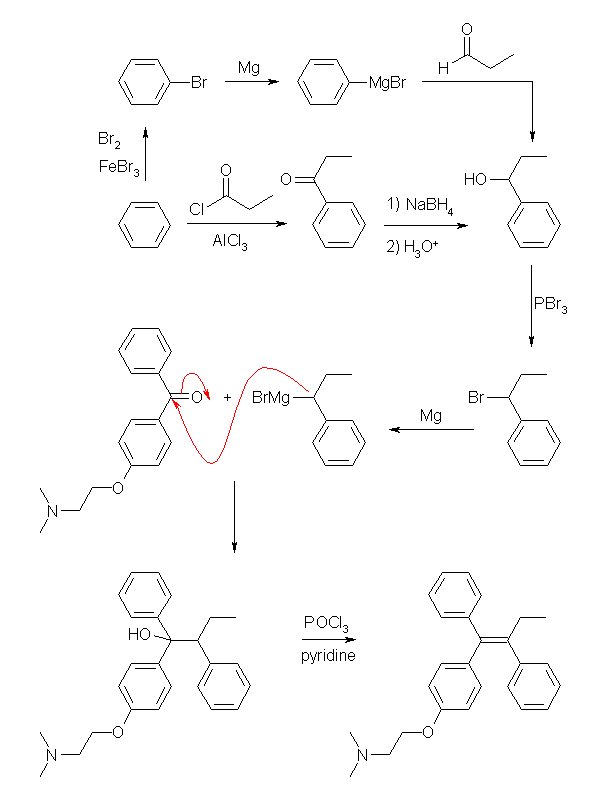
1-phenylpropanol は2通りの合成法を示した。benzene を臭素化し、グリニヤル試薬としたのち、propanal と反応させるか、また Friedel-Crafts 反応で、propanoyl chloride を用いて propiophenone とし、これをヒドリド還元する。
1-phenylpropanol を PBr3 などで処理し、ハロゲン化物に変換したのち、グリニヤル試薬としてから与えられたケトン(4-(2-dimethylaminoethoxy)benzophenone)と反応させる。
(図では示していないが、4-(2-dimethylaminoethoxy)benzophenone を還元して得られたアルコールを臭素化、グリニヤル試薬としたのち、propiophenone と反応させて得られる 1-[4-(2-dimethylaminoethoxy)phenyl]-1,2-diphenylbutan-1-ol を脱水してもよい。)
19.53, 51
アセトアルデヒドから生じるアセタールの構造と、パラアルデヒド paraldehyde の構造の類似性に着目すること。
カルボニル基は酸触媒存在下、プロトン化を受けることで、中性でよりずっと求核反応を受けやすくなる。アセタールの生成においては、アルコールの酸素(の孤立電子対)が求核種としてはたらく。パラアルデヒドの生成では、アルデヒドの酸素(の孤立電子対)が求各種となる。
(解答例)
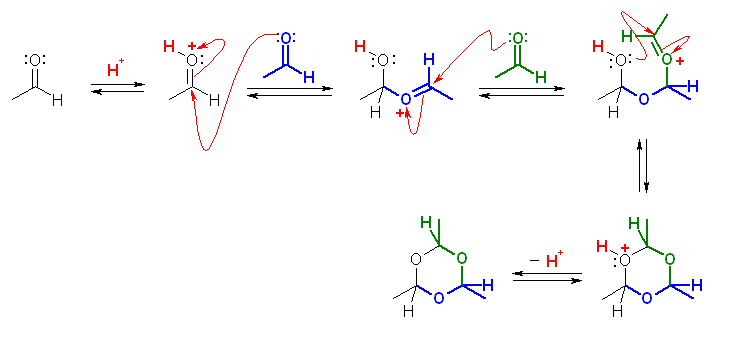
酸触媒によりプロトン化を受けたカルボニルが、別分子のアセトアルデヒドのカルボニル酸素からの求核攻撃を受けることができる。3分子の求核付加反応で、6員環構造となる。6員環は、結合角の歪みのないため、安定な構造と考えてよい。
19.54, 52
エステルや酸クロリドは求核種との反応でカルボニル求核置換を起こすのに対し、アルデヒドやケトンは求核種との反応で求核付加を起こす。これは、アルデヒドやケトンでは十分な強さの脱離基がないからである。しかし、Cannizzaro 反応では、もう1分子のアルデヒドが受容体となり、(通常では脱離しない)ヒドリドが脱離する。
ヒドリドの求核付加反応は還元に相当し、ヒドリドの脱離は酸化に相当する。すなわち、Cannizzaro 反応は、2分子のアルデヒドがカルボン酸とアルコールに不均化する反応である。
Meerwein-Ponndorf-Verley 反応でも、ケトンがアルコールに還元される段階で、ヒドリドの授受が行われている。
アルミニウムトリイソプロポキシドの構造に注意すること。[(CH3)2CHO]3Al と書かれているが、(R-O-)3Al の形であり、アルデヒド基 -CHO は含まれない。
(解答例)
Meerwein-Ponndorf-Verley 反応では、アルミニウムトリイソプロポキシドのアルミニウムがルイス酸として働く。
図中、結合の電子対ごと水素(上図中、青で示した)が移動する過程は、ルイス酸の配位を受けてより求電子的になった(求核攻撃を受けやすくなった)カルボニル酸素への分子内でのヒドリド移動である。
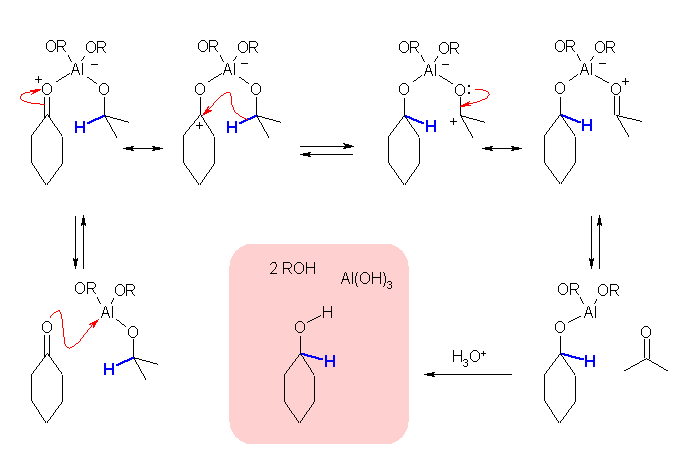
アルミニウムトリアルコキシドは加水分解により、アルコールと水酸化アルミニウムになる。アルミニウムトリイソプロポキシドは、加水分解によりイソプロパノールが生じるが、シクロヘキサノンを用いた Meerwein-Ponndorf-Verley 反応が進行するとシクロヘキシルオキシドとなるから、これを加水分解すればシクロヘキサノールとなる。いわば、この反応では、シクロヘキサノン(ケトン)とイソプロパノール(2級アルコール)が、シクロヘキサノール(2級アルコール)とアセトン(ケトン)になる過程であるといえる。
Cannizzaro 反応では、アルデヒドのカルボニル基に水酸基が求核付加したのち、酸素上の負電荷に助けを借りて(炭素−酸素間に二重結合ができながら)ヒドリドが脱離し、近傍にある(ケトンより求電子的な)アルデヒドがこのヒドリドを受け取る(言ってみれば、このヒドリドによりアルデヒドのカルボニル基が求核攻撃を受ける)過程である。
このような Meerwein-Ponndorf-Verley 還元反応は、解答例に反応機構を示したように可逆な過程である。つまり、過剰のアセトンを用い、アルミニウムアルコキシドを反応させると、(解答例に示した反応は、左へ平衡がずれて、)1級または2級のアルコールは酸化されて、アルデヒドおよびケトンが得られる。(そして同時に、イソプロパノールが得られる。)このような反応は、Oppenauer 酸化と呼ばれる。
19.55, 53
まず、アミンとカルボニル化合物がイミンを与える反応を思い起こすこと。ヒドラジンは、2つのアミノ基が直結した形の分子であり、また 2,4-pentanedione は分子内にカルボニル基が2つある。これらの分子が1対1で反応したときに、2箇所で結合して環状となる。ただし、単に2箇所でイミンとするだけだと、3,5-dimethylpyrazole とは二重結合の位置が異なることに注意すること。
(解答例)
反応機構は、次の順で書くことができる。まず、2,4-pentandione の一方のカルボニル基をヒドラゾンとする。ヒドラゾンの生成はイミンの生成と同じ機構である。これで、分子内にアミノ基とカルボニル基を持つ分子となる。つづいて、この残ったアミノ基とカルボニル基でイミンをつくるように反応をさせる。3,5-dimethylpyrazole とくらべて、二重結合の位置、および水素の位置の異なる5員環構造をもつ異性体(3,5-dimethyl-4H-pyrazole)を生じるが、さらに、ケト=エノール互変異性化反応のように二重結合の位置を変化させることができる。
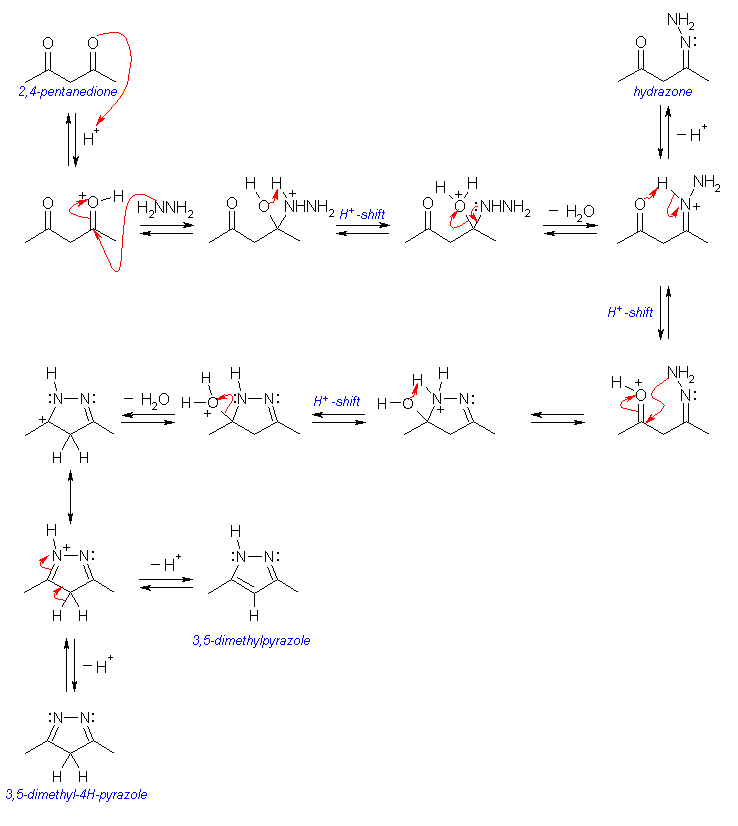
2つのカルボニル基がイミンとなった構造の 3,5-dimethyl-4H-pyrazole は、非芳香族であるが、互変異性化によって生じる 3,5-dimethylpyrazole は芳香族である。このことが、反応のドライビングフォースであると考えられる。
3,5-dimethylpyrazole は、2つの二重結合の π 結合中に4つの電子をもつ。また水素と結合した窒素は sp2 混成をとって、その孤立電子対は面に垂直な方向にとびでた p 軌道中にあって、隣接した π 軌道と共役している。これら、計6個の電子が5つの原子の p 軌道からできた π 分子軌道内にあって芳香族性を示す。これは、pyrrole と同じである。
(発展2)
β-ジケトンの2つのカルボニル基に挟まれたメチレンは、酸性度が高く「活性メチレン」と呼ばれることがある。
19.56, 54
上の問いと同じように考えて反応機構を書くことができる。
(解答例)
反応機構は、次の図のように書くことができる。問い 19.55 の解答例に示した図と比較すること。(H2N-NH2 が H2N-OH になっても、ほとんど同じ反応機構である。ただし、最終生成物 3,5-dimethylisoxazole は、二重結合の位置の異なる異性体を持たない。)
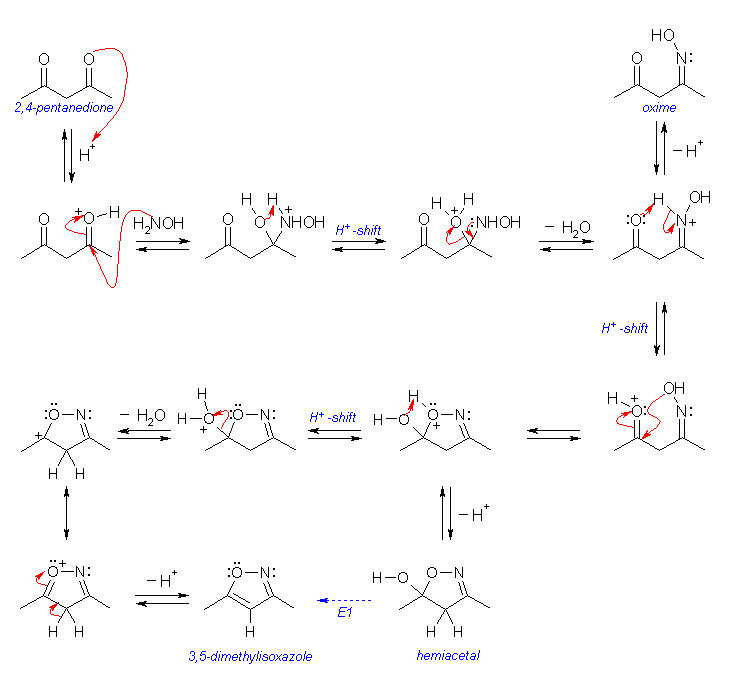
まず、2,4-pentandione の一方のカルボニル基をオキシムとする。これは、ヒドロキシルアミンのアミノ基とカルボニル基の脱水縮合反応である。ヒドラゾンやイミン生成の反応機構を参照すること。これで、分子内に(窒素に結合した)水酸基とカルボニル基を持つ分子となる。つづいて、アセタールの生成(図 19.12 参照)のはじめの過程と同じように、酸触媒のもとプロトン化を受けたカルボニル基に、この水酸基が分子内の求核付加をし、ヘミアセタールを生じる。
ヘミアセタールからアセタールを生じる反応では、図 19.12 の機構では、プロトン化を受けた水酸基が水として脱離してオキソニウムイオン中間体となったのち、もう1分子のアルコールの求核付加が起きるように書かれている(= SN1 反応)。
これと同じように、 3,5-dimethylisoxazole を生じる反応でも水の脱離によりオキソニウムイオン中間体を生じる。そしてその後、酸性度の高い活性メチレンからプロトンが脱離しながら共役二重結合を形成し、芳香族性をもつ生成物となる(= E1 反応)。
(ヘミアセタールからアセタールを生じる反応において、水の脱離とアルコールの求核攻撃は協奏的に起きている(= SN2 反応)と考えることもできる。同様に、隣接した2つの炭素からの水酸基とプロトンの脱離を、E2 反応として考えてもよい。ここで、E1 で進行しているか、E2 で進行しているかを区別しようとすることは、実験的なデータが示されていないので、あまり意味がない。)
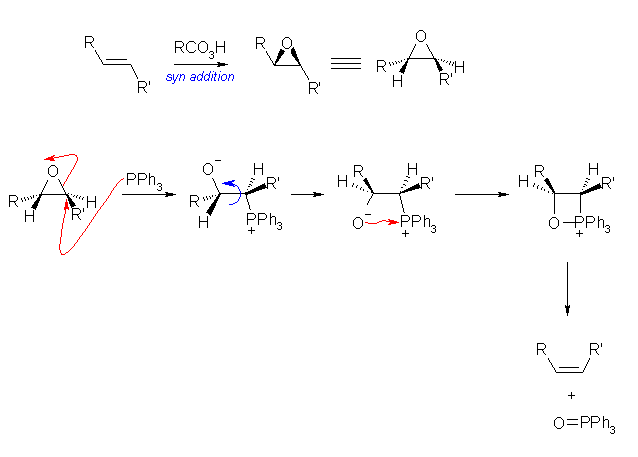
19.57, 55
Wittig 反応の最終段階では、リンイリドの求核攻撃により生じたベタインが、酸素、リンを含む4員環の構造をとり、トリフェニルホスフィンオキシドが脱離してアルケンを与える。この問いのエポキシドとトリフェニルホスフィンの反応でも同じベタインを生じる。
アルケンからエポキシドを形成する段階は、教科書 18.7 節を参照すること。シンの立体化学で進行する。
トリフェニルホスフィンは、リンが求核的である。ハロゲン化アルキルとの反応ではハロゲンの結合した炭素に SN2 反応して、ホスホニウム塩を与える。エポキシドに対しては、酸素の結合した炭素に SN2 反応しベタインを生じる。(エポキシドでは、通常の鎖状エーテルよりも求核置換反応しやすかったことを思い出すこと。)このとき、アンチの立体化学で付加していることになる。
ベタインから、4員環の中間体を経由してトリフェニルホスフィンオキシドが脱離する反応は、シンの立体化学である。
以上の立体化学を総合して考えると、なぜアルケンのシス−トランス異性化が起きるかが判るはずである。
(解答例)
19.58, 56
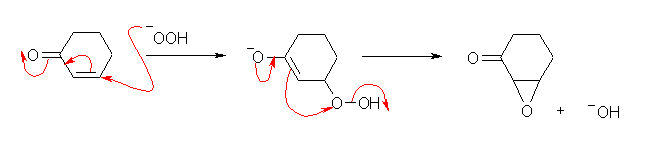
孤立二重結合では反応せず、不飽和ケトンに特異的であるということは、分極した二重結合に対しての求核攻撃が必要であることを示している。
塩基性の溶液中では、過酸化水素は次のように解離する。
HOOH ←→ HOO- + H+
このペルオキシアニオン HOO- が求核種としてはたらく。
(解答例)
19.59-19.71 (57-74)
19.59 - 19.68 は、分光学の問題なので、省略。
5版 19.70 - 19.74 ( Spartan View を用いる問題)も、省略。
19.69, 67
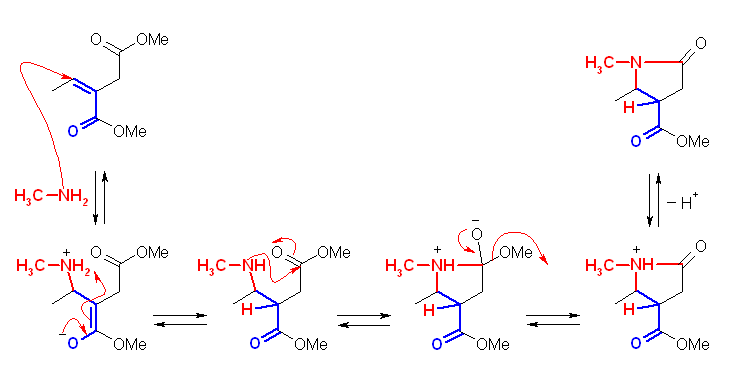
エステルとアミンの反応では、カルボニル基にアミンが求核攻撃したあと、アルコキシ基が脱離する機構で進行し、酸アミドを与える。(教科書 21.6 節、アミノリシス)
一方、アミンは不飽和カルボニルに共役付加する。第1級アミンが付加すると、そのカルボニル基の β 位に第2級のアミンとして結合することになる。ついで、分子内でのアミノリシスが生じると、与えられた反応式となる。
(解答例)
19.70, 68
グルコースのピラン環の酸素と、隣接した炭素上の(問いの図で着色された)水酸基は、ヘミアセタールの構造であることに着目すること。
ヘミアセタールは、可逆的にアルコールとアルデヒドを生じる。この平衡は(カルボニルへの水和と同様に)酸や、塩基の触媒で加速されるが、水中でもゆっくりとおきる。環状のグルコースが鎖状となることにより、カルボニル基の結合した単結合の周囲での自由回転が可能となるが、再び環状にもどる際、カルボニル基のプロキラル面のどちらからもアルコールによる求核攻撃が起きる可能性があり、これが異性化反応の機構の鍵である。
教科書 25.5 節、25.6 節を参照のこと。
なお、β-グルコースは、ピラン環に結合したすべての水酸基がエカトリアル位に結合しており、最も安定な構造である。
(解答例)
煩雑さを避けるため、グルコースのピラン環の酸素に隣接した炭素上の(問いの図で着色された)水酸基以外の置換基は省略して以下の図を示した。
他の位置の水酸基と異なり、注目している水酸基はヘミアセタールを構成する部分であると捉えることができる。そのため、酸および塩基により触媒されてアルデヒドを与える。(教科書 19.6節「H2O の求核付加:水和」を参照。なお、アセタールは塩基触媒では生成しないし、加水分解もされない。)
ヘミアセタールとアルデヒドの間の平衡はわずかな酸や塩基により触媒されるが、純水中では遅い反応となる。とはいえ、水自身も弱い酸かつ塩基としてはたらくことができるから、糖の異性化反応はゆっくりと進行することになる。
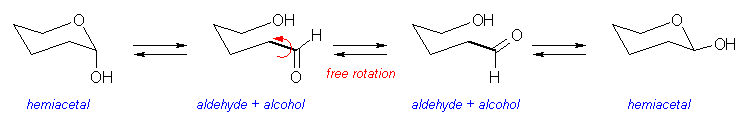
生じたアルデヒド体は、再び環にもどる際、水酸基によるカルボニル基への求核付加がおきるが、アルデヒドのねもとが単結合で自由回転をすることが可能なので、プロキラル面のいずれからでも反応が生じる。
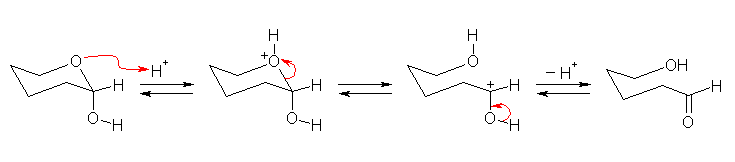
以下に、ヘミアセタールからアルデヒドへの異性化の反応機構を、酸触媒の場合、塩基触媒の場合にわけて示した。アルデヒドからヘミアセタールにもどる反応は、これらの逆反応である。
酸触媒
塩基触媒
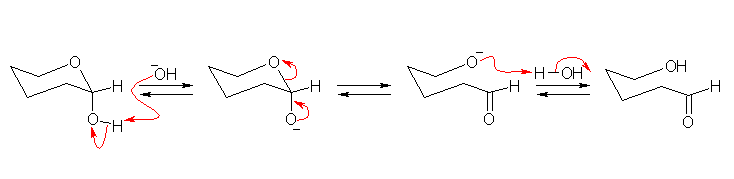
ヘミアセタール炭素(ヘミアセタールの閉環によって新たに生じたキラル中心)をアノマー中心と呼ぶ。また、α-グルコールと β-グルコースのような(アノマー中心の立体配置のみが異なる)異性体の組を、互いにアノマーであるという。(教科書 25.6 節参照)
類似のもので、より広い範囲の異性体を表す言葉として、エピマーがある。これは、糖の中で1箇所だけ水酸基の立体配置の異なる異性体をさす。アノマーもエピマーの中の特殊なケースであるといえるが、アノマー中心以外の水酸基の立体配置はいずれかの結合が切れなければ互いに入れ替わらないから、アノマー中心以外の水酸基の立体配置の異なる糖は、互いに異なる物質として区別される。たとえば、ガラクトースとグルコース、グルコースとマンノースは互いにエピマーである。(しかし、ガラクトースとマンノースは、水酸基の立体配置が2箇所で異なるから、エピマーではない。)
グルコースでは、水溶液中で安定な構造として、 α-グルコール(37.3%)と β-グルコース(62.6%)の形で存在している。(β-体の方が、アノマー中心炭素の結合した水酸基がエカトリアルにいるからより安定である。安定性の差の定量的な議論については、教科書 4.11-4.12 シクロヘキサンの配座解析を参照のこと。また、水酸基のもつ 1,3-ジアキシャル相互作用の大きさは、4.11 節中の、表 4.2 に記載されている。)
鎖状のグルコースと区別して環状のグルコースを表現するため、α-グルコールや β-グルコースを、グルコピラノースとよぶことがある。この名は、酸素を含む6員環の pyran (C5H6O の分子式をもつ。環内に二重結合を2つもつ)に由来している。
鎖状のグルコースをグルコピラノースと区別したい場合には、アルデヒド型グルコースなどとよぶ場合もある。
19.71, 69
問い 19.70 の異性化の機構で途中で生じる鎖状のグルコースがアルデヒドであることに注目する。アルデヒドは、NaBH4 により、ヒドリド還元される。
(解答例)
環状グルコースは、水溶液中でアルデヒド型との間に平衡がある。このためわずかに生じたアルデヒド型グルコースがヒドリドにより還元され、ソルビトール sorbitol を生じる。
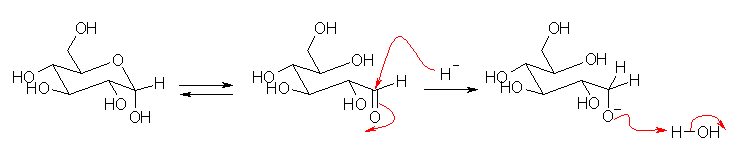
水溶液中の平衡で、アルデヒド型は1%にも満たないわずかな量しか生じていないが、還元されることで平衡が右へずれるので、結局すべてのグルコースが還元されることになる。
ここで、環状グルコース(グルコピラノース)のヒドリドによる求核攻撃について考えてみよう。環状グルコース中、最も求電子性が高いのは、酸素が2つ結合したヘミアセタール炭素である。しかしながら、ともに σ 結合だから、カルボニル基の π 結合ほど分極していないため、カルボニル炭素よりも求電子性は小さいと考えられる。もしこのヒドリドによる求核攻撃があっても、プロトン化をうけていない水酸基やアルキルオキシ基は、脱離することがない。(もし、このヒドリドによる求核攻撃と引きつづく脱離がおきるとすると、アセタールがカルボニル基の保護として役立たないことになる。)
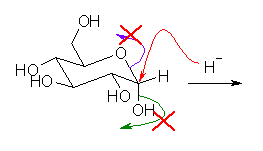
また、上図で示した緑と紫の2つの脱離(実際には、どちらも起きないと考えているのだが)は、脱離基である水酸化物イオンやアルコキシドの塩基性度にさほど差がないから、脱離において選択性もないと考えられる。もし、この脱離が起きると考えるなら、アルキルオキシ基の脱離によるソルビトールの生成(紫の矢印)とともに、水酸基の脱離による環状エーテルの生成(緑の矢印)がおこるはずである。(そのような副生成物は観察されない。だから、環状グルコースがヒドリド還元をうけているのではない。)