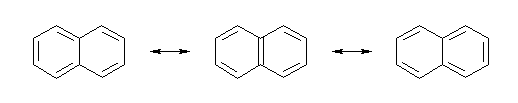
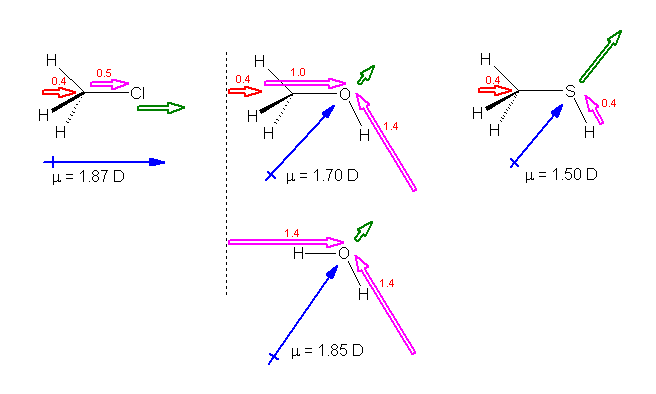
2.01-2.10
2.01
僥僉僗僩36儁乕僕偺恾2.2偵梌偊傜傟偨丄揹婥堿惈搙偺悢抣傪嶲峫偵偡傞丅
傑偨丄揹婥堿惈搙偺惓妋側悢抣傪尒側偔偰傕夝偗傞傛偆偵丄偦偺戝彫娭學偵偮偄偰偼埲壓偺傛偆偵妎偊偰偍偔偙偲丅
扽慺傛傝堿惈側尨巕偼丄拏慺丄巁慺丄僴儘僎儞乮僼僢慺丄墫慺丄廘慺乯偺傒丅
傑偨丄廃婜昞偺偦傟偧傟偺尨巕偺埵抲偲揹婥堿惈搙偺孹岦偵偮偄偰偼丗
丒摨偠廃婜偱偁傟偽丄廃婜昞偺塃偺曽偑揹婥堿惈搙偼戝
丒摨偠懓偱偁傟偽丄廃婜昞偺忋偺曽偑揹婥堿惈搙偼戝
乮夝摎椺乯
揹婥堿惈搙偺悢抣偺戝偒偄曽偑丄傛傝堿惈側尨巕偱偁傞丅
(a) H
(b) Br
(c) Cl
(d) C
2.02
寢崌偟偰偄傞尨巕摨巑偺揹婥堿惈搙偺抣傪嶲峫偵丄傛傝揹婥揑偵堿惈側尨巕忋偵晧偺晹暘揹壸乮δ亅乯傪丄傛傝揹婥堿惈搙偺彫偝偄尨巕忋偵惓偺晹暘揹壸乮δ亄乯傪抲偔丅
偨傑偨傑擇偮偺尨巕偺傕偮揹婥堿惈搙偑傑偭偨偔摨偠偱偁傟偽丄乮摨偠尨巕摨巑偺寢崌側偳乯乽懳徧揑側嫟桳寢崌乿偲側傝丄揹婥堿惈搙偵嵎偑偁傞応崌偼乮揹婥堿惈搙偺嵎偑偍傛偦俀埲撪偱偁傟偽乯乽嬌惈嫟桳寢崌乿傗丄乮揹婥堿惈搙偺嵎偑偍傛偦俀埲忋偱偁傟偽乯乽僀僆儞寢崌乿偲側傞丅僀僆儞寢崌偱偁傞応崌偵偼丄晹暘揹壸乮δ亅 傗 δ亄乯偱偼側偔揹壸乮亅 傗 亄乯傪尨巕忋偵抲偔丅
乮夝摎椺乯
(a) H3Cδ亄-Clδ亅
(b) H3Cδ亄-Nδ亅H2
(c) H2Nδ亅-Hδ亄
(d) H3C-SH
(e) H3Cδ亅-Mgδ亄-Br
(f) H3Cδ亄-Fδ亅
(d) 偵偮偄偰丄扽慺偲棸墿偺揹婥堿惈搙偼摨偠抣偱偁傞偐傜丄傎傏旕嬌惈偺乮暘嬌偟偰偄側偄乯嫟桳寢崌偱偁傞偲峫偊傜傟傞丅
2.03
寢崌偟偰偄傞尨巕摨巑偺揹婥堿惈搙偺抣偺嵎偑戝偒偄傎偳丄寢崌偺嬌惈偑戝偒偄丅偦偺嵎偑栺俀埲忋偺偲偒丄僀僆儞寢崌偱偁傞偲峫偊傜傟傞丅
乮夝摎椺乯
寢崌偵娭偡傞嬌惈偑彫偝偄曽偐傜戝偒偔側傞弴偵丄
H3C-OH (1.0) 亙
H3C-MgBr (1.3) 亙
H3C-Li (1.5) 乣
H3C-F (1.5) 亙
H3C-K (1.7)
乮僇僢僐撪悢抣偼丄恾2.2 傛傝撉傒庢偭偨揹婥堿惈搙偺嵎偺抣乯
2.04
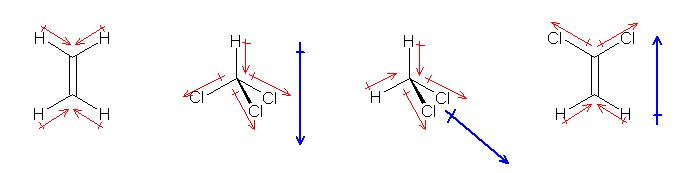
恾偵帵偝傟偨惷揹億僥儞僔儍儖儅僢僾偵偍偄偰偼丄惵怓乮揹巕枾搙掅偄丗惓乯仺愒怓乮揹巕枾搙崅偄丗晧乯偺曽岦偵暘嬌偟偰偄傞偲撉傒庢傞偙偲偑偱偒傞丅
乮夝摎椺乯
C-Cl 寢崌偵娭偟偰偼丄C偲Cl 偺揹婥堿惈搙偐傜傕梊憐偝傟傞捠傝丄Cδ亄-Clδ亅 偺傛偆偵暘嬌偟偰偄傞丅
偙偺暘嬌偵傛傝丄惷揹億僥儞僔儍儖儅僢僾偵偍偄偰丄墫慺尨巕偺廃埻偑愒偔側偭偰偄傞偲峫偊偰傛偄丅偟偐偟丄偙偺惷揹億僥儞僔儍儖儅僢僾傪傛偔傒傞偲丄墫慺尨巕偺廃埻偑嬒摍偵愒偔側偭偰偄傞傢偗偱偼側偄偙偲偵婥晅偔偼偢偱偁傞丅偙傟偼丄偙偺惷揹億僥儞僔儍儖儅僢僾偑暘巕慡懱偲偟偰偺乮偡傋偰偺寢崌傗屒棫揹巕懳偐傜偺暘嬌偺婑梌偺榓偲偟偰偺乯揹壸偺曃傝傪昞偟偰偄傞偙偲偵傛傞丅
墫慺尨巕偼丄扽慺偲偺寢崌埲奜偵丄俁懳偺屒棫揹巕懳傪傕偮丅偙偺屒棫揹巕懳偼丄儊僞儞偺惓巐柺懱峔憿偲偺椶悇偐傜傕梊應偱偒傞傛偆偵丄儊僠儖婎 亅CH3 偵偍偗傞悈慺偲摨偠傛偆偵丄扽慺偲偺寢崌偺媡曽岦偺幉傪拞怱偲偟偨廃埻偵峀偑偭偰偄傞丅偦偺偨傔丄摢偺偰偭傌傫乮墫慺偵偍偄偰丄扽慺偲偺寢崌偺斀懳懁乯偵偁偨傞晹暘偺揹壸枾搙偑庒姳壓偑偭偰惷揹億僥儞僔儍儖儅僢僾偵偍偄偰偼愒傒偑尭偭偰偄傞偲峫偊傞偙偲偑偱偒傞丅
2.05
暘巕偺憃嬌巕儌乕儊儞僩偼丄偦傟偧傟偺暘巕偺帩偮寢崌偺暘嬌偺婑梌偺榓偵傛偭偰寛傑傞丅
栤戣偺慜採帠崁偵岆傝偑偁傝丄僄僠儗儞僌儕僐乕儖偺憃嬌巕儌乕儊儞僩偼幚嵺偵偼侽偱偼側偄丅偙偙偱偼丄僄僠儗儞僌儕僐乕儖偺暘巕偑丄師偵帵偡俁師尦柾宆偺宍偵尷掕偝傟傞応崌偵尷偭偰峫偊傞偙偲偵偣傛丅偦偺応崌偵偼丄憃嬌巕儌乕儊儞僩偑侽偲側傞丅
僄僠儗儞僌儕僐乕儖 偺俁師尦柾宆
乮夝摎椺乯
C亅O 寢崌偼扽慺尨巕偲巁慺尨巕偺揹婥堿惈搙偐傜傕梊憐偝傟傞傛偆偵丄Cδ亄-Oδ亅 偺傛偆偵嫮偔暘嬌偟偰偄傞丅
傕偟丄扽慺亅扽慺寢崌偺幉偵増偭偨帺桼夞揮偑忋偺俁師尦柾宆偵帵偟偨妏搙偵屌掕偝傟偰偄傞偲丄暘巕撪偺俀偮偺 C-O 寢崌偵婲場偡傞寢崌偺暘嬌偼丄屳偄偵摨偠戝偒偝偱慡偔惓斀懳偺岦偒偱偁傞偨傔丄屳偄偵懪偪徚偟崌偭偰偟傑偆偙偲偵側傞丅乮儀僋僩儖偺榓傪偲傞偺偲丄摨偠傛偆偵峫偊傞丅乯偦偺偨傔丄暘巕慡懱偲偟偰偼憃嬌巕儌乕儊儞僩傪帩偨側偄丅
扨偵丄暘巕偺峔憿偑乽懳徧偩偐傜乿偲偄偆昞尰偱偼惓偟偔側偄丅嵍塃懳徧偩偑丄偦傟偧傟偺寢崌偵桼棃偡傞憃嬌巕偑懪偪徚偝傟側偄傛偆側椺偲偟偰丄偨偲偊偽悈暘巕偺傛偆側峔憿傪峫偊偰傒傞偙偲丅傕偟偳偆偟偰傕乽懳徧乿偲偄偆偙偲偽傪巊偄偨偄側傜丄乽揰懳徧乿偲偡傞傋偒偱偁傞丅
乮敪揥乯
僄僠儗儞僌儕僐乕儖偺傛偆側暘巕偼丄扽慺亅扽慺寢崌偺幉偵増偭偨帺桼夞揮傪偡傞偙偲偑偱偒傞丅傕偟丄偙偺夞揮傪巭傔傞偙偲偑偱偒傞偲偡傞側傜偽丄偦偺偲偒偺妏搙乮巁慺亅扽慺亅扽慺亅巁慺偺擇柺妏乯偵傛傝丄暘巕偼侽偱偼側偄憃嬌巕儌乕儊儞僩傪帩偮偙偲偑偱偒傞丅偨偲偊偽丄俀偮偺悈巁婎偑摨偠曽岦傪岦偄偰偄傞応崌丄偙偺扽慺亅巁慺偺寢崌偺暘嬌偼懪偪徚偝傟偢偵巆偭偰偟傑偆偐傜偱偁傞丅
扽慺亅扽慺寢崌幉偵増偭偨帺桼夞揮偑偁傞偺偱丄慡懱偲偟偰偼丄偦偺暘巕偺僐儞僼僅儊乕僔儑儞偛偲偺懚嵼検偵墳偠偨婑梌傪偟丄暯嬒揑側抣偺憃嬌巕儌乕儊儞僩傪帵偡偙偲偵側傞丅偦偺偨傔丄僄僠儗儞僌儕僐乕儖偺憃嬌巕儌乕儊儞僩偼侽偱偼側偄抣傪傕偮丅
2.06
峔惉尨巕偺崿惉忬懺傪峫偊傞偙偲偵傛傝丄暘巕偺宍偑敾抐偱偒傞丅
師偵丄偦傟偧傟偺寢崌偵婲場偡傞暘嬌乮 Hδ亄-Cδ亅 偍傛傃丄Cδ亄-Clδ亅 乯傪丄儀僋僩儖偺榓傪偲傞梫椞偱懌偟崌傢偣偰傗傞偲丄暘巕慡懱偺暘嬌乮偡側傢偪憃嬌巕儌乕儊儞僩乯偑媮傑傞丅
乮夝摎椺乯
(a) 憃嬌巕儌乕儊儞僩傪帩偨側偄丅C-H 寢崌偺暘嬌偼憡嶦偝傟傞偨傔丅
(b)乣(d) 恾偺傛偆偵憃嬌巕儌乕儊儞僩傪帩偮丅
恾拞丄愒偺栴報偑寢崌偵桼棃偡傞暘嬌丄惵偺栴報偑暘巕慡懱偱偺憃嬌巕儌乕儊儞僩丅
2.07
嫵壢彂偺栤偄偵梌偊傜傟偨傛偆側寢崌偺條幃偑崌棟揑偱偁傞偙偲丄傑偨丄偦偺峔憿偵偍偄偰偼拏慺偲堦曽偺巁慺偺忋偵宍幃揹壸偑惗偠傞偙偲傪帵偣偽傛偄丅
宍幃揹壸偺寁嶼偺巇曽偼丄嫵壢彂 2.3 愡傪嶲徠偡傞偙偲丅傑偨丄昞 2.2 偺傛偆偵丄庡側尨巕乮扽慺丄巁慺丄拏慺丄棸墿丄儕儞乯偺壸揹偟偨忬懺偺嵟奜妅偺揹巕悢傛傝丄寢崌偺悢偍傛傃屒棫揹巕懳偺悢傪梊應偱偒傞傛偆偵偡傞偙偲丅乮壸揹偟偨尨巕偺揹巕攝抲偼丄拞惈偺尨巕偵懳偟丄壙揹巕傪憹尭偡傞偙偲偱摼傞偙偲偑偱偒傞丅乯
乮夝摎椺乯
拏慺偼戞俀廃婜偺尦慺偱偁傞偐傜丄偦偺壙揹巕妅偼 俴 妅偱偁傞丅俴 妅偼暃妅偵 2s 偲 2p 傪帩偪丄俉偮傑偱偺揹巕偑擖傞丅偡側傢偪丄拏慺偑壔崌暔傪偮偔傞嵺偵帩偮偙偲偺偱偒傞乽嫟桳寢崌偲屒棫揹巕懳偺悢偺崌寁乿偼係偑嵟戝偲側傞丅
廬偭偰丄僯僩儘婎 亅NO2 偵偍偄偰丄拏慺偲巁慺偺娫偺寢崌偑椉曽偲傕擇廳寢崌偵側傞偙偲偼側偄丅乮傕偟丄拏慺偲巁慺偺娫偑偲傕偵擇廳寢崌偱偁傟偽丄拏慺偼俆杮偺寢崌傪傕偨側偗傟偽側傜側偄丅乯
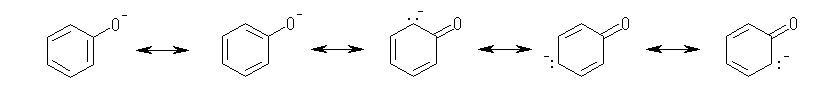
僯僩儘婎偺拏慺偲巁慺偺娫偼乽擇廳寢崌偲扨寢崌乿傑偨偼乽偳偪傜傕扨寢崌乿偺偄偢傟偐偱偁傞偙偲傪慜採偲偟丄傑偨丄僯僩儘婎偼揹婥揑偵拞惈偺姱擻婎偱偁傞偙偲偐傜丄奺尨巕偺傕偮宍幃揹壸偺榓偑僛儘偵側傞傛偆偵峫椂偟偰昤偄偨峔憿傪師恾偵帵偡丅偨偩偟屒棫揹巕懳偼惵偱丄宍幃揹壸偼愒偱帵偟偨丅
恾嵍偼丄宍幃揹壸傪峫椂偟偨堦斒揑側僯僩儘婎偺峔憿偺昤偒曽偱丄拏慺偲巁慺偺娫偑擇廳寢崌偲扨寢崌偱昞偝傟丄拏慺忋偵惓偺宍幃揹壸傪抲偔傕偺偱偁傞丅栤偄偱傕偙偺峔憿偑梌偊傜傟偰偄傞丅
恾拞墰偼丄偦偺拏慺偲巁慺偺娫偺擇廳寢崌偵巊傢傟偰偄偨 π 揹巕偑拏慺忋偺屒棫揹巕懳偺宍偵側偭偰偍傝丄偦偺寢壥丄惓偺宍幃揹壸偼巁慺忋偵堏摦偟偰偄傞丅宍幃揑偵偼偙偺宍傕壜擻側傕偺偱偁傞偑丄拏慺偲巁慺傪斾妑偡傞偲丄巁慺偺曽偑揹婥堿惈搙偑崅偄偺偱丄惓偺宍幃揹壸傪巁慺偺忋偵偼抲偔偺偼晄帺慠偱偁傞丅乮愒帤晹暘偺椶帡偺椺偲偟偰丄>C=O 偲偄偆擇廳寢崌偺 π 揹巕傪扽慺傑偨偼巁慺偺偄偢傟偐堦曽偺尨巕忋偵扴傢偣傞偵偟偰傕丄偙偺寢崌偼丄揹婥堿惈搙傪峫偊傞偲丄>Cδ+-Oδ- 偺傛偆偵暘嬌偟偰偄傞偺偼柧傜偐偩偐傜丄>C--O+ 偲偄偆僀僆儞懳偺峔憿偼丄>C+-O- 偲偄偆僀僆儞懳偺峔憿傛傝傕晄帺慠偱偁傞丅乯
恾塃偱偼丄嵍偺峔憿偵偍偄偰拏慺偲巁慺偺娫偺擇廳寢崌偵巊傢傟偰偄偨 π 揹巕傪丄巁慺忋偺屒棫揹巕懳偺宍偱昤偄偨傕偺偱偁傞丅偦偺偨傔丄椉巁慺偺宍幃揹壸偼亅侾丄拏慺忋偱亄俀偲側偭偰偄傞丅偙傟偼丄宍幃揑偵偼壜擻側傕偺偱偼偁傞偟丄揹婥堿惈搙偺娤揰偐傜尒偰丄拞墰偺恾傛傝揔愗偱偁傞傕偺偺丄拞墰偺拏慺忋偺宍幃揹壸俀亄偼丄嬌抂偵揹巕晄懌偱偁傞偺偱丄傗傗晄帺慠偱偁傞丅
埲忋偺峫嶡偵傛傝丄嫵壢彂偵梌偊傜傟偨峔憿乮忋恾偺嵍乯偑嵟傕揔愗偱偁傞偲偄偊傞丅乮忋壓偺俀偮偺巁慺偱栶妱傪擖傟懼偊偰丄拏慺偲壓偺巁慺偲偺娫偑擇廳寢崌丄忋偺巁慺偑晧揹壸傪扴偆峔憿傕丄摍壙偱偁傞丅乯
師偵丄偙偺峔憿偵偍偗傞宍幃揹壸偺寁嶼朄偵偮偄偰丄嵞妋擣偟偰偍偙偆丅
拏慺尨巕丗
拞惈尨巕偲偟偰悢偊傞応崌偺壙揹巕偺悢丗俆
嫟桳寢崌偑係杮側偺偱丄拏慺偺壙揹巕偺偆偪寢崌偵巊梡偝傟傞偲悢偊傜傟傞揹巕偺悢丗俉乛俀亖係
屒棫揹巕懳偵偁傞揹巕偺悢丗侽
廬偭偰丄宍幃揹壸偼丂俆亅係亅侽亖亄侾
擇廳寢崌偟偰偄傞巁慺尨巕丗
拞惈尨巕偲偟偰悢偊傞応崌偺壙揹巕偺悢丗俇
嫟桳寢崌偑俀杮側偺偱丄巁慺偺壙揹巕偺偆偪寢崌偵巊梡偝傟傞偲悢偊傜傟傞揹巕偺悢丗係乛俀亖俀
屒棫揹巕懳偵偁傞揹巕偺悢丗係
廬偭偰丄宍幃揹壸偼丂俇亅俀亅係亖侽
拏慺偲扨寢崌偟偰偄傞巁慺尨巕丗
拞惈尨巕偲偟偰悢偊傞応崌偺壙揹巕偺悢丗俇
嫟桳寢崌偑侾杮側偺偱丄巁慺偺壙揹巕偺偆偪寢崌偵巊梡偝傟傞偲悢偊傜傟傞揹巕偺悢丗俀乛俀亖侾
屒棫揹巕懳偵偁傞揹巕偺悢丗俇
廬偭偰丄宍幃揹壸偼丂俇亅侾亅俇亖亅侾
乮敪揥乯
儕儞(P)傗棸墿(S)偼丄戞俁廃婜偺尦慺偺応崌丄暃妅偲偟偰 3s, 3p, 3d 傪傕偮 俵 妅偑嵟奜妅乮outermost shell乯偲側傞偐傜丄壔崌暔傪偮偔傞嵺丄偙偺妅偵偼嵟崅偱 3s乮俀屄乯亄 3p乮俇屄乯亄3d乮侾侽屄乯偺揹巕偑擖傞偙偲偑壜擻偱偁傞傛偆偵尒偊傞偑丄摨偠廃婜偺婓僈僗偱偁傞傾儖僑儞(18Ar)偺揹巕攝抲偑丄乮 (1s)2(2s)2(2p)6(3s)2(3p)6 乯偱偁傞偙偲偐傜傕敾傞傛偆偵丄3s乮俀屄乯亄 3p乮俇屄乯偺揹巕偑擖偭偨帪揰偱暵妅峔憿傪帵偡丅乮慻棫尨棟偵傕斀塮偝傟偰偄傞傛偆偵丄3d 偵揹巕傪偄傟傞傛傝傕丄愭偵4s偵揹巕偑擖傞丅乯偦偺偨傔丄尨巕壙妅乮valence shell乯偱偁傞 俵 妅偵俉屄偺揹巕偑擖偭偨忬懺丄偡側傢偪僆僋僥僢僩傪枮偨偟偨忬懺偑堦斒揑偵埨掕偱偁傞偲峫偊偰傛偄丅
2.08
梌偊傜傟偨暘巕偺偦傟偧傟偺尨巕偵偮偄偰丄寢崌偺悢偍傛傃屒棫揹巕偺悢傪傕偲偵丄昞2.2 傪嶲峫偵偟偰宍幃揹壸傪寛傔傞偙偲偑偱偒傞丅側偍丄
壙揹巕偑係偱偁傞拞惈偺扽慺偐傜攈惗偟偨丄C(亄) 偼乮壙揹巕偑俁屄側偺偱乯儂僂慺(B)偲摨偠揹巕峔憿傪丄傑偨C(亅) 偼乮壙揹巕偑俆屄側偺偱乯拏慺(N)偲摨偠揹巕峔憿傪帩偮丅
壙揹巕偑俆偱偁傞拞惈偺拏慺偐傜攈惗偟偨丄N(亄) 偼乮壙揹巕偑係屄側偺偱乯扽慺(C)偲摨偠揹巕峔憿傪丄傑偨N(亅) 偼乮壙揹巕偑俇屄側偺偱乯巁慺(O)偲摨偠揹巕峔憿傪帩偮丅
壙揹巕偑俇偱偁傞拞惈偺巁慺偐傜攈惗偟偨丄O(亄) 偼乮壙揹巕偑俆屄側偺偱乯拏慺(N)偲摨偠揹巕峔憿傪丄傑偨O(亅) 偼乮壙揹巕偑俈屄側偺偱乯僼僢慺(F)偲摨偠揹巕峔憿傪帩偮丅
僠僃僢僋帠崁偲偟偰丄慡懱偲偟偰拞惈側暘巕偺応崌丄宍幃揹壸偺崌寁偑僛儘偵側偭偰偄傞偐偳偆偐丄昁偢妋擣偡傞偙偲丅乮僀僆儞偱偁傞応崌偼丄宍幃揹壸偺崌寁偑僀僆儞偺壙悢偲側傞丅乯
乮夝摎椺乯
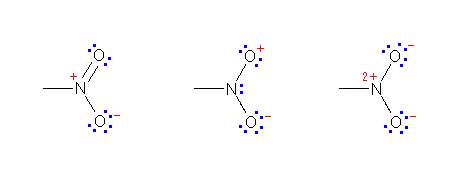
乮屒棫揹巕懳偺昞帵偼徣棯偡傞丅乯
(a) H2C=N(亄)=N(亅)
(b) H3C-C佭N(亄)-O(亅)
(c) H3C-N(亄)佭C(亅)
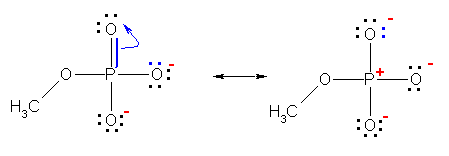
2.09
奺尨巕偺宍幃揹壸偺崌寁偑丄拞惈暘巕偱偼僛儘偵側傝丄僀僆儞偱偁傞応崌偼偦偺壙悢偲側傞偙偲傪妋擣偡傞偙偲丅
乮夝摎椺乯
乽(P)=O乿偺巁慺忋偵偼宍幃揹壸偼懚嵼偟側偄丅俀偮偺乽(P)-O乿偺巁慺忋偵丄亅侾偺宍幃揹壸偑懚嵼偡傞丅
乮敪揥乯
栤偄 2.7 偺敪揥偱傕彂偄偨傛偆偵丄戞俁廃婜偺尨巕偱偁傞儕儞偵懳偟偰偼俆杮埲忋偺寢崌傪彂偔応崌偑偁傞丅
側偍丄栤戣偺恾偵梌偊傜傟偨峔憿偲偼宍幃揑偵堎側傞偑丄恾拞偺乽(P)=O乿寢崌傪扨寢崌偵奐偒丄偙偺巁慺忋偵傕亅侾偺宍幃揹壸傪梌偊偨偺偪丄儕儞(P)忋偵亄侾偺宍幃揹壸傪梌偊傟偽丄儕儞(P)忋偺寢崌偺悢偑係杮偲側傝丄僆僋僥僢僩傪枮偨偡宍偱帵偡偙偲偑壜擻偱偁傞丅
2.10
嫵壢彂 2.5 愡丄2.6愡偺嫟柭宍乮嬌尷峔憿幃乯傪昤偔忋偱偺婯懃傪嶲徠偺偙偲丅椺戣2.2 傗椺戣 2.3 傪丄夝愢傪撉傒側偑傜夝偄偰傒傞偲嬶懱揑側嶌嬈偑傢偐傝傗偡偄丅
偍傛偦師偺庤弴偱峴偆偙偲偵側傞丅
1) 梌偊傜傟傞暘巕幃丄僀僆儞幃偵柕弬偟側偄傛偆偵峔憿幃傪傂偲偮彂偄偰傒傞丅偙偺偲偒丄屒棫揹巕懳傪傕偮傕偺偼昁偢彂偔傛偆偵偟丄偦傟偧傟偺尨巕偺壙揹巕偺悢傗丄嵟奜妅偺揹巕悢傪妋擣偟偰偍偔丅
2) 昁梫偱偁傟偽丄宍幃揹壸傪晅偡傞丅傑偨丄屒棫揹巕懳傗擇廳寢崌偺埵抲傪妋擣偡傞丅
3) 婯懃偵廬偄丄π 揹巕傑偨偼屒棫揹巕懳偩偗傪摦偐偟側偑傜暿偺嫟柭宍傪昤偔丅揹巕偺摦偒傪嬋偑偭偨栴報偱昤偒側偑傜峫偊傞傛偆偵偟傛偆丅偄偔傜 π 揹巕傑偨偼屒棫揹巕懳偱偁偭偰傕棧傟偨埵抲傊堏摦偝偣傞偙偲偼偱偒側偄偺偱拲堄偡傞偙偲丅傑偨偙偺偲偒丄尨巕偺埵抲偲僔僌儅寢崌乮偵娭梌偡傞揹巕乯偼丄摦偐偟偨傝丄夞揮偝偣偨傝斀揮偟偨傝偟偰偼偄偗側偄丅
4) 嫟柭宍偲嫟柭宍偺娫偼丄嵍塃傪岦偄偨俀杮偺栴報偱偼側偔丄椉抂偑栴偵側偭偨侾杮偺栴報偱娭學偯偗傞丅
(a) 栤戣 2.9 偵昤偐傟偨峔憿傪嶲峫偵偡傞偙偲丅扽巁僀僆儞 CO32- 偺峔憿忋偺椶帡偵傕拲栚偟偰傒傛偆丅扽巁僀僆儞偺嫟柭宍偵偮偄偰偼丄椺戣 2.2 傪嶲徠偡傞偙偲丅
(b) 徤巁僀僆儞 NO3- 偲扽巁僀僆儞 CO32- 偺峔憿忋偺椶帡偵傕拲栚丅
(c) 傾儕儖僇僠僆儞偵偮偄偰偼丄椺戣 2.3 偱埖偭偨儁儞僞僕僄僯儖儔僕僇儖偲偺峔憿忋偺椶帡偵傕拲栚偡傞偙偲丅
(d) 埨懅崄巁偼儀儞僛儞娐偲僇儖儃儞婎偲傪傕偭偰偄傞丅儀儞僛儞娐晹暘偱偺嫟柭偵偮偄偰偼 44 儁乕僕丄2.4 愡嵟屻偁偨傝偺恾側偳偑嶲徠偱偒傞丅傑偨丄僇儖儃儞巁僀僆儞偺晹暘偺嫟柭偵偮偄偰偼丄恷巁僀僆儞偺嫟柭偲偺椶帡偵拲栚偡傞偙偲丅43 儁乕僕偺婰弎側偳傪挌擩偵撉傫偱傒傛偆丅
乮夝摎椺乯
揹巕偺摦偒偼丄嬋偑偭偨栴報偱昤偔丅偙偺偲偒丄揹巕懳偺摦偒傪昞偡栴報偼捠忢偺栴報傪梡偄丄揹巕侾偮偺摦偒傪昞偡栴報偼曅栴報乮摢偺晹暘偺愜傝曉偟偑曅懁偩偗偺傕偺乯傪梡偄傞栺懇偑偁傞丅
(a) 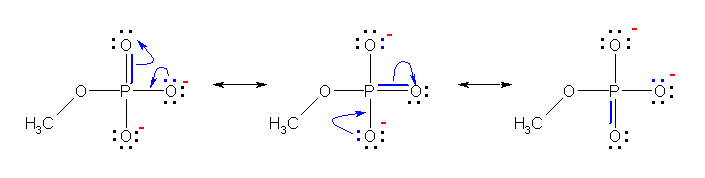
忢偵巁慺偺傂偲偮偑儕儞偲偺娫偱擇廳寢崌偵側傞傛偆偵揹巕傪摦偐偡偲忋恾偺傛偆偵側傞丅傑偨丄栤偄 2.9 偺敪揥偺崁偵彂偄偨峔憿偼丄師偺傛偆側揹巕偺摦偒偱昞尰偝傟傞丅忋偺俁偮偺嬌尷峔憿幃偲偺娭學偵偮偄偰傕傛偔尒斾傋偰傒傞偙偲丅
(b) 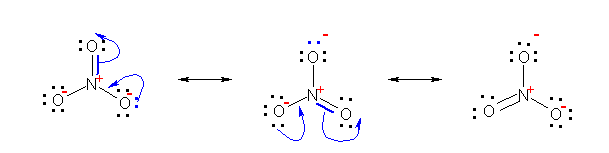
(c) 
(d) 儀儞僛儞娐晹暘偱偺嫟柭峔憿偼丄壓恾丄椢怓偺栴報偺傛偆側揹巕偺摦偒偵傛傝丄俇堳娐偺拞偺擇廳寢崌偺埵抲偑擖傟懼傢傞宍偺嬌尷峔憿傪傕偮丅傑偨丄僇儖儃儞巁僀僆儞晹暘偺嫟柭偱偼丄壓恾丄惵怓偺栴報偺傛偆側揹巕偺摦偒偵傛傝丄偦傟偧傟偺嬌尷峔憿偵偍偄偰俀偮偺巁慺尨巕偺忋偺揹壸偑擖傟懼傢傞宍偲側傞丅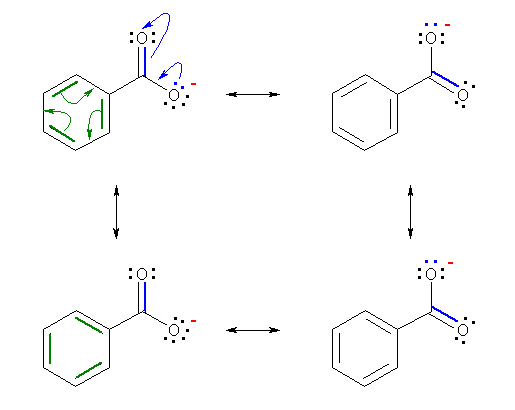
2.11-2.20
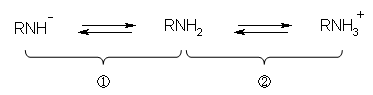
2.11
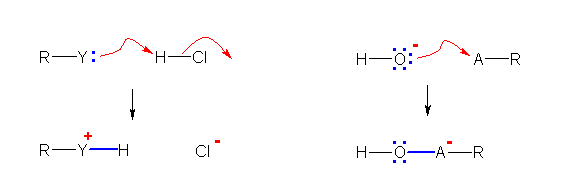
嫟栶巁丄嫟栶墫婎偵偮偄偰偼丄Brønsted-Lowry 偺掕媊偵娭楢偡傞偺偱丄嫵壢彂 2.7 愡傪嶲徠偡傞偙偲丅庼嬈偱偼丄僉儍僢僠儃乕儖傪偡傞応崌偺丄搳庤栶偲曔庤栶偱愢柧偟傑偟偨丅偁傞弖娫偵巁偱偁傞傕偺偼丄H+ 傪庤曻偟偨弖娫偵巁偱偼側偔側傝傑偡丅乮傕偆偄偪偳 H+ 傪偆偗偲傞偙偲偑偱偒傞偐傜丅乯乮敪揥偺崁傪嶲徠偡傞偙偲乯
乮夝摎椺乯
HNO3乮巁乯 亄 :NH3乮墫婎乯 仺 NO3亅乮嫟栶墫婎乯 亄 NH4亄乮嫟栶巁乯
巁偑僾儘僩儞(H亄)傪曻弌偟偰惗偠偨僀僆儞偑嫟栶墫婎偱偁傞丅乮曻弌偟偨応強偵乯傕偆堦搙僾儘僩儞傪庴偗庢傞偙偲偑壜擻偱偁傞偐傜墫婎偺柤偑晅偔丅
墫婎偑僾儘僩儞(H亄)傪庴偗庢偭偰惗偠偨僀僆儞偑嫟栶巁偱偁傞丅庴偗庢偭偨僾儘僩儞傪嵞搙曻弌偡傞偙偲偑壜擻偱偁傞偐傜巁偺柤偑晅偔丅
偔偳偔側傞偑丄師偺傛偆偵彂偄偰傕傛偄丅
HNO3偼丄巁偲偟偰摥偔偙偲偑偱偒丄偦偺寢壥惗偠傞嫟栶墫婎偼 NO3亅 偱偁傞丅
:NH3偼墫婎偲偟偰摥偔偙偲偑偱偒丄偦偺寢壥惗偠傞嫟栶巁偼 NH4亄偱偁傞丅
峏偵偄偆側傜偽丄
NO3亅 偼丄巁亅墫婎斀墳偺拞偱墫婎偺栶妱傪壥偨偡偑丄偦偺嫟栶巁偼 HNO3偱偁傞丅
NH4亄 偼丄巁亅墫婎斀墳偺拞偱巁偺栶妱傪壥偨偡偑丄偦偺嫟栶墫婎偼 :NH3偱偁傞丅
偲偄偆昞尰傕偱偒傞丅
娙寜偵偡傞偲丄
HNO3偺嫟栶墫婎偼 NO3亅 偱偁傞丅
:NH3偺嫟栶巁偼 NH4亄偱偁傞丅
NO3亅 偺嫟栶巁偼 HNO3偱偁傞丅
NH4亄 偺嫟栶墫婎偼 :NH3偱偁傞丅
側偍丄徤巁僀僆儞偺峔憿偵偮偄偰偼丄2-10(b)偺摎偊傪嶲徠偡傞偙偲丅
乮敪揥乯
偨偩偟丄偁傞暔幙偑 Brønsted-Lowry 偺巁偱偁傝丄摨帪偵 Brønsted-Lowry 偺墫婎偱偁傞偲偄偆偙偲傕偱偒傞丅偨偲偊偽師偺幃傪峫偊偰傒傛偆丅
1) HO- 亄 HCl 仺 H2O 亄 Cl-
2) H2O 亄 HCl 仺 H2O 亄 H3O+
忋偺幃偼丄悈巁壔僫僩儕僂儉側偳偲墫巁偑拞榓偡傞幃丅墫婎丄HO- 偑丄僾儘僩儞(H亄)傪庴偗庢傞偙偲偵傛傝丄嫟栶巁丄H2O 偵側傞丅
壓偺幃偼丄墫巁偑巁偲偟偰夝棧偡傞偲偒偺堦斒揑側幃丅悈拞偱偼丄梀棧偺僾儘僩儞(H亄)偲 Cl- 偵側傞傛傝丄悈暘巕偑僾儘僩儞(H亄)傪偆偗偲偭偰僆僉僜僯僂儉僀僆儞偵側傞偲峫偊傜傟偰偄傞丅偡側傢偪丄偙偺幃偵偍偄偰偼丄悈偑墫婎偲偟偰摥偔丅偦偺嫟栶巁偼 H3O+ 偱偁傞丅
偡側傢偪丄偁傞暔幙偑 Brønsted-Lowry 偺榞慻傒偺拞偱乽巁偱偁傞乿乽墫婎偱偁傞乿偲偄偆尵偄曽偑偱偒傞偺偼丄揔摉側乽巁亅墫婎斀墳乿傪峫偊偨偲偒偵偺傒桳岠偱偁傝丄偦偺斀墳偺庬椶偵傛偭偰偼摨偠暔幙偑巁偲偟偰傕摥偒丄墫婎偲偟偰傕摥偔偙偲偑偱偒傞応崌偑偁傞丅
乮僉儍僢僠儃乕儖偺椺偱偄偆側傜丄侾恖偱偼僉儍僢僠儃乕儖偵側傜側偄丗憡庤偺暔幙偺懚嵼偑憐掕偝傟偰丄偼偠傔偰巁亅墫婎偺斀墳幃偵側傞丅乯
2.12
傑偢梟塼偺 pH 偑 7 傛傝戝偒偗傟偽傾儖僇儕惈丄7 傛傝彫偝偗傟偽巁惈丄偲妎偊偨傛偆偵丄pKa 傕偦偺戝彫偱巁偺嫮偝傪昞偡偙偲偑偱偒傞偙偲傪擣幆偡傞傋偟丅
乮埲壓偵偍偄偰丄僽儔僂僓偵傛傝惓偟偔昞帵偝傟偰偄側偄応崌丄乽仼仺乿偼丄暯峵傪昞偡栴報偱偁傞丅乯
HA 仼仺 H亄 亄 A亅 偺暯峵斀墳偵偮偄偰丄
嫮偄巁偲偼丄傛傝懡偔偺 H+ 傪梌偊傞巁偱偁傞偐傜丄傛傝嫮偄巁傎偳丄偙偺暯峵偑塃傊偐偨傛傞丅
巁惈搙掕悢偼丄偦偺掕媊傛傝丄
| Ka = | [ H亄] | [ A亅] |
| [ HA ] | ||
偲昞偝傟傞丅巁偑夝棧懁乮忋幃塃懁乯偵暯峵偑偢傟偰偄傞乮僾儘僩儞傪曻弌偟偰偄傞乯傎偳丄暘曣偼彫偝偔丄暘巕偼戝偒偔側傞丅偡側傢偪丄Ka偺抣偑戝偒偄丅
側偍丄Ka 偲 pKa 偺娭學偼丄pH 偲 [H亄] 乮僾儘僩儞偺擹搙乯偺娭學偲摨偠偱偁傞丅偡側傢偪丄 pKa = 亅log( Ka ) 偱偁傞偐傜丄pKa 偺抣偑彫偝偄傎偳丄Ka 偼傛傝戝偒側抣偱偁傞丅
乮夝摎椺乯
傛傝彫偝側 pKa 傪帩偮僼僃僯儖傾儔僯儞偺傎偆偑嫮巁偱偁傞丅
2.13
偙偙偱偼丄拲栚偟偰偄傞墫婎偺嫟栶巁偺巁夝棧暯峵偲偟偰丄師偺暯峵傪峫偊傞丅
乮嫟栶巁乯 仼仺 H亄 亄 乮墫婎乯
NH3 仼仺 H亄 亄 NH2亅
H2O 仼仺 H亄 亄 OH亅
側偍丄傛傝嫮偄巁乮偡側傢偪傛傝嫮偔僾儘僩儞傪曻弌偟丄忋婰偺暯峵偼塃偵孹偔乯偲嫟栶偟偰偄傞墫婎偼庛偄乮偡側傢偪僾儘僩儞傪庴偗庢傝偵偔偄乯丅傑偨丄媡偵丄傛傝庛偄巁乮僾儘僩儞傪曻弌偟偵偔偔丄忋婰偺暯峵偼嵍偵孹偔乯偲嫟栶偟偰偄傞墫婎偼嫮偄乮偡側傢偪僾儘僩儞傪庴偗庢傝傗偡偄乯丅
乮夝摎椺乯
傾儞儌僯傾 NH3 偼丄傾儈僪僀僆儞 NH2- 偺嫟栶巁偱偁傞丅傑偨丄悈 H2O 偼丄悈巁壔暔僀僆儞 OH- 偺嫟栶巁偱偁傞丅
偙偙偱丄傛傝庛偄墫婎偺嫟栶巁偱偁傞悈偺曽偑丄巁偲偟偰嫮偄丅
墫婎偑傛傝庛偄
伀 仾
墫婎偼丄僾儘僩儞傪庴偗庢傝偵偔偄
伀 仾
嫟栶巁偼丄僾儘僩儞傪曻弌偟傗偡偄
伀 仾
嫟栶巁偼丄傛傝嫮偄
偦偺偨傔丄傾儈僪僀僆儞 NH2- 偼丄悈巁壔暔僀僆儞 OH- 傛傝傕嫮偄墫婎偱偁傞丅
側偍丄偙偙偱乽傾儞儌僯傾偼墫婎偲偟偰摥偔偐傜乿傑偨偼乽傾儞儌僯傾偼悈傛傝墫婎惈偑嫮偄偐傜乿偲愢柧偡傞偺偼岆傝偱偁傞丅傾儞儌僯傾傗悈偺墫婎惈偺嫮偝偐傜媍榑偝傟傞偺偼丄偦偺嫟栶巁偲偟偰偺 NH4亄 傗丄H3O亄 偺巁偲偟偰偺嫮偝偩偗偱偁傞丅乮偙傟偵娭楢偟偨暯峵偼埲壓偺捠傝乯
NH3 亄 H亄 仼仺 NH4亄
H2O 亄 H亄 仼仺 H3O亄
亊 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄乮AH 偑乯墫婎偲偟偰嫮偄乿
仜 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄偦偺嫟栶墫婎乮A亅 偑乯墫婎偲偟偰嫮偄乿
2.14
斀墳幃偺塃曈偲嵍曈偵偁傞擇偮偺巁偺偆偪丄偳偪傜偑嫮偄巁偱偁傞偐傪丄pKa 偺僨乕僞偐傜挷傋傞丅乮僥僉僗僩p50 偺昞2.3 傪嶲徠偺偙偲乯
嫮偄巁偼僾儘僩儞傪曻弌偟偰嫟栶墫婎 A亅 偵側傝丄傛傝庛偄巁偼僾儘僩儞傪庴偗庢傝丄巁宆乮 AH 偺宍乯偱梀棧偡傞丅
乮夝摎椺乯
嫮偄巁偑巁夝棧偟偰僾儘僩儞傪梌偊丄憡懳揑偵庛偄巁偺墫傗嫟栶墫婎偑偦偺僾儘僩儞傪庴偗庢傞偙偲偵傛傝丄庛偄巁偑梀棧偡傞傛偆側斀墳偑婲偒傞丅媡偵丄庛偄巁偑巁夝棧偟偰僾儘僩儞傪梌偊丄憡懳揑偵嫮偄巁偑梀棧偡傞傛偆側斀墳偼婲偒側偄丅
(a) HCN乮pKa=9.31乯偼丄CH3CO2H乮pKa=4.75乯傛傝庛偄巁偱偁傞丅廬偭偰偙偺斀墳偼恑峴偟側偄丅乮塃曈偐傜嵍曈傊偺斀墳偼丄傛傝庛偄巁偑惗偠傞偺偱丄恑峴偡傞丅乯
(b) CH3CH2OH乮pKa=16.00乯偼丄HCN乮pKa=9.31乯傛傝庛偄巁偱偁傞丅廬偭偰偙偺斀墳偼恑峴偟側偄丅乮塃曈偐傜嵍曈傊偺斀墳偼丄傛傝庛偄巁偑惗偠傞偺偱丄恑峴偡傞丅乯
2.15
2.14 偲摨偠傛偆偵峫偊傞丅傾儞儌僯傾偲傾僙僩儞傪巁偲偟偰峫偊偨嵺偵丄偳偪傜偑嫮偄巁偱偁傞偐傪 pKa 偺抣偐傜敾抐偡傞丅傛傝嫮偄巁偼僾儘僩儞傪曻弌偟偰嫟栶墫婎 A亅 偵側傝丄傛傝庛偄巁偼僾儘僩儞傪庴偗庢傝丄巁宆乮 AH 偺宍乯偱梀棧偡傞丅
乮夝摎椺乯
巁偲偟偰偔傜傋偨応崌丄傾僙僩儞偲傾儞儌僯傾偱偼傾僙僩儞偺曽偑嫮巁偱偁傞丅偟偨偑偭偰偙偺斀墳偼恑峴偟丄嫮巁乮傾僙僩儞乯偑僾儘僩儞傪曻弌偟丄庛巁乮傾儞儌僯傾乯偺嫟栶墫婎偱偁傞 NH2亅 偑僾儘僩儞傪庴偗庢傝丄傛傝庛偄巁偱偁傞傾儞儌僯傾乮 NH3 乯偑梀棧偡傞丅
2.16
pKa = 亅log( Ka ) 偱偁傞偐傜丄Ka = 10亅pKa 偱寁嶼偱偒傞丅乮捈壓偺乮偪傚偭偲曗懌乯傪嶲徠偺偙偲丅乯
仺 幚嵺偺寁嶼偵偼丄娭悢揹戩乮乽log乿傗乽10x乿偺儃僞儞偺偁傞傕偺乯傪梡偄偰偔偩偝偄丅
乮夝摎椺乯
10亅9.31 = 4.9 亊 10亅10
巜悢丒懳悢偺娭學偑偁傞応崌偺桳岠悢帤偵偮偄偰偼丄埲壓偺傛偆偵寁嶼偟偰妋擣偡傞偙偲丅
pKa 偑 9.31 偱偁傞偲婰弎偡傞偺偼丄pKa 偑亇0.01掱搙偺斖埻撪偺抣傪帩偮偙偲傪帵偟偰偄傞丅廬偭偰丄Ka 偺抣偼丄偍傛偦
丂丂10亅9.30 = 5.012 亊 10亅10
丂丂10亅9.31 = 4.898 亊 10亅10
丂丂10亅9.32 = 4.786 亊 10亅10
偺娫偺斖埻偵偁傞偙偲偑敾傞丅偙偺妋擣傛傝丄巜悢偑 0.01 曄壔偡傞偩偗偱寢壥偼彫悢揰埲壓侾埵偑曄壔偡傞偺偱丄彫悢揰埲壓侾埵傑偱掱搙偺惛搙偱昞偟偰偍偗偽傛偄偙偲偑敾傞丅
乮彫悢揰埲壓俀寘栚埲壓偺晹暘偺悢帤偼丄偁偒傜偐偵怣棅偱偒側偄偑丄彫悢揰埲壓侾寘栚偺晹暘偼丄4.8 偐 4.9 偐 5.0 掱搙偺斖埻偱偁傞偙偲傪帵偡偨傔偵堄枴偑偁傞丅堦寘彮側偔娵傔偨 5 亊 10亅10 偲偄偆摎偊偱偼丄乮4.5乣5.5乯亊 10亅10 偺斖埻傪帵偡偙偲偵側傝丄惓偟偄惛搙偱帵偟偰偄傞偙偲偵側傜側偄丅乯
乮偪傚偭偲曗懌乯
y = 10x 偺娭學偑偁偭偨偲偒丄椉曈偺懳悢傪偲傞偲
log( y ) = log( 10x ) 偲側傞丅塃曈傪惍棟偡傞偲
log( 10x ) = x log( 10 ) = x 偲側傞丅乮 log10 10 = 1 偱偁傞偐傜丅乯
偙偙偱丄y 偲偄偆暥帤傪 Ka 偲偄偆暥帤偱抲偒姺偊偰傗傞偙偲偵偡傞偲
pKa = 亅log( Ka ) = 亅log( y ) = 亅x 側傢偗偩丅偩偐傜丄
y = 10x = 10亅pKa 側偺偱偡丅
2.17
儖僀僗巁偲儖僀僗墫婎偵偮偄偰偼僥僉僗僩pp55-58傪嶲徠偡傞偙偲丅
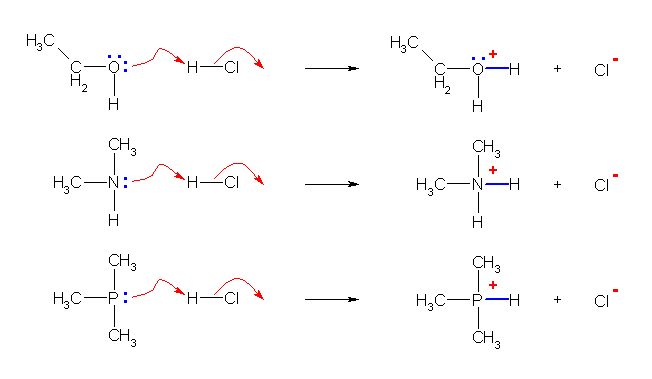
屒棫揹巕懳傪帩偮暘巕偼丄偡傋偰儖僀僗墫婎偲偟偰摥偔丅乮拞惈偺僴儘僎儞尨巕丄偨偲偊偽 R3C-Cl 偼椺奜偲偡傞丅乯
儖僀僗巁偲偟偰屒棫揹巕懳傪庴偗擖傟傞偙偲偑壜擻側偺偼丄僾儘僩儞偦偺傕偺傪娷傔丄僆僋僥僢僩傪枮偨偟偰偄側偄乮戞俀廃婜埲崀偱偼丄壔崌暔傗僀僆儞傪宍惉偟偰傕尨巕壙妅偺揹巕偑俇屄埲壓偱偁傞傛偆側傕偺乯傕偺偱偁傞丅
側偍丄儅僋儅儕乕偺嫵壢彂偱偼僾儘僩儞偦偺傕偺偩偗偱偼側偔丄僾儘僩儞偺嫙梌懱偵偮偄偰傕儖僀僗巁偺斖醗偵偼偄傞傕偺偲偟偰偄傞偑丄儖僀僗巁偺掕媊乽揹巕懳傪庴偗庢傞偙偲偑壜擻側傕偺乿傪尩枾偵夝庍偡傞偲丄僾儘僩儞偼儖僀僗巁偱偁傞偑丄僾儘僩儞嫙梌懱偼儖僀僗巁偱偼側偄丅偙偺曈傝偼丄嫵壢彂偵傛偭偰埖偄偑堎側傞丅
偍嬥偺擖偭偨偍嵿晍偼丄偍嬥偲摨摍偵埖偆偙偲偑偱偒傞偗傟偳丄偦偺偍嵿晍偑偍嬥偱偁傞偐偲偄偆偲丄偦偆偱偼側偄丅
乮夝摎椺乯
傑偢丄堦斒揑側幃偲偟偰 H-Cl 暘巕丄H-O- 僀僆儞偲偺斀墳偺宍幃傪埲壓偵帵偡丅揹巕偺摦偒傪昞偡愒偄嬋偑偭偨栴報偲丄斀墳偺慜屻偱堏摦偟偨傝丄徚柵丄惗惉偟偨揹巕懳傗寢崌側偳偺懳墳傪傛偔尒傞偙偲丅
嵍懁丗屒棫揹巕懳傪傕偭偨尨巕乮偙偙偱偼 Y 偲昞帵偟偨乯偑儖僀僗墫婎偲偟偰摥偒丄儖僀僗巁偲偺娫偵怴偨側寢崌傪惗惉偡傞丅偙偙偱偼丄僾儘僩儞乮H+乯偦偺傕偺偱偼側偔丄Cl- 偺扙棧偵傛偭偰僾儘僩儞傪梌偊傞墫巁暘巕 H-Cl 傪儖僀僗巁偲偟偰埖偭偰偄傞丅乮僸儞僩偵傕愒帤偱弎傋偨傛偆偵丄僾儘僩儞嫙梌巁傪 Brønsted 巁偲偟偰偺傒埖偄丄儖僀僗巁偲偟偰偼埖傢側偄応崌傕偁傞丅偦偺応崌偼丄墫巁暘巕偺巁夝棧屻偵惗偠傞僾儘僩儞乮H+乯偺傒傪昤偗偽傛偄丅乯
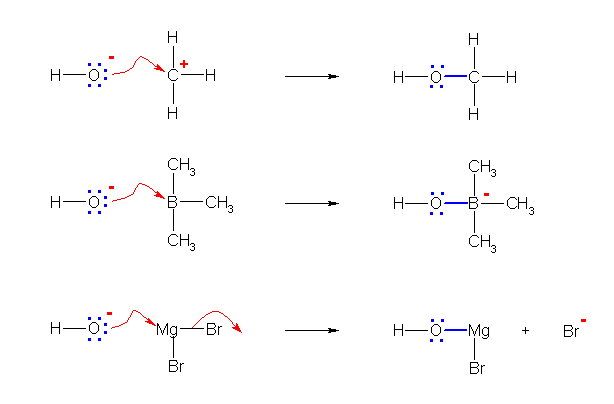
塃懁丗悈巁壔暔僀僆儞偺巁慺尨巕偼俁懳偺屒棫揹巕懳偲晧偺揹壸傪帩偮丅偙偺晹暘偑儖僀僗墫婎偲偟偰摥偒丄儖僀僗巁偲偺娫偵怴偨側寢崌傪惗惉偡傞丅偙偙偱偼儖僀僗巁偼 A 偱帵偟偰偄傞丅
怴偨側寢崌偺惗惉傗愗抐偵墳偠偰曄壔偡傞奺尨巕偺宍幃揹壸偺曄壔偵拲堄偡傞偙偲丅
(a)
(b)
2.18
(a) 拏慺側偳偺尨巕偑乽墫婎偲偟偰摥偔乿偲偄偆偙偲偼丄偦偺屒棫揹巕懳偑僾儘僩儞乮儖僀僗巁乯傪庴偗庢傞偙偲傪昞偟偰偄傞偐傜丄傛傝揹巕枾搙偺崅偄乮恾偵偍偄偰偼愒偄怓偺乯拏慺尨巕偺曽偑傛傝墫婎惈偱偁傞偲敾抐偱偒傞丅
傑偨丄偁傞暘巕偑乽巁偲偟偰摥偔乿応崌偵偼丄儖僀僗墫婎側偳偺揹巕懳乮晧偺晹暘揹壸傪帩偭偰偄傞乯偵傛傝丄傛傝惓偵懷揹偟偨悈慺乮惓偺晹暘揹壸傪帩偭偰偄傞乯傪梲僀僆儞偲偟偰堷偒敳偐傟傞偺偱偁傞偐傜丄傛傝堿惈偺尨巕乮偙偺応崌偼拏慺乯偵寢崌偟偨乮恾偵偍偄偰偼惵偄怓偺乯悈慺尨巕偑傛傝巁惈偱偁傞偲敾抐偱偒傞丅
(b) (a) 偱峫偊偨丄嵟傕墫婎惈偺崅偄埵抲偑僾儘僩儞壔傪偆偗偨傝丄嵟傕巁惈偺崅偄埵抲偺悈慺偑僾儘僩儞偲偟偰敳偗偨傝偡傞丅偙傟傜偵懳墳偡傞嫟柭偺嬌尷峔憿傪彂偔偨傔偵偼丄偁傞傂偲偮偺峔憿幃偵偍偄偰丄擇廳寢崌偺埵抲丄偍傛傃屒棫揹巕懳偺埵抲傪柧傜偐偵偡傞偲偙傠偐傜偼偠傔傞丅嫵壢彂 2.5丄 2.6 愡傪嶲徠偵偟側偑傜揹巕懳乮屒棫揹巕懳丄傑偨偼 π 寢崌乯傪堏摦偝偣傞傛偆偵偡傞丅
乮夝摎椺乯
敪揥偺崁偵傕弎傋偰偄傞傛偆偵丄僀儈僟僝乕儖拏慺偼俀偮偲傕 sp2 崿惉傪偲傞丅屒棫揹巕懳偵偼俀捠傝偁傝丄俆堳娐偺暯柺撪偵偁傞乮C-H 寢崌側偳偲摨偠傛偆偵曻幩曽岦偵峀偑偭偨乯sp2 崿惉婳摴撪偵偁傞傕偺乮壓恾偵偍偄偰愒偱帵偟偨乯偲丄娐偵悅捈側曽岦乮π 寢崌傪宍惉偟偰偄傞 p 婳摴偲摨偠曽岦乯偵偁傞 p 婳摴撪偵偁傞傕偺乮惵偱帵偟偨乯偲偑偁傞丅偙偺偆偪丄傛傝嫮偄儖僀僗墫婎惈傪帵偡偺偼丄愒偱帵偟偨傛偆側 sp2 崿惉婳摴撪偺屒棫揹巕懳偱偁傝丄嫟柭峔憿傪峫偊傞嵺偵娐忋偺懠偺擇廳寢崌偲嫤憈揑偵摦偄偰偄偔偺偼惵偱帵偟偨傛偆側 p 婳摴撪偺屒棫揹巕懳偱偁傞丅
(a) 悈慺偺寢崌偟偰偄側偄曽偺拏慺偑傛傝墫婎惈丅僀儈僟僝乕儖偑巁偵傛傝僾儘僩儞壔傪庴偗傞斀墳幃傪帵偡丅
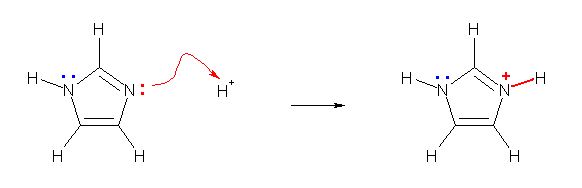
揹婥堿惈搙偺崅偄尨巕偱偁傞拏慺偵寢崌偟偨悈慺偑嵟傕巁惈丅僀儈僟僝乕儖偑墫婎乮B-乯偲斀墳偟偰扙僾儘僩儞壔傪庴偗傞斀墳幃傪帵偡丅
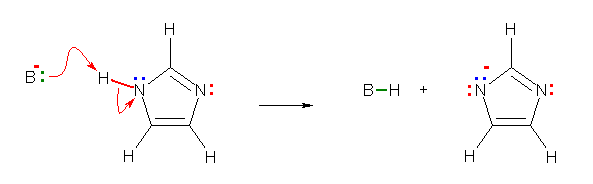
(b)
僾儘僩儞壔偺惗惉暔偵偮偄偰偺嫟柭峔憿幃偼丄愒怓偺嬋偑偭偨栴報偱帵偟偨傛偆側揹巕偺摦偒偱丄師恾偺傛偆偵彂偔偙偲偑偱偒傞丅
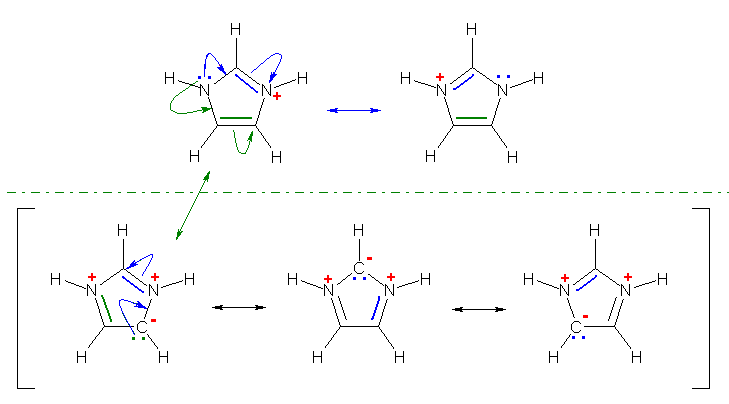
偨偩偟丄恾偺壓敿暘偺俁偮偺傛偆側嬌尷峔憿幃偼丄椢怓偺嬋偑偭偨栴報偱帵偡傛偆側揹巕偺摦偒偵廬偊偽昤偔偙偲偑壜擻偱偁傞偑丄峔憿幃拞偱椬愙偟偨俀偮偺尨巕偵惓偲晧偺揹壸傪彂偐偞傞傪偊側偔側傞偨傔偵晄帺慠側峔憿偱偁傞丅廬偭偰丄堦斒揑偵嫟柭峔憿傪峫偊傞嵺偵偼丄婑梌偺戝偒偄嬌尷峔憿偲偟偰忋恾偺忋偺俀庬偺傒傪峫偊傟偽傛偄丅
扙僾儘僩儞壔偺惗惉暔偵偮偄偰偺嫟柭峔憿幃偼丄愒怓偺嬋偑偭偨栴報偱帵偟偨傛偆側揹巕偺摦偒偱丄師恾偺傛偆偵彂偔偙偲偑偱偒傞丅
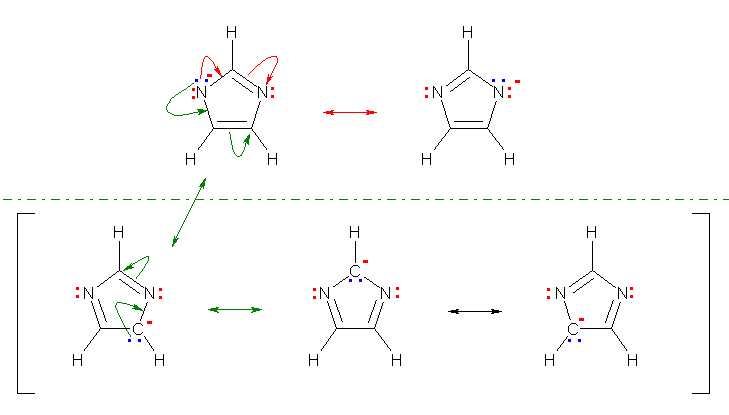
偨偩偟丄恾偺壓敿暘偺俁偮偺傛偆側嬌尷峔憿幃偼丄椢怓偺嬋偑偭偨栴報偱帵偡傛偆側揹巕偺摦偒偵廬偊偽昤偔偙偲偑壜擻偱偁傞偑丄晧偺宍幃揹壸傪拏慺傛傝傕揹婥堿惈搙偺崅偔側偄扽慺忋偵彂偐偞傞傪偊側偔側傞偨傔偵晄帺慠側峔憿偱偁傞丅廬偭偰丄堦斒揑偵嫟柭峔憿傪峫偊傞嵺偵偼丄婑梌偺戝偒偄嬌尷峔憿偲偟偰忋恾偺忋偺俀庬偺傒傪峫偊傟偽傛偄丅
乮敪揥乯
僀儈僟僝乕儖 偺俁師尦柾宆
忋偺儕儞僋偐傜傕妋擣偱偒傞傛偆偵丄僀儈僟僝乕儖偼暯柺宆偺暘巕偱偁傞丅偡側傢偪丄僀儈僟僝乕儖娐偵娷傑傟傞俀偮偺拏慺偼丄暯柺宆俁攝埵偺 sp2 崿惉偱偁傞丅峔憿幃偐傜傕敾傞傛偆偵丄拞惈偺僀儈僟僝乕儖偺俀偮偺拏慺尨巕偼丄偄偢傟傕俁杮偺寢崌偲侾懳偺屒棫揹巕懳傪帩偮丅扽慺偲擇廳寢崌傪偲傞拏慺偵偍偄偰偼丄p 婳摴偼扽慺偲偺擇廳寢崌偵巊梡偝傟丄屒棫揹巕懳偼 sp2 崿惉婳摴偺偆偪偺侾偮傕擖偭偰偄傞偲峫偊傜傟傞丅傕偆傂偲偮偺拏慺偼悈慺偲寢崌偟偰偍傝丄俀偮偺扽慺側傜傃偵悈慺偲偺寢崌偵俁偮偁傞 sp2 崿惉婳摴偑巊傢傟丄偙偺俁攝埵偵悅捈側 p 婳摴拞偵屒棫揹巕懳偑擖偭偰偄傞丅
偡側傢偪丄俆堳娐傪宍惉偟偰偄傞俆偮偺尨巕乮俁偮偺扽慺偲俀偮偺拏慺乯偼丄偄偢傟傕 sp2 崿惉偱偁傝丄寁俆偮偺 p 婳摴偑摨偠曽岦乮娐偵懳偟偰悅捈側曽岦乯傪岦偔丅偙偺拞偵偼俀杮偺擇廳寢崌偵巊傢傟偰偄傞係偮丄偍傛傃屒棫揹巕懳偲偟偰昤偐傟偰偄傞俀偮偺揹巕偑擖偭偰偄傞傛偆側 6π 揹巕宯偺壔崌暔丄偮傑傝丄朏崄懓壔崌暔偱偁傞偲偄偊傞丅乮朏崄懓惈偵偮偄偰偼丄15復傪嶲徠偡傞偙偲丅乯
2.19
懳徾偲偟偰峫偊偰偄傞梟幙暘巕偺暘嬌乮暘巕撪偺揹壸偑曃傝丄δ+ 傗 δ- 傪惗偠傞偙偲乯偼丄恊悈惈傪惗偠傞尨場偲側傞丅偙傟偼丄悈偼乮揹婥堿惈搙偺戝偒偔堎側傞丄巁慺亅悈慺偺寢崌傪帩偮偨傔偵乯戝偒偔暘嬌偟偰偍傝丄梟幙暘巕偺 δ+ 偲偼丄悈偺巁慺尨巕乮δ-乯偑堷椡揑偵憡屳嶌梡偟丄梟幙暘巕偺δ-偲偼丄悈偺悈慺尨巕乮δ+乯偑堷椡揑偵憡屳嶌梡偟丄悈偵梟偗偨忬懺偑埨掕偵側傞偐傜偱偁傞丅偮傑傝丄戝偒偔暘嬌偟偨姱擻婎偼恊悈惈婎偱偁傞偲偄偭偰傛偄丅
恊悈惈偺姱擻婎傪帩偨側偄暘巕偼慳悈惈偱偁傞丅恊悈惈偺姱擻婎傪帩偮傕偺偱傕丄暘巕慡懱偺戝偒偝偵懳偡傞妱崌偑彫偝偗傟偽丄恊悈惈偺搙崌偄偼掅偄丅
暘巕拞偺姱擻婎偱傕丄悈巁婎乮亅OH乯傗丄僇儖儃僯儖婎乮>C=O)偼丄戝偒偔暘嬌偟偰偍傝丄恊悈惈傪帵偡偲峫偊偰傛偄丅摿偵丄悈巁婎偺応崌偼悈偲摨條偵悈慺寢崌偺嫙梌擻丄庴梕擻偺椉曽傪帵偡偨傔丄恊悈惈偑摿偵嫮偄丅乮僇儖儃僯儖婎偼丄悈慺寢崌偺庴梕擻傪帵偡丅乯
價僞儈儞A 偺俁師尦柾宆
價僞儈儞C 偺俁師尦柾宆
乮夝摎椺乯
價僞儈儞C 偼恊悈惈偱悈偵梟偗傗偡偄丅價僞儈儞A 偼慳悈惈偱帀偵梟偗傗偡偄丅
乮敪揥乯
捠忢偺怘惗妶傪偟偰偄傞暘偵偼栤戣側偄偑丄價僞儈儞偑懱偵偲偭偰昁梫側傕偺偱偁傞偐傜偲偄偭偰價僞儈儞嵻側偳傪愛傝夁偓傞偲丄夁忚愛庢偵傛傞忈奞偑尰傟傞偙偲偑偁傞丅悈梟惈偺價僞儈儞孮偼丄擜側偳偵傛偭偰懱奜偵攔煏偝傟傗偡偄偺偱夁忚愛庢偵傛傞忈奞偑尰傟偵偔偄偲偝傟傞偑丄帀梟惈價僞儈儞偼娞憻傪偼偠傔偲偡傞懱撪偵拁愊偝傟傗偡偄偨傔丄夁忚愛庢偵傛傞忈奞偑尰傟傗偡偄丅乮偨偲偊偽懱傪嶌偭偰偄傞嵶朎偺嵶朎枌側偳偼帀幙側偳偐傜偱偒偰偄傞偨傔丄帀梟惈偺暔幙傪拁愊偟傗偡偄偲峫偊傜傟傞丅乯
2.20
嫵壢彂偺暘巕儌僨儖恾偐傜敾傞傛偆偵丄僫僼僞儗儞傪峔惉偡傞偡傋偰偺扽慺尨巕偼俁杮偺僔僌儅寢崌傪帩偭偰偄傞丅乮偡傋偰偺扽慺尨巕偑 sp2 崿惉偟偰偄傞丅乯偦偺偨傔丄偡傋偰偺扽慺尨巕偑係杮偺寢崌傪帩偰傞傛偆偵丄椬愙偟偨扽慺摨巑偺娫偵揔媂擇廳寢崌傪擖傟傞丅
娷傑傟傞擇廳寢崌偺悢偼丄師偺傛偆偵偟偰傕媮傔傞偙偲偑偱偒傞丅乮晄朞榓搙偺峫偊曽乯
扽慺偺悢傪悢偊傞偲侾侽屄偱偁傞丅
伀
娐峔憿傕懡廳寢崌傕娷傑側偄傾儖僇儞偱偁傞偲偡傞偲丄悈慺偺悢偼俀俀屄偱偁傞偼偢丅
乮傾儖僇儞偺堦斒幃偑丄CnH2n+2 側偺偱丅乯
伀
悈慺偺悢傪悢偊傞偲俉屄偱偁傝丄忋偺梊憐傛傝侾係屄彮側偄丅
乮晄朞榓搙偼丄14/2 亖 7 偱偁傞丅乯
伀
堦斒偵丄懡廳寢崌偑侾憹偊傞丄傑偨偼丄娐偺峔憿偑侾憹偊傞偛偲偵悈慺偺悢偼俀屄尭傞丅
乮晄朞榓搙偑侾憹偊傞 亖 悈慺偺悢偑俀屄尭傞乯
伀
暘巕撪偺娐偺峔憿偑俀偮偁傞偐傜丄懡廳寢崌偼俆杮偱偁傞丅
昤偒偆傞嫟柭峔憿偺悢傪挷傋傞偨傔偵偼丄師偺傛偆偵峫偊傞丅傑偢丄堦曽偺儀儞僛儞娐乮擇廳寢崌偑岎屳偵俁売強乯晹暘偵懳偟偰俀庬椶偺嫟柭峔憿傪峫偊傞偙偲偑偱偒傞丅偙偺偦傟偧傟偵偮偄偰丄傕偆堦曽偺弅崌偟偨娐偵偼俀売強偺擇廳寢崌傪抲偔偙偲偵側傞偑丄偳偺傛偆側抲偒曽偑壜擻偐峫偊傛丅
乮夝摎椺乯
埲忋偺俁偮偺嫟柭峔憿傪昤偔偙偲偑偱偒傞丅
拲堄両両丂
 偼丄娫堘偄丅擇偮偺娐偵嫟捠偟偰偄傞扽慺偺寢崌偑俆杮偵側偭偰偄傞丅
偼丄娫堘偄丅擇偮偺娐偵嫟捠偟偰偄傞扽慺偺寢崌偑俆杮偵側偭偰偄傞丅
2.21-2.30
2.21
忋偺栤戣偲摨條偵丄帵偝傟偰偄傞僔僌儅寢崌偺悢偑係枹枮偺扽慺尨巕偵偮偄偰拲栚偡傞丅傑偨丄巁慺尨巕偼俀杮偺寢崌傪帩偮偺偱丄帵偝傟偰偄傞僔僌儅寢崌偺悢偑俀枹枮偺巁慺尨巕偵偮偄偰傕拲栚偡傞丅偙偺暘巕撪偵偼俁売強偺扽慺亅扽慺擇廳寢崌偲侾売強偺扽慺亅巁慺擇廳寢崌偑偁傞丅
僀僽僾儘僼僃儞 偺俁師尦柾宆
乮夝摎椺乯
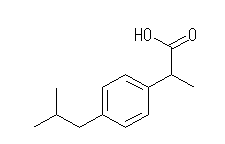
僀僽僾儘僼僃儞 C13H18O2, 2-(4-isobutylphenyl)propanoic acid
側偍丄拞墰偺儀儞僛儞娐偺拞偵俁偮偁傞擇廳寢崌偺埵抲偼丄扨寢崌偲岎屳偵側傞傛偆偵彂偄偰偁傟偽傛偔丄俀捠傝偺昤偒曽乮堦曽偼傕偆堦曽傪嬀偵幨偟偨傛偆側埵抲娭學乯偑偁傝摼傞丅
2.22
嫵壢彂 2.2 愡傪嶲峫偵偟丄栤戣 2.5 側偳偲摨偠傛偆偵峫偊傞丅暘巕慡懱偺憃嬌巕儌乕儊儞僩偼丄堎側傞揹婥堿惈搙傪帩偮尨巕娫偺寢崌偺揹壸偺曃傝乮暘嬌乯偺儀僋僩儖榓偱峫偊傞偙偲偑偱偒傞丅偦傟偧傟偺寢崌偵桼棃偡傞暘嬌傪栴報偱昤偒丄儀僋僩儖偲偟偰榓傪偲傞丅摨偠戝偒偝偱姰慡偵媡岦偒偺栴報偺榓偼丄屳偄偵偆偪徚偟偰僛儘偲側傞丅
梌偊傜傟偨惷揹億僥儞僔儍儖儅僢僾偐傜傕暘巕慡懱偱偺揹壸偺曃傝偺條巕偑敾傞丅偙傟偲傕尒斾傋偰丄寢崌偵増偭偨晹暘揑側暘嬌乮揹壸偺曃傝乯偲丄暘巕慡懱偺憃嬌巕儌乕儊儞僩偺娭學傪傛偔棟夝偟偰偍偔偙偲丅
乮夝摎椺乯
墫慺尨巕偼扽慺尨巕傛傝傕戝偒側揹婥堿惈搙傪帩偮乮嫵壢彂 P36, 恾2.2乯偺偱丄扽慺亅墫慺寢崌偼暘嬌偟偰偄傞丅偦偺暘嬌乮揹壸偺曃傝乯偺儀僋僩儖傪丄愒偺栴報偱昞偡偲丄暘巕慡懱偺憃嬌巕儌乕儊儞僩偼丄偦偺榓偲側傝丄惵偺栴報偲側傞丅
cis-1,2-dichloroethene 偱偼丄摨偠曽岦偺 C-Cl 寢崌偵桼棃偡傞暘嬌偺榓偲偟偰丄憃嬌巕儌乕儊儞僩偑惗偠傞偑丄trans-1,2-dichloroethene 偱偼丄媡傪岦偄偨 C-Cl 寢崌偵桼棃偡傞暘嬌偑懪偪徚偟崌偆偨傔偵憃嬌巕儌乕儊儞僩偼惗偠側偄丅
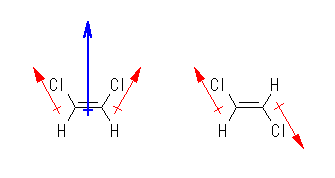
乮敪揥乯
栤戣 2.5 偲杮幙揑偵堎側傞偺偼丄僄僠儗儞僌儕僐乕儖偺応崌偵偼扽慺亅扽慺寢崌偺幉偵増偭偨帺桼夞揮偑壜擻偱偁偭偨乮偦偺偨傔丄栤戣偺慜採帠崁偵岆傝偑偁傝丄僄僠儗儞僌儕僐乕儖偺憃嬌巕儌乕儊儞僩偼幚嵺偵偼侽偱偼側偄丄偲偄偆帠懺偑惗偠偨乯偺偵懳偟丄1,2-僕僋儘儘僄僞儞偺応崌偼扽慺摨巑娫偑擇廳寢崌偱偁傞偐傜丄捠忢偺忦審偱偼寢崌偺幉偵増偭偨夞揮偼婲偒側偄偨傔丄暘巕偺宍偑屌掕偝傟偰偄傞偲偄偆偙偲偱偁傞丅
栤戣 2.5 偱傕乽trans-1,2-僕僋儘儘僄僥儞偲摨偠傛偆側宍乮丗栤戣2.5偺僸儞僩偵儕儞僋偱帵偟偨俁師尦儌僨儖偑帵偡宍乯偵屌掕偝傟偰偄傞乿偲偄偆尷掕忦審壓偱峫偊傟偽丄暘巕慡懱偲偟偰憃嬌巕儌乕儊儞僩傪帩偨側偄偲偟偰椙偄丅
2.23
懡廳寢崌偺埵抲丗乮揹壸傪帩偨側偄乯扽慺尨巕丄拏慺尨巕丄巁慺尨巕偼丄偦傟偧傟係杮丄俁杮丄俀杮偺寢崌傪帩偮偺偱丄帵偝傟偰偄傞僔僌儅寢崌偺悢偑偙偺悢偵枮偨側偄尨巕偵偮偄偰拲栚偡傞丅
屒棫揹巕懳偺埵抲丗壙揹巕偺悢偑俆屄丄俇屄偱偁傞拏慺尨巕丄巁慺尨巕偼丄偦傟偧傟侾懳丄俀懳偺屒棫揹巕懳傪帩偮丅
傾僨僯儞 偺俁師尦柾宆
僔僩僔儞 偺俁師尦柾宆
乮夝摎椺乯
暘巕儌僨儖恾傛傝暘巕幃傪撉傒庢傞偲丄傾僨僯儞偼 C5H5N5丄僔僩僔儞偼 C4H5ON3 偱偁傞丅偙傟傜偺晄朞榓搙偼丄偦傟偧傟丄傾僨僯儞偼俇丄僔僩僔儞偼係偲側傞丅
乮晄朞榓搙偺寁嶼丗壓偺敪揥偺崁傪嶲徠乯
傾僨僯儞丗(5*2+2 +5 -5)/2 = 6
僔僩僔儞丗(4*2+2 +3 -5)/2 = 4
暘巕儌僨儖恾傛傝丄娐忬峔憿傪悢偊傞偲丄傾僨僯儞偱俀丄僔僩僔儞偱侾偱偁傞偐傜丄忋偺晄朞榓搙偺偆偪丄暘巕拞偵懚嵼偡傞懡廳寢崌偵桼棃偡傞晄朞榓搙偼丄傾僨僯儞偱係丄僔僩僔儞偱俁偲側傞丅
(a) 
乮擇廳寢崌偺埵抲偼丄忋偺嫟柭幃偵昞偝傟偰偄傞俀偮偺嬌尷峔憿幃偺偳偪傜偱傕壜丅乯
(b) 
乮敪揥乯
扽慺丄巁慺埲奜偵丄拏慺偍傛傃巁慺側偳傪娷傓暘巕偺晄朞榓搙偺寁嶼偺巇曽
拏慺偼俁杮偺寢崌丄巁慺偼俀杮偺寢崌丄僴儘僎儞偼侾杮偺寢崌傪帩偮偙偲傪峫椂偡傞偲丄
C-H 寢崌偑 C-NH2 偲側傞偲丄暘巕偺拞偺悈慺偺悢偼侾偮憹偊傞丅
C-H 寢崌偑 C-O-H 偲側偭偰傕丄暘巕偺拞偺悈慺偺悢偼曄壔偟側偄丅
C-H 寢崌偑 C-Br 側偳偲側傞偲丄暘巕偺拞偺悈慺偺悢偼侾偮尭傞丅
埲忋傛傝丄扽慺偺悢 m 丄拏慺偺悢 n 丄巁慺偺悢 o 丄僴儘僎儞偺悢 p 偵懳偟丄晄朞榓搙偼 {(2m+2) +n -p -(悈慺偺悢)}/2 偱媮傔傞偙偲偑偱偒傞丅偙偺寁嶼偵偍偄偰丄巁慺偺悢偼晄朞榓搙偵塭嬁偟側偄丅
2.24
崪奿峔憿幃偺婯懃傛傝丄徣棯偝傟偰偄傞偺偼乽扽慺偵寢崌偟偨悈慺乿偺傒偱偁傞丅廬偭偰丄乮懡廳寢崌傕娷傔偰悢偊偰乯係杮枹枮偺寢崌偟偐昤偐傟偰偄側偄扽慺偼丄偦偺巆傝偺悢偺悈慺偲寢崌偟偰偄傞丅
嫵壢彂乮戞俈斉丄戞侾嶞乯偵梌偊傜傟偰偄傞僄僼僃僪儕儞偺峔憿偼丄偍偦傜偔娫堘偭偰偄傞丅偙偙偱偼丄嫵壢彂偺峔憿偵懳偟偰夝摎偡傞偙偲丅
偙偺栤偄偵偍偄偰 僄僼僃僪儕儞偲偟偰梌偊傜傟偨暘巕偺俁師尦柾宆
僄僼僃僪儕儞 偺俁師尦柾宆
僐僇僀儞 偺俁師尦柾宆
乮夝摎椺乯
徣棯偝傟偨尦慺傕偡傋偰昞婰偡傞偲丄師偺傛偆側峔憿幃偲側傞丅
(a) 
(b) 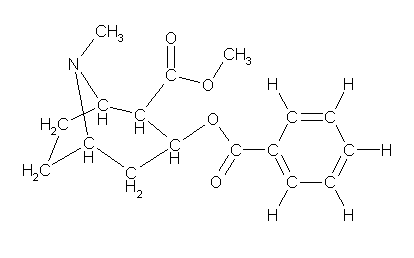
廬偭偰丄
(a) 悈慺偺悢偼17屄丄暘巕幃偼C11H17ON
(b) 悈慺偺悢偼21屄丄暘巕幃偼C17H21O4N
2.25
栤戣 2.1 偐傜 2.3 傪嶲徠偡傞偙偲丅廃婜昞偱塃丄忋偵偄偔傎偳揹婥堿惈搙偼戝偒偔側傞孹岦偵偁傞丅嫵壢彂36儁乕僕丄恾 2.2 偵嬶懱揑側揹婥堿惈搙偺悢抣傕梌偊傜傟偰偄傞丅
乮夝摎椺乯
(a) F
(b) F
(c) O
(d) O
2.26
揹婥堿惈搙偺嵎偑戝偒偄 亖 嫮偔暘嬌偟偰偄傞 亖丂偦偺寢崌偑丄傛傝嬌惈偱偁傞
乮夝摎椺乯
僇僢僐撪偵俀偮偺尨巕偺揹婥堿惈搙偺嵎傪昞偟偨丅栴報偑嬌惈偺岦偒乮亄仺亅乯
(a) H3C 仺 Cl (0.5) 亜 Cl 亅 Cl (0.0)
(b) H3C 仼 H (0.4) 亙 H 仺 Cl (0.9)
(c) HO 仼 CH3 (1.0) 亜 (CH3)3Si 仺 CH3 (0.7)
(d) H3C 仼 Li (1.5) 亙 Li 仺 OH (2.5)
2.27
2.22 側偳傕嶲徠偡傞偙偲丅暘巕慡懱偺憃嬌巕儌乕儊儞僩偼丄偦傟偧傟偺寢崌偺揹壸偺曃傝乮暘嬌乯偺儀僋僩儖榓偱峫偊傞偙偲偑偱偒傞丅側偍丄偙傟傜偺暘巕偱丄摿偵揹婥堿惈搙偺嵎偑戝偒偄丄偦偟偰扽慺亅悈慺寢崌偲偼暘嬌偺岦偒偑媡偱偁傞傛偆側丄扽慺亅巁慺寢崌偺暘嬌偺傒拲栚偟偰丄偦偺榓傛傝憃嬌巕儌乕儊儞僩傪媮傔偰傕傛偄丅
乮夝摎椺乯
揹婥堿惈搙偺堎側傞尨巕娫偺寢崌乮C-H 寢崌偼柍帇偟丄C-Cl 寢崌偺傒偵拲栚偟偨乯偺揹壸偺曃傝乮暘嬌乯偺儀僋僩儖傪丄愒偺栴報偱昞偡偲丄暘巕慡懱偺憃嬌巕儌乕儊儞僩偼丄偦偺榓偲側傝丄惵偺栴報偲側傞丅
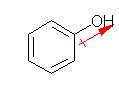
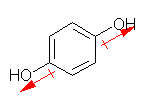
| (a) phenol | (b) benzene-1,2-diol catechol |
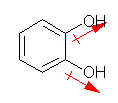
(c) benzene-1,3-diol resorcinol |
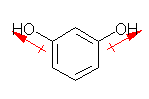
(d) benzene-1,4-diol hydroquinone |
 |
 |
 |
 |
| 儀僋僩儖偺榓乮惵栴報乯 | |||
 |
 |
 |
 |
| 峔憿傛傝梊應偝傟傞憃嬌巕儌乕儊儞僩偺憡懳揑側戝偒偝 | |||
| 1.00 | 1.73 | 1.00 | 0.00 |
2.28
(a) 嫵壢彂38儁乕僕偺寁嶼幃傪梡偄傞偲丄H-Cl 傪姰慡偵僀僆儞惈偺寢崌乮偡側傢偪丄悈慺尨巕忋偵惓枴偺惓揹壸丄墫慺尨巕忋偵惓枴偺晧揹壸偑偁傞傕偺丄H+-Cl-乯偲峫偊偨偲偒偺憃嬌巕儌乕儊儞僩偺戝偒偝傪寁嶼偡傞偙偲偑偱偒傞丅偡側傢偪丄μ = 俻 亊 r 偵偍偄偰丄r乮 悈慺亅墫慺偺尨巕娫嫍棧 乯偼 136 pm乮扨埵偼儊乕僩儖偵側偍偟偰偐傜戙擖偡傞偙偲乯丄俻偼揹婥慺検乮 1.60 亊 10亅19 C 乯偲偟偰寁嶼偡傞丅
(b) 幚應偺憃嬌巕儌乕儊儞僩偺戝偒偝偑 (a) 偺傛偆偵寁嶼偟偨抣傛傝傕彫偝偄偺偼丄悈慺尨巕丄墫慺尨巕忋偺揹壸偺愨懳抣 俻' 偑揹婥慺検傛傝彫偝偄偨傔偱偁傞丅偡側傢偪丄悈慺尨巕傗墫慺尨巕偑 100% 偺僀僆儞 "H+"丄"Cl-" 偱偼側偔丄晹暘揹壸傪帩偮乮 "Hδ+"丄"Clδ-"乯偵偡偓側偄偐傜偱偁傞丅偙偺 俻' 偺戝偒偝偺揹婥慺検俻偵懳偡傞妱崌偑僀僆儞惈偺妱崌偱偁傞偐傜丄偦偺抣偼丄幚應偺憃嬌巕儌乕儊儞僩偺戝偒偝偺 (a) 偱媮傔偨抣乮100% 僀僆儞惈偱偁傞偲壖掕偟偰嶼弌偝傟傞抣乯偵懳偡傞妱崌偵摍偟偄丅
乮夝摎椺乯
(a) HCl偑姰慡偵僀僆儞惈偱偁傞傕偺偲偟偰丄偦偺憃嬌巕儌乕儊儞僩傪寁嶼偡傞偲丄μ = 俻 亊 r 偵偍偄偰丄r乮 悈慺亅墫慺偺尨巕娫嫍棧 乯偼 136 亊 10亅12 m丄俻偼揹婥慺検乮 1.60 亊 10亅19 C 乯偲偟偰寁嶼偡傞偲丄μ = 2.176 亊 10亅29 C m 偲側傞丅3.336 亊 10亅30 C m 偑 1 D 偱偁傞偐傜丄姺嶼偡傞偲丄6.52 D 偲側傞丅
(b) 幚應抣偼 1.08 D 偱偁傞偐傜丄 1.08 / 6.52 = 0.1656乧 偲側傝丄16.6 % 偺僀僆儞惈傪帩偮偙偲偑寁嶼偝傟傞丅
(a) 偵偮偄偰偼丄傑偭偲偆偵寁嶼偡傞偺偱偼側偔丄嫵壢彂 p38 偵傕帵偝傟偰偄傞悢抣偲偟偰丄揹婥慺検偺揹壸偑 100 pm偱 4.80 D 偵側傞偲偄偆娭學傪妎偊偰梡偄偰傕傛偄丅偡側傢偪丄HCl偑姰慡偵僀僆儞惈偱偁傞傕偺偲偟偰丄揹壸娫偺嫍棧偑 136 pm 偱偁傞偲偄偆偙偲偼丄偙偺帪偺憃嬌巕儌乕儊儞僩偼 4.80 亊 1.36 偲偟偰寁嶼偝傟傞丅
2.29
扽慺亅悈慺寢崌偲扽慺亅墫慺寢崌偱偼暘嬌偺岦偒偑媡偱偁傞偙偲偵拲栚偟丄暘巕慡懱偺憃嬌巕儌乕儊儞僩傪峫偊傞嵺偵丄扽慺亖巁慺寢崌偺暘嬌偺岦偒偲摨偠曽岦偺栴報乮偡側傢偪憃嬌巕儌乕儊儞僩傪戝偒偔偡傞曽岦乯側偺偐丄扽慺亖巁慺寢崌偺暘嬌偺岦偒偲媡曽岦偺栴報乮偡側傢偪憃嬌巕儌乕儊儞僩傪偆偪徚偟偰彫偝偔偡傞曽岦乯側偺偐傪峫偊傞丅
乮夝摎椺乯
H-C 寢崌偵偍偄偰偼丄H 仺 C 偺岦偒偵暘嬌偟偰偄傞乮揹婥堿惈搙偺嵎偼 0.4 乯偺偵懳偟丄C-Cl 寢崌偵偍偄偰偼丄C 仺 Cl 偺岦偒偵暘嬌偟偰偄傞乮揹婥堿惈搙偺嵎偼 0.5 乯丅壓恾偱偼丄偙傟傜偺寢崌偵桼棃偡傞暘嬌傪愒偺栴報偱丄偦偟偰丄俀偮偺愒栴報偺崌惉偵傛傝惗偠傞暘嬌傪惵栴報偱帵偟偰偄傞丅
儂儖儉傾儖僨僸僪傗儂僗僎儞偺 C=O 寢崌偺暘嬌乮恾拞偺崟栴報乯偵偙傟傜偺暘嬌乮恾拞偺惵栴報乯傪懌偟崌傢偣傞偙偲偵傛傝暘巕慡懱偲偟偰偺憃嬌巕儌乕儊儞僩偑摼傜傟傞偑丄偙偺懌偟嶼偺寢壥丄儂儖儉傾儖僨僸僪偱偼寢崌偺暘嬌偳偆偟偑摨偠岦偒側偺偱丄暘巕偺憃嬌巕儌乕儊儞僩偑戝偒偔側傞曽岦偵婑梌偡傞偺偵懳偟丄儂僗僎儞偱偼寢崌偺暘嬌偳偆偟偑懪偪徚偟偁偭偰暘巕偺憃嬌巕儌乕儊儞僩偑彫偝偔側傞曽岦偵婑梌偡傞丅
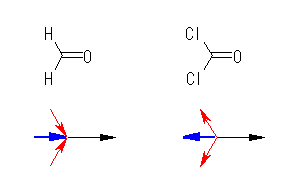
乮敪揥乯
側偍丄儂僗僎儞 Cl2C=O 偼丄擇巁壔扽慺傪悈偵梟夝偝偣偨帪偵惗偠傞乽扽巁乿(HO)2C=O 偺巁墫壔暔偵憡摉偡傞壔崌暔偱偁傞丅
2.30
憃嬌巕儌乕儊儞僩傪梌偊傞幃偼丄μ = 俻 亊 r 偱偁傞丅俻 偺抣偼丄偁傞寢崌偵偦偭偨俀偮偺尨巕偺揹婥堿惈搙偺嵎偑戝偒偗傟偽戝偒偄傎偳戝偒偔側傞偲梊憐偝傟丄100亾偺僀僆儞惈偲側偭偨帪偵嵟戝抣偲側傞丅
乮夝摎椺乯
憃嬌巕儌乕儊儞僩傪梌偊傞幃偼丄μ = 俻 亊 r 偱梌偊傜傟傞偐傜丄俻 偑摨偠偱傕丄r 偑彫偝偗傟偽丄憃嬌巕儌乕儊儞僩偼彫偝偔側傞丅僼僢慺偺曽偑墫慺偵斾傋偰尨巕敿宎偑彫偝偄偐傜丄C-Cl 寢崌傛傝傕 C-F 寢崌偺曽偑抁偄偼偢偱偁傞丅偙偺寢崌偺挿偝偑堎側傞偙偲偑塭嬁偟偰偄傞偲峫偊傞偙偲偑偱偒傞丅
栤偄 2.28 偱傕尒偨傛偆偵丄H-Cl 傕 100% 偺僀僆儞惈傪帩偮傢偗偱偼側偄偐傜丄僀僆儞惈偺妱崌乮亖暘嬌偺搙崌偄乯偑堎側傞偙偲傪棟桼偵嫇偘偨偔側傞偐傕偟傟側偄丅偟偐偟丄偦傟偼乽揹婥堿惈搙偺嵎偑戝偒偄傎偳傛傝嫮偔暘嬌偡傞乿偲偄偆尨懃偐傜偼偢傟偰偟傑偆丅幚嵺偵丄偙偺僀僆儞惈偺妱崌傪寁嶼偟偰傒傞偲丄埲壓偺傛偆偵側傞丅
尨巕敿宎偺僨乕僞乮乽尰戙壔妛偺婎慴乿妛弍恾彂弌斉幮丄p44傛傝丄扽慺 77 pm丄僼僢慺64 pm丄墫慺 99 pm 乯傪梡傞偲丄C-Cl 偺寢崌挿偼 176 pm丄C-F 偺寢崌挿偼 141 pm 偲側傞丅100亾偺僀僆儞惈偱偁傟偽丄憃嬌巕儌乕儊儞僩偼偦傟偧傟丄乮4.80 亊 1.76亖乯8.45 D丄乮4.80 亊 1.41亖乯6.77 D 偲側傞偼偢偱偁傞偐傜丄栤偄偵偁偨偊傜傟偨憃嬌巕儌乕儊儞僩偺幚應抣偑偡傋偰扽慺-僴儘僎儞寢崌偵桼棃偡傞偲壖掕偡傟偽丄僋儘儘儊僞儞 CH3Cl 偱偼乮1.87/8.45 亖乯22亾偺丄僼儖僆儘儊僞儞 CH3F 偱偼乮1.81/6.77 亖乯27亾偺僀僆儞惈傪帩偮偲偄偆寁嶼偵側傞丅偡側傢偪丄揹婥堿惈搙偺嵎偑戝偒偄傎偳暘嬌偺戝偒偝乮僀僆儞惈偺妱崌乯偑戝偒偔側傞偲偄偆梊憐偲柕弬偟偰偄側偄偙偲偑傢偐傞丅
2.31-2.40
2.31
嫵壢彂 p39 偺婰弎丄偍傛傃丄椺戣 2.1 傪嶲徠偡傞偙偲丅
乮夝摎椺乯
儊僞儞僠僆乕儖偺憃嬌巕儌乕儊儞僩偑寢崌偺暘嬌傛傝梊憐偝傟傞傛傝傕戝偒側抣傪帵偡偺偼丄庡偵棸墿忋偺屒棫揹巕懳偵桼棃偡傞丅
旕忢偵戝嶨攃偱偁傞偑丄彮偟偽偐傝掕検揑側峫嶡傪壛偊偰傒傛偆丅昞 2.1乮嫵壢彂 p39乯偵傛傟偽丄憃嬌巕儌乕儊儞僩偺戝偒偝偼丄悈偱 1.85 D丄僋儘儘儊僞儞偱 1.87 D丄儊僞僲乕儖偱 1.70 D丄儊僞儞僠僆乕儖偱 1.52 D 偱偁傞丅奺寢崌偺暘嬌偺戝偒偝偑恾 2.2 傛傝撉傒庢偭偨揹婥堿惈搙偺嵎乮壓恾拞丄愒怓偺彫偝側僼僅儞僩偺悢帤乯偵斾椺偡傞傕偺偲嬤帡偟偰丄奺寢崌偵桼棃偡傞暘嬌傪恾拞偵昤偒昞偡偙偲偵偡傞乮壓恾丄僺儞僋栴報乯丅傑偨丄惓巐柺懱偺儊僞儞 CH4 偵偍偄偰丄偦偺懳徧惈傛傝 C-H 寢崌偵桼棃偡傞暘嬌偑寢壥揑偵懪偪徚偝傟傞偙偲傪峫偊偰傒傞偲丄儊僠儖婎偺俁杮偺 C-H 寢崌偺暘嬌偺崌寁偲偟偰惗偠傞儀僋僩儖傪丄H-C 寢崌偵桼棃偡傞侾杮偺寢崌偺傕偮暘嬌偲摨偠戝偒偝偲偟偰嶌恾乮壓恾丄愒栴報乯傪偡傞偙偲偑偱偒傞丅
傕偟丄偙偙偱儊僞僲乕儖偍傛傃儊僞儞僠僆乕儖偺憃嬌巕儌乕儊儞僩偑丄庡偵偡傋偰尨巕娫偺寢崌偺暘嬌偵桼棃偡傞偲峫偊傞側傜偽丄壓恾傛傝撉傒庢傟傞傛偆偵丄儊僞儞僠僆乕儖偺憃嬌巕儌乕儊儞僩偼儊僞僲乕儖偵懳偟偰偍傛偦 1/3 掱搙偵側傞偲梊憐偝傟傞丅
偟偐偟丄乽悈暘巕偱偼 H-O 寢崌偑抁偄乮偡側傢偪丄μ = Q * r 偺幃偵偍偄偰丄r 偑彫偝偄乯偙偲傪峫偊偰傕側偍丄僋儘儘儊僞儞偲摨掱搙偺憃嬌巕儌乕儊儞僩傪帩偮乿偨傔偺愢柧偲偟偰丄俀慻偺屒棫揹巕懳偵桼棃偡傞暘嬌傪峫偊偨乮嫵壢彂 p39乯丅偙傟傪壓恾偱偼椢偺栴報偱昞帵偟偨丅摨條偵丄棸墿傕俀慻偺屒棫揹巕懳傪帩偮偐傜丄乮偦偺戝偒偝偼丄揹婥堿惈搙偺堎側傞巁慺忋偲棸墿忋偱摨偠岠壥傪傕偮偲偼尵偊側偄偑乯丄偙傟偵桼棃偡傞暘嬌乮壓恾丄椢偺栴報乯傪峫偊傞偙偲偑偱偒傞丅乮側偍丄摨條偵丄僴儘僎儞傕俁懳偺屒棫揹巕懳傪帩偭偰偄傞偺偩偐傜丄摨條偺岠壥偑偁傞傕偺偲偟偰峫偊傞偙偲偑偱偒傞丅乯
2.32
栤戣 2.7-2.9 丄嫵壢彂p42 偺 昞2.2 側偳傕嶲徠偺偙偲丅
1) 尨巕斣崋偐傜偦偺尨巕偑拞惈側傜壙揹巕偑偄偔偮偲側傞偐悢偊傛丅扽慺側傜係丄拏慺側傜俆丄巁慺側傜俇側偳丅傑偨丄廃婜昞忋偱摨偠懓偵懏偟偰偄傟偽丄偙偺悢帤偼摨偠偼偢偱偁傞丅
2) 旕嫟桳揹巕懳偼俀屄丄嫟桳寢崌偼僔僌儅寢崌偵偟傠僷僀寢崌偵偟傠偦傟偧傟侾屄丄傪偦偺尨巕偑桳偟偰偄傞傕偺偲悢偊傞丅
3) 忋偺侾乯偲俀乯偺嵎偑宍幃揹壸偱偁傞丅
乮忋婰偺愢柧偼丄嫵壢彂偺愢柧傪偐偒側偍偟偨偩偗偵偡偓側偄丅乯
奺尨巕偺宍幃揹壸偺榓偼丄拞惈偺暘巕偱偼侽偵側傞丅乮僀僆儞偱偼偦偺壙悢偵側傞丅乯
側偍丄(a) (CH3)2O-BF3 偼
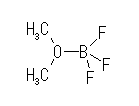 偺傛偆側寢崌弴偱偁傞丅
偺傛偆側寢崌弴偱偁傞丅
乮夝摎椺乯
宍幃揹壸偼丄僇僢僐撪偵帵偟偨丅寁嶼幃偼徣棯丅摨偠尨巕庬偑偁傞応崌偼嵍偐傜丅
(a) O(+1)丄B(-1)
(b) C(-1)丄N(+1)丄N(0)
(c) O(0)丄N(+1)丄N(-1)
(d) O(0)丄O(+1)丄O(-1)
(e) C(-1)丄P(+1)
(f) N(+1)丄O(-1)
奺帺偑摫弌偟偨摎偊偺悢抣偑偁偭偰偄傞偐妋擣偡傞偨傔偵悢抣偺傒嫇偘偰偄傑偡偑丄廻戣偺僲乕僩偵乽寁嶼幃偼徣棯乿偲彂偐傟偰偄傞偺偼丄晄壜偱偡丅摉慠丄奆偝傫偼強掕偺寁嶼傪偟偨偐傜摎偊偺悢抣偑僲乕僩偵彂偗傞傢偗偱偡偐傜丅
2.33
偲傕偵乮屳偄偵乯嫟柭宍偱偁傞偨傔偺忦審偲偼丄嫵壢彂p44乽婯懃俀乿偱梌偊傜傟傞傛偆偵丄π 揹巕偁傞偄偼旕寢崌揹巕乮 lone-pair 乯偺埵抲偩偗偑堎側傞傕偺偱偁傝丄擇廳寢崌偺埵抲偼堏摦偟偰傕峔傢側偄偑丄僔僌儅寢崌偺埵抲傗尨巕偺攝抲偑堎側偭偰偼偄偗側偄丅
乮夝摎椺乯
(a) 嫟柭宍偱偼側偄丅嵍偺峔憿幃拞偺係堳娐偺僔僌儅寢崌偑塃偺峔憿幃拞偱偼愗傟偰偄傞丅
(b) 嫟柭宍偱偁傞丅
(c) 嫟柭宍偱偁傞丅
(d) 嫟柭宍偱偁傞丅
摿偵丄(c) 偍傛傃 (d) 偵帄傞揹巕偺摦偒傪栴報偱恾帵偡傞偲丄師偺傛偆偵側傞丅
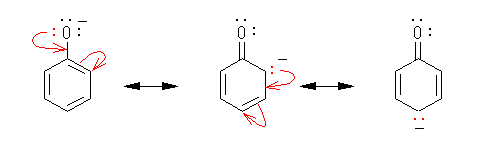
側偍丄師恾偺傛偆側揹巕偺摦偒偼丄寢壥偲偟偰摨偠傕偺傪梌偊偰偄傞偑丄惓偟偔側偄丅
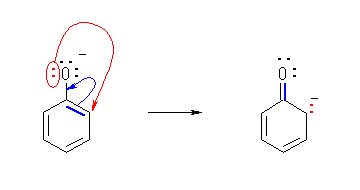
屒棫揹巕懳傗寢崌偺揹巕懳傪丄棧傟偨埵抲偵挼偽偟偰偼偄偗側偄丅乮忋恾偱偼丄愒偱彂偄偨栴報偑丄巁慺忋偺屒棫揹巕懳傪乮椬偱偼側偔乯侾偮抲偄偨棧傟偨扽慺偵傑偱挼偽偟偰偄傞丅乯乽屒棫揹巕懳偼丄屒棫揹巕懳偺傑傑懠偺尨巕偺忋偵堏摦偡傞乿偺偱偼側偔丄屒棫揹巕懳偼丄椬愙偡傞尨巕偲偺娫偺嫟桳寢崌乮π寢崌乯偵側傞丅傑偨丄π寢崌偵巊傢傟偰偄傞俀偮偺揹巕偑丄椬偺寢崌傪丄扨寢崌偐傜擇廳寢崌偵偡傞傛偆側宍偱堏偝傟傞偙偲偼偁傞偑丄偙偺俀偮偺揹巕偑乮寢崌偺椉抂偺偆偪偺堦曽偺乯傂偲偮偺尨巕忋偵抲偐傟丄怴偨偵屒棫揹巕懳偲側傞偙偲傕偁傞丅
乮敪揥乯
偲偙傠偱丄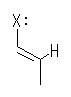 偺嫟柭偲偟偰昤偐傟偰偄傞
偺嫟柭偲偟偰昤偐傟偰偄傞 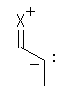 偺傛偆側峔憿偼丄屒棫揹巕懳傪傕偮扽慺偺宍幃揹壸偑
偺傛偆側峔憿偼丄屒棫揹巕懳傪傕偮扽慺偺宍幃揹壸偑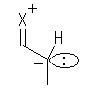 偺傛偆偵側傞偙偲偵傕拲堄偣傛丅
偺傛偆偵側傞偙偲偵傕拲堄偣傛丅
偙偺屻幰偺嫟柭峔憿偵偍偗傞屒棫揹巕懳偼丄偙偺嬌尷峔憿幃偺傒偵拲栚偟偰峫偊傞偲丄偙偺扽慺偺 sp3 崿惉婳摴偺偆偪偺堦偮偵擖偭偰偄傞偲峫偊傞偙偲偵側傞丅
偟偐偟丄傕偲傕偲 sp2 婳摴傪巊偭偰俁杮偺僔僌儅寢崌偑偁傝丄摨帪偵 p 婳摴傪巊偭偰僷僀寢崌乮擇廳寢崌乯偟偰偄偨偲峫偊傞偲丄嫟柭偱偼尨巕偺埵抲偑摦偐側偄偺偩偐傜丄扽慺偺崿惉忬懺偼 sp2 偺傑傑偱丄 p 婳摴偵揹巕偑堦偮傛偗偄偵擖偭偰旕寢崌惈偺揹巕懳偲側偭偰偄傞偲偄偆尒曽傕偱偒傞丅
傕偲傕偲嫟柭峔憿乮嬌尷峔憿乯偼丄嫵壢彂p44乽婯懃侾乿偵偁傞傛偆偵壖憐揑側峔憿偱偼偁傞偑丄幚嵺偺峔憿偼偙偺俀偮偺嫟柭峔憿偺拞娫偺宍偱偁傞偲偟偰棟夝偱偒傞偺偱偁傞偐傜丄偙偺傛偆側徻嵶側媍榑偵堄枴偑側偄傢偗偱偼側偄丅
傑偨丄偙傟傜偺嫟柭偺揹巕偺摦偒偑偁偒傜偐偵側傞傛偆偵丄娭學偡傞揹巕偺擖偭偰偄傞婳摴傪偁傜傢偵昤偔偲丄師偺傛偆偵側傞丅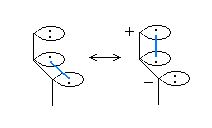
偙偺恾拞偺係偮偺揹巕偺埵抲乮俀偮偼屒棫揹巕懳偲側傝丄巆傝偺俀偮偼 π 寢崌偵娭梌偟偰偄傞丅乯偵拲堄偣傛丅
2.34
嫵壢彂pp44亅45 偺嫟柭宍偺婯懃偵偟偨偑偭偰昤偔丅
幚嵺丄嫟柭偼昤偄偰傒傞偲偄偔偮偐偺僷僞乕儞偟偐側偄偙偲偑傢偐傞丅廗偆傛傝姷傟傠偺悽奅偲偄偭偰偟傑偭偰傕椙偄偐傕偟傟側偄丅側偍丄嫟柭偵娭梌偡傞偺偼乮旕嫟桳揹巕傗 π 揹巕偟偐嫟柭偵娭梌偣偢丄σ 寢崌揹巕偼嫟柭偵娭梌偟側偄偺偩偐傜乯丄
1) 懡廳寢崌
2) 屒棫揹巕懳傪帩偮尨巕乮巁慺傗拏慺側偳乯
3) 僇儖儃傾僯僆儞 俠亅乮屒棫揹巕懳傪傕偮乯
4) 僇儖儃僇僠僆儞 俠亄乮嬻偺 p 婳摴傪傕偮乯
側偳偩偗偱偁傞丅
(a) 宍幃晧揹壸偼丄僇儖儃僯儖巁慺偺忋偵傕帩偭偰偙傜傟傞丅
(b) 宍幃晧揹壸偼丄梌偊傜傟偰偄傞埲奜偵俀偮偺扽慺忋偵傕帩偭偰偙傜傟傞丅
(c) 俁偮偺拏慺偲傕宍幃惓揹壸傪扴偆偙偲偑偱偒傞丅
(d) 棸墿偑宍幃惓揹壸傪帩偮嫟柭宍傪昤偔偙偲偑偱偒傞丅
(e) 宍幃惓揹壸偼丄梌偊傜傟偰偄傞埲奜偵俀偮偺扽慺忋偵傕帩偭偰偙傜傟傞丅
乮夝摎椺乯
揹巕偺棳傟傪昞偡栴報偼丄偡傋偰旕嫟桳揹巕懳傑偨偼懡廳寢崌偺π揹巕偐傜敪偟丄椬愙偡傞尨巕傗寢崌偵棳傟崬傓丅
(a) 
亊傪偮偗偰帵偟偨傛偆側丄俆杮偺寢崌傪傕偮僇儖儃僯儖扽慺偺傛偆偵丄偁傞尨巕偺壙揹巕偑俉傪墇偊偰偟傑偆傛偆側嫟柭峔憿偼懚嵼偟側偄丅乮嵍抂偺峔憿偐傜丄旕嫟桳揹巕懳偐傜敪偡傞傂偲偮偺栴報偵偦偭偰揹巕傪摦偐偟偨偩偗偱偼丄宍幃揑偵偙偺傛偆側峔憿偲側偭偰偟傑偆偨傔丄僇儖儃僯儖扽慺亖巁慺擇廳寢崌偺π揹巕偼丄揹婥堿惈搙偺戝偒偄巁慺忋偵旕嫟桳揹巕懳偲偟偰廂擺偝傟傞偙偲偵側傞丅乯
(b) 
側偍丄乽屒棫揹巕懳偑丄傂偲偮抲偄偰棧傟偨扽慺忋偵摦偔乿偺偱偼側偔丄椬偺扽慺偲偺娫偺π寢崌偵側傞偙偲偵拲堄丅恾偼丄2.33偺摎偊夝愢傪嶲徠偺偙偲丅
(c) 
(d) 
(e) 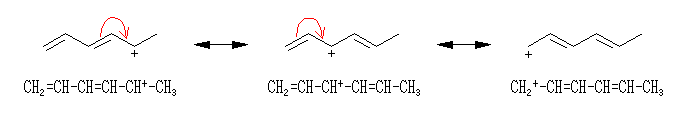
2.35
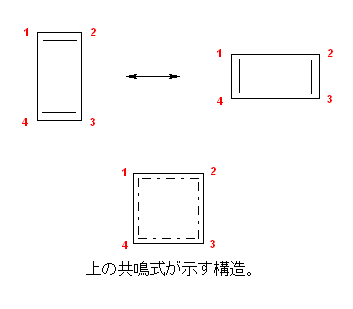
乽俀偮偺峔憿偑嫟柭宍偱偼側偄棟桼乿偲偼丄側偤僔僋儘僽僞僕僄儞偵偍偄偰扨寢崌偲擇廳寢崌偑屳偄偵嫟柭偟側偄偺偐偲偄偆偙偲偱偼側偔丄僔僋儘僽僞僕僄儞偑挿曽宍偺暘巕偱偁傞偲偄偆帠幚偵婎偯偄偨忋偱丄偦偺帠幚偐傜偙傟傜偺峔憿偑乽側偤嫟柭偱偁傞偲偼尒側偣側偄偺偐乿傪摎偊傟偽傛偄丅
僔僋儘僽僞僕僄儞偺暘巕柾宆傪帵偟偨丅乮僋儕僢僋偱俁師尦昞帵乯
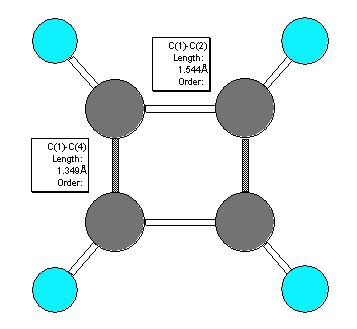
乮夝摎椺乯
傕偟偙偺俀偮偺峔憿偑嫟柭偱偁傞側傜偽丄p44 乽婯懃俀乿傛傝丄尨巕偺埵抲偼摨偠偼偢偱偁傞丅傑偨丄乽婯懃侾乿傛傝幚嵼偺峔憿偼俀偮偺壖憐揑側嫟柭宍偺拞娫偺峔憿傪帩偮偼偢偱偁傞丅擇廳寢崌偺埵抲偑偙偲側傞嫟柭峔憿偱昤偐傟傞儀儞僛儞偺傛偆偵丄幚嵺偵偼扨寢崌偲擇廳寢崌偺挿偝偵嬫暿偑側偔乮尵偭偰傒傟偽侾丏俆廳寢崌偺傛偆偵乯扨寢崌偲擇廳寢崌偺拞娫偺嫍棧傪傕偭偨寢崌偑暲傫偱偄傞偙偲偵側傞偼偢偱偁傞丅
偡側傢偪丄偙偺傛偆側嫟柭偱昞偝傟傞側傜偽僔僋儘僽僞僕僄儞偼惓曽宍偺暘巕偱側偗傟偽側傜側偄丅偟偐偟丄幚嵺偼栤戣暥偱梌偊傜傟偰偄傞傛偆偵挿曽宍偺暘巕偱偁傝丄嫟柭偱昞偝傟傞偲偄偆壖掕偵堦抳偟側偄丅
2.36
弶傔偰傒傞斀墳偱屗榝偆偐傕偟傟側偄偑丄乽巁亅墫婎斀墳乿偲巜掕偝傟偰偄傞偺偩偐傜丄H+乮僾儘僩儞乯偺傗傝偲傝偩偗傪峫偊傟偽傛偄丅
側偍丄揹婥堿惈搙偺悢抣偐傜敾抐偱偒傞傛偆偵丄儊僞僲乕儖拞偺 C-O 寢崌偼丄嬌惈偺嫟桳寢崌偱偁偭偰丄僀僆儞寢崌偱偼側偄丅偦偺偨傔丄師偺傛偆側斀墳偼峫偊側偄丅
乮亊乯 CH3-OH 仺 CH3+ + OH-
悈巁壔僫僩儕僂儉偱偼丄Na 偲 OH 偺娫偼丄僀僆儞寢崌偱偁傞丅
乮仜乯NaOH 仺 Na+ + OH-
憡庤偑嫮偄巁側傜丄儊僞僲乕儖偼墫婎偲偟偰偼偨傜偒丄僾儘僩儞傪庴偗庢傞丅偙傟偼丄傾儖僐乕儖巁慺偑屒棫揹巕懳傪帩偭偰偄傞偐傜偱偁傞丅
憡庤偑嫮偄墫婎側傜丄儊僞僲乕儖偼巁偲偟偰偼偨傜偒丄僾儘僩儞傪嫙梌偡傞丅偙傟偼揹婥堿惈搙偺崅偄巁慺尨巕偵寢崌偟偨悈慺傪帩偮偐傜偱偁傞丅
乮夝摎椺乯
(a) CH3OH + HCl 仺 CH3OH2+ + Cl-
(b) CH3OH + NaNH2 仺 CH3ONa + NH3
忋偺俀偮偺斀墳偼丄娭梌偟側偄僀僆儞傪彍偄偰師偺傛偆偵彂偔偲傢偐傝傗偡偄偐傕偟傟側偄丅乮巁偲偟偰偼偨傜偄偰曻弌偝傟偨僾儘僩儞傪壓慄晅偒偱昞偟偨丅乯
(a') CH3OH + H+ 仺 CH3OH2+
(b') CH3OH + NH2- 仺 CH3O- + NH3
2.37
斾妑揑嫮偄巁偱偁傞偲偄偆偙偲偼丄偡側傢偪僾儘僩儞傪梌偊堈偄偲偄偆偙偲偱偁傝丄僾儘僩儞傪梌偊偨屻偵惗偠傞嫟栶墫婎偺峔憿偑埨掕偱偁傞乮嫟栶墫婎偑僾儘僩儞傪庴偗庢傝偵偔偄丄嫟栶墫婎偑斾妑揑庛偄墫婎偱偁傞乯偲偄偆偙偲偱偁傞丅
側傜偽丄墫婎偑埨掕側峔憿偱偁傞乮庛偄墫婎偱偁傞乯偙偲傪帵偣偽丄偦偺嫟栶巁偑嫮偄偙偲傪愢柧偱偒傞丅
恷巁偺嫟栶墫婎乮恷巁僀僆儞丄傾僙僥乕僩僀僆儞乯 CH3CO2亅 偑埨掕側棟桼傪峫偊傟偽傛偄丅
乮夝摎椺乯
恷巁偺嫟栶墫婎偱偁傞僀僆儞 CH3CO2亅 偼丄師偵帵偡傛偆側嫟柭偵傛傝埨掕偱偁傞丅傛傝埨掕偱偁傞偲偄偆偙偲偼丄僾儘僩儞傪憡懳揑偵庴偗庢傜側偄偺偩偐傜丄墫婎偲偟偰庛偄丅嫟栶墫婎偑庛墫婎偱偁傞偲偄偆偙偲偼丄傕偲偺巁偑嫮巁偱偁傞偙偲傪帵偡丅
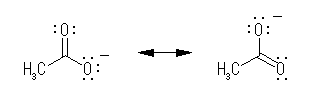
仸 乮恷巁僀僆儞偱偼側偔乯恷巁偵懳偟偰偼嫟柭幃偼偐偗側偄丅傕偟彂偗偨偲偟偰傕丄偦傟偑恷巁偺巁惈搙偺愢柧偵偼側傜側偄丅
乮敪揥乯
忋婰偺夝摎埲奜偵乮栤戣暥偺乽嫟柭傪梡偄偰乿偲偄偆忦審偵偼崌抳偟側偄偑乯丄乽扽慺偵偔傜傋偰巁慺偺曽偑揹婥堿惈搙偑崅偄偺偱丄巁慺偵寢崌偟偨悈慺偼丄扽慺偵寢崌偟偨悈慺傛傝巁惈偱偁傞乿偲弎傋傞偙偲偑偱偒傞丅偙偺偙偲偼丄傾儖僇儞偵偔傜傋偰傾儖僐乕儖偺曽偑斾妑揑嫮偄巁偱偁傞偙偲傪愢柧偡傞丅偟偐偟丄傾儖僐乕儖偵斾妑偟偰傕僇儖儃儞巁偼偢偭偲嫮偄巁偱偁傞偙偲傪帵偡偵偼丄忋婰偺夝摎椺偺傛偆側愢柧偑昁梫偱偁傞丅
2.38
偙偺栤戣傪夝偔偵偁偨傝丄愭偵栤偄 2.39 偵廬偄丄偙傟傜偺暘巕偺揰揹巕峔憿傪昤偄偰傒傞偙偲丅
庬乆偺儖僀僗巁丗嫵壢彂 p56 傑傫拞偁偨傝丅偨偩偟丄僾儘僩儞偦偺傕偺偼儖僀僗巁偱偁傞偑丄乽拞惈偺僾儘僩儞嫙梌懱乿偼尩枾偵偼儖僀僗巁偱偼側偄丅
庬乆偺儖僀僗墫婎丗嫵壢彂 p57 傑傫拞傛傝彮偟壓丅屒棫揹巕懳傪帩偮傕偺丅偨偩偟丄屒棫揹巕懳傪帩偭偰偄偰傕丄梲僀僆儞傗丄拞惈偱傕僴儘僎儞偺屒棫揹巕側偳偼僇僂儞僩偟側偄応崌偑懡偄丅偙傟偼丄偨偲偊偽 H3O亄 偑傕偆堦偮偺僾儘僩儞傪庴偗庢偭偰 H4O2亄 偲側傞傛偆側斀墳偼乮儖僀僗峔憿偲偟偰昤偔偙偲偼壜擻偱偁傞偑乯旕忢偵婲偙傝偵偔偄偐傜偱偁傝丄尵偭偰傒傟偽H3O亄 偼憡懳揑偵儖僀僗墫婎偲偟偰旕忢偵庛偄偲尒側偣傞偐傜偱偁傞丅
乮夝摎椺乯
(a) AlBr3 : Lewis 巁
(b) CH3CH2NH2 : Lewis 墫婎 丗N 偑旕嫟桳揹巕懳傪帩偮丅
(c) BH3 : Lewis 巁
(d) HF : 僾儘僩儞嫙梌懱偱偁傞偐傜 Brønsted 巁偱偁傞偑丄嫹媊偺 Lewis 巁偱偼側偄丅傕偪傠傫丄Lewis 墫婎偱傕側偄丅
(e) CH3SCH3 : Lewis 墫婎 丗S 偑旕嫟桳揹巕懳傪帩偮丅
(f) TiCl4 : Lewis 巁
2.39
夵傔偰僸儞僩偼梌偊側偄偑丄壙揹巕偺奣擮傪巚偄弌偡偙偲丅傑偨丄2.41 傪夝偔偵偁偨傝丄偳偙偵屒棫揹巕懳偑偁傝丄偳偺尨巕偑僆僋僥僢僩傪枮偨偝偢揹巕懳傪庴偗庢傝傗偡偔側偭偰偄傞偺偐丄偲偄偆揰傪暪偣偰峫偊傞昁梫偑偁傞丅
乮夝摎椺乯
(a) 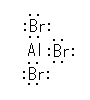
(b) 
(c) 
(d) 
(e) 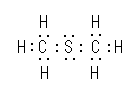
(f) 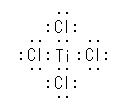
2.40
偄偢傟偐堦曽偑僾儘僩儞傪憡庤偵懳偟偰搉偟丄傕偆堦曽偑庴偗庢傞丄偲偄偆峔恾偑乽巁亅墫婎斀墳乿偱偁傞丅偡側傢偪丄
HA1 亄 HA2 仼仺 H2A1亄 亄 A2亅
HA1 亄 HA2 仼仺 A1亅 亄 H2A2亄
偺俀偮偺僷僞乕儞偑峫偊傜傟傞丅偲偼偄偊幚嵺偵婲偒傞偺偼丄傛傝嫮偄巁偑僾儘僩儞傪曻弌偟丄傛傝嫮偄墫婎偑僾儘僩儞傪偆偗偲傞応崌偱偁傞丅
(a) 儊僞僲乕儖偲棸巁偱偼丄棸巁偺曽偑嫮偄巁偱偁傞偐傜丄偙偺幃偱偼儊僞僲乕儖偑墫婎偲偟偰摥偒丄僾儘僩儞傪庴偗庢傞丅
(b) NaNH2 偼丄傾儈僪僀僆儞乮 NH2亅 乯偲偟偰峫偊傞丅乮傾儈僪僀僆儞乮 NH2亅 乯偼丄傾儞儌僯傾偺嫟栶墫婎偱偁傞丅乯儊僞僲乕儖偲傾儈僪僀僆儞偱偼儊僞僲乕儖偺傎偆偑巁偲偟偰嫮偄丅乮儊僞僲乕儖偑巁偲偟偰偼偨傜偔偲偒偼丄CH3O亅傪惗偠傞丅堦曽丄傕偟傾儈僪僀僆儞偑巁偲偟偰偼偨傜偔偲壖掕偡傞偲丄僾儘僩儞傪幐偄 NH2亅 偲俀壙偺傾僯僆儞偵側傞偙偲偵側傝丄偐側傝惗偠偵偔偄丅乯
傑偨丄墫婎偺嫮偝偼嫟栶巁偺庛偝偱敾抐偱偒傞丅儊僞僲乕儖偺嫟栶巁偑 CH3OH2亄 偱偁傞偺偵懳偟偰丄傾儈僪僀僆儞偺嫟栶巁偺 NH3 偼丄拞惈暘巕偱埨掕乮傛傝僾儘僩儞傪曻弌偟偵偔偄亖憡懳揑偵巁偲偟偰庛偄乯偱偁傞丅偙傟傪峫偊傞偲丄儊僞僲乕儖傛傝傕傾儈僪僀僆儞偺曽偑嫮墫婎偱偁傞丅
(c) CH3NH3亄Cl亅 偼丄儊僠儖傾儞儌僯僂儉僀僆儞乮 CH3NH3亄 乯偲偟偰峫偊傞丅偙傟偼丄儊僠儖傾儈儞乮 CH3NH2 乯偺嫟栶巁偱偁傞丅
悈巁壔僫僩儕僂儉乮 NaOH 乯偼丄悈巁壔暔僀僆儞乮 OH亅 乯偲偟偰峫偊傞丅乮 悈巁壔暔僀僆儞偼丄悈偺嫟栶墫婎偱偁傞丅乯儊僠儖傾儞儌僯僂儉僀僆儞偲悈巁壔暔僀僆儞傪斾妑偡傞偲丄儊僠儖傾儞儌僯僂儉僀僆儞偺傎偆偑巁偲偟偰嫮偄丅乮傕偟丄悈巁壔暔僀僆儞偑巁偲偟偰偼偨傜偔偲壖掕偡傞偲丄僾儘僩儞傪幐偄 O2亅 偲側傞偙偲偵側傞丅乯
乮夝摎椺乯
巁偼愒偱帵偟偨丅
(a) CH3OH + H2SO4丂仺 CH3OH2+ + HSO4-
(b) CH3OH + NaNH2 仺 CH3ONa + NH3
(c) CH3NH3+Cl- + NaOH 仺 CH3NH2 + H2O + NaCl
側偍丄(b),(c) 偺斀墳幃傪丄斀墳偵娭梌偟側偄僀僆儞乮 H+ 偺傗傝偲傝偵娭梌偟側偄僀僆儞丅偙偙偱偼丄 Na
(b') CH3OH + NH2- 仺 CH3O- + NH3
(c') CH3NH3+ + OH- 仺 CH3NH2 + H2O
傑偨丄乽乮岆乯巁-墫婎斀墳偱偼乮偄偮傕拞榓斀墳偑恑峴偟偰乯悈傪惗偠傞乿偲岆夝偟偰偄傞偲丄(a) 偵娭偡傞岆摎偲偟偰丄
(d) NaOH + H2SO4丂仺 NaHSO4 + H2O
偺椶悇偐傜丄
(a") CH3OH + H2SO4丂仺 CH3HSO4 + H2O
偲彂偒偨偔側傞傜偟偄丅
2.36 偺僸儞僩偵傕彂偄偨偲偍傝丄CH3OH 偑墫婎偲偟偰偼偨傜偔偲偒偵偼丄傾儗僯僂僗偺掕媊偺墫婎偲偟偰偼偨傜偄偰 OH- 傪弌偡偺偱偼側偔丄Brønsted 墫婎偲偟偰偼偨傜偄偰 H+ 傪庴偗庢傞偩偗偱偁傞丅偙傟偼丄悈巁壔僫僩儕僂儉偑 Na+ 偲 OH- 偵夝棧偡傞偙偲偑梕堈偱偁傞偺偲偼堎側傝丄
(亊) CH3OH 仺 CH3+ + OH-
偺傛偆偵偼夝棧偟側偄偨傔偱偁傞丅偙偺傛偆側夝棧偑婲偙傜側偄棟桼偺堦偮偼丄僫僩儕僂儉傗扽慺偺僀僆儞壔僄僱儖僊乕傗丄偁傞偄偼揹婥堿惈搙偐傜傕悇應偱偒傞偲偍傝丄 扽慺傛傝僫僩儕僂儉偺曽偑梲僀僆儞偵側傝傗偡偄丄偡側傢偪丄Na+ 偵斾傋傞偲 CH3+ 偑埨掕偱偼側偄偐傜偱偁傞丅
側偍丄屻擔妛廗偡傞偙偲偵側傞偱偁傠偆撪梕偱偼偁傞偑丄摨偠傛偆偵傾儖僐乕儖偱偁偭偰傕俁媺偺傾儖僐乕儖偺応崌偼丄
R3C-OH + H+ 仺 R3C-OH2+
R3C-OH2+ 仺 R3C+ + OH2
偺俀抜奒偱悈傪扙棧偡傞偙偲偑壜擻偱偁傞丅偙傟偼丄侾媺偺僇儖儃僇僠僆儞偱偁傞 CH3+ 偵偔傜傋偰丄俁媺偺僇儖儃僇僠僆儞偱偁傞 CR3+ 偺曽偑傛傝埨掕偱偁傞偨傔偱偁傞丅偨偩偟丄偦偺応崌偱傕
(亊) CR3OH 仺 CR3+ + OH-
偺傛偆側斀墳偼惗偠側偄丅揹婥揑偵拞惈偱偁傞悈 H2O 偱偁傟偽扙棧偑壜擻偱偁傞偺偵懳偟丄悈巁壔暔僀僆儞 OH- 偑偦偺傑傑偱扙棧偡傞偙偲偑偱偒側偄偺偼丄忋偺媍榑偲摨條偵丄乽 H2O 偺曽偑 OH- 傛傝埨掕偱偁傞偐傜偱偁傞乿偲尵偭偰傛偄丅偙傟偵偮偄偰偼丄 H2O 偼丄H3O+ 偺嫟栶墫婎偱偁傝丄傑偨丄OH- 偼 H2O 偺嫟栶墫婎偱偁傞偙偲傪峫偊傞偲丄傛傝嫮偄巁偱偁傞 H3O+ 偺嫟栶墫婎 H2O 曽偑傛傝埨掕偱偁傞乮墫婎惈偑掅偄乯偙偲傪梕堈偵悇應偱偒傞偼偢偱偁傞丅
2.41-2.50
2.41
栤戣 2.7-2.9 丄2.32 丄嫵壢彂p42 偺 昞2.2 側偳傕嶲徠偺偙偲丅
乮夝摎椺乯
偙偺栤偄偱偼丄扽慺偲悈慺偵娭偟偰偼偡傋偰宍幃揹壸侽偱偁傞丅偦偺懠偺晹暘偼丄
(a) N(+1)丄O(-1)
(b) N(-1)丄N(+1)丄N(0)
(c) N(0)丄N(+1)丄N(-1)
側偍丄(b) 偲 (c) 偼屳偄偵嫟柭宍偱偁傞懳偱偁傞丅
2.42
栤偄 2.22 側偳傪嶲徠偡傞偙偲丅1,2-僕僋儘儘僄僥儞偺墫慺尨巕偺戙傢傝偵僇儖儃僉僔婎 -CO2H 偲偟偨傕偺偑丄儅儗僀儞巁偍傛傃僼儅儖巁偱偁傞丅
傑偢惍棟偺偨傔偵僇儖儃僉僔婎偑尨巕抍乮抲姺婎乯偲偟偰帵偡暘嬌偵偮偄偰峫偊丄師偄偱丄偦偺岠壥偑丄1,2-僕僋儘儘僄僥儞偺偲偒偲摨條偵僄僥儞偵寢崌偟偨応崌偵丄暘巕慡懱偲偟偰偳偺傛偆偵摥偔偺偐傪尒傟偽傛偄丅
僇儖儃僉僔婎偺岠壥偵偮偄偰偼丄偨偲偊偽恷巁 (CH3CO2H) 偵偮偄偰尒偰傒傟偽傛偄丅昞 2.1乮嫵壢彂 p39乯偵偼丄恷巁偺憃嬌巕儌乕儊儞僩偺戝偒偝偑帵偝傟偰偄傞丅傑偨丄恷巁偺憃嬌巕儌乕儊儞僩偺曽岦傪抦傞偨傔偵偼丄嫵壢彂 p53 偵丄偦偺惷揹億僥儞僔儍儖儅僢僾偑宖嵹偝傟偰偄傞丅
乮夝摎椺乯
昞 2.1乮嫵壢彂 p39乯傛傝丄扽慺偵寢崌偟偨僇儖儃僉僔婎偼丄 1.7 D 憡摍偺暘嬌傪帵偡丅傑偨丄僇儖儃僉僔婎偼扨寢崌偱寢崌乮壓恾丄椢偱昞帵乯偟偰偄傞偐傜帺桼偵夞揮偡傞偙偲偑偱偒傞偨傔丄偦偺僇儖儃僉僔婎偑帩偮晹暘峔憿乮僇儖儃僯儖婎 C=O 傗丄悈巁婎 亅OH 側偳乯偵桼棃偡傞傛偆側暘嬌偼丄寢嬊偺偲偙傠暯嬒壔偝傟偰偟傑偆偨傔丄僇儖儃僉僔婎偑帵偡暘嬌偺曽岦偼丄扨弮偵師恾偵帵偡傛偆偵乮椢偱昞帵偟偨乯寢崌偺曽岦偱峫偊偰傛偄丅乮側傫傜偐偺棟桼偵傛傝丄僇儖儃僉僔婎偺帺桼夞揮偑婲偒側偄傛偆側宯偱偁傞応崌偵偼丄偙偺峫偊曽偑惓偟偔側偄偐傕偟傟側偄丅乮拹乯乯
師恾偺傛偆偵丄偙偺暘嬌偺儀僋僩儖傪丄愒偺栴報偱昞偡偲丄暘巕慡懱偺憃嬌巕儌乕儊儞僩偼偦偺榓偲側傝丄惵偺栴報偲側傞丅
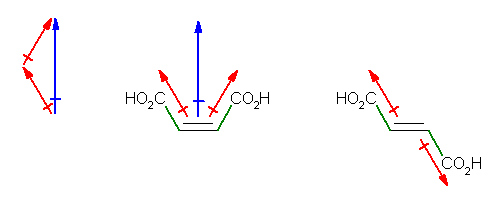
偡側傢偪丄cis-but-2-enedioic acid 乮姷梡柤丗儅儗僀儞巁乯偱偼丄摨偠曽岦偵寢崌偟偨僇儖儃僉僔婎偵桼棃偡傞暘嬌偺榓偲偟偰丄憃嬌巕儌乕儊儞僩偑惗偠傞偑丄trans-but-2-enedioic acid 乮姷梡柤丗僼儅儖巁乯偱偼丄媡岦偒偺暘嬌偑懪偪徚偟崌偆偨傔偵憃嬌巕儌乕儊儞僩偼惗偠側偄丅
乮拹乯俀偮偺僇儖儃僉僔婎偑摨曽岦偵寢崌偟偰偄傞儅儗僀儞巁偱偼丄偦偺俀偮偺僇儖儃僉僔婎偑悈慺寢崌偟偰帺桼夞揮偑惂尷偝傟傞偲梊憐偝傟傞丅偟偐偟丄忋偺媍榑乮僼儅儖巁偵偍偄偰丄暘嬌偑懪偪徚偝傟偰憃嬌巕儌乕儊儞僩傪帵偝側偄乯偵偍偄偰丄崪巕偼曄傢傜側偄丅
2.43
栤戣 2.12 偺僸儞僩嵞宖丅
HA 仼仺 H亄 亄 A亅 偺暯峵斀墳偵偮偄偰丄巁惈搙掕悢偼
| Ka = | [ H亄] | [ A亅] |
| [ HA ] | ||
偲昞偝傟丄Ka偺抣偑戝偒偄傎偳巁偑夝棧懁乮忋幃塃懁乯偵暯峵偑偢傟偰偄傞乮僾儘僩儞傪曻弌偟偰偄傞乯偨傔丄嫮偄巁偱偁傞丅
pKa = 亅log( Ka ) 偱偁傞偐傜丄pKa 偺抣偑彫偝偄傎偳丄Ka 偼傛傝戝偒側抣偲側傞丅
乮夝摎椺乯
pKa 偺抣偑彫偝偄傎偳丄巁偲偟偰嫮偄丅
傾僙僩儞(pKa=19.3) 亙 僼僃僲乕儖(pKa=9.9) 亙 2,4-儁儞僞儞僕僆儞(pKa=9.0) 亙 恷巁(pKa=4.75)
2.44
NaOH 偼丄悈巁壔暔僀僆儞偲偟偰峫偊傞偲丄悈偺嫟栶墫婎偱偁傞丅堦斒偵丄
HA 亄 OH亅 仼仺 A亅 亄 H2O
偲偄偆暯峵斀墳偼丄嫮偄巁偼僾儘僩儞傪曻弌偟嫟栶墫婎偲側傝丄嫮偄墫婎偼僾儘僩儞傪偆偗偲傝嫟栶巁偵側傞偺偱丄傛傝庛偄巁傗墫婎偑梀棧偡傞曽岦偵恑峴偡傞丅偙偺斀墳偑塃傊恑峴偡傞偨傔偵偼丄嵍曈偺巁乮 HA 乯傛傝傕塃曈偺乮 OH亅 偺嫟栶巁偱偁傞乯巁乮 H2O 乯偺曽偑庛偄巁偱偁傞昁梫偑偁傞丅
乮夝摎椺乯
悈巁壔暔僀僆儞 OH-偺嫟栶巁偱偁傞悈(pKa=15.74)傛傝傕 pKa 偺彫偝側乮傛傝嫮偄乯巁偼丄悈巁壔暔僀僆儞偲斀墳偡傞丅偟偨偑偭偰丄僼僃僲乕儖(pKa=9.9) 丄2,4-儁儞僞儞僕僆儞(pKa=9.0)丄恷巁(pKa=4.75) 偺俁庬椶偼丄悈巁壔僫僩儕僂儉偲乮傎傏乯姰慡偵斀墳偡傞丅
偙偙偱乽傎傏姰慡偵斀墳偡傞乿偲偄偆尵梩偺堄枴偵偮偄偰偼丄壓偺乮敪揥乯偺崁傪撉傓偙偲丅
乮敪揥乯
HA 亄 OH亅 仼仺 A亅 亄 H2O
偲偄偆暯峵偺丄暯峵掕悢 K 偼丄師幃偱梌偊傜傟傞丅
| K = | [ A亅 ] | [ H2O ] | = | [ H亄] | [ A亅] | 亊 | [ H2O ] | = | Ka(HA) | |
| [ HA ] | [ OH亅] | [ HA ] | [ H亄] | [ OH亅] | Ka(H2O) | |||||
偟偨偑偭偰丄K 偺抣偑100埲忋乮偡側傢偪丄暯峵掕悢偺拞偺暘曣偵懳偟偰暘巕偺抣偑100攞埲忋乯偱偁傞偲偒偵偙偺暯峵偑乽姰慡偵乿塃傊恑峴偟偨偲傒側偣傞側傜偽丄偦偺偨傔偵偼丄斾妑偡傞巁偲悈偺巁夝棧棧掕悢 Ka 偑 100攞埲忋偺嵎偑偁傞偙偲丄偡側傢偪 pKa 偺抣偑俀埲忋堘偆偙偲偑昁梫忦審偱偁傞丅
偙偺偲偒丄拲栚偟偰偄傞巁偲悈偑摨掱搙懚嵼偡傞傕偺偲偟偰乮偡側傢偪
乮敪揥 偦偺俀乯
僼僃僲乕儖乮 pKa亖9.9 乯傪丄pH 偺堎側傞悈偵梟偐偡偙偲傪峫偊傞丅
PhOH 仼仺 PhO亅 亄 H亄
| Ka = | [ PhO亅] | [ H亄] | = 10亅9.9 |
| [ PhOH ] | |||
1) 悈偵梟偐偟偰 pH 亖 9.9 偺梟塼偲偡傞偲偒丅
[ H亄 ] 亖 10亅9.9 傛傝丄
| [ PhO亅] | = | Ka | = 1 |
| [ PhOH ] | [ H亄 ] |
偲側傝丄 [ PhOH ] 亖 [ PhO亅] 丄偡側傢偪挌搙敿検偺僼僃僲乕儖偑巁偲偟偰夝棧偟丄墫偲側偭偰偄傞丅
2) 悈偵梟偐偟偰 pH 亖 7.9 偺梟塼偲偡傞偲偒丅
[ H亄 ] 亖 10亅7.9 傛傝丄
| [ PhO亅] | = | Ka | = 10亅2 |
| [ PhOH ] | [ H亄 ] |
偲側傝丄 栺侾亾偺僼僃僲乕儖偑巁偲偟偰夝棧偟丄墫偲側偭偰偄傞丅乮傎偲傫偳偡傋偰偺僼僃僲乕儖偼夝棧偟偰偄側偄丅乯
3) 悈偵梟偐偟偰 pH 亖 11.9 偺梟塼偲偡傞偲偒丅
[ H亄 ] 亖 10亅11.9 傛傝丄
| [ PhO亅] | = | Ka | = 102 |
| [ PhOH ] | [ H亄 ] |
偲側傝丄 栺侾亾偺僼僃僲乕儖偑巁偲偟偰夝棧偣偢巆偭偰偄傞丅乮傎偲傫偳偡傋偰偺僼僃僲乕儖偑夝棧偟偰丄墫偵側偭偰偄傞丅乯
偡側傢偪丄偁傞巁傪傾儖僇儕悈梟塼偵梟偐偟偰俋俋亾埲忋夝棧偝偣傞乮拞榓偟偰墫偺宍偵偝偣傞乯偨傔偵偼丄偦偺巁偺 pKa 傛傝傕俀埲忋戝偒側 pH 偺悈梟塼偲偡傞昁梫偑偁傞丅偙偙偱栤戣偵偟偰偄傞偺偼丄巁傪梟偐偡慜偺梟塼偺 pH 偱偼側偔丄梟偐偟偨屻偺 pH 偱偁傞偙偲偵拲堄偡傞偙偲丅偨偩偟丄戝検偺傾儖僇儕悈梟塼傪梡偄偨応崌偼丄巁傪梟偐偡慜偲梟偐偟偨屻偱 pH 偼傎偲傫偳曄壔偟側偄偲峫偊偰椙偄丅
2.45
傾儞儌僯傾丄傾儈儞丄悈丄傾儖僐乕儖側偳偼丄巁偲偟偰傕墫婎偲偟偰傕偼偨傜偔偙偲偑偱偒傞暘巕偱偁傞偐傜丄崿棎偟側偄傛偆偵惍棟偟偰峫偊傞偙偲丅
傾儈儞 RNH2 偺俀慻偺巁-墫婎暯峵偺斀墳幃傪帵偟偰偍偔丅
偙偙偱丄嘆偺暯峵偵偮偄偰峫偊傞偲偒偼嘆偺椉抂偺暔幙 RNH-偲RNH2偩偗偵偮偄偰峫偊丄嘇偺暯峵偵偮偄偰峫偊傞偲偒偼嘇偺椉抂偺暔幙 RNH2偲RNH3+偩偗偵偮偄偰峫偊傞昁梫偑偁傞偙偲偵拲堄丅
側偍丄栤戣 2.13 傪傕偆堦搙嶲徠偡傞偙偲丅
傛傝庛偄巁偺嫟栶墫婎偺曽偑丄墫婎偲偟偰嫮偄丅
巁偑傛傝庛偄
伀 仾
巁偼丄僾儘僩儞傪曻弌偟偵偔偄
伀 仾
嫟栶墫婎偼丄僾儘僩儞傪庴偗庢傝傗偡偄
伀 仾
嫟栶墫婎偼丄傛傝嫮偄
仜 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄偦偺嫟栶墫婎乮A亅 偑乯墫婎偲偟偰嫮偄乿
亊 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄乮AH 偑乯墫婎偲偟偰嫮偄乿
屻幰偺昞尰偑亊偱偁傞棟桼丂丗丂AH 傪丄忋偱帵偟偨 RNH2 偲撉傒懼偊偨偲偒丄乽AH 偑巁偲偟偰庛偄乿偲偼嘆偺暯峵偺偙偲傪尵偭偰偍傝丄乽AH 偑墫婎偲偟偰嫮偄乿偲偼嘇偺暯峵偺偙偲傪尵偭偰偄傞丅偙偺俀偮偼傑偭偨偔撈棫偺帠徾偱偁傞偐傜丄堦斒揑側場壥娭學偼帵偡偙偲偑偱偒側偄偺偱丄亊偱偁傞丅
乮夝摎椺乯
傾儞儌僯傾乮NH3乯偼丄傾儞儌僯僂儉僀僆儞乮NH4+乯偺嫟栶墫婎丄
儊僠儖傾儈儞乮CH3NH2乯偼丄儊僠儖傾儞儌僯僂儉僀僆儞乮CH3NH3+乯偺嫟栶墫婎偱偁傞丅
儊僠儖傾儞儌僯僂儉僀僆儞偼憡懳揑偵庛偄巁偱偁傞偐傜丄偦偺嫟栶墫婎偱偁傞儊僠儖傾儈儞偼丄傾儞儌僯傾傛傝嫮偄墫婎偱偁傞丅
亊 乽pKa 偑傛傝戝偒偄傎偆偑嫮墫婎偱偁傞乿
仺 Ka 傗 pKa 偼丄偁偔傑偱傕巁偺嫮偝傪婯掕偡傞偺傒偱丄墫婎偲偟偰偺嫮偝偼慡偔暿傕偺偱偁傞丅乮憡娭偑偁傞応崌傕偁傞偑丄巁偺嫮偝丄墫婎偺嫮偝偼丄撈棫偺僷儔儊乕僞偱偁傝丄巁偲偟偰庛偔乮偨傑偨傑乯墫婎偲偟偰偼嫮偄働乕僗傕偁傟偽丄巁偲偟偰庛偔摨帪偵墫婎偲偟偰傕庛偄働乕僗傕偁傞丅偨偲偊偽丄儊僞儞 CH4 偼 傾儞儌僯傾 NH3 傛傝傕庛偄巁偱偁傞偑丄儊僞儞偼傾儞儌僯傾傛傝傕墫婎偲偟偰傕庛偄丅乯
亊 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄乮AH 偑乯墫婎偲偟偰嫮偄乿
亊 乽儊僠儖傾儈儞偺曽偑 pKa 偑戝偒偔庛巁偱偁傞偐傜丄儊僠儖傾儈儞偼墫婎偲偟偰嫮偄乿
仺 pKa 偺戝偒偄傎偆偑庛巁偱偁傞偲偄偆偲偙傠傑偱偼崌偭偰偄傞偑丄偦偺偙偲偵傛偭偰墫婎偲偟偰偺嫮偝傪媍榑偡傞偙偲偼偱偒側偄丅偨偲偊偽丄悈偑巁偲偟偰摥偔偲偒偼嫟栶墫婎 OH- 傪惗偠傞偺偩偟丄悈偑墫婎偲偟偰摥偔偲偒偼嫟栶巁 H3O+ 傪惗偠傞丅慜幰偺斀墳偑婲偙傝傗偡偄丄婲偙傝偵偔偄偐傜偲偄偭偰丄屻幰偺斀墳偑婲偙傝傗偡偄偐偳偆偐傪媍榑偡傞偙偲偼偱偒側偄丅
仜 乽AH 偑巁偲偟偰傛傝庛偄偲偄偆偙偲偼丄偦偺嫟栶墫婎乮A亅 偑乯墫婎偲偟偰嫮偄乿
仜 乽儊僠儖傾儈儞偺嫟栶巁偺 pKa 偺曽偑戝偒偄偺偱庛巁偩偐傜丄偦偺嫟栶墫婎偱偁傞儊僠儖傾儈儞偼墫婎偲偟偰傛傝嫮偄乿
2.46
栤戣 2.44 偲摨條偵峫偊傞丅傕偟丄tert-僽僩僉僔僪傾僯僆儞偑悈偲斀墳偡傞傎偳嫮偄墫婎偱偁傟偽丄悈偲斀墳偟偰乮僾儘僩儞傪悈偐傜堷偒敳偒乯 tert-BuOH 乮偲丄悈偺嫟栶墫婎 OH亅 乯偵側偭偰偟傑偆偨傔丄偙偺僀僆儞傪悈拞偱敪惗偝偣傞偙偲偼偱偒側偄丅
乮夝摎椺乯
悈拞偱嶌傞偙偲偼偱偒側偄丅
tert-BuO- + H2O 仼仺 tert-BuOH + OH-
偲偄偆幃傪峫偊傞丅tert-BuOH乮pKa=18乯偲 H2O乮pKa=15.74乯偱偼丄悈偺曽偑嫮偄巁偱偁傞偐傜丄悈偑僾儘僩儞傪曻弌偟偰斀墳偼塃傊恑峴偡傞丅
2.47
僺儕僕儞偼丄偦偺拏慺偑屒棫揹巕懳傪帩偮偨傔丄墫婎偲偟偰偼偨傜偔丅恷巁偼儊僠儖悈慺偲僇儖儃僉僔婎偺悈慺偺俀庬椶偺悈慺傪帩偮偑丄巁惈搙偑傛傝崅偄偺偼僇儖儃僉僔婎偺悈慺偱偁傞丅
嬋偑偭偨栴報傪昤偔嵺偵偼丄儖僀僗墫婎乮揹巕懳乯偐傜敪偟丄偦偺揹巕懳傪庴偗庢傞儖僀僗巁偵岦偐偭偰栴報傪昤偔偙偲乮椺戣 2.6丄嫵壢彂p58乯丅
乮夝摎椺乯
僺儕僕儞恷巁墫乮C5H5NH+丒CH3CO2-乯偑惗偠傞丅壓偺幃偵廬偭偰惗偠傞梲僀僆儞偲堿僀僆儞偐傜側傞墫偱偁傞丅
2.48
pKa 偲 Ka 偺娭學幃偼丄埲壓偺捠傝丅
pKa 亖 亅 log10 Ka
廬偭偰丄Ka 亖 10亅pKa
巜悢昞婰傪幚悢昞婰偵捈偡偵偼丄娭悢揹戩摍傪傕偪偄傞丅
乮夝摎椺乯
(a) Ka = 10-19.3 = 5.01 亊 10-20
(b) Ka = 10-3.75 = 1.78 亊 10-4
2.49
pKa 偲 Ka 偺娭學幃偼丄埲壓偺捠傝丅
pKa 亖 亅 log10 Ka
昁梫偵墳偠偰娭悢揹戩摍傪傕偪偄傞丅
乮夝摎椺乯
(a) pKa = 亅 log10(5.0 亊 10-11) = 10.30
(b) pKa = 亅 log10(5.6 亊 10-5) = 4.25
2.50
pH 傪媮傔偨偄偺偩偐傜丄
HCO2H 仼仺 HCO2亅 亄 H亄
偙偙偱丄僊巁偺慡擹搙乮夝棧偟偰偄傞傕偺偲夝棧偟偰偄側偄傕偺傪偡傋偰偁傢偣偨擹搙乯傪 C 偲抲偔丅偙偺抣偼丄栤戣暥傛傝 0.050 mol/L 偲梌偊傜傟偰偄傞丅
傑偨丄偙偺偲偒夝棧偟偰偄傞僊巁偺妱崌乮夝棧搙偲偄偆乯傪 α 偲抲偔丅
巁夝棧暯峵偵偁傞梟塼拞偱偺擹搙偼丄忋婰偺婰崋傪巊偆偲丄
[ HCO2H ] 亄 [ HCO2亅] 亖C
[ HCO2亅] 亖 C α
[ H亄] 亖 C α
偲側傞偐傜丄
| Ka = | [ HCO2亅] | [ H亄] | = 10亅3.75 = | ( C α ) | ( C α ) | = | C α2 |
| [ HCO2H ] | C ( 1 亅 α ) | 1 亅 α | |||||
偲昞偣傞丅偙偙偱丄 α 偑侾偵斾傋偰廫暘偵彫偝偄偲壖掕 仏 偡傞偲丄
媮傔傞傋偒悈慺僀僆儞擹搙偼丄[ H亄] 亖 C α 偱偁傞丅
拹 仏 丗彫悢揰埲壓俀寘埲忋偺惛搙偱 pH 傪媮傔偨偄偲偒偵偼丄忋婰塃曈偺暘曣傪
擇師曽掱幃偺夝偺岞幃傛傝丄
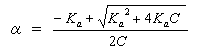
彫悢揰埲壓侾寘栚傑偱偺惛搙偱偺 pH 偺寁嶼偵偼丄偙偺壖掕偼丄寁嶼偟偰傒偨寢壥 α 偑 0.05 掱搙傛傝彫偝偐偭偨帪偵偼偦偺傑傑梡偄偰傕傛偄丅α 偑戝偒偄応崌偼丄忋偺擇師曽掱幃偺夝偺岞幃傛傝媮傔側偍偡丅
乮夝摎椺乯
僸儞僩偵廬偭偰夝偔偲丄夝棧搙 α 偼丄0.0596 偲側傞偐傜丄[ H亄] 亖 2.98 亊 10-3 mol/L 偱偁傞丅廬偭偰丄pH 亖 亅 log [ H亄] 亖 2.5 偲側傞丅
乮敪揥乯
忋偺乮僸儞僩乯偵夝愢偟偨埖偄偼丄媮傔偨 pH 偑丄巁偺梟塼偺応崌偱偼偍傛偦 6 埲壓丄墫婎偺梟塼偺応崌偱偼偍傛偦 8 埲忋偱偁傞応崌偵惓偟偄丅乮尵偄姺偊傞偲丄拞惈晅嬤偱偼惓偟偔側偄丅乯傕偟偙傟傛傝傕偢偭偲婬敄偱丄拞惈晅嬤偺 pH 傪傕偮悈梟塼偵偮偄偰峫偊側偗傟偽偄偗側偄応崌偵偼丄悈偺夝棧偵傛傝惗偠傞悈慺僀僆儞擹搙偺塭嬁偑柍帇偱偒側偄偨傔丄惓妋側 pH 傪媮傔傞偨傔偵偼傗傗暋嶨側埖偄傪偟側偗傟偽側傜側偄丅乮偙傟偼丄乽暘愅壔妛乿偺斖醗偲側傞丅乯
2.51-2.58
2.51
扽巁悈慺僫僩儕僂儉偼丄扽巁偺僫僩儕僂儉墫偱偁傞偲偄偆栤戣暥偵偍偗傞拹庍偺堄枴偡傞偙偲偼丄扽巁悈慺僫僩儕僂儉 NaHCO3 偑丄扽巁 H2CO3 偺嫟栶墫婎偱偁傝丄乮傕偲偺巁偺宍偱偼帩偭偰偄偨 H+ 傪幐偆戙傢傝偵乯Na+ 偲偺僀僆儞懳偵側偭偨宍傕偺偱偁傞偙偲傪堄枴偟偰偄傞丅偡側傢偪丄偙偙偱偼丄扽巁悈慺僫僩儕僂儉傪乮扽巁偺嫟栶乯墫婎偲偟偰丄Brønstead - Lowry 偺巁墫婎斀墳傪峫偊傟偽傛偄偙偲傪帵嵈偟偰偄傞丅
栤偄 2.44 偲摨偠傛偆偵峫偊傞丅
乮夝摎椺乯
恷巁乮pKa=4.75乯
栤偄 2.43 偵帵偝傟偨巁傪丄堦斒揑偵 HA 偲彂偔傕偺偲偟丄
HCO3- + HA 仼仺 H2CO3 + A-
偲偄偆幃傪峫偊傞丅H2CO3乮pKa=6.37乯傛傝傕嫮偄巁 HA 偼丄HCO3- 偵僾儘僩儞傪梌偊丄帺恎偼 A- 偲側傝丄斀墳偼塃傊恑峴偡傞丅廬偭偰丄pKa 偑 6.37 傛傝彫偝側巁偺傒偑扽巁悈慺僫僩儕僂儉偲斀墳偡傞丅
乮敪揥乯
側偍丄扽巁悈慺僫僩儕僂儉乮 NaHCO3 乯偼丄墫婎偲偟偰斀墳偡傞偲偒丄扽巁傛傝傕嫮偄巁偱偁傞暔幙傛傝僾儘僩儞傪偆偗偲傝丄傛傝庛偄巁偱偁傞扽巁乮 H2CO3 乯偲側傞丅扽巁偼悈偵擇巁壔扽慺偑梟偗偨傕偺偱偁傞偐傜丄嫮巁傪扽巁悈慺僫僩儕僂儉偱拞榓偡傞偲丄擇巁壔扽慺偺婥懱偑敪惗偡傞丅偙傟偼丄師偺暯峵斀墳偑乽儖僔儍僩儕僄偺尨棟乿偵廬偄丄扽巁乮 H2CO3 乯偺擹搙偑忋偑傞偙偲偵傛傝塃傊偢傟傞偙偲偵傛傞傕偺偲棟夝偱偒傞丅
H2CO3 仼仺 H2O 亄 CO2
墫婎偲偟偰扽巁僫僩儕僂儉乮 Na2CO3 乯傪梡偄偰傕丄嫮偄巁偲斀墳偟偰扽巁乮寢壥偲偟偰擇巁壔扽慺偺婥懱乯傪敪惗偡傞丅偙偺帪偺斀墳偼丄戞侾抜奒栚偲偟偰丄扽巁僀僆儞 CO32- 偑僾儘僩儞傪偆偗偲偭偰扽巁悈慺僀僆儞 HCO3- 傪惗偠丄師偵戞俀抜奒偲偟偰丄扽巁悈慺僀僆儞 HCO3- 乮扽巁悈慺僫僩儕僂儉乯偑傕偆傂偲偮偺僾儘僩儞傪偆偗偲傞偙偲偱恑峴偡傞丅偟偨偑偭偰丄巁亅墫婎斀墳偺婲偙傝傗偡偝傪峫偊傞応崌偵偼丄
扽巁僫僩儕僂儉乮 Na2CO3 乯
仼仺
扽巁悈慺僫僩儕僂儉乮 NaHCO3 乯
仼仺
扽巁乮 H2CO3 乯
偺俀抜偺斀墳偲偟偰丄偦傟偧傟傪暿屄偵昡壙偟偰傗傞昁梫偑偁傞丅乮尵偄姺偊傞偲丄扽巁偺俀偮偺悈慺偼丄戞侾抜奒栚偲戞俀抜奒栚偱堎側傞巁惈搙掕悢 pKa 傪帩偮丅乯
2.52
乽栤戣 2.51 傪嶲峫偵偟偰乿偲偄偆偺偩偐傜丄僼僃僲乕儖丄恷巁偲傕偵巁偲偟偰峫偊偨応崌偵丄扽巁悈慺僫僩儕僂儉偲斀墳偡傞傕偺偑偳偪傜偐丄偲偄偆娤揰偐傜摎偊傟偽傛偄丅
乮夝摎椺乯
2.51 偵帵偟偨傛偆偵丄恷巁偺傒偑扽巁悈慺僫僩儕僂儉偲斀墳偟偰擇巁壔扽慺傪惗偠傞丅僼僃僲乕儖偼斀墳偟側偄丅
偙偙偱丄婥懱乮擇巁壔扽慺乯傪敪惗偡傞斀墳偼丄尒偨栚偱梕堈偵敾抐偱偒傞丅乮婥朅偑妋擣偱偒傞丅乯
2.53
杮棃丄巁亅墫婎斀墳偱偁傟偽暯峵偱懆偊傞昁梫偑偁傞丅
(a) 偲 (c) 偼丄Brønsted - Lowry 偺掕媊偵傛傞巁亅墫婎斀墳偲偟偰峫偊傞偙偲偑偱偒傞丅偦偺応崌偼丄嵍曈偩偗偱側偔丄塃曈偵懳偟偰傕乮嫟栶乯墫婎丄乮嫟栶乯巁傪寛傔傞偙偲偑偱偒傞丅
(a)丄(b) 偍傛傃 (d) 偼丄Lewis 偺掕媊偵傛傞巁亅墫婎斀墳偲偟偰峫偊傞偙偲偑偱偒傞丅(c) 偼丄嵍曈偺僾儘僩儞嫙梌懱傪 Lewis巁偲偟偰埖偆乮儅僋儅儕乕撈帺偺乯掕媊偵傛傟偽丄摨條偵Lewis 偺巁亅墫婎斀墳偺斖醗偵擖傞偑丄堦斒揑偵偼僾儘僩儞嫙梌懱偼 Lewis 巁偲偟偰埖傢側偄丅
乮夝摎椺乯
巁偼愒偱丄墫婎偼惵偱帵偟偨丅偨偩偟丄塃曈偼嵍曈偵懳偡傞嫟栶巁傗嫟栶墫婎偱偁傞丅
(a) CH3OH + H+ 仺 CH3OH2+
(b) CH3C(=O)CH3 + TiCl4 仺 CH3C(=O+:Ti-Cl4)CH3
(c) C6H10O + Na+丒H- 仺 C6H9O-丒Na+ + H2
(d) C4H8ONH + BH3 仺 C4H8ON+(H)(B-H3)
(b), (d) 偼 Lewis 偺掕媊偵傛傞巁亅墫婎斀墳側偺偱丄塃曈偺奺惗惉暔偵懳偟偰嵍曈偺惉暘偵懳偟偰偺嫟栶巁偱偁傞偲偐丄嫟栶墫婎偱偁傞偲偄偆尵偄曽偼偟側偄丅
(a) 傕丄嵍曈偺斀墳偑 Lewis 偺掕媊偵傛傞巁亅墫婎斀墳偲偟偰峫偊傞側傜丄乽塃曈偺 CH3OH2+ 偼丄嵍曈 CH3OH 偺嫟栶巁偱偁傞乿偲偄偆尵偄曽偼偟側偄丅
傑偨丄尩枾側堄枴偱 (a) 傪 Brønsted 偺巁亅墫婎斀墳偲偟偰峫偊傞側傜丄乽 H+ 偼巁偱偁傞乿偲偄偆尵偄曽偼娫堘偄偱偁傞丅乮 H+ 偦偺傕偺偑巁側偺偱偼側偔丄H+ 傪梌偊傞傕偺偑 Brønsted 偺巁偱偁傞丅偦偺偨傔丄巁 HCl 傗丄巁 CH3CO2H 偵懳偟偰偼丄偦偺巁偺嫮偝傪帵偡巜昗偺悢抣偲偟偰巁惈搙掕悢 Ka 傪掕傔傞偙偲偑偱偒傞偑丄H+ 偦偺傕偺偵懳偟偰 Ka 傪掕傔傞偙偲偼偱偒側偄丅乯偟偐偟丄傛偔側偝傟傞徣棯偲偟偰丄 H+ 偑 H3O+ 偺偙偲傪昞偟偰偄傞傕偺偱偁傞偲夝庍偟偰偟傑偆偲丄H+ 傪 Brønsted 偺巁偲偟偰埖偭偰偟傑偆偙偲偑壜擻偲側傞丅乮柧帵揑偵偼帵偝傟側偄偑丄偦偺応崌偺 H+ 乮H3O+乯偺嫟栶墫婎偼丄梟攠偱偁傞 H2O 偲偄偆偙偲偵側傞丅乯
(c) 偺塃曈偵偁傞 H2 偵偟偰傕丄乽H2 偼丄僸僪儕僪僀僆儞 H- 傪墫婎偲偟偰峫偊偨応崌偺嫟栶巁偱偁傞乿偲偄偆暥偼惓偟偄偑丄 H2 偼巁偲偟偰偼旕忢偵庛偄偺偱丄扨偵乽H2 偼巁偱偁傞乿偲偄偆尵偄曽傪偟偨応崌偼乮暥柆偵傕傛傞偑乯惓偟偔側偄偙偲偵側傞働乕僗偑懡偄丅乮偙偺濨枂偝偼丄乽H2 偼巁偱偁傞乿偲偄偆暥復偑柦戣偱偼側偄偙偲偵桼棃偡傞丅乽傾儕偼嵶嬠傛傝傕戝偒偄乿偲偄偆憡懳揑側斾妑偱偺暥柆偱偁傟偽惓偟偄偑丄扨偵乽傾儕偼戝偒偄乿偲尵偭偰傕尩枾偵偼恀婾傪寛傔傞偙偲偑弌棃側偄偺偲摨偠偱偁傞丅傑偨丄姶妎揑偵偼乽傾儕偼戝偒偄乿偲偄傢傟傞偲婾偩偲姶偠傞偺偱偁傞丅乯
乮娬榖媥戣乯
Brønsted 偺昞婰偼 Brönsted 偲側偭偰偄傞嫵壢彂傕偁傞丅
側偍丄 ø 偼丄乽僊儕僔傾暥帤偺僼傽僀丗 φ 乮html 偱偺昞婰 φ乯乿偱偼側偔丄乽傾僋僙儞僩婰崋偮偒傾儖僼傽儀僢僩 letter o with stroke丗 ø 乮html 偱偺昞婰 ø乯乿偱偁傞丅
2.54
2.33-2.34 偺僸儞僩傪嶲徠偺偙偲丅
偙偺傛偆側栤戣傪夝偔偲偒丄僲乕僩偵摎偊乮乽嫟柭峔憿偱偁傞乿乽側偄乿乯偩偗偑彂偐傟偰偄偰傕丄偁偲偱尒捈偟偨偲偒偵慡偔栶偵棫偨側偄丅乽偳偺傛偆側栤戣偐傢偐傞傛偆偵乿峔憿幃傪彂偒幨偟側偑傜丄乽摎偊偺棟桼偲偟偰乿嫟柭峔憿偱偁傞応崌偼丄俀偮偺峔憿幃傪娭學晅偗傞傛偆側揹巕偺摦偒傪帵偟偨傝丄嫟柭峔憿偱偼側偄応崌偵偼丄偦偺堎側傞崻嫆偺埵抲傪嬶懱揑偵帵偟偨傝偟側偑傜乽摎偊乿傪彂偔傛偆偵偡傞偺偑丄墦夞傝偺傛偆偵尒偊偰丄幚偼嵟傕岠棪偺傛偄曌嫮朄偱偁傞傛偆偵巚傢傟傞丅
乮夝摎椺乯
(a) 嫟柭峔憿偱偁傞丅
(b) 嫟柭峔憿偱偼側偄丅悈慺尨巕偺埵抲偑嵍塃偱堎側偭偰偄傞偨傔丅
(c) 嫟柭峔憿偱偼側偄丅悈慺尨巕偺埵抲偑嵍塃偱堎側偭偰偄傞偨傔丅
(d) 嫟柭峔憿偱偁傞丅
2.55
2.33-2.34 偺僸儞僩傪嶲徠偺偙偲丅
(a) 偺僯僩儘儊僞儞偺嫟柭偼丄傾僙僥乕僩僀僆儞乮CH3CO2-乯偺嫟柭偲峔憿揑偵椶帡偟偰偄傞丅傑偨丄2.54(d) 偵椺帵偝傟偨僯僩儘儊僞儞偐傜僾儘僩儞偺偲傟偨嫟栶墫婎偺嫟柭峔憿偲傕娭楢偟偰惍棟偟偰偍偙偆丅
乮夝摎椺乯
(a) 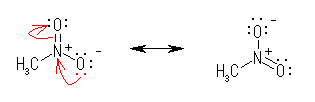
(b) 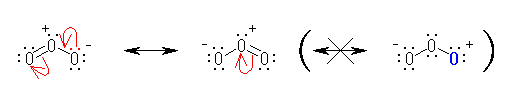
(c) 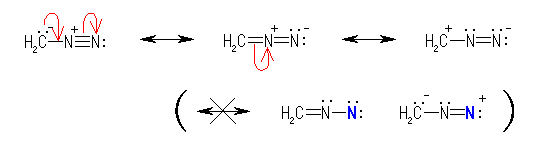
(b) 傗 (c) 偵偍偄偰丄亊偱帵偟偨峔憿偼丄揹婥堿惈搙偑崅偄拏慺傗巁慺尨巕偐傜揹巕懳傪扗傢傟偰壙揹巕偑俇屄偵側偭偨傕偺乮惵帤偱帵偟偨尨巕乯傪娷傒丄廳梫偱偼側偄丅
2.56
昞 2.2 偐傜傕撉傒庢傟傞傛偆偵丄惓偺宍幃揹壸傪帩偮扽慺尨巕偼丄俁屄偺壙揹巕傪帩偮偐傜丄拞惈偺戞侾俁懏偺尦慺乮傾儖儈僯僂儉傗儂僂慺乯偲摨條偵丄俁杮偺寢崌傪傕偪丄僆僋僥僢僩傪枮偨偝側偄丅偙偺偨傔丄僇儖儃僇僠僆儞偼儖僀僗巁偲偟偰摥偔丅
椺帵偝傟偰偄傞斀墳偵偍偄偰丄儖僀僗墫婎偼悈偱丄偦偺巁慺尨巕偺屒棫揹巕懳偑惓揹壸傪傕偮扽慺偲偺娫偱偺寢崌偵巊傢傟傞丅
僇儖儃僇僠僆儞 H3C-CH(+)-CH=CH2 偑悈偲斀墳偟偰俀庬偺傾儖僐乕儖傪梌偊傞嵺丄悈偲斀墳偟偰偄傞売強偑偦傟偧傟堎側偭偰偄傞偙偲偵拲堄偟偰峫偊傞丅
娭楢偟偨峔憿偲偟偰丄栤偄 2.34(d) 傕嶲徠偡傞偙偲丅
乮夝摎椺乯
僇儖儃僇僠僆儞 H3C-CH(+)-CH=CH2 偼丄師幃偱帵偡傛偆側嫟柭偺婑梌偵傛傝丄惓揹壸偼俀偮偺扽慺偵旕嬊嵼壔偟偰偄傞偲峫偊傜傟傞丅偦偺偨傔丄悈暘巕偲傕丄俀売強偱斀墳偑婲偒傞丅
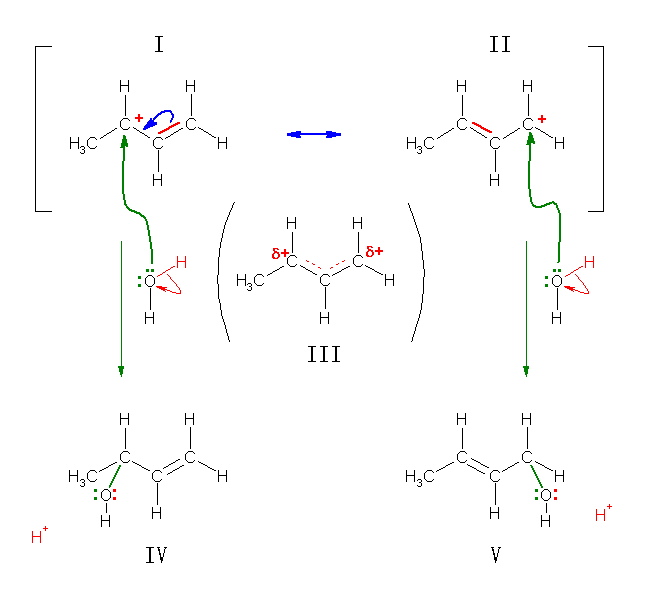
忋恾偵偍偄偰丄峔憿 I 偲峔憿 II 偼丄嫟柭偺嬌尷峔憿偱偁傞偐傜丄偙傟傜偺堎側傞峔憿偑幚嵼偡傞傢偗偱偼側偄丅偙偺僇儖儃僇僠僆儞偼丄偙偺俀偮偺嬌尷峔憿幃偺拞娫偺傛偆側惈幙傪傕偮偨偩傂偲偮偺峔憿偱偁傝丄偡側傢偪惓揹壸偑俀偮偺扽慺忋偵晹暘揹壸偲偟偰懚嵼偟偰偍傝丄峔憿 III 偺傛偆偵昤偔偙偲偑偱偒傞丅偙偺峔憿 III 偺僇僠僆儞偺堎側傞俀売強偺扽慺忋偵悈偑峌寕偡傞偙偲偱丄傾儖僐乕儖 IV 偍傛傃傾儖僐乕儖 V 偑惗偠傞丅
2.57
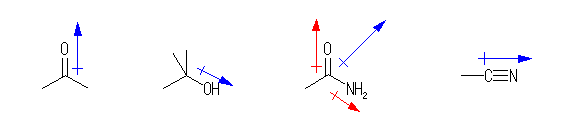
姱擻婎偺拞偺寢崌偺嬌惈偐傜丄姱擻婎偺帩偮暘嬌傪媮傔傟偽傛偄丅
乮夝摎椺乯
偙偙偱偼丄扨偵寢崌偺暘嬌偐傜惗偠傞憃嬌巕儌乕儊儞僩偺岦偒偺傒傪栤戣偵偡傞丅幚嵺偵偼丄摨偠乽扽慺亅巁慺乿寢崌偱傕丄傾儖僐乕儖偺傛偆偵扨寢崌偺応崌偲丄僇儖儃僯儖婎偺擇廳寢崌偺応崌偱偼丄暘嬌偺搙崌偄偑堎側傞丅乮扨寢崌偺 σ揹巕偵偔傜傋丄擇廳寢崌偺 π揹巕偼暘嬌偟傗偡偄丅乯
2.58
傑偢嫟栶墫婎偺峔憿偵偮偄偰偼丄偦傟偧傟偺暘巕拞偱堦斣巁惈搙偺崅偄悈慺傪扵偡偙偲丅偙偙偱偼丄揹婥堿惈搙偺崅偄尨巕乮巁慺尨巕乯偵寢崌偟偨悈慺偱偁傞丅
傑偨丄儊僞僲乕儖傪巁偲偟偰峫偊偨偲偒偺嫟栶墫婎偱偁傞儊僩僉僔僪傾僯僆儞偼丄摿偵嫟柭峔憿傪昤偔偙偲偑偱偒側偄偑丄僼僃僲乕儖偺嫟栶墫婎偱偁傞僼僃僲僉僔僪傾僯僆儞偼丄嫟柭峔憿傪昤偔偙偲偑偱偒埨掕偱偁傞丅嫟栶墫婎偑埨掕偱僾儘僩儞傪庴偗庢傝偵偔偄乮墫婎偲偟偰庛偄乯偺偩偐傜丄偦偺嫟栶巁偱偁傞僼僃僲乕儖偼乮憡懳揑偵丄儊僞僲乕儖偵斾傋偰乯嫮偄巁偱偁傞偲寢榑偡傞丅偱偼丄偳偺傛偆側嫟柭峔憿偑昤偗傞偺偐丅
乮夝摎椺乯
儊僞僲乕儖傪巁偲偟偰峫偊偨偲偒偺嫟栶墫婎偱偁傞儊僩僉僔僪僀僆儞 CH3O- 偼丄摿偵嫟柭峔憿傪昤偔偙偲偑偱偒側偄丅
偙傟偵懳偟偰僼僃僲乕儖偺嫟栶墫婎丄僼僃僲僉僔僪僀僆儞乮C6H5O-乯偼丄埲壓偱帵偡傛偆側嫟柭岠壥偵傛傝埨掕偱偁傞丅嫟栶墫婎乮僼僃僲僉僔僪僀僆儞乯偑埨掕偲偄偆偙偲偼丄偦偺嫟栶墫婎偦偺傕偺乮僼僃僲僉僔僪僀僆儞乯偑僾儘僩儞傪庴偗庢傝偵偔偔丄庛墫婎偱偁傞偐傜丄乮尦偺巁偱偁傞乯僼僃僲乕儖偼丄傾儖僐乕儖偲斾妑偟偰傛傝嫮偄巁偱偁傞偲寢榑偱偒傞丅