5.01-5.10
5.01
教科書 §5.1(pp133-134)の記述をよく読むこと。
(解答例)
(a) 置換 : -Br が -OH に置換されている。
(b) 脱離 : 臭化水素 HBr が脱離してオレフィン(アルケン)が生じている。
(c) 付加 : 二重結合に水素が付加している。
5.02
塩素化反応は、次の形式による置換反応である。
R-H + Cl2 → R-Cl + HCl
したがって、2-methylpentane, C6H14 より、その塩素化体として C6H13Cl を生じる。
このとき、すべての水素に反応するチャンスがある。異なる位置の水素で置換反応が起こると、異なる生成物(位置異性体)を生じる。
なお、考えられる生成物は5種類。
(解答例)
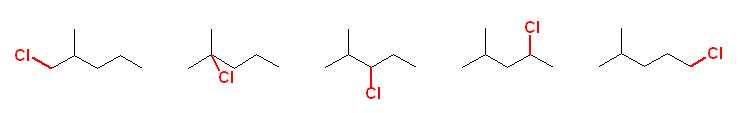
生成物の名称は、図左より以下の通り。
1-chloro-2-methylpentane,
2-chloro-2-methylpentane,
3-chloro-2-methylpentane,
2-chloro-4-methylpentane,
1-chloro-4-methylpentane
メチル基の位置番号が、塩素との関係で2または4になっていることに注意。また、2位のメチル基が塩素化されたものは、1位の位置で塩素化されたものと同じ構造であることに注意。
5.03
反応式をよく見て、反応の前後で変化しているところを探す。
次図の赤で示したところが反応の前後での違い。
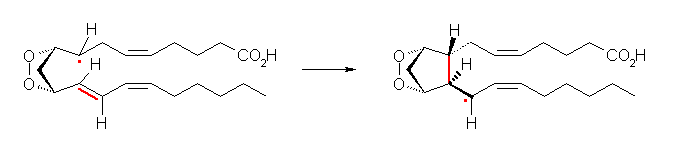
(解答例)
反応の種類:同じ分子の中の2つの部分の間に新しく結合が生じているが、脱離しているものはない。したがって「分子内の」「付加反応(ラジカル付加反応)」である。また、分子式が反応の前後で変わっていないから、「転位反応」であると捉えてもよい。
反応の機構を曲がった矢印で書くとき、ラジカルのように対をなしていない電子の動きを表すためには、「片鈎の」矢印を用いることに注意すること。次図。
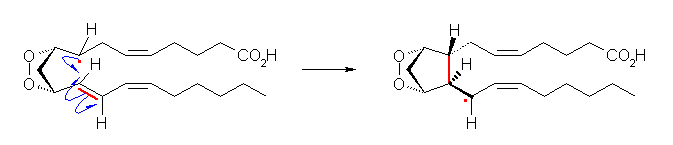
なお、反応前のラジカル中心は、3本のシグマ結合を持つので、sp2混成であると考えられ、残った p 軌道中に不対電子が入っている。 また、このラジカルが付加していく二重結合も、2つの sp2混成炭素からなっており、π 結合はこの2つの炭素上の p 軌道に電子が1つずつ入っている状態で生じている。したがって、1列に並んだ3つの p 軌道の中にそれぞれ電子が1つずつ入った系であると考えると、次図のように上の反応機構を書くこともできる。
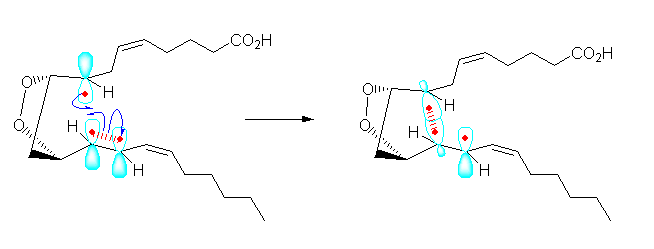
5.04
例題 5.1 の「解き方」を見よ。
まず、それぞれのイオンや分子の構造を書き、すべての孤立電子対と形式電荷を書き加えること。その上で、電子不足の原子(正電荷をもつ原子、正の部分電荷をもつ原子)がどれか、また、電子過剰の原子(負電荷をもつ原子、負の部分電荷をもつ原子、特に新たに結合を作っていくために必要な孤立電子対をもつもの)がどれかを見極めること。
(解答例)
(a) 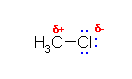
炭素にくらべてハロゲンの電気陰性度が高いので、上図のように分極し、部分電荷をもつ。このため、ハロゲンの結合した炭素は求電子試薬として働くことができる。(炭素の部分に求核攻撃をうける。)
また、電気陰性度の高い塩素が孤立電子対を持つから、この塩素は、形式的に求核性をもつ。この部分が求核的に他の原子(たとえば X+)に結合すると、
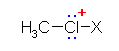
のように、塩素上に形式電荷として正電荷をもつことになる。実際には、このような CH3Cl 分子における塩素原子の求核性による反応はあまり知られていないように思われる。ただし、
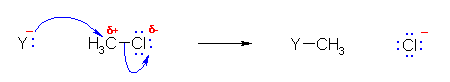
のような求核種との反応(求核置換反応)で生じる塩化物イオン Cl- は、求核性が無視できない。
(b) 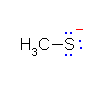
チオラート(チオールの共役塩基)は、優れた求核種である。
水酸化物イオン HO- や、アルコキシラート RO- と同様である。
(c) 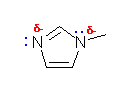
電気陰性度が高く、負の部分電荷を帯びた窒素上に孤立電子対があるため、求核性を示す。
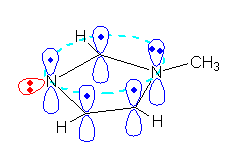
また、二重結合があり、π 電子は原子同士の結合の作る面の上下に広がっているために、求電子攻撃をうけやすい(求核種としてはたらく)。しかし、この化合物の場合は、同じ平面から垂直につきでた5つの p 軌道があり、その中に6つの電子が入っている。ベンゼン(C6H6)に代表されるような、6π 電子が環状になった構造の分子は、芳香族性(教科書、15章で詳しく学ぶ)を持ち、特に安定である。もし、この二重結合が求電子反応をうけると芳香族性が失われるため、安定化の要因がなくなるために不利であるから、そのような反応は起き難い。つまり、エチレンのような単純な二重結合にくらべて、この化合物における二重結合は、求核性が小さい(求電子反応をうけにくい)。
同じ理由で、2組ある窒素の孤立電子対のうち、一方は求核性を持つが、もう一方は求核性をほとんどもたない。次図の青で示された、芳香族の 6π 系に組み込まれた方の電子対(メチル基のついた窒素上の電子対)は求核性をもたない。(同様に、塩基性も示さない。)
(d) 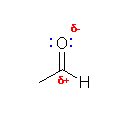
カルボニル基は、電気陰性度の差により大きく分極する。これは、(a) のような炭素−ハロゲンの結合や、アルコールやエーテルにおける炭素−酸素の単結合でも同じことが起きるのであるが、炭素=酸素の間が二重結合である場合、特に π 電子が(結合の軸の上下に広がっており、原子から強くは束縛されていないため)動きやすく、したがって分極もより大きなものとなる。
このため、カルボニル化合物の場合、その炭素の求電子性が重要である。(炭素の位置に対し、求核攻撃をうけやすい。)
また、負の部分電荷をもつ酸素上には孤立電子対もあるから、求核性も示し、プロトンをうけとったり、ルイス酸を配位したりすることができる。
大雑把には、次のようにまとめておくとよい。
求電子試薬:正電荷を持つもの、正の大きな部分電荷を持つもの(ハロゲンや、酸素など、電気陰性の原子に結合している炭素や水素)、特に、酸素やハロゲンに結合した酸性の水素。また、中性ではあるがオクテットを満たしていないルイス酸であるもの。
求核試薬:負電荷を持つもの、負の大きな部分電荷を持つもの、中性ではあるがπ電子を持つもの、および窒素、酸素上の孤立電子対を持つもの。
ただし、カルボニル基や、シアノ基は多重結合および酸素、窒素上に孤立電子対を持つが、求核種としてより、求電子種としての働きの方がより重要である。
5.05
静電ポテンシャルマップでは、青いところは電子不足、赤い部分が電子豊富であることを示していた。また、ホウ素は3族の元素であるから、中性の原子で価電子が3であった。
(解答例)

ホウ素は3本の結合をもち、それ以外の電子対等をもたないので、オクテットを満たさないルイス酸である。(最外殻であるL殻に、空の p 軌道をもつ。)また、フッ素は結合に関与する以外の3つの孤立電子対を持つ。
ホウ素はポテンシャルマップから読みとれるように電子不足の原子となっており、求電子試薬としてはたらくことができる。
5.06
オレフィンとハロゲン化水素の極性付加反応では、プロトン(水素イオン)が求電子試薬としてはたらき、二重結合(の π 電子)に付加し、カルボカチオンを与え、ひきつづいてハロゲン化物イオンがそのカチオン中心と静電的に(つまり、 Cl- などが求核試薬としてはたらいて)結合する。
(解答例)
HBr との反応 : 1-bromocyclohexane,
HCl との反応 : 1-chlorocyclohexane
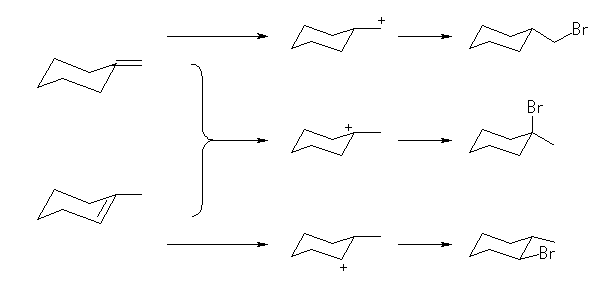
5.07
非対称な二重結合にプロトンが付加する際、二重結合に関与した2つの炭素のどちらに結合するかにより、カルボカチオンに2種類の構造が考えられることに注意する。
(解答例)
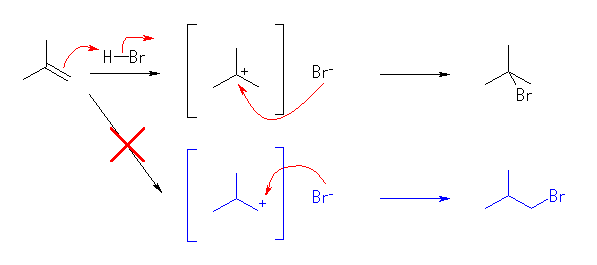
生成物の構造から考えて、カチオン中心に臭化物イオンが結合していくのであるから、上記反応式の上で示した3級のカルボカチオンが生じている。下で示したカルボカチオンは1級であるから、3級のカルボカチオンよりも生じにくい。
5.08
矢印をもちいた表記については、教科書 §5.4〜§5.6 などをじっくり読むこと。
(解答例)
以下に示す図において、曲がった矢印の位置(出発点、矢印の先の点)、生成物の構造や電荷の有無について注意すること。
また、図をみながら、曲がった矢印で表される電子の動きによって、どの結合や電子対が無くなり、代わりにどこに結合や電子対が生じているのかを確認すること。
(a) 
(b) 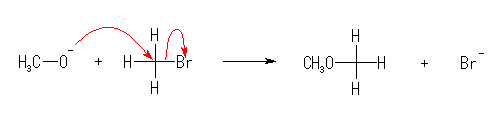
(c) 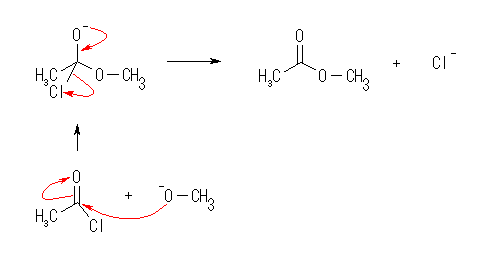
5.09
・電子対から原子への矢印では、そこに結合が新たにできる。
・結合からの矢印では、そこの結合が1本減る。(二重結合からは単結合、単結合は切れる。)
・矢印の先では結合が1本増えるか、矢印の先の原子が電子を受け取り価数が増える。
(解答例)

5.10
教科書 §5.7 (pp148-151)をよく読んでください。
(解答例)
反応のギブス自由エネルギー変化が負(発エルゴン的)である反応は、平衡が成立した場合に正反応が進行する側に偏り、反応に有利である。したがって、 -44 kJ/mol の反応。
5.11-5.20
5.11
反応物 ←→ 生成物
の反応において、平衡定数 Keq は、[ 生成物 ] / [ 反応物 ] で与えられたことを思い出すこと。この数値が1より大であるということはどういうことか。また、1より小であるということはどういうことか。
(解答例)
平衡定数の式から明かなように、平衡定数が大きい(分母が小さく、分子が大きい)方が生成物よりに傾いており、より発エルゴン的である。したがって、1000 の場合の方が発エルゴン的(反応により系のもつギブスの自由エネルギーが減少する)である。
5.12
反応速度は、アレニウスの式、 k = A × exp ( − ΔG‡ / RT ) で与えられる反応速度定数に比例する。ここでは、前指数項 A の大小は問わないものとして考えることにする。
(解答例)
アレニウスの式において前指数項 A が共通であるならば、反応の活性化エネルギー ΔG‡ が小さい反応ほど、その反応速度が速い。従って、ここでは +45 kJ/mol の活性化エネルギーを持つ反応の方が、+70 kJ/mol の活性化エネルギーの反応よりも速い。
ただし、以下の点を気をつける。
・同じ温度での比較であること。もし温度が違えば活性化エネルギーの大小だけでは反応の速さを議論できない。
・同じような反応であること。異なる種類の反応は、異なる A の値を持つことがあり、その場合も活性化エネルギーの大小だけでは反応の速さを議論できない。
・逆反応について考えなくてもよい系であること。可逆反応の場合は、生成物の量がごく少ない(したがって逆反応がほとんど進まない)初期の反応速度で比較していること。逆反応の割合が増えてきて、遂に平衡が成り立つ時点では、見かけ上は反応が進まない。(見かけ上、反応物と生成物の量が変化しない。)
・また、この平衡に達する点がどのあたりかという情報は、反応の活性化エネルギー ΔG‡ (途中で越えるべき山の高さ)からは得られない。平衡定数と関連するのは、反応の自由エネルギー変化 ΔG° (反応の前後−山の裾の左右−の高さの差)だけである。
5.13
吸エルゴン過程では反応の自由エネルギー変化が正であり、発エルゴン過程では反応の自由エネルギー変化が負である。自由エネルギー変化が正であるということは、反応前よりも反応後の方が高い自由エネルギーを持つことに相当する。
(解答例)
(例)
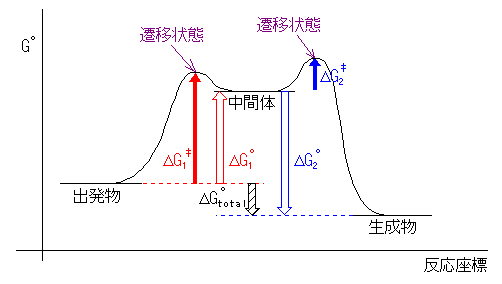
第一段階が吸エルゴン過程なので「出発物(反応物)」より「中間体」の方がエネルギーが高く、また、第二段階が発エルゴン過程なので「中間体」より「生成物」のエネルギーが低い。(遷移状態に相当する山の高さは、一つめと二つ目でどちらが高くても構わない。)
ΔG°total は正でも負でも良い。
5.14
「つぎのハロゲン化アルキルは、2つの異なるアルケンに HBr が付加して得られる。」という問いの文は、「2つの異なるアルケンに、別々に HBr が付加したとき、それぞれが同じハロゲン化アルキルを生じる(A + HBr → 図の生成物、B + HBr → 図の生成物) 」という意味。「2つのアルケンと HBr からハロゲン化アルキルが生じる(A + B + HBr → 図の生成物)」という意味ではないです。念のため。
アルケン(二重結合を持つ不飽和炭化水素)へのハロゲン化水素の付加反応では、隣接したふたつの炭素上に、水素とハロゲン原子が結合を作る。したがって、生成物の臭素の位置より、もとのアルケンにおける二重結合の位置を類推することが可能である。
(解答例)
反応の位置選択性(二重結合の左右の炭素のどちらに臭素が、どちらに水素が結合するかの選択性)を考えなければ、下図のように、1-pentene、2-pentene のいずれも 2-bromopentane を形成しうる。
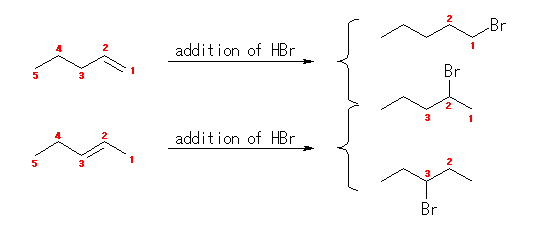
(発展)
反応の位置選択性
カルボカチオン中間体を経由する反応では、より安定な(級数のおおきい)カルボカチオンを好むから、1-pentene からは 2-bromopentane のみを主生成物として与え、2-pentene からは 2-bromopentane と 3-bromopentane とを生じる。
この図にあたえられた生成物が経由するカルボカチオンは、上より、1級、2級、2級である。
5.15
まずは図より、カルボカチオンの構造の中で、形式電荷が +1 となっている炭素を探すこと。(通常の分子の構造式と異なる部分が見つかるはずである。)
教科書の5章で何度にもわたってでてきたアルケンへの臭化水素の極性付加反応においては、二重結合部分のπ 電子が H-Br に対して求核的にはたらき、隣接した炭素の一方上にこの臭化水素由来の水素が結合し、もう一方の炭素上に形式電荷が生じる。次に、カルボカチオン上に臭化物イオンが結合していく。したがって、上の問い 5.14 と同様にカルボカチオンの正電荷を担っている炭素に臭素が結合した生成物となる。
(解答例)
反応の位置選択性(二重結合の左右の炭素のどちらに臭素が、どちらに水素が結合するかの選択性)を考えなければ、下図のように、methylenecyclohexane、1-methylcyclohexene のいずれも(この問いに示された)共通のカルボカチオン中間体を経由し、1-bromo-1-methylcyclohexane を生じる。
(発展)
反応の位置選択性
カルボカチオン中間体を経由する反応では、より安定な(級数のおおきい)カルボカチオンを好むから、解答例で示した2つの出発物質の、いずれからも 1-bromo-1-methylcyclohexane を主生成物として生じる。
5.16
電子不足(青) → 正の部分電荷(δ+) → 求電子性
電子豊富(赤) → 負の部分電荷(δ−) → 求核性
(解答例)
いずれも酸素、硫黄原子の付近での電子密度が高い(図で赤に近い色となっている)ことから、これらの原子は求核性を示すと考えられる。
(a) では、ホルムアルデヒドの炭素についてきいている。ここは電子密度が低く、図では青くなっている。求電子性を示す。
(b)硫黄原子は、電子密度が高く、求核性を示す。
5.17
(a) はじめの状態から、増えれば正、減れば負である。数値としては、最後の状態からはじめの状態を差し引く。(0から10に増えた場合には、差は10−0=+10、5から−3に減った場合には、差は−3−5=−8、というように。)図中に描くには、はじめの状態の高さから最後の状態へ向けた矢印で描く。(反応の自由エネルギー変化に注目する場合、はじめの状態と最後の状態のみできまり、途中の山の高さ(活性化エネルギ−)には依存しない。)
(b)(c) 「一つの段階」の反応では、ひとつの山(遷移状態)を越える。
「一つの段階」に対する反応エネルギー図の例として、教科書 153 ページの図 5.4 を参照。
(解答例)
図は省略しました。教科書 153 ページの図 5.4 を参照のこと。(皆さんの宿題で、図が「省略される」のは不可です。)
(a) 正である。
(b) 2段階。
(c) 途中で2つの遷移状態を経由する。
5.18
(a) ひとつ山を越えたあとのそれぞれの谷が中間体である。「中間体の数+生成物につき1」(=越えるべき山の数)が反応の段階数である。
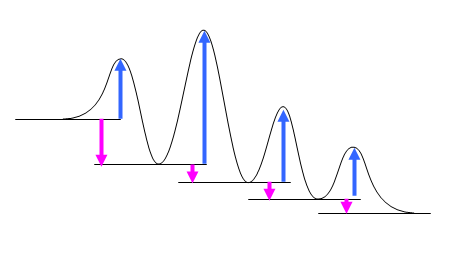
(b) は、ピンクの矢印が(下向きに)長いものが、最も発エルゴン的。(c) は、青い上向きの矢印(活性化エネルギー)の一番大きなものが、最も遅いと考えられる。
(解答例)
教科書の図から判断する。正確に判断したければ、ものさしをあててみてください。
(a) 4段階(1つの段階は、ポテンシャルエネルギーの谷からはじめ、山を越えて次の谷底までの部分)
(b) 最も発エルゴン的な反応とは、反応自由エネルギー変化(それぞれの段階ごとの始状態(谷底)と終状態(次の谷底)のエネルギー差:上図でピンクの矢印)が負で一番大きい段階である。それぞれの段階での反応自由エネルギー変化はいずれもほぼ同じ大きさである。(強いて言えば、若干1番目の過程が大きく発エルゴン的かもしれない。)
(c) 越えなければ山が一番高いところ(麓の低いところから登る)の段階が、一番遅い反応となると予想される。強いていえば、2番目?(ただし、「アレニウスの式における前指数項による影響はほとんど無視できる」=「活性化エネルギーが低い反応ほど反応速度が大きい」ものと仮定した。この仮定に関係する詳細は、5.12 のヒントおよび解答例を参照のこと。)
5.19
官能基を構成するそれぞれの原子の電気陰性度から決まる。
それぞれ、分子の構造式を書き、その上に分極を記すこと。分極を示す矢印の使い方については、教科書 §2.2 を参照すること。
(解答例)
解答は、それぞれ分子の構造式を書き、その構造に伴うように分極を示すこと。
a) シアノ基(−C≡N) 。窒素上に δ− が生じるように分極する。
b) エーテル結合(−O−)(または、メトキシ基、−OMe)、酸素上に δ− が生じるように分極する。R-O-Rの結合角は、水分子と同様に約110度で曲がっている。分子全体では、2つのR-O結合の分極の和としての分極を持つ。(教科書 p39、水分子の分極を参照のこと。)
c) カルボニル基(>C=O)(または、ケトン基)、および、エステル結合(−(C=O)-O−)。いずれも酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
d) 二重結合×2個、カルボニル基(>C=O)×2個。カルボニル酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
e) 二重結合(C=C)、アミド基(−CONH2)。酸素および窒素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
f) 芳香環、ホルミル基(−CHO)(または、アルデヒド基)。酸素上に δ− が、カルボニル炭素上に δ+ が生じるように分極する。
5.20
出発物質(反応物質)と、生成物質の構造をくらべ、どこが変化しているかを明らかにせよ。
(解答例)
a) 置換。−Br が、−CN で置換された。
b) 脱離。隣接した炭素から水素と水酸基が、水分子として脱離した。
c) 付加。cyclopentadiene と 3-butene-2-one とが反応して結合を作るが、なにも抜け落ちる部分がない。
d) 置換。水素がニトロ基(−NO2)で置換された。
5.21-5.30
5.21
このような問題において、該当する単語の意味が判らないとき、教科書末尾の索引を引き、該当するページおよびその付近の内容を参照すること。
(解答例)
教科書にそのまま載っているものなので、ここでは省略。宿題の答えで「省略します/した」は不可。教科書末尾の索引を引き、該当するページおよびその付近の内容を参照すること。
5.22
問い 5.11 の考え方も参照すること。 Keq = [生成物]/[出発物] である。2つの状態の間に平衡があるとき、必ず、エネルギーの低い(=安定な)ものの割合が多くなる。
(解答例)
Keq < 1 より、ΔG° > 0 で吸エルゴン過程である。
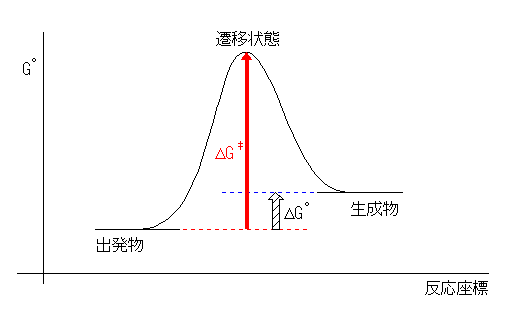
Keq < 1 なので、出発物より生成物の方が少ない。つまり、生成物のエネルギーは出発物のものよりも高い。
5.23
問い 5.22 と関連して考えること。
(解答例)
Keq > 1 より、ΔG°total < 0 で発エルゴン過程である。

Keq > 1 なので、分母より分子が大きい、すなわち、平衡において生成物を生じる側に有利である。つまり、出発物より生成物の方がエネルギー的に低い(安定である)。また、中間体は出発物や生成物よりもエネルギーが高い。以上の関係を満足していれば、他はどのように描いてもよい。たとえば、一つ目の山と二つ目の山は、どちらが高くても構わない。
5.24
問い 5.22、5.23 と関連して考えること。
(解答例)
(例)
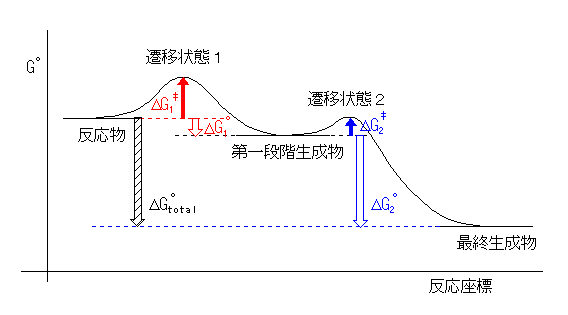
発エルゴン過程なので、ΔG°total < 0 である。また、
第二段階の方が、第一段階よりも速いから、
ΔG‡1 > ΔG‡2 の関係がある。ここで、(発展)に述べたことを応用すると、2段階とも発エルゴン過程である場合、更に ΔG°1 < ΔG°2 であることが予想できる(が、確定というわけではない)。
なお、この図では第一段階生成物(中間体)を、反応物(出発物)よりも低く書いているが、5.23 に描いたようなエネルギー図でも構わない。
(発展)
反応の活性化エネルギーは、同種の反応の間では、反応エネルギー差との間に相関があることが経験的に知られている。おおざっぱにまとめると、発熱反応においては、発熱量が多いほど(反応エネルギー差が大きいほど)活性化エネルギーは小さくなる傾向にあると言える。これをまとめたのが下図である。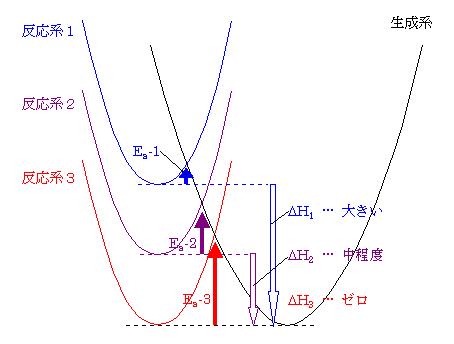
すなわち、経験的に、より発熱的である反応は(平衡が生成物よりに偏るだけではなく)反応速度も大きく、より反応が進行しやすい傾向にある。
5.25
問い 5.22、5.23、5.24 と関連して考えること。
(解答例)
(図は省略)宿題の答えで「省略します/した」は不可。
Keq = 1 なので、ΔG° = 0 である。すなわち、反応系と生成系が同じポテンシャルエネルギーを持つ。活性化エネルギーの高さは任意で構わない。一般的には 40〜150 kJ/mol の範囲(教科書 p154)。
5.26
教科書 §5.7 をよく読むこと。
(b) で問われている反応が自発的に進行するか否かは、ΔG° の符号により判定することができるが、ΔG° の値は、教科書 p149 にある式で、ΔH°、ΔS°、ならびに温度(室温、25℃の場合、T=298K を用いる)から計算できる。
(解答例)
(a) 反応が発熱的か吸熱的かは、ΔH° の符号より判定する。ここでは負の値であるから、反応前より反応後の方が低くなっている。つまり発熱的。
(b) 反応は、発エルゴン的(ΔG° の符号が負)のとき、自発的である。ここで、
ΔG° = ΔH° - TΔS°
の式から計算する。
ΔG° = (-44[kJ/mol])- 298[K]×(-0.12[kJ/Kmol])
= (-44[kJ/mol])- (-36[kJ/mol])
= -8 [kJ/mol]
よって、ΔG° < 0 なので、発エルゴン的で自発的な(有利な)反応である。
5.27
メタンと塩素の反応については、教科書 §5.3 を参照すること。
(解答例)
アルカンのラジカル塩素化反応は、「開始反応」「成長反応」および「停止反応」から成り立っている。このうち、開始反応は紫外線などのエネルギーにより塩素分子が均一的に開裂して塩素ラジカルを生じる段階であり、光が照射されている間は定常的に塩素ラジカルの供給源としてはたらく。一方、成長反応は光の照射を必要とせず、塩素ラジカルを触媒として反応が進行する。成長反応では、開始反応で生じた塩素ラジカルは消費されず、従って塩素ラジカルは停止反応のみで消費され、その濃度はゆっくりと減少する。
そのため、光を遮断したあとも、あらたには塩素ラジカルが供給されないので、停止反応により徐々に消費され反応は遅くなるが、はじめに開始反応により生じた塩素ラジカルは、いきなりはなくならずに、成長反応を触媒するため塩素化反応はゆっくりと進行する。
5.28
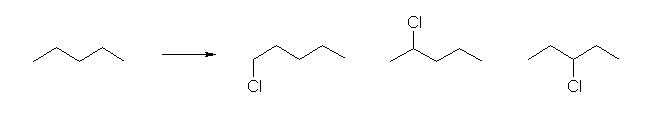
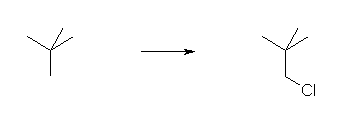
ペンタンから 1-クロロペンタンを得る場合の反応式を書いてみること。また、ネオペンタン(2,2-ジメチルプロパンの慣用名)を塩素化する場合の反応式を書いていること。
(解答例)
ラジカル塩素化は、一般的に反応の位置選択性があまりない。つまり、第1級水素であろうと、第2級水素であろうと、また、第3級水素であろうと、その反応性にほとんど差がない。((発展)の項も参照のこと。)
そのため、ペンタンを塩素化すると次式のように3種の生成物が、ほぼ 6:4:2 の比で(存在している同種の水素の数の比で)生じる。
一方、ネオペンタンの場合、すべての水素が同一の種類であるから、次式のようにモノ塩素化された化合物は1種類しか生じない。
(発展)
ラジカルハロゲン化の反応における反応エネルギー差は、結合解離エネルギー(教科書 p151 の表5.3)からおよそ見積もることができる。(教科書 §5.8 参照)
表 5.3 より、結合解離エネルギーを抜粋すると、次のようになる。
| H-Cl | 432 kJ/mol | |
| Cl-Cl | 243 kJ/mol | |
| H-Br | 366 kJ/mol | |
| Br-Br | 193 kJ/mol | |
| 第1級 | CH3CH2-H | 420 kJ/mol |
| CH3CH2-Cl | 338 kJ/mol | |
| CH3CH2-Br | 285 kJ/mol | |
| 第2級 | (CH3)2CH-H | 401 kJ/mol |
| (CH3)2CH-Cl | 339 kJ/mol | |
| (CH3)2CH-Br | 274 kJ/mol | |
| 第3級 | (CH3)C3-H | 390 kJ/mol |
| (CH3)C3-Cl | 330 kJ/mol | |
| (CH3)C3-Br | 263 kJ/mol |
全反応エネルギー差(上表より計算)すると次のようになる。
R-H + Cl-Cl → R-Cl + H-Cl
第1級水素:CH3CH2−H
ΔH° = [(−338)+(−432)] − [(−420)+(−243)] = −107 (kJ/mol)
第2級水素:(CH3)2CH−H
ΔH° = [(−339)+(−432)] − [(−401)+(−243)] = −127 (kJ/mol)
第3級水素:(CH3)3C−H
ΔH° = [(−330)+(−432)] − [(−390)+(−243)] = −129 (kJ/mol)
R-H + Br-Br → R-Br + H-Br
第1級水素:CH3CH2−H
ΔH° = [(−285)+(−366)] − [(−420)+(−193)] = −38 (kJ/mol)
第2級水素:(CH3)2CH−H
ΔH° = [(−274)+(−366)] − [(−401)+(−193)] = −46 (kJ/mol)
第3級水素:(CH3)3C−H
ΔH° = [(−263)+(−366)] − [(−390)+(−193)] = −46 (kJ/mol)
ハロゲンが共通であれば、反応する水素が第1級〜第3級で、反応熱は比較的似ているが、わずかに1級よりも2級および3級でやや大きいという結果になっている。また、ハロゲンが塩素の方が、臭素にくらべて大きく発熱的であることがわかる。
ただし、反応の位置選択性を議論する場合には、このような反応全体のエネルギー差で議論するよりは、教科書 p137 の成長反応の(a)のような、ハロゲンラジカルによりアルカンの水素引き抜きをする過程のみで議論した方がよいかもしれない。その場合は、単純に R-H の結合解離エネルギーを比較することで傾向が見えるであろう。その場合もやはり同様に、第1級、第2級、第3級となるにつれてやや切れやすくなる傾向にある。ただし、ラジカル塩素化のように反応が大きく発熱的である場合には、第1級、第2級、第3級とも、十分に速く反応してしまうため、この結合解離エネルギーの差が位置選択性にはほとんど影響しない。ラジカル臭素化では、条件によっては反応が緩和になり、第1級、第2級、第3級のアルキル水素の結合解離エネルギーの差が反応速度に差として影響を及ぼす(第1級より第2級、第2級より第3級の位置で優先して臭素化が進行する)場合があり得る。
5.29
問い 5.28 を参照すること。
(解答例)
(a), (c), (e), (f)
問題 5.28 で pentane をラジカル塩素化すると3種の混合物になると解説したように、一般的に、ラジカル塩素化は反応の位置選択性が乏しく、塩素化の対象となるアルカンに区別できるような水素(分子を回転させたりしても重ね合わせることができないような水素)があると、それぞれから生じるモノクロロ体は単一とはならない。
5.30
反応式をよく見て、反応の前後で変化しているところを探す。
(解答例)
解答例をみながら、ひとつの矢印ごとに、どこの電子が移動してどこに結合が生じたりしたのかを確認すること。
(a)
(b)
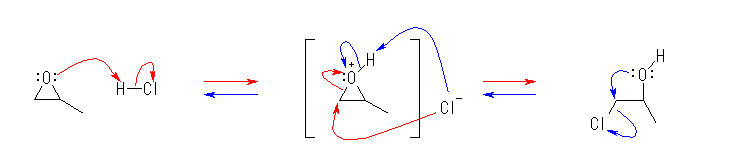
5.31-5.41
5.31
問い 5.30 などと同様に考えること。
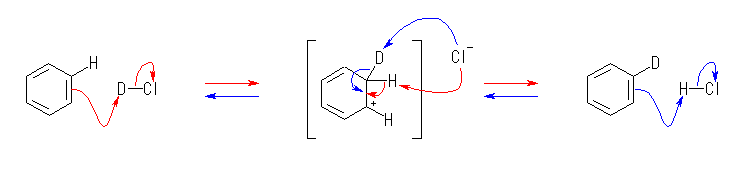
なお、D は、水素の同位体で、2H のことです。化学反応性を考える上では、1H と同じと考えてもらって結構です。化学的な反応性は似ていても、いくつかの方法では H と D を区別して扱うことができますので、どこで反応が起きたのかを知るための目印などとして用いられることがあります。このようなラベルの付け方を、同位体標識と言います。
重水素 D の天然の存在比は、水素全体の中で、約 0.015% とわずかですが、水 H2O に比べて重水 D2O の方が沸点が101.4℃と高いことから、比較的簡単に濃縮することができるので、高純度の同位体として入手しやすいもののひとつです。
(解答例)
解答例をみながら、ひとつの矢印ごとに、どこの電子が移動してどこに結合が生じたりしたのかを確認すること。
(a)
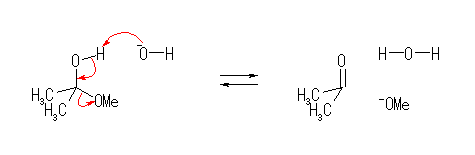
(b)
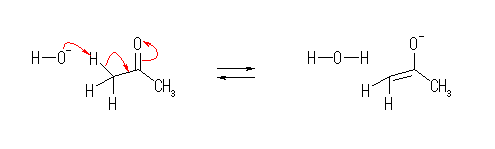
あらためて言うまでもないが、図中の -OMe は、-OCH3 を意味する。
5.32
(a) 平衡定数の定義は、教科書 p148 に書かれている。
(b) 室温で反応がゆっくりおこることから、活性化エネルギーの大きさをどの程度と見積もるかについては、教科書 p154 の記述を参考にすること。
教科書 p154 「一般に多くの有機反応は、40〜150 kJ/mol の範囲の活性化エネルギーをもっている。 … 中略 … 活性化エネルギーが 80 kJ/mol 以下の反応は室温またはそれ以下でも起こり、これより高いエネルギーの場合には加熱が必要となる。」
(c) 「定量的な」エネルギー図を描くためには、活性化エネルギーの大きさの他、反応エネルギー変化も知る必要がある。後者は、平衡定数が既知であれば、そこから計算できる。
なお、ある反応に伴うエネルギー差とは、始めの状態に対して最終的にどうなったのか(上がったのか、下がったのか)ということなので、符号が意味をもつ。従って、反応のエネルギー図の中に「反応エネルギー(差)」や、「活性化エネルギー」を書き込む場合に、この符号も含めて書き込む必要がある。すなわち、大きさを表すだけの両矢印(⇔)ではなく、方向性を持った矢印で表さなければならない。
(解答例)
(a) Keq = [生成物] / [出発物] = 0.70 / 0.30 = 2.3
(b) ΔG‡ は、およそ 80 kJ/mol 程度と考えられる。(ヒント参照)
(c) ΔG° = −RT ln ( Keq ) = −8.3145 × 298 × 0.847 J/mol = −2.1 kJ/mol の値を用いる。
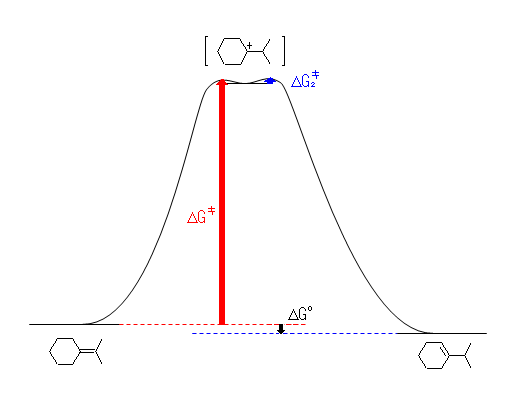
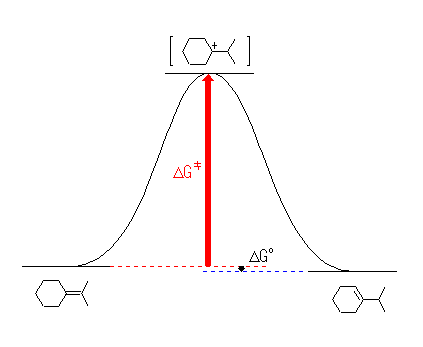
カルボカチオン「中間体」は、厳密には遷移状態ではないから、エネルギーの極小点として描くのが正しい。図中、青で示した活性化エネルギー(中間体であるカルボカチオンが生じたあと、生成物に変化する段階の活性化エネルギー)は、赤のものよりずっと小さいから速やかに反応するため、赤で示した活性化エネルギーが反応全体の速度を決める。別の表現を使うなら、カルボカチオンを生じる過程が律速段階である。従って、(b)のおよそ 80 kJ/mol という値は、赤の矢印に相当する高さである。
厳密には正しいわけではないが、全体としてのエネルギー関係を大まかに捉えるための近似として、中間体と遷移状態にほとんど差が無いという仮定をしてしまうことがある。これにより、図を簡略化することができる(次図)。ただし、この簡略化した図は、あくまでも上で描いたような「正しい」図が理解できることを前提として用いなければならない。
5.33
反応式をよく見て、反応の前後で変化しているところを探す。
(解答例)
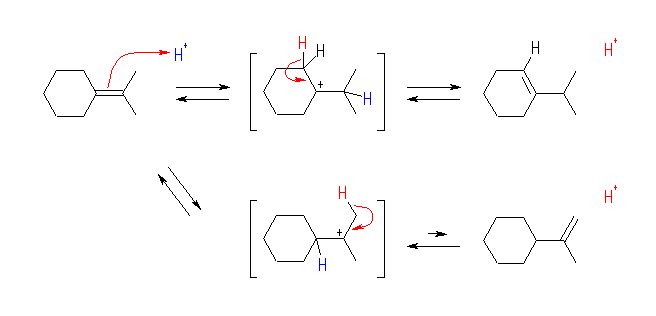
isopropylidenecyclohexane へのプロトン付加により、いずれも3級である2種類のカルボカチオンが生じる。下段のカルボカチオンからは、isopropylidenecyclohexane へ戻る過程(左)と、isopropenylcyclohexane を生じる過程(右)が考えられる。しかし、二重結合に多くのアルキル基の置換したアルケンの方が安定であるため、2置換の isopropenylcyclohexane を生じる(右)のではなく、isopropylidenecyclohexane へ戻る(左)のが主となる。(教科書 §11.7(pp372- 374)では、アルキル置換基の数とアルケンの安定性に関連した、Zaitsev 則について述べられている。これは、ハロゲン化アルキルからの脱離反応によりオレフィンを得る際の位置選択性について述べた一般則である。)
(発展)
alkane より水素を一つ除いて遊離原子価のある(結合する余地を残す)炭素をもつものが alkyl 基であった。(例: methane → methyl, ethane → ethyl)
語尾が -yl の1価のアルキル基から、その同一の遊離原子価炭素から水素を、さらに1つまたは2つ取り除いてできる置換基(2価基、3価基)は、語尾を -idene, idyne とする。
| 炭素数 | 1価基 | 2価基 | 3価基 |
|---|---|---|---|
| 1 | −CH3, methyl | =CH2, methylene * | ≡CH, methylidyne |
| 2 | −CH2CH3, ethyl | =CHCH3, ethylidene | ≡CCH3, ethylidyne |
| 3 | −CH2CH2CH3, propyl | =CHCH2CH3, propylidene | ≡CCH2CH3, propylidyne |
| (2) | −CH=CH2, vinyl | =C=CH2, vinylidene | − |
| (3) | −CH(CH3)2, isopropyl | =C(CH3)2, isopropylidene | − |
5.34
問い 5.32 などを参照すること。
(解答例)
(a) 第1段階は第2段階より遅く、第2段階は第3段階よりさらに遅いので、活性化エネルギーの大小関係は、以下のようになる。
ΔG‡1 > ΔG‡2 > ΔG‡3
ここで、反応は室温でゆっくり進行するのだから、これらの中で一番大きな値であるような 活性化エネルギーは、およそ 80 kJ/mol 程度と考えられる。
また、平衡定数はおよそ1であるから、ΔG°total = −RT ln ( Keq ) = 0 kJ/mol で、出発系と生成系のエネルギーは、ほぼ同じである。
(b)
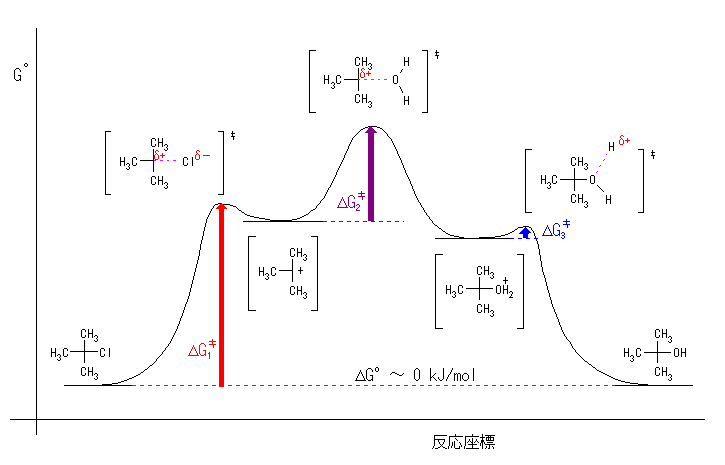
図中の遷移状態でピンクの破線で示したのは、結合ができはじめ、あるいは切れはじめの状態を表している。この図では、二番目の中間体のエネルギーの方が、最初の中間体のエネルギーよりわずかに低く描かれているが、現段階では、2つの中間体のうちどちらが安定であるかという情報は無いので、どちらで描いてもよい。
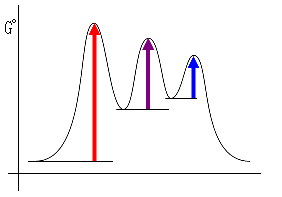
たとえば、次のような形でも,
ΔG‡1 > ΔG‡2 > ΔG‡3
を満たし、かつ、平衡定数がおよそ1であること(ΔG°total = −RT ln ( Keq ) = 0 kJ/mol)と合致する。
5.35
反応式をよく見て、反応の前後で変化しているところを探す。
(解答例)
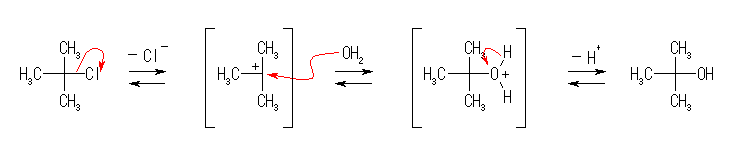
教科書の問いでは、2番目の中間体からプロトンが脱離する段階は、別の水分子がルイス塩基としてはたらき、H+ ではなく、H3O+ の形で脱離するように表記している。その場合は、水分子の酸素の孤立電子対から発し、脱離すべき水素へ向かう曲がった矢印を追加する。
5.36
ΔG° = ΔH° - TΔS° の関係式を用いる。計算時に、単位(kJ と J )を混同しないように注意すること。
(解答例)
ΔG° = ΔH° - TΔS°
= (−75 [kJ/mol]) − 298 [K] × (+54 [J/K mol])= −91.1 kJ/mol
ΔH°、ΔG° ともに負であるから、発熱的で、発エルゴン的である。
5.37
反応式をよく見て、反応の前後で変化しているところを探す。
(解答例)
開裂する結合と生成する結合については、それぞれ確認しておくこと。ここでは詳細は省略。
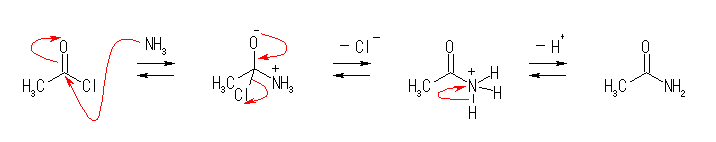
5.38
(a) (初めに書かれた構造と異性体の = 初めに書かれた構造と同じ分子式を持つ)カルボカチオンと水の反応によって、生成物の α-テルピネオール が生じている。したがって、α-テルピネオール中の水酸基は、水由来である。水分子のもつ分極を考えたとき、一般に水分子がカルボカチオンと反応するときに、どのような形式の反応になると考えられるかを考えること。それにより、「水との反応により α-テルピネオールを与える」ようなカルボカチオンの構造が決まる。
(b) 次いで、反応式をよく見て、反応の前後で変化しているところを探す。
(解答例)
水分子の酸素は δ- に分極しているから、カルボカチオンの正電荷をもつ炭素と結合する。
例) CH3CH2+ + H2O → CH3CH2OH2+ → CH3CH2OH + H+
これにより直接生成するのは、プロトン化したアルコールで、更に脱プロトン化することでアルコールを与える。したがって、水との反応で α-テルピネオールを与えるようなカルボカチオンは、生成物において水酸基が結合している位置が正電荷となっており、それ以外は生成物と同じ骨格をもつカルボカチオンである。これを踏まえて反応機構をすべて書き下すと次図のようになる。
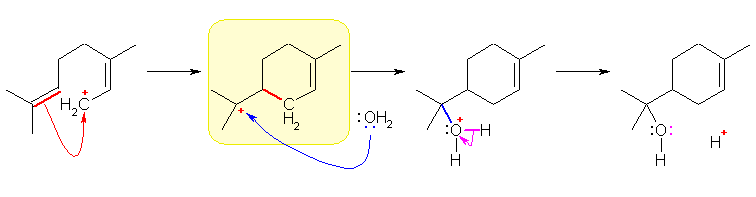
薄く黄色の背景をつけた構造が、(a) の答え。
はじめのカルボカチオンの構造が異性化していく反応を、次の図で説明する。
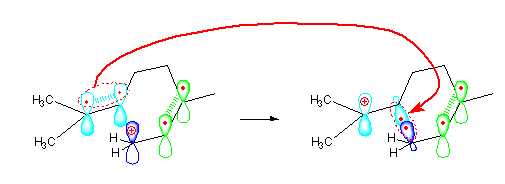
二重結合に関与する炭素は、sp2 混成で、その p 軌道を水色と黄緑で表した。これら隣接する p 軌道は、電子を1つずつもち、隣りから重なって π 結合となっている。また、青の位置はカルボカチオンの正電荷の位置で、やはり sp2 混成をしている。p 軌道は空である。図では形式電荷の + を丸付きで書き込んである。
曲がった矢印で描く場合には、π 結合に関与した2つの p 電子を、新たに σ 結合ができる位置に移動させるようにする。水色の2つの p 軌道に入っていた電子対は、水色の一方、および青色の変化して生じる σ 結合性の軌道の中に入っていく。(このときの混成状態は、あらたに σ 結合が生じるのにあわせて sp3 混成になっていく。)
5.39
曲がった矢印の表現による電子対の移動(結合の開裂と新しい結合または電子対の生成)が、構造式のどこで生じているのかを確認すること。
(解答例)
(a) 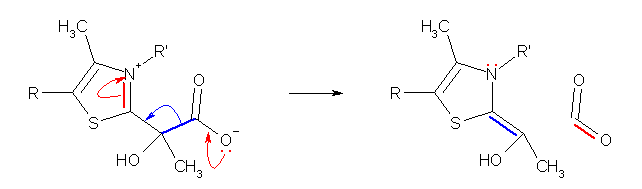
(b)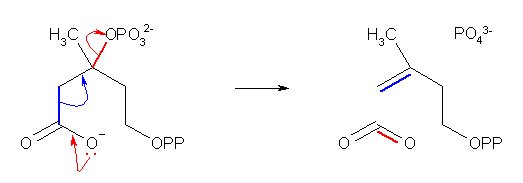
(c)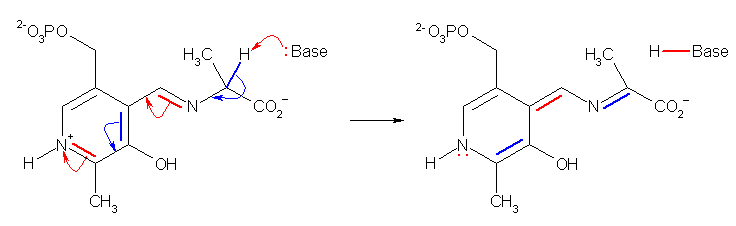
5.40
no hint
(解答例)
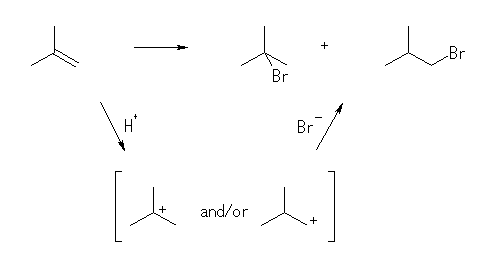
組み合わせとしては、2-bromo-2-methylpropane および 1-bromo-2-methylpropane とが生じる可能性がある。しかし、反応機構を考えると、中間体としてカルボカチオンを経由するために、より安定なカルボカチオン(3級のカルボカチオン)から生じる 2-bromo-2-methylpropane が主生成物となると考えられる。
5.41
no hint
(解答例)
5.40 の解答例に併せて示した。