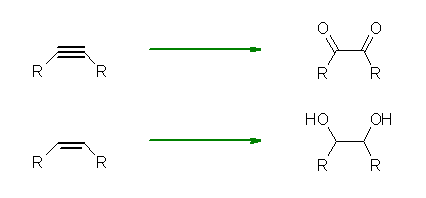
8.01-8.10
8.01
多重結合をふくむ中で一番長い部分が主鎖。目で見ただけでは間違うから、はじめは、確認のために両端をそれぞれ1となるようにして2通りの方法で番号を振ってみよ。ついで、そのうちのどちらが正しいかを判断せよ。まず、はじめにでてくる多重結合の位置番号が小さくなるように選ぶ。すべての多重結合の位置番号が同じになる場合は、三重結合より二重結合を優先させる。それでも2通り選ぶことができる場合には、置換基の事情を考慮する。初めの置換基の位置番号が小さくなるように番号をつける。
(解答例)
英語で表記できること。
(a) 2,5-dimethylhex-3-yne [2,5-ジメチルヘキサ-3-イン]
(2,5-dimethyl-3-hexyne [2,5-ジメチル-3-ヘキシン])
左右どちらから数えても同じ構造。
(b) 3,3-dimethylbut-1-yne [3,3-ジメチルブタ-1-イン],
(3,3-dimethyl-1-butyne [3,3-ジメチル-1-ブチン])
三重結合の位置番号が小さくなるように、図左より番号をつける。
(c) 3,3-dimethyloct-4-yne [3,3-ジメチルオクタ-4-イン],
(3,3-dimethyl-4-octyne [3,3-ジメチル-4-オクチン])
左右どちらから数えても、oct-4-yne となるから、初めの側鎖置換基の位置番号が小さくなるように図左より番号をつける。
(d) 2,5,5-trimethylhept-3-yne [2,5,5-トリメチルヘプタ-3-イン],
(2,5,5-trimethyl-3-heptyne [2,5,5-トリメチル-3-ヘプチン])
三重結合の位置番号が小さくなるように図右より番号をつける。
(e) 6-isopropylcyclodecyne [6-イソプロピルシクロデシン],
または、6-(1-methylethyl)cyclodecyne [6-(1-メチルエチル)シクロデシン]
イソプロピル基の番号が小さくなるように、図では時計回りに番号をつける。なお、他に優先度の高い官能基を持たないシクロアルキンなので、環の1,2の位置に三重結合があることは、明示的に示されなくてもあきらかなため、三重結合の位置番号を示す -1- は省略されている。
(f) octa-2,4-dien-6-yne [オクタ-2,4-ジエン-6-イン],
(2,4-octadien-6-yne [2,4-オクタジエン-6-イン])
どちらから数えても、全ての多重結合で同じ番号となるから、二重結合を優先して番号をつける。
多い間違い 2,4-octadiene-6-yne 数字を挟んでいるため見落としがちだが、次に母音ではじまる「yne」がつづくため、e を落とさなければいけない。
8.02
不飽和度を計算すると2だから、分子内に三重結合があるとすると、これ以外の多重結合や環構造はない。
したがって、炭素数6の飽和炭化水素について構造異性体を書き、そのそれぞれについて三重結合を適当な位置にいれるなどすればよい。
(解答例)
まず、炭素数6の飽和炭化水素、hexane の構造異性体
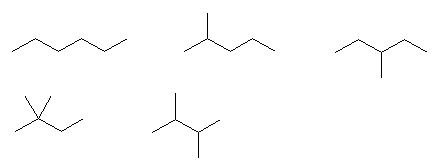
hexane, 2-methylpentane, 3-methylpentane
2,2-dimethylbutane, 2,3-dimethylbutane
のそれぞれについて、三重結合を導入することを考える。
hexane 由来のものとして
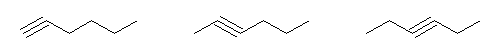
hex-1-yne, hex-2-yne, hex-3-yne
2-methylpentane, 3-methylpentane 由来のものとして
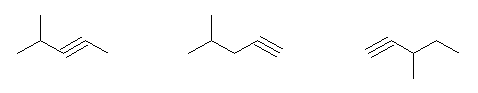
4-methylpent-2-yne, 4-methylpent-1-yne, 3-methylpent-1-yne
2,2-dimethylbutane 由来のものとして
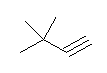
3,3-dimethylbut-1-yne
あるいは、別の方法
主鎖が hexyne であるもの

hex-1-yne, hex-2-yne, hex-3-yne
主鎖が pentyne であるもの
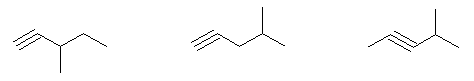
3-methylpent-1-yne, 4-methylpent-1-yne, 4-methylpent-2-yne,
主鎖が butyne であるもの
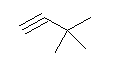
3,3-dimethylbut-1-yne
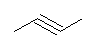
2-butyne を主鎖にしてしまうと、側鎖がもてない。(三重結合の sp 炭素は置換基を1つしか持たない。1,4-位の炭素にアルキル基が結合している場合は、主鎖が butyne より長くなる。)
8.03
(b), (c) はマルコフニコフ配向性に従った位置特異性で反応は進行する。
(解答例)
(a) 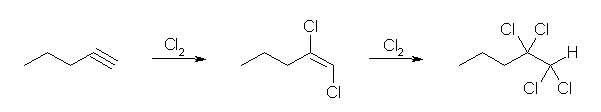
pent-1-yne からは、1,1,2,2-tetrachloropentane が生じる。
(b) 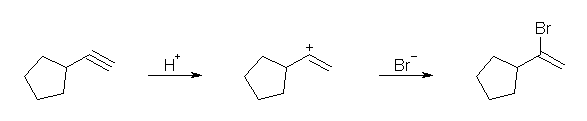
ethynylcyclopentane からは、ビニル型カルボカチオンを経由して (1-bromovinyl)cyclopentane が生じる。
(c) 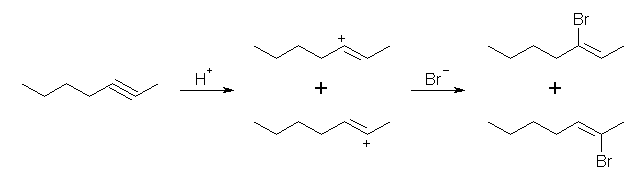
hept-2-yne からは、安定性の等しい2種のビニル型カルボカチオンを経由するので、2-bromohept-2-ene と 3-bromohept-2-ene の混合物を与える。
8.04
アルキンへの水和には、アルケンへの水和と異なり水銀イオンが触媒として必要である。しかしながら、形式的にはアルケンへの水和と同様の酸触媒の機構と同様に考えてよい。
アルケンの場合は2つの sp2 炭素に結合しているアルキル基の数により、どちらにプロトンが結合していくかで異なる級数のカルボカチオンを生じる場合があり、より安定なカルボカチオンを生じる経路で反応が進行する。
アルキンの場合は、末端アルキンでは2つの sp 炭素のどちらにプロトンが結合するかで、生じるカルボカチオンの安定性は異なるが、内部アルキンの場合、2つの sp 炭素にアルキル基が1つずつ結合しているわけだから、生じるカルボカチオンの安定性に差はないことになる。
アルキンへの水和で生じるエノールは、速やかにケト体に互変異性化するのが一般的である。
(解答例)
内部アルキンでは、反応中間体のビニル型カルボカチオンで、三重結合のどちらに(形式的な)正電荷が生じても、その安定性に差がないから、一般的には反応混合物を与えることになる。
(a) 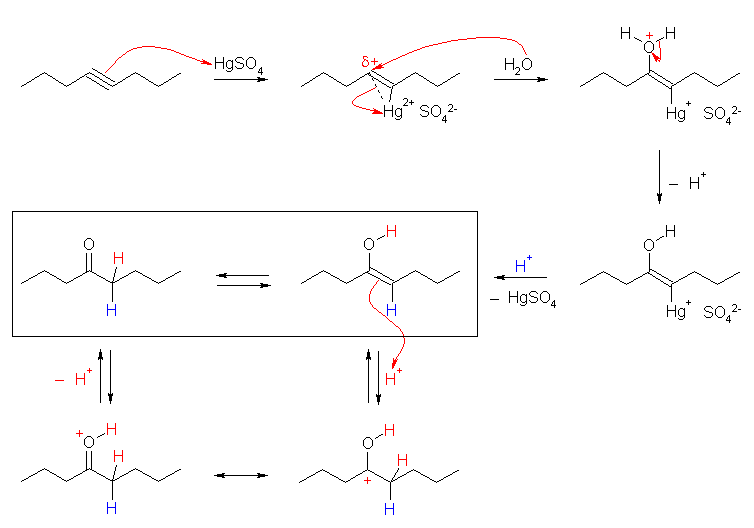
oct-4-yne は左右対称なアルキンだから、反応の位置に関係なく同じ生成物となる。
この図では、水銀イオンによる触媒の機構を、教科書の図 8.3 を参考にして示した。水銀がプロトンで置換されて生じるエノールは、互変異性化によりケト体を生じる(上図、枠内)。
この互変異性化は、酸、塩基のどちらによっても触媒されるが、上図では酸触媒での機構を示した。エノールにプロトンが付加すると水酸基の結合した炭素上に正電荷をもつカルボカチオン(最下段、右)が生じる。このカルボカチオンは、プロトン化されたケトン(最下段、左)と共鳴の関係にある。
(b) 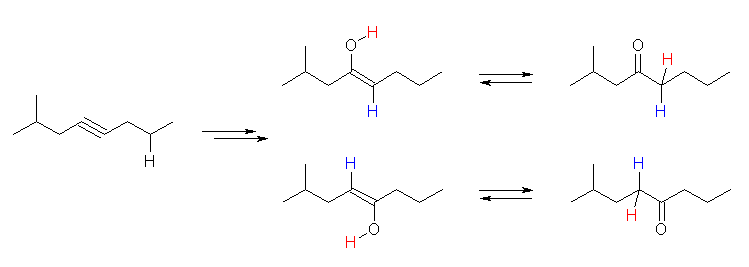
2-methyloct-4-yne は左右非対称な内部アルキンだから、2種のケトンの混合物を与える。
8.05
問い 8.4 と同様に考える。
(解答例)
(a) 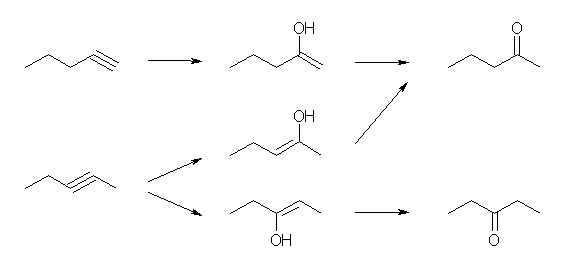
pent-1-yne は末端アルキンだから、ただ1種の生成物を与える。直接の生成物は pent-1-en-2-ol だから、このエノールが互変異性化して pentan-2-one を生じる。
pent-2-yne も、最終的に pentan-2-one を生じるが、pentan-3-one との混合物を与える。
(b) 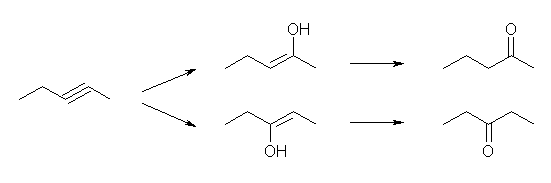
(a) でも述べたように、pent-2-yne は、pentan-2-one と pentan-3-one の混合物を与える。
水和とそれにつづく互変異性化によって pentan-3-one のみを選択的にあたえるアルキンは存在しない。
8.06
アルキンへのヒドロホウ素化による水和は、アルケンへのヒドロホウ素化による水和と同じように逆マルコフニコフ配向の位置選択性で進行する。この意味で、この反応は硫酸水銀を触媒とした水和と相補的である。しかし、非対称な内部アルキンを出発物質とする場合、2種の混合物を与える点は同じである。
また、生じたエノールがケト体に互変異性化するのも、硫酸水銀を触媒とした水和と共通である。ただし、末端アルキンの反応のときには、比較的立体障害が小さいから二重にヒドロホウ素化される。その酸化、加水分解でアルデヒドを生じるのだが、末端アルキンの1段のヒドロホウ素化により生じるエノールが互変異性化したと考えても同じ生成物になる。
(解答例)
(a) 
(b) 
8.07
(a) と (b) では、アルキンに対して異なる位置選択性での水和である。従って、出発物質だけではなく、反応条件(硫酸水銀を触媒として用いる水和なのか、ヒドロホウ素化−酸化を経由する反応なのか)も検討すること。
(解答例)
(a) 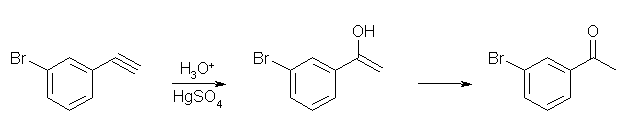
(b) 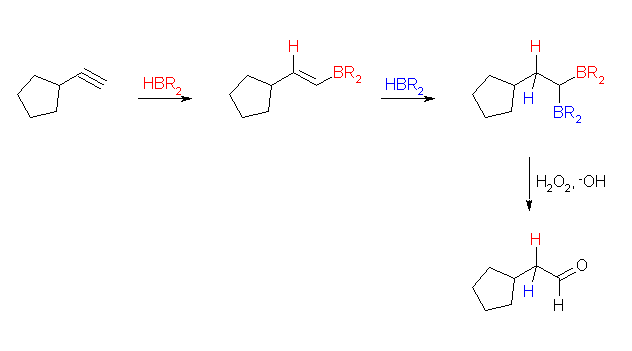
8.08
シス、トランスを作り分けるために、反応条件(試薬の種類等)を選択する必要がある。
(解答例)
原料となるアルキンは、生成物のアルケンの二重結合の位置がそのまま三重結合になっているもの。
リチウム-アンモニア還元では熱的に安定なトランス体を与え、 Lindlar 触媒を用いた接触水素化では反応がシン付加で進行するからシス体を与える。
(a) 2-octyne を Li/NH3 の条件で還元する。
(b) 3-heptyne を Lindlar 触媒を用いて接触水素化する。
(c) 3-methyl-1-pentyne を還元する。条件は、 Li/NH3 を用いても、 Lindlar 触媒を用いた接触水素化でも、どちらでもかまわない。
8.09
2章で学んだことを思い出すこと。弱酸の塩と強酸を混ぜると、弱酸は遊離し、強酸は塩を生じる。
(解答例)
この選択肢の中では、(b) のみがアセトンからプロトンを引き抜く。
アセトン( pKa = 19.3)からプロトンが引き抜かれて生じるのは、当然ながら、アセトンを酸としてみたときの共役塩基である。
(a) KOH の共役酸である H2O は、酸性度定数として pKa = 15.7 を持つから、アセトン( pKa = 19.3)より強酸である。従って、 KOH は相対的に強い酸の塩、アセトンは弱酸であるから、KOH でアセトンからプロトンを引き抜くことはできない。
(b) アセチレン HC≡CH は、酸性度定数として pKa = 25 を持ち、アセトンよりも相対的に弱い酸である。従って、ナトリウムアセチリド Na+ -C≡CH は相対的に弱酸の塩、アセトンは強酸ということになるから、これらを混合すると、弱酸であるアセチレンが遊離し、アセトンからはプロトンが引き抜かれた共役塩基 CH3C(=O)CH2- が生じる。
(c) 炭酸水素ナトリウムの共役酸である炭酸 H2CO3 は、酸性度定数として pKa = 6.4 を持つから、アセトン( pKa = 19.3)よりかなり強い酸である。従って、強酸の塩である NaHCO3 は、弱酸であるアセトンからプロトンを引き抜くことはできない。
(d) NaOCH3 の共役酸である CH3OH は、酸性度定数として pKa = 15.6 を持つから、アセトン( pKa = 19.3)より強酸である。従って、相対的に強い酸の塩である Na+-OCH3 は、弱酸であるアセトンからプロトンを引き抜くことはできない。
(発展)
塩基としての反応は H+ に対しての攻撃であり、求核反応は C+ に対する攻撃で起きる。したがって、塩基性の強さと求核性の強さにはある程度の相関があり、塩基性をもつ分子種は多かれ少なかれ求核性を併せ持つ。従って、塩基としては十分に強くても、求核攻撃が優先しておきてしまうようなものも原理的にありえる。
8.10
教科書 8.8 節参照。アセチリドアニオンのアルキル化は、第1級の臭化アルキルまたはヨウ化アルキルに限られることに注意すること。
(解答例)
(a) hex-2-yne
pentyne + bromomethane, propyne + bromopropane の2通りが考えられる。
(b) 2-methylhex-3-yne
3-methylbut-1-yne + bromoethane の組み合わせが適当である。
but-1-yne + 2-bromopropane の組み合わせでは、第2級のハロゲン化アルキルなので適用できない。
(c) 1-cyclohexylpropyne または、prop-1-ynylcyclohexane
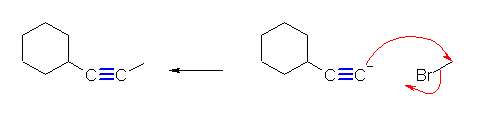
ethynylcyclohexane + bromomethane の組み合わせが適当である。
propyne + bromocyclohexane の組み合わせでは、第2級のハロゲン化アルキルなので適用できない。
(発展)
第1級の臭化アルキルまたはヨウ化アルキルに限られる理由については、教科書の11章で詳しく学びます。簡単にいうと、置換の際に脱離すべきハロゲンが結合した炭素が第1級の場合、その炭素上、ハロゲン以外は、水素2つとアルキル基が結合しているのですが、第2級では、水素1つとアルキル基2つになります。そうなると、アセチリドアニオンがその炭素原子に対して攻撃しようとしても、立体的に混みあっているために簡単には近づけないのです。
そのため、目的物を与えるような反応(求核置換反応)は、速度が遅くなってしまいます。そのとき、別の反応も起きるために、競争で負けてしまうわけです。
競争の相手となる別の反応とは、HBr の脱離反応です。(このとき、ハロゲン化アルキルに対応したアルケンが得られます。アセチリドアニオンは、プロトンを得て、もとのアルキンに戻ってしまいます。)これは、アセチリドアニオンが、ハロゲンの結合した位置の隣の炭素上の水素原子に対して、塩基として働くような反応です。これが第2級、第3級のハロゲン化アルキルを用いたときに主反応となってしまうのは、1)水素原子は炭素原子よりも外側から近づきやすいことと、2)第2級、第3級と級数があがるに従って、水素原子がプロトンとして抜けたあとのカルボカチオンがより安定であること(従って、水素の酸性度が高く、塩基によって引き抜かれやすい)、などの理由によります。(厳密には、E2機構を考える場合、カルボカチオンを生じるわけではなく、協奏的に反応が進行することになります。)
8.11-8.20
8.11
プロピン(末端アルキン)とハロゲン化アルキルからは、内部アルキンを合成することができる。また、問題 8.8 のように、アルキンからアルケンを合成することができる。
また、このような問題では逆合成という手法で考える。すなわち、まず、目的の生成物を与えることのできる前駆物質は何かを考え、次に、その前駆物質を与えることのできる物質は何かを考えるというように、目的物質からひとつずつ遡っていって出発物質に至る考え方である。
(解答例)
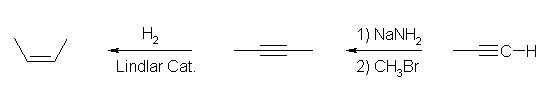
プロピンから生じさせたアセチリドアニオンを求核種としてブロモメタン、またはヨードメタンと反応させて but-2-yne を得る。この後、Lindlar 触媒による接触水素化反応で、シン付加により三重結合をシス体の二重結合に還元するとよい。
8.12
いくつかの目的化合物は、一段階では合成することができない。逆合成の方法で考えればよい。
(解答例)
(a) cis-oct-4-ene
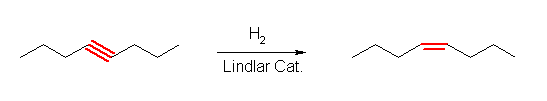
Lindlar 触媒を用いた接触水素化反応で、シン付加によりシス体のアルケンが得られる。( trans- 体は、液体アンモニア中のリチウムによる還元で得られる。)
(b) butanal
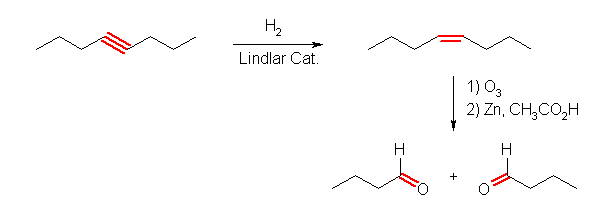
cis- または trans-oct-4-ene としたのち、アルケンのオゾン開裂することにより目的のアルデヒドが得られる。
(c) 4-bromooctane
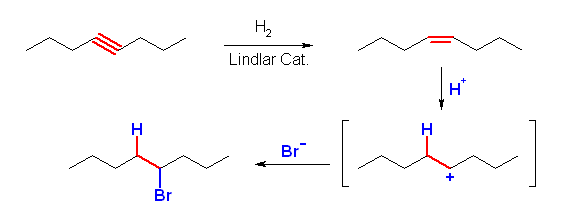
cis- または trans-oct-4-ene に HBr を付加させればよい。
(d) octan-4-ol
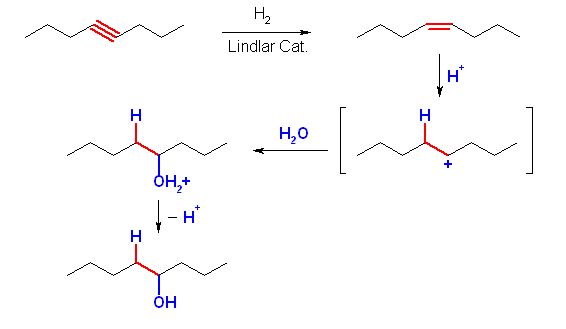
cis- または trans-oct-4-ene を水和すればよい。上図では酸性水溶液中の反応として描いたが、この水和では左右対称だから位置選択性について考慮しなくてよいから、オキシ水銀化法( 1) Hg(OAc)2, H2O, 2) NaBH4 )、ヒドロホウ素化法( 1) BH3, 2) H2O2, -OH )のいずれを用いてもよい。
(e) 4,5-dichlorooctane
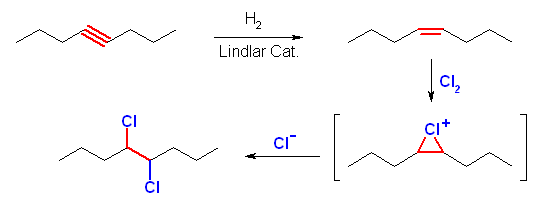
cis- または trans-4-octene に Cl2 を付加させればよい。
(f) butanoic acid
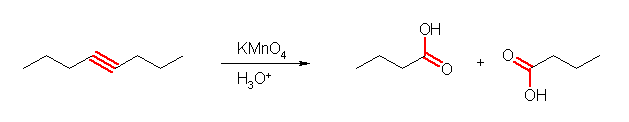
対称なアルキンの酸化的開裂により、2分子のカルボン酸を得ることができる。(ここでは、アルキンを直接酸化開裂させているが、主に収率的な観点から、過マンガン酸カリウムによる反応を避けるためには、(b) と同様、cis- または trans-oct-4-ene とし、オスミウム酸化によってジオール octane-4,5-diol としたのち、過ヨウ素酸による酸化開裂を行ってもよい。)
8.13
(a) 炭素数が 10 のアルキンを接触水素化すれば、同じ炭素数のアルカン、すなわちデカンを与える。では、アセチレンから炭素数が 10 のアルキンを得るためにはどうすればよいか。
(b) 2,2-dimethylhexane 中には4級の炭素がある。アルキンやアルケンの sp および sp2 炭素に直接アルキル基を導入するような反応は、これまでに習っていないから、この部分は「ハロゲン化アルキル」として導入してしまうのが簡単である。
(c) アルデヒドは、末端アルキンの水和(条件を選ぶこと)によって得ることができる。
(d) ケトンは、アルキンの水和によって得ることができる。反応の位置選択性に注意して前駆体となるアルキン、および水和の条件を選ぶこと。
(解答例)
(a) decane
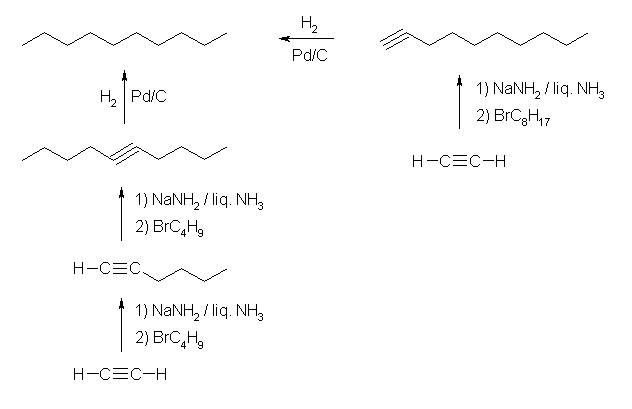
末端アルキン、内部アルキンのいずれも、パラジウムなどを触媒とした接触水素化反応でアルカンを与えるから、アセチレンから、アセチリドアニオンのアルキル化で炭素数10のアルキンを合成すればよい。アセチレンと 1-bromooctane の反応により末端アルキンを与える過程が一番反応段階数が少なくて済む。
(b) 2,2-dimethylhexane
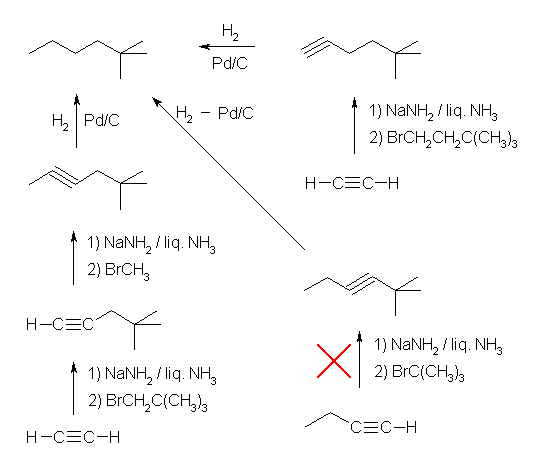
5,5-dimethylhex-1-yne, 5,5-dimethylhex-2-yne, 2,2-dimethylhex-3-yne のいずれもパラジウムなどを触媒とした接触水素化反応で合成することができるが、アセチリドアニオンのアルキル化反応では用いることができるハロゲン化アルキルは第1級のものに限られるから、2,2-dimethylhex-3-yne はこの方法で合成することは出来ない。
(c) hexanal
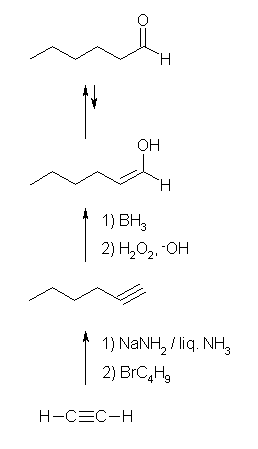
末端アルキンを、逆マルコフニコフ配向性で水和すると alk-1-en-1-ol が生じる。これはケトエノール互変異性化反応によりアルデヒドを与える。従って、hex-1-yne をヒドロホウ素化法で水和すればよい。
別解として、対応するアルケン(中央に二重結合のある C12 のアルケン)をオゾン酸化等で開裂する方法もOKです。これにより、2分子のアルデヒドが得られますが、左右対称のアルケンを材料とすると、単一の生成物を与えることになります。ただし、アルキンのまま酸化開裂させるとカルボン酸を与えるので、アセチレンをアセチリドアニオンにしたのち2分子の 1-bromopentane と反応させることでアルキル化し dodec-6-yne を合成後、二重結合までの部分的な還元(Li/liq-NH3、または、Lindlar 触媒下の接触水素添加)をする必要があります。また、アルケンの酸化開裂の条件は、酸性の過マンガン酸カリウムを用いた場合はやはりカルボン酸までいってしまうので、オゾン酸化とする必要があります。(冷アルカリ性の過マンガン酸カリウム、または、四酸化オスミウムを用いた酸化で隣接ジオール dodecane-6,7-diol としたのち、過ヨウ素酸で切ってもよいです。)
(d) heptan-2-one
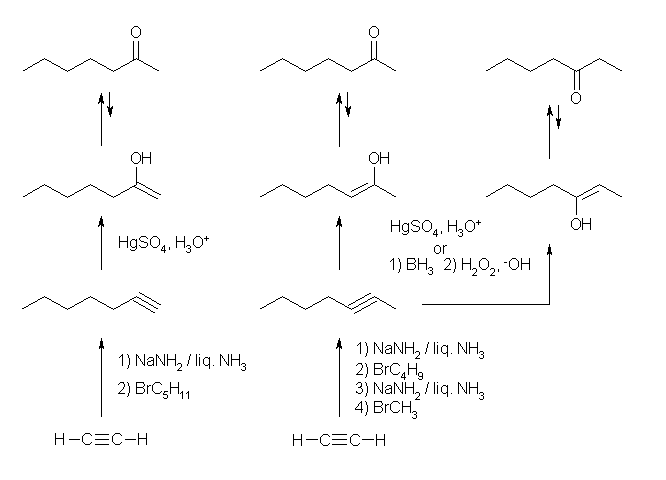
末端アルキンを、マルコフニコフ配向性で水和すると alk-1-en-2-ol が生じる。これはケトエノール互変異性化反応によりメチルケトンを与える。従って、hept-1-yne を硫酸水銀触媒の下で水和すればよい。
内部アルキンは、ヒドロホウ素化法による水和でも、硫酸水銀触媒による水和でも(2つの sp 炭素の級数に差がないから)反応に位置選択性は出ない。このため、hept-2-yne は、いずれの方法によっても 2- および 3-heptanone の混合物を与える。合成の方法としては(他に選択肢の無い限り)好ましくない。
8.14
命名は、アルキル側鎖より、多重結合の番号が小さくなるように番号を振る。
i) 、ii) の反応条件の反応を覚えていない場合は、章末の「反応のまとめ」でさがすこと。
(解答例)
(i) Lindlar 触媒による接触水素化反応では、シン付加によりシス体のアルケンを与える。
(ii) が硫酸水銀触媒による水和は、マルコフニコフ配向性で進行し、ビニルアルコールを与えるが、つづいてケト−エノール互変異性化を起こしてカルボニル化合物を与える。
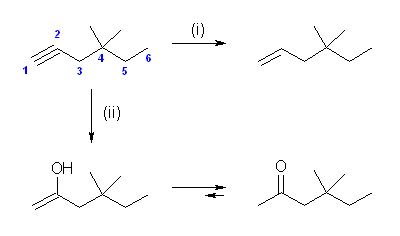
(a) 4,4-dimethylhex-1-yne
→ (i) 4,4-dimethylhex-1-ene
→ (ii) 4,4-dimethylhexan-2-one
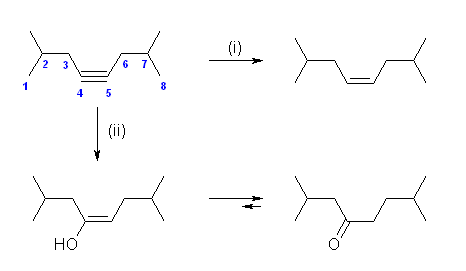
(b) 2,7-dimethyloct-4-yne
→ (i) cis-2,7-dimethyloct-4-ene
→ (ii) 2,7-dimethyloctan-4-one
8.15
原料となるアルキンだけではなく、反応の位置特異性も考慮して反応条件も選定すること。
(a) アルデヒドは、アルキンの水和により生じた alk-1-en-1-ol のケト−エノール互変異性化による生じる。
(b) 1,2-dichloroalkane はアルケンへの Cl2 の付加で生じるが、アルキンへの2分子の HCl の付加で gem-dichloroalkane を生じることができる。
(解答例)
(a) 4-methylpentanal ← 4-methylpent-1-yne
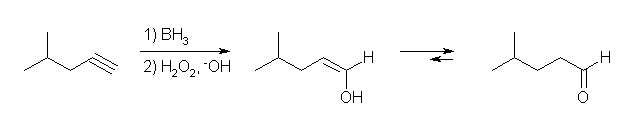
逆マルコフニコフ配向性での反応が必要だから、ヒドロホウ素化法での水和を行う。
(b) trans-1-(1,1-dichloroethyl)-2-methylcyclohexane ← trans-eth-1-ynyl-2-methylcyclohexane
HCl がマルコフニコフ配向性で付加すればよい。
8.16
まずは与えられた図を構造式に描き直してみること。(a)、(b) ともに炭素数は6の化合物だから、炭素−炭素結合の過程を含む必要がある。
いずれも多段階の合成が必要であるから、逆合成の手法で考えること。最終的な目的化合物を与えることができる1つ前の段階の化合物を考え、更にその化合物を与えるようなものを考える。最終的に炭素4以下の化合物に行き着けば正解である。
一般的に逆合成の手法で考える場合、目的の最終生成物から出発物質につながる過程はただ一つとは限らない。さまざまな合成についての知識が増えれば増えるほど、考え付くことのできる選択肢は増えるので、より良い(収率が良いだとか、安価な試薬を用いることができるだとか、実験操作が簡単であるとか。)合成法に辿り着くことが可能となる。
(解答例)
(a) 1-cyclopropylpropan-2-ol
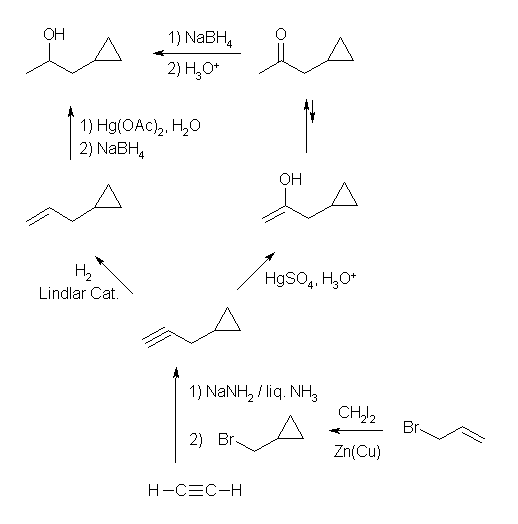
第2級のアルコールを合成するためには、アルケンに水和したり、ケトンの還元によって合成することができる。アルケン、ケトンともに同じアルキンから出発して得ることができる。
(b) hex-5-en-2-one
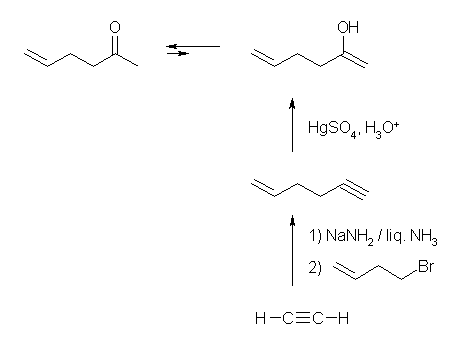
メチルケトンは末端アルキンの硫酸水銀触媒による水和で合成することができる。
8.17
三重結合の炭素は、sp 混成である。
(解答例)
5員環の平均的な結合角は108度となる。sp 混成炭素は、結合角が180度で直線的な構造しかとれない。もし sp 混成炭素にこれより小さな結合角をとらせようとすると、p 軌道の側面からの重なりが小さくならざるを得ないため不安定となる。
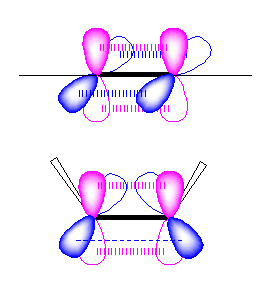
上図では、sp 混成炭素の(混成していない) p 軌道を示した。
以下に、仮想的な cyclohexyne から cyclodecyne まで、炭素数を1ずつ増えたときに sp 炭素の結合角がどのように変化するかを分子模型の絵で示した。
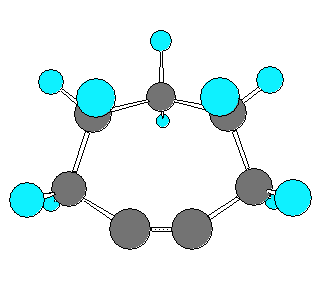
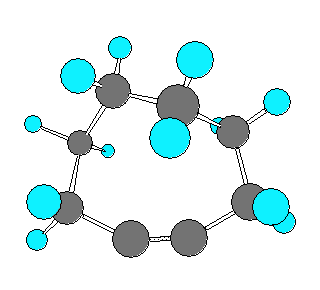
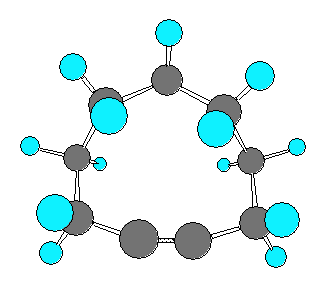
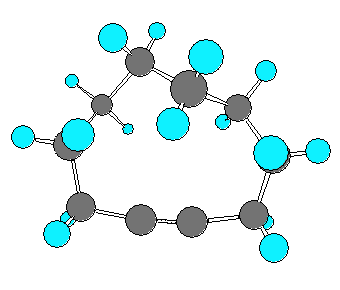
なお、実験事実として安定に単離できる最小のシクロアルキンは、シクロオクチン(C8H12) であると書かれた文献があるが、シクロオクチンは、上の図からもわかるように、sp混成炭素の結合角はまだ180度に達していない。そのため、いくらかの環歪みをもった分子である。
8.18
問い 8.01 のヒントを参照すること。なお、エン、インの前の母音は省略されるが、ジエン、ジインとなる場合の前の母音は省略されないことに注意。
(解答例)
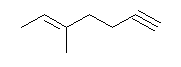
(a) 2,2-dimethylhex-3-yne
左右のどちらから番号をつけても三重結合の位置番号は同じになるが、側鎖のアルキル基の番号が小さくなるよう、図右より番号をつける。
(b) octa-2,5-diyne
はじめの(番号の小さい方の)三重結合について、番号が小さくなるように、図左より番号をつける。
(c) 3,6-dimethylhept-2-en-4-yne
はじめの多重結合について番号が小さくなるように、図左より番号をつける。
(d) 3,3-dimethylhexa-1,5-diyne
左右のどちらから番号をつけても、hexa-1,5-diyne であるので、側鎖のアルキル基の番号が小さくなるよう、図左より番号をつける。
(e) hexa-1,3-dien-5-yne
左右のどちらから番号をつけた場合でも、多重結合の位置番号は 1,3,5- となる。そのため、はじめにでてくる(番号の小さい)多重結合二重結合であるように番号をつける。図左より。
(f) 3,6-diethyl-2-methyloct-4-yne
左右のどちらから番号をつけても主鎖は oct-4-yne となる。そのため、はじめにでてくる側鎖の番号が小さくなるよう、図右から番号をつける。
8.19
命名ルールを見直してみること。なお、問いではエン、インの位置を示す番号が主鎖の炭素数を示すアルカンの母体名の前に置かれていることに注意する。
(解答例)
新命名系での名称をあわせて示しておく。必ず英語で表記できるようにすること。
なお、以下の構造式においては、炭素の位置が判りやすいように三重結合炭素の結合角を無視して描いているが、sp 炭素の結合角(180度)を考慮して書いてもよい。また、短縮構造式での表記も当然のことながら×にはならない。
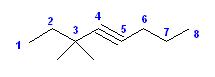
(a) 3,3-dimethyloct-4-yne [3,3-ジメチルオクタ-4-イン]
CH3CH2C(CH3)2C≡CCH2CH2CH3
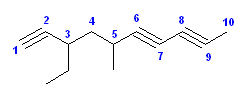
(b) 3-ethyl-5-methyldeca-1,6,8-triyne [3-エチル-5-メチルデカ-1,6,8-トリイン]
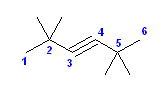
(c) 2,2,5,5-tetramethylhex-3-yne [2,2,5,5-テトラメチルヘキサ-3-イン]
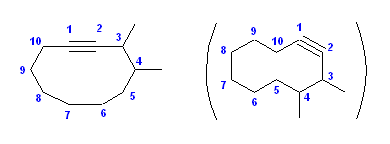
(d) 3,4-dimethylcyclodecyne [3,4-ジメチルシクロデシン]
(e) hepta-3,5-dien-1-yne [ヘプタ-3,5-ジエン-1-イン]
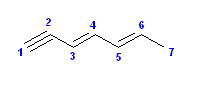
(f) 3-chloro-4,4-dimethylnon-1-en-6-yne [3-クロロ-4,4-ジメチルノナ-1-エン-6-イン]
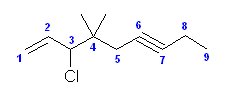
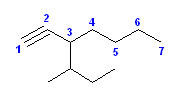
(g) 3-sec-butylhept-1-yne [3-sec-ブチルヘプタ-1-イン]
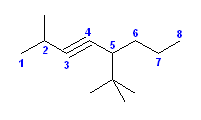
(h) 5-tert-butyl-2-methyloct-3-yne [5-tert-ブチル-2-メチルオクタ-3-イン]
8.20
炭素数 13 のアルカンは、トリデカン。
(解答例)
(a) (3E,5E,11E)-trideca-1,3,5,11-tetraene-7,9-diyne
[(3E,5E,11E)-トリデカ-1,3,5,11-テトラエン-7,9-ジイン],
((3E,5E,11E)-1,3,5,11-tridecatetraene-7,9-diyne
[(3E,5E,11E)-1,3,5,11-トリデカテトラエン-7,9-ジイン])
(b) tridec-1-ene-3,5,7,9,11-pentayne
[トリデカ-1-エン-3,5,7,9,11-ペンタイン],
(1-tridecene-3,5,7,9,11-pentayne
[1-トリデセン-3,5,7,9,11-ペンタイン])
8.21-8.30
8.21
三重結合、二重結合、芳香環中の二重結合のそれぞれで反応性が異なることに注意して解答せよ。
(解答例)
(a) パラジウム−炭素を触媒とした接触水素化反応では、三重結合と二重結合は単結合まで還元される。ベンゼン環の二重結合は反応しない。従って、butylbenzene を生じる。
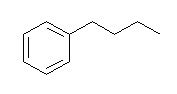
(b) Lindlar 触媒を用いると、接触水素化でも二重結合はこれ以上還元されない※。三重結合は二重結合まで還元される。((E)-buta-1,3-dienyl)benzene を生じる。(三重結合は、接触水素化により cis-体を与えるが、この問題ではもともと二重結合だった位置が trans-体である。)
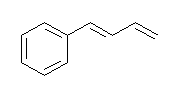
※:Lindlar 触媒を用いての接触水素添加が、アルキンをシス体のアルケンにまで還元する条件であったことを思い出せば、当たり前である。もし、二重結合が更に還元されるのであれば、生成物としてアルケンをとることができない。
8.22
(a) から順を追って考えればよい。
(解答例)
(a) 分子式 C8H10 で表される分子の不飽和度は、(18-10)/2 = 4 より、4である。
(b) Lindlar 触媒を用いた接触水素化では二重結合は還元されないから、この条件下で1モルの水素を吸収するということは三重結合が1つあるということを意味する。
(c) パラジウム触媒では、三重結合は2モルの水素を、二重結合は1モルの水素を吸収する。三重結合は (b) より1つあることがわかっているから、パラジウム触媒で吸収する3モルの水素のうち2モルは三重結合由来である。従って、二重結合は1つ。
(d) 不飽和度が (a) より4であった。(b), (c) より三重結合1つと二重結合1つがあることが判っているが、これらに由来する不飽和度は、計3である。従って、残りの不飽和度は環構造に由来する。従って、環を1つ持つ。
(e) (省略)(自分の描いた構造式を各自確認すること。「炭素数8、環の構造を1つもち、二重結合、三重結合をそれぞれ1つもつ」条件に合致していれば正解である。)
ただし、三重結合の炭素はsp混成であるから、結合角は180度である。そのため5員環、6員環、7員環など、小さな環構造の構成要素として三重結合を含むようなものは安定ではない。(8.17 の解答例に示した図も参照のこと。)
Cyclooctyne (C8H12) is the smallest cycloalkyne capable of being isolated and stored as a stable compound. (単離し保存することができる程度に安定なうちで一番小さなシクロアルキンは、シクロオクチンである。)
8.23
忘れている反応については、章末の「反応のまとめ」を参照して探すこと。
(解答例)
(a) 2-bromohex-1-ene
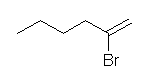
マルコフニコフ配向に従った位置選択性で付加する。
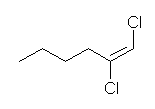
(b) 1,2-dichlorohex-1-ene
(c) hex-1-ene
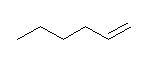
Lindlar 触媒を用いた水素化の立体はシン付加であるが、末端アルキンなので考慮しなくてもよい。(生成物が末端アルケンなのでシス−トランスの異性体を持たない。)
(d) hept-2-yne
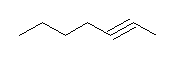
アセチリドアニオンのアルキル化。
(e) hexan-2-one
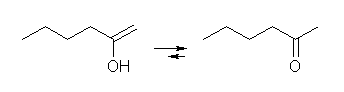
はじめに hex-1-en-2-ol を生じるが、ケト−エノール互変異性化により、主生成物として hexan-2-one を生じる。
(f) 2,2-dichlorohexane
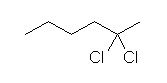
HCl が付加する際、1分子め、2分子めともにマルコフニコフ配向に従う。1分子目で結合したハロゲンは、アルキル基と同様にカルボカチオンを安定化する効果を持っていたことも思い出すこと。なお、出発物質が末端位以外のアルキンで、1分子 HCl の付加では位置選択性がない場合でも、2分子めの HCl の付加では位置選択性が生じる。
8.24
問い 8.24 では末端アルキンであったが、この問いでは内部アルキンである。上と同様、忘れていた反応については、章末の「反応のまとめ」を参照して探すこと。
(解答例)
(a) (Z)-dec-5-ene
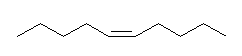
Lindlar 触媒を用いた水素化の立体はシン付加である。
(b) (E)-dec-5-ene
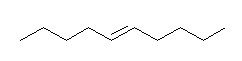
液体アンモニア中のリチウム還元では、熱的に安定なトランス体を生じる。
(c) (E)-5,6-dibromodec-5-ene
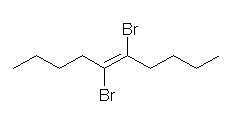
臭素の付加は、アンチの立体化学で進行するためトランス体を与える。
(d) decan-5-one
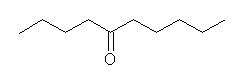
ヒドロホウ素化は逆マルコフニコフ配向性であるが、左右対称な内部アルキンであるから位置選択性は問題にならない。
(e) decan-5-one

硫酸水銀触媒による水和はマルコフニコフ配向性であるが、左右対称な内部アルキンであるから位置選択性は問題にならない。
(f) decane
8.25
非対称な内部アルキンについての問いである。
(c) の2段階目の付加反応性の位置選択性にあっては、臭素がカルボカチオンを安定化するのか、不安定化するのかということについて考えなくてはならない。誘起効果としては(電気陰性度からは)臭素が電子吸引性であるから、一見、カルボカチオンを不安定化するようにも見えるが、実験事実からは、共鳴効果(孤立電子対がカルボカチオンの空の p 軌道に流れ込む効果)による安定化の方が大きい。そのため、アルキル基と同じようにハロゲンが余分に置換したカルボカチオンの方が安定であると考えてよい。(出典:マーチ、第4版、pp750-751)
(解答例)
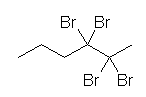
(a) 2,2,3,3-tetrabromohexane
(b) 2-bromohex-2-ene, and 3-bromohex-2-ene
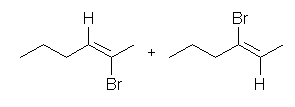
位置選択性がないから、上記2つの混合物となる。付加した H と Br は生成物の構造中においてトランスの位置関係となる。(ただし、E-Z 表記をすると、いずれも Z-体である。上記の構造を見て確認すること。)
(c) 2,2-dibromohexane, and 3,3-dibromohexane
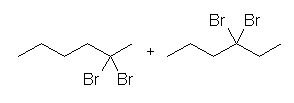
2,3-dibromohexane は生じない。
ヒントの2行目以降を参照すること。1分子目の HBr の付加にあっては2つの炭素が同じ級数なので、位置選択性が無く (b) で示される2種類の混合物を与えるが、2分子めの HBr の付加にあっては位置選択性がでてくる。マルコフニコフ配向性を考えるにあたって、ハロゲンはアルキル基と同様であるとして扱うことができるため、ハロゲンの結合した炭素上に正電荷をもつようなカルボカチオンのみを中間体として経由することになる。
(d) (E)-hex-2-ene
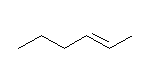
液体アンモニア中のリチウム還元では、熱的に安定なトランス体のアルケンを生じる。
(e) hexan-2-one, and hexan-3-one
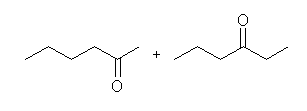
内部アルキンでは、2つの sp 炭素上のアルキル置換基の数が同じだから、反応に位置選択性は見られない。水和により生じる2種のエノール(hex-2-en-2-ol と hex-2-en-3-ol)は、すみやかにケト−エノール互変異性化し、上記2種のケトンの混合物を与える。
8.26
忘れていた反応については、章末の「反応のまとめ」を参照して探すこと。また、アルキンをアルケンにしてから反応させる場合は、7章末の「反応のまとめ」を参照すること。
(解答例)
時計の1時の場所から右回りに示す。
2-chloroalkane, R-CHCl-CH3
アルケンにしたのち、マルコフニコフ配向での HCl の付加反応を用いる。
1) H2, Lindlar 触媒、2) HCl
alkan-1-ol, R-CH2CH2OH
アルケンにしたのち、逆マルコフニコフ配向での水和反応(ヒドロホウ素化反応)を用いる。
1) H2, Lindlar 触媒、2) BH3 (または 9-BBN)、3) H2O2, -OH
alk-2-yne, R-C≡C-CH3
アセチリドとしたのち、ハロゲン化アルキルと反応させる。
1) NaNH2, liq-NH3、2) CH3I(CH3Br でも可)
alkan-2-one, R-C(=O)CH3
マルコフニコフ配向で水を付加(硫酸水銀触媒下、硫酸-水を作用)させると、エノール R-C(OH)=CH2 を生じるが、これは速やかにケト−エノール互変異性化により目的のメチルケトンを与える。
H2SO4, H2O, HgSO4
2-alkyloxirane, 1,2-epoxyalkane
アルケンにしたのち、エポキシドへ変換する。エポキシドへの変換は過酸による方法、ハロヒドリンを形成させてから閉環させる方法とがあり得る。
1) H2, Lindlar 触媒、2) mCPBA
alk-1-ene, R-CH=CH2
アルケンにする方法は、Lindlar触媒を用いた接触水素化(シス体が得られる)、または、液体アンモニア中でのリチウムによる還元(トランス体が得られる)、などの方法がある。
H2/ Lindlar 触媒 または、Li/liq-NH3
alkane, R-CH2CH3
パラジウム触媒を用いた接触水素化では、二重結合、三重結合ともに完全に還元されてアルカンを与える。
H2/Pd(炭素粉末上に担持させた触媒を Pd/C と書くこともある。)
alkanal, R-COH
末端アルキンのヒドロホウ素化反応では、生成する alk-1-en14-ol のケト−エノール互変異性化によりアルデヒドを与えるが、その構造はR-CH2COH である。ここでは炭素数が1つ減っているものを与えるようにするため、アルケンにしたのち、オゾンによる酸化開裂を行わせる。
1) H2, Lindlar 触媒、2) O3、3) Zn/AcOH
8.27
まず、分子式から不飽和度を計算し、次いで、二重結合および三重結合の数や位置を判断する。
(解答例)
A の分子式は C9H12 であるから、不飽和度は、式 (20-12)/2 より4と計算される。
Pd/C を触媒として水素を3モル当量吸収するから、不飽和度4のうち、1は環の構造に由来することがわかる。なお、多重結合に由来する不飽和度は3であるから、三重結合が1つと二重結合が1つ、または二重結合が3つの組み合わせのみが考えられる。
水銀(II)塩(硫酸水銀など)の触媒の下に希硫酸で処理してケトンを生じるのは、アルキンである。末端アルキンの場合は、単一の生成物(メチルケトン)を与える。2つの異性体ケトンを生じるのは非対称な内部アルキンだからである。
もともと、炭化水素 A は酸素を含まないから、これを KMnO4 で酸化して生じるトリカルボン酸 E および酢酸において、カルボキシ基はもともとあったものではなく、二重結合および三重結合の酸化開裂によって生じたものである。これを手がかりに考えると、二重結合、三重結合の位置が推定できる。
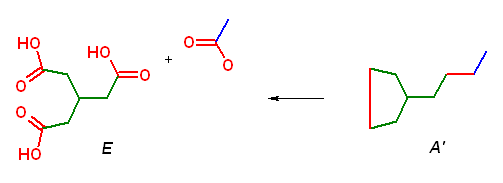
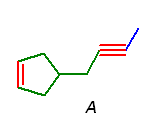
これらの情報より、A の構造は、上図で A' で示した構造のうち、赤の部分が一方が二重結合、もう一方が三重結合であることがわかる。しかし、問い 8.17 で見たように5員環の中に3重結合を含めることはできないから、A の構造は次図のように一意に求まる。(また、この条件を考えなくても、アルキンの水和により2つのケトン異性体を生じるから、アルキンは非対称でなくてはならない。5員環の中の多重結合はその左右に関して対称である。)
また、これに基づき、B〜D の構造は次図のように決めることができる。
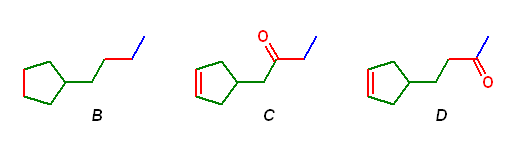
8.28
反応の位置選択性や立体選択性に留意して反応条件を選ぶこと。
章末の「反応のまとめ」も適宜参照すること。
(解答例)
(a) 硫酸水銀触媒による水和を用いる。
マルコフニコフ配向での水和により、but-1-en-2-ol を生成し、そのケト−エノール互変異性化により、butan-2-one を与える。
(b) ヒドロホウ素化反応による水和を用いる。
逆マルコフニコフ配向での水和により、but-1-en-1-ol を生成し、そのケト−エノール互変異性化により、butanal を与える。
(c) 強塩基 NaNH2 で処理してアセチリドアニオンとしたのち、ヨードメタン CH3I と反応させる。
アセチレン誘導体を、アセチリドにすると、ハロゲン化アルキルに対する求核置換反応を進行させることができる。これにより、炭素鎖を伸ばすことができる。prop-1-ynylbenzene (または、1-phenylpropyne)
を与える。
(d) Lindlar 触媒を用いた水素化を用いる。
Lindlar 触媒による接触水素化では、シン付加によりシスアルケンを生じるので、(Z)-prop-1-enylbenzene (または、1-phenylpropene)を与える。
(e) KMnO4 での酸化開裂を行う。
炭素数が減っており、多重結合の位置より左側の部分の炭素数と等しくなっている。そのため、多重結合の酸化開裂を用いることができる。アルキンは、KMnO4 による酸化開裂で、直接、カルボン酸を与えることができる。propanoic acid を与える。
(f) 臭素を付加し、1,2-dibromohexane としたのち、2当量の NaNH2 で塩基処理する。
アルキンの π 結合は、対応する位置からの H-Br などの脱離で生じさせることができる。すなわち、アルキン hexyne の直接の前駆体は、halo-alkene である 1- または 2-bromohex-1-ene である。このhalo-alkene 中の二重結合の π 結合も、やはり対応する位置からの H-Br などの脱離で生じさせることができる。すなわち、dihalo-alkane があればよいことになる。従って、hex-1-ene に臭素 Br2 を付加させ、1、2-dibromohexane としたのち、2分子の HBr を脱離させると、hex-1-yne を与える。
(発展)
アルキンからは、反応条件を選択することによってシス/トランスのアルケンを合成しわけることができた。(f) にもあるようなアルケンをアルキンに変換する方法(§8.2)を応用すると、シス体のアルケンをトランス体に変換したり、トランス体のアルケンをシス体に変換する方法になる。
シス体のアルケン ←→ アルキン ←→ トランス体のアルケン
8.29
前問の(発展)の項を参照すること。
(解答例)
まず、アルケンに臭素を付加させ、次いで2当量の NaNH2 で塩基処理してアルキンに変換する。そののち、シス体が欲しい場合は Lindlar 触媒による接触水素化を、トランス体が欲しい場合は液体アンモニア中でのリチウム還元を行うとよい。
8.30
三重結合は KMnO4 でカルボン酸のみを生じる。
二重結合も、KMnO4 を用いるとケトンとカルボン酸を生じる。従って、生成物がカルボン酸のみである場合、もとの炭化水素中の多重結合が、二重結合であったのか三重結合であったのかを区別することはできない。もしケトンが生じる場合は、その部分は二重結合由来である。
また、O3 による酸化開裂では、三重結合はカルボン酸を与える※。アルデヒドやケトンを与えるのは、酢酸中の亜鉛処理などを伴う O3 による二重結合の酸化開裂のときのみである。
(解答例)
(d), (e) では、アルデヒド、ケトンを生じているから、KMnO4 による反応ではない。(KMnO4 条件では、アルデヒドはカルボン酸まで酸化される。)
(a) oct-1-ene または oct-1-yne の KMnO4 による酸化開裂。または oct-1-yne の O3 による酸化開裂。
(b) prop-1-enylbenzene または prop-1-ynylbenzene の KMnO4 による酸化開裂。または prop-1-ynylbenzene の O3 による酸化開裂。一般的に芳香環(ベンゼン環)は、オゾンでは反応しない。(下方の解説のように反応する場合もあるが、それは例外である。)
(c) cyclodecene または cyclodecyne の KMnO4 による酸化開裂。または cyclodecyne の O3 による酸化開裂。
(d) 5-methylhept-5-en-1-yne の O3 による酸化開裂。
(e) 1-ethynylcyclohexene の O3 による酸化開裂。
以下、(d) を例にとって解説図を載せておく。(e) も同様である。
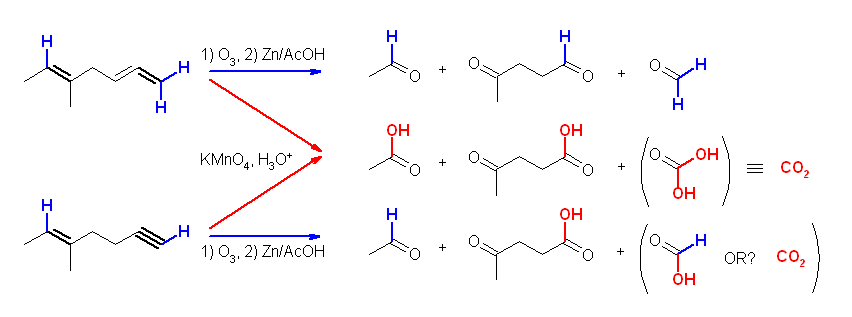
ヒントにも述べてあるように5、6位間の二重結合由来の生成物がアルデヒドとケトンとなっているので、(過マンガン酸カリウムではなく)オゾン酸化の条件であったことがわかる。(過マンガン酸カリウムでは、アルデヒドがカルボン酸まで酸化されてしまう。)このため、1、2位間の多重結合がカルボン酸を与えるためには、三重結合でなくてはならなかったことを示唆する。
ただし、上の図から形式上、末端アルキンのオゾン酸化では二酸化炭素ではなくギ酸が生じるのではないかと思われる。(発展)の項にも記述したように、教科書の記述(p261)「末端アルキンのオゾン酸化では、一方の生成物として(末端炭素より)二酸化炭素が生じる」にミス(すなわち、筆者の先生の勘違い?)があるのではないかと思うところだが。
(発展)
※ (d) に関連して、教科書の記述(p261)で、「末端アルキンのオゾン酸化では、一方の生成物として(末端炭素より)二酸化炭素が生じる」という記述があるが、これについては、疑問が残る。
アルケンのオゾン酸化でも見たように、この条件では、ホルムアルデヒド(H-CHO or H2CO)は酸化されない。そうであるならば、形式的に生じるはずのギ酸も、二酸化炭素まで酸化される反応が起きないのではないか。これについては、(問題の出題ミスを含めて)もう少し調べてみたいと思います。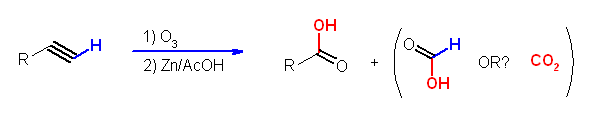
なお、マーチの第4版(英語版)には次のような記述がある。
「三重結合のオゾノリシスは、比較的一般的ではないし、反応も進行しにくい。これはオゾンが求電子的な試薬であり、三重結合より二重結合に対して反応しやすいからである。三重結合を含む物質は、一般的にカルボン酸を与えるけれど、時により、オゾンによりα−ジケトンを与える反応をする。芳香族化合物は同様にオレフィンよりも反応性が低いが、実際に開裂を起こすこともある。その時は、ケクレ構造(共鳴の極限構造式)で表されるような二重結合がその位置にあるかのように振る舞い、ベンゼンからは3モルのグリオキサール(HCO-CHO)(IUPAC名では、エタンジアール)を、o-キシレンからは、グリオキサールとMeCO-CHO、そして MeCO-COMe とを、3:2:1の比で与える。このことは、このような開裂が起きる場合には、全く統計的に起きることを示している。」
三重結合を含む物質はオゾンにより一般的にカルボン酸を与えることは事実ですが、むしろ、これは例外的な反応として捉えてもよいかもしれない。なお、上記中のα−ジケトンを与える反応は次図の上段のようになる。
この反応をするような試薬もいくつも知られていて、数例を挙げると、四酸化ルテニウム、中性の過マンガン酸カリウムなどがある。なお、類似の下段の反応は、四酸化オスミウムや、冷・アルカリ性の過マンガン酸カリウム、mCPBAなどの有機過酸によりエポキシドを生成してから水酸化物イオンによる開環など、いくつかの条件をすでに学んだ。
8.31-8.40
8.31
(a) 炭素数が1つ減っている。従って酸化開裂反応が反応の候補である。しかし、直接アルキンを酸化開裂させても、アルデヒドは得られない。
(b) 炭素数は2つ増えている。炭素−炭素結合生成反応を行う必要がある。
(解答例)
(a) 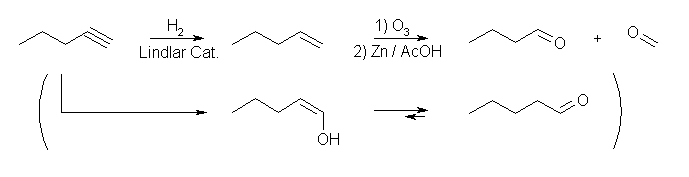
アルキンの水和(逆マルコフニコフ配向)でもアルデヒドを得ることはできるが、炭素数がもとのアルキンと同じアルデヒドを与える。炭素数が1つ減っているので、酸化開裂反応を用いればよい。酸化開裂によりアルデヒドを与えるのは、アルケンをオゾン酸化したときだけである。
(b) 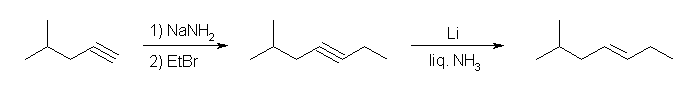
アセチレン誘導体から生じるアセチリドイオンは、ハロゲン化アルキルに対して求核攻撃して炭素−炭素結合生成を行うことができる。得られる内部アルキンを、トランス体に還元するには、液体アンモニア中でのリチウムによる還元をおこなえばよい。
8.32
逆合成の手法で考えること。まず、目的とするシクロプロパン環は、Simmons-Smith 反応(教科書 7.6 節参照)を用いて合成することが可能である。
Simmons-Smith 反応で 1-butyl-2-methylcyclopropane を与えるために用いることのできるアルケンは、問い 7.40 も参照すると、hex-1-ene または hept-2-ene である。
ところで、Simmons-Smith 反応は、立体選択的であるため、アルケンの幾何異性体(シス体/トランス体)のそれぞれから合成することのできるシクロプロパン誘導体は、互いに異なる立体異性体である。今回の目的物の構造を考えあわせ、どのようなアルケンからはじめる必要があるかを考えること。
ついで、そのアルケンを得るための方法を考えればよい。
(解答例)
Simmons-Smith 反応で、選択的に cis-二置換のシクロプロパンを与えるためには、cis-アルケンを原料としなければならない。下図のように、1,1-diiodoethane を用いれば、hex-1-ene からも 1-butyl-2-methylcyclopropane を与えることができるが、cis-体とtrans-体の混合物を与えることになってしまう。
cis-hept-2-ene は、hept-2-yne を Lindlar 触媒下に水素化すると得られる。はじめに与えられているのは hex-1-yne だから、ここから生じさせたアセチリドアニオンとヨードメタン(またはブロモメタン)との反応でアルキル化すればよい。
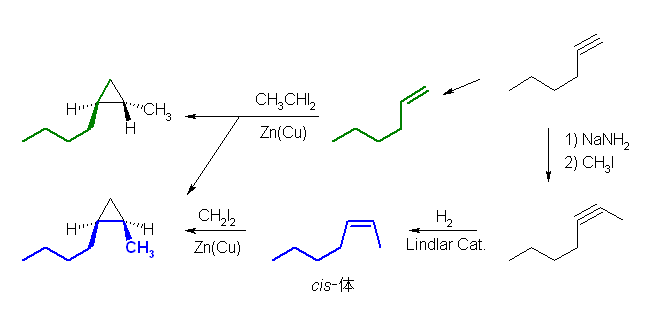
上の図で意味が判らない場合は、次図をよく眺めてください。
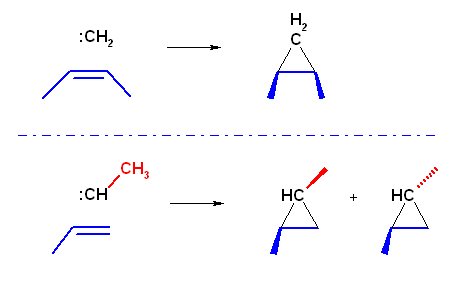
(シスまたはトランスのアルケンと無置換のカルベン(:CH2)を反応させると、生成するシクロプロパン環のシス、トランスも、出発物質に応じて選択的に決まるが、メチル基がひとつだけついたカルベン(:CH-CH3)とを反応させると、シス−トランスの混合物になってしまうことを表した図。)
8.33
1つめ。アルデヒドを合成することができる反応に、どのようなものがあったのかを思い出してみること。
2つめ。炭素数を増やす反応である。
(解答例)
1つめ。
アルデヒドを生成物とする反応には、アルキンの逆マルコフニコフ配向での水和(ヒドロホウ素化反応)や、アルケンの酸化開裂(オゾン酸化)がある。
その他も、第1級アルコールの酸化でアルデヒドを合成する方法や、ケト−エノール互変異性化反応を活かした方法として、(メトキシメチレン)トリフェニルホスホランを用いた Wittig 反応(教科書 19 章、第6版の 問題 19.37 のヒント 参照。)などが考えられる。
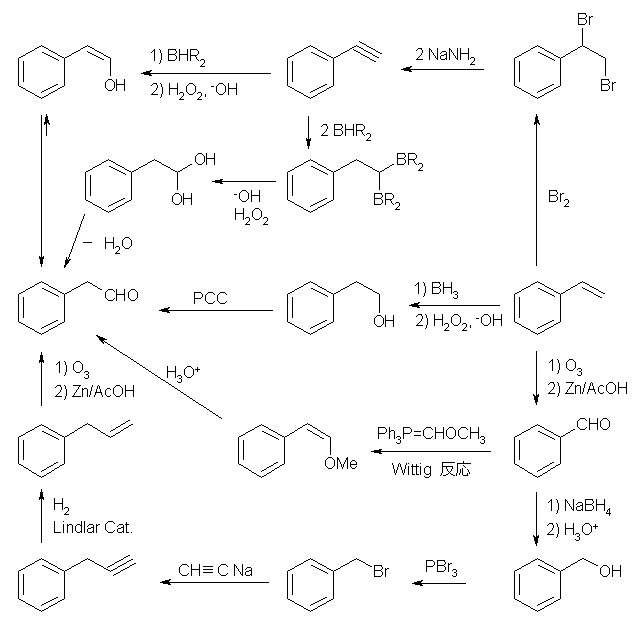
2つめ。
最終目的とするアルケンはトランス体であるから、対応するアルキンを液体アンモニア中でリチウムで還元すればよい。このアルキン prop-1-ynylbenzene (または、1-phenylpropyne)を得るためには、ethynylbenzene (または、phenylacetylene)からアセチリドイオンとし、ヨードメタン等と反応させる必要がある。そのために styrene (vinylbenzene) の二重結合を三重結合に変換する反応が必要である。
その他にも、目的物が熱的に安定な方の異性体であるから、いくつかの方法で合成が可能である。いくつかの反応例を下図に示した。(熱的に不安定なシス型を与えるためには、アルキンの Lindlar 触媒を用いての水素化反応などがある。)
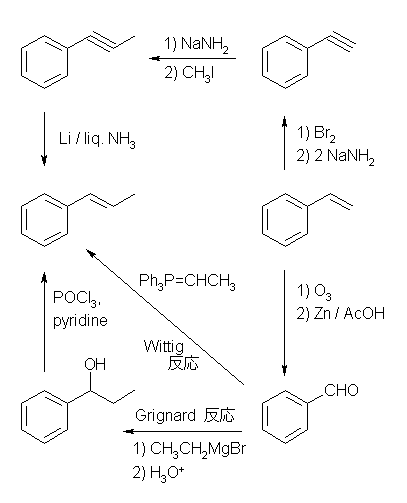
Wittig 反応については教科書 19.12 節、Grignard 反応については教科書 19.8 節を参照のこと。
8.34
まずは目的生成物の構造式を描き、出発物質である 1-butyne と比較すること。その上で、どの部位でどのような反応が起きているのかを見出すこと。
(解答例)
(a) 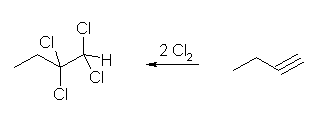
(b) 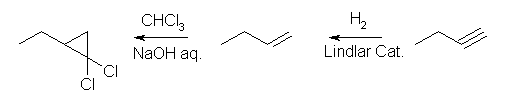
三重結合を二重結合に部分的還元する方法は、ここでは生成物のシストランス異性体を考慮しなくてもよいので、Lindlar 触媒を用いた接触水素化以外に、リチウム−アンモニア法でもよい。
8.35
(a), (b) は、アセチリドイオンとハロゲン化アルキルの反応で直接合成される。(c) 〜 (e) は、アルキンからの変換で合成される。特に (d) は、反応で混合物とならないよう、その前駆体を選ぶ必要がある。
(解答例)
(a) 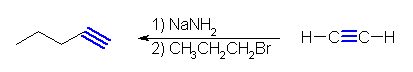
(b) 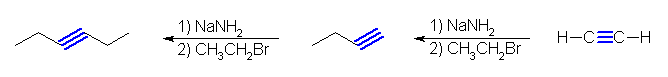
(c) 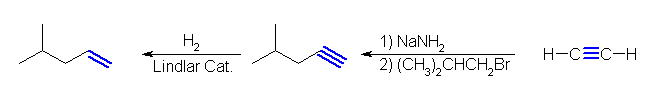
(d) 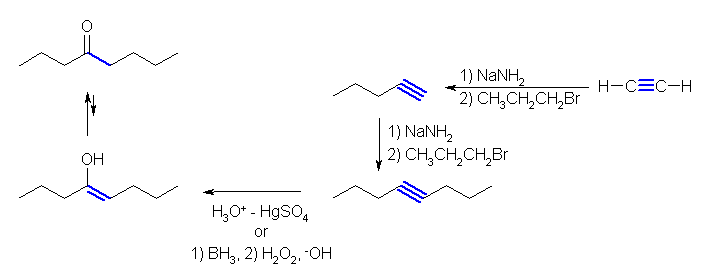
水和反応では、内部アルキンでは2つの sp 炭素上のアルキル置換基数に差が無いから硫酸水銀を触媒とした水和を用いても、ヒドロホウ素化を用いても位置選択性は生じないから、左右対称な oct-4-yne を用いるべきである。oct-3-yne の水和では、octan-3-one と octan-4-one の混合物を与えてしまう。
(e) 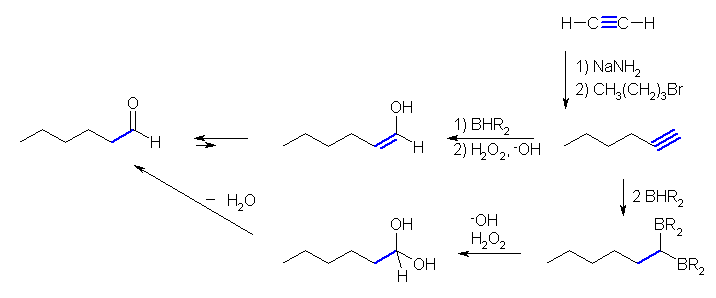
末端アルキンのヒドロホウ素化反応では、教科書的には、1分子のアルキンに2分子のボランが付加していく(上図、下からの経路)。単に形式的には、1分子のアルキンに1分子のボランが付加してから、加水分解により得られるエノールの互変異性化によっても同じ生成物が与えられる。
8.36
(a), (b) は、教科書 8.5 節のアルキンの還元の2つの反応、接触水素化とリチウム−アンモニア還元の反応機構を見直し、どこで水素が導入されるのかを調べること。新たに導入される水素の代わりに、重水素を含むものを使うとよい。
(c) は、酸性度の高い水素を D に置き換える反応である。酸性度が高いということは、その水素が酸解離平衡で H+ として抜けたり再結合したりしやすいということである。
(解答例)
(a) 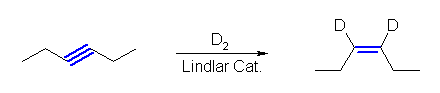
(b) 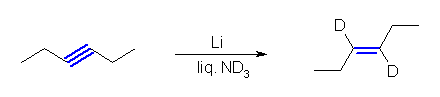
(c) 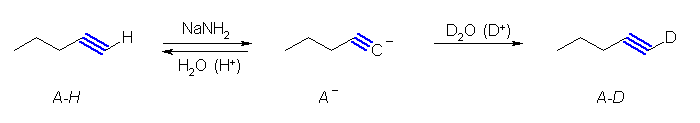
アセチレン誘導体をブレンステッド酸として捉え、プロトンを引き抜いた形(共役塩基)にしてから、D2O などから D+ を供給する。アセチレンの pKa 〜 25 は、水(pKa 〜 15)と比べてずっと弱い酸であることを示すので、アセチリドイオンは、水によって完全にプロトンを与えられ、アルキンにもどることができる。
(d) 
単に D2 を用いた接触水素化では、生成物中に H が1つ残ってしまう。このため、はじめに (c) と同様の方法でsp 炭素上の水素を D 化しないとならない。
8.37
環状であろうと、環状でなかろうと、反応の基本部分は同じである。
(解答例)
アセチリドイオンとハロゲン化アルキルによる炭素−炭素結合の生成反応を用いる。
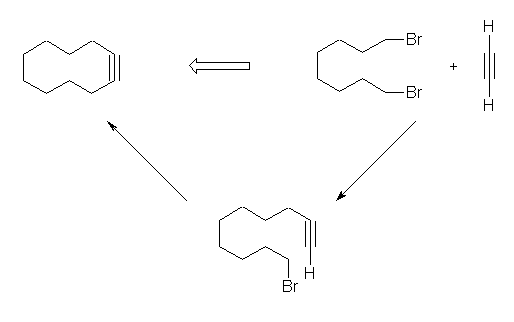
8.38
最終目的とするアルケンは、熱的に安定なトランス型ではなく、熱的に不安定なシス型であるから、限られた方法でのみ合成が可能である。
(解答例)
熱的に不安定なシス型のアルケンを合成するためには、アルキンの Lindlar 触媒を用いての水素化反応などを用いることができる。
muscalure CH3(CH2)7CH=CH(CH2)12CH3 は、C23 のアルケンである。IUPAC名は (Z)-9-tricosene である。
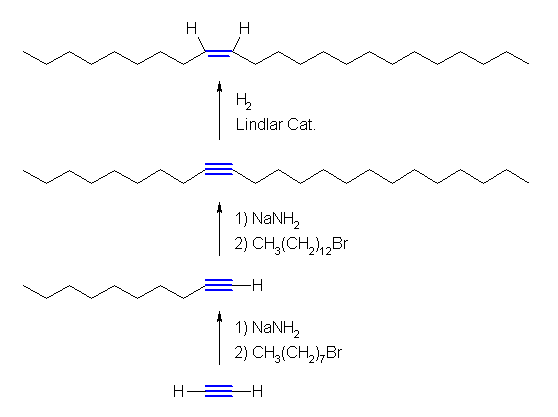
アセチリドアニオンとハロゲン化アルキルの反応により、内部アルキンを合成し、続いて Lindlar 触媒を用いての接触水素化を行う。アセチレンからのアルキル基の導入は、左右のどちらを先に行ってもよい。
8.39
まず、分子式から不飽和度を求めよ。
次いで、水素の吸収数より、多重結合や環の数を決めることができる。
オゾン酸化では二重結合からは、ケトンおよびアルデヒドを与え、三重結合からはカルボン酸を与える。
また、NaNH2 による処理は、アセチレンからアセチリドアニオンを生じさせる条件である。
(解答例)
化合物 A の分子式 C9H12 から、式 (20-12)/2 より不飽和度は4である。
また、この分子 A はパラジウム触媒で3モル当量の水素を吸収するから、不飽和度4のうち1は環の構造によるものである。残りは、3つの二重結合、または1つの二重結合と1つの三重結合のいずれかに由来することになる。
A のオゾン酸化では、シクロヘキサノン(ケトン)を与えることから、少なくとも1つの二重結合の位置を決めることができる。
また、化合物 A は、NaNH2 による処理後、CH3I との反応により、炭素数の1つ多い化合物 C を与えるから、末端アルキンを含んでいる。
以上の条件を満たすのは、次式のような構造である。
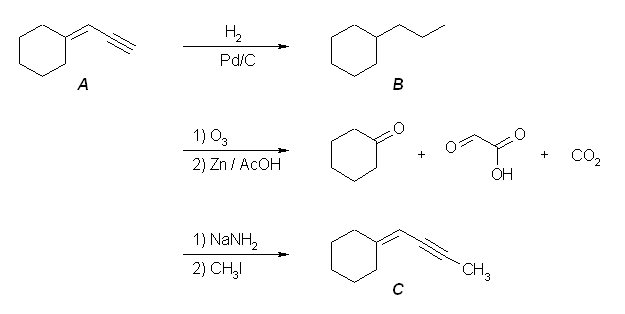
8.40
まず、分子式から不飽和度を求めよ。
次いで、水素の吸収数より、多重結合や環の数を決めることができる。
オゾン酸化では二重結合からは、ケトンおよびアルデヒドを与え、三重結合からはカルボン酸を与える。
(解答例)
化合物 A の分子式 C12H8 から、式 (26-8)/2 より不飽和度は9である。
また、パラジウム触媒により8モル当量の水素を吸収するから、不飽和度9のうちの1つは、環の構造によるものであり、残りは多重結合である。
オゾン分解でカルボン酸を与えるのは三重結合であるが、ジカルボン酸のみを与えていることからも環の構造を示唆する。(もし直鎖構造であれば、末端の位置に由来する二酸化炭素、またはモノカルボン酸が必ず得られるはずである。)
なお、オゾン分解によりケトンやアルデヒドは生じていないから、すべての多重結合は三重結合である。つまり、8モル当量の水素を吸収することから三重結合の数は4である。したがって、12員環で4つの三重結合をもつ cyclododecatetrayne が化合物 A である。シュウ酸(炭素数2)とコハク酸(炭素数4)を与えるから、cyclododeca-1,3,7,9-tetrayne または cyclododeca-1,3,5,9-tetrayne のいずれかが A の構造である。
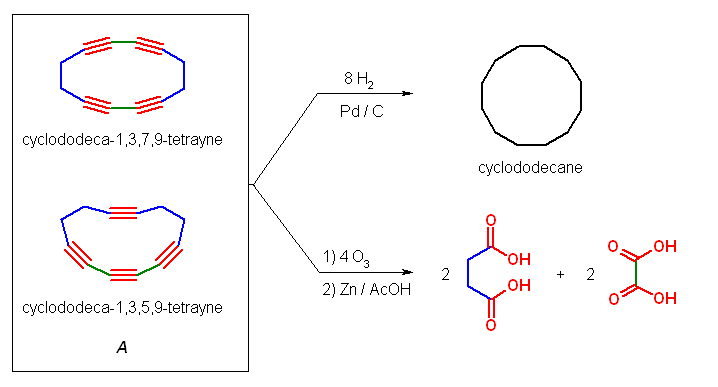
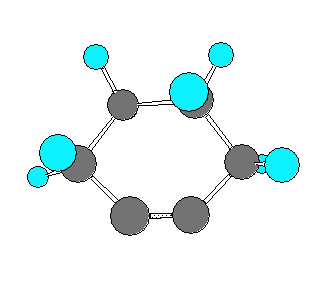
なお、cyclododeca-1,3,7,9-tetrayne と cyclododeca-1,3,5,9-tetrayne を比べたとき、これらの分子模型の絵(以下、2つ)を比較してみると、cyclododeca-1,3,7,9-tetrayne の方がわずかだけ sp 炭素の角度歪みが小さく見える。しかし、ここではこれら2つの構造のもつひずみエネルギーを定量的に評価する手段を持たないから、一方の構造のみを「不可能な形※」と決めることはできないように思われる。この両者を A の構造の答えとしてよい。
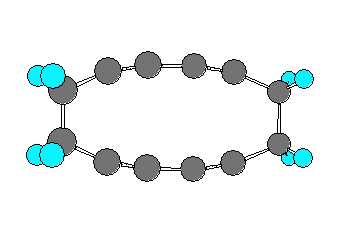
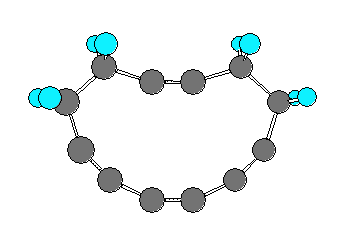
※ 問い 8.17 の cyclopentyne などのように員数の少ないシクロアルキンは、「不可能な形」である。
8.41-8.47
8.41
章末の「反応のまとめ」等で見直すこと。
(解答例)
(a) は、アセチリドイオンと第1級ハロゲン化アルキルによるアルキル化反応。
(b) は、接触水素化による部分還元。
(c) は、Simmons-Smith 反応。
従って、反応条件は、
(a) 1) NaNH2, 2) CH3CH2I
(b) H2, Lindlar 触媒
(c) CH2I2, Zn(Cu)
8.42
目的化合物である 2-methylbuta-1,3-diene の構造を描いてみること。どこがケトン由来で、どこがアセチリド由来であると考えることができるか。なお、2-methylbuta-1,3-diene は、炭素数5である。アセチレン由来のアセチリドイオン(炭素数2)とのカップリングで炭素数5を与えるケトンは炭素数3であるはずだから、acetone である。
また、カルボニル化合物への求核攻撃で生じるアルコールは脱水によりアルケンを与える。(教科書 7.1 節、および教科書 17.6節等を参照のこと。)
(解答例)
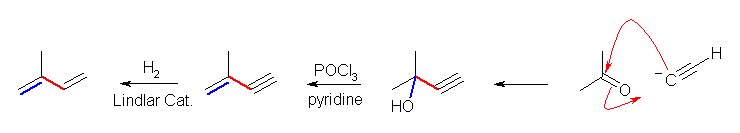
アルコールからの脱水によるアルケンの合成について、上の図では教科書 17.6 節に基づいた反応条件を示したが、これ以外にも、THF 中で硫酸と加熱(教科書 7.1 節参照)などでも良い。
8.43
問い 8.42 の反応で示されているのと同じパーツが、メストラノールの構造の中にあるはずである。
(解答例)
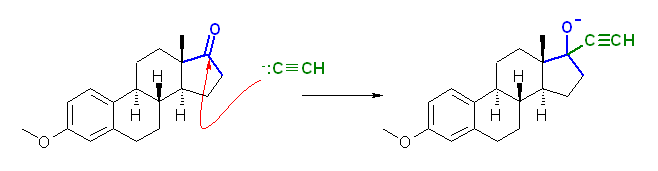
8.44
まず、分子式より不飽和度を求める。ただし、不飽和度のうち1つはカルボン酸の中のカルボニル基由来である。
また、オゾン酸化で4つの部分に分解するということは、3箇所に多重結合があることを意味する。それぞれの分解生成物より対応を考えること。
(解答例)
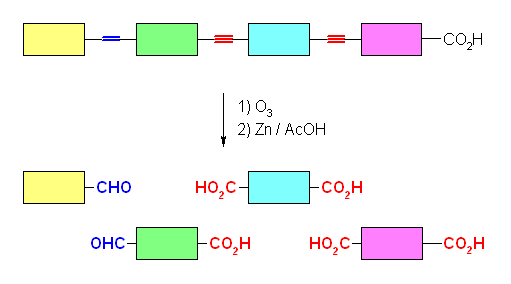
エリトロゲン酸 erythrogenic acid の分子式 C18H26O2 の不飽和度は、式 (38-26)/2 より6である。ただし、このうち1はカルボン酸中のカルボニル基に由来する。
パラジウム触媒による接触水素化で5モル当量の水素を吸収するから、環構造は持たず、多重結合のみを持つ。
オゾン酸化で4つの部分に分解するということは、3箇所に多重結合があることを意味する。炭素−炭素の多重結合に由来する不飽和度が5だから、二重結合1つ、三重結合2つである。
生じる4つの部分のうち、カルボン酸でない方の末端に由来する2つはモノカルボニル化合物(アルデヒド、ケトン、カルボン酸のいずれか)、内部に由来する2つはカルボニル性の官能基を2つもつ化合物である。また、カルボン酸側の末端に由来する部分も、カルボニル性の官能基を2つもつ化合物である。
ここで、分解生成物としてジカルボン酸として2種類が与えられており、問いに与えられた条件では、これらのうちどちらがカルボン酸末端に由来するかを区別することはできないから、それぞれの分解生成物の構造との対応を考えると、次の2つの可能性が考えられる。
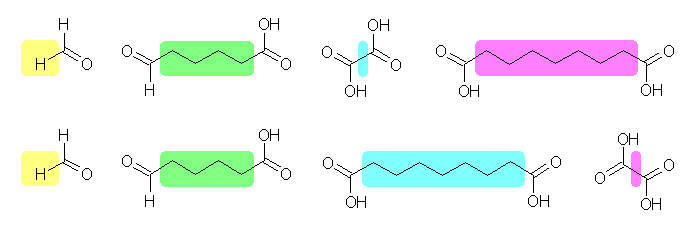
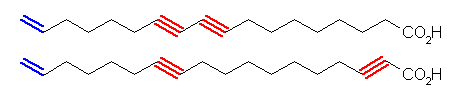
(上) octadec-17-ene-9,11-diynoic acid, (下) octadec-17-ene-2,11-diynoic acid
この2つの構造のうち、どちらが erythrogenic acid の構造であるかを知るためには、カルボン酸末端に由来するフラグメントを他のフラグメントと区別できればよい。
例1:erythrogenic acid をエステル化したのち、オゾン酸化すると、カルボン酸末端由来のフラグメントのみ、ジカルボン酸のモノエステルの形で得られる。
例2:erythrogenic acid を、まず Lindlar 触媒存在下で水素添加し、分子内の三重結合をすべて二重結合に変え、これをオゾン酸化する。カルボン酸末端由来のフラグメントはアルデヒド酸で得られ、もう一方のジカルボン酸フラグメントはジアルデヒドとして得られるため、区別できる。
8.45
もし覚えがないようであれば、アルケンと、臭素、水の反応については、教科書7章末の「反応のまとめ」を見て探すこと。
(解答例)
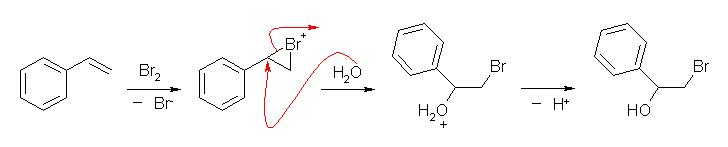
アルケンと、臭素、水の反応ではハロヒドリンを生成する。これは、ブロモニウムイオンに対しての水の求核付加で生じる。
この反応は、位置選択性(配向性)は、マルコフニコフ配向に従い、立体選択性はアンチ付加である。
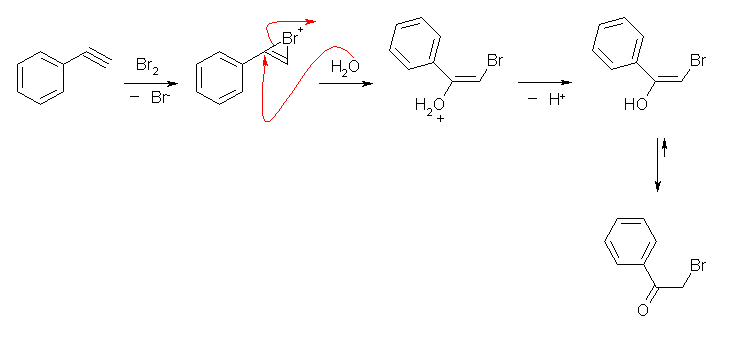
同様にアルキンからの場合もブロモニウムイオン中間体を経由して、同様の反応を生じる。生じたビニルアルコールはケト−エノール互変異性化によりケトン体を与える。
8.46
隣接した二重結合(集積二重結合)については、すでに学習済みであるはず。さほど難しい問題ではないだろう。
(解答例)
cumulene の中央の2つの炭素の混成状態は、2本のシグマ結合をもつ炭素であるから、sp 混成である。
sp 混成炭素では、結合角 180度、すなわち直線上に並んだ2本の sp 混成軌道がシグマ結合をつくる。この直線に対して垂直な方向に2組の p 軌道をもつ。従って、cumulene では次図のような軌道をもつと考えられる。( sp 混成軌道は省略し、p軌道のみを示す。)
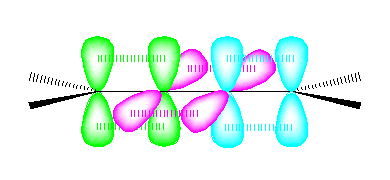
なお、参照として H2C=CH2 および H2C=C=CH2 の2つの分子の軌道を以下に示しておいた。
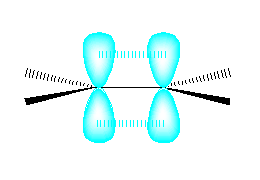
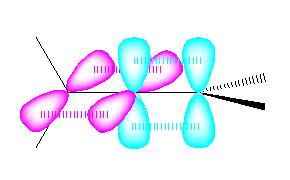
H2C=CH2 および H2C=C=C=CH2 は、平面4配位型の構造をもつ。従って、通常のアルケンと同様、異なる4つの置換基を持つとシス−トランスの幾何異性体(E, Z で表記される)をもつ。これに対し、H2C=C=CH2 は非平面型であるから、4つの異なる置換基を持ってもシス、トランスの幾何異性体とはならない。(軸不斉に由来する光学異性体となる。)
分子模型を組んでみたので、写真を載せておく。赤と青のタマは、任意の置換基と思ってください。以下の写真では、同じ置換基が同じ側にあるので、シス体。または (Z)-体。


8.47
アセトンは、ケト−エノール互変異性化によりビニルアルコール型の propen-2-ol, CH3-C(OH)=CH2 を与える。酸性条件下で、この分子はアルケンとして振舞うことができる。
なお、-H が -D となったものについて、deuterio- で命名できる。発展の項参照。
(解答例)
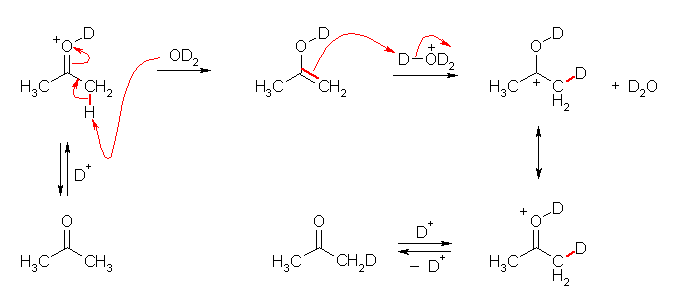
ここでは、6つの水素のうち1つが重水素に交換される反応の機構を示す。この反応は、酸性、塩基性のいずれでも触媒される。6つの水素(や重水素)のうちどれが反応に関与するのかは、ほぼ単純に確率的に決まると考えてよい。この交換反応が1つの分子に対し、なんどもなんども起きると、最終的にほぼすべての水素が交換されることになる。なお、周囲に重水 D2O が多量にあると -H から -D への交換が多く進行する。もし、周囲に軽水 H2O が多量にある場合には、-D から -H への交換が多く進行することになる。
酸性条件下でケトンにプロトン H+ (厳密には、この問いにおいてはジュウテロン D+ )がルイス酸として配位すると、カルボニルの分極が増し、中性の水でも塩基や求核剤として働くことが可能となる。このため、エノール化が促進される。(ケト−エノール互変異性化は、酸によっても塩基によっても触媒される。)このエノール体は、アルケンとしての反応として、プロトン化を受けてカルボカチオンを与えることができる。水酸基の結合した炭素上に生じるカルボカチオンは、プロトン化したカルボニル基と共鳴構造の関係にある。ここから脱プロトン(厳密には、脱ジュウテロン)することにより、重水素化されたアセトンを再生する。
塩基性条件でも、重水素交換が生じる。これは、問い 8.36(c) などと同様に、塩基によりプロトンが引き抜かれて生じたカルボアニオンに、D+ が付加する形で進行する。
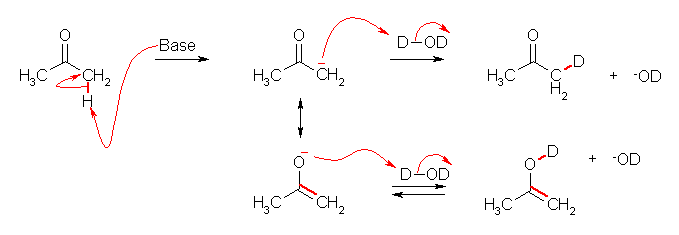
アセチレンやアセトンの酸性度については、下巻の巻末付録 B を参照すること。アセチレンは酸性度定数として pKa = 25 の値をもつ。また、アセトンは酸性度定数として pKa = 19.3 の値をもつ。従って、アセトンはアセチレンより酸性度が高い。(生じるカルボアニオンは、上図の中央下段のような酸素上に形式電荷をもつアニオンとの共鳴構造の関係にある。このようなアニオンは、エノラートアニオンとよばれる。下のアニオンの構造は、エノール体の水酸基から脱プロトン化した構造である。)
酸性条件下、塩基性条件下のそれぞれの反応機構を対応させてみておくこと。
(発展)
水素の同位体について区別する必要がある場合、次の用語を用いることが推奨されている。
| 一般名 | 1H | 2H | 3H | |
| 原子( H ) | hydrogen | protium | deuterium | tritium |
| 陽イオン( H+ ) | hydron | proton | deuteron | triton |
| 陰イオン( H- ) | hydride | protide | deuteride | tritide |
| 原子団( -H ) | hydro | protio | deuterio | tritio |
特に区別する必要がない場合、陽イオン( H+ )の一般的な表現として慣用的に hydron の代わりに proton を用いる場合がある。