6.01-6.10
6.01
飽和な脂肪族炭化水素(アルカン)の一般式を思い出すところから始める。直線状にならんだ炭素鎖は、それぞれ4本の結合を持つがうち2つは水素と結合している(-CH2-:メチレン)。直線状にならんだ炭素鎖の両末端だけは、3つの水素と結合している(-CH3:メチル)。これを考えると、アルカンの一般式、(CH3)×2+(CH2)×m が分子式であるが、いま、m+2 を n と置いて式を整理すると、CnH2n+2 が導出される。アルカンが途中で分岐していても同じ式で表されることは、各自、構造式を描きながら確認しておくこと。
分子の中の任意の2つの水素を取り去り、その炭素同士を結合した場合、隣接していた場合には多重結合に、離れた位置だった場合には環構造となり、不飽和度が1増える。従って、注目する分子の分子式中の水素数の、アルカンの一般式との差を2で割れば不飽和度となる。
なお、不飽和度の原因として、環構造と多重結合の存在がある。環構造をもたない場合、環構造を1つ持つ場合、… の順に整理し、可能な骨格構造(直線状、主鎖炭素数が1つ少なく分岐したメチル基を持つ場合、主鎖炭素数が2少なくメチル基2つまたはエチル基を持つ場合、…)をすべて書き出したのち、残りの不飽和度を多重結合(すべて二重結合で三重結合を持たない場合、三重結合を1つ持つ場合、2つ持つ場合… の順に整理する)に由来するものとして割り当てていく。
(解答例)
以下に、区別可能な異性体の種類を挙げる。それぞれ、構造式で書いて確認すること。また、それぞれの構造に対応する名称も確認すること。
ただし、構造上難しいもの(たとえば、sp 炭素の結合角が、本来の結合角180度とくらべて極端に小さい場合など)は、常識的に避けるように気をつけましょう。
(a) C4H8 は、不飽和度が1であるから、
環をもつもの:2種類
環を持たないもの;
一番長い炭素鎖が4のもの:2種類(シス−トランス異性体を別に数えると3種類)
一番長い炭素鎖が3のもの:1種類
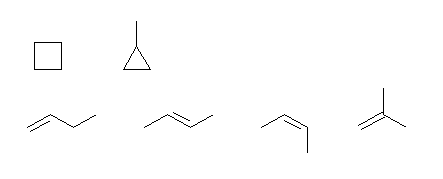
環状の母体としては、シクロブタン、シクロプロパンのそれぞれが考えられる。cyclobutane、methylcyclopropane
環を持たないアルケンとしては、炭素鎖が4のものでは二重結合の位置異性体として、上の but-1-ene と but-2-ene があり、更に、but-2-ene にはシス、トランス異性の区別がある(Z-体とE-体が存在する)。
枝分かれをもつ骨格構造として、2-メチルプロパンを考え、これに二重結合を一箇所加えると、対称性から1種類のアルケンだけが考えられる。2-methylprop-1-ene (新しいIUPACの勧告に従わずに、置換基+母体という形式において、母体の先頭に主官能基の位置を示す数字が付く形で、2-methyl-1-propene という書き方になる場合もある。)
(b) C4H6 は、不飽和度が2であるから、
2つの環をもつもの:1種類
1つの環と二重結合をもつもの:4種類
環を持たないもの;
2つの二重結合をもつもの:2種類
3重結合を1つもつもの:2種類
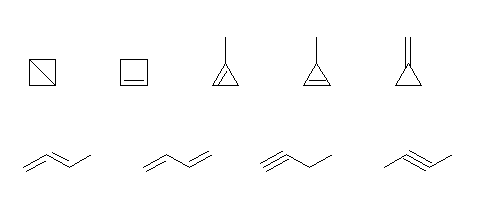
二環系の化合物として、bicyclo[1.1.0]butane がある。
また、環を1つもつものとしてはシクロブタン、メチルシクロプロパンに二重結合を1つ加えた構造だから、cyclobutene、1-methlcyclopropene、3-methylcyclopropene、および、methylenecyclopropane が考えられる。
環を持たないものとして、炭素が4つ直線上に並んでいる上に2箇所の二重結合、または三重結合を1箇所加えると、buta-1,2-diene、buta-1,3-diene、but-1-yne、but-2-yne が考えられる。
炭素が4つであるから、2-メチルプロパンのように枝分かれを持つ可能性があるが、2-メチルプロパンの構造に(構造として矛盾なく)2箇所の二重結合を導入したり、三重結合を導入することができないので、該当する構造は無い。
(c) C3H4 は、不飽和度が2であるから、
2つの環をもつもの:0種類
1つの環と二重結合をもつもの:1種類
環を持たないもの;
2つの二重結合をもつもの:1種類
3重結合を1つもつもの:1種類
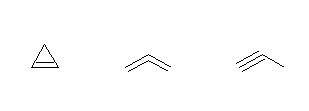
炭素数が3しかないから、環を2つもつことはできない。したがって、シクロプロパンに二重結合を加えた、cyclopropene、そして、3つの炭素が直線状に並び、二重結合を2つもった propa-1,2-diene、同様に3つの炭素が直線状に並び、三重結合をもった prop-1-yne が考えられる。
6.02
C, H 以外の元素については、次のように置き換えてから不飽和度の計算をすると、炭化水素に帰着させることができる。
-NH2 → -H (分子式から、NnHn を引き去る。窒素と同数の水素を減じてから不飽和度を計算する。)
-OH → -H (分子式から、On を引き去る、または、酸素は無視して不飽和度を計算する。)
-Br, -Cl, -I → -H (分子式から、Xn を引き去り、Hn を加える。ハロゲンは水素に置き換えてから不飽和度を計算する。)
(解答例)
ヒントに示した方法により、同じ不飽和度をもつ炭化水素の分子式を求め、これより計算した。
(a) C6H5N → C6H4 と同じ不飽和度
{(6*2+2)-4}/2 = 5
(b) C6H5NO2 → C6H4 と同じ不飽和度
{(6*2+2)-4}/2 = 5
(c) C8H9Cl3 → C8H12 と同じ不飽和度
{(8*2+2)-12}/2 = 3
(d) C9H16Br2 → C9H18 と同じ不飽和度
{(9*2+2)-18}/2 = 1
(e) C10H12N2O3 → C10H10 と同じ不飽和度
{(10*2+2)-10}/2 = 6
(f) C20H32ClN → C20H32 と同じ不飽和度
{(20*2+2)-32}/2 = 5
6.03
まず、条件より、不飽和度を求めよ。次に、この不飽和度となるよう、問い 6.2 のヒントも参照しながら水素数を計算せよ。
(解答例)
環が3つ、二重結合が8箇所であるから、不飽和度は11である。炭化水素において、不飽和度が1増すごとに水素数は2つずつ減るから、この化合物が仮に炭素と水素のみから出来ている炭化水素であるものとすると、炭素数が16である場合、16×2+2−(11×2)=12個となる。ハロゲンが1つ含まれるためには水素数が1つ少なくなり、窒素が2つ含まれるためには水素がその同数の2つ増える。また、酸素は水素の数に影響を与えないから、12−1+2=13より、ジアゼパムの分子式は C16H13ClN2O である。
なお、ジアゼパムの構造式は次の通り。
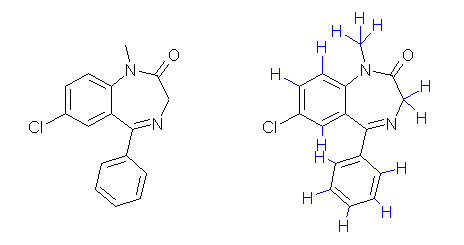
左が通常の構造式の書き方に従ったもの。右は、水素をすべて明示した。骨格や炭素、窒素、酸素といった原子の位置や結合の順序が異なっていたとしても、同じ不飽和度をもてば(環の数と多重結合の数が同じであれば)水素の数は同じになる。
6.04
教科書 §6.3 (pp172-173) の命名法を復習すること。二重結合を含んだ一番長い炭素鎖が主鎖となる。その長さのアルカン(alkane)から派生した名前をつける。アルキル置換基等よりも、二重結合の位置を優先して番号が小さくなるように位置番号を振る。アルケンの位置番号は、C2 と C3 の間が二重結合である場合は、アルカ-2-エン( alk-2-ene )のように表現する。
教科書の問いの短縮構造式を見ながら、骨格構造式に書き直してみること。その上で、どこが主鎖になるのかを探すとよい。
(解答例)
(a) 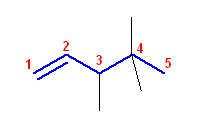
3,4,4-trimethylpent-1-ene
二重結合の番号が小さくなるよう主鎖を選ぶ。主鎖は、二重結合が C1 と C2 の間にくるので、pent-1-ene となる。2,2,3-trimethylpent-4-ene ではない。
(b) 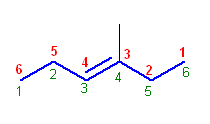
3-methylhex-3-ene
主鎖の二重結合の位置は、左右どちらから数えても同じ番号となるから、次の選択肢として、側鎖の番号が小さくなるようにしてよい。従って、上の構造では右から数える(赤字)。
(c) 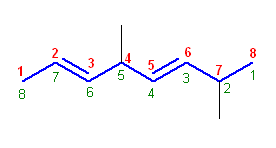
4,7-dimethylocta-2,5-diene
主鎖のオクタン上の二重結合の位置番号(のうち、若い方)がより小さくなるように番号を振る。従って上の構造では左から数える(赤字)ので、主鎖は、octa-2,5-diene となる。
(d) 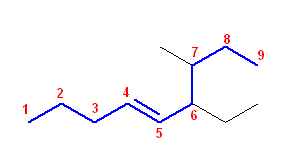
6-ethyl-7-methylnon-4-ene
多重結合を含む中で最長のつながりは、上図のように9つの炭素鎖であるから、主鎖は nonene である。位置番号は二重結合の番号が小さくなるように振る。
(発展)
ヒントに関連して、alk-2-ene ( アルカ-2-エン )は、2-alkene( 2-アルケン )とも表記される。新しいIUPACの勧告は、位置を示す番号を主官能基を表す ene の直前におき曖昧さを少なくするものであるが、慣例的な理由で以前の表現も多く利用されている。適宜、どちらを用いても間違いとはいえないが、新表記に慣れておくべきだろう。なお、この授業においては化合物の命名はすべて英語表記でできるようになることを求めるが、位置番号の位置の違いにより綴りそのものには変化がないが、カタカナ表記では、英語綴りで存在しない母音を補っていることに注意せよ。(alkene アルケン → alk-ene アルカ-エン)。
6.05
IUPAC名のうち、置換基を表している「番号+置換基名」(場合によっては複数存在する)を除いた部分が「多重結合の位置+(主鎖の長さを情報として含む)アルケン名」である。まず、その構造を書き、番号をつける。(慣れてきたら、番号については頭の中で確認するだけでもよい。)その上で、先に省略していた置換基をすべて書き込む。
(解答例)
ここでは、主鎖を左から右に向かって書いているが、他の書き方でもよい。回転や平行移動、単結合の廻りの回転で重ねることができるものは同じ構造である。
(a) 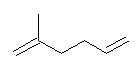
(b) 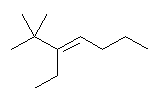
(c) 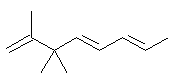
(d) 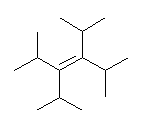
6.06
(ひとつの)多重結合の位置が、C1、C2となるように番号をつける。複数の多重結合が環内にある場合は、次の多重結合の位置番号が小さくなるようにする。次いで、はじめにでてくる置換基(同順の位置に複数ある場合はアルファベット順で先にくるもの)の位置番号が小さくなるように番号を決める。
(解答例)
(a) 1,2-dimethylcyclohexene
(b) 4,4-dimethylcycloheptene
(c) 3-isopropylcyclopentene
or, 3-(1-methylethyl)cyclopentene
6.07
骨格構造式にかきなおしてみてから、自分の描いたアルケンにシストランス異性体(幾何異性体)があるかどうかを判断すると良い。
(解答例)
(a), (b), (d) は、二重結合の炭素の一方に、同じ置換基が2つ結合している。このようなものについては、シストランス異性体(幾何異性体)は存在しない。
左のものがシス(水素と水素が同じ側にあるから)、右のものがトランス。
(c) 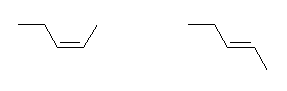
(e) 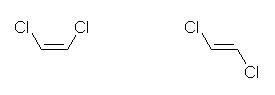
(f) 
§6.5 で学ぶ E, Z 配置とは異なり、あくまでも「同じ置換基」が同じ側か反対側かで考える必要がある。(c) や (f) については、水素以外の置換基すなわち、メチルとエチル、ブロモとクロロのように「異なるもの同士」が同じ側にあるかどうかは、シス、トランスという命名の基準にはならない。
6.08
シス、トランスの表示は 小文字、イタリックで。間にハイフンを書く。
(例)trans-alk-2-ene
(解答例)
(a) cis-4,5-dimethylhex-2-ene
(b) trans-6-methylhept-3-ene
それぞれ、cis-4,5-dimethyl-2-hexene、trans-6-methyl-3-heptene という書き方もあるが、新しいIUPAC勧告に従った書き方に慣れるように。
6.09
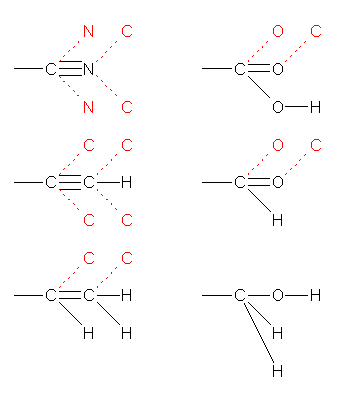
原子番号の大きい順。同じ原子については、次の原子で判断する。二重結合の場合は、6.41 のヒント等も参照のこと。
(解答例)
原子番号の大きい順。
同じ原子の場合は、次の原子で判断する。(ここでは特殊な表記を用いて赤字で示した。元素記号に隣接したカッコ内に、その原子から結合しているとみなす原子(や、原子団)を書いた。)
(a) −Br > −H
(b) −Br > −Cl
(c) −CH2CH3 > −CH3 : −C(C(H,H,H),H,H) > −C(H,H,H)

(d) −O(H) > −N(H,H)
(e) −CH2OH > −CH3 : −C(O(H),H,H) > −C(H,H,H)
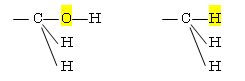
(f) −CH=O > −CH2OH : −C(O(C),O,H) > −C(O(H),H,H)
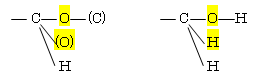
6.10
原子番号の大きい順。同じ原子の場合は、次の原子で判断する。
二重結合の場合は、6.41 のヒント等を参照のこと。多重結合を含む系について次に例示した。
左段、上より −C≡N, −C≡CH, −CH=CH2。右段、上より −CO2H, −CHO, −CH2OH
(解答例)
(a) −Cl > −OH > −CH3 > −H
(b) −CH2OH > −CH=CH2 > −CH2CH3 > −CH3 : −C(O(H),H,H) > −C(C(C,H,H),C,H) > −C(C(H,H,H),H,H) > −C(H,H,H)

(c) −CO2H > − CH2OH > −C≡N > −CH2NH2 : −C(O(C),O(H),O) > −C(O(H),H,H) > −C(N(C,C),N,N) > −C(N(H,H),H,H)
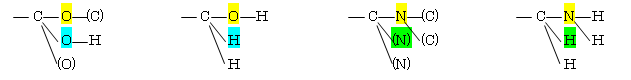
(d) −CH2OCH3 > −C≡N > −C≡CH > −CH2CH3 : −C(O(C(H,H,H)),H,H) > −C(N(C,C),N,N) > −C(C(C,C,H),C,C) > −C(C(H,H,H),H,H)
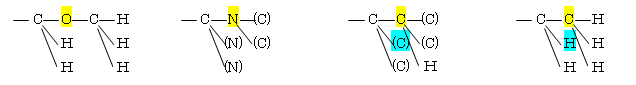
6.11-6.20
6.11
6.41 のヒントを参照。
(解答例)
(a),(c) → Z
(b),(d) → E
なお、アルケンの E/Z の帰属には関係ないが、IUPAC名をつける際には、(a) 、(c)、 (d) は、いずれも命名上アルケンよりも優先度の高い官能基を含んでいる。そのような場合、炭素鎖の番号の選び方と、主官能基名(命名における接尾語)が変化する。 E/Z 配置を除いた名称は次の通り。
(a) 2-chloro-3-methylpent-2-en-1-ol, 二重結合よりアルコールが優先されるから、水酸基の結合した炭素の番号が小さくなるように主鎖の1の位置を決める。
(b) 1-chloro-2-ethyl-1-methoxypent-1-ene, エーテルは主官能基にならない。メトキシ基は、他のクロロ、エチルと同列に扱い、アルファベット順に置く。
(c) 3-hydroxy-2-(3-methylcyclopentylidene)propanoic acid, この分子中、カルボン酸が最も優先される官能基であるから、カルボン酸の炭素(結合した位置ではない)の番号を1とする。
(d) 2-aminomethylbut-2-enenitrile, この分子中、シアノ基(シアノ基を含む化合物の一般名はニトリル)が最も優先される官能基であるから、シアノ基の炭素(結合した位置ではない)の番号を1とする。
(発展)
アルケンのシス−トランス異性体については、cis-, trans- および (E)-, (Z)- のどちらでも表せるものもある。しかし、一般的に (E)-, (Z)- の表記を用いることが推奨される。なお、次のような分子では、trans- 体であるが、Z 体である。つまり、「cis- 体 = Z 体、trans- 体 = E 体」という覚え方をしてはいけない。
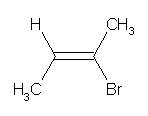
(この分子では「同じもの(メチル基)」がトランスの位置に結合しているが、「優先順位の高いもの(メチル基、および臭素)」はシスの位置に結合している。)
6.12
イソプロピル基ほか、いくつかの水素の部分が重なっていて見づらいので、注意すること。
(解答例)
構造式に書き直すと、次の通り。
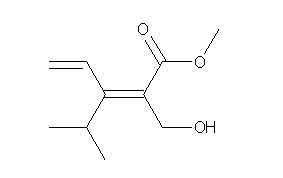
これを、多重結合の部分に、「規則3」でいうところの等価な単結合原子(赤文字)を補って表示すると次図のようになる。
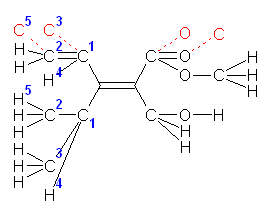
向かって左側、vinyl 基と isopropyl 基の優先順位を決める際、青の数字の順に原子を確認する。(1) 始めの原子が C で共通、(2)(3)(4) そこに結合した原子も C,C,H で共通である。(5) 二重結合からの結合の数が3本目の原子として C(5),H,H の結合した炭素( C(2) )の方が、H(5),H,H の結合した炭素より優先順位が上であることが決まる。よって、vinyl 基の方が優先順位が上である。
向かって右側、methoxycarbonyl 基と、hydroxymethyl 基では、O,O,O の結合した methoxycarbonyl 基 の炭素の方が、O,H,H の結合した hydroxymethyl 基の炭素より、優先順位が上である。
したがって、Z 体である。
(発展)
この化合物では、ester が最優先される官能基である。メチルエステルの場合、その命名は methyl alkan-oate となる。(エステル酸素上の置換基 methyl と、主鎖の構造を示す alkanoate の間には半角スペースがある。なお、この命名ではエステルはカルボン酸塩などと同列に扱っているものである。すなわち、「alkan-oate」の部分は、R-CO2- というカルボン酸の共役塩基の部分と共通の命名であり、メチルエステル R-CO2CH3 が methyl alkan-oate となるのに対し、カルボン酸のナトリウム塩R-CO2Na は、sodium alkan-oate となる。)
問い 6.11 のカルボン酸やニトリルのときと同様、エステルの(付け根ではなく)カルボニル炭素の位置が1位となり、以下、主鎖中に最多(この分子の場合2つ)の二重結合がくるように炭素鎖をえらび、番号をつける。二重結合の位置は C2-C3 および、C4-C5 である。C2上にある置換基は、複合官能基(水酸基をもつメチル基)でヒドロキシメチル基(メチルは炭素に番号をつけて区別する必要がないので、2-(1-hydroxymethyl) のようにする必要がない)。また、C3 上の置換基はイソプロピル基(または、1-メチルエチル基)。立体化学以外の完全な名前は次の通り。
methyl 2-hydroxymethyl-3-isopropylpenta-2,4-dienoate
6.13
安定性については、(a)、(c)は、 二重結合の上のアルキル置換基の数による違い、(b) はシス体とトランス体による違いに注意して解答すること。
(解答例)
(a) but-1-ene と 2-methylprop-1-ene 。より多置換である 2-methylpropene の方が安定。
(b) (Z)-hex-2-ene と、(E)-hex-2-ene 。立体障害の小さな E-体の方が安定。
(c) 1-methylcyclohexene と 3-methylcyclohexene 。より多置換である 1-methylcyclohexene の方が安定。
(b) では、命名に E/Z 表記を用いることに慣れて欲しいが、 cis-, trans- の表記でも間違いとはしない。
6.14
(b)〜(d) は、非対称なアルケンなので付加反応の配向性を考える必要がある。そのために反応機構を考えること。中間体として生じるカルボカチオンの安定性により配向が決まる。(マルコフニコフ配向)
なお、(c) では、はじめに酸由来の H+ が付加したあと、カルボカチオンに水が付加し、H+ が脱離するという過程を考えるとよい。
(解答例)
(a) 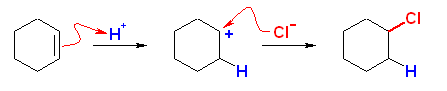
chlorocyclohexane
(b) 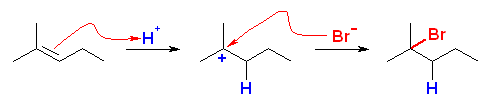
2-bromo-2-methylpentane
(c) 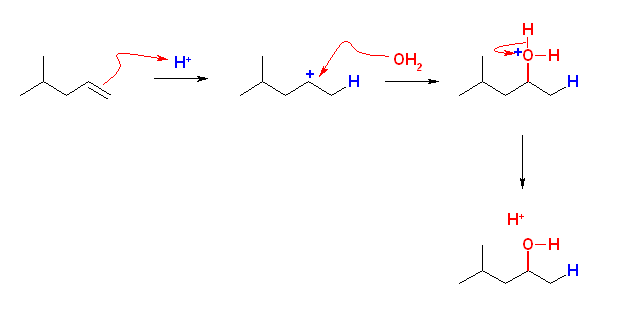
4-methylpentan-2-ol
(d) 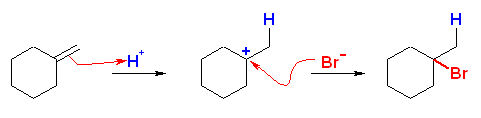
1-bromo-1-methylcyclohexane
(発展)
ヒントに示した (c) の反応機構では、反応が進行しても、H+ は消費されずに再生される。そのため、酸は触媒であるということができる。触媒とは、反応によって変化せず、ただ反応速度だけを速くする性質をもつ。もし、酸が触媒として加えられていないと、中間体のカルボカチオンを生じないから、水の付加が起きない。
6.15
ハロゲン化水素の付加反応では、二重結合の両端の炭素の一方にはハロゲンが、一方には水素が付加する形式であるから、目的とするハロゲン化アルキルの、ハロゲンの結合した位置の炭素、および、隣接する炭素の間に二重結合を持つアルケンが出発原料となる。
ハロゲンの結合した炭素が2級や3級のときは、隣接炭素が複数あって二重結合を入れるべき位置に可能性がいくつかある場合には、それぞれについて、そのアルケンにプロトンを付加してカルボカチオンを生じさせるときに目的物に対応したものが生じるかどうかを確認する必要がある。
(c) は、考えられる一方のアルケンからは、安定性に差のない2種のカルボカチオンが生じるため、2種のハロゲン化アルキルの混合物となってしまうが、もう一方のアルケンからは、(対称性の関係から)1種のカルボカチオンしか生じない。
(d) は、考えられる一方のアルケンからは、2級と3級のカルボカチオンを生じるような位置であるが、その安定性の差より3級のカルボカチオンが生じるのに対し、目的とするハロゲン化アルキルは2級のカルボカチオン経由で生じるため、原料としてふさわしくない。もう一方のアルケンからは、1級と2級のカルボカチオンが生じるような位置であり、安定性の差より2級のカルボカチオンのみが生じるため、目的のハロゲン化アルキルを与える。
(b) は、考えられるアルケン2種は、いずれも2級と3級のカルボカチオンを生じるような位置であるから、3級のカルボカチオン1種のみが生じ、目的とするハロゲン化アルキルを与える。
(a) は、分子の対称性の問題より、考えられるアルケンはもともと1種類しかない。
(解答例)
(a) 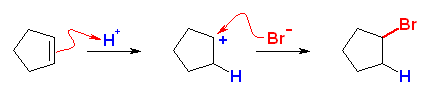
cyclopentene と HBr により生じる。
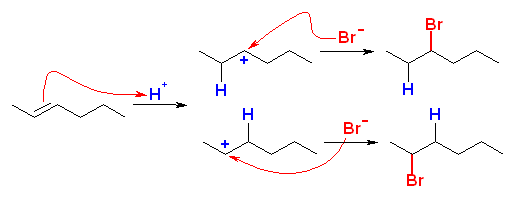
(b) 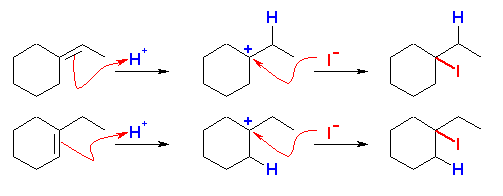
1-ethylcyclohexene または、ethylidenecyclohexane と HI とにより生じる。
(どちらから出発しても、中間体としては、3級のカルボカチオンしか生じない。)
(c) 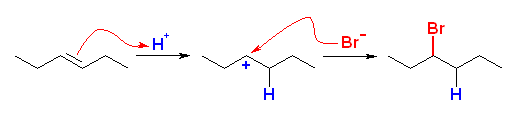
hex-3-ene と HBr により生じる。
hex-2-ene からは、上図のように2種類の2級のカルボカチオンを生じてしまうから、3-bromohexane 以外に、2-bromohexane が同じくらい生じてしまう。
(d) 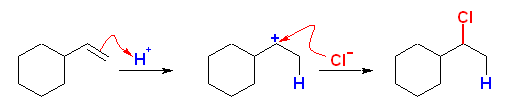
vinylcyclohexane と HCl により生じる。もし、 ethylidenecyclohexane を用いると、(b) のように3級のカルボカチオンを優先して生じるから、目的とする (1-chloroethyl)cyclohexane ではなく、1-chloro-1-ethylcyclohexane を生じてしまう。
(発展)
(d) の解説に関連して、次の2つの名称に対応する構造を整理しておくこと。
(1-chloroethyl)cyclohexane
1-chloro-1-ethylcyclohexane
6.16
カルボカチオンは、1級より2級、2級より3級が安定である。
(解答例)
(a) 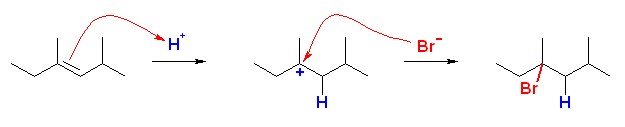
(b) 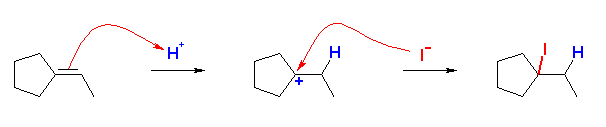
6.17
カルボカチオンの電荷を担う炭素は、sp2 混成で、3配位平面形の結合を持つ。従って、図で示されている中で、結合が3本しかない炭素上に正電荷を持つことがわかる(※)。その炭素の、sp2 混成に寄与しない空の p 軌道は、3本の結合のつくる平面と直交している。隣接した炭素のシグマ結合(C−H など)のうち、このp 軌道と平行になるシグマ結合が超共役に関与する。
(※)ただし、骨格構造式のように二重結合を2本の価標で表している場合はわかりやすいが、分子の立体構造を表すための図の中には二重結合が1本の線でしか示されない場合もある。その場合、二重結合をとる両方の炭素ともが3配位平面構造をもつ。従って、図の中に3本しか結合を持たない炭素を見つけたあと、すべての隣接する炭素を調べる必要がある。隣接する炭素がすべて4本の結合を持ちながら、自分自身が3本しか結合を持たない(隣との間での多重結合によるものではない)ということが分かれば、その炭素上に正電荷があるものと判断できる。
(解答例)
構造式に書き直すと、次のようになる。
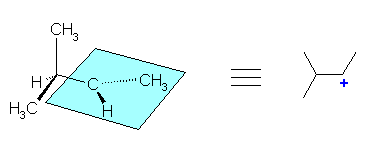
水色の平面の中心にある炭素が、3配位、平面型であることから、カルボカチオンの中心炭素であると判断できる。従って第2級のカルボカチオンである。
この立体配座にあるとき、カチオン炭素の空の p 軌道 は、水色の平面に垂直な方向にでているから、これと同じ方向をむいている C-H シグマ結合が超共役に関与する。
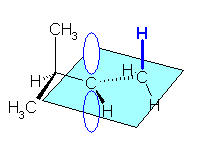
立体配座を固定しない(単結合の周りの自由回転を許す)なら、カチオン炭素に隣接した2つの炭素から結合している合計6本のシグマ結合(C-H シグマ結合に限るなら4本)のすべてが、超共役に関与する可能性がある。(これらが同時には関与できない。それぞれの配座において、カチオン炭素の空の p 軌道と平行に近いものだけが関与する。)
6.18
教科書 §6.10(pp 193〜196)の Hammond の仮説についてよく読むこと。
A から遷移状態 B を経由して C に至るとき、図 6.13 にも示されるように吸エルゴン的な反応では遷移状態は生成物に近く、発エルゴン的な反応では遷移状態は出発物に近い。(グラフの横軸が「反応の推移」を表していることに注意。すなわち、グラフ上で横方向に近い位置にある状態ほど構造も互いに似ていると近似的に考えてよい。)
一般に反応中間体は出発物質や生成物よりもエネルギーが高いから、反応中間体が生じる過程は吸エルゴン的、反応中間体より生成物に至る過程は発エルゴン的であると考えられる。
(解答例)
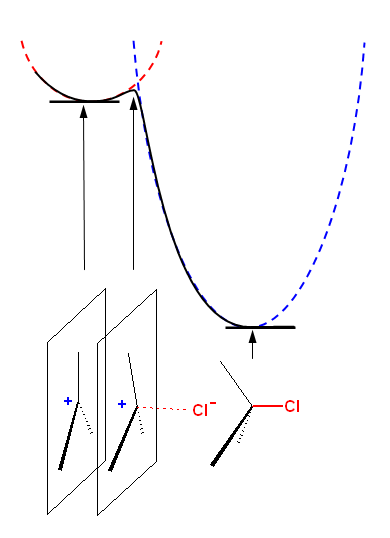 中間体は、(反応出発物質や)反応生成物よりエネルギーが高いはずであるから、発エルゴン過程である。(もし、一番安定なエネルギーであれば、反応の途中で生じる単離されない物質ではなく、安定な生成物として単離されるようになる。)
中間体は、(反応出発物質や)反応生成物よりエネルギーが高いはずであるから、発エルゴン過程である。(もし、一番安定なエネルギーであれば、反応の途中で生じる単離されない物質ではなく、安定な生成物として単離されるようになる。)
第2段階の遷移状態は、中間体から生成物への変化の途中に生じる遷移状態である。Hammond の仮説によれば、この遷移状態は、中間体に近い構造を持つはずである。
左の図では、赤の破線のエネルギー曲線で中間体を表した。(反応してしまうことなく、安定な構造から、構造が変化すると、エネルギーは高くなる。)青の破線は、生成物の構造のポテンシャルエネルギー曲線である。(たとえば、C−Cl 結合の長さが伸びればエネルギーの高い状態になる。)
この両者ともに近い構造が、遷移状態の構造であると考えられ、共通のポテンシャルエネルギー曲線上にある(付近の)点を経由して、反応は進行する(黒の実線)と考えられる。
中間体は、平面3配位のカルボカチオン、生成物は4面体型の4配位であるから、遷移状態はその中間で、正電荷をもつ炭素と塩素アニオンの間で引力的な相互作用がはじまり、結合が出来かけたような状態であると予想される。塩素アニオンから電子が流れこんで共有結合を生成すると、生成物である。
6.19
生じている過程は文章で書くと次のようになる。これを電子対の移動を表現する矢印で描くこと。
・臭化水素から水素イオンがビニル基のパイ電子に付加し、2級のカルボカチオンを生じる。
・続いて、シクロヘキサンの置換基の根元の3級水素が、結合電子ごと(すなわちヒドリドとして )転位し、結果として3級のカルボカチオンとなる。
・最後に、臭素化物イオンがカルボカチオンに付加する。
(解答例)
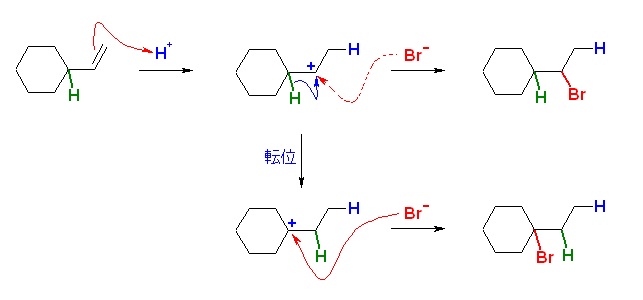
3級水素がヒドリドとして隣接炭素上へ移動(転位)することにより、より安定な3級のカルボカチオンを生じる。
(発展)
カルボカチオンは、条件により、簡単に骨格の転位を起こすことが知られている。水素、メチル基、フェニル基などが比較的簡単に移動しやすい。
カルボカチオンの転位の機構を、「ヒドリド移動」と「アルケンへのプロトンの可逆的な付加と脱離」の両方で示した。本質的にはどちらも同じ結果を生じている。
6.20
アルカンよりもアルケンの方が優先されるから「多重結合を含む中で一番長い」部分が主鎖となる。二重結合が C2 と C3 の間にある炭素数6のアルケンは、二重結合の位置:2番目の炭素(と3番目の炭素の間)を示す数を母体名(ヘキセン)の前に置き、hex-2-ene とする。更に、ここに置換基を表す部分を加え、完全な名前とする。
シクロアルケンの場合は、cycloalk-1-ene に対して置換基の位置を示す番号がなるべく小さくなるように番号を振ることに注意。(通常、cycloalk-1-ene の -1- は省略されるので明示されない。)
(解答例)
(a) 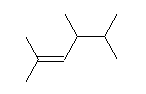
2,4,5-trimethylhex-2-ene
(b) 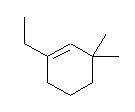
1-ethyl-3,3-dimethylcyclohexene
6.21-6.30
6.21
それぞれ、分子内に二重結合は複数あるが、立体化学(幾何異性体)が区別されるような二重結合はそれぞれ、1箇所ずつであることに注意せよ。
なお、発展でも述べるが、アルデヒド基やカルボン酸は、命名上アルケンよりも優先される官能基である。
(解答例)
図中、太い線で表した位置の二重結合に対して立体化学が区別できる。複数の二重結合に対して立体化学が区別できるときも、同様の命名に従う。(→発展の項を参照)
(a) 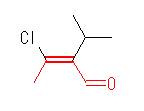
(E)-3-chloro-2-isopropylbut-2-enal
(b) 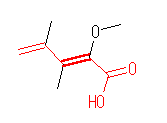
(Z)-2-methoxy-3,4-dimethylpenta-2,4-dienoic acid
(発展)
次のような構造を持つ場合、「炭素の数が多いこと」や「多重結合の数が多いこと」よりも「カルボン酸を含むこと」が主鎖を決める上での優先事項になるので、赤で示した部分が主鎖となる。
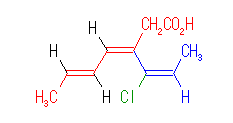
これを命名するときは、次のようになる。
3-[(E)-1-chloroprop-1-enyl]-(3Z,5E)-hepta-3,5-dienoic acid
6.22
「2つの異なるアルケン」は、HCl との求電子付加反応において同じ中間体を与えるということである。反応の形式を考えるならば、カルボカチオンの正電荷が存在する炭素が、もともとの二重結合の一端である。
図より、どの位置の炭素上に正電荷が存在するカルボカチオンかを判断する際、炭素からでている結合の数に注目すればよい。
(解答例)
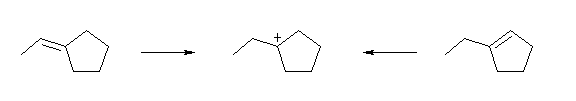
生じたカルボカチオンの正電荷は、もとの二重結合に関与した2つの炭素の一方であったことを考えると、上図のようになる。どちらの場合も、もとの二重結合の炭素上の置換基の数は1と2であり、従って2級および3級のカルボカチオンが生じる可能性のある構造であるが、実際にはどちらから出発した場合でも、3級のカルボカチオンのみが生じると予想できる。
超共役が最大になるのは空のp軌道と平行な方向に結合したC-Hである。
ほとんど平面内にある5員環の炭素からでている C-H 結合は、カルボカチオンの電荷をもつ炭素の空のp軌道と平行になることができない。エチル基は5員環に対して自由に回転することができるので、空のp軌道との超共役が大きい(すなわち安定なカルボカチオンを生じるような)角度をとることができる。
6.23
不飽和度の計算法における、炭素、水素以外の種々の原子の影響は、教科書 p170-171 にも書かれているように、その原子の持つ結合の数で決まってくる。ただ、このページ全体を理解しようとせずに下部の「まとめると」の部分のみをただ丸暗記しようとするなら、それは間違いのもとになるばかりでなく、おおいに無駄である。
簡単に不飽和度を知るための手段のひとつは、ある程度小さな原子数の分子であれば、その数の炭素を直鎖状にならべて描き、水素、その他の元素を書き加えてみて、実際にいくつ不飽和結合を足せば良いかを確認してみることである。(この作業を、上記「まとめ」を意識しながら行えば、その意味が理解でき、構造式を書いてみなくても不飽和度が計算できるようになる。)
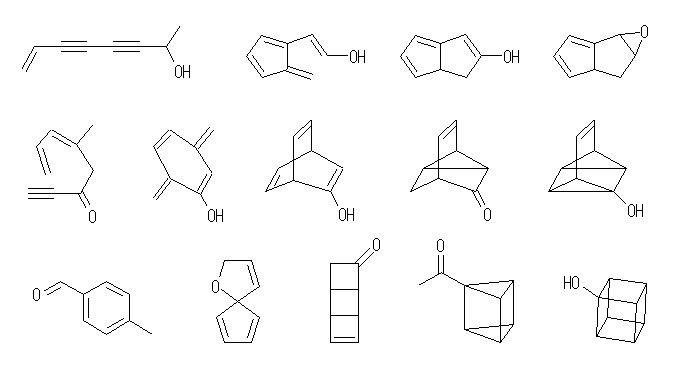
(解答例)
同じ不飽和度でも、可能な構造は、そこに含まれる環構造の数で分類することができる。たとえば不飽和度が2であれば、可能な構造として次の場合がある。
・多重結合を2つ持つ場合。(3重結合が1つ、または2重結合が2つ)
・環の構造を1つと、多重結合を1つ持つ場合。
・環の構造を2つもつ場合。
図で与えた例が、それぞれいくつの環構造と多重結合を含むか、数えて確認すること。また、自分で「例」として描いた構造が正しい不飽和度をもつかどうかも判定せよ。
ただし、多重結合は炭素−炭素間のみとは限らない。代表的なそれ以外の多重結合としては、カルボニル( C=O )や、ニトリル( C≡N )などがあり得る。
また、環の員数は3以上の任意であるし、環以外の部分は直鎖状でも分岐していても構わない。つまり、含酸素化合物では、エーテルおよびアルコール、アルデヒド、ケトンなどを考える必要がでてくる。
以下には、いくつかの代表的な例のみを示し、"すべての"可能な構造式を与えることはしない。
(a) C10H16 … 不飽和度 = 3 (= [22-16]/2 )
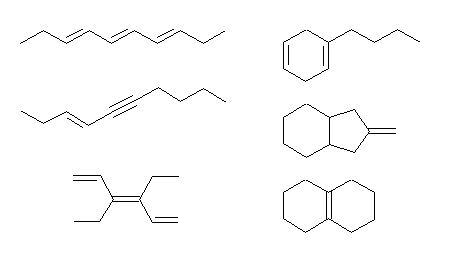
(b) C8H8O … 不飽和度 = 5 (= [18-8]/2 )
(c) C7H10Cl2 … 不飽和度 = 2 (= [16-(10+2)]/2 )
(d) C10H16O2 … 不飽和度 = 3 (= [22-16]/2 )
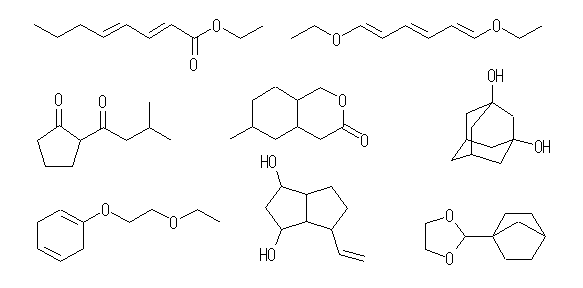
(e) C5H9NO2 … 不飽和度 = 2 (= [12-(9-1)]/2 )
(f) C8H10ClNO … 不飽和度 = 4 (= [18-(10+1-1)]/2 )
6.24
炭素の数と水素の数の関係から不飽和度が計算されるのだから、同様に炭素の数と不飽和度が判れば水素の数は計算できるはずである。
(解答例)
(a) 環を2つ、二重結合を1つ持つのだから、不飽和度は3である。分子中の酸素の数は同じ不飽和度をもつ化合物中の水素の数に影響を与えない。炭素数8の化合物において、飽和のアルカンでは水素数は18個だから、不飽和度3の場合、水素の数は18−6=12である。従って、完全な分子式は C8H12O2
(b) 二重結合を2つ持っているのだから、不飽和度は2である。炭素数7の飽和アルカンでは水素数が16個であるが、窒素が1つあることによって水素数は1つ多くなる。そのため、不飽和度2であるためには、水素の数は16+1−4=13である。従って、完全な分子式は C7H13N
(c) 環を1つ、二重結合を3つ持つのだから、不飽和度は4である。炭素数9の飽和アルカンでは水素数が20個であるが、分子中の酸素の数は同じ不飽和度をもつ化合物中の水素の数に影響を与えず、窒素が1つあることによって水素数は1つ多くなる。そのため、不飽和度4であるためには、水素の数は20+1−8=13である。従って、完全な分子式は C9H13NO
6.25
問い 6.24 と同様に考えよ。
(解答例)
環を4つと二重結合を8つ持つのだから、不飽和度は12である。炭素数22の飽和アルカンでは、水素数は46個であるが、分子中の酸素の数は同じ不飽和度をもつ化合物中の水素の数に影響を与えず、窒素が2つあることによって水素数は2つ多くなる。一方で、塩素は1つにつき、水素数を1つ減らすから、この分子の場合、水素の数は46+2−1−24=23である。従って、完全な分子式は C22H23ClN2O2
6.26
教科書 §6.3 (pp 172-174)の命名法を復習すること。立体化学が区別されるような構造式が与えられている場合は、幾何異性体の区別として、E, Z 表記をするようにする。
(解答例)
(a) (E )-4-methylhex-2-ene
(b) (Z )-4-ethyl-3,7-dimethyloct-2-ene
(c) 2-ethylbut-1-ene
(d) (E )-3,4-dimethylhepta-1,5-diene
(e) (2Z, 4E )-4,5-dimethylocta-2,4-diene
(f) buta-1,2-diene
(a) の (E )-4-methylhex-2-ene を (E )-4-methyl-2-hexene のように書いても可である。(b) 以下も同様。
(a) では、「hex-2-ene」の部分、「hexa-2-ene」ではないことに注意。(b),(c) も同様に、-ene の直前の母音を落とすことを忘れないこと。ただし、(d),(e),(f) は、-diene (母音ではなく子音 d で始まる)をつける際に、hepta-1,5-diene のように母音 a が落ちないことに注意すること。これらの事情は、位置番号を示す数字の位置によっては影響されないから、「2-hexene」 は「hex-2-ene」、「1,5-heptadiene」は「hepta-1,5-diene」と同じである。また、稀に語尾の e を落としてしまっている人もいるが、注意されたい。
(c) は、"(最多の)多重結合を含む中で"一番長い部分を主鎖にとるから、3-methylene-pentane や 3-methylidene-pentane ではない。
(d) は、(置換基の位置よりも優先して)二重結合の位置番号が小さくなるように番号を振ることに注意する。
(e) 2つの二重結合の立体化学を表す場合は、6.21の(発展)を参照すること。
(f) このように連続した二重結合は、集積二重結合とよばれる。間の炭素は sp 混成で、結合角は180度である。なお、この集積二重結合の系においては、間の sp 炭素の2つの p 軌道の都合から、隣接した2つのπ軌道同士が90度に直交していることになる。
6.27
教科書 §6.3 (pp 172-174)の命名法を復習すること。
(解答例)
(3E )-3,7-dimethylocta-1,3,6-triene
最も多くの二重結合を含む炭素鎖を主鎖に選ぶ。また、番号は、1つめの二重結合の番号が小さくなるように振る。(逆から振ると、2,5,7 になるが、2より1の方が小さいので、1,3,6である。)
(発展)
教科書に与えられているのは、β-ocimene ( Me2C=CHCH2CH=CMeCH=CH2 )である。
α-ocimene は CH2=CMeCH2CH2CH=CMeCH=CH2 の構造をもつ。
β-オシメンは、植物の害虫に対する誘導防衛に関与する物質として知られている。
詳細は、ここ(外部へリンクします。 などを参照のこと。
6.28
教科書 §6.3 (pp 172-174)の命名法を復習すること。
(解答例)
(3E, 6E )-3,7,11-trimethyldodeca-1,3,6,10-tetraene
最も多くの二重結合を含む炭素鎖を主鎖に選ぶ。また、番号は、1つめの二重結合の番号が小さくなるように振る。
6.29
教科書 §6.3 (pp 172-174)の命名法を復習すること。
(解答例)
上段左より (a) 〜 (c)、下段左より (d) 〜 (f)
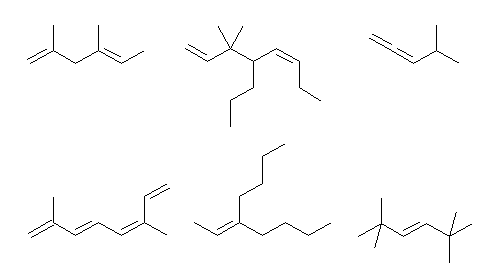
6.30
教科書 §6.3 (pp 172-174)の命名法を復習すること。
(解答例)
シクロヘキサン環の番号は、二重結合のある位置の炭素が1と2になる。その制約の上で、はじめに出てくる置換基の番号が若くなるようにつけるわけだが、そうすると、置換基(イソプロピル基)が結合している方の炭素が1となり、もう1つの二重結合炭素が2になるので、上図では右周りに番号をつけることが決定される。従って、メチル基の結合位置は4位となる。
命名においては、置換基をアルファベット順に並べるから、1-isopropyl-4-methyl の順に書かれる。cyclohexene の二重結合の位置を明示するなら、cyclohex-1-ene(カタカナ表記の場合、シクロヘキサ-1-エン)だが、1箇所しか二重結合がないシクロアルケンの場合、かならず -1-ene となるから、位置番号は省略される。
6.31-6.40
6.31
主鎖のアルケンごとに分類して探す。
・主鎖が pentene となるもの
→ pentene の二重結合の位置異性体を探す。( pent-1-ene, pent-2-ene )
そのそれぞれについて、幾何異性体が存在しないかチェックする。
・主鎖が butene となるもの
→ butene の二重結合の位置異性体を探す。( but-2-ene, but-2-ene )
→ 上のそれぞれに、異なる位置に methyl 基を置換させる。( 2-methylbut-1-ene, 3-methylbut-1-ene, 2-methylbut-2-ene )
そのそれぞれについて、幾何異性体が存在しないかチェックする。
(別法)次のようにさがしてもよい。
対応するアルカンの構造異性体をすべて描き、そのそれぞれについて、重複のないように二重結合を書き込む。
・pentane 由来のもの。
・2-methylbutane 由来のもの。
そのそれぞれについて、幾何異性体が存在しないかチェックする。
(解答例)
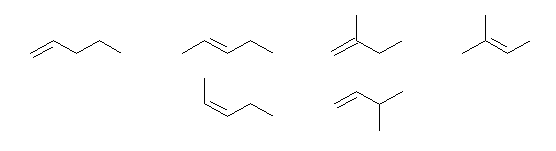
上段左より
pent-1-ene,
(E)-pent-2-ene,
2-methylbut-1-ene,
2-methylbut-2-ene
下段左より
(Z)-pent-2-ene,
3-methylbut-1-ene
6.32
6.31 と同様に場合分けしながらすべてを探す。
アルカンでは一番長い炭素鎖を主鎖としたのに対し、アルケンでは、二重結合を含む中で最も長い炭素鎖を主鎖とする。
このため、アルカンでは 2-ethyl〜 という置換基は存在できなかったのであるが(たとえば 2-ethylbutane と置こうとすると、butane より長い炭素鎖があることになるから、3-methylpentane と命名されなければならない。)これに対し、アルケンでは、2-ethyl-alk-1-ene (主鎖が最多の炭素鎖ではない)などのような置換基の置き方も可能であることに注意する。
(解答例)
赤で示した4種は幾何異性体をもつが、ここでは一方のみを示している。そのため、問題に指定してある17種のうち、13種のみを示している。宿題においては、省略せずに17種すべての構造を書き、命名まで行うこと。
次図において、主鎖ごとに分類して場合を尽くして探した。側鎖アルキル基は○で囲んで示している。
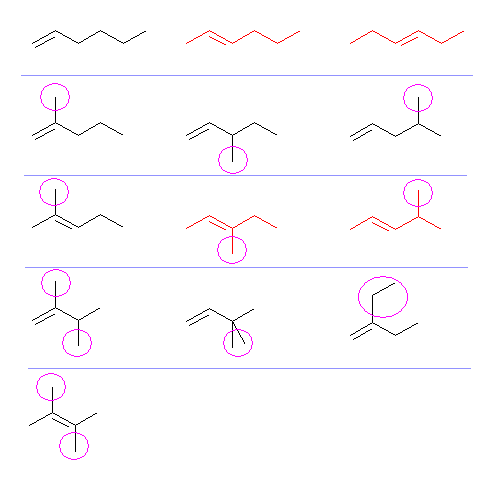
命名は、最上段左より順に
hex-1-ene,
(E)-hex-2-ene,
(E)-hex-3-ene
2段目左より
2-methylpent-1-ene,
3-methylpent-1-ene,
4-methylpent-1-ene
3段目左より
2-methylpent-2-ene,
(E)-3-methylpent-2-ene,
(E)-4-methylpent-2-ene
4段目左より
2,3-dimethylbut-1-ene,
3,3-dimethylbut-1-ene,
2-ethylbut-1-ene
最下段
2,3-dimethylbut-2-ene,
なお、ヒントに書いたように、4段目右のような構造(最多の炭素鎖中には二重結合が無い場合)もあることに注意する。すなわち、アルカンの構造を探す場合には、端から2番目の炭素上にエチル基があると主鎖が変わってしまったのであるが、アルケンの場合は主鎖に多重結合を含むことが条件であるから、端から2番目の炭素上にエチル基を置くなどが可能である。ただし、当然のことながら、同じ端から2番目の炭素であるからと言ってもエチル基を3位に置いた「3-ethyl-but-1-ene」は主鎖の取りかたを誤った命名で、正しくは「3-methyl-pent-1-ene」となる。(すなわち、上から2段目ですでにカウント済み。)
また、さがす順として、6.31 ヒント(別法)に示したように、まずはじめに対応するアルカンの構造異性体(下図、左列)をすべて書きだし、それぞれについて、重複のないように二重結合を書き込んでもよい。
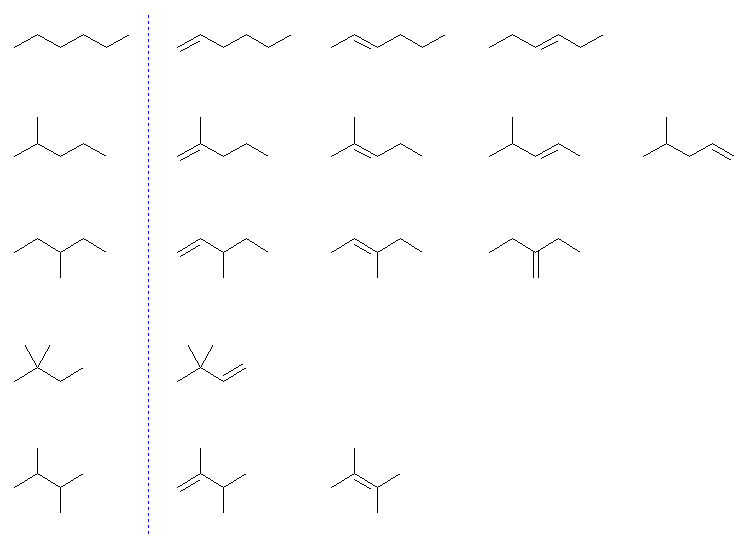
(ここで幾何異性体の一方のみを示しているのは、上と同じ。)
6.33
E 体、Z 体について、それぞれの構造を書いてみること。
but-2-ene の Z 体が、E 体よりも不安定な理由については、教科書 §6.6 を参照せよ。これを、2,2,5,5-tetramethylhex-3-ene に適用したときにどうなるか。
(解答例)
(Z)-but-2-ene,
(Z)-2,2,5,5-tetramethylhex-3-ene の構造を次に示す。
上図よりわかるように、メチル基同士の立体反発に由来する butene の Z 体における E 体に比較しての不安定さよりも、t-ブチル基同士の立体反発に由来する 2,2,5,5-tetramethylhex-3-ene の Z 体における E 体に比較しての不安定さの方が大きい。
(発展)
教科書 § 6.6 で示されているように、アルケンの E 体、Z 体についての安定性の差は、水素化熱を比較することで知ることができる。
but-2-ene および 2,2,5,5-tetramethylhex-3-ene の水素化熱の数値を表に与えておく。(出典:マクマリー有機化学 第6版)
水素化反応の反応熱であるから、符号が負ということから、水素化反応が発熱的であることがわかる。この場合、水素化反応で生じるアルカンは、E 体、Z 体のどちらから出発しても共通のものを与えるから、生成物の高さを基準にすると、アルケンの位置が高い(相対的に不安定である)ほど、この発熱の量が大きいことになるから、反応熱の絶対値が大きいことになる。従って、符号が負で絶対値が小さいようなアルケンの方が安定であるといえる。
| 物質名 | 水素化熱 / kJ mol-1 |
|---|---|
| (E)-but-2-ene | -115.5 |
| (Z)-but-2-ene, | -119.5 |
| (E)-2,2,5,5-tetramethylhex-3-ene | -112.6 |
| (Z)-2,2,5,5-tetramethylhex-3-ene | -151.5 |
6.34
二重結合に直結した(置換基のねもと、または水素の)4つの原子は、二重結合に関わる2つの炭素原子とともに同一平面内にある構造となっていることに注意する。 もし (E)-cyclohexene が存在するとすれば、どのような構造になるだろうか。
教科書に、「分子モデルを組むと参考になる」のヒントが与えられているように、「分子モデルを組むことができない」、「(適当な結合角と結合長で)分子の構造を描くことができない」ような分子は、結合角などのひずみが大きいためなどの理由により不安定であると考えられる。
(解答例)
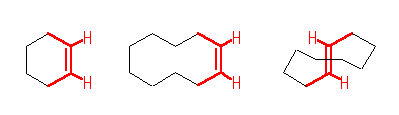
上図、赤で示した5本の結合は、(ほぼ)同一平面内にある。員数のおおきなシクロアルケンは、上図のシクロデセンの構造式のように、Z 体、E 体ともにとることが可能であるが、員数の小さなシクロヘキセンは、Z 体しかとることができない※。
問い 6.35, 6.36 にも関連して、シクロオクテン、シクロノネンにおいても Z 体以外に、E 体をとることも可能であるが、これらのシクロアルケンにおいては E 体の方が不安定であり、その度合いは環の員数が小さいほど大きくなる。これは、E 体においては、図に赤で示されたような二重結合とその上の置換基の根元の原子をすべて同一平面内に置こうとしたときに、環の員数が小さいときには長さが足りず、歪むからであると考えられる。

(Z)-cyclohexene

(E)-cyclooctene
以下のリンク先は、Jmol による3次元模型です。マウスドラッグで回転させることができるので、ぐりぐり廻してみてください。シクロオクテンでは、シストランスの異性体が可能という意味がよくわかると思います。
シス−シクロオクテンの3次元模型
トランス−シクロオクテンの3次元模型
(発展)
※員数の小さなシクロヘキセンのトランス体について
(外部リンク)「有機化学美術館」より、☆ひずんだ多重結合(2)
http://www.org-chem.org/yuuki/cycloalkene/2.html
6.35
6.34 のヒントと解説を参照すること。
(解答例)
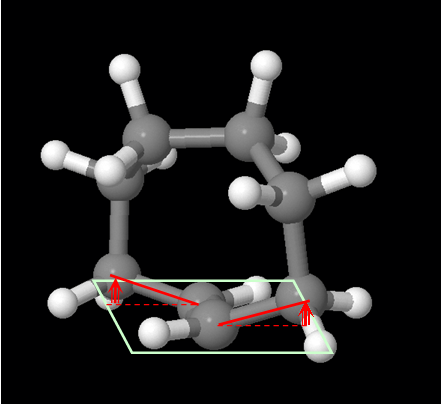
シクロアルケンの環の員数が小さいと、トランス体をとろうとしたときに生じる歪みが大きくなってしまう。
トランス−シクロオクテンの3次元模型
を動かしてみると判るように、トランス体をとったとき、シクロオクテンの二重結合の周囲は平面内におさまらずに持ち上げられ、結合角に歪みを生じていることがみて取れる。
6.36
6.34 のヒントと解説を参照すること。
(解答例)
シクロオクテンに比べ、シクロノネンでは環の員数が大きくなってきており、トランス体をとろうとしたときに生じる環の歪みが相対的に小さい。
6.37
中央の炭素からでているシグマ結合の数は2である。
(解答例)
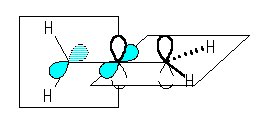
中央の炭素は、sp 混成をしており、上図のような p 軌道をもつ。
sp 混成の炭素の結合角は 180 度である。従って、アレンは3つの炭素が直線状に並んでおり、また、4つの水素は直交した2つの面の上にある。
6.38
問い 6.33 の発展の項も参照すること。
水素化熱とは、水素化反応の生成物が、出発物質を基準としてどれだけのポテンシャルエネルギーを持つかを示している。二重結合の水素化熱が負の値であるということは、二重結合をもつ化合物の方が、その水素化により生じるアルカンよりも不安定であることを示す。
すなわち、同じ生成物を与えるような二つの反応では、負でより絶対値の大きな反応エネルギーをもつものでの出発物質の方が不安定である。
(解答例)
たとえば同じ pentane を与えるような水素化反応2つを考える。
出発物質は、一方は集積二重結合をもつアレン類(下図左 penta-1,2-diene)、もう一方は集積ではない二重結合を2つもつジエン類(下図右、penta-1,4-diene)であるものとする。
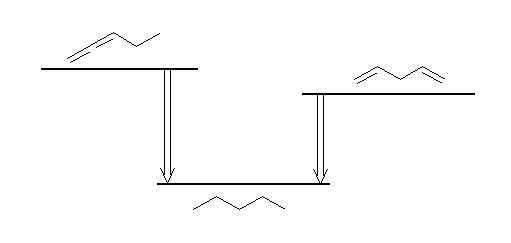
左は、アレンの水素化熱は置換基に依ってはさほど変化しないと仮定して、298 kJ/mol の発熱反応であり、また右は、プロペンの水素化熱を2倍して求められるように、252 kJ/mol の発熱反応となる。すなわち、アレンはジエンよりも一般に不安定である。
(発展)
buta-1,3-diene で見られるようにひとつおきに隣りあった二重結合(二重結合、単結合、二重結合となっているもの)は、共役二重結合とよばれ、二重結合が二つ以上離れてある場合よりも安定化をうけている。
6.39
反応の形式は、カルボカチオン中間体を経由した付加反応である。 このときのカルボカチオン中間体の安定性を考慮せよ(マルコフニコフ則)。
(解答例)
(a) 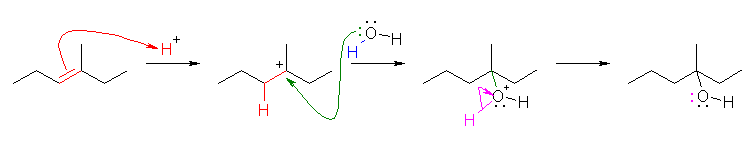
3-methylhexan-3-ol
硫酸(触媒)由来のプロトン付加によるカルボカチオンの生成、水の付加、プロトンの脱離の3段階の反応となる。
(b) 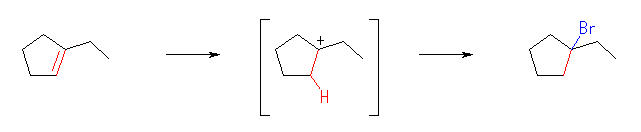
1-bromo-1-ethylcyclopentane
(c) 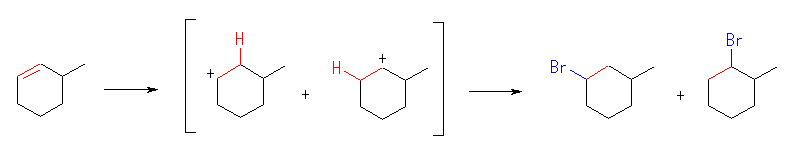
生じるカルボカチオンは、どちらも2級で安定性に大きな差はない。このため、2種類の生成物がほぼ等しい量生じると予想される。
1-bromo-3-methylcyclohexane,
1-bromo-2-methylcyclohexane
(d) 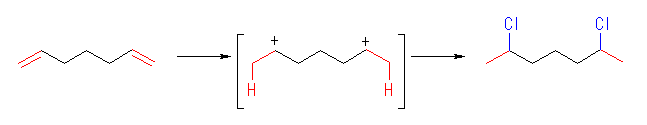
2,6-dichloroheptane
この反応は、上のようなジカチオンを経由すると考えるより、まず塩化水素が1モル付加して 6-chlorohept-1-ene を生じ、つづいて2モルめの塩化水素が付加すると考えた方が自然である。(生成物の構造は、いずれであっても変わらない。)
(発展)
Q: (c)で、ヒドリド移動(カルボカチオンの転位:教科書§6.11)が起きると、次図のように安定な第3級のカルボカチオンを生じるから、もしカルボカチオンが転位して安定な構造になることが一般的なのであれば、3級の一つの生成物(1-bromo-1-methylcyclohexane)に限定できるのではありませんか?
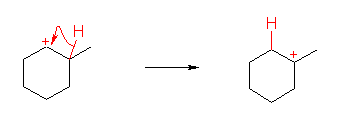
A: ヒドリド移動が起きるか起きないかは、カルボカチオンでいる時間が長いか短いかなど、
さまざまな要因に依ります。カルボカチオンの転位は、常におきる可能性がありま
すので、生成物が「予想通り」にならないこともよくあります。
なお、今回の質問では、はじめにできるカルボカチオンは、両方とも2級ですから、ほぼ
同じ量のカルボカチオンが生じるでしょう。カルボカチオンの場合は、ブロモニウムイオ
ンなどの3員環のものではないので、この2つは区別されると考えられます。このうち、3級
炭素に隣接したものの方は、ヒドリド移動により3級のカルボカチオンに転移することが
予想できますが、仮にこの転移が100%起きたとしても、はじめに生じる2級のカルボ
カチオンのもう一方の方からは、2つ離れた位置までのヒドリド移動は、遠いため、あま
り起きないだろうと考えられ、そのために生成物はひとつにはなりません。
とはいえ、生成物が一つになってしまう可能性がないわけではありません。そのような説
明も可能です。アルケンに対してプロトンが付加しカルボカチオンを与える過程は、実は
可逆です。つまり、カルボカチオンからプロトンが脱離すると(臭化アルカンからの臭化
水素の脱離の過程と似ていますが)アルケンを与えますね。問題で与えられている 3-メ
チルシクロヘキセンにプロトンが付加し、またプロトンが脱離する過程をくり返している
うちに、一番安定なアルケンである 1-メチルシクロヘキセンになってしまいます。(3-
メチルシクロヘキセンの1位にプロトンが付加し、2位に正電荷のあるカルボカチオンに
なったのち、3位からプロトンが抜ける。生じたアルケンは多置換であるほど安定であ
る。)
このメカニズムが成り立つためには、臭化物イオンによる攻撃が遅くないといけませ
ん。(通常、酸性条件下では、臭化アルカンから2級のカルボカチオンができる過程は、
それほど速いとは考えませんので。)しかし、このメカニズムが成り立ちさえすれば、ヒ
ドリド移動の説明をせずに 1-ブロモ-1-メチルシクロヘキサンが主生成物となることの説
明もできてしまいます。
今の教科書のレベルでは、あまり入り組んだところまでの説明は求められていませんか
ら、大学編入試験レベルくらいまでは、まずはヒドリドの転移等を考えなくて説明できる
通常の生成物はなにかというところを押さえておいて、その上で、「予想される生成物と
は異なるものができてしまった時に、その理由を」尋ねられたときに説明できるようにし
ておく、というところで良いと思います。
6.40
6.39 と同様、反応の形式は、カルボカチオン中間体を経由した付加反応である。 このときのカルボカチオン中間体の安定性を考慮せよ(マルコフニコフ則)。
(解答例)
(a) 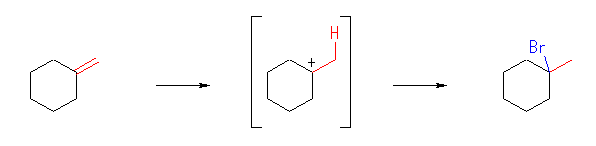
1-bromo-1-methylcyclohexane
(b) 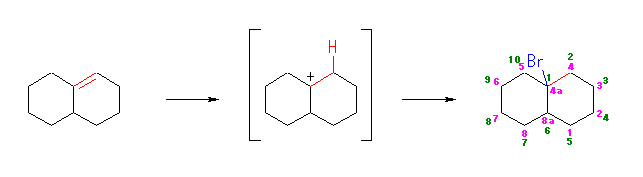
1-bromobicyclo[4.4.0]decane,
または、 4a-bromo-1,2,3,4,4a,5,6,7,8,8a-decahydronaphthalene
異なる体系の命名の仕方があるが、体系により位置番号が異なっていることに注意する。
(c) 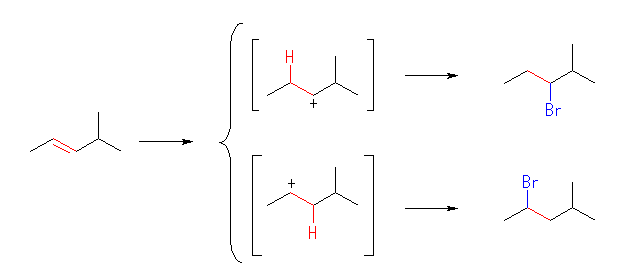
生じるカルボカチオンは、どちらも2級で安定性に大きな差はない。このため、2種類の生成物がほぼ等しい量生じると予想される。
3-bromo-2-methylpentane,
2-bromo-4-methylpentane
6.41-6.50
6.41
教科書§6.5(pp 176-180)
・多重結合を含む置換基は次のように開く。(シグマ結合の順を変えない。多重結合ではその両側の原子に単結合が二重、三重にあるものとする。ただし、この時重複する原子(下図、カッコ付き赤文字で表した)は、その先には結合を考えない。)
たとえば、アルデヒド基の根元の炭素からは、-O-(C)、-(O)、-H が結合していると考える。
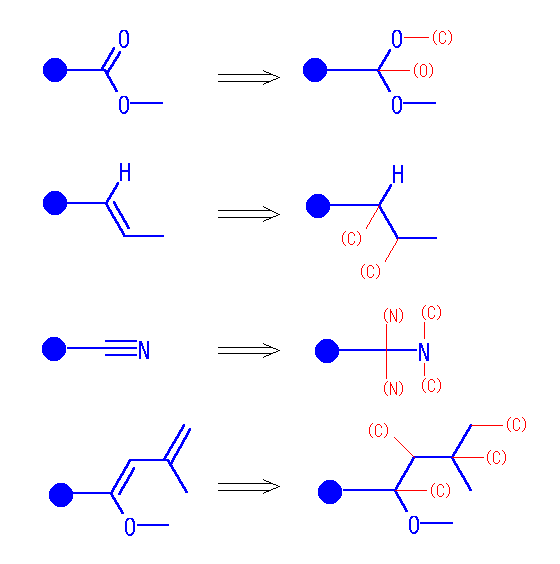
・根元から1番目の原子、根元から2番目の原子、3番目の原子… とグループ分けしてならべる。同じ順位のものは、同じ原子に結合しているものごとにまとめながら、重いものほど前にならべておく。
-CH2OH なら -C-{O, H, H}-[H]、アルデヒド基 -C(=O)H なら -C-{O, O, H}-[C] となる。
・根元から近いところから、同順の場合は重いものから軽いものへの順で差が現れるまで、比較する。
-C-{O, H, H}-[H] < -C-{O, O, H}-[C]
同じ距離の原子、たとえば2番目の原子の種類と数の構成が同じである場合は、その中で一番重い原子について3番目以下の原子の結合をみて順位に差をつける。
(例):-C(S-CH3)OH と、-C(O-SiH3)SH の場合。
1番目の原子:どちらも C で同順。
2番目の原子:どちらも S, O, H の3つ。やはり同順。
3番目の原子を参考に2番目の原子に差をつける:まず、2番目の原子のうち一番重い S についている原子に注目する。前者では[C]、後者では[H]だから、Sの方が優先順位が上となる。(どの原子から結合しているかを無視すれば、[C, H]、[Si, H] となり、後者の方が重いように見えるが、これは間違い。)
-C-{S[C], O, H} > -C-{S[H], O, H}
(解答例)
原子番号の大きい順。同じ原子については、次の原子で判断する。(判断した位置を下線で表記した。)
(a) -I > -Br > -CH3 > -H
(b) -OCH3 > -OH > -COOH > -H
(c) -CO2CH3 (-C-{O[CH3], O[(C)], (O)}) > -CO2H (-C-{O[(C)], O[H], (O)}) > -CH2OH (-C-{O, H, H}) > -CH3 (-C-{H, H, H})
2番目の原子として{O, O, O}×2通り > {O, H, H} > {H, H, H} としたのち、2つの{O, O, O}については3番目の原子以降(カッコ [ ] で表現した)を考慮した。カッコ ( ) は、多重結合を開いてその先の結合を考えない原子を表している。
(d) -C(=O)CH3 (-C-{O, O, C}) > -CH2CH2OH (-C-{C[O, H, H], H, H}) > -CH2CH3 (-C-{C[H, H, H], H, H}) > -CH3 (-C-{H, H, H})
(e) -CH2Br (-C-{Br, H, H}) > -CN (-C-{N, N, N}) > -CH2NH2 (-C-{N, H, H}) > -CH=CH2 (-C-{C, C, H})
(f) -CH2OCH3 (-C-{O[C], H, H}) > -CH2OH > (-C-{O[H], H, H}) > -CH=CH2 (-C-{C, C, H}) > -CH2CH3 (-C-{C, H, H})
6.42
6.41 と同様に、教科書§6.5(pp 176-180)
ただし、これらの化合物は、いずれも命名上アルケンよりも優先度の高い官能基を含んでいる。
(解答例)
二重結合を形成する炭素、それぞれの上の2つの置換基のうち、優先順位の高いものを挙げると次のようになる。
(a) 左 -CH2OH, 右 -CH3
(b) 左 -Cl, 右 -OCH3
(c) 左 -CN, 右 -CH2OH
(d) 左 -CO2CH3, 右 -CH=CH2
従って、立体配置も含めたこれらの化合物の命名は次の通り。
(a) (Z)-2-methylbut-2-en-1-ol
(b) (Z)-2-chloro-3-methoxyprop-2-enoic acid
(c) (E)-2-ethyl-4-hydroxy-3-methylbut-2-enenitrile
(d) 2-[1-ethylprop-2-en-(Z)-ylidene]propanedioic acid monomethyl ester
6.43
シクロアルケンの番号の付け方に注意する。多重結合が1,2位になるのが最優先、2つ目以降の多重結合がある場合は、その番号が小さくなるようにする。次いで置換基の番号が小さくなるように考える。
(解答例)
(a) 3-methylcyclohexene
(b) 1,5-dimethylcyclopentene
(c) 1-ethylcyclobuta-1,3-diene
(d) 1,2-dimethylcyclohexa-1,4-diene
(e) 5-methylcyclohexa-1,3-diene
(f) cycloocta-1,5-diene
6.44
立体も含めて命名する必要がある。
なお、(b),(c) は、環状の部分を母体として命名できるが、側鎖の中の立体は明示する必要がある。(7員環以下のトランスのシクロアルケンは安定には単離されないから、環の中の二重結合の立体は特に明示しなくてもよい。)
(解答例)
(a) (3E,5Z)-octa-1,3,5-triene
(b) 環の炭素の位置番号は、2つの二重結合の位置で決める。1つ目の二重結合の番号が1と2であるとき、もうひとつの二重結合は4と5になるように選ぶ。(逆回りだと、5と6になってしまうので。)そのような番号のつけ方で右回り、左回り(どちらの二重結合を先につけるかで変わる)があるが、置換基の位置番号が小さくなる方を選ぶ。また、置換基中の位置番号は、環に直接結合しているところが1位になる。従って、
6-[(Z)-but-1-enyl]cyclohepta-1,4-diene
(c) 二重結合の番号が1と2になるような2通りの番号のつけ方(右回り、左回り)のうち、はじめの置換基の位置番号が小さくなる方を選ぶ。また、置換基中の位置番号は、環に直接結合しているところが1位になる。従って、
3-[(Z)-but-1-enyl]-4-vinylcyclopentene
慣用名 vinyl の代わりに系統的な命名で ethenyl とした表記でも可。
6.45
6.41 のヒントを参照すること。
(解答例)
(a) 正しい
(b) 正しい:CH2-CH=CH2 と CH2-CH(CH3)2 を比べると、2番目の炭素から結合しているものはともにC, C, H であるが、その下位の原子を数えると {C[(C)], C[H2], H} および {C[H3], C[H3], H} となるから、2-propenyl基の方が順位が高い。
(c) 誤り:-CH2NH2 と -CH2NHCH3 を比べると、2番目の窒素から結合しているものが {H, H} および {C, H} なので後者の方が順位が高い。
(d) 正しい:-CN は -C-{N[(C), (C)], (N), (N)} と多重結合を開くことができる。-CH2N(CH3)2 は、-C-{N, H, H} だから、炭素に結合した原子の種類だけで順位が決まる。
(e) 誤り:cyclopentylidene 基は左右対称なので、幾何異性体は存在しない。
(f) 正しい:-CO2H は -C-{O[(C), O[H], (O)]} と開くことができ、-C(=O)CH3 ( -C-{O[(C)], (O), C[H3]} ) より順位が高い。
6.46
反応式の前後で、どの部分が変化しているか。また、その反応により二重結合の軸のまわりでの「回転」がおきているかどうか。
(解答例)
tert-ブチルエステルは、メチルエステルよりも順位が上であるが、加水分解して生じるカルボキシ基はメチルエステルよりも順位が下となる。このため、単に命名のルール上で置換基の優先順位の入れ替えがあり、E, Z の表記が入れ替わるだけであり、二重結合のまわりでの回転によって、立体が入れ替わるのではない。
6.47
カルボカチオンの転位では、
・正に帯電した炭素の、隣接炭素の上から、
・水素(-H)、メチル(-CH3)、フェニル(-C6H5)基、またはアルキル基が、
・共有結合の電子を対として持ったまま移動して、
・2級や3級の安定なカルボカチオンを生じる。
転位の機構は、問題 6.19 の(発展)の項等も参照すること。
(解答例)
(a) 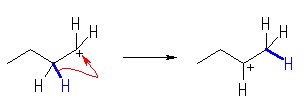
のように、2級カルボカチオンに転位する。
3級カルボカチオンは、次図のように更に2回の転位を経ないと生じないが、途中で、より安定性が低く2級のカルボカチオンからの転位が生じにくい1級のカルボカチオンを経由しないといけないので、考えなくてよい。(絶対に生じないという保障はない。実験の条件によって変わる可能性は残されている。)
(b) もとの2級カルボカチオンよりも安定な3級のカルボカチオンが生じるような転位のみを考える。
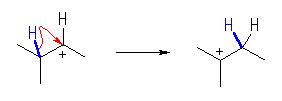
(c) 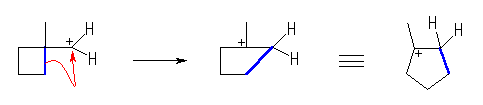
6.48
1-isopropylcyclohexene にプロトンを付加させると、3級のカルボカチオンが生じるが、転位生成物が得られたという実験事実を説明するためには、更にヒドリド転位して別の構造の3級のカルボカチオンになっているものと考えるとよい。
(解答例)
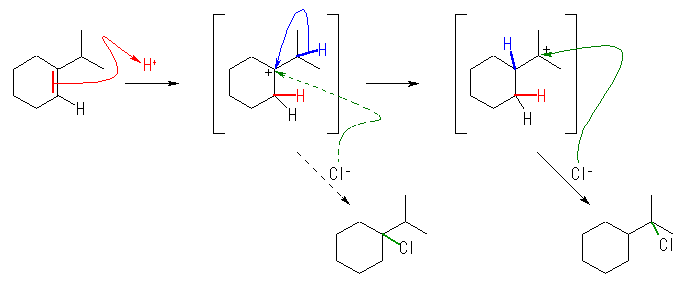
はじめに生じたカルボカチオンと塩化物イオンが反応すると通常の生成物として、1-chloro-1-isopropylcyclohexane が得られるが、カルボカチオンが、更に転位してから塩化物イオンと反応すると、1-(1-chloro-1-methylethyl)cyclohexane を生じる。
(発展)
isopropyl 基は、IUPAC命名の上で用いてもよい慣用名であるが、誘導体をつくって命名することは許されていない。従って、chloroisopropyl 基のような命名の仕方は許されず、1-chloro-1-methylethyl 基と書かなくてはいけない。
6.49
はじめに生じるカルボカチオンの構造を考えて、最終生成物の構造にするために可能な骨格の転位を考えてみること。
(解答例)
教科書の問いに示された図では、生成物の構造が上図と上下逆に示されている。
6.50
どの結合が切れ、どこに新たに結合が生じるのかを電子対の動きを示す曲がった矢印から読み取ること。
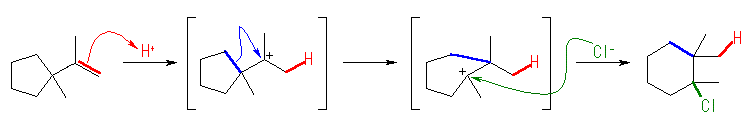
(解答例)
2-メチル-1-シクロブチルカチオンを経由して、1-ブロモ-2-メチルシクロブタンを生じる。
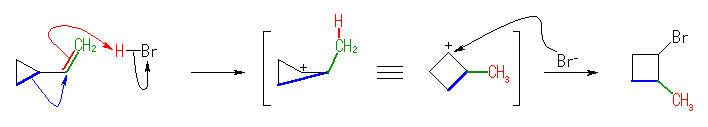
(発展)
シクロプロパン環は、結合角に由来する大きな環ひずみをもっているから、同じ2級のカルボカチオンでも、ビニル基にプロトンが付加して生じたシクロプロピルエチルカチオンは、容易に転位して環ひずみを解消することができると考えられる。
6.51-6.59
6.51
6.23 のヒントを参照のこと。
(解答例)
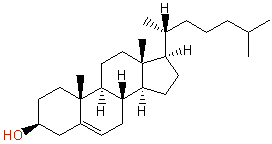
(a) Cholesterol, コレステロール, C27H46O :不飽和度 = 5 (= ( 56 - 46 )/2 )
次図のように、4つの環構造と1つの二重結合をもつ化合物である。
IUPAC名 : cholest-5-en-3β-ol
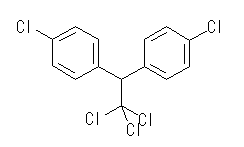
(b) DDT (Dichloro-Diphenyl-Trichloroethane), C14H9Cl5 :不飽和度 = 8 (= ( 30 - ( 9 + 5 ))/2 )
次図のように2つの芳香環(環2つと二重結合6つ)をもつ化合物である。
IUPAC名 : 1,1,1-trichloro-2,2-bis(p-chlorophenyl)ethane
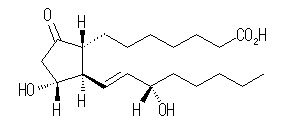
(c) プロスタグランジンE1, PGE1, C20H34O5 :不飽和度 = 4 (= ( 42 - 34 )/2 )
次図のように環構造1つの他、炭素−炭素二重結合1つ、カルボニル(カルボン酸中のものを含む)2つをもつ化合物である。
IUPAC名 : (1R,2R,3R)-3-hydroxy-2-[(E)-(3S)-3-hydroxy-1-octenyl]-5-oxocyclopentaneheptanoic acid
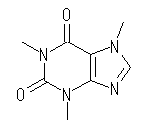
(d) カフェイン, Caffeine, C8H10N4O2 :不飽和度 = 6 (= ( 18 - ( 10 - 4 ))/2 )
IUPAC名 :3,7-Dihydro-1,3,7-trimethyl-1H-purine-2,6-dione
次図のように環構造2つ、二重結合4つ(カルボニル等を含む)をもつ化合物である。
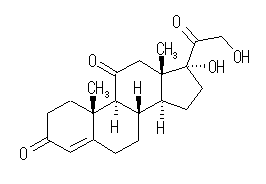
(e) コルチゾン, Cortisone, C21H28O5 :不飽和度 = 8 (= ( 44 - 28 )/2 )
IUPAC名 :17,21-dihydroxypregn-4-ene-3,11,20-trione
次図のように環構造4つ、炭素−炭素二重結合1つと3つのカルボニル基をもつ化合物である。
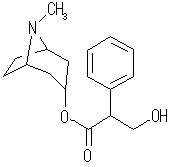
(f) アトロピン, atropine, C17H23NO3 :不飽和度 = 7 (= ( 36 - ( 23 - 1 ))/2 )
IUPAC名 :tropan-3α-yl rac-3-hydroxy-2-phenylpropanoate
次図のように3つの環構造、4つの多重結合をもつ化合物である。
6.52
以下の点を考慮する。
・カルボカチオンが1級から3級になっていること。
・反応が自発的におきていること。
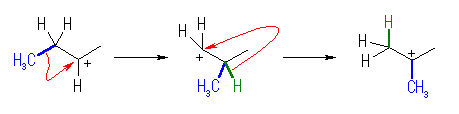
(解答例)
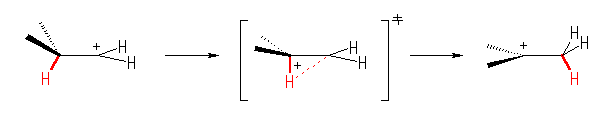
カルボカチオンは、1級から3級になる。
自発的に反応がおこることからも、より安定な生成物を与える反応で、発エルゴン的であるということがわかる。
Hammond の仮説より、発エルゴン的な反応なので、遷移状態は出発物に近いと考えられる。
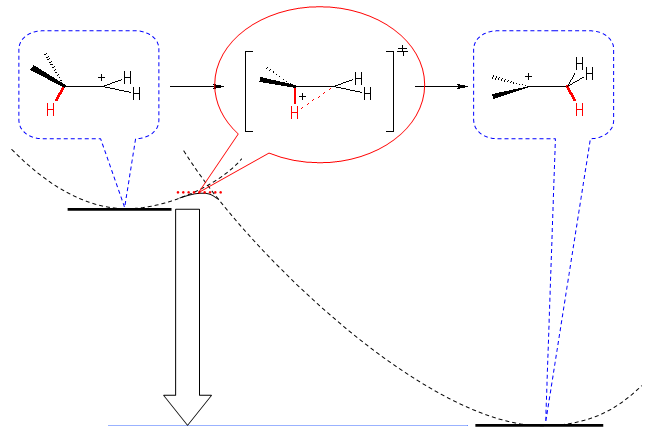
6.53
図6.8(教科書p185)、図6.16(教科書p195)などを参照すること。
(解答例)
1級より2級のカルボカチオンの方が安定であるから、エネルギー図において、下方に描く。
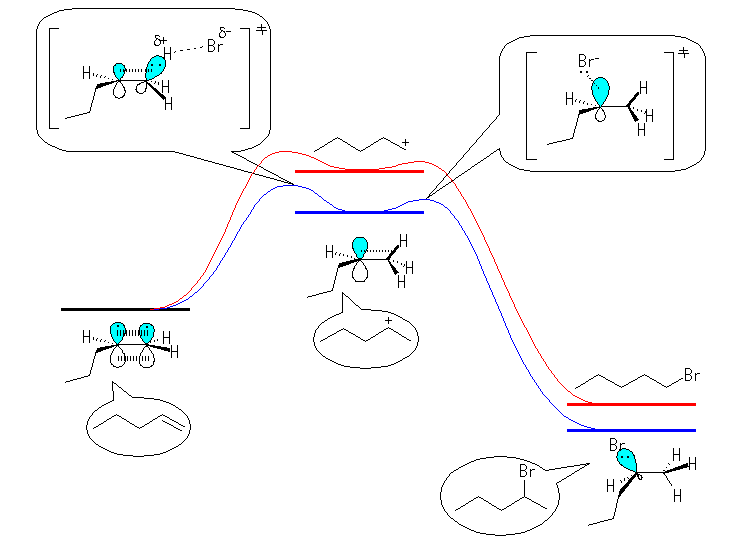
6.54
Hammond の仮説より導かれる結果として、カルボカチオンを生じる過程、カルボカチオンからハロゲン化アルキルに変化する過程、いずれも中間体のカルボカチオンに構造が似た遷移状態を経るはずである。
(解答例)
6.53 を参照
(提出するノートに「6.53 を参照」などと書くのは不可。それが答えなのではありません。6.53 を参照しながら自分で考えて答えを判断して書く、または、自分で書いた答えを 6.53 を見ながら合っているかどうかを判断する、などしてください、という意味です。)
6.55
曲がった矢印による電子の動きの表し方については、教科書、前の章、§ 5.6 などに立ち返って見てみること。
なお、問いには「アルケンの求電子付加を含む」段階を示すように書いてあるが、「アルケンに対する求電子付加」である。
(解答例)
第1段階:
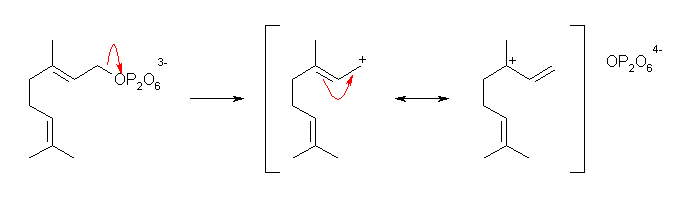
反応式中に書かれていない「塩基」により、二リン酸イオンが脱離して、カルボカチオンを与えている。なお、生じたカルボカチオンは、二重結合に隣接した炭素上にある。すなわち、アリル位のカルボカチオンである。そのため、カルボカチオンは共鳴構造で表される。教科書では、2つ書ける共鳴の極限構造式のうち、より級数の高いカルボカチオンの構造(共鳴の寄与の多い構造)で示している。
第2段階:
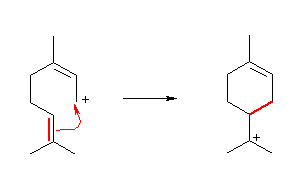
共鳴のもう一方の極限構造の正電荷をもつ炭素が、分子内でアルケンに対して求電子付加している。これは、視点を変えれば、アルケンが(H+ ではなく)カルボカチオンに対して求核反応していくことにより、カルボカチオンを形成する反応であるとも言える。また、反応の前後でのカルボカチオンの分子式は変わっていないから、カルボカチオンの転位反応であるとも言える。
第3段階:
カルボカチオンから H+ が脱離してアルケンを生じる。この反応は、二重結合に H+ が付加してカルボカチオンを生じる過程の逆反応である。この反応機構の詳細は11章で学ぶ。なお、脱離することができる水素は、2種類考えられる、が、生体内の反応であるために位置選択性が高い反応になっていると考えることができる。
6.56
曲がった矢印による電子の動きの表し方については、教科書、前の章、§ 5.6 などに立ち返って見てみること。
なお、問いには「アルケンの求電子付加を含む」段階を示すように書いてあるが、「アルケンに対する求電子付加」である。
(解答例)
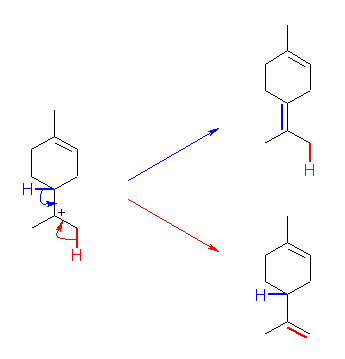
第1段階:
アルケンに対し、H+ が求電子付加することにより、カルボカチオンを形成する反応である。H+ から見た場合は、アルケンに対する求電子付加であるともいえる。
第2段階:
正電荷をもつ炭素が、分子内でアルケンに対して求電子付加している。これは、視点を変えれば、アルケンが(H+ ではなく)カルボカチオンに対して求核反応していくことにより、カルボカチオンを形成する反応であるとも言える。また、反応の前後でのカルボカチオンの分子式は変わっていないから、カルボカチオンの転位反応であるとも言える。
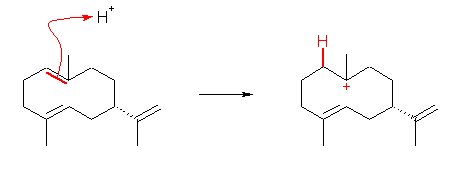
第3段階:
ヒドリドの移動により、正電荷の位置が隣にシフトしている。これは、カルボカチオンの転位反応のひとつである。このヒドリドの移動は、環状アルカンの同じ面側同士でおきているため、もともと正電荷のあった位置のメチル基の立体は、生成物においては、選択的に紙面奥側になっている。
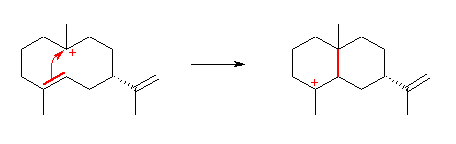
第4段階:
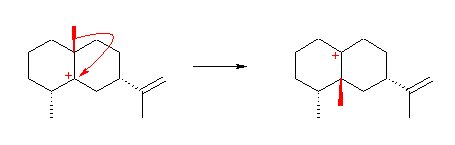
メチル基の移動により、正電荷の位置が隣にシフトしている。これは、カルボカチオンの転位反応のひとつである。このメチル基の移動は、環状アルカンの同じ面側同士でおきているため、出発物、生成物において、メチル基の位置は同様に紙面手前側になっている。
第5段階:
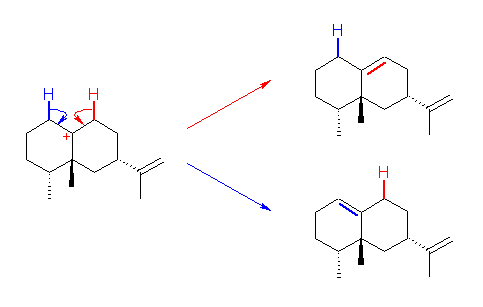
カルボカチオンから H+ が脱離してアルケンを生じる過程である。この反応は、二重結合に H+ が付加してカルボカチオンを生じる過程の逆反応で、反応機構の詳細は11章で学ぶ。なお、脱離することができる水素は、2種類考えられる、が、生体内の反応であるために位置選択性が高い反応になっていると考えることができる。(橋頭位、先の反応でメチル基の移動した先の炭素上には水素が結合していないので、脱離することができる水素は2種類である。)
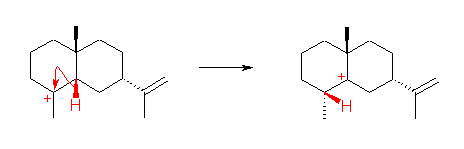
6.57
問題文から、塩化アルキルからカルボカチオンが生じて、これがベンゼン環と反応することが判る。これまでの知識として、カルボカチオンは、より安定な構造に転位することがある。以上を総合して考えればよい。
(解答例)
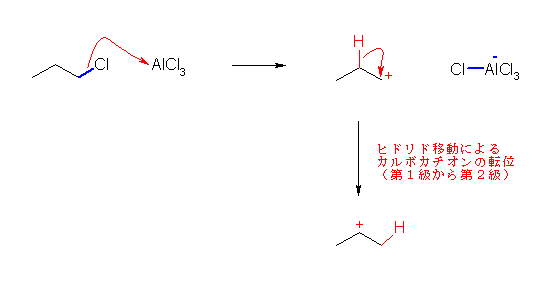
この反応では、1-chloropropane から生じた1級のカルボカチオンは、ヒドリド転位により2級のカルボカチオンに転位してからベンゼンと反応するため、主生成物としてイソプロピルベンゼンを与える。
(発展)
この問いの反応は、「フリーデル・クラフツ反応, Friedel-Crafts reaction」と呼ばれ、芳香族求電子置換反応のひとつである。フリーデル・クラフツ反応によるアルキル化は、ハロゲン化アルキルとルイス酸から生じるカルボカチオンが転位しやすいため、炭素数3以上の直鎖アルキル基を導入する目的には使用できない。直鎖アルキル基の導入のための代替法としては、フリーデル・クラフツ反応により、アシル化(アルカノイル化ともいう、R-C(=O)- の導入)をしたのち、カルボニル基をメチレンまで還元する方法がある。
6.58
二重結合に触媒として加えられた H+ が付加してカルボカチオンを生じる。この際の位置選択性により、生成物であるアルコールの構造が決まる。位置選択性については、中間体のカルボカチオンの安定性を考えること。
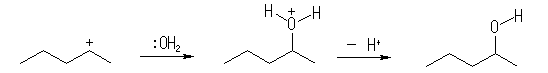
カルボカチオンの正電荷を担う炭素に水が結合した結果、アルコール酸素上に H+ が結合した形式の分子(プロトン化アルコール)を与える。続いて、速やかに H+ を失い、アルコールを与える。問い 6.39 (a) も参照すること。
(解答例)
いずれも、出発物の構造から考えられる中間体カルボカチオンが、1級と2級、2級と3級のように安定性に差があるため、一方しか生じない。このため、主生成物もそれぞれ1つである。
(a) 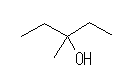
3-methylpentan-3-ol
(b) 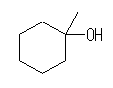
1-methylcyclohexan-1-ol
(c) 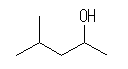
4-methylpentan-2-ol
6.59
ハロゲン化アルキルからの HBr の脱離反応は、アルケンに HBr が付加する反応の逆反応で、アルケンを与える。
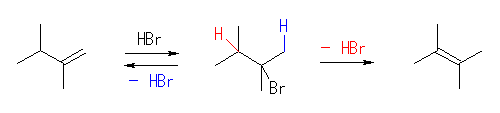
(解答例)
反応機構の詳細については、11章で学ぶ。