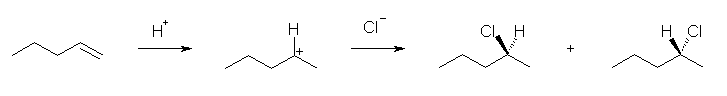
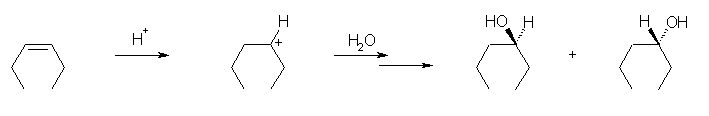
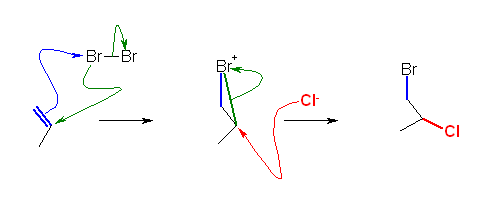
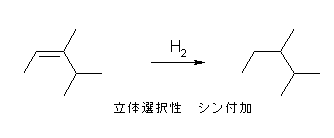
6.01-6.10
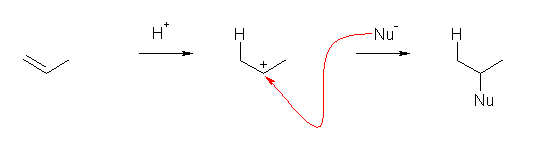
6.01
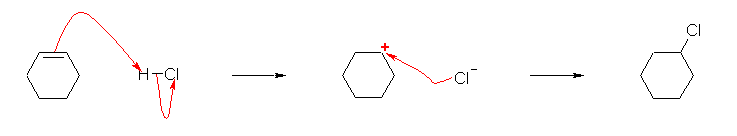
問いのすぐ上に書かれている 2-methylpropene と HCl の反応を参考にすること。
(解答例)
シクロヘキセンが、二重結合に対して左右対称であるから、この付加反応では位置選択性は考える必要がない。(どちらの二重結合炭素に先に H+ が付加しても、同じカルボカチオンを与える。)
二重結合上の水素等、反応位置付近で水素を省略せずに書いた反応機構が次図。はじめのうちは、このように書くことを推奨します。
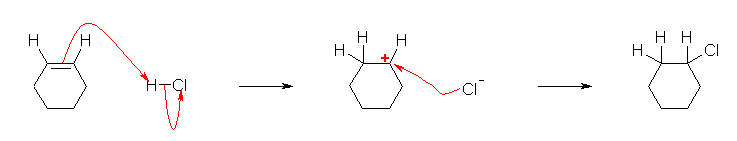
ケクレ構造式のルールで許される範囲で、水素を省略して、次図のように書いても可。
(はじめの問題なので、詳しく書いておくが)
・ひとつめの矢印は、二重結合の π 電子が出発点、H-Cl の水素が到達点。(水溶液中の場合など、条件によっては、先に酸解離している場合には、H+ でも可。)
・ふたつめの矢印は、H-Cl の σ 結合電子が出発点。到達点は、塩素原子(塩素原子の先の空間を指すように書いてしまうミスが多いので気をつけること)。塩素原子が電子対を受け取ることで、塩化物イオンになるからである。
・最後の矢印は、塩化物イオンの孤立電子対が出発点。到達点はカルボカチオンの炭素原子。
6.02
a) 空の p 軌道と(ほぼ)平行な方向にでている σ 結合のみが対象である。すなわち、C+ に隣接した原子上の σ 結合(や、場合によって、孤立電子対)が、カルボカチオンを安定化するような相互作用(超共役)をする。
(解答例)
a) C+ には、隣接した原子は水素のみ、隣接原子上に孤立電子対や σ 結合はない。答え。ゼロ。
b) エチルカチオンでは、C+ に隣接した炭素上に σ 結合があり、超共役によるカチオンの安定化がある。
6.03
カチオン名は、C+ の位置で結合しているアルキル基名と同じ命名構造をもつ。 すなわち、アルキル基 R-CH2− の水素が遊離した炭素が yl で表されているのに対応し、アルキルカチオン R-CH2+ の場合も、やはり、水素が遊離して、かつ正電荷をもつ炭素が yl で表されている。
さて、イソブチル基、sec-ブチル基など、アルキル基の慣用名は、t-ブチル基以外、覚えなくてよいことにしていた。そのため、以下に、対応するカチオンの構造を示しておく。
1 イソブチルカチオン : (CH3)2CHCH2+
2 n-ブチルカチオン : CH3CH2CH2CH2+
3 sec-ブチルカチオン : CH3CH2CH+CH3
(解答例)
1 イソブチルカチオン(第1級カルボカチオン)、該当する σ 結合数は3。
2 n-ブチルカチオン(第1級カルボカチオン)、該当する σ 結合数は3。
3 sec-ブチルカチオン(第2級カルボカチオン)該当する σ 結合数は6。この3つのカルボカチオンの中では、最も安定。
6.04
a) 単純に、級数で比較してよい。
b) 級数はすべて同じである。酸の強さ(=共役塩基の安定性)を考えたときと同じように考える。強い電子求引性基が結合するほど、その数が多いほど、また、σ結合を介した距離が短いほど、カルボカチオンを不安定化する。電子供与性基であれば、逆に安定化する。 σ 結合を介したハロゲンは、電気陰性度の差による誘起効果により、カルボカチオンを不安定化する。(ただし、カルボカチオン炭素に直結した臭素、塩素、ヨウ素は、その孤立電子対により、アルキル基と同程度のカルボカチオンの安定化をもたらす。)
(解答例)
(安定)>(不安定)の順で示す。
a) CH3CH2C+(CH3)2 (第3級のカルボカチオン) > CH3CH2CH+CH3 (第2級のカルボカチオン) > CH3CH2CH2CH2+ (第1級のカルボカチオン)
b) CH3CH(CH3)CH2CH2+ > CH3CH(Cl)CH2CH2+ > CH3CH(F)CH2CH2+
6.05
横軸(反応座標)上の位置が近いほど、構造も近い。
また、(グラフの傾き方がほぼ同じように変化すると考えて)一般的に、縦軸(のエネルギー)の値が近いほど、横軸上の位置も近いと考えることが多い。
(解答例)
遷移状態(山の天辺)の構造は、そのとエネルギーが近い方、すなわち、相対的に不安定な方に近いと考える。(理由は、ヒントを参照すること。)
a) 生成物
b) 反応物(出発物)
c) 反応物(出発物)
d) 生成物
6.06
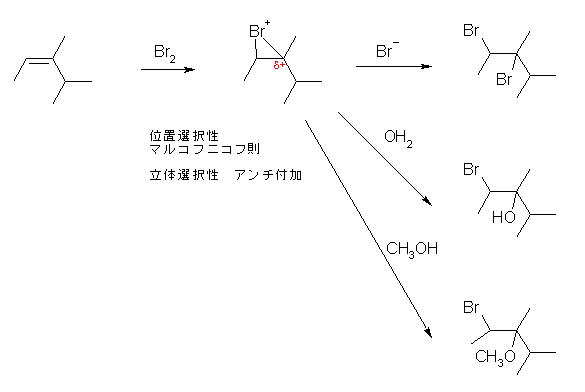
より安定なカルボカチオンを経由して生じる生成物を与える。この位置選択性を、Markovnikov則(マルコフニコフ則)という。
ただし、f) のみ、反応基質の構造より、位置選択性を考える必要性がない。(どちらの位置に臭素が結合しても同じ生成物を与える。)
なお、HBr の付加反応において、立体選択性は考慮しなくてよい。これは、中間体として生じるカルボカチオンが、sp2 混成で平面型の構造をとり、臭化物イオンが面の上下のどちらから付加してくるかを区別できないためである。
(解答例)
a) 2-bromobutane
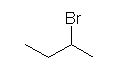
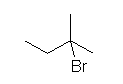
b) 2-bromo-2-methylbutane
c) 1-bromo-1-methylcyclopentane
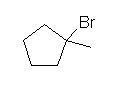
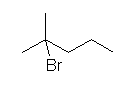
d) 2-bromo-2-methylpentane
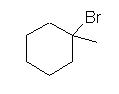
e) 1-bromo-1-methylcyclohexane
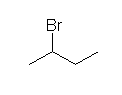
f) 2-bromobutane
6.07
生成物において、臭素の結合している炭素が、反応物(出発物)では二重結合炭素の一方であった。二重結合を置くやり方が複数考えられる場合がある。そのそれぞれについて、位置選択性から考えて、目標化合物が主生成物として単独で得られるかどうかをチェックすること。
(解答例)
a) 2-methylpropene
これは、一通りしか考えられない。
b) prop-2-enylcyclohexane
二重結合の位置異性体である prop-1-enylcyclohexane からでは、2種類の同程度に安定なカルボカチオン(いずれも第2級)が生じてしまうため、目標物質である(2-bromopropyl)cyclohexane 以外に、(1-bromopropyl)cyclohexane が同程度の量だけ副生してしまうため、適切ではない。
c) (1-methylethenyl)cyclohexane
二重結合の位置異性体である (1-methylethylidene)cyclohexane からは、目標物質以外に、1-bromo-1-(1-methylethyl)cyclohexane が同程度の量だけ副生してしまうため、適切ではない。
d) 1-ethylcyclohexene
ethylidenecyclohexane
のいずれでも良い。どちらも構造的に可能性のある2種類のカルボカチオンは、第2級と第3級で、安定性に差があるので、目標物質が主生成物として得られる。(副生成物の量も同程度であろうと予測される。)
※ 目標物質が 1-bromo-1-methylcyclohexane である場合は、
1-methylcyclohexene (構造的に、第2級と第3級のカルボカチオンが生じ得る)よりも、methylidenecyclohexane (高像的に、第1級と第3級のカルボカチオンが生じ得る)の方が、位置選択性が高い(副生成物の量が少ない)と予測される。(構造的に生じ得る2種類のカルボカチオンの安定性の差が大きいため。→ 問 6.08 を参照)
6.08
構造的に考えられる2種類のカルボカチオンについて、その安定性の差が大きければ大きいほど、高い位置選択性で反応する。
(解答例)
a) HBr の付加により、いずれも 2-bromo-2-methylbutane を与えるが、
2-methylbut-1-ene に H+ が付加したとき、構造的に生じ得るカルボカチオンは、第1級と第3級で、その安定性の差が大きいのに対し、2-methylbut-2-ene に H+ が付加したとき、構造的に生じ得るカルボカチオンは、第2級と第3級であるため、その安定性の差が小さい。そのため、2-methylbut-1-ene の方が、位置選択性が高い(2-methylbut-1-ene を出発物質としたときに、副生成物である、第1級カルボカチオン経由の生成物の量は、2-methylbut-2-ene を出発物質としたときに、副生成物である、第2級カルボカチオン経由の生成物の量と比べて、相対的に少ない。)
b) HBr の付加により、いずれも、1-bromo-1-methylcyclohexane を与えるが、
methylidenecyclohexane を出発物質とすると、中間体として考えられる2種類のカルボカチオンは、第1級と第3級で、その安定性の差が大きいのに対し、1-methylcyclohexene を出発物質としたときに中間体として考えられる2種類のカルボカチオンが第2級と第3級で、その安定性の差が小さい。そのため、methylidenecyclohexane を用いた場合の方が、位置選択性が高い反応となる。
6.09
ある酸を水溶液としたとき、その pH が pKa の数値と等しいとき、半量が酸型、残りの半量が解離して共役塩基型を取ったことを思い出すこと。(参照:第2章 Henderson-Hasselbalch 式)
(解答例)
溶液の pH が -2.5 から 15 の範囲では、2-プロパノールの 50 % 以上が
溶液の pH が -1.5 から 14 の範囲では、2-プロパノールの 90 % 以上が
中性の、非プロトン化体として存在する。
(これは、水溶液中のほとんどすべての条件に合致する。)
※ pH が -2.5 以下では、共役酸(プロトン化されたカチオン)として存在するものが半量以上となり、pH が 15 以上では共役塩基(アルコキシドイオン、RO-)として存在するものが半量以上となる。
↓
さて、何が言いたい問題であるかというと。
酸触媒による二重結合に対しての水和反応の、生成物の構造や反応機構を書くとき、
1) 二重結合に対する H+ の付加によるカルボカチオンの生成
2) カルボカチオンに対する水の付加
で止めるのではなく、さらに
3) 生じたプロトン化アルコールからの H+ の脱離(電気的中性なアルコール分子の遊離)
まで書かなければならない、ということである。
6.10
反応機構は、教科書 p282 の中ほどを参照のこと。
(解答例)
a) この反応は、
1) 二重結合に対する H+ の付加によるカルボカチオンの生成
2) カルボカチオンに対する水の付加
3) 生じたプロトン化アルコールからの H+ の脱離(電気的中性なアルコール分子の遊離)
の3段階で進行する。その過程ひとつずつに対応した遷移状態があるから、
3つ。
b) 上の過程 1) および 2) の結果として生じた生成物「カルボカチオン」および「プロトン化アルコール」が中間体である。
2つ。
c) 「最も小さい速度定数をもつ」 = 「最も遅い」である。教科書 p282 の記述も参考にすると、はじめの中間体であるカルボカチオンを生成する過程 1) が最も遅い。
6.11-6.20
6.11
反応の位置選択性に注意すること。
すなわち、最も安定なカルボカチオンを経由して進行するものが主生成物となる(マルコフニコフ則に従う)。
(解答例)
a) pentan-2-ol
b) cyclohexanol
c) hexan-2-ol と hexan-3-ol の両方がほとんど差がなく得られる
d) 1-methylcyclohexan-1-ol
b) の反応では、反応基質の構造が二重結合に対して対称なため、位置選択性に関係なくただ1種類のアルコールのみが得られる。
命名において、b) は、主基1つのみが結合しているため、位置番号は不要で、cyclohexan-1-ol とはしないが、d) では、メチル基が結合しており(主基の位置番号を一番小さくするという規則があり、この構造においては、主基 -ol の位置は必ず 1 でなければならないが)、主基の位置番号を省略せずに示さなければならない。
6.12
b) と c) は、反応機構の観点から比較して述べるとよい。
(解答例)
a)
1) 2-chloro-2-methylpropane
2) 2-bromo-2-methylpropane
3) 2-methylpropan-2-ol
4) 2-methoxy-2-methylpropane
b) はじめに H+ が付加し、4つの反応とも、共通のカルボカチオン(t-ブチルカチオン)を経由する反応であること。
c) この共通のカルボカチオンに対して付加する求核種が異なる。1) と 2) はハロゲン化物イオンであり、3) と 4) は中性の水、およびアルコールである。そのため、3) と 4) では、生成物がカチオンであり、そこから H+ が脱離して最終生成物を与える。
6.13
二重結合に水を付加させるとアルコールが得られるが、 6.12 の4) のように、二重結合にアルコールを付加させるとエーテルが得られる。
エーテル R1-O-R2 を、R1-OH と R2 に対応するアルケンとの反応で得る組み合わせ、および、R2-OH と R1 に対応するアルケンとの反応で得る組み合わせとを考えることになる。さらに、そのそれぞれに対し、アルケンの二重結合の位置として適切なものはどれか考える必要がある。
(解答例)
酸触媒による付加反応で、目的生成物を与える組み合わせは、教科書にもあるとおり、次の3つが考えられる。
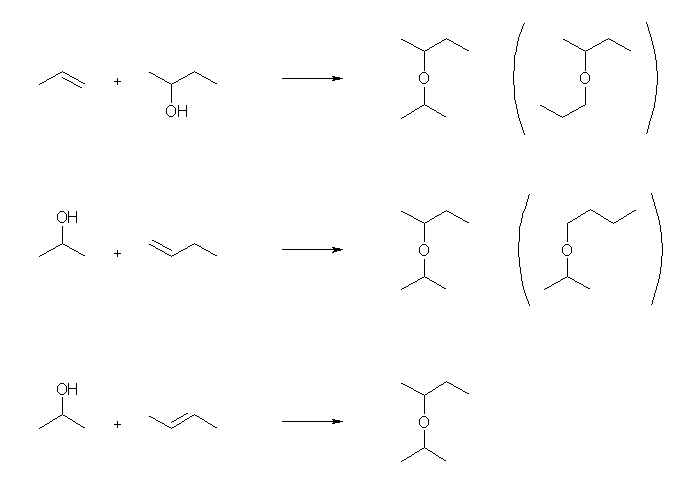
このうち、一番下が、アルケンの対称性の関係より、1種類の生成物しか与えない。上および中央の2つの組み合わせでは、主生成物は目的生成物であるが、反応の条件により、位置選択性が悪い反応を行うと、カッコの中に示した副生成物が生じる可能性がある。
6.14
a), b) は、エーテルであるが、メトキシ基を導入するためには、(炭素1個のアルケンは存在しないから)メタノールとアルケンの反応の組み合わせとなる。
c), d) は、アルケンと水より、アルコールを得る反応である。
(解答例)
酸触媒により、以下の基質の組み合わせで付加反応を行う。
a) cyclohexene + methanol
b) 2-methylpropene + methanol
c) cyclopentene + water
d) but-2-ene + water
ただし、d) は、but-1-ene と水との反応でも、目的物が主生成物として得られる。
6.15
p284 一番上の反応機構を参考にせよ。なお、反応に用いているアルコール(3-methylbutan-1-ol)の構造は、若干複雑なように見えるかも知れないが、methanol や ethanol が反応する場合と区別する必要はない。
(解答例)
次の3段階で反応は進行する。
1) アルケンへの H+ の付加によるカルボカチオンの生成。この H+ の供給のため、この反応では硫酸を酸触媒として加えている。(過程 3 で H+ が再生し、消費されない(触媒である)ことを確認すること。)
なお、この過程が3段階の反応の中で最も遅い(律速段階である)。
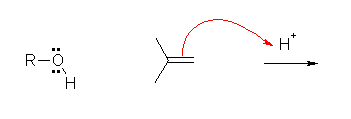
2) アルコールが求核種として働き、カルボカチオンに付加する。
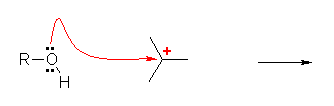
3) 生じたプロトン化エーテルより、H+ が脱離し、最終生成物であるエーテルを与える。
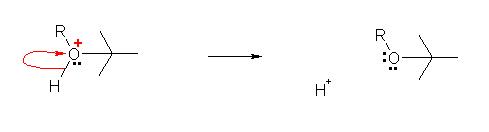
※ なお、教科書 p284 の反応機構では、H+ と書く代わりに、溶媒であるアルコール R-OH がプロトン化された R-OH2+ を用いている。水中で、裸のプロトン H+ が存在する代わりにオキソニウムイオン H3O+ が存在するのと同じ理屈である。
特に指定されない限り、水中におけるオキソニウムイオンを H+ と記して問題がなかったように、プロトン化アルコールの代わりに H+ と記しても差し支えない。
このようなところを厳密にするなら、たとえば塩化水素との反応のような場合でも、極性溶媒中であれば、アルケンとの反応に先立って解離が起きているはずなので、H-Cl との反応として書くのではなく、プロトン化溶媒との反応として書かなければいけない、などの考察が必要になる。
6.16
・ヒドリドシフト(水素の転位)や、アルキル基の転位は、カルボカチオン炭素の隣接原子上からのみ生じる。
・仮に水素やアルキル基を動かしてみたとき、前後でカルボカチオンの安定性に差がない場合は、その転位は生じないものと考えてよい。
以上の条件で考えること。そのために、潜在的に可能なすべての転位により生じるカルボカチオンの構造を書き出してみること。
教科書の誤植の訂正
a) (誤)「1,2-ヒドリドシフトすると第三級カルボカチオンを生じるが」
→(正)「1,2-ヒドリドシフトすると第二級カルボカチオンを生じるが」
(解答例)
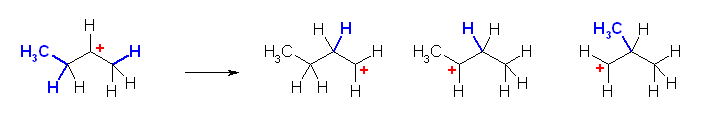
a)
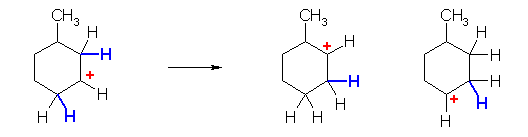
上記のような、環の上に結合している置換基(水素やアルキル基)の転位のみならず、環の骨格を構成している部分(アルキル基)も、潜在的には転位が可能である。
とはいえ、はじめの形である第2級のカルボカチオンは、上記、いずれの転位によっても、より安定な構造を生じることはない。従って、「このカルボカチオンは転位しない」(反応条件にもよるが、転位による生成物を考えなくてよい)。
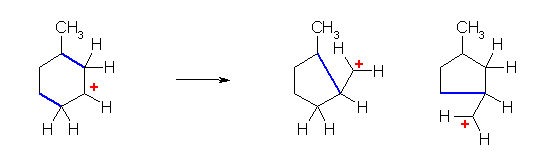
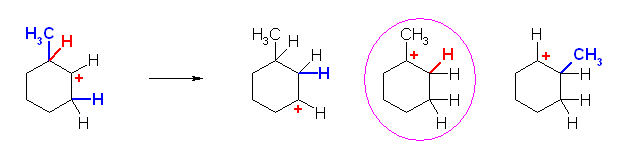
b)
上の構造式で、左側の隣接位より、水素が転位したときのみ、もとのカルボカチオン(第2級)より安定な、第3級のカルボカチオンを生じることが可能である。この転位のみが生じる。
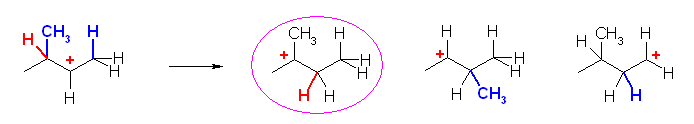
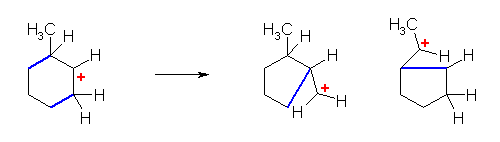
c)

上の構造式で、左右対称なので、右側からのみの転位を検討すればよい。水素の転位でも、メチル基の転位でも、環骨格炭素の転位でも、いずれも、もとのカルボカチオン(第3級で安定)から、より不安定なカルボカチオンしか生じない。従って、このカルボカチオンは転位しない。
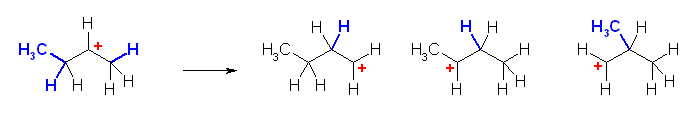
d)
潜在的に可能性のあるいずれの転位でも、もとのカルボかチン(第3級で安定)から、より不安定なカルボカチオンしか生じない。従って、このカルボカチオンは転位しない。
e)
隣接位のメチル基の付け根の位置の水素が転位(ヒドリドシフト)したときに、もとのカルボカチオン(第2級)より安定な、第3級のカルボカチオンを生じることが可能である。この転位のみが生じる。
f)
潜在的に可能性のあるいずれの転位でも、もとのカルボカチオン(第2級)より安定なカルボカチオンを生じることはない。従って、このカルボカチオンは転位しない。
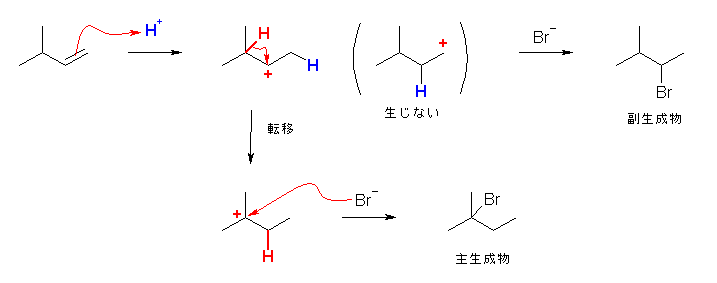
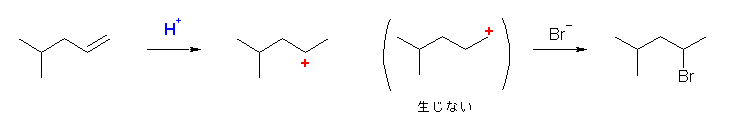
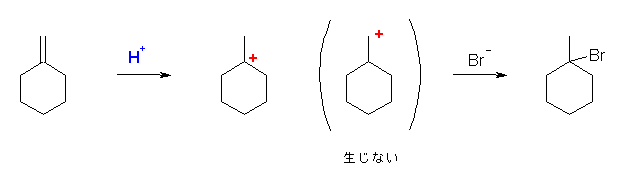
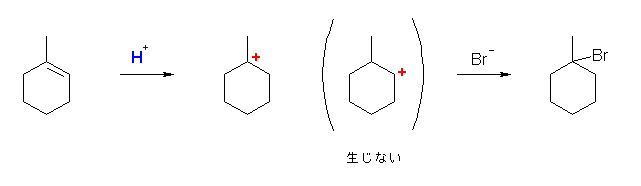
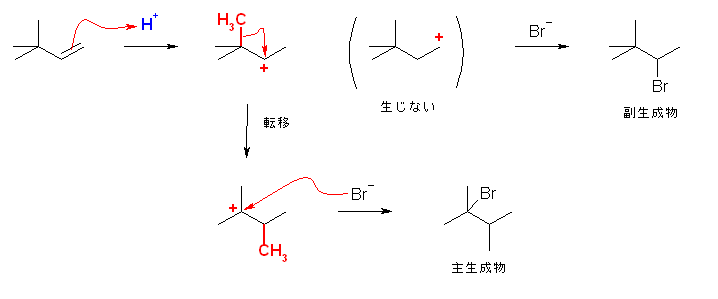
6.17
はじめに生じるカルボカチオンの安定性を考慮すること。
第2級のカルボカチオンの場合、更に安定な第3級のカルボカチオンへの転位がないかを探すこと。
(解答例)
a) 2-bromo-2-methylbutane
b) 2-bromo-4-methylpentane
c) 1-bromo-1-methylcyclohexane
(置換基が2つ以上あるので、シクロヘキサン上の位置番号を省略することはできない。)
d) 1-bromo-1-methylcyclohexane
e) 2-bromo-2,3-dimethylbutane
f) 生成物は、次の2つのほぼ等量の混合物となる。(どちらが主ということはない。)
1-bromo-3-methylcyclohexane
1-bromo-4-methylcyclohexane
6.18
ヒドロホウ素化反応の位置選択性を決める要因(教科書 p290)は、2通りあり、どちらも同じ配向性を示す。ここでは、電気的な要因(分子内の電子の分布に基づく分極構造によるもの)ではなく、立体的な要因について問われている。
(解答例)
9-BBN は、ホウ素化合物 H-BR2 の中でも、R の部分が嵩高く、立体的要因が強く効くものである。そのため、位置選択性が高くなる。
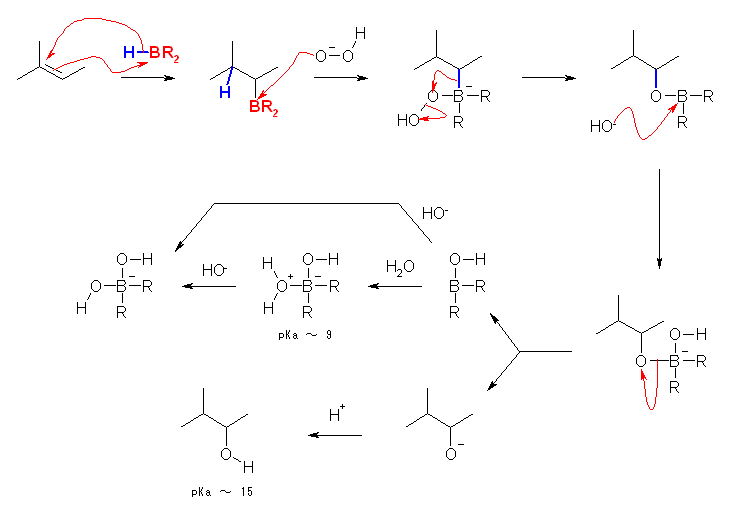
6.19
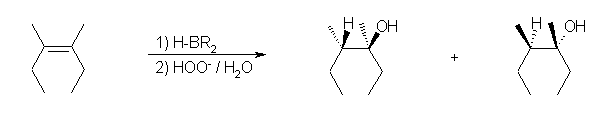
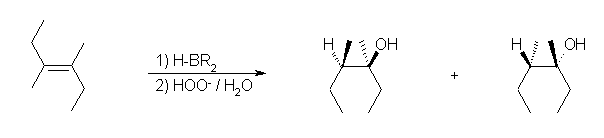
ヒドロホウ素化-酸化反応では、逆マルコフニコフ配向(位置選択性)での水の付加(R2C=CHR → R2HC-CHR(OH))が生じる。環に含まれる二重結合の場合には、立体選択性が区別できる生成物を与える。立体選択性は、シン付加である。
化合物名については、教科書は古い規則で示している。
2-メチル-2-ブテン → 2-メチルブタ-2-エン, 2-methylbut-2-ene
(解答例)
a) 3-methylbutan-2-ol
b) trans-2-methylcyclohexan-1-ol
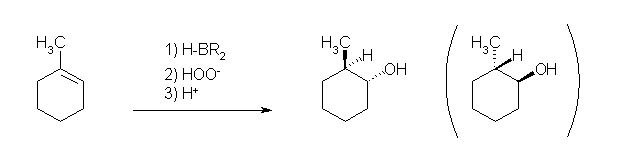
ヒドロホウ素化反応がシン付加であるため、もとから結合していたメチル基は、水酸基に対してトランス(環の逆)側に結合している。ヒドロホウ素化が面の上下のどちらで生じるかの違いによる「カッコの中に示したもの」と「そうでないもの」は、同様にトランス体であるが、空間内の平行移動や回転によって重ねあわせることはできず、鏡対称のカタチである。(4章で学ぶ、光学異性体である。)
ここでは、シン付加によりトランス体を生じることのみを問題にしており、どちらの光学異性体ができるかを(今回は、両者を等量生じる)特に問題にしないので、上記式のカッコ内を示さなくてもよい。
a) の反応を例にとり、反応機構の大事なところを曲がった矢印で示した。曲がった矢印が沢山書き連ねてあり、非常に複雑な反応のように見えるかもしれないが、いずれも、必然的にそうなるものでしかない。すなわち、慣れてくれば、自然と他には書きようがないことがわかる。
・はじめに、ホウ素がルイス酸である(3本の結合をもつのみなので、価電子数が6で、八偶子を満たしていない。)また、ホウ素の電気陰性度は、水素よりわずかに小さいため、水素−ホウ素結合は、Hδ--Bδ+ のように分極している。そのため、ホウ素が二重結合のπ電子を受け取る。また、これとほぼ同時に、より級数の高い側の炭素に対し、ヒドリド(H-)を与える。(これにより、逆マルコフニコフ配向となる。)
ここまでの反応は、THF などの有機溶媒中で行われ、水やアルコールなどホウ素に強く配位するものが溶媒として加えられたりはしない。
・ここから溶媒中に水が加わる。(反応熱による急激な温度上昇や、過酸化水素によるエーテルの過酸化物の生成などを防ぐ目的で、はじめに水を加えることもある。)アルカリ性の過酸化水素水を加えることにより、生じた HOO-イオンがルイス酸であるホウ素に求核攻撃する。
・B-O-OH という構造から、水酸化物イオン HO- が脱離するのと協奏的に、隣接位よりアルキル基が転位する。これは、カルボカチオンの転位と全く同様に捉えて構わない。B-O-OH から水酸化物イオンを先に脱離させておくと、生じるのは B-O+ というイオン(電気陰性度が高いはずの酸素上に生じた陽イオンなので、不安定)であることを考えると理解できるだろう。たぶん、実際にはこの転位があるから -OH が脱離できる、という順序なのかもしれないが。
・この転位により、ふたたび三配位、ルイス酸に戻ったホウ素に対し、脱離したばかりの水酸化物イオンが求核攻撃する。(本当のところは、塩基性の水溶液(過酸化水素も含むけれど)中の反応なのだから、さきほど生じたばかりの水酸化物イオン以外にも、周囲には多くの水酸化物イオンがあるかもしれない。また、生じた水酸化物イオンは水との間でプロトンのやりとりをしているだろう。とはいえ、酸素に同位体標識でもしてやらないと、脱離したまさにその水酸化物イオンが反応に関与するのかどうかの区別を付けられるわけではない。)
・水酸化物イオンの求核攻撃が可逆であるように、水酸化物イオンの代わりにアルコキシドイオンが脱離する。酸性水溶液中であるならば、R-O(H+)-B のようにプロトン化してから中性のアルコールで脱離させる。
・脱離したアルコキシドイオンは強塩基である。(水とアルコールの pKa がほぼ同じと考えると、水酸化物イオンと同等の強さと思ってよい。)従って、すぐさま R2B-OH(すなわちホウ酸誘導体)や周囲の水からプロトンを受け取り、中性のアルコールを遊離する。
(発展)
教科書では、過酸化水素 H2O2 の共役塩基「 HOO- 」というイオンに対し、「過酸化水素イオン」という語を充てているが、一般的に使用されるものではないような気がする。皆さんは、「過酸化水素イオン」の語を用いるのは、やめておいたほうがよい。(誤りだと思うのですが、明確に誤りであるとする根拠もまだ見つけていないので、やや曖昧な表現になっていますが。)
というのも、水に対応したその共役塩基である水酸化物イオン HO- を水イオンと呼ぶことはあり得ないからである。
そのまま HOO- と示すか、ヒドロペルオキシドイオンという名称を用いるかするようにしてください。
※ 判ればいいじゃん、というような安易な考え方はしないように。たとえば Cl- のことを、今でも「塩素イオン」と言ってしまう人がいますが、よっぽど年寄りの人(昔は、クロリドイオンに対し、塩素イオンの訳語を用いていたようです)か、化学とは無縁の世界の人でしょう。相手がそういう方である場合には、脳内変換して、ああ、実際には「塩化物イオン」のことを指しているよね、と思ったりしておけば良いのですが、皆さんのように化学系の学科出身の方の発言の場合には、そうもいきません。
基本的には、「元素名」+「イオン」という名称になるのは(水素イオン、リチウムイオン、などのように)単一元素からなる陽イオンですから、「塩素イオン」という語で Cl+ というイオンを指します。(厳密には「塩素(I)イオン」と価数を示すべきでしょうね。)
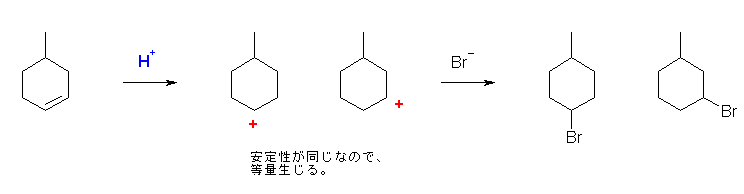
6.20
HBr の極性付加では、はじめにカルボカチオンを生じることに注意する。
(解答例)
主生成物は、2-bromo-2-methylbutane である。
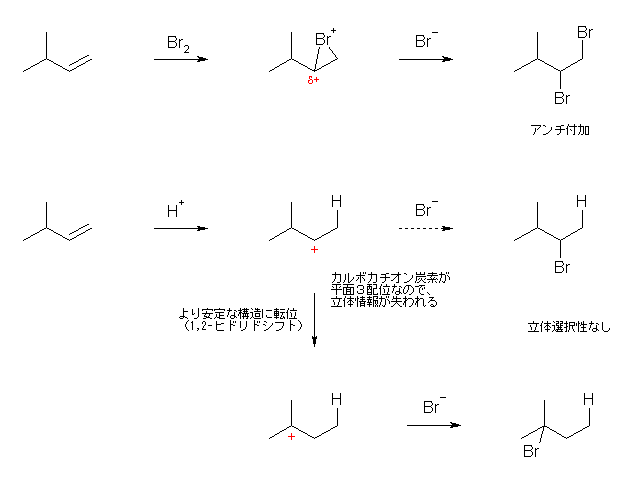
・Br2 の代わりに HBr を用いることで、
立体選択性がなくなる。
代わりに、アルケンの構造にもよるが、位置選択性がでてくる。
(マルコフニコフ配向をとる。pent-2-ene のように、二重結合炭素2つが非等価で、アルキル置換基の数が同じ場合は、位置選択性なく、2種類の位置異性体がほぼ等量ずつ生成する。)
・この問題の場合は、カルボカチオンがより安定な構造に転位する。
6.21-6.30
6.21
b) 問題文に、ミスリードが含まれているように思える。
(誤)「正電荷をもった臭素原子よりも」
(正)「正の形式電荷をもった臭素原子よりも」
そもそも、オキソニウムイオン(H3O+)やアンモニウムイオン(H4N+)でもそうだったように、形式電荷をもつ原子が実質的な電荷を帯びているわけではないことに注意しなければならない。
ブロモニウムイオンの実際の電荷の分布については、教科書 p293 の静電ポテンシャル図を参照すること。(臭素が結合した炭素よりも、電気陰性度の高い臭素側に、より電子が多く集まっていることが確認できるはずである。)
上記の説明がきちんと把握できていれば、そもそも臭化物イオン Br- がブロモニウムイオンのいずれの位置を攻撃するのかについては自明であり、わざわざ問いで訊かれている内容(ブロモニウムイオンの臭素原子に対する求核攻撃)を考慮する必要はないが、練習のために解いてみること。
なお、この際、臭素のすべての孤立電子対を書きながら考えること。
(解答例)
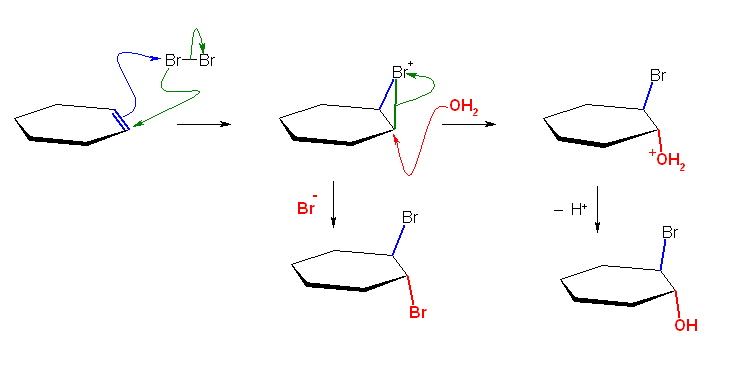
a) HBr の極性付加反応では、その第一段階としてプロトン H+がアルケンに求電子付加し、カルボカチオンを与えるのに対し、Br2 の極性付加反応では、形式的には Br+がアルケンに求電子付加し、環状のブロモニウムイオンを与える。
b) 臭化物イオン Br-が、環状ブロモニウムイオンの臭素に対して求核攻撃すると、
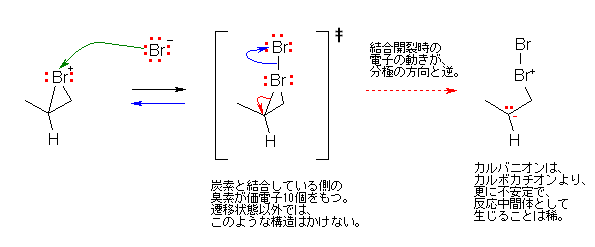
まず、上図中央に書かれたような構造が書ける。よく見ると、3配位の臭素は、2組の孤立電子対をもち、価電子が10個となってしまう。このような構造は遷移状態などの過渡的な構造でなら書いても構わないが、安定構造としては考えない(第2周期元素では原理的に書くことができない。臭素などのそれ以上の周期では、原理的には可能であるが、通常の条件ではあまり考えなくてよい)。
そこで、臭素の配位を1本減らさなければならないのだが、このとき、上図には示されていないが、C-Br → C+ + Br- となる(電気陰性度の違いを考えると自然な)不均一結合開裂では、臭素の価電子数の問題は解決されない(で、10個のままとなる)。
無理に C-Br → C- + Br+ となる不自然な方向の不均一開裂をさせた結果を上図に示してある。これにより、臭素の価電子は8個になるが、そもそもこの不均一開裂は、電気陰性度の違いを考慮したときに不利なので(HBr → H- + Br+ と書かれた式を見たら不自然でしょ?)、起きない。
唯一可能なのが、上の遷移状態から青の曲がった矢印の過程だが、これは今考えた反応の逆反応である。
以上が問いの要求に対する解答だが、ヒントにも書いたように、ブロモニウムイオンの正電荷は、形式電荷を担う臭素原子ではなく、炭素上にある。そのため、臭素原子に対する求核攻撃は、そもそも生じない。
環状ブロモニウムイオンの静電ポテンシャルマップは、教科書(p293)を参照のこと。また、プロペンと臭素との反応で生じた環状ブロモニウムイオンの構造を、次に示しておく。
正電荷が(形式電荷を担う臭素原子ではなく)、より級数の高い方の第2位の炭素原子に主に存在していることと対応して、
・2位の炭素の臭素との結合は切れかけているので、長い。(「 C-Br+-R → C+ + Br-R 」の寄与がある、という表現をすることがある。)
・2位の炭素が、ほぼカルボカチオン性をもつので、2位の炭素が(臭素との結合を除けば)ほぼ平面3配位となっている。(このことと対応して、臭化物イオンの求核攻撃は、第2位炭素に対してのみ生じる。ただし、完全なフリーのカルボカチオンではないので、環を形成している臭素原子とは逆の面からのみ、攻撃が可能である。)
(次のリンク先を参照)
環状ブロモニウムイオン の3次元模型
また、同じ3次元模型について、特徴的な方向からみた2つの図を貼っておく。
(上)横から見た図。
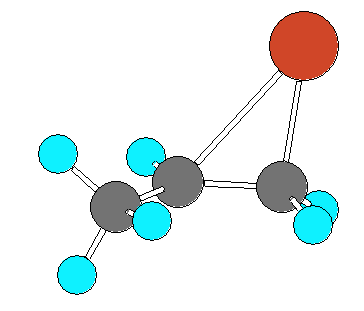
(下)対応するプロペンの第2位、第1位炭素が重なるような方向(上図で左側)から見た図。
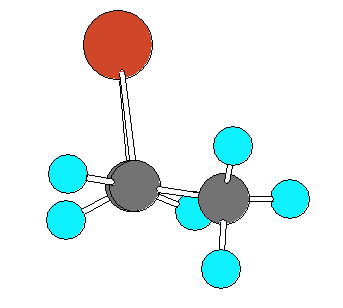
6.22
共有結合は、最外殻(価電子殻)の電子が、他の原子と共有されることで形成される。
(解答例)
Na+ も K+ も価電子を持たないから。
「最外殻がオクテットを満たしているため」でも、同じことを言っているので、可。最外殻がオクテットを満たしていない原子が、他の原子と共有結合をすることで、価電子殻がオクテットを満たすようになる。
6.23
反応の進行を示す矢印(→)の上に書かれているのは溶媒である。ここでは、溶媒分子も求核試薬として働く可能性があることに注意する。
2種類の求核試薬が共存したとき、そのどちらが求核試薬として働くかは、2つの求核試薬の濃度および、求核性の強さに依する。
溶媒として用いているものは、その濃度効果が大きく効く。溶媒は、常に溶質分子を取り囲んでいるため、反応の機会が多いのに対し、低濃度の求核試薬は拡散して対象となる分子と衝突するための確率が小さいからである。
また、求核性の強さは、およそ塩基性の大小と関係があるので、塩基性の高い方(共役酸の酸性が低い方)が求核試薬として働くと考えてよい場合が多い。
(解答例)
# すごく真剣に考えだすと、非常にストレスを感じる問題かもしれません。反応式に明示されているプラスアルファの要因(明示された溶媒だったり、NaI などの添加物だったり)が競合するべきものである、と単純に考えて結論を出すとよいでしょう。
a) 主:1-chloro-2-methoxy-2-methylpropane
副:1,2-dichloro-2-methylpropane
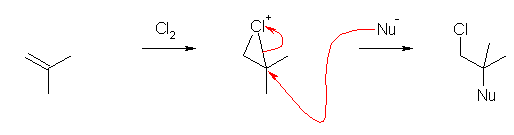
アルケンと Cl2 の反応により、環状クロロニウムイオンが生じる。これに、Cl- と CH3OH の2種類が、競合して求核種として働く。(求核種の攻撃は、より級数の高い炭素上で生じる。)
この際、溶媒であるメタノールが求核種として働いた生成物が主となる。溶媒が優先的に求核種として働く傾向は、アルケンの濃度および塩素の濃度が低い場合に顕著となる。溶媒は、生じたクロロニウムイオンの周囲をすべて取り囲む様に大量に存在できるのに対し、塩化物イオン Cl- は、アルケン1分子に対し1イオンのみが生成するから、もしアルケンの濃度や塩素の濃度が低い場合には、生じる Cl- の濃度も低く、溶媒に競合できなくなってしまうためである。
c) 主:butan-2-ol
副:2-chlorobutane
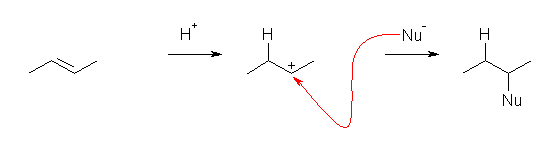
はじめにカルボカチオンが生じたのち(より安定な構造への転位は存在しないので、そのまま)求核攻撃を受ける。この際、Cl- と 水が競合して求核種として働く。この際、溶媒である水が求核種として働いた生成物が主となる可能性がある。(もちろん、HBr の濃度に依る。)
d) 主:2-bromo-3-methoxybutane
副:2,3-dibromobutane
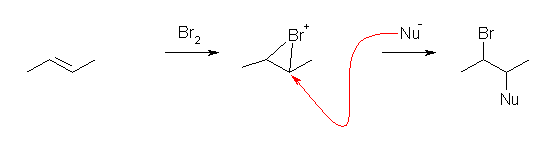
(英語版の解答例では、2,3-dimethoxybutane が主生成物であると記している。しかし、これは著者の誤り、または単なる誤植であると考えられる。2,3-dimethoxybutaneを生じるためには、上で主生成物として記した 2-bromo-3-methoxybutane がもう一段階次の反応を起こしていると考えるしかない。しかし、この反応、酸性条件でのハロゲン化アルキルに対する求核置換反応は考慮する必要がない(この条件では起きない)と考えられる。臭素基は水酸基と異なり、酸性条件でもプロトン化を受けないため、脱離性能が上がるわけではない。また、CH3O- のように求核性の高いイオン種は、酸性条件下では存在しない。)
さて、アルケンが Br2 と反応して、環状ブロモニウムイオンを生じる。(ここで、a) の環状クロロニウムイオンとは異なり、2つの炭素の級数は同じ第2級である。従って、C-Br の結合長は左右とも同じように描いている。また、求核攻撃は、2つの炭素の対し、平等に生じる。ただし、もともとの構造の対称性から、どちらの炭素に対して求核攻撃が起きても生成物の構造より区別することはできない。)
ここで、Br-と、メタノールの2種類が、競合して求核種として働く。溶媒であるメタノールが、求核種として働いたとき、2-bromo-3-methoxybutane が生成物として得られる。
b) 主:2-iodopropane
副:2-bromopropane
(副:propan-2-ol)
NaI を系に加えてその効果を検討することがこの問いの意図となっていることを考えるなら、この反応は水溶液中で実施されていないとおかしい。無溶媒の反応、すなわち「プロペンの気体と HBr の気体の間の反応、気相反応」では、そもそもこの章で問題にしているようなカルボカチオンを中間体として生じる極性付加は生じない。また、非極性溶媒でも、この反応はおきず、NaIも溶解しない。(カルボカチオンを含むイオンは、極性溶媒中でのみ安定化を受けて存在できるのであって、気相中や、非極性溶媒中では不安定で生じることができない。)なので、明示されていないが、「この反応は水中で行われている」または、「HBr が水溶液として加えられている」ものと結論しておくことにしよう。
この反応では、はじめにカルボカチオンが生じ、(この場合、より安定なカルボカチオンへの転位は、該当するものがないため、起こらないので、そのまま)求核種の攻撃を受ける。塩である NaI は水溶液中で、Na+ と I- に解離(電離)しているから、この系は、Br- と I- の両者が求核種として働く。(Na+ は、この反応に関与しない。)
ハロゲン化物イオンでは、水中ではイオン径の大きい I- が最も強い求核性を持ち、イオン径が小さくなる順 Br-、Cl- の順に求核性が下がる。(非水溶媒中では、この3種のイオンでは、イオン径の最も小さい Cl- が最も求核性が高く、I- が最も求核性が小さい。※)
※ 同じ1価の陰イオンなので、イオン径が小さいほど、その表面の電荷が密集していることになるので求核性が上がると予想される。これを考えると、非水溶媒中の結果が説明できる。水中では、この求核性の高さが溶媒を引き寄せる原因にもなり、結果として、溶媒和されたイオン として存在するので、求核性の大小が逆転してしまう。非水溶媒中では、裸のイオンとして存在している、という言い方をする。
以上が出題者が意図したであろう解答例と、それに対する解説である。さて、この系では、溶媒である(はずの)水も反応に関与できる。そのため、HBr や NaI の濃度が十分に低ければ、propan-2-ol も生成するはずである。a), c), d) と同様に考えるなら、これが主生成物でもおかしくない。
では、なぜ a) では溶媒であるメタノールが求核種として働いた生成物が主となると考え、c) では溶媒である水が求核種として働いた生成物が主となると考えたのに対し、なぜこの b) では溶媒である水が求核種として働いた生成物が主となるとは考えなくてもよいのだろうか。
実際のところは、反応の条件が変化すれば、考えうる生成物のうちどれが主生成物になるのかなどということは簡単に入れ替わってしまうこともあるだろう。また、そのようなことを厳密に規定できるような反応条件を与えたり、反応条件ごとにどのように変化するかをつぶさに観察することが現段階での主眼ではない。かといって、反応条件により一概には言えないなどという正論をぶったところで、練習問題の答え(や、試験の答え)にはなり得ない。
では。ぶっちゃけてしまえば、これは、単に出題者が水が反応に関与することを意図していない出題の仕方をしているからである。もし、水の反応の関与を考慮して欲しいなら、溶媒である水を明記するだろう。また、せっかく問いとして、NaI を加えることで、Br- と I- の求核性の大小を思い出して問いに答えるように仕向けておきながら、実は水が優先的に求核攻撃してしまい、両ハロゲン化物イオンはあまり反応しません、では NaI を加えた効果が答えに反映されない。
こういうぶっちゃけ方は、これは受験テクニックだったり、パズルの解き方的な考え方なので、これで終わりにするのはちょっと躊躇われる。
そこで、この b) の場合では、溶媒である水が主たる求核種として働いていない理由を、少々それっぽく理屈付けておこうと思う。ひとつめは、水中でも裸のイオンとして振舞う I- の求核性の高さによる効果であろう。ふたつめは、濃度の効果である。a) の反応では、アルケンと Cl2 の反応で、一つ目の求核種である Cl- が生じた。すなわち、a) の反応において、Cl- の濃度は、高々アルケンと同じでしかない。一方、b) では暗黙のうちにではあるが、HBr や NaI は、アルケンに対して過剰に与えられているだろう。従って、Br- や I- の濃度は十分に高く、溶媒の水に競合できると考えてよいだろう。c) でも同様のことが言えるのであるが、上で議論しているように、塩化物イオン Cl- は、水中では溶媒和されることにより、求核性が下がっており、溶媒である水に競合できずに負けてしまっているのであろう。※2
※2 希硫酸は、ほとんど求核性のない酸として扱ってよい場合が多い。そのため、アルケンからカルボカチオンを発生させるための(共役塩基が求核付加生成物を与えないような)酸として硫酸を用いると、溶媒である水が求核付加し、アルコールを与える。一方、上の議論では塩酸もこの目的で使用できるように見えてしまう。ただし、塩酸の濃度によっては、これは正しくない。たとえば、3年生の学生実験でも行う予定であるが、2-methylpropan-2-ol を塩酸(すなわち、塩化水素の水溶液)で処理することで、2-chloro-2-methylpropane を生じる反応が進行する。すなわち、何が言いたいのかというと、Cl- は、溶媒である水が周囲に多量にあったとしても、常に競合できずに負けるというわけではない。
(発展)
主生成物(major product):量的にも最も多く生成する生成物。
?(minor product):量的に主とはならない生成物。
副生成物(byproduct):結果的には minor 生成物である(場合が多い)が、どちらかというと単純な量の主従で決まるより、目的や意図に即していない、または、注目していない、というような意味で使用されることが多い。
minor product を少量生成物と訳すのはちょっとニュアンスが違うような気がする。全体で小スケールで実験を行ったら、主生成物が少量である場合もあるわけだし。「主」に対する語は「従」「支」「傍」などだが従生成物ともあまり言わないようだし。
単にカタカナにして、「マイナー(な)生成物」と言っておいてください。
6.24
問題文にも与えているように、「I-Cl」という分子は、「Iδ+-Clδ-」のように分極している。(そのため、名称は、塩化ヨウ素である。)ならば、はじめに生じる環状ハロニウムイオンは、どちらの元素で反応したものが得られるか。
(解答例)
2-chloro-1-iodobutane
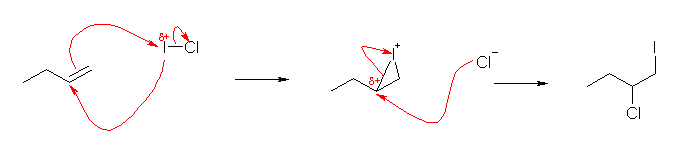
はじめに、アルケンの π 電子は、塩化ヨウ素の、より正電荷を帯びているヨウ素に求核攻撃をして、環状ヨウドニウムイオンを生じる。ここで、2つの炭素の級数に差があるので、次の求核攻撃は、第2級炭素側で生じる。
6.25
問 6.23 と同様、溶媒が競合して求核攻撃する場合について考えよ。ただし、a) のジクロロメタン CH2Cl2 は、求核種としては働かない。
(解答例)
はじめに環状ブロモニウムイオンが生じる過程は共通である。また、これに対する求核攻撃は、より級数の高い炭素(2位の炭素が、第2級である)に対して生じる。
a) では、競合する求核種がないため、Br- が更に求核攻撃し、ビシナルなジブロミドを与えるが、b) 〜 d) では、Br- の代わりに溶媒が求核攻撃した結果の生成物が(主、または、条件により副生成物として)得られることが予想される。
a) 1,2-dibromobutane
b) 1-bromobutan-2-ol
c) 1-bromo-2-ethoxybutane
d) 1-bromo-2-methoxybutane
6.26
Cl2 との反応なので、はじめにアルケンが環状クロロニウムイオンを生じる。次いで、分子内での反応を考えてみよ。式に与えられている生成物の構造と、はじめに生じると予想される環状クロロニウムイオンの構造を比較すると、答えがわかるはずである。
(解答例)
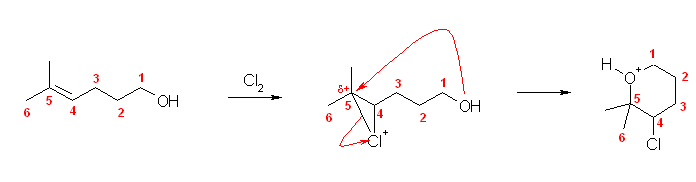
環状クロロニウムイオンが、分子内で水酸基の求核攻撃を受ける。生じたプロトン化環状エーテル(上図、最右側生成物)から脱プロトン化すると、問いに与えられた生成物となる。
6.27
(解答例)
6.28
§6.10 を参照すること。
(解答例)
アルケンと有機過酸の反応では、二重結合だった場所がオキシラン環(C,C,O から成る三員環)になる。従って、オキシラン環の位置を二重結合に戻した構造がもとの原料のアルケンである。
a) cyclohexene
b) but-1-ene
6.29
アルケンとオゾンの反応を、ジメチルスルフィドで処理することにより、オゾン開裂が生じ、R2C=CR2 → R2C=O + O=CR2 の反応となる。Rがすべてアルキル基の場合はケトンを、一方の炭素上でRがアルキル基と水素である場合は、アルデヒドを与える。
(解答例)
a) 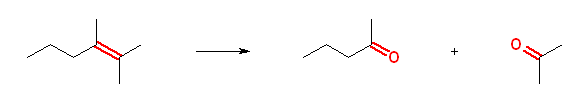
pentan-2-one + propan-2-one (propan-2-one の慣用名は、acetone アセトン)
b) 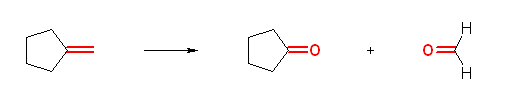
cyclopentanone + methanal (methanal メタナール の慣用名は、formaldehyde ホルムアルデヒド)
c) 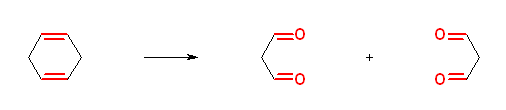
propanedial
d) 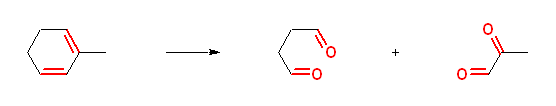
butanedial + 2-oxopropanal
e) 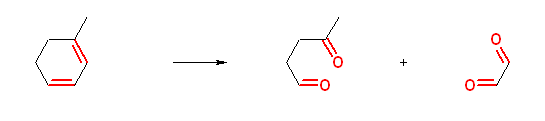
4-oxopentanal + ethanedial (ethanedial エタンジアール の慣用名は、glyoxal グリオキサール)
f) 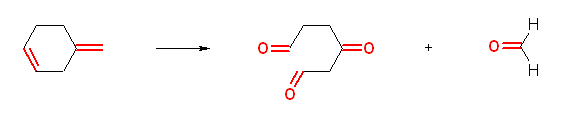
3-oxohexanedial + methanal
(発展)
☆
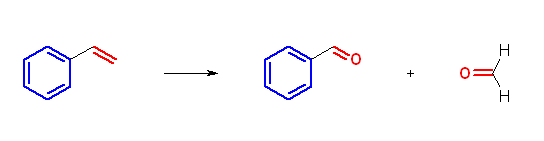
ベンゼン環内の二重結合は、オゾン酸化で切れない。
6.30
問い 6.29 のようなパターンを参考にして考えよ。
(解答例)
a) 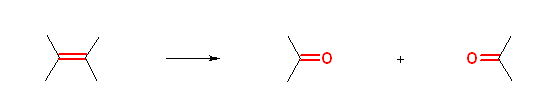
2,3-dimethylbut-2-ene → propan-2-one
b) 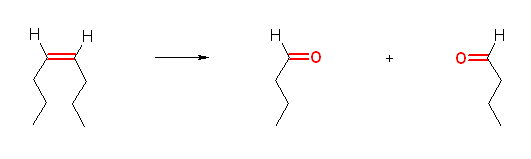
oct-4-ene → butanal (オクタ-4-エンの幾何異性体は、シス、トランスのいずれでもよい。)
6.31-6.40
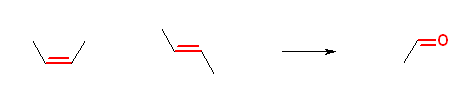
6.31
問いの29、30 の答えを見ながら考えるとよい。
(解答例)
1) もとのアルケンの幾何配置(E/Z のどちらであったのか)は判らない。
2) カルボニル基を二つ含む生成物が得られた場合、もとの構造をただひとつの候補に絞ることは難しい。
この例では、もとのアルケンの分子式(または分子量)が判れば区別が付けられる。
この例では、たとえもとのアルケンの分子式が C12H20 であると判っても、二重結合およびメチル基の位置異性体を生成物から判断することはできない。
また、更には、得られた生成物中のカルボニル基がアルケンのオゾン開裂に由来せず、反応物中にはじめから存在していた可能性まで含めて考慮すると、更に複雑になる。
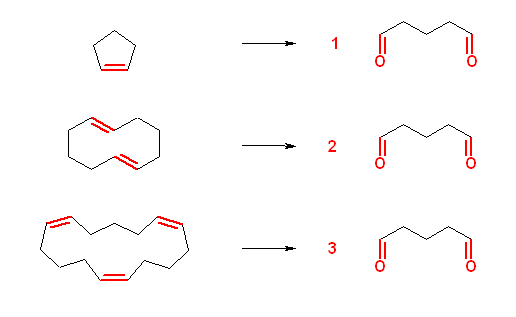
6.32
オゾン酸化では、二重結合を形成している2つの炭素がカルボニル基に変換され、別の側にいくことになる。鎖状のアルケンで二重結合が一箇所のものは、二重結合の位置で分断されて2つの分子になっていく。それぞれの生成物は、カルボニル基を1つずつもつことになる。従って、あるオゾン酸化の生成物が2つのカルボニル基を持っていたなら、もとの構造は、2つの二重結合に挟まれた部分であるか、若しくは環内に二重結合をもつ分子かのいずれかであることになる。
29から31の答えなども参照すること。
(解答例)
教科書に解説されている、また、以下に示す解答は、同じ反応生成物を与えるうちで、もっとも単純な例である。
たとえば a) では、問い 6.31 の b) に示されたのと同様に、1-methylcyclohexene が一つの反応物の構造の候補であるならば、1,7-(または、1,8-)dimethylundeca-1,7-diene もまた反応物の構造の候補である。
a) 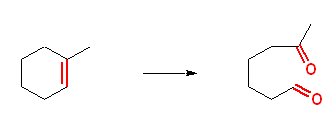
b) 
※ a) ではアルケン、b) ではジエンと指定しているので、少なくとも b) は上の解答例のみが条件に合致するものである。(もし、pentanedial 上に非対称な置換基が結合していた場合は、反応物の構造が2種類考えられることになる。)
a) で「アルケン」と言っている部分を、二重結合が1つのアルケンに限定しているなら、上の解答例のみが合致するものである。しかし、別の反応物の候補である環状のジエンも、アルケンの枠組みに入る。
6.33
(解答例)
6.34
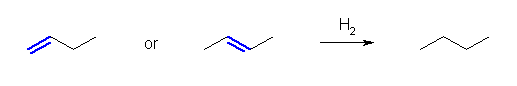
「アルカンを」「アルケンを出発物質に用いて合成する」ためには、接触水素添加(接触水素化、水素付加)が必要である。
アルカンの一般式 CnH2n+2
↑ H2
アルケンの一般式 CnH2n
出発物質のアルケンにおいて、二重結合の位置異性体は、すべて接触水素添加により同じ生成物を与える。
(解答例)
a) 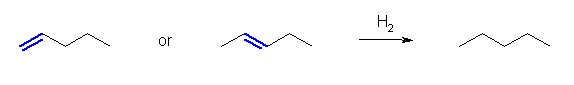
b) 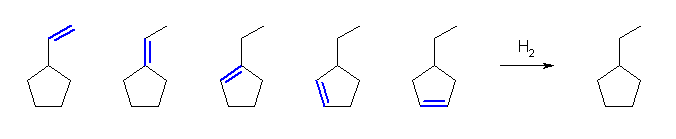
6.35
6.34 と同様に、二重結合の位置異性体を数えればよい。
(解答例)
幾何異性体(シス-トランス異性体)を区別するかどうかで、アルケンの種類数は変わる。
a) 2種類(幾何異性体を区別する場合には、3種類)。
b) 3種類(幾何異性体を区別する場合には、4種類)。
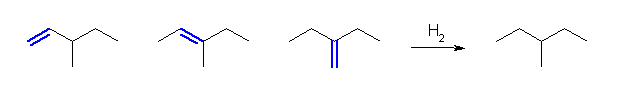
c) 3種類(幾何異性体を区別する場合には、5種類)。

6.36
教科書 p304 の図 6.7 も参照すること。接触水素化反応は、いずれも発エルゴン反応である。
これは、反応の前後で結合の状態の変化を比べてみれば判る。
R2C=CR2 + H2 → R2HC-CR2H
変化しない 4本の C-R 結合以外を抜き出すと、
反応前 C=C 部分、σ結合1本、π結合1本、H-H のσ結合1本
反応後 C-C 部分、σ結合1本、新たに生じる C-H の σ結合2本。
差分として1本の π 結合が 1本の σ 結合になっている。ばらばらの原子が共有結合を作って安定化するのだが、π 結合による安定化は、σ 結合による安定化の半分程度でしかない。
従って、反応前の状態より、反応後の方が安定化が大きい。
反応熱は、通常、始状態を基準に取って示すから、発エルゴン過程の場合、反応自由エネルギー変化は負、ΔG < 0 で表される。
なお、この教科書では kcal/mol という単位を用いているが、常に、kJ/mol に換算しておくこと。-30 kcal/mol = -126 kJ/mol
(解答例)
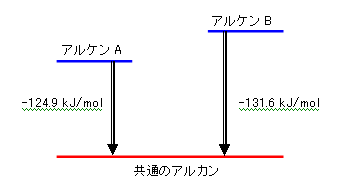
ヒントにも書いたように、接触水素化は、発エルゴン過程である。(反応前よりも反応後の方がポテンシャルエネルギーが低くなる。)従って、反応自由エネルギー変化の絶対値が小さい方が、もとのアルケンも安定であるということになる。
よって、A の方が安定なアルケンである。
6.37
教科書 §6.13 にも書かれているように、二重結合を形成している2つの炭素上の4つの置換基のうち、4つともアルキル基である場合が最も安定である。カルボカチオンの安定性を考えるときと同様だと覚えておくとよい。
(解答例)
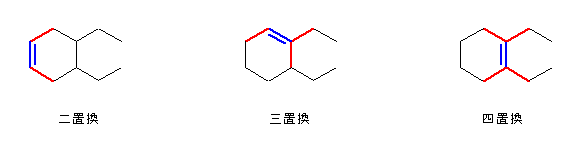
(左)4,5-diethylcyclohexene
二置換のアルケンで、この3種の中では最も不安定。水素化熱(の絶対値)は、最も大きい。
(中)1,6-diethylcyclohexene
三置換のアルケン。
(右)1,2-diethylcyclohexene
四置換のアルケンで、この3種の中では最も安定。水素化熱(の絶対値)も、最も小さい。
6.38
教科書 §6.13 を参照すること。二重結合を形成している2つの炭素上の4つの置換基においてアルキル基の数が多いほど安定である。ただし、同じ2である場合は、かさ高いアルキル基同士がシスの位置関係にあるよりも、トランスの位置関係にある場合の方が安定である。シス体とジェミナル体(2つのアルキル基が同一炭素上にあるもの)は、安定性が近い(一概に大小関係を言えない)。
(解答例)
(安定)← →(不安定)の順
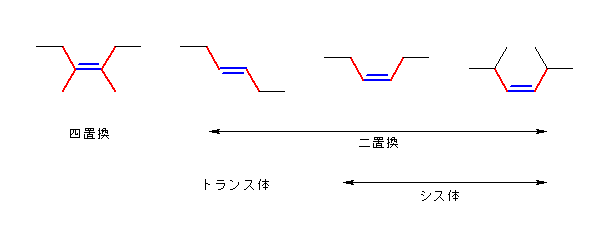
(Z)-3,4-dimethylhex-3-ene
四置換体で、この4種の中で最も安定である。
(E)-hex-3-ene
二置換体だが、アルキル基同士がトランスの位置関係にあるため、アルキル基同士の重なり形相互作用がない。そのため、残りの2つ(アルキル基同士がシスの位置関係のもの)よりも安定である。
(Z)-hex-3-ene
二置換体で、アルキル基同士がシスの位置関係にあり、C3-C4の方向から見たとき、2つのエチル基同士は重なり形の相互作用を示す。そのため、トランス体に比べて不安定である。
(Z)-2,5-dimethylhex-3-ene
二置換体で、アルキル基同士がシスの位置関係にある点では (Z)-hex-3-ene と同じである。しかし、C3-C4 の方向から見たとき、重なり形の相互作用を示すアルキル基は、エチル基よりも大きな(かさ高い)イソプロピル基(1−メチルエチル基)である。そのため、4種の中で最も不安定である。
6.39
(解答例)
6.40
2-ブテン → ブタ-2-エン but-2-ene
用語については、教科書の p308 を参照せよ。
立体選択的に反応が進行するためには、プレキラル面を区別した反応が生じる必要がある。
異なる3種類の配位子が結合した平面に、上から、および下から攻撃が起きたとき、異なる立体の生成物を与える。
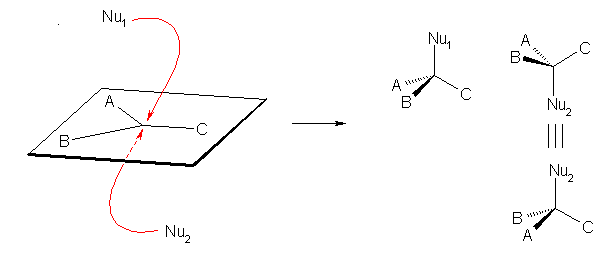
「面を区別して反応が進行する」=面の上方から、または下方からの反応のいずれかがもう一方に優先して生じる。
この場合、一方の立体異性体がもう一方に優先することになる。(立体特異的な反応となる。)
(解答例)
a) No.
一般的に、二重結合に対する HBr の極性付加反応(現在学習している型の反応)では、潜在的に生じる可能性のある2種類のカルボカチオンの安定性に差がある場合に、位置選択的となる。but-2-ene との反応では、(but-2-ene の幾何配置、E体か、Z体かに無関係に)二重結合炭素のどちらにはじめに H+ が付加したとしても、どちらも第2級のカルボカチオンを生じる。(その上、対称性の関係で、この2つは全く同一の構造である。)そのため、位置選択性はない。
b) No.
一般的に、二重結合に対する HBr の極性付加反応(現在学習している型の反応)は、立体選択的ではない。
「立体選択的ではない」というのは、この反応により、どれか特定の立体異性体が優先的に生じることはなく、すべてが確率に従って生じるだけであることを示す。
はじめに二重結合炭素に H+ が付加する際、二重結合炭素の面を区別して、どちらかからの付加が優先するわけではない。また、二重結合炭素に H+ が付加して生じるカルボカチオン炭素は、sp2 混成の平面3配位型となる。この平面の上下が区別されることなく、どちらからも同じ確率で求核反応が生じる。
生成物である 2-bromobutane は、2位の炭素上に結合している4つの置換基が、すべて異なる(臭素、水素、メチル、エチル)ので、立体異性体が考えられるが、臭化物イオンがカルボカチオンに対して求核攻撃する際に面の区別を行わないから、2種類の立体異性体が等量の混合物(すなわち、ラセミ体)として生じる。そのため、立体選択的ではない。
c) No.
反応物(but-2-ene) には、2つの立体異性体(E体とZ体)があるが、どちらも同じ反応生成物を与える。したがって、立体特異的ではない。
d) Yes.
この反応では、2-bromobutane のみを生じ、1-bromobutane は得られない。
理由は、それぞれを与える中間体であるカルボカチオンの安定性で説明される。
e) No.
生成物である 2-bromobutane は、2位の炭素上に結合している4つの置換基が、すべて異なる(臭素、水素、メチル、エチル)ので、立体異性体が考えられるが、臭化物イオンがカルボカチオンに対して求核攻撃する際に面の区別を行わないから、2種類の立体異性体が等量の混合物(すなわち、ラセミ体)として生じる。そのため、立体選択的ではない。
f) No.
反応物(but-1-ene) には、立体異性体が存在しない。そのため立体特異的であるかどうかを判定する要因を満たさない。(Yes/No の二択の場合、立体特異的ではない、としか言いようがないので No.)
(発展)
実は、二重結合に対し HBr が付加する反応は、大きく分けて2種類の全く異なる反応様式がある。
そのひとつが、現在学習している(教科書の第6章で扱っている)反応である。はじめに H+ が付加し、カルボカチオンを経てから、求核試薬(Br-)が結合する反応である。この反応を「極性付加」と呼んでおこう。
もうひとつはラジカル反応で進行する。ラジカル開始剤と HBr の反応により生じた臭素ラジカルが二重結合に付加し、生じた有機ラジカル種が HBr から水素引き抜きをすることで進行する。全く異なる反応機構で進行し、位置選択性も、逆マルコフニコフ配向である。
水溶液などの極性溶媒中では、カルボカチオンなどのように電荷をもつ分子種が安定化を受けるため、極性付加が進行する。ラジカル機構でのHBrの付加を起こそうとすると、溶媒に無極性の溶媒を選択しないといけない。
6.41-6.50
6.41
炭素上の4つの置換基がすべて異なる場合(その炭素が「不斉炭素」である場合)に、立体異性体が存在する可能性がある。(詳細は、第4章であらためて学習する。)
(解答例)
a)
b)
c)
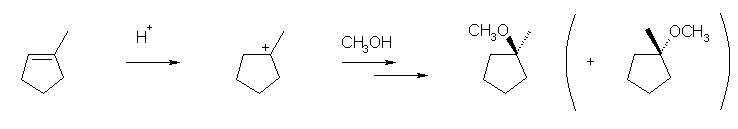
生成物は、立体異性体を持たない。(メトキシ基が結合した炭素の4つの置換基のうち、2つは同じ構造(シクロペンタン環を構成する鎖)であるため。上の2つの構造式が、面の上下をひっくり返すように回転させたときに、完全に重ね合わせることが可能な構造、すなわち、同一の構造であることを確認しておこう。)
d)
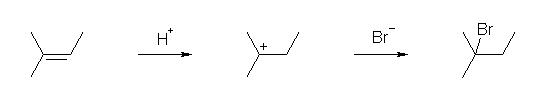
生成物は、立体異性体を持たない。臭素が結合した炭素上に、2つのエチル基があり、臭素がこの上にあろうと下にあろうと、ひっくり返すことで重ね合わせることができる。
6.42
(解答例)
6.43
(解答例)
6.44
接触水素化は、二重結合を形成する面の上または下から2つの水素原子がシン付加する。
(解答例)
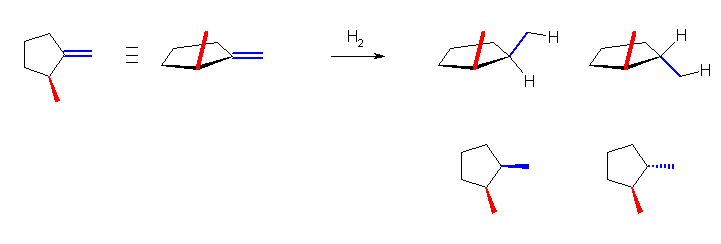
1-methylidene-2-methylcyclopentane を出発原料として用いて、接触水素化する時、H2が、1-メチリデン基の上、または下からシン付加する。水素が、2-メチル基の突き出している方と逆の方向からシン付加すると、cis-1,2-dimethylcyclopentane を与え、逆に、水素が 2-メチル基と同じ方向からシン付加すると、trans-1,2-dimethylcyclopentane を与える。(上図を参照。)
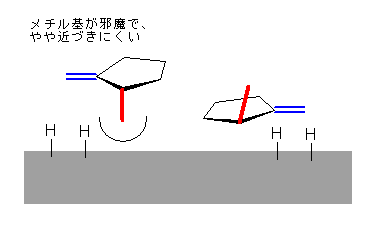
この反応は均一溶液中で生じるのではなく、教科書 p303 の図 6.6 に描かれているように、固体(パラジウムや白金)の表面に結合した水素原子を、二重結合の部分が吸い上げるようにして反応する。つまり、1-メチリデン基の面の上下のうち、固体の表面に近づける方向から水素がシン付加する。この際、2-メチル基が突き出している側は、メチル基がかさ高いため、そうでない側に比べて、パラジウムや白金の表面に近づきにくくなっていると予想される。したがって、cis-1,2-dimethylcyclopentane の方が、trans-体よりも多く生じると予想される。
6.45
アルケンの幾何配置を保存したままエポキシド(オキシラン環)を形成する。なので、アルケンのシス配置の置換基は、オキシラン環の面に対し同じ方向(シス配置)となり、アルケンのトランス配置の置換基は、オキシラン環の面の逆方向(トランス配置)となる。
有機過酸の反応は、形式的には HO+ の反応と考えてよい。(臭素 Br2 の反応で、形式的には Br+ の反応で、環状ブロモニウムイオンを形成するのと同じである。)
b) アルケンの対称性が低い場合、アルケンの二重結合が作る面に対し、上から反応した場合と、下から反応した場合に、空間内の回転や平行移動では重ね合わせることのできない、右手と左手の関係(鏡面対称)なペアとなる。
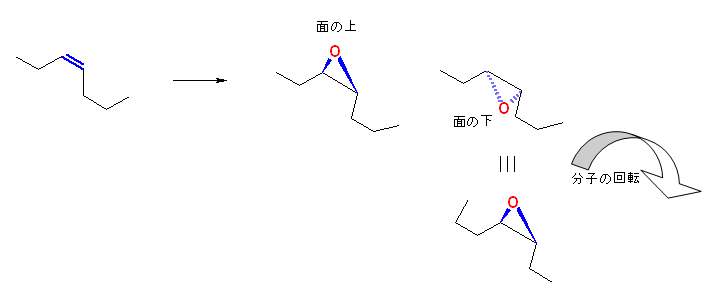
(解答例)
エポキシドを形成する際、反応は二重結合炭素が形成している平面に対し、酸素の結合する方向として、「面の上」「面の下」で同じ確率で生じる。この結果生じる2つ生成物は、右手と左手の関係(鏡面対称)なペアとなる。
(E)-hept-3-ene から生じる2つのエポキシドを立体的に表示した例を図示する。
この2つが、重ね合わせることのできない関係であることを図より確認してください。
教科書に与えられた構造は、いずれも次図において二重結合の作る面を紙面とし、これに対し「面の上」(紙面手前側)に酸素が結合してオキシラン環が生じたものである。
1) (E)-hept-3-ene より、目的のエポキシドが合成できる。
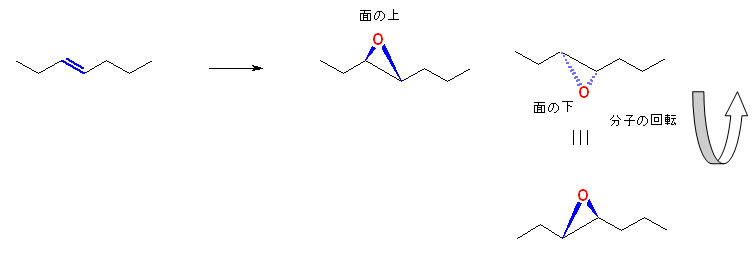
2) (Z)-hept-3-ene より、目的のエポキシドが合成できる。
6.46
反応機構の詳細は、6.19などを参照すること。
ヒドロホウ素化反応では、位置選択性が逆マルコフニコフ配向、立体選択性はシン付加である。
(解答例)
a)
得られるシクロヘキサノールは、立体異性体を持たない。
2位に結合した新しく結合した水素は、もとから結合していた水素と区別がつかない。また、1位の炭素(水酸基が結合した炭素)上の4つの置換基は、2つが同じである(シクロヘキサン環を構成する鎖の部分)。
もし、H-BR2 の代わりに、重水素置換された D-BR2 を用いた場合は、生成物の構造上、2位と6位が同等ではなくなるので、立体異性体を生じるようになる。
b)
c)
HとOHがシン付加したとき、3位炭素上に新しく結合した水素と、もとから結合した水素とは区別できないので、この生成物からは立体選択的に反応が進行しているかどうかを区別できない(シン付加でも、アンチ付加でも同じ生成物を与える)のだが、水酸基の結合した炭素上の4つの置換基は、すべて種類が異なる(水酸基、水素、メチル、エチル)ため、立体異性体をもつ。
d)
生成物の構造上、3位(水酸基の結合位置)も、4位(あらたに水素が結合した位置)も、いずれも、その炭素上で4つの置換基の種類がすべて異なっており(すなわち、「不斉炭素」である)、そのそれぞれについて2通りの立体異性体の組み合わせが考えられるから、4-methylhexan-3-ol には、2×2=4通りの立体異性体が存在する。そのうち、3,4-dimethylhex-3-ene の (Z)- 体を出発物質とした場合には、上図の2つのみが得られる。(E)- 体を出発物質とした場合に得られる2つの立体異性体とは別のものとなっている。
この問いの範疇外ではあるが、次の生成物を上の式と比較してみるとよい。(下図では、上と比較しやすいよう、エチル基の向きをそろえるため、3-4位間の単結合に沿って180度回転させて示している。)
6.47
(解答例)
6.48
(解答例)
6.49
(解答例)
6.50
(解答例)
6.51-6.60
6.51
環状ブロモニウムイオンに対し、臭化物イオン Br- と競合して水が求核試薬として働くことを考える。
(解答例)
a) trans-2-bromocyclohexanol を生じる。
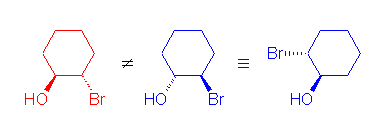
一応、鏡像異性体のペアがあり、等量ずつ生じる。(次の反応機構のところで、水が求核攻撃するとき、環状ブロモニウムイオンを形成している炭素のどちらに対しても同じ確率で攻撃しうるからである。)(2年生の学習範囲では、4章を跳ばしているので、鏡像異性体の扱いは、定期試験では問わない。)
b)
6.52
(解答例)
6.53
環状ブロモニウムイオンは、2つの炭素の級数が異なるので、塩化物イオンによる求核攻撃を位置選択的に受ける。
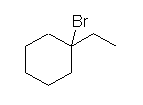
(解答例)
1-bromo-2-chloropropane を生じる。
b) 1-bromo-2-chloropropane ( CH3-CH(CH3)Cl-CH2Br ) は、2位炭素上の4つの置換基がすべて異なる(メチル基、水素、塩素、ブロモメチル基)ので、この炭素を不斉中心として鏡像異性体が存在する。塩化物イオンは、環状ブロモニウムイオンの環の逆側からしか攻撃できないが、環状ブロモニウムイオンを生じる過程において、臭素が二重結合炭素が作る面の上下を区別せずに反応するので、結局、どちらかの鏡像異性体のみが優先して生じるということはなく、等量ずつ生じることになる。
6.54
(解答例)
6.55
(解答例)
6.56
(解答例)
6.57
(解答例)
6.58
(解答例)
6.59
位置選択性に注意せよ。(マルコフニコフ則に従う。)
c), d) については、カルボカチオンの骨格転位を考えなくてはならない。
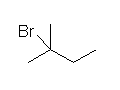
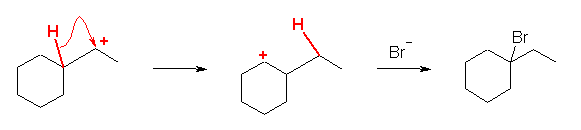
(解答例)
a) 1-bromo-1-ethylcyclohexane
(主生成物は、第3級のカルボカチオンを経由して生じる。逆の位置選択性の 1-bromo-2-ethylcyclohexane が生じるために必要なカルボカチオンは、第2級であるため、主生成物にはならない。)
b) 2-bromo-2-methylbutane
c) 1-bromo-1-ethylcyclohexane
d) 3-bromo-2,3-dimethylpentane
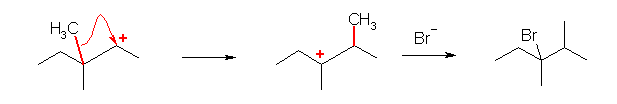
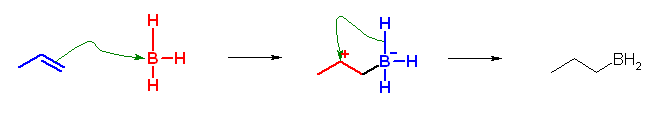
6.60
求核剤(求核試薬):正電荷に対して反応するもの。それ自身が負電荷をもつか、または中性であってもルイス塩基(孤立電子供与体)として働き得る孤立電子対(多くの場合、酸素や窒素上の孤立電子対)を持つ。ここでは、カルボカチオンに結合していく分子やイオン。
求電子剤(求電子試薬):負電荷に対して反応するもの。ルイス酸であるもの。それ自身が正電荷をもつ場合も多いが、場合により、電気的に中性であっても、アルミニウムやホウ素など3本の共有結合を持ち、最外殻電子が6個しかないようなものも求電子剤として働く。
(解答例)
求核的に働く部分を青、求電子的に働く部分を赤で示した。
a)
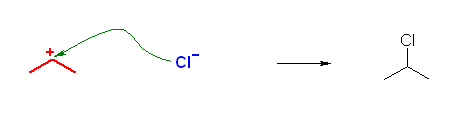
b)

c) わかりやすくするために、2段階にわけて書いた。実際には次のように分子内にイオン対を持つような中間体を経由するのではなく、この2つの反応が同時進行で協奏的に進行すると考えられている。(あとで学ぶが、そのため、BH3 の付加反応では、位置選択的であるばかりではなく、立体選択的でもある。)
6.61-6.70
6.61
復習的な問題ですな。位置選択性、立体選択性に注意すること。 答えは、構造で示してもよい。
(解答例)
a) 2-bromo-2-methylbutane
マルコフニコフ配向に従い、位置選択的に反応が進行する。(3級の炭素に、より陰性な臭素が結合する。)
カルボカチオンを経由するため、立体選択的ではない。
b) 2-iodo-2-methylbutane
a) と同じ反応である。
c) 2,3-dichloro-2-methylbutane
環状クロロニウムイオンに対し、塩化物イオンが第3級炭素に求核攻撃する。位置選択的な反応ではあるが、2位、3位ともに塩素が結合するため、生成物の構造から位置選択的であるかどうかを判断することはできない。また、塩化物イオンは環状クロロニウムイオンの環の下側からのみ反応が生じ、アンチ付加となる。しかしながら、C2-C3 の単結合の自由回転により、生成物の構造からアンチ付加であるかどうかを判断することはできない。
d) prppan-2-one と ethanal
e) 2-methylbutane
接触水素化は、立体選択的にシン付加で進行する。しかし、生成物の構造からは、これを判断することはできない。
f) 2,2,3-trimethyloxirane
エポキシドは、オキシラン環(C,C,O の三員環)を基準にして命名できる。酸素が1位なので、メチル基は、2、2、3位に結合している。
g) 2-methylbutan-2-ol
硫酸による酸触媒で、カルボカチオン中間体を経て、そこに水が求核攻撃する。マルコフニコフ配向に従い、位置選択的に反応が進行するが、立体選択性はない。
h) 2,3-dibromo-2-methylbutane
c) と同様である。
i) 3-bromo-2-methylbutan-2-ol
環状ブロモニウムイオンに対し、その3級炭素側に、位置選択的に水が求核攻撃することによる。臭素に対し、水の付加位置は、アンチの立体選択性となるが、この生成物の構造からは、立体選択的であったかどうかの判断はできない。
j) 3-bromo-2-methoxy-2-methyl-butane
i) と同様である。水の代わりにメタノールが求核攻撃するので、アルコールの代わりにメチルエーテルが生じている。(命名上、エーテルを主官能基とすることはない。側鎖置換基としてメトキシ基となる。)
k) 3-methylbutan-2-ol
ヒドロホウ素化反応では、逆マルコフニコフ配向となる。(より級数の小さい側に、水酸基が結合し、g) とは逆の位置選択性でアルコールが得られる。)この反応は、立体選択的にシン付加で進行するが、この生成物の構造から立体選択性を判断することはできない。
6.62
(解答例)
6.63
構造を書き、二重結合炭素上のアルキル基の数を数えよ。
問 6.36 〜 38 などを参照すること。
(解答例)
a),c) 2,3-dimethylhex-2-ene が二重結合炭素上のアルキル基が4つで、この選択肢の中では最も安定である。そのため、水素化熱(水素化反応の反応エンタルピー変化、負の値、の絶対値)が最も小さい。
b) 4,5-dimethylhex-2-ene は、二重結合炭素上のアルキル基が2つで、この選択肢の中では最も不安定である。そのため、水素化熱が最も大きい。
6.64
すでに学習した反応の位置選択性を確認すること。
(解答例)
3-methylbut-1-ene を出発物質として、
a) 3-methylbutan-1-ol を得るためには、位置選択性が「逆マルコフニコフ配向」で水を付加させる必要がある。(生成物において、水酸基が、より級数の小さい側の炭素の結合している。) そのような反応としてヒドロホウ素化−酸化反応を利用できる。
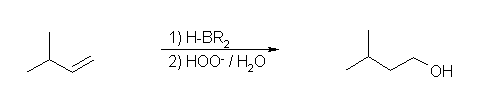
b) 2-methylbutan-2-ol は、二重結合炭素のどちらでもない位置に水酸基が結合しており、第3級のアルコールである。これは、前駆体であるカルボカチオン中間体が、転位により生じていることを示唆する。
3-methylbut-1-ene に H+ を付加させて生じた第2級のカルボカチオンは、ヒドリドの1,2-シフト(隣接位への転位)により、より安定な第3級のカルボカチオンを生じ、つづいて水が求核付加する。得られたプロトン化アルコールより、脱プロトンして、2-methylbutan-2-ol が得られる。従って、反応条件とすると、硫酸酸性の水溶液による水和反応を行えばよい。
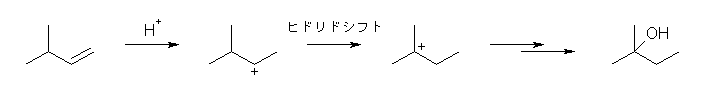
c) なお、教科書では扱っていないが、カルボカチオンの骨格転位を生じることなく「マルコフニコフ配向」で水和によるアルコールを得るためには、オキシ水銀化法を用いることができる。
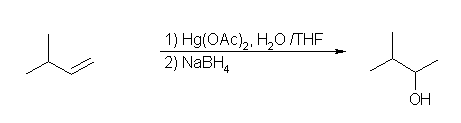
6.65
(解答例)
6.66
(解答例)
6.67
まず、反応物および生成物の構造を書いてみるとよい。
6.64 なども参照せよ。
(解答例)
はじめに生じた第2級のカルボカチオンが、一部、第3級への転位(ヒドリドの1,2-シフト)を起こしてから、臭化物イオンが求核付加しているため。
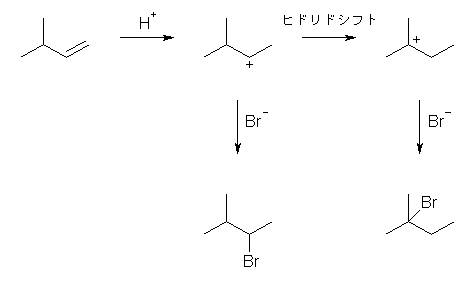
※ はじめに生じた第2級のカルボカチオンが、すぐに求核攻撃を受けるのか、骨格転位をしてから求核攻撃を受けるのかは、2つの反応の相対的な速さによって決まる。つまり、反応の種類や条件によって変化し、一概にかならずどちらかであるといえるようなものではない。もし、求核試薬の攻撃が速い(求核種の濃度が高い、求核種の反応性が高い、などの要因による)場合には、カルボカチオンが転位する前に生成物を与えてしまう。相対的に反応性が低く、従って相対的に求核試薬の付加が遅い場合には、ほとんどが転位生成物を与えることになる。
6.68
(解答例)
6.69
5章の曲がった矢印の書き方を復習してください。
(解答例)
a)
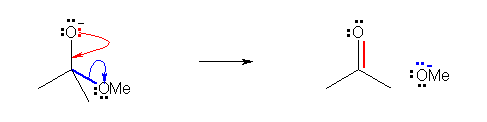
b)
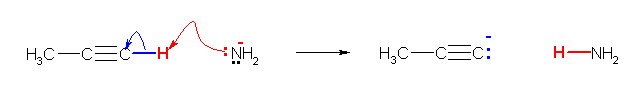
c)
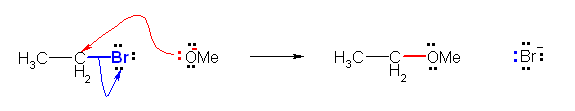
6.70
これも復習的な問題です。たとえば教科書 p331 の【反応のまとめ】を参考にすると効率がよいかもしれません。
(解答例)
時計の12時の位置から右廻りに。
Br2/CH2Cl2
環状ブロモニウムイオンを経由する、臭素化。水やアルコールは溶媒として用いることができない。また、ベンゼンやヘキサンなど極性が低い溶媒も不適切である。
H2/Pd-C
接触水素化
HBr
明示していないが、臭化水素の濃度が高ければ水溶液中で行ってもよい。カルボカチオンを経由する。
mCPBA などの有機過酸
mCPBA は、メタクロロ過安息香酸 m-chloroperbenzoic acid の頭文字。
1) O3, -78℃、2) (CH3)2S
オゾン開裂。
低濃度の Br2/H2O
β-ハロヒドリン。環状ブロモニウムイオンに、水が求核攻撃して生じる。水は級数の高い方の炭素にのみ攻撃する。
CH3OH, 触媒として H2SO4
カルボカチオンを経由し、アルコールがカルボカチオンに付加していく。
H2O、触媒として H2SO4
1) BH3/THF, 2) H2O2, OH-
逆マルコフニコフ配向でのアルコールは、ヒドロホウ素化反応によって得ることができる。BH3 と書く代わりに 9-BBN でもよい。
6.71-6.80
6.71
(解答例)
6.72
(解答例)
6.73
まず目的物の構造を書いてみてから考えよ。
(解答例)
a) methylidenecyclohexane と 1-methylcyclohexene は、H+ の付加により共通の第3級カルボカチオンを生じる。(より級数が小さく、不安定なカルボカチオンは生じない。)この第3級のカルボカチオンに臭化物イオンが求核付加すると、1-bromo-1-methylcyclohexane を与える。
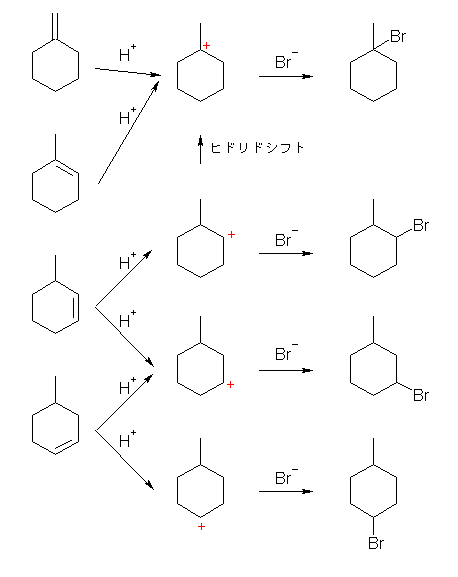
3-methylcyclohexene は、2種類の第2級のカルボカチオンを生じるが、そのうちの一方は、メチル基の根元の水素がヒドリドとして転位することで、第3級のカルボカチオンを与え、同じ 1-bromo-1-methylcyclohexane を与える。転位せずに付加生成物を与えて 1-bromo-2-methylcyclohexane も(おそらく僅かながら)得られる可能性がある。また、もう一方のカルボカチオンは転位せず、1-bromo-3-methylcyclohexane をそのまま与える。(はじめに生じる第2級のカルボカチオンは、同じ安定性であるため、同じ量を生じるので、3種類の混合物となる場合、1-bromo-3-methylcyclohexane が全体の50%、残り50%は、転位の割合により1-bromo-2-methyl体と、1-bromo-1-methyl体とになる。)
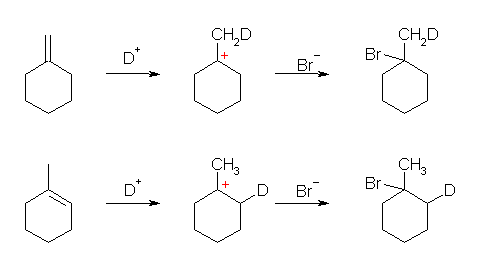
b) 重水素イオン(D+)の結合位置が異なるため、生成物は区別される。
6.74
d) 〜 f):アルケンの相対的安定性は、2つの二重結合炭素上にアルキル基が多く置換した方が安定である。これは、π 電子が、アルキル基の超共役効果により「共役が広がる」効果があるからである。(孤立した二重結合が2つあるよりも、buta-1,3-diene のように共役したほうが安定であるのと同じ理屈となる。)
(解答例)
a) 左(第3級のカルボカチオン)の方が、右(第2級のカルボカチオン)より安定である。
b) 左の方が安定。いずれも第2級のカルボカチオンである。しかし右の方には、電子求引性の塩素が結合しているため、カチオンを不安定化させる効果がある。
c) 右(第3級のカルボカチオン)の方が、左(第2級のカルボカチオン)より安定である。
d) 左は、二重結合炭素上のアルキル基の数が1、右は2であるから、右の方がより安定である。
e) 左は、二重結合炭素上のアルキル基の数が3、右は2であるから、左の方がより安定である。
f) 左は、二重結合炭素上のアルキル基の数が2、右は3であるから、右の方がより安定である。
6.75
(解答例)
6.76
反応速度定数とは、反応の種類や温度により決まる定数。反応の速さは基質の濃度(の n 乗)に比例する。このときの比例定数である。
同じ反応速度定数を持っていても、基質の濃度が低ければ遅く、基質の濃度が高ければ速い反応となる。
反応速度定数の大小を、そのまま反応の速さの大小として議論してよい。
a) 「相対速度」とは、任意の反応の速度定数を1としたときの相対値である。つまり、自分で基準として定めたい反応を選び、その反応速度定数で割ればよい。
b)〜c) 反応の速さが速いための条件の一つに、活性化エネルギーが小さいことが挙げられる。活性化エネルギーとは、反応物(出発物)のエネルギーから、遷移状態までのエネルギーである。中間体がより安定である場合には、それに伴い、遷移状態のエネルギーも安定となる場合が多い。したがって、一般的な結論として「より安定な中間体を経由する反応は、不安定な中間体を経由する反応と比較して、速く進行する」といえる。(ただし、反応の種類が大きく異なるもの同士では比較することができない場合がある。)
d) 活性化エネルギーの大小では説明できない例である。(2年生のレベルで、この問いを自力で解ける必要はないが、解説を読んでおいてください。)
(解答例)
a) どれを基準として1に選んでもよい。ここでは、最も構造の単純な propene の反応速度を1とした場合と、この表中で最も小さな値をもつ (E)-but-2-ene の反応速度を1とした場合とをそれぞれ示しておく。
| substrate | propene | (Z)-but-2-ene | (E)-but-2-ene | 2-methylbut-2-ene | 2,3-dimethylbut-2-ene |
| rate constant (k) | 4.95 e-8 | 8.32 e-8 | 3.51 e-8 | 2.15 e-4 | 3.42 e-4 |
| krelative | 1.00 | 1.68 | 0.709 | 4340 | 6910 |
| krelative | 1.41 | 2.37 | 1.00 | 6130 | 9740 |
以上の表から読み取れるべき最も大事な点は「数値の桁の違い」である。つまり、propene, (E)- および (Z)- のbut-2-ene の3種類は、ほぼ同じ速度で反応するのに対し、2-methylbut-2-ene と 2,3-dimethylbut-2-ene は数千倍以上速く反応するということである。
b) もとの二重結合炭素の一方に水素が結合して sp3 混成となっているため、二重結合の幾何配置の情報が失われてしまうため、(E)- および (Z)- のbut-2-ene のいずれを反応物(出発物)としても、生じる中間体の構造は共通である。
にも関わらず、反応の速さに差がある(活性化エネルギーの大きさに差がある)のは、もともとの構造に、安定性に差があるからである。(Z)-体では、2つのメチル基(but-2-ene の1位、4位)が重なり形の配座となっているため、二重結合に結合したアルキル基の数が同じであるにも関わらず、(E)-体よりもやや不安定である。そのため、遷移状態までのエネルギー(活性化エネルギー)がやや小さくてすむ。(もともと高いところにいるため、更に高いところに上がるために、小さなエネルギーですむ。)このため、(E)-体と比べて(Z)-体の方が大きな反応速度定数を示す。
c) propene, (E)- および (Z)- のbut-2-ene の3種類からは、中間体として生じるカルボカチオンが第2級であるのに対し、2-methylbut-2-ene と 2,3-dimethylbut-2-ene からは、中間体として生じるカルボかチオンが第3級で、より安定である。この違いにより、反応は数千倍以上速くなる。
d) 3置換体である 2-methyulbut-2-ene より、4置換体である 2,3-dimethylbut-2-ene の方がやや安定である。また、カルボカチオンはいずれも第3級で、そのエネルギーの差はあまりないと考えられる。つまり、活性化エネルギーのみを考えると、3置換体である 2-methyulbut-2-ene の方が速く反応するはずである。
さて、この反応では、律速段階は、中間体のカルボカチオンを形成する過程であった。反応基質であるアルケンが H+ と衝突してカルボカチオンを形成する際、安定な第3級のカルボカチオンを形成できるのは、 2-methyulbut-2-ene では一方の二重結合炭素が水素を受け取ったときに限られるのに対し、 2,3-dimethylbut-2-ene では、二重結合炭素のどちらが水素を受け取ってもよい。そのため、H+ とアルケンとの間の有効な衝突の回数は、2,3-dimethylbut-2-ene では 2-methyulbut-2-ene に対し、2倍あるということになる。このため、反応速度が2倍(弱)程度に大きい。
6.77
(解答例)
6.78
(解答例)
6.79
(解答例)
6.80
6.15 を参照のこと
(解答例)
a) 次の3段階で反応は進行する。
1) アルケンへの H+ の付加によるカルボカチオンの生成。アルケンが求核種、プロトン(硫酸の酸解離により生じた)が求電子種である。
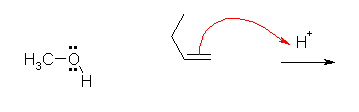
2) アルコールが求核種として働き、カルボカチオンに付加する。
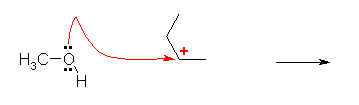
3) 生じたプロトン化エーテルより、H+ が脱離し、最終生成物であるエーテルを与える。
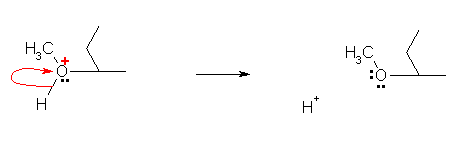
b) 律速段階は、アルケンにプロトンが付加してカルボカチオン中間体を生じる過程である。
c), d) 第1段階目では、求核種はアルケン、求電子種はプロトンである。
e), f) 第2段階目では、求核種はアルコール、求電子種はカルボカチオンである。
6.81-6.90
6.81
no hint
(解答例)
a) 1-bromo-1-ethylcyclohexane
位置選択性:マルコフニコフ配向。
立体選択性:なし。カルボカチオンを経由するため。
b) 1-ethylcyclohexane
位置選択性:二重結合炭素2つに同じく水素が結合するので、位置選択性はない。
立体選択性:シン付加。H/2 の代わりに、重水素 D/2 を付加させた場合などは、生成物においてもシン付加であることを区別できる。
c) trans-2-ethylcyclophexanol
位置選択性:逆マルコフニコフ配向。
立体選択性:シン付加。エチル基の根元に結合する水素と水酸基がシクロヘキサン環の同じ方向。つまり、エチル基と水酸基はトランスの位置関係の生成物のみ得られる。
d) 1,2-dibromo-1-ethylcyclohexane (2つの臭素がトランスの位置関係の異性体のみ。)
位置選択性:二重結合炭素2に同じく臭素が結合するので、位置選択性はない。
立体選択性:環状ブロモニウムイオンを経由するので、2つの臭素はアンチ付加となる。
6.82
(解答例)
6.83
(解答例)
6.84
特に、b) は、生成物の構造から遡って考えてみること。5章の曲がった矢印の書き方の練習の中に、ここでおきていることと同様の反応例がある。
(解答例)
a) 次の3段階で反応が進行する。
1) アルケンへのプロトンの付加(カルボカチオン中間体の生成)
2) カルボカチオン中間体に対する水の求核付加(プロトン化アルコールの生成)
3) プロトン化アルコールからのプロトンの脱離
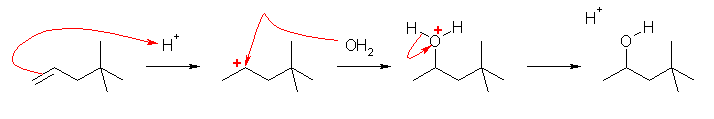
b) 生成物の構造が、出発物と比較して炭素の並びが変わっている。これは、骨格の転位が起きていることを示す。
次の段階で反応が進行する。
1) アルケンへのプロトンの付加(カルボカチオン中間体の生成)
2) カルボカチオンの骨格転位(第2級のカルボカチオンが、より安定な第3級のカルボカチオンに骨格転位する)
より具体的には、この反応では、カチオン炭素に隣接するメチル基が σ 電子対(結合電子対)ごと隣に移動している。
3) 転位により生じた第3級のカルボカチオンに、塩化物イオンが求核付加する。
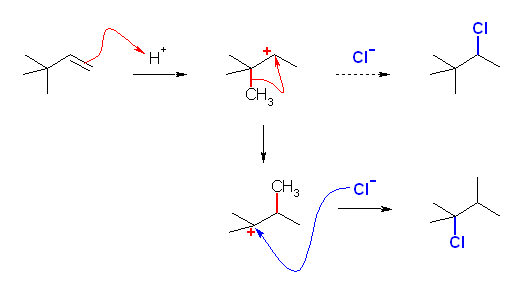
6.85
環状ブロモニウムイオンに対し、分子内の水酸基が求核攻撃して環を形成する。問6.26 などを参照すること。
(解答例)
a) 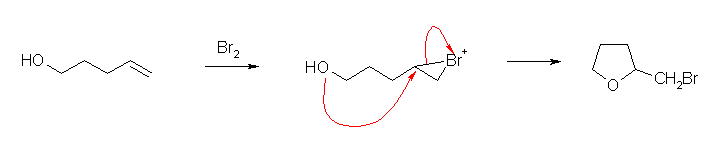
b) 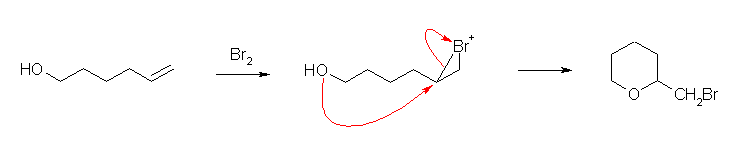
6.86
(解答例)
6.87
6.76 を参照してください。
アルケンの安定性を考える必要があります。
(解答例)
a) but-1-ene → 2-chlorobutane
(1-chlorobutane を生じるためには、より不安定な第1級のカルボカチオンを生じなければならない。)
but-2-ene → 2-chlorobutane
(but-2-ene の2位、3位のいずれでカルボカチオンを生じても、結果として得られる生成物の構造は同一である。命名上、3-chlorobutane は間違いで、2-chlorobutane としなければならない。)
b) いずれを出発とした場合も、中間体として生じるのは、共通の第2級カルボカチオンである sec-ブチルカチオンである。(but-1-ene からは、第1級のカルボカチオンも考えられるが、より安定な第2級のカルボカチオンを経由する反応が、実際に進行する反応である。)そのため、活性化エネルギーの大小は、反応物(出発物)の安定性で決まる。アルケンは、1置換体よりも2置換体の方が安定であるから、出発物の相対的なエネルギーでは、but-1-ene よりも but-2-ene の方が低い。そのため、but-2-ene からの反応の方が活性化エネルギーがやや高い。
c) but-2-ene の(Z)-体、(E)-体のいずれを出発とした場合も、中間体の構造は共通である。b) と同様の議論により、より安定な反応物(出発物)を用いた場合の方が、活性化エネルギーは高くなり、従って、反応は遅くなる。but-2-ene の(Z)-体と(E)-体を比較すると、(Z)-体の方が、2つのメチル基が重なり形配座をとっていることにより、やや不安定である。そのため、(Z)-体の方が小さな活性化エネルギーを持つので、HCl とより速く反応する。
6.88
はじめに生じたカルボカチオンは、骨格転位により、より安定な(級数の大きい)カルボカチオンとなることがある。骨格の転位は、転位によってカルボカチオンがより安定になる場合におきる。また、カルボカチオに対する求核種の付加反応との競争となるため、より弱い求核種を用いている場合に顕著になる傾向にある。ここでは、b) 〜 d) については骨格転位(メチル基や水素(ヒドリド)の移動)を考えて答えを書いてください。
(解答例)
a) 2-bromopentane と 3-bromopentane のほぼ等量の混合物。(いずれも、安定性にほとんど差のない、第2級のカルボカチオンを経由して生じる。)
b) 3-bromo-3-methylhexane
はじめに生じた第2級のカルボカチオンに、そのまま臭化物イオンが求核付加すると、 2-bromo-3-methylhexane を生じるところであるが、隣接の 3 位炭素上の水素が σ 結合電子対ごと(すなわち、ヒドリド H:- として)移動して、第3級のカルボカチオンを生じるため。
c) 3-bromo-2,3-dimethylhexane
はじめに生じた第2級のカルボカチオンに、そのまま臭化物イオンが求核付加すると、2-bromo-3,3-dimethylhexane を生じるところであるが、隣接の 3 位炭素上のメチル基が σ 結合電子対ごと移動して、第3級のカルボカチオンを生じるため。
d) 1-bromo-1-ethylcyclopentane
はじめに生じた第2級のカルボカチオンに、そのまま臭化物イオンが求核付加すると、(1-bromoethyl)cyclopentane が生じるところであるが、隣接のシクロペンタン環炭素上の水素がヒドリドとして移動することにより、第3級カルボカチオンを生じるため。
※ 転位の反応機構については、6.59(c)-(d), 6.84(b) などを参照してください。
6.89
問 6.29 〜 32 などを参照すること。パターンで考えてダイジョウブです。
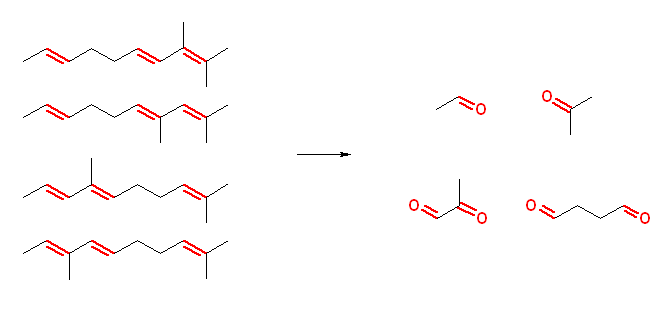
(解答例)
a) 7-oxooctanal
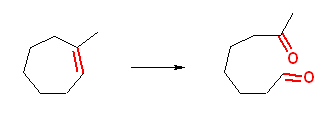
b) 2-methylheptanedial
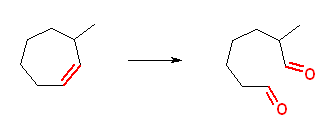
c) 2-oxoheptanedial + methanal
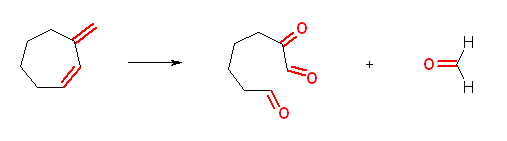
d) propanedial + 2-oxobutanedial + methanal
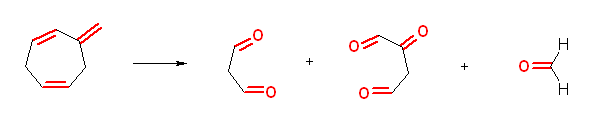
e) ethanedial + 3-oxopentanedial + methanal
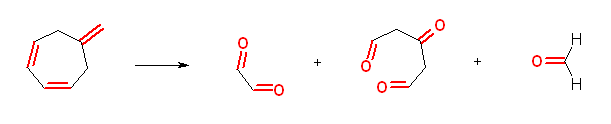
6.90
(解答例)
6.91-6.100
6.91
(解答例)
6.92
(解答例)
6.93
(解答例)
6.94
ジアゾメタンは、問題文にも示されているように、共鳴形のひとつが、 :CH2--N2+ で表される。C-N 結合の電子対を窒素が受け取るようにして中性分子である N2 が脱離すると、カルベン :CH2 を生じる。(実際にカルベンを単独で単離して用いることは難しいので、ジアゾメタンをカルベンを与えるもの、または、カルベンと反応形式上同等に働くものとして扱う。)
このカルベンは、最外殻電子が6個(孤立電子対1対、C-H 結合2本なので共有電子対2対)で、オクテットを満たしていないため、ルイス酸として働き、求核攻撃を受けることができる。また、孤立電子対をもつので求核攻撃をすることもできる。
これは、HO+ や Br+ と同じである。そのため、反応の形式も同じで、このシクロプロパン環の形成の反応機構は、アルケンと有機過酸によるエポキシドの形成、アルケンと臭素 Br2 の反応による環状ブロモニウムイオンの形成と同じである。
(解答例)
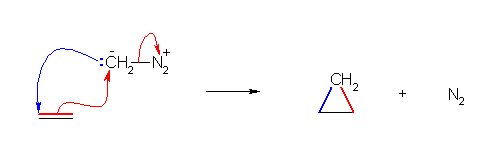
アルケンの π 電子が、オクテットを満たしていないジアゾメタンの炭素(ヒントにも示したようにルイス酸として働く)に求核攻撃すると同時に(協奏的に)中性分子である N2 が脱離する※。また、このとき同時に(協奏的に)炭素上の孤立電子対が、アルケンの炭素に求核的に攻撃する。(もし、H+ この協奏過程を考えなければ、CH2+-CH2-CH2- を形成してしまうことになり、不自然であることがわかると思う。)
反応性の低い中性の窒素分子 N2 は、ほとんど塩基性も、求核性も持たない。そのため、脱離基としては、ほぼ最も強力なものである。
6.95
(解答例)
6.96
ジクロロカルベンが持つ炭素上の孤立電子対は、クロロホルムの C-H 結合が、塩基よりプロトンを奪われたあとに残す結合電子対(だったもの)である。このようにして生じるクロロホルムの共役塩基 CCl3- が塩化物イオンを失うと、ジクロロカルベンとなる。
(解答例)
つぎの2つの反応機構の共通点に着目してよく比較してみること。
a) 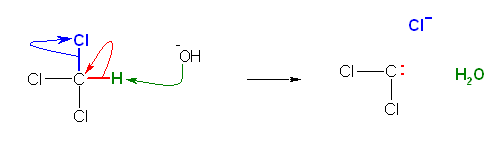
b) 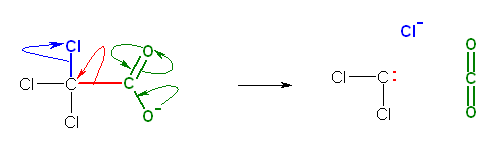
この脱炭酸(二酸化炭素 CO2 が脱離する反応)は、クロロホルムからプロトンが引き抜かれる反応と同じであるとみなすことができる。
6.97
6.94 ジアゾメタンとの反応(ジアゾメタンは、カルベン CH2 の等価体としてはたらく)と同じように考えればよい。
(解答例)
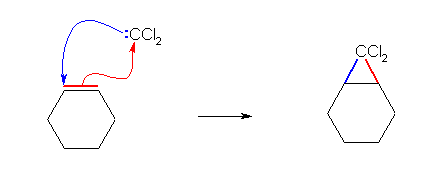
6.98
カルボニル基の部分で二重結合になるようにもとの分子を考えればよい。
(解答例)
もっとも単純な例のみ示す。(1つの環状アルケンが開裂して1分子を与えている例を示す。他には、環状ジエンが2箇所で開裂して同一の形状の分子を与える可能性もあり得る。また、環状トリエンが3箇所で、以下同文。)
a) 
b) 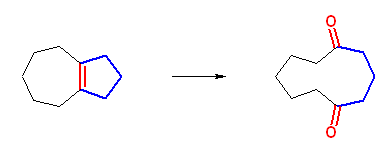
c) 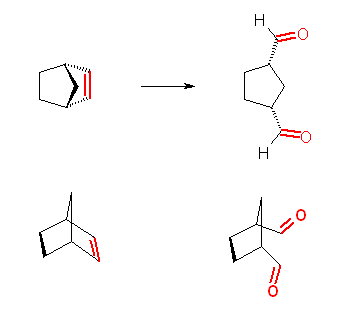
6.99
no hint
(解答例)
○ 酸触媒によりカルボカチオンを経由する反応
HBr
H2O, H2SO4
○ ヒドロホウ素化反応
1) BH3/THF, 2) HOO-
○ 環状ブロモニウムイオンを経由する反応
Br2/CH2Cl2 (溶媒は反応に関与しない)
Br2/H2O (溶媒が求核種として働く)
Br2/CH3OH (溶媒が求核種として働く)
○ 接触水素化
6.100
炭素の並びが変化しているのだから、「カルボカチオンの転位」で説明できるどうかを、まず考えてみること。
(解答例)
まず、(1-methylethenyl)cyclobutane (※)の二重結合に H+ が付加してカルボカチオンを生じるところは、特に問題なく、次の式を書けるだろう。
最終生成物の構造から、その対応する前駆体のカルボカチオンの構造も、特に問題なく、次のように書けるはずだ。
では、このカルボカチオンの構造の間を、転位反応で合理的につなぐことができればよいことになる。
はじめの転位は、級数のみに注目すると、第3級のカルボカチオンから第2級のカルボカチオンを生じている。しかしながら、この反応では、シクロブタン環のひずみが大きいため、これが開くことによりひずみが解消されて安定となるため、はじめの第3級カルボカチオンよりも、転位により生じる第2級のカルボカチオンの方が安定である。このために転位が生じている。更に、シクロペンタン環上のメチル基が転位することで、第2級のカルボカチオンが、更に安定な第3級となることができるため、2度目の転位も引きつづき生じると考えられる。
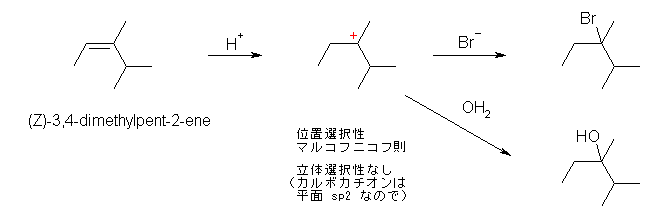
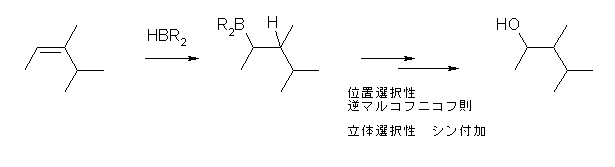
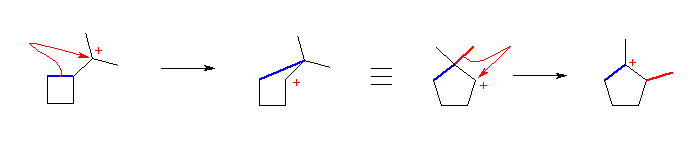
※ 2013勧告以前の規則では、多重結合を持つ部分が優先したため、2-cyclobutylprop-2-ene と命名していた。現行の規則では、環の方が鎖に優先するので、母体はシクロブタンである。
6.101-6.107
6.101
酸触媒によるアルケンの水和反応(水の付加反応)は、カルボカチオンを中間体として経由する。そのため、より安定なカルボカチオンを経由するほうが、より速い。
(解答例)
いずれも、酸触媒により第3級のカルボカチオンを与える。一方は、電子求引性基である塩素を置換基としてもつ。これにより、カルボカチオンが不安定化される。そのため、塩素を持たない、2-methylpropene の方が速く水和されると考えられる。
6.102
2年生の段階では、初見、自力で解けなくても構いません。解等例の解説を読んで理解してください。
(解答例)
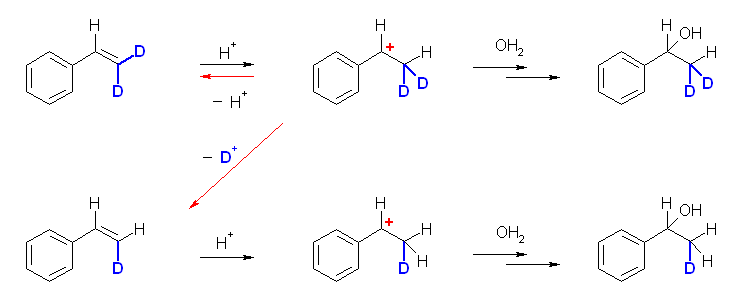
回収された未反応のアルケンに、重水素がすべて残っていた( D が H に置き換えられるような反応が起きていなかった)ということは、上の反応式の赤矢印で書いたような反応、つまり、アルケンへのプロトンの付加の逆反応で、カルボカチオンからアルケンを生じる反応が起きていなかったということを示す。
カルボカチオンは、プロトンを脱離してアルケンに戻るか、求核試薬が付加して生成物を与えるかの2つの反応が競争するはずであるが、そのうち後者しか生じていないということは、プロトンの脱離によりアルケンを再生する過程は、カルボカチオンに対する水の付加反応と比較して、相対的に十分に遅いということがわかる。
6.103
(解答例)
6.104
(解答例)
6.105
6.100 も参考にすること。
シクロペンタンも、歪みはさほど大きくないが、シクロアルカンでは、6員環(シクロヘキサン)がもっとも歪みが小さい。
(解答例)
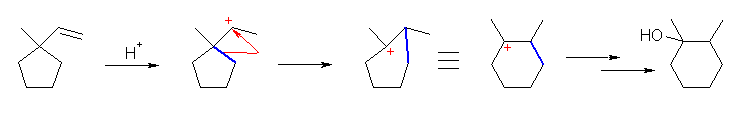
1-ethenyl-1-methylcyclopentane にプロトンが付加して、第2級のカルボカチオンを生じると、シクロペンタン環を構成しているアルキル基がそのカルボカチオン炭素上に転位する。これにより、環の歪みが小さくなるほか、級数も第3級となる。このため、転位後のカルボカチオンの方が安定である。水が求核的に付加して、得られたプロトン化アルコールより、脱プロトン化することで最終生成物の 1,2-dimethylcyclohexanol が得られる。
6.106
(解答例)
6.107
(解答例)