5.01-5.10
5.01
指針1) 問題文に与えられた条件より、不飽和度を判断し、不飽和度に応じて、アルカンの一般式 CnH2n+2 より、水素の数を2ずつ減らせばよい。
指針2) 一般的に、不飽和結合の位置、枝分かれの有無やその位置だけでは、炭素の数に対して水素の数は変化しない。なので、問題文の条件にある構造式をひとつ書いてみて、その分子式を書いてもよい。
なお、 π結合が1つあるということは、単結合が二重結合になっていることを示す。
単結合を二重結合にする際には、隣接した炭素からそれぞれ C-H 結合を切り、空いた手同士で π 結合を作らせるため、同じ炭素の数に対し、二重結合が1つ増えるごとに、水素の数が2つずつ減る。
エタン CH3-CH3
↓
エテン CH2=CH2
また、隣接していない炭素からそれぞれ C-H 結合を切り、空いた手同士で σ 結合を作らせると、シクロアルカンとなる。
プロパン CH3-CH2-CH3 ↓
シクロプロパン *-CH2-CH2-CH2-*
(ただし、* の位置同士で結合した場合)
このように、分子式から、同じ炭素数でも、水素が2つ減るごとに、多重結合または環の構造が1つ増えていることが読み取れる。
飽和の炭化水素の一般式は、CnH2n+2 であった。炭素の数 n から飽和炭化水素に予測される水素の数 2n+2 と比較して水素が2減るごとに、不飽和度が1増えるという言い方をする。
不飽和度が1の化合物は、二重結合が1つ、または環の構造を1つもつ。一般式は、CnH2n である。
ただし、不飽和度と、その物質が飽和であるか不飽和であるかは、1対1に対応しているわけではない。
二重結合および三重結合を不飽和結合ともいう。多重結合をもつ物質は、不飽和である。しかし、環の構造を持っても多重結合を持たない物質は、不飽和ではない。
(解答例)
a) π 結合が1、環構造が1なので、不飽和度は2。
従って、炭素5のペンタンに比べて水素が4個少ない。
(5×2 + 2) - 4 = 8
C5H8
以下のいずれかの構造を書いて水素の数を確認してもよい。
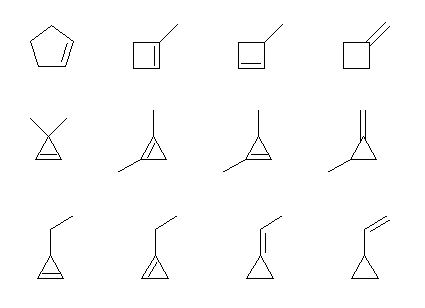
b) π 結合が2、環構造が0なので、不飽和度は2。
従って、炭素4のブタンに比べて水素が4個少ない。
(4×2 + 2) - 4 = 6
C4H6
以下のいずれかの構造を書いて水素の数を確認してもよい。

c) π 結合が1、環構造が2なので、不飽和度は3。
従って、炭素10のデカンに比べて水素が6個少ない。
(10×2 + 2) - 6 = 16
C10H16
該当する条件に相当する構造を書いてみてもよい。異性体は沢山あるので一例のみ挙げる。
a) の分子の名称。上段左より
cyclopentene, 1-methylcyclobutene, 3-methylcyclobutene, methylidenecyclobutane
中段左より
3,3-dimethylcyclopropene, 1,2-dimethylcyclopropene, 1,3-dimethylcyclopropene, 1-methyl-2-methylidenecyclopropane
下段左より
3-ethylcyclopropene, 1-ethylcyclopropene, ethylidenecyclopropane, ethenylcyclopropane (慣用名 vinylcyclopropane)
b) の分子の名称。左より
buta-1,2-diene, buta-1,3-diene, but-1-yne, but-2-yne
c) に例示した分子の名称
bicyclo[4.4.0]dec-1(6)-ene
(発展)
c) に例示した分子の名称
二環系の構造を、2つの島の間を3本の橋が架かっているものと見る。すると、橋の長さ(炭素数)が、4、4、0である。二環を構成している全炭素数(側鎖の置換基があったとしても数えない)は、10である。そこで、多重結合がなければ、
bicyclo[4.4.0]decane となる。カッコの中は、橋の長さを長い順にピリオドで区切って示す。(カンマではない。)
3本の橋の架かっている島の位置を「架橋位炭素」と呼ぶ。
位置番号は、1つの架橋位炭素を1位とする。続いて、最も長い橋を渡ってもう一方の架橋位炭素へ渡る。この時連番をつける。橋の構成炭素が、2、3、4、5。もう一方の架橋位炭素が6となる。続いて、2番目に長い橋を渡って、1位の架橋位炭素に戻る。この時連番をつける。橋の構成炭素が7、8、9、10位となる。一番短い橋が炭素を含んでいる場合は、1位の架橋位炭素から、向かいの架橋位炭素まで(続きの番号を)連番でつけながら渡る。
さて、今回示した化合物において、二重結合の位置は、1位と6位の間である。このように、連続していない番号の多重結合を表すときは小さい位置番号である1に、もう一つの位置番号をカッコに入れて添えて示す。
bicyclo[4.4.0]dec-1(6)-ene
bicyclo[4.4.0]dec-1-ene だと、1位と2位の間に二重結合がある別の構造を示すことになる。
5.02
1) アルカンの一般式 CnH2n+2 と比較して、水素がいくつ少ないか数えよ。
2) その差を2で割ったものが不飽和度である。
(解答例)
a) C10H22 が不飽和度0のアルカンであるから、これと比べて水素の数は6個少ない。( 22 - 16 = 6 )
従って、不飽和度は3。
b) (20×2 + 2) - 34 = 8
従って、不飽和度は4。
c) (8×2 + 2) - 16 = 2
従って、不飽和度は1。
d) (12×2 + 2) - 20 = 6
従って、不飽和度は3。
e) (40×2 + 2) - 56 = 26
従って、不飽和度は13。
5.03
1) アルカンの一般式 CnH2n+2 と比較して、水素がいくつ少ないか数えよ。
2) その差を2で割ったものが不飽和度である。
3) 不飽和度が1つ増えるごとに、&pi 結合が1つ、または環の構造が1つ増える。
もし、不飽和度が2であるなら、次の4つの可能性がある。
・二重結合が二箇所ある。(二重結合は、C=C=C のように隣接してもよい。)
・三重結合が1箇所ある。
・環の構造が1つと二重結合が1つある。(二重結合は、環の構造に含まれる場合、つまりシクロアルケンである場合、と、環の外に二重結合がある場合がある。環に対し、二価基、alkylidene が結合している場合もある。)
・環の構造が2つある。→ (発展)の項)
(解答例)
a) (3×2 + 2) - 6 = 2
よって、不飽和度は1。
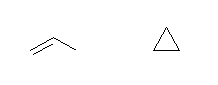
propene, cyclopropane
b) (3×2 + 2) - 4 = 4
よって、不飽和度は2。
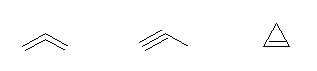
propa-1,2-diene, propyne, cyclopropene
c) (4×2 + 2) - 6 = 4
よって、不飽和度は2。
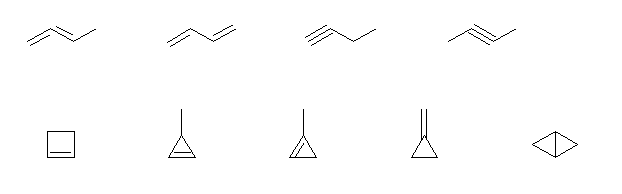
上段左より
buta-1,2-diene, buta-1,3-diene, but-1-yne, but-2-yne
下段左より
cyclobutene, 3-methylcyclopropene, 1-methylcyclopropene, methylidenecyclopropane, bicyclo[1.1.0]butane
(発展)
環が2つの分子を分類しておくと、次の4種類がある。
1) 次のように2つの環がそれぞれ独立して存在している場合
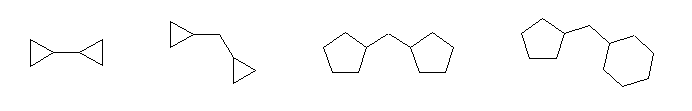
左より、それぞれ
(慣用名)bicyclopropyl
1,1'-methylenedicyclopropane
1,1'-methylenedicyclohpentane
(cyclopentylmethyl)cyclohexane
2) スピロ系:次のように1つの炭素が2つの環に対し、同時に構成員となっている場合。
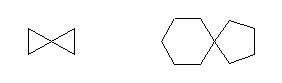
左より
spiro[2.2]pentane (or, spirobicyclopropane)
spiro[4.5]decane (or, cyclohexanespirocyclopentane)
3) 二環系:2つ以上の炭素が2つの環に対し、同時に構成員となっている場合。
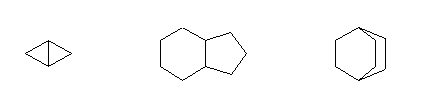
bicyclo[1.1.0]butane
bicyclo[4.3.0]nonane
bicyclo[2.2.2]octane
二環系の命名は、5.1 の発展の項を参照してください。
4) (カテナン)2つの環構造が絡まっているようなもの
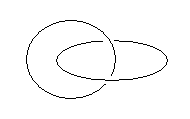
複数の環構造が、「鎖」「オリンピックマーク」のように、共有結合を介さずに繋がった分子集合体のこと。
なお、6員環程度では輪の穴の部分に他の何かを通すほどの隙間はないことなどから、今は検討の対象から除外しておいても差し支えないだろう。なお、シクロアルカンが2つ絡んでいる場合、CnH2n + CmH2m という分子式になることからもわかるように、環が2つあるにも関わらず、見かけの不飽和度は Cn+mH2(n+m) より、1のままです。
これは、2つの分子を新しい共有結合で結ぶためには、水素2つを切って、そこでつなぐことになるのであるから、逆に、不飽和度を考える際に、「2つの部分の間に共有結合がない」場合に「不飽和度が1下がる」(水素が2つ増える)というように考えると辻褄があいます。
5.04
不飽和度をもとに算出できる
(解答例)
分子式が C40H56 であるから、
(40×2 + 2) - 56 = 26
よって、不飽和度は 13 である。環が2つ、三重結合はないから、二重結合は、13 - 2 = 11 個である。
β -カロテンの3次元構造は
5.05
構造式をもとに数えよ
(解答例)
a) 2
b) 4
5.06
a), b) 「側鎖」+「主鎖」の命名構造である。
c), d) は、〜アルコール、〜エーテルという命名であることから、官能種類命名法に従っている。「エチルビニルエーテル」は、「エチル基」「ビニル基」を持つ。なお、ビニル基は、エテニル基の慣用名。「アリルアルコール」は、「アリル基」をもつ。アリル基はプロパ-2-エンイル基の慣用名。
(解答例)
a) 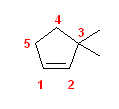
b) 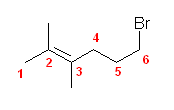
c) 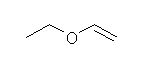
置換命名法では、1-ethoxyethene
d) 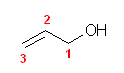
置換命名法では、prop-2-en-1-ol
5.07
f) 官能種類命名法では、「アルキル+アルキル+エーテル」となるが、ここでは置換命名法に従うこと。酸素の左右でどちらが優先して母体となるか考えるとき、
1) 主基の有無では、どちらも主基をもたないため引き分け。
2) 環>鎖でも、どちらも環ではないため引き分け
3) 炭素鎖の長さが優先する
4) 多重結合の数が優先する。
2013 勧告以前では、アルキルオキシ基のついたプロペンと命名することになったのであるが、2013年勧告より、上記 2)、3) が加わっているため、多重結合よりも炭素鎖の長さが優先する。従って、このエーテル化合物の母体は、ブタン。
(解答例)
a) 4-methylpent-2-ene
b) 2-chloro-3,4-dimethylhex-3-ene
c) 1-bromocyclopentene
d) 1-bromo-4-methylhex-3-ene
e) 1,5-dimethylcyclohexene
f) 1-(prop-1-enyloxy)butane
1-butoxyprop-1-ene は2013年勧告に照らして誤り。
g) 1-bromo-2-methylpent>a-1,3-diene
h) 8,8-dimethylnon-1-ene
5.08
no hint
(解答例)
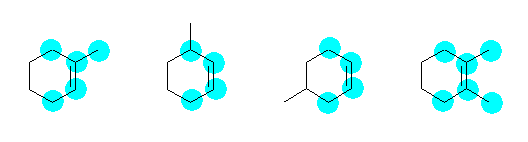
a) 5
b) 4
c) 4
d) 6
5.09
優先順位則を教科書で確認せよ。
この後に及んで周期表を覚えていないなどということのない様に。(最低限、第2周期と第3周期、までの全元素と、ハロゲンを縦に覚えていることを前提としている。)
(解答例)
a) 直接結合している原子、すなわち、ヒドロキシ基では酸素、メチルは炭素として、それぞれ原子番号の大きい順。
-I > -Br > -OH > CH3
b) 最優先は、直接結合している原子が酸素であるヒドロキシ基。他は、直接結合しているのが炭素である。
炭素(親)に対し、子の世代の結合元素を調べると、2-ヒドロキシエチル基は(C, H, H)、クロロメチル基は(Cl, H, H)、ビニル基は多重結合を開いて(C, C, H)である。これですべて順位が決まる。
-OH > -CH2Cl > -CH=CH2 > -CH2CH2OH
5.10
優先順位則を教科書で確認せよ。
(解答例)
エチル基とフェニル基を比較すると、直接結合しているのは炭素で等しい。炭素(親)に対し、子の世代の結合元素を調べると、エチル基は(C, H, H)であるのに対し、フェニル基では(C, C, C)である。よって、フェニル基の方が優先順位が上である。
次に、無置換のフェニル基と、そのパラ位に置換基をもつフェニル基を比較する。結合の根元から順にたどっていったときに始めて構造に差が生じるのがフェニル基のパラ位で、一方は水素、一方は酸素である。よって、4-(2-(N,N-ジメチルアミノ)エトキシ)フェニル基の方が優先順位が上である。
優先順位が上のものが二重結合に対し同じ側に結合している。したがって、(Z)体である。
5.11-5.20
5.11(12)
優先順位則を教科書で確認せよ。
(解答例)
a) pent-2-ene
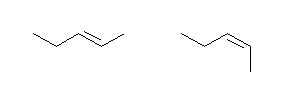
左が (E)体、右が(Z)体。
b) 3-chlorohex-3-ene
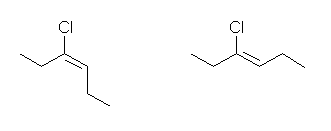
左が (E)体、右が(Z)体。
c) 3-(chloromethyl)-4-ethyl-2-methyloct-3-ene
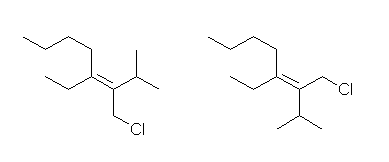
左が (E)体、右が(Z)体。
chloromethyl 基の方が isopropyl基(1-methylethyl基)よりも優先順位が上。ビニル炭素に直接結合した炭素(親)に対し、子の世代がクロロメチル基では(Cl, H, H)に対し、イソプロピル基では(C, C, H) である。
d) 3-tert-butyl-2-(2-hydroxyethyl)pent-2-en-4-ynal
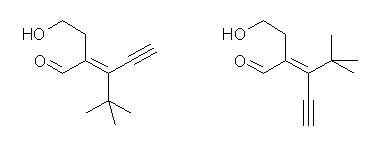
左が (E)体、右が(Z)体。
まず、化合物名。この分子において水酸基とアルデヒド基があるが、命名においてアルデヒドが優先。そこで、アルデヒド(-CHO)を含むもっとも長い炭素鎖を選ぶ。三重結合側に数えても、t-ブチル基側に数えても、どちらも同じ炭素鎖長5となる。そこで、次に優先順位として、多重結合がある側に数える。ここで、ペンタナールに、二重結合と三重結合の入った、ペンタ+エン+イン+アールという基本構造が確定する。アルデヒド側(主基)の番号が小さくなるように番号をつけるから、二重結合の位置は2(と3の間)、三重結合の位置は4(と5の間)である。
側鎖の一つは、2-ヒドロキシエチル基。もう一つの側鎖は t-ブチル基である。t-ブチル基は、1,1-ジメチルエチル基の慣用名であるが、2013年勧告でも優先名 PIN として使用が認められた数少ない慣用名である。
E/Z を決めるために、優先順位を数えるとき、アルデヒド基と2-ヒドロキシエチル基のところで間違える者はほとんど居ないだろう。エチニル基 −C≡CH と t-ブチル基のところは慎重に判断して欲しい。ビニル炭素の直接結合した炭素を親として、子の世代を比較する。三重結合を開いたとき、エチニル基は(C, C, C) であり、t-ブチル基と同じである。次に、孫の世代を比較する。t-ブチル基の3つの炭素は、すべて孫の世代として(H, H, H)を持つ。これに対し、エチニル基は(開いた結果として、重複しているためカッコをつけた2つの炭素は、孫の世代の結合を持たないものとするのであるが、もう一つの炭素は)(C, C, H)をもつ。この時点で差が生まれるので、順位を決定でき、エチニル基の方が優先となる。
5.13
cis-, trans- ではなく、(E)-, (Z)- を用いること。
(解答例)
a) (E)-hept-2-ene
b) (Z)-3,4-dimethylpent-2-ene
c) (Z)-1-chloro-3-ethyl-4-methylhex-3-ene
5.14
まずは、(E)-, (Z)- を区別せずに構造を書き上げてから、必要に応じて二重結合の幾何配置を直せばよい。
イソプロピル基は、1-メチルエチル基のことである。
ブチル基とイソプロピル基では、炭素数はブチル基の方が多いが、優先順位を数えるときには炭素数では決まらないことに注意せよ。
(解答例)
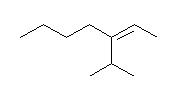
イソプロピル基は、優先名 PIN では使用できない。
(Z)-3-(1-methylethyl)hept-2-ene
イソプロピル基は、ビニル炭素に結合している炭素を親として、子の世代が(C, C, H) である。子の世代が (C, H, H)である直鎖アルキル基より、優先順位が高い。
5.15
二重結合の一方のビニル炭素上に、同じ置換基が結合している場合には、幾何異性体は考えなくてよい。
(解答例)
a)
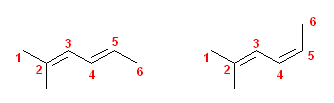
2位(と3位の間)の二重結合は幾何異性体を持たない。
左 : (E)-2-methylhexa-2,4-diene
右 : (Z)-2-methylhexa-2,4-diene
b)
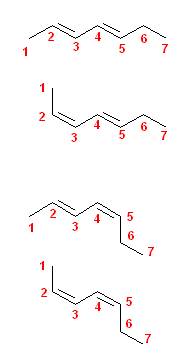
上から
(2E, 4E)-hepta-2,4-diene
(2Z, 4E)-hepta-2,4-diene
(2E, 4Z)-hepta-2,4-diene
(2Z, 4Z)-hepta-2,4-diene
c)
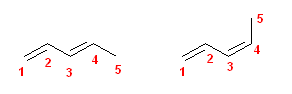
1位(と2位の間)の二重結合は幾何異性体を持たない。
左 : (E)-penta-1,3-diene
右 : (Z)-penta-1,3-diene
5.16
求核剤: 正電荷を求めるもの。ルイス塩基として、孤立電子対を相手に与える。
求電子剤: 負電荷を求めるもの。ルイス酸として、相手の孤立電子対を受け取る。
原子核の構造を思い出してください。原子核は正電荷をもち、その周囲に、その電荷と釣り合うだけの電子雲がありました。
(解答例)
a) AlCl3 は、求電子剤としてはたらいている。
AlCl3 のアルミニウムは最外殻電子がもともと3つ。3本の共有結合をとり、価電子が6個の状態である。閉殻構造をとる(八遇子を満たす)ことができず、電子不足であり、ルイス酸としてはたらき、別の分子やイオンなどから孤立電子対を受け取ることができる。
ルイス塩基として働き孤立電子対を与えているのは、アミン窒素。したがって、アンモニア NH3が求核剤としてはたらいている。
b) H+ がルイス酸として働いている。これが求電子剤である。また、OH- がルイス塩基として働いている。これが求核剤である。
5.17
求核剤: 正電荷を求めるもの。自分自身は、どちらかというと負電荷をもつ。
求電子剤: 負電荷を求めるもの。自分自身は、どちらかというと正電荷をもつ。
(解答例)
H- 求核剤(負電荷をもつ)
CH3O- 求核剤(負電荷をもつ)
CH3C≡CH 求核剤(π 電子があるため。)
CH3C+HCH3 求電子剤(正電荷をもつ)
NH3 求核剤(孤立電子対をもつため)
5.18
結合の分極の仕方と、結合開裂の関係を考えること。
(解答例)
a) 正しい矢印の結果では、C+ + Br- を生じる開裂となっているのに対し、誤りとして描かれた矢印に沿って電子対を動かすと、C-Br の結合電子対は、炭素側にうつり、C- + Br+ が生じる。
b) 正しい矢印の結果では、O + H+ を生じる開裂となっているのに対し、誤りとして描かれた矢印に沿って電子対を動かすと、>O+-H の結合電子対は、水素側にうつり、O2+ + H- が生じる。
C-も、Br+ も、H- も、ある条件では実在するイオンである。ただし、O2+ はかなり無理がある構造のようにも思われる。
はじめから分極している結合は、その分極の方向に電子が移動して結合解離が起きるほうが、逆行して結合解離するよりも小さいエネルギーで済む。上の誤りの電子対の動きは、分極の方向に逆行し、より電気陰性度の高い元素側に正電荷が、より電気陰性度の低い元素側に負電荷が割り振られるような不利な解離となっている。
5.19
反応の前後でどこがどう変化したのかを読み取ること。切れた結合はどれか。新たに生じた結合はどれか。
このような問題を解く際、特に、孤立電子対や、炭素上にあり省略された水素を意識すること。慣れないうちは、省略せずすべてを書き込みながら行うとよい。特に孤立電子対は省略せずに書くようにしないと、慣れていても間違いをすることがある。
なお、実際に曲がった矢印を書くときには、p236-237 のコラム(曲がった矢印についての注意)をよく読むこと。
出発点:結合電子対、または原子上の孤立電子対。
到達点:新たに結合ができる場合は、相手の原子。
すでにある結合が多重結合になる場合は、その結合の中央付近。
結合がきれて一方の原子が孤立電子対として受け取る場合は、その原子。
なお、電子対は、「離れた」ところへは動くことはできない。可能なのは、
原子上の孤立電子対は、その原子と別の原子との間の結合へ、
結合電子対は、その両端の原子上の孤立電子対として、または、隣の結合へ
のいずれかのみである。
(解答例)
5.20 の解答も併せて示す。
a) 二重結合酸素の孤立電子対を使用して、オキソニウムイオンからプロトンを受け取る。オキソニウムイオン中の O-H 結合は、切れたあと酸素上に孤立電子対を残す。
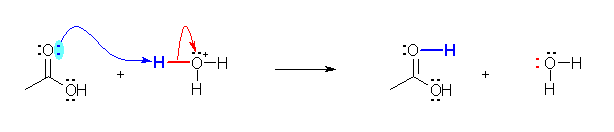
オキソニウムイオン(中のプロトン)が求電子剤として働いている。(プロトン H+ は、ルイス酸である。)
二重結合酸素の孤立電子対がルイス塩基性を示す。酢酸分子が求核剤として働いている(※)。
b) シクロヘキセンの二重結合の π 電子が、臭素イオン(陽イオン)との間での結合に使用される。二重結合の両端の炭素のうち、一方は、これにより電子不足となりカルボカチオンを生じる。
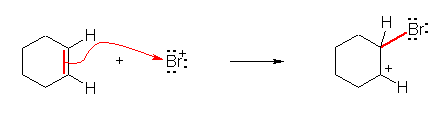
シクロヘキセンが求核剤として働き、臭素イオンが求電子剤として働いている。
c) 水酸化物イオンの酸素上の孤立電子対を用い、酢酸の最も酸性度の高い水素をプロトンとして引き抜き、新たに結合を生じる。酢酸の O-H 結合に使われていた電子対は、酸素上の孤立電子対として残る。
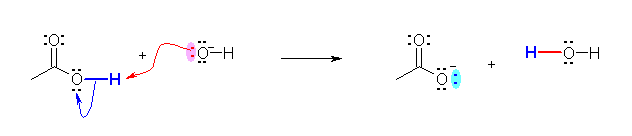
酢酸は求電子剤として働いている。酢酸の酸解離により生じるプロトンはルイス酸である。また、水酸化物イオンが求核剤として働いている(※)。
d) カルボカチオンの炭素は、価電子が6個で、電子不足であり、ルイス酸として働く。塩化物イオンの孤立電子対を用いて C-Cl 結合を形成する。
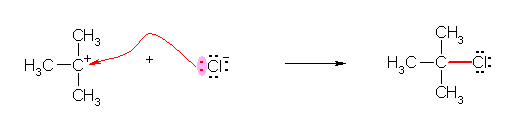
2-メチルプロパン-2-イルカチオンが求電子剤として働き、塩化物イオンが求核剤として働いている。
(※)ここでは、問 5.20 の題意に沿って、反応物を求核剤、求電子剤に分類した。しかし Cδ+ との結合生成などの反応を「求核反応」と呼ぶ場合がある。その文脈においては、この(※)をつけた Brønsted 酸からのプロトン引き抜き反応は「求核反応」ではなく「塩基として働いた」と表現される。
(発展)
Br+ は、臭素イオン bromonium ion
Br- は、臭化物イオン bromide ion
5.20
曲がった矢印との対応から言うと、曲がった矢印の出発点は電子のあるところ、すなわち求核剤としてはたらくところである。曲がった矢印の到達点は電子が行き着くところ、すなわち求電子剤としてはたらくところである。
(解答例)
5.19 に併せて示した。
5.21-5.30
5.21
(解答例)
5.22
エネルギー差の単位 kcal/mol は、1 cal = 4.2 J を用いて単位換算し、kJ/mol に直してから計算しましょう。
熱平衡時の分布比(B/A)は、ボルツマン分布式より計算できる。
(B/A) = exp(-ΔE/RT)
ただし、室温では RT = 2.5 kJ/mol として計算してよいです。その他の温度の場合は真面目に計算しなおしましょう。R = 8.314 J/Kmol です。
A が全体(A+B)に占める割合は、A/(A+B) です。A/(A+B) を x と置いてやると、1/x = (A+B)/A = 1 + (B/A) ですね。
つまり、ボルツマン分布式から算出される値に1を足してから逆数をとると、分母側のものが全体に占める割合になるわけです。分母側、分子側というのはあまり意識せずに、安定な方が全体に占める割合が多い( 50% より多くなる)と考えてやれば OK です。
c) 問題文の「イソプロピルシクロへキサンに対して」というのは、日本語が変ですよね。「イソプロピルシクロヘキサンでは、フルオロシクロヘキサンと比較して」大きいのは、と読んでください。
なお、exp(X) = eX です。また、exp(-X) = e-X = 1/(eX) です。(102 = 100、10-2 = 1/100 だったことを思い出してください。)
(解答例)
ヒントにも書いた熱平衡時の分布比を、 (B/A) で表すことにします。なお、これ(厳密には [B]/[A] )は、熱平衡の平衡定数です。
A ←→ B
K = [B]/[A]
a) (教科書にも解説があります。)
A アキシャル体、B エカトリアル体とすると、A → B の変化での反応自由エネルギー差 ΔE = -0.25 kcal/mol = -1.05 kJ/mol である。
(反応自由エネルギー差が負ということは、この変化で自由エネルギーが減るということ。つまり、より安定になるということです。)
K = B/A = exp(-ΔE/RT)
= exp(-(-1.05)/2.5)
= 1.522
[A]:[B] = 1:1.522 なので、
エカトリアル体 B の全体に占める割合は、1.522/2.522 = 60 %
従って、アキシャル体 A の割合は、40 %
(検算)K = A/B = 0.40/0.60 = 0.67 → 計算数値精度の範囲内で上記数値と一致。
なお、K-1 = A/B = exp(-1.05/2.5) = 0.66 より
[A]:[B] = 0.66:1 なので、
0.66/1.66 = 40 %(アキシャル体の割合)、または、1/1.66 = 60 %(エカトリアル体の割合) と計算してもよい。
b) A アキシャル体、B エカトリアル体とすると、A → B の変化での反応自由エネルギー差 ΔE = -2.1 kcal/mol = -8.8 kJ/mol である。
(反応自由エネルギー差が負ということは、この変化で自由エネルギーが減るということ。つまり、より安定になるということです。)
K = B/A = exp(-ΔE/RT)
= exp(-(-8.82)/2.5)
= 34.1
[A]:[B] = 1:34.06 なので、
エカトリアル体 B の割合は、34.1/35.1 = 97 %
従って、アキシャル体 A の割合は、3 %
c) 上の2つとも同じ式を用いていて、ΔE の値のみを変えて代入した結果であるから、この結果の違いは ΔE の値によるものである。すなわち、アキシャル体とエカトリアル体とでのひずみの量に差があるほど、より安定なエカトリアル体の割合が増えている。これは、エカトリアル体同士を比較したときに、置換基がフルオロ基であるよりもイソプロピル基である場合により安定になるのではなく、アキシャル体同士を比較したときに、置換基がフルオロ基であるよりもイソプロピル基である場合に、より不安定であるからである。アキシャル位の置換基は、シクロヘキサン環の面の同じ側のアキシャル水素との間に、1,3-ジアキシャル相互作用を持つが、これが、置換基がかさ高いほど大きくなるためである。
5.23
(解答例)
5.24
(解答例)
5.25
(解答例)
5.26
教科書 p245 を確認してください。
「熱力学的に安定」…「自由エネルギーの値が小さい」、単に「安定な」という言葉を用いた場合は、通常は熱力学的な安定性を指す場合が多いです。
「速度論的に安定」…「その点が、反応座標図(エネルギー図)において極小である」かつ「左右(正・逆反応)ともに、活性化自由エネルギーが大きい」ことを表す。熱力学的には相対的に不安定であっても、変化するために越えなければいけない山が高ければ、その状態にとどまります。(授業中の解説では、ダイヤモンドを例にしました。ダイヤモンドは黒鉛と比較して、常温常圧では熱力学的に不安定です。しかし、速度論的には安定なので、自然に変化してしまうことは現実的な時間内では起こりません。)
(解答例)
a) 「反応物と比較して、熱力学的に安定な生成物を与える」→ 反応物(出発物)との相対的なエネルギーの大小で比較したとき、生成物(反応座標の方向、右側)が、より安定(反応座標図(エネルギー図)では下の方に位置する)であるもの。従って、(a) と (b) がほぼ同程度で、両者がこの条件に当て嵌まる。
b) 「生成物が速度論的に最も安定である」 → 逆反応でもとに戻ろうとする場合の活性化自由エネルギーが大きいほど、速度論的には安定である。従って、(b) が最も速度論敵に安定である。
なお、(a) と (d) を比較すると、(a) の方が熱力学的には安定であるが、(d) の方が速度論的には安定である。このことからもわかるように、熱力学的な安定性と速度論的な安定性の間には、全く関係がない。
c) 速度論的に最も不安定なのは、(c) である。
5.27
ここでは、生成物の熱力学的な安定性を問題にしていますが、これは反応物(出発物)と比較した場合の安定性を尋ねていると考えてください。
本来、速度論的な安定性も、比較対象がないと答えられません。 a) と b) とで比較して答えを書いてください。
(解答例)
・a)、b) ともに、反応物(出発物)と比較して生成物は熱力学的に不安定であると指定されているので、生成物のエネルギーを出発物よりも高く描く。
・速度論的な安定性の大小を、逆反応の活性化自由エネルギーで表現する。これが高いほど、速度論的にも安定である。
・反応物(出発物)、生成物は、ともにエネルギー的に極小である(周囲よりも低い)。
・(1段階反応として書く場合)反応物(出発物)と生成物の間に、かならず山(エネルギー的に反応物や生成物よりも高い位置)をひとつだけ書く。もし、途中に極大が複数ある場合には、複数段階の反応ということになる。途中にある極小点は、すべて中間体である。
従って、たとえば次図のようになる。
(R) が反応物、(P) が生成物として、
a) 左側:右図に比べると速度論的に不安定。b) 右側:左図に比べると速度論的に安定。
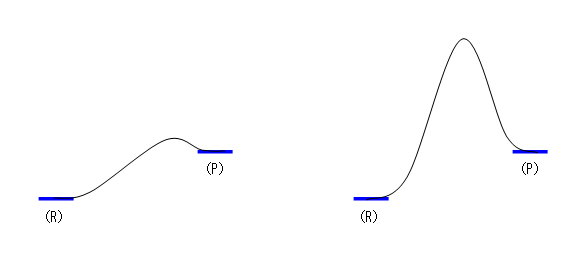
ただし、極端になって、逆反応の活性化自由エネルギーがゼロ(生成物がエネルギー的な極小ではなくなってしまう)と、まずいです。(反応物、生成物、中間体、いずれもエネルギー的に極小の点です。遷移状態はエネルギー的に極大の点です。極小でも極大でもない点は、分子の形が変化していく途中の構造であって、なにか生成物のようなものを表すものではありません。)次図は、ダメな例です。速度論的には最も不安定ですが、そもそも生成物とはいえない(すぐに別の構造に変化してしまう)のです。

5.28
(解答例)
5.29
(解答例)
5.30
(解答例)
5.31-5.40
5.31
(解答例)
5.32
縦軸のエネルギーを、エンタルピー H とした場合、反応で系のエネルギーが下がる場合に「発熱反応」、系のエネルギーが上がる場合を「吸熱反応」と言いました。
縦軸のエネルギーを、(ギブスの)自由エネルギー G とした場合、反応で系のエネルギーが下がる場合を「発エルゴン反応」、系のエネルギーが上がる場合を「吸エルゴン反応」と言います。
(解答例)
「2段階反応である」 : 極大をもつ山を2つ書きます。これにより、反応物 →(山)→ 中間体 →(山)→ 生成物 となります。
「1段階目が吸エルゴン的である」 : 始状態(反応物)から比べて、1つ目の山の麓(1段階目の反応の生成物、反応全体で見た場合では中間体)を、相対的に高い位置に書きます。
「2段階目が発エルゴン的である」 : 始状態(反応全体でみた場合の中間体)から比べて、2つ目の山の麓(反応生成物)を、相対的に低い位置に書きます。
「反応全体とすると、吸エルゴン的」 : 反応物と比べて生成物の方を、相対的に高いところに書きます。
以上を満たすように作図していれば正解です。
(従って、次の2パターン、どちらでもOKです)
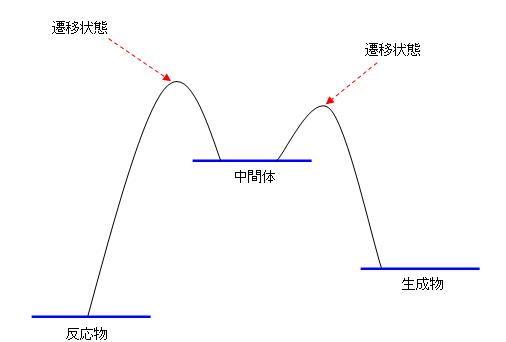
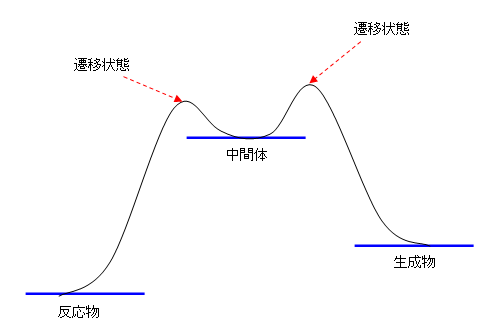
・2箇所ある遷移状態のどちらが高いかの指定はされていない。(反応中間体から見たときの、生成物へ戻る過程、反応物を与える過程、この2つの起こりやすさに影響があります。上の2つのパターンでは、これが逆になっていますが、問題文に指定はありません。)
・横軸を反応軸としてみたとき、分子の形の変化に対し、エネルギーの変化は滑らかであるはずです。その観点からみると、上の図より下の図の方がより自然です。上の図では、水平な線のところから反応が起こり始めるところ、反応が終わって生成物を与えるところで、グラフが斜めに突き刺さるように経っていますが、これが不自然です。たとえば、授業で二原子分子で例を挙げて説明したように、最も安定な(エネルギー図ではグラフの極小を与えるような)構造からの配座や結合距離などの変化は、滑らかな底部をもつ放物線のような形になり、急に立ち上がるようなエネルギー変化はしません。
5.33
活性化自由エネルギー(単に活性化エネルギーと言うこともあります)は、反応の進行方向に沿ってみたときに越えなければいけない山の高さです。同じひとつのエネルギー図が与えられたとしても、山の麓の高さが左右で異なる場合には、正方向(一般には左から右)へ山を越えるときと、逆方向に山を越えるときとで活性化エネルギーが異なります。
「律速段階」(Rate Limitting Step, RLS)とは、連続した一連の段階反応のうち、もっとも速度の小さい(遅い)過程のことを指します。
(解答例)
a) 次図の中に、連続した3段階の反応で越えなければいけない山の高さを、3つの縦の赤い二重線矢印で表した。これが(正方向の反応での)活性化自由エネルギーである。
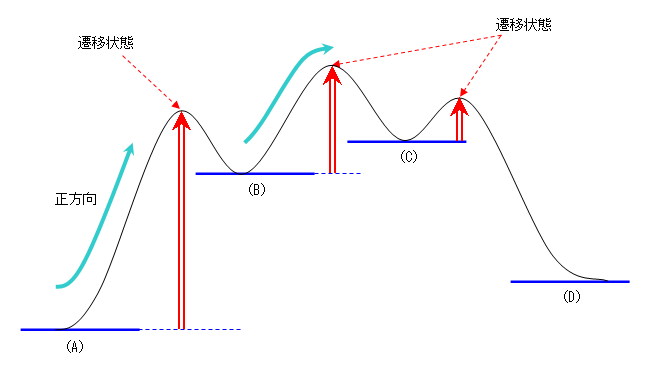
従って、「(A) → (B) の段階」が、もっとも大きな活性化自由エネルギーをもつ。
b) (B) が「はじめに生じる中間体」である。従って、ここを中心に正反応、逆反応における活性化自由エネルギーを調べればよい。次図の二重線矢印2つの大小を比較する。
より低い山(より小さな活性化自由エネルギー)を越えやすいので、この中間体(B)は、(C)へと進む過程よりも(A)に戻る過程の方が速く、相対的に多くが(A)に戻ってしまう。
c) 最も遅い過程 = 最も活性化自由エネルギーの大きい課程 です。従って、「(A) → (B) → (C) → (D)」という一連の過程のうち、「(A) → (B)」が最も遅い過程であり、これが律速段階となります。
5.34
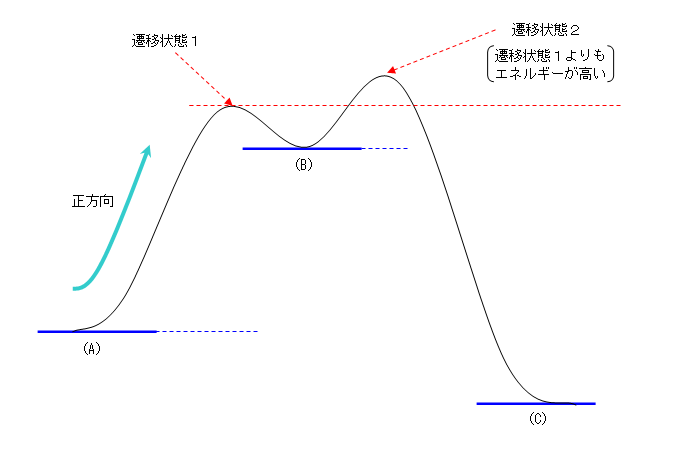
「安定」=「エネルギーが低い」,「不安定」=「エネルギーが高い」 です。
(解答例)
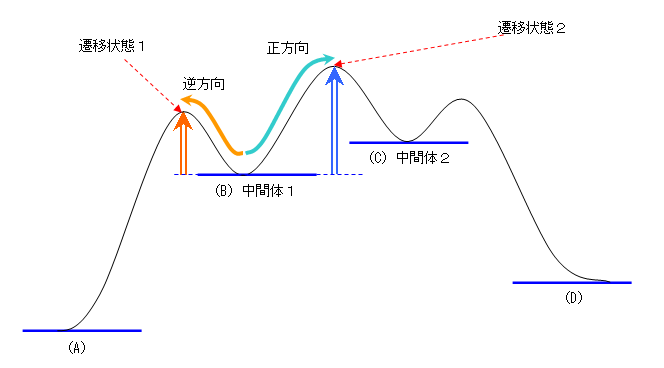
条件を満たした図を書くと、次図のようになる。
・もっとも安定なのは(C)である。
・(B)は、(A)や(C)よりも不安定である。
・遷移状態は、(B) → (C) の方がエネルギーが高い。
a) 中間体は、(B) の一つのみ。
b) 2段階過程であり、遷移状態は2つある。
c) 自分の書いた図によって、答えは変わります。上の図では、(A) → (B) の過程よりも、(B) → (C) の方が速くなりますので、答えは k2 ですが、次図、右のような形の図を書いた場合は、(A) → (B)の過程の方が速くなりますので、答えは k1 です。
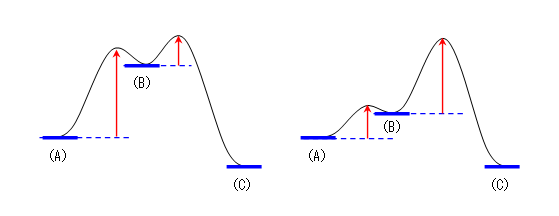
d) 遷移状態1より遷移状態2の方が高いエネルギーをもつものと指定されているので、逆反応の速さを考えるときに、(C)→ (B) よりも、(B) → (A) の方が活性化自由エネルギーが大きくなるような図は書けないので、全員、自分の図を調べたときに、(B)→(A) が速いはずである。したがって、k-1 です。
e) k-1
f) 自分の書いた図によって変化する。(A) → (B) 、(B) → (C) のうち、遅い方(活性化自由エネルギーの大きい方)が律速段階である。
g) (C) → (B)、(B) → (A) のうち、活性化自由エネルギーが大きい方であるから、この問題文の条件(遷移状態1より遷移状態2の方が高いエネルギーをもつ)では、(C) → (B) が律速段階である。
5.35
(解答例)
5.36
ここのリストの中には、主基(語尾となる官能基)はありませんが、ある場合には、その位置番号がなるべく小さくなるように母体の炭素に番号を振ります。
(アルキル基として命名する場合は、結合の付け根、yl の位置が1番になるようにします。)
その次の優先順位として、側鎖よりもまず多重結合の位置番号の組が小さくなるように番号を振ります。(このあたり、アルカンのときにくらべてプラスアルファで考慮しなきゃいけないので、注意です。)
(解答例)
a) 3,8-dibromonon-4-ene
b) (Z)-4-ethyl-3,7-dimethyloct-3-ene
c) 1,5-dimethylcyclopentene
d) 3-ethyl-2-methylhept-2-ene
e) 4-methylcyclohxene
f) 4-ethyl-5-methylcyclohexene
c) は間違いやすい。2,3-dimethyl は誤り。二重結合の位置が 1, 2 位となることが優先的に決まる。その上で、二重結合上の置換基は、より数字の小さい1位に決まる。
5.37
(解答例)
5.38
d) と f) は、慣用名であるビニル基、アリル基の構造を思い出すこと。
(解答例)
a)
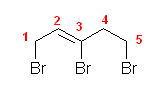
b)
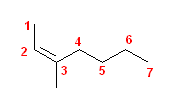
c)
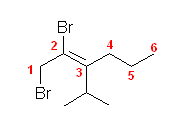
d)
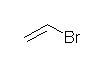
vinyl bromide 臭化ビニル は、官能種類命名法。置換命名法では、bromoethene
e)
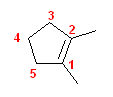
f)
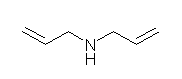
5.39
(解答例)
5.40
(解答例)
5.41-5.50
5.41
幾何異性体についても考慮し、(E)-, (Z)- を付すこと。 e) では、2013年勧告に従った命名をすること。
母体の炭素に位置番号を振るときには、
1) 主基の番号が小さくなるように
2) 多重結合の位置番号(の組)が小さくなるように
3) 側鎖の位置番号の組が小さくなるように
の順です。
(解答例)
a) (E)-3-methylhex-3-ene
b) (E)-8-methylnon-4-ene
c) (E)-9-bromonon-2-ene
d) 2,4-dimethylpent-1-ene
e) 3-methylidenehexane
f) (Z)-pent-2-ene
e) について、2-ethylpent-1-ene とするのは、2013年勧告以前は正解。現状では不正解。
幾何異性体を cis-, trans- で表示することもあるが、皆さんはすべて (E)-, (Z)- で表すようにしてください。
5.42
5.19 のヒントも参照すること。
反応の前後で変化しているところがどこであるかを、まず探すこと。
(解答例)
水酸化物イオンは水になっている。すなわち、酸素の孤立電子対がプロトンを受け取っている。このとき、新たに生じる結合は酸素の孤立電子対であった電子を用いている。
ブロモエタンは、プロトンを放出する際、電子対が残る。その電子対は、C-C 二重結合のπ 電子として残る。臭素の結合の位置の炭素は、その結果として5本目の結合を持つことになるが、それを避けるために、C-Br 結合が開裂する際、結合電子対を臭素側に渡す。その結果として臭化物イオンが生じる。
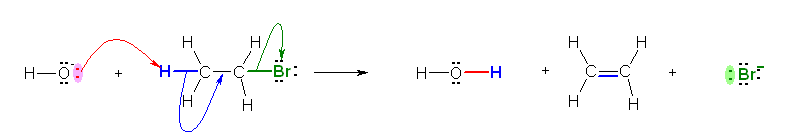
5.43
(解答例)
5.44
(解答例)
5.45
(解答例)
5.46
優先順位則を教科書で確認せよ。
(解答例)
a) -CH2CH3 > -CH3
-CH2CH2Cl > -CH2CH3
よって、(Z)体
b) -CH2C≡CH > -CH2CH2CH3 ∵(C, (C), (C))>(C, H, H)
-CH(CH3)2 > -CH2CH=CH2 ∵ (C, C, H)>(C, H, H)
よって、(E)体
c) -Br > -CH3
-CH2Br > -CH2CH2CH2CH3
よって、(E)体
d) -C(=O)CH3 > -CH2OH ∵ (O, O, C)> (O, H, H)
-CH2Br > -CH2CH2Cl
よって、(Z)体
e) -Br > -CH2CH2Br
-CH2CH2CH(CH3)2 > -CH3
よって、(E)体
f) -CH(CH3)2 > -CH3
-CH2CH2Cl > -CH2CH2CH2CH3
よって、(E)体
5.47
(解答例)
5.48
優先順位則を教科書で確認せよ。
(解答例)
a) 結合一番付け根の炭素を親としたとき、子の世代が、左から順に(C, H, H)、(C, C, H)、(C, C, H)、(H, H, H)である。イソプロピル基とビニル基以外は、これで順位が決まる。イソプロピル基は、子の炭素上の孫世代が(H, H, H)であるのに対し、ビニル基では子の炭素の一つについてその孫世代が(C, H, H)であるため、ビニル基>イソプロピル基の順となる。
-CH=CH2 > -CH(CH3)2 > -CH2CH2CH3 > -CH3
b) -OH > -NH2 > -CH2OH > -CH2NH2
c) -Cl > -C(=O)CH3 > -C≡N > -CH=CH2
5.49
(解答例)
5.50
5.19、5.42 などを参照すること。
a) アンモニアが求核的に攻撃しているのは、(若干図が見にくいが)水素ではなく、炭素であることに注意すること。
(解答例)
a)
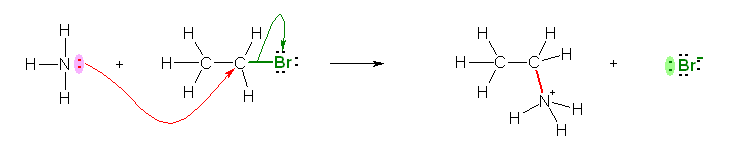
この置換反応においては、炭素に対してアンモニアが求核的に攻撃している。これは、臭素との結合の分極により、この炭素が正の部分電荷をもつからである。
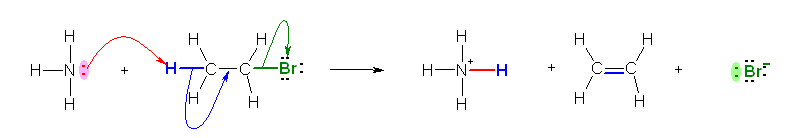
アンモニアが塩基として働く場合は、水素に求核的に攻撃してプロトンを引き抜く。その場合は、次式のように脱離反応となる。
b) 水酸化物イオンがカルボニル炭素に求核的に攻撃し、付加反応となっている。これは、カルボニル基が強く分極しているためである。酸素は炭素より電気陰性度が高く、かつ、カルボニル基の π 電子がその電気陰性度の差により大きく動いている。
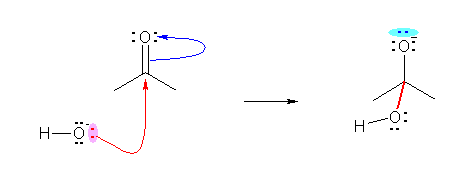
c) 2,3-ジメチルブタ-2-エンにおいて、π 電子に対するプロトンの付加が生じる。
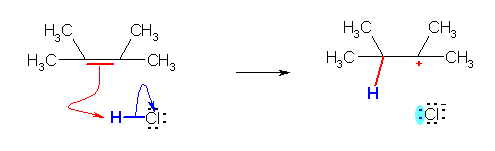
なお、c) の反応では、アルケンが左右対称なため、どちらの炭素にプロトンが付加し、どちらの炭素上にカチオンの正電荷が残るのかについては、考えなくてもよいが、非対称なアルケンを用いた場合には、位置選択性が問題になることがある。
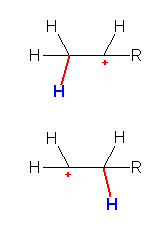
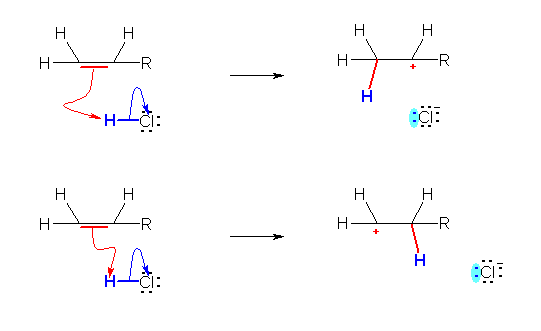
・生じるカルボカチオンの級数に差がある場合には、より級数の高いカルボカチオンが生じる割合が大きい。
・一般的な曲がった矢印の書き方の規則では、アルケンに対するプロトンの付加位置の違いを区別して書き分けることはできない。
・現時点では、まだ一般的とはいえないが、一部には、曲がった矢印の出発点付近の曲げ方で、付加の位置(方向)を区別して書き分けることを提唱している先生もいる。
(従来からある曲がった矢印の書き方の規則と矛盾していないので、意識的にこの新規則を用いてもよい。)
5.51-5.60
5.51
与えられた名称に従って構造を書いてみること。
書いた構造を正しく命名してみること。
ほとんどの名称は間違いです(そうでなければ問題にならない)。
(解答例)
a) 3-ペンテン(ペンタ-3-エン)は、二重結合が 3位(と4位の間)にあることを示す。次の構造を見てわかるように、逆の端から位置番号をつけたほうが、主鎖の二重結合の位置番号が小さくて済む。
正しい名称: pent-2-ene
b) 2-オクテンは、正しい名称であるが、二重結合の位置番号は、-ene の直前に書くほうが好ましい。
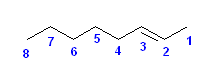
正しい名称: oct-2-ene
c) ビニル基は、-CH=CH2 である。次の構造式を見てわかるように、最も長い炭素鎖は、ペンタンの5ではなく、6となる。主鎖の位置番号は、(主基は存在しないので、2番目の優先順位として)二重結合の位置が小さくなるようにつける。
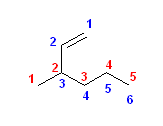
正しい名称: 3-methylhex-1-ene
d) 1位に結合したエチル基を主鎖に含めて数えると、最も長い炭素鎖はペンテンの5ではなく、7となる。
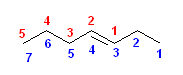
正しい名称: hept-3-ene
e) シクロアルケンの場合、必ず二重結合の位置が1位と2位になるが、5位は逆順で数えると4位となる。(主基の位置番号がもっとも小さくなる、多重結合の位置が小さくなる、の2つの優先的な規則に次いで)置換基の位置番号が小さくなるように位置番号を振る。
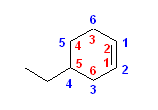
正しい名称: 4-ethylcyclohexene
1位と2位の間に二重結合があるシクロアルケンの場合、二重結合の位置を示す位置番号は省略する。cyclohex-1-ene とはしない。
f) 3-ヘキセン(ヘキサ-3-エン)は、左右のどちらの端から数えても二重結合の位置番号は同じになる。なので、次の優先的な規則として、置換基の位置番号が小さくなるように数える。
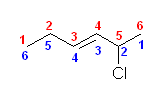
正しい名称: 2-chlorohex-3-ene
g) 2位のエチル基を含めて主鎖とした方が炭素鎖長を長くとることができる。(主基はないので)二重結合の位置番号が小さくなるように位置番号をつける。
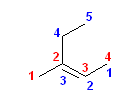
正しい名称: 3-methylpent-2-ene
h) 位置番号を含めて構造に対する命名は正しいが、この二重結合には幾何異性体(立体配置異性体)は存在しない。そのため、(E)-体でも (Z)-体でもない。
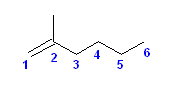
正しい名称: 2-methylhex-1-ene
i) シクロアルケンの場合、必ず二重結合の位置が1位と2位になるが、2位は逆順で数えると1位となる。(主基の位置番号がもっとも小さくなる、多重結合の位置が小さくなる、の2つの優先的な規則に次いで)置換基の位置番号が小さくなるように位置番号を振る。
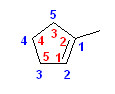
正しい名称: 1-methylcyclopentene
5.52
(E)-体、 (Z)-体の区別に注意すること。
(解答例)
a)
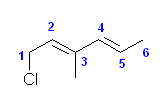
b)
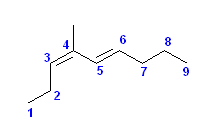
c)
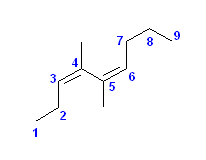
d)
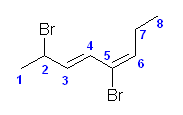
5.53
5.33 などを参照すること。
おそらく、e) は問題の不備ですね。「速いか」ではなく「どちらが(相対的に)速いか」で答えてください。
f) 反応全体の出発物は (A) で、(C) と (E) の2つは反応中間体です。そのため、「律速段階の出発物」という言い方も奇妙な感じもするのですが、ここでは、3段階ある反応のうち、最も遅い反応(律速段階)(←活性化自由エネルギーが最も大きい反応)を、「出発物 → 生成物」と書いたときの「出発物」という意味で答えてください。
j) 「速い = 速度定数が大きい」です。
(解答例)
a) (C) と (E) の2つ。
b) 反応座標図(エネルギー図)のうち、(B)、(D)、(F) の3つの文字が遷移状態の位置を示す。
c) (E) → (G) の過程が最も活性化自由エネルギーが小さく、反応が速い。
d) (G) の方がエネルギーが低い。すなわち(熱力学的に)安定である。
e) 「速いか」→ そんなのは、縦軸のエネルギーの絶対値も与えられていないし、反応温度も書かれていないので答えられません。
「どちらが速いか」 → 活性化自由エネルギーの小さい方です。(A) を生成する過程(逆反応側)
f) (C) → (E) の過程が最も遅い(律速段階である)。よって、(C)
g) (A) よりも (C) の方が不安定である。よって、吸エルゴン的である。
h) (A) よりも (G) の方が安定である。従って、発エルゴン的である。
i) (C) と (E) では、(C) の方がエネルギーが小さい。(C) の方が安定である。
j) (E) → (G) が最も活性化自由エネルギーが小さく、従って最も速い。つまり、最も大きな反応速度定数を持つ。
k) 逆反応では、(G) → (E) が最も大きな活性化自由エネルギーをもち、従って最も遅い。つまり、最も小さな反応速度定数をもつ。
j) と k) で同じ素過程の正反応と逆反応が(教科書の図では)最も速い反応と最も遅い反応のペアになっているのは、たまたま偶然によるものです。下図のような場合、正反応では、(A) → (B) が速い過程ですが、逆反応においても (B) → (A) の方が (C) → (B) よりも速くなっています。
5.54
(解答例)
5.55
(解答例)
5.56
(解答例)
5.57
(解答例)
5.58
(解答例)
5.59
(解答例)
5.60
(解答例)