3.01-3.10
3.01
アルカン、すなわち不飽和結合も環の構造も持たない炭化水素についての問いである。枝分かれ構造の有無は、水素の数に影響を与えない。
(具体的な解き方)
アルカンの一般式は、 CnH2n+2 である。(発展)の項を参照。
この一般式に当て嵌めて求めればよい。
(解答例)
アルカンの一般式 CnH2n+2 より、
a) 炭素数が 17個であるアルカンでは、n=17 に対し、2n+2 = 36 より、36個の水素をもつ。
b) 炭素数が 74個であるアルカンでは、n=74 に対し、2n+2 = 150 より、150個の水素をもつ。
b) 水素数が 74個であるアルカンでは、2n+2=74 なので、n = 36 より、36個の炭素を持つ。
(発展)
炭素数 n のアルカンの構造を短縮構造(簡略構造)で書くと、次のようになる。
CH3-(CH2)n-2-CH3
両末端は、-CH3 であるが、間はすべてメチレン鎖(隣の炭素との間に2本の結合を有し、残り2本の結合が水素と結合している、-CH2-)である。ここでは、炭素の全数を n としているので、メチレンの数は(n-2)個である。
以上を数え上げることで、アルカンの一般式 CnH2n+2 が導出される。
なお、この一般式を基準にし、同じ炭素数 n に対し、水素の数が 2n+2 から 2 つ減るごとに、不飽和度が 1 ずつ増える。不飽和度 1 ごとに、環の構造または、多重結合(不飽和結合)が 1 ずつ増えている。これは、炭化水素の異なる炭素上から 2 つの水素を切り離し、その位置で結合を作らせるとき、炭素同士が離れている位置であれば環構造を、隣接している場合には多重結合となるからである。(三重結合の場合は、不飽和度 2 に対応する。)なお、用語として「不飽和度」であるが、環構造は不飽和結合ではない。
3.02
要注意
教科書 p104-105 では、イソブタン、イソペンタン、イソヘキサン、イソヘプタンという一連の構造に、あたかも一般的な規則があるかのように説明しているが、誤りである。
「イソ〜」という名称は、すべて慣用名であり、一般的な規則に従って命名されているのではなく、個々の構造と名称の間に1対1の対応関係があるだけである。イソブタン、イソペンタン、イソヘキサン、イソヘプタン、(その他、イソプロピル基、イソブチル基、など)の間に、-CH(CH3)2 という末端で枝分かれをした構造を持ち、残りの部分は直鎖であるという共通点があるが、これは、この4種の分子(+α)にのみ当て嵌まる規則でしかない。
「イソブタン」がブタンの異性体であるように、イソという接頭辞がもとの分子の異性体(分子式は同じで、結合の順序など、構造に差があるもの)の一つを表すときに命名に使用することがあるということは、おそらく正しいと思われる(が、規則に従っているわけではなく、すべての慣用名を知っているわけではないので、断言はできない)。
そのため、慣用名「イソオクタン」という名称から構造を書き出すためには、類推で導くことは不可能であり、何かで調べるか、あらかじめその構造を知っているという条件が必要である。
(具体的な解き方)
オクタンについては、名前から炭素数との対応を思い出すこと。メタン、エタン、プロパン、… と、炭素数の順に唱えて数えてもよし、オクトパスがタコ(蛸)のことであるなど、なにかのきっかけで思い出してもよし。分岐のない炭素鎖を書く。構造式の種類は、短縮構造式(簡略構造式)でも、骨格構造式でも、その他、なんでも、ルールに則っていれば自由。
イソオクタンについては、慣用名であるから、「オクタンの異性体である」という以上のことは名前からは分からない。具体的な構造は、知らなければ、教科書、書物、インターネットなどで調べるしかない。
(学生からの質問)
Q:オクタンの構造異性体は沢山あるのですが、そのすべてがイソオクタンですか。
A:いいえ、違います。「イソオクタン」というのはオクタンの異性体を表す一般名(あてはまる構造が複数ありえる)なのではなく、ある特定の構造に1対1で対応している名称です。実際に、対応している構造がオクタンの構造異性体であるのは事実ですが、解答例に示した、ただ一つの構造のもののみがイソオクタンです。
(解答例)
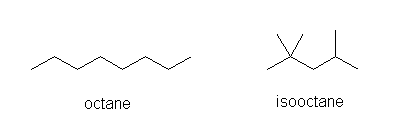
イソオクタン isooctane の体系名(置換命名法によるもの)は、2,2,4-trimethylpentane
要注意 なお、「問題の解き方(英語版)」では、解答として、イソオクタンとして 2-methylheptane を示しているが、これは著者の誤解による誤りであると思われる。
(発展)
同様に、イソ〜 という名称が、「-CH(CH3)2 という末端で枝分かれをした構造」を示すのではないような例として、アミノ酸である ロイシン、イソロイシン などが挙げられる。次の構造式を確認してみてください。
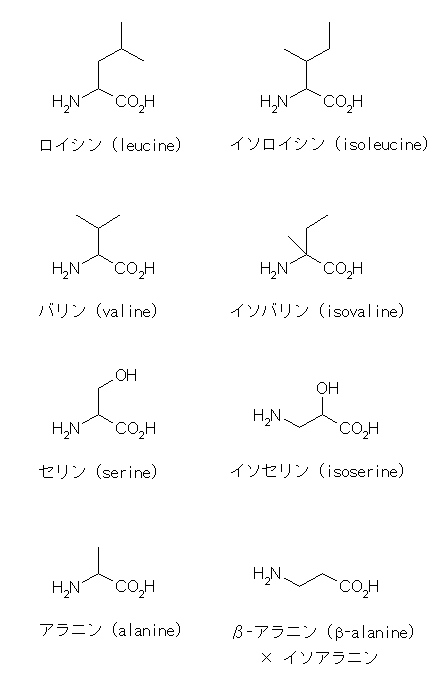
セリンに対応する異性体としてイソセリンが存在するが、β-アラニンが、アラニンの異性体であるにも関わらず「イソアラニン」とは呼ばれないことからも、異性体(のひとつ)を一般的に(常に)「イソ〜」で命名するべきであるという規則さえ存在しないということが判るだろう。
(発展2)
※ 命名法において、母音の重なりを嫌う場合が多い(例、methane + ol → methanol のように、母音 o と重なるため、e が落ちる)が、イソオクタン は、iso + octane → isooctane (isoctane イソクタン ではない)。詳細は省略するが、methane の e は、サイレントな e または、マジック e と呼ばれる、発音しない母音であるからです。(まあ、これも少々いい加減な説明であって、hexa + ane で構成されている hexane ヘキサン は、そもそも、hexaane ヘキサアンではありません。また、アルコールでは、水酸基の数が2つだと 〜diol ですが、水酸基の数が3つでは、〜triol です。水酸基4つでは、tetraol (テトラオール)ですが、一部 〜tetrol(テトロール) という表記もあります。ちゃんと調べられていないのですが、tetrol は慣用名の一部として残っているのだと思います。
3.03
構造が与えられてその分子の正しい名前を書けといわれた場合には、体系名として、置換命名法による命名することを第一とせよ。
代表的な慣用名については、その名称が示す構造を知っている、または理解できることが必要であるものもある。しかし、慣用名が書けなくても、体系名が書ければそれで構わない。
(具体的な解き方)
1) まず、赤色 → 酸素、青色 → 窒素、黒 → 炭素 などの規則に従い、骨格構造式に書きなおしてみるとわかりやすい。
2) 分子の中の官能基をマルで囲むなどして、分子の種類(アルコール、エーテル、アミンなど)を判断せよ。
3) 分子の種類に応じた語尾を思い出すこと。以前に配布した命名法のプリントなどを参照してもよい。
4) その官能基が結合している炭素鎖(主鎖)について、炭素の数と、結合の位置を数えよ。
5) 「主鎖アルカン名」-「位置を表す数字」-「官能基を表す接尾語」の順にならべて完成させる。ただし、接尾語が母音ではじまる場合(-ol、-amine など)は、アルカン名の最後の e は、落とされる。
ただし、側鎖置換基(アルキル基の分岐、主官能基以外のすべての置換基)がある場合は、「側鎖置換基の位置、その置換基名」をアルファベット順で、上記の先頭に書く。
(解答例)
官能基により決まる分子の種類(functional class, アルコール、エーテル、など)の前にアルキル基名をつけた命名法(カッコ内に示した)は、優先されるべき体系名とはいえない(PIN ではない。発展の項参照)ので、非推奨(化合物名として間違っているわけではない)。
a) propane の構造に、水酸基が結合している。結合位置は、propane の1位炭素である。依って、
propan-1-ol プロパン-1-オール
△ ( propyl alcohol プロピルアルコール)
b) 酸素の両端にアルキル基が結合したエーテルである。置換命名法では、エーテル構造に対応する「語尾」は存在しない。従って、ここでは、methoxy 基 CH3-O- をひとつの置換基として命名する必要がある。結合位置は、propane の1位炭素である。依って
1-methoxypropane 1-メトキシプロパン
△( methyl propyl ether メチルプロピルエーテル)
c) propane の構造に、アミノ基が結合している。結合位置は、propane の1位炭素である。依って、
propan-1-amine プロパン-1-アミン
propylamine プロピルアミン
(発展)
propyl alcohol などは、慣用名ではなく、ある規則に従って命名されている。「官能種類命名法」(「基官能命名法」)に従った命名である。しかしながら、IUPAC 2013年改訂により、有機化合物の命名において、優先名 PIN が定められた際、原則として置換命名法に従うことになった。ただし、従来の命名も、一般名 GIN として使用が認められる。
とはいえ、PIN が推奨される以上、一般名 GIN は書けるが、優先名 PIN は書けないというのは困る。
要は、複数の命名法があっても、置換命名法に従ってさえいれば、おおかた間違いないということです。
アミンは「アルキル基名+amine」という命名が(PINとしても)許容されていたと思います。もともと「アルキルアミン」という名称は「アルキル基名」と「アミン」の間にスペースなしの1単語として命名するため、厳密には官能種類命名法(基官能命名法)のように見えてもそうではなく、置換命名法の変形として捕らえられるようです。ただ、アミンは例外と思うより、他のアルコールやエーテルと同じ規則で命名できる「アルカン名」「位置」「語尾:アミン」、すなわち、プロパン-1-アミンのように命名するもの、と思っておいていただいた方が話が単純になりますし、汎用性があります。
3.04
分子式 C5H12 が、アルカンの一般式 CnH2n+2 に従っている。つまり不飽和度がゼロで、分子内に環の構造も、多重結合も存在していないということである。つまり、pentane の異性体 (pentane も含めて全部で3種類)の中から条件に合致するものを探す。
(具体的な解き方)
1) C5H12 構造異性体をすべて、骨格構造式を用いて書き出してみよ。このとき最長の炭素鎖長が5のもの、4のもの、3のもの、というように場合を尽くすようにして書き出す。
2) 炭素上のアルキル基の数が、その炭素の級数である。すなわち、骨格構造式において、炭素を示す点の分岐の数で判断できる。「ヘ」型ならその中央の炭素は、第2級、「ト」型に分岐していれば第3級、「+」型であれば第4級。
(解答例)
ペンタンの構造異性体は、次の3つ。
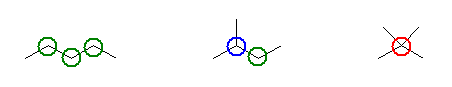
ただし、第2級炭素は緑、第3級炭素は青、第4級炭素は赤のマルで囲んだ。マルで囲んでいない残りの炭素は、すべて第1級。
以上より、条件に合致するものを探すと、
a) 構造式は、上図、中央。2-methylbutane
b) 構造式は、上図、右。2,2-dimethylpropane
3.05
次の手順で探すとよい。
1) まず、C4H10 の構造異性体をすべて(といっても2種類)書き出す。
2) 次いで、それぞれの非等価な水素をひとつ臭素に置き換える。
命名は、最も長い炭素鎖(butane, propane)上に、どの位置に、どの置換基(methyl-, bromo-)が結合しているかを見極め、規則に従い「置換命名法で」命名する。
(解答例)
C4H10 の構造異性体は、次の2種類。それぞれ非等価な水素を重複しないよう、位置を矢印で示した。
矢印の無い位置は、すでに等価な水素が矢印で示されている。たとえば、左の n-C4H10 について、左から3番目の炭素は、左から2番目の炭素と等価。よって、これらの上に結合している水素は互いに等価である。
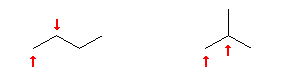
従って、それぞれの位置に臭素を結合した(水素と臭素を置換した)結果の構造式は、次の通り。
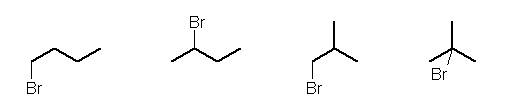
左より、順に
1-bromobutane
2-bromobutane
1-bromo-2-methylpropane
2-bromo-2-methylpropane
この問いでは、命名法について限定していないから、以下の官能種類命名法による命名でも可。(試験では、上記の置換命名法を問う予定である。)
左より、順に
n-butyl bromide
sec-butyl bromide
isobutyl bromide
t-butyl bromide
3.06
4本の結合をもつ炭素が「正四面体型である」以外の、否定すべき、考えられる構造は、「平面4配位型、すなわち正方形の対称性をもつ」ものです。
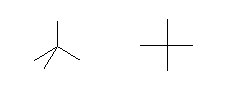
(具体的な解き方)
「正四面体型」である場合、「平面4配位型(正方形型)」である場合の2通りについて、示された条件が満たされるかどうか、検討せよ。どちらも満たされる場合は、「区別がつかない」ので不適切な選択肢であるといえる。
(参考) 平面型のメタンの三次元構造
(解答例)
a) 臭化メチル(ブロモメタン) CH3Br のように、炭素上に3つの同じ置換基(この場合は -H)と、1つの別の置換基(この場合は -Br)が結合している場合、正四面体構造でも異性体は1種類しかないし、平面4配位型(正方形型)でも異性体は1種類しかない。
b) 四塩化炭素 CCl4 では、炭素より塩素の方が電気陰性度が大きいために、C-Cl 結合には分極が生じている。分子全体として4本の結合の分極が打ち消されてしまう(ベクトルとして足し合わせたときにゼロになる)ような場合、分子は双極子モーメントを持たない。正四面体構造であっても、平面4配位型(正方形型)であっても、いずれも4本の C-Cl 結合による分極は打ち消しあうので、分子は、双極子モーメントを持たない。
以上の理由より、a) と b) は、平面4配位型であることを否定できないから、「炭素が正四面体構造であることの証拠」にはならない。
c) ジブロモメタン CH2Br2では、もし、炭素が平面4配位を取ると、隣接した2つの水素が臭素に置換されたものと、対角線上の2つの水素が臭素に置換されたものが、それぞれ異なる構造として区別される。(ヒントにリンクした「平面型のメタンの三次元構造」を参照すること。)
このようにジブロモメタンに構造異性体がないということは、平面4配位であることを否定する。同時に、さらに対称性が低いほかの構造であることも否定する。従って、炭素が正四面体構造であることの証拠となる。
3.07
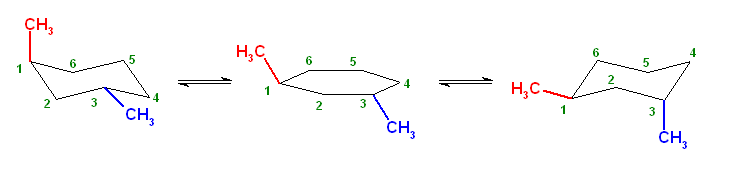
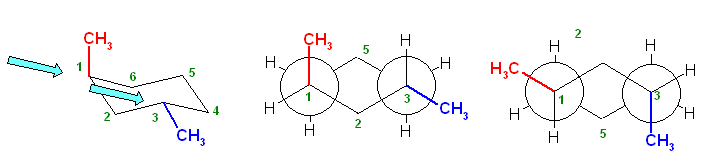
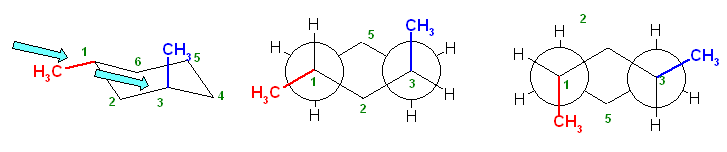
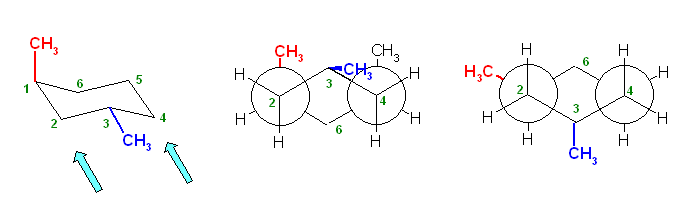
構造式は、紙面内で回転させたり、結合のでる方向を変えたりしてあっても、同じとみなしてよい。
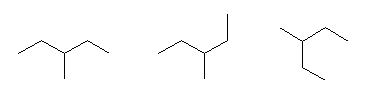
(教科書の表現を借りるならば、置換命名法により命名する際に同じ名称となるならば。別の表現をするなら、トポロジー的(位相幾何学的)に同じであるならば。)上記3例は、いずれも同一。3-methylpentane
また、価標の先に置換基の式を書く場合、式(-OH、-CH3 など)のどの原子と結合しているのかを意識し、位置や式の順序を考えて書く。
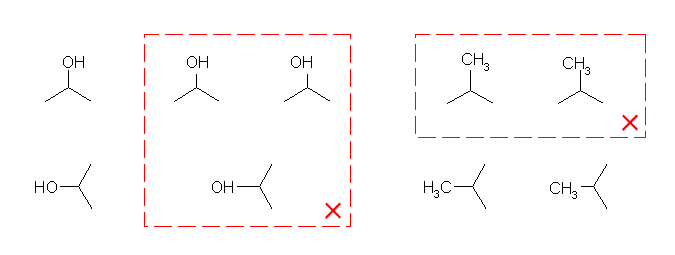
赤で囲んだような構造は不適切である。(ただし、左側にでている価標の先に、メチル基を書く場合、上の注意書きに従えば、H3C- と書くべきであるが、CH3- という書き方も一般的に認められている。)
(解答例)
骨格構造式と、置換命名法による体系名を書いておく。
a)
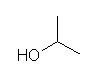
propan-2-ol
b)
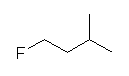
1-fluoro-3-methylbutane
c)
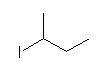
2-iodobutane
d)
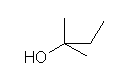
2-methylbutan-2-ol
e)
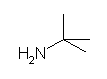
2-methylpropan-2-amine
t-butylamine
f)
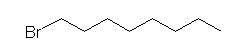
1-bromooctane
(発展)
t-butyl (または、tert-butyl) 以外の分岐アルキル基名は、優先名 PIN では使用できない。一般名 GIN の中でのみ使用可能。
なお、個人の体感的なものだが、t-pentyl 基という名称は、最近ほとんど見かけない。
t-pentyl 基は(この授業では)覚えなくてよい。それ以外の分岐アルキル基名も、名称から構造が書ける程度には覚えておく。構造から名称を書く場合は、体系的ルールに従った名称を書けるようにする。
3.08
3.3 と同じように命名せよ。
(具体的な手順)
1) 骨格構造式に書きなおす。
2) 命名において接尾語となるべき、主官能基をマルで囲む。
3) 主鎖を探し、位置番号を決める。
4) 主官能基以外の側鎖、置換基を「側鎖置換基の位置、その置換基名」の形でリストにする。
5) 「側鎖置換基の位置、その置換基名」をアルファベット順、次いで、「主鎖アルカン名」-「位置を表す数字」-「官能基を表す接尾語」の順にならべて完成させる。ただし、接尾語が母音ではじまる場合(-ol、-amine など)は、アルカン名の最後の e は、落とされる。
(解答例)
骨格構造式で示しなおした。青の部分が主鎖、赤で示したところが接尾語となるべき主官能基。エーテルやハロゲン化アルキル(アルキルハライド)は、接尾語となるべき主官能基にはなれないので、側鎖置換基として命名することになる。
a)
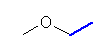
1-methoxyethane
(エタンの一置換体では、置換基の位置が1種類しかないから、位置番号である 1- が省略されることもある。)
b)
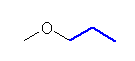
1-methoxypropane
c)
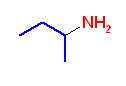
butane-2-amine
1-methylpropylamine
(アルキル基名 sec-butyl は、優先名 PIN では使用できないので、PIN としては、sec-butylamine は不可)
d)
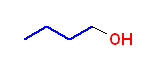
butan-1-ol
e)
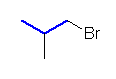
1-bromo-2-methylpropane
f)
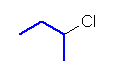
2-chlorobutane
3.09
a の例について、教科書の解説を読み、同じように書くこと。体系名の成り立ちを理解するためにも、きちんと答えが導けるようにならないといけませんな。
1) 名前の最後の部分から、主鎖の構造が判る。
2) (慣れれば、不要だが)主鎖の端から1、2、と順に番号を振る。
3) 側鎖置換基を、それぞれの指定の位置に書き加えていく。
4) アルキル基名に相当する部分がカッコで括られており、括弧内が「位置を表す数字」、「置換基名」 、「主鎖に相当するアルキル基名」で構成されているのは、複合官能基である。複合官能基では、主鎖に相当するアルキル基の主鎖との結合位置の炭素を1番とし、離れていくように番号を振る。
(解答例)
主鎖の(教科書の訳語では「親の」)名称と構造を青で示した。
a) 2,2-dimethyl-4-propyloctane
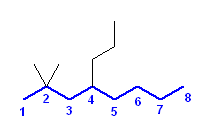
b) 2,3-dimethylhexane
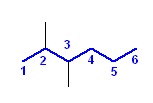
c) 4,4-diethyldecane
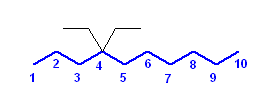
d) 2,4,5-trimethyl-4-(1-methylethyl)heptane
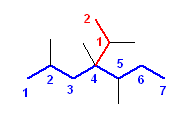
e) 2,5-dimethyl-4-(2-methylpropyl)octane
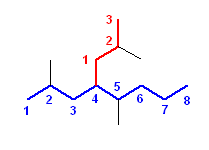
f) 4-(1,1-dimethylethyl)octane
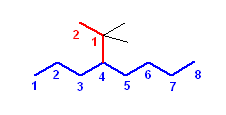
(発展)
置換基名がカッコで囲まれており、カッコ内にも数字があるのは、複合官能基名。解答例と見比べてみてもらえばわかると思うが、カッコの外にある数字は、すべてその化合物の主鎖炭素上の位置番号だが、カッコ内の数字は、置換基の中の主鎖に相当する部分(解答例では赤で示した)上の数字の意味。つまり
4-(1-methylethyl)
という名前の部分は、主鎖の4位に、(1-methylethyl)基が結合していると読む。
1-methylethyl基とは、ethyl基の1位(主鎖に結合している一番近い炭素)上に、余分なメチル基を持つ構造である。
3.10
オクタンの異性体を「すべて漏れなく、そして重複なく」書き出すためには、(授業でも説明したように)最長鎖が、8のもの、7のもの、6のもの、と場合を尽くしながら書いていくようにする。(教科書の解き方の解説もよく読んでみてください。同じこと、言っているだけですけどね。)
(c)〜(f) は、解く必要なし。
(解答例)
最長の炭素鎖が8

octane
最長の炭素鎖が7
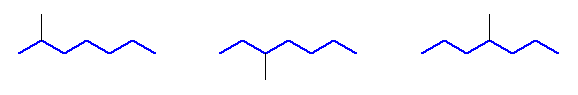
2-methylheptane, 3-methylheptane, 4-methylheptane
最長の炭素鎖が6
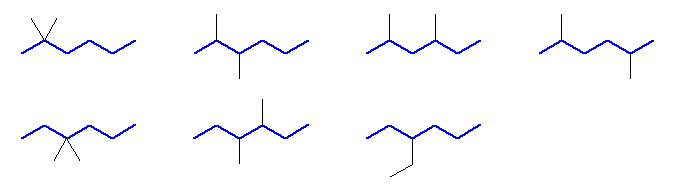
上段: 2,2-dimethylhexane, 2,3-dimethylhexane, 2,4-dimethylhexane
下段: 3,3-dimethylhexane, 3,4-dimethylhexane, 3-ethylhexane
最長の炭素鎖が5
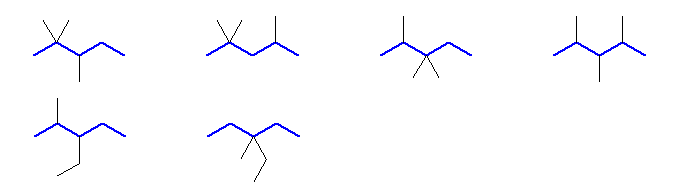
2,2,3-trimethylpentane, 2,2,4-trimethylpentane, 2,3,3-trimethylpentane, 2,3,4-trimethylpentane
3-ethyl-2-methylpentane, 3-ethyl-3-methylpentane
最長の炭素鎖が4
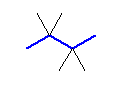
2,2,3,3-tetramethylbutane
(発展)
なお、最長の炭素鎖が5のとき、側鎖アルキル基が3つの炭素を持つ。そのような側鎖として、1-methylethyl基(慣用名 isopropyl基)がありえる。n-propyl 基は、pentane の1位、2位、3位に結合すると、最長鎖長が5から増えてしまう(ということは、上の段階ですでに考慮済みである)のであったが、1-methylethyl基は、最長炭素鎖長を変えずに3位に結合することが可能である。
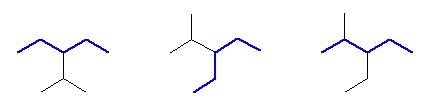
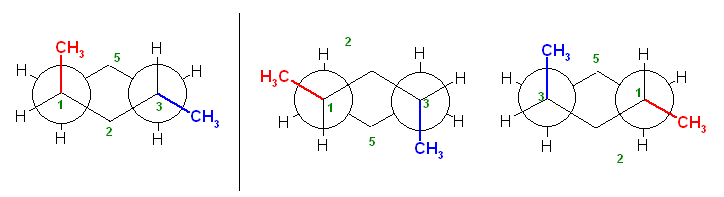
しかし、3-(1-methylethyl)pentane という名前に対応する構造(上図左)は、同じ長さの別の鎖部分を主鎖として選ぶことで、すでに考慮済みである 3-ethyl-2-methylpentane と同じ構造であることが判る。
主鎖の選び方によって、3-(1-methylethyl)pentane と 3-ethyl-2-methylpentane という2つの名前があるように見えるこの化合物について、置換命名法の規則によれば、前者の命名は誤りであり、後者の命名が正しい。
プリント p8 置換命名法
2. 主鎖の決め方
(8)(側鎖の数)主鎖の長さが同じ候補が複数ある場合で、(4)〜(7) の比較でも決まらない場合、側鎖の置換基の数が最多のものを選ばなければならない
からである。
3.11-3.20
3.11
b や g の簡略構造は、枝分かれがわかりやすいように、骨格構造式に書きなおしてから命名すると間違いにくい。
まず、最も長い炭素鎖がどこか(主鎖がなにか)を探すこと。
番号の付け方(主鎖の1位を、どちらの端にするか)は、結果として付けられる側鎖の位置番号の組が小さくなるように選ぶ。
(解答例)
a)
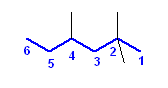
2,2,4-trimethylhexane
b)
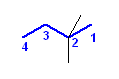
2,2-dimethylbutane
c)
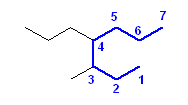
3-methyl-4-propylheptane
d)
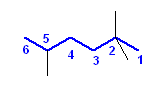
2,2,5-trimethylhexane
e)
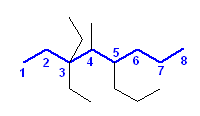
3,3-diethyl-4-methyl-5-propyloctane
f)
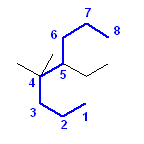
5-ethyl-4,4-dimethyloctane
位置番号は、番号の組が小さくなるよう、メチル基の付け根が4位、エチル基の付け根が5位。(4,4,5 の方が、4,5,5 よりも小さい番号の組であるから。)
化合物名を組み立てる際には、側鎖は、アルファベット順に並べる。このとき、倍数接頭辞(di) のアルファベットは考慮しない。従って、(e) で始まる置換基名 5-ethyl 基の方が、(m) で始まる置換基名 4,4-dimethyl 基より先に並べられる。
g)
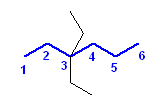
3,3-diethyloctane
h)
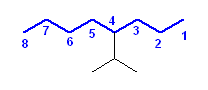
4-(1-methylethyl)octane
i)
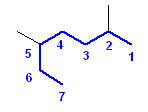
2,5-dimethylheptane
3.12
C5H12 の構造異性体は、全部で3つある。上の問いと同様に、場合を尽くして探してみること。その上で、条件を満たすものを探せ。
(解答例)
ペンタンの構造異性体は、次の3つ。

ただし、第2級炭素は緑、第3級炭素は青、第4級炭素は赤のマルで囲んだ。マルで囲んでいない残りの炭素は、すべて第1級。
以上より、条件に合致するものを探すと、
a) 構造式は、上図、左。pentane
b) 構造式は、上図、右。2,2-dimethylpropane(第4級炭素上に水素はないから、第1級水素しかない。)
c) 構造式は、上図、中央。2-methylbutane
d) 構造式は、上図、中央。2-methylbutane(pentane には、第2級水素が6個あり、条件に合致しない。
3.13
炭素は、4本の結合をもち、骨格構造式のうち、価標(結合の棒)を省略できるのは、明示していない炭素に結合した C-H のみである。従って、着目している炭素の位置から書かれている価標の本数を、4から差し引いた残りが C-H 結合である。
(解答例)
これで実際に数えてみてください。
モルヒネの3次元分子モデル
上記リンクをクリックすると、別ウィンドウにて分子模型の3D表示をします。スマホ等で何も確認できない場合は、演習室のPC等で開いてみてください。
3.14
特にヒントなし
次の解答例では、教科書の構造となるべく対応するように骨格構造式の向きなどをそろえたが、3.07 のヒントにも述べたように、紙面内で回転させたり、結合のでる方向を変えたりしてあっても、同じとみなしてよい。
(解答例)
a)
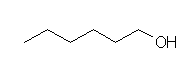
hexan-1-ol
b)
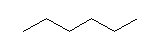
hexane
c)
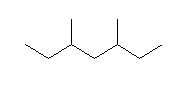
3,5-dimethylheptane
d)
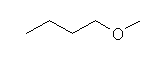
1-methoxybutane
e)
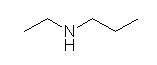
N-ethylpropanamine
N-ethyl-N-propylamine
なお、N- は、炭素上の位置番号を表す数字に対応して、窒素原子上の置換を表す位置記号。イタリックにすること。
f)
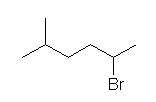
2-bromo-5-methylhexane
炭素主鎖(hexane)について、左右のどちらから位置番号を振っても、置換基の位置の組は、2,5- で同じになる。5-bromo-2-methyl〜が正しくないのは、
プリント p9 置換命名法
3. 位置番号をつける。
(4)(置換基の名称)位置番号の組が左右どちらから数えても同じ場合で、(1)〜(3) の比較でも決まらない場合、側鎖の名称のアルファベット順で最も先のものを最も小さい番号にする
からである。
すなわち、ここでは、bromo の方が methyl より先に来るので、小さい番号にする。(ただし、位置番号の決める優先順位として、このアルファベット順はかなり下の方です。たいていは、その前に、主基の位置や、多重結合の位置番号、あるいは、位置番号の組の大小で決まってしまいます。)
3.15
特にヒントなし。
問い 3.11 を解くとき、先に骨格構造式に書き直すことから始めるのがよい。
(解答例)
問い 3.11 の解答例を見よ。
3.16
特にヒントなし。
(解答例)
a) 3,4-diethyl-2-methylheptane
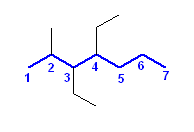
CH3CH(CH3)CH(CH2CH3)CH(CH2CH3)CH2CH2CH3
b) 2,2,5-trimethylhexane
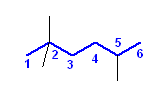
CH3C(CH3)2CH2CH2CH(CH3)2
3.17
d), g), i), j) は、最も鎖長の長い炭素鎖が主鎖となる。
2013 年IUPAC改訂に伴い、優先名 PIN において、多重結合の有無、炭素鎖数の大小に関わらず、環構造が鎖に優先するように変更されたので、残りの選択肢は、すべて、シクロアルカンが主鎖になる。
プリント p8
置換命名法
2.主鎖(母体の炭化水素)の決定
(1) 主基(分子の種類 class を決める最も優先順位の高い官能基)が結合している部分を主鎖とする。
この問題の例では、主基となる置換基は無いので、(1) では決まらない。
(2) 環構造が鎖に優先する。
これは、たとえ鎖の上に多重結合があっても変わらない。
※ 「炭素鎖長や多重結合の有無に関わらず、環が鎖に優先する」「鎖長が多重結合の有無に優先する」ように変更されたのは、2013勧告からなので、教科書等において対応がなされていない記述があるかもしれません。
(解答例)
a)
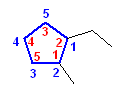
1-ethyl-2-methylcyclopentane
シクロペンタン上に2つの置換基が結合している。どちらを1位にとっても、置換基の位置番号の組は、「1,2」となる。そのため、番号の若い1位に、アルファベット順で先にくる置換基を置く。
b)
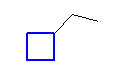
ethylcyclobutane
シクロアルカン上に置換基がひとつしかない。そのため、置換基の結合位置は、等価であり、1種類しかない。(必ず1位とすることができる。)よって、位置番号は省略される。(等価だから省略されるのであって、1位だから省略されるというロジックではない。その証拠に、a) では、1-ethyl 基の位置番号は省略されていない。)
c)
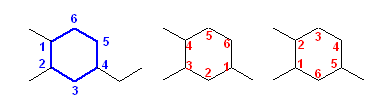
4-ethyl-1,2-dimethylcyclohexane
置換基の位置番号の組が一番小さくなるのは、左の青字で示したような順で、「1,2,4」となる場合である。
このようなもっとも小さい位置番号の組を探すためには、次の手順で考えるとよい。
(1) まず、任意の置換基が1位だったとする。
(2) 次に近い位置の方に向かう廻り順で番号を降る。
これは、位置番号の組がもっとも小さいためには、その組の中で最小の数字が1であり、2番目に小さい数字がついで小さい必要があるからである。
そのようにして、3つの置換基のどれかが1位であるとしたときの位置番号の組は、上図を参考にしてもらうとわかるように、「1,2,4」<「1,2,5」<「1,3,4」の3通り。(このような手順を踏まなくても、慣れればもっとも小さい番号の組が 1,2,4 であるというのは自然に見えてくると思いますので、ご心配なく。)
側鎖置換基は、アルファベット順に並べる必要がある。比較するのは、4-ethyl と 1,2-dimethyl である(その置換基が2つあることを示す倍数接頭語の d は、アルファベット順に含まれない)ので、上記命名となる。
d)
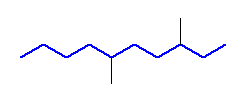
3,6-dimethyldecane
上の構造で、右端より数えたほうが位置番号の組が小さくなる。
e)
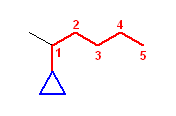
(1-methylpentyl)cyclopropane
× 1-methylpentylcyclopropane ではない。このように複合官能基にカッコがないと、カッコの中は複合官能基の母体であるペンチル基上の位置番号(赤字の数字)であり、カッコの外はシクロプロパン環上の位置番号という規則で考えて、たとえば次の構造
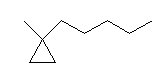
1-methyl-1-pentylcyclopropane
の、ペンチル基の位置番号を書き忘れた名称(正しくはないが)とも解釈できてしまう。
f)
1-ethyl-3-(2-methylpropyl)cyclohexane
g)
5-(1-methylethyl)nonane
h)
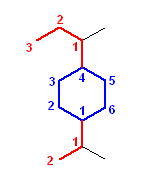
1-(1-methylethyl)-4-(1-methylpropyl)cyclohexane
i)
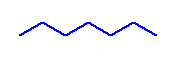
heptane
j)
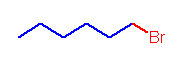
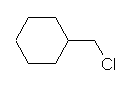
1-bromohexane
表記された価標の本数は、heptane と同じであるが、最も右側の価標の先には、炭素(メチル基)が省略されている代わりに、臭素が結合している。すなわち、C7 ではなく、 C6 の化合物である。
(発展)
側鎖アルキル基をアルファベット順に並べるときの注意。
0) ethyl < methyl < propyl など、先頭の文字から順に判定する。
1) 辞書の掲載順を考えればよい。すなわち、methyl < methylethyl の順。
2) t-butyl基、sec-butyl基のように、ハイフンで区切られた記号の部分はアルファベット順に含めない。これは両方とも b で始まるアルキル基名である。一方、ハイフン区切りのない、isopropyl基、isobutyl 基は、p や b で始まるのではなく、i で始まるアルキル基名である。
3) 同じ置換基が複数あることを示す接頭辞は、ハイフン区切りがないにも関わらず、アルファベット順に考慮しない。つまり、tribromo < ethyl < dimethyl の順。
4) 倍数接頭辞のように見えても、複合官能基の名称に含まれているものは、置換基の固有の名称の一部として扱う。1,1-dimethylethyl基が3つ結合している場合は、たとえば1,1,4-tris(1,1-dimethylethyl)-3-ethyl-cyclooctane のようになる。tris は、同じものが3つあることを示す倍数接頭辞(trimethyl の tri に相当し、複合官能基が3つあることを示す)なので、t は数えない。一方で、1,1-dimethylethyl 基は、d で始まる置換基名なので、2-ethyl よりも先に書かれる。
3.18
「2通りの名称をつけ」る必要なし。
置換命名法に則った命名(体系名)のみを書け。(教科書で「慣用名」と述べているところの官能種類命名法に従った命名は、行う必要がない。)
(解答例)
置換命名法によるもの
a) 2-chlorobutane
b) bromocyclohexane
c) 1-chloro-4-methylpentane
d) 2-fluoropropane
官能種類命名法によるもの。☆を記したのは、アルキル基の名称に慣用名を用いるもの。)
a) ☆ sec-butyl chloride
1-methylpropyl chloride
b) cyclohexyl bromide
c) ☆ isohexyl chloride
4-methylpentyl chloride
d) ☆ isopropyl fluoride
1-methylethyl fluoride
第1級のハロゲン化アルキル → c)
第2級のハロゲン化アルキル → a), b), d)
3.19
メチルシクロヘキサンは、次図に示すように、非等価な水素は5通りある。メチル基の結合している炭素(第3級炭素)にも水素があることを見落とさないように。
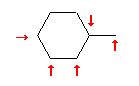
(解答例)
a) 第1級のハロゲン化アルキル
(chrolomethyl)cyclohexane
複合官能基なので、カッコを忘れないようにしてください。(英語版の書籍「問題の解き方」では、カッコを忘れていますが、間違いだと思います。)
b) 第2級のハロゲン化アルキル
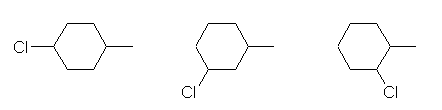
左より順に
1-chloro-4-methylcyclohexane
1-chloro-3-methylcyclohexane
1-chloro-2-methylcyclohexane
c) 第3級のハロゲン化アルキル
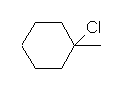
1-chloro-1-methylcyclohexane
3.20
b), c) は解答する必要なし。
エーテルは、体系名(置換命名法)において、主基とならない。(対応する接尾語をもたない。)そのため、RO-, アルコキシ基(アルキルオキシ基の短縮形)を側鎖置換基として命名する必要がある。炭素鎖の長い方を主鎖とする。
ここでも、主鎖を選ぶ際の優先順位は同じ。3.17 のヒントに述べたとおり。すなわち、(1) 主基、(2) 環>鎖、(3) 鎖長、(4) 多重結合の数 の順である。
(解答例)
a) 置換命名法によるもの
1) methoxyethane
主鎖は、より鎖長の長いアルカンである、エタン。
CH3O- は、methyl-oxy 基。短縮形の methoxy 基と記すのが一般的。
※ どちらの炭素も等価なので、位置番号の 1 は不要。「末端に結合しているから」という理由ではない。
2) ethoxyethane
どちらの炭素鎖を主鎖に選んでも同じ名前である。
ethyl-oxy 基 の短縮形は ethoxy 基。
3) 4-methoxyoctane
主鎖は、より鎖長の長いアルカンである、オクタン。
4) 3-methyl-1-(1-methylethoxy)butane
最長炭素鎖長は、酸素原子の左側が2、右側が4。従って右側が主鎖。
左側部分は、枝分かれを含んでいるので、複合官能基として命名する。
(慣用名では、isopropyloxy 基、その短縮形は、isopropoxy 基となる。ただし、2013 勧告で、優先名 PIN の中では、tert-butyl 基以外の分岐アルキル基に慣用名を用いることは許されないことになった。)
5) 1-propoxybutane
位置番号の「1-」を落とさぬよう注意すること。
6) 2-(1-methylethoxy)hexane
c) 官能種類命名法によるもの。「アルキル基名1」「スペース」「アルキル基名2」「スペース」「ether」の形の命名になる。
1) ethyl methyl ether
2) diethyl ether (優先名 PIN としては不適切だが、慣例的に使用されることの多い名称。)
3) methyl 1-propylpentyl ether
4) 3-methylbytyl 1-methylethyl ether
又は、isobutyl isopropyl ether (アルキル基名称に慣用名を用いたもの。)
5) butyl propyl ether
6) 1-methylethyl 1-methylpentyl ether
1-methylethyl 基は、慣用名として isopropyl 基が使用可能(優先名 PIN では使用不可能)だが、1-methylpentyl 基は、sec-butyl 基の類推で sec-pentyl 基ということはできない。
(発展)
RO- は、alkyloxy 基 アルキルオキシ基 として命名する。
ただし、炭素数が4以下のアルキルオキシ基、ならびにフェニルオキシ基は、慣用名として、短縮形(アルコキシ基の形)となる。
CH3O- → methoxy, methyloxy
CH3CH2O- → ethoxy, ethyloxy
CH3(CH2)2O- → propoxy, propyloxy
CH3(CH2)3O- → butoxy, butyloxy
CH3(CH2)4O- → pentyloxy (pentoxy ではない。)
PhO- → phenoxy, phenyloxy
上記5つの短縮形の慣用名(メトキシ、エトキシ、プロポキシ、ブトキシ、フェノキシ)は、誘導体を作ってよい。
例 CH2BrO- → bromomethoxy-
また、分岐アルキル基の慣用名に対応するアルコキシ基の名称もあるが、慣用名に相当する分岐アルキル基上に別の基が置換する場合は、その慣用名を使用することができない。
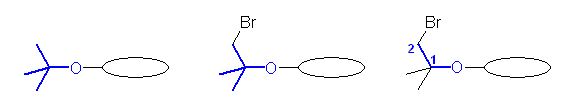
例 (CH3)3CO- → tert-butoxy
例 (CH3)2C(CH2Br)O- → 2-bromo-1,1-dimethylethoxy-
後者(上図、右側の2つ)は、tert-butoxy 基のひとつのメチル基上に臭素が置換している構造であるが、「bromo-tert-butoxy」のように命名することができない。そのため、エトキシ基上に、2-bromo 基、2つの 1-methyl 基が置換した、複合置換基として命名することになる。
3.21-3.30
3.21
同族列(教科書 p103): CH4 → CH3CH3 → CH3CH2CH3 → CH3CH2CH2CH3 … のように、-CH2- ずつ増えていくもの。(メタン → エタン のところは、違うように見えるけど、CH3-H → CH3-CH2-H と見てやれば、やっぱり -CH2- が差分なのです。)
ここでは、アルキル基部分に分岐のない直鎖長の末端位に水酸基のついた一連のアルコールを書けばよい。
(解答例)
ここでも、alkane 由来のアルコールについて、置換命名法(alkanol)と、官能種類命名法(alkyl alcohol)とを並列にしておく。前者で表示することができれば、後者は不要。(優先名 PIN としては、官能種類命名法は使えない。)
置換命名法では、propanol 以上では水酸基の位置指定が必要であることに注意。
アルキル基名は、原則として(枝分かれのないアルキル基を示すので)余分なものは不要だが、枝分かれのないことを明示する目的で、n- という記号を付加することがある。(例:propan-1-ol = n-propyl alcohol)
炭素数1
CH3OH
methanol
methyl alcohol
炭素数2
CH3CH2OH
ethanol
ethyl alcohol
炭素数3
CH3(CH2)2OH
propan-1-ol
propyl alcohol
炭素数4
CH3(CH2)3OH
butan-1-ol
butyl alcohol
炭素数5
CH3(CH2)4OH
pentan-1-ol
pentyl alcohol
炭素数6
CH3(CH2)5OH
hexan-1-ol
hexyl alcohol
3.22
アルコールの場合は、水酸基の結合した炭素の級数が、そのアルコールの級数である。炭素上のアルキル基の数を数えるとき、水酸基は(アルキル基ではないので)数に入れない。なお、d のように1つの分子内に2つの水酸基がある場合、そのそれぞれについて第何級であるのかを決めることができる。
(解答例)
a) pentan-1-ol
第1級アルコール
b) 5-chloro-2-methylpentan-2-ol
第3級アルコール
位置番号の組は、塩素の付け根を1位とした方が小さいのだが、主基である水酸基の位置番号を小さくすることの方が優先される。
c) 5-methylhexan-3-ol
第2級アルコール
主基である水酸基の位置番号を小さくすることが優先されるので、2-methylhexan-4-ol とはならない。
d) 7-methyloctane-3,5-diol
どちらの水酸基も、第2級のアルコールである
水酸基が2つあるので、接尾語は「diol」である。そのため、母音の重なりが生じないので、octane の「e」は落ちずに残ることに注意する。
3.23
アルコール C6H14O は、( R-H → R-OH という置換によって生じているから )、炭化水素 C6H14 の水素を水酸基に置換したものである。
この分子式は、アルカンの一般式 CnH2n+2 の n=6 の場合であり、不飽和度0で、環の構造も多重結合も持たないことを意味する。
(具体的な解き方)
第3級のアルコールは、水酸基の付け根の炭素が第3級であるのだから、hexane の構造異性体すべて(全5種類)を書き、そのうちの第3級炭素の位置で、水素を水酸基に置き換えることで目的の構造をすべて書くことができるはずである。
答えのアルコールは3種類ある。
(解答例)
hexane の構造異性体は、以下の5つ。
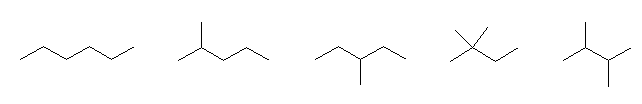
左より、hexane, 2-methylpentane, 3-methylpentane, 2,2-dimethylbutane, 2,3-dimethylbutane
第1級炭素には青、第2級炭素には緑、第3級炭素には赤でマルをつけた。ただし、分子の構造から互いに等価なものは、一方のみにマルをつけてある。
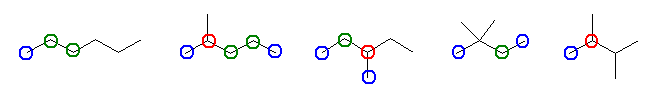
第4級炭素にはマルをつけていない。それぞれの炭素上の水素を水酸基に置換することにより、互いに異性体の関係にあり、重複のないアルコール C6H14O の、全17種類の構造を得ることができる。
第3級炭素上(赤マル)の水素を水酸基に置換して得られる第3級アルコールは、次の3種類。
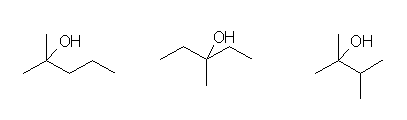
左より、2-methylpentan-2-ol, 3-methylpentan-3-ol, 2,3-dimethylbutan-2-ol
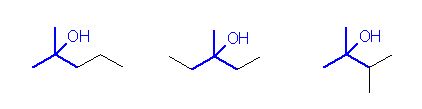
(発展)の項に書いたことは、次の図で理解できると思います。
(発展)
答えに辿り着く別の思考ルーチンとして、次のようなものもありえる。
第3級のアルコールを構成するためには、中心となる第3級の炭素、その炭素上の3つのアルキル基、第3級炭素上の水酸基が必要である。すなわち、最低限の構成要素を持ったものとして、2-methylpropan-2-ol (tert-butyl alcohol)が考えられる。これは、炭素数が4なので、このアルコールに炭素を2つ増やす方法を考える。第3級炭素上の3つのアルキル基炭素を A, B, C とするときに、残り2つの炭素が A, A 上にあるパターンとして、メチル基2つで存在するもの、エチル基で存在するもの。残り2つの炭素が A, B 上に2つのメチル基として存在するもの。以上3通りが考えられ、それぞれ、上の解答例に示した構造と対応している。
3.24
a) と d) は、主鎖がシクロヘキサン環である(主基である水酸基がシクロヘキサン環に結合しているため)。位置番号を決める際には、環状構造ではどこからでも数え始めることができるので、主基の位置が1になることが優先される。
b) は、主基である水酸基が結合している炭素鎖のうち、最も長くなるように選ぶ。b), c) においては主基の位置番号が1である必要はない。左右のどちらかの端から順に番号をふり、主基の位置番号がなるべく小さくなるように選ぶ。
(解答例)
a) 4-chloro-3-ethylcyclohexan-1-ol
シクロアルカン上に主基が1つしかない場合に、その位置が1になるのは確定である。そのため、主基の位置番号を省略することもある。
b) 7,8-dimethylnonan-3-ol
主基の位置番号を小さくする方が優先。従って、2,3-dimethylnonan-7-ol は誤り。
c) 1-bromo-5,5-dimethylheptan-3-ol
d) 4-methylcyclohexan-1-ol
a) と同じ都合により、主基の位置番号を省略することもある。
3.25
アミンの級数は、窒素上のアルキル基の数によって決まる。アルコールでは、水酸基の結合した炭素の級数であったが、アミンではアミノ基の結合した炭素の級数ではない。
(解答例)
a) 主基は存在しない。臭化物(臭化アルキル、アルキルブロミド)(ハロゲン化物、ハロゲン化アルキル、アルキルハライド)として考えるなら、第3級である。
置換命名法 : 2−bromo-2-methylpropane
官能種類命名法 : tert-butyl bromide, または 1,1-dimethylethyl bromide
官能種類命名法による名称の日本語表記は、「臭化tert-ブチル」または「tert-ブチルブロミド」など。なお、tert-butyl 基は、慣用名であるが、分岐アルキル基としては唯一、優先名 PIN の中で使用することが認められている。(ただし、官能種類命名法であるという点で、tert-butyl bromide は、すでに優先名 PIN としては正しくないが。)
b) 第3級のアルコールである。
置換命名法 : 2-methylpropan-2-ol
官能種類命名法 : tert-butyl alcohol, または 1,1-dimethylethyl alcohol
c) 第1級のアミンである。
置換命名法 : 2-methylpropan-2-amine
官能種類命名法的な置換命名法 : tert-butylamine, または (1,1-dimethylethyl)amine
官能種類命名法的に命名する際に、アミンの場合は、「アルキル基名」と
「アミン」の間にスペースが入らないことに注意する。
(発展)
なお、c) の構造について、アミノ基を水素に戻した母体化合物 CH(CH3)3 は、(2013勧告では、PIN として不許容となる)慣用名 isobutane をもつが、isobutane は誘導体を作ることができない慣用名である。従って、methane → methan-amine と同じロジックで、isobutan-amine とすることはできない。(methan-amine と記載したが、音節の区切りを表すハイフンは、通常は改行時以外には書かない。)
3.26
まず、アミンの体系名(アルカン + アミン)を書けるようにすること。官能種類命名法的なもの(教科書では「慣用名」と書かれているもの。アルキル + アミン)は、かならずしも書けなくてもよいが、アルキル基名を体系名の規則で書いてやれば書ける。
(解答例)
a)
hexan-1-amine
hexylamine
第1級のアミン
b)
N-(2-methylpropyl)butan-2-amine
主基であるアミノ基が結合しているもので比較して、右側のアルキル基は炭素数4で、左側のアルキルよりも長いので主鎖とする。従って、butane + amine で(eは母音の重複により落ちて)butan-2-amine となる。慣用名 isobutyl 基(優先名 PIN では使用できない慣用名なので、この授業では非推奨)、複合置換基名としては 2-methylpropyl 基が、butan-2-amine の窒素上に置換している。
第2級のアミン
c)
N-ethyl-N-methylethanamine
diethylmethylamine
第3級のアミン
はじめの置換命名法における母体は、ethanamine。窒素上に、エチル基とメチル基が置換している。
官能種類命名法的な置換命名法では、アルキル基名を列挙してから最後に「アミン」を付す。アルキル基名間、および接尾語である「amine」との間にスペースは入らない。
(発展)にも記すように、× N-ethyl-N-methylethylamine は誤り。
d)
N-propylbutan-1-amine
主基の位置番号(-1-)を忘れないこと。
butylpropylamine
第2級のアミンである。
e)
N,N-diethylpropan-1-amine
diethylpropylamine
第3級のアミンである。
(発展)にも記すように、× N,N-diethylpropylamine は誤り。
f)
N-ethyl-3-methylcyclopentan-1-amine
主基の位置番号が -1- なのは自明なので、省略されることがある。
第2級のアミンである。
b), f) については、官能種類命名法的な置換命名法は使用できない。アルキル基名を複合官能基としてしか命名できないため。
(発展)
b) について、補足。
官能種類命名法的な置換命名法では、「アルキル基名」「アルキル基名」「アミン」となる。スペースは入らない。そのため、アルキル基名に慣用名を用いた場合は、次。
sec-butylisobutylamine
sec-butyl 基は、b で始まる置換基名、isobutyl 基は、i で始まる置換基名なので、この順である。
この両アルキル基名は、慣用名で、優先名 PIN では使用できない。従って、このsec-butylisobutylamine
は、優先名 PIN としては正しくない。(この官能種類命名法的な置換命名法は、アルキル基名が単純である場合に限定されて許容される(と思われる)が、そうすると、複合官能基名を使用して、(1-methylpropyl)(2-methylpropyl)amine と命名するのは正しくないと思われる。)
「アルカンアミン」という名称を与える置換命名体系と、「アルキルアミン」を与える官能種類命名法的な(変則)置換命名体系を適当にいり混ぜたりしてはいけない。そのため、「位置番号+置換基名」+「アルキルアミン」とはならない。(必ず、「位置番号+置換基名」ときたら「アルカンアミン」となる。)
たとえば、b) を N-isobutyl-sec-butylamine と書くと、sec-butylamine
に対しての置換命名ということになるので、オカシイ。(当然、さらに、sec-butane は存在しないから、N-isobutyl-sec-butanamine ともならない。)また、N-isobutyl-N-sec-butylamine と書いたとしても、「amine」という存在しない母体の窒素上に2つのアルキル置換基がある、という表現なので、これもオカシイ。(置換命名法の体系上、「アミン」は接尾語であり、アルカンアミンであれば母体となるが、母体「アミン」は存在しない。比較対象として、2-ブロモエタノール であれば正しいが、アルコールを示す母体「オール」を母体とした、誤った命名 メチルオールがオカシイことと一緒である。)
同様のことは、c) 以降についても言えて、次のような例は、すべて間違い。
× N-methyl-diethylamine
× N-ethyl-N-methyl-ethylamine
× N,N-diethylpropylamine
3.27
たとえば、a) では、主鎖+主基である、1-プロパンアミン(プロパン-1-アミン, propan-1-amine と書くことを推奨。)の構造を書く。ついで、側鎖を書き込んでいく。この場合は、アミノ基の位置が1であることから、2位炭素、3位炭素の位置が決まる。また、アミノ基窒素上の置換基は、位置番号に相当するところが 1- などとなる代わりに、N- となっていることに注意する。
d) と f) は、「3つのアルキル基名」+「アミン」という、官能種類命名法的な命名構造になっている。窒素上に3つのアルキル基の結合した、第3級アミンである。
(解答例)
a)
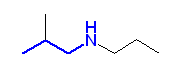
b)
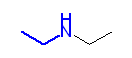
c)
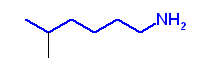
d)
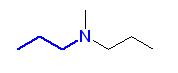
e)
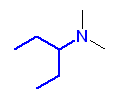
f)
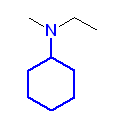
(いろいろと補足)
a) について、どちらで数えても同じ炭素数3であるのに、母体が構造式で窒素より左の propanamine であって、右側の propanamine ではないのは、主鎖上の分岐置換の数の多い方を主鎖に選んでいるからである。
b) は、官能種類命名法的な置換命名をするならば、diethylamine である。
c) 官能種類命名法的な置換命名をして、isoheptylamine と命名するのは誤り
isoheptane という慣用名は存在するが、isoheptyl 基は(優先名 PIN のみならず、一般名 GIN としても)慣用名として認められていないため。
isopropyl, isobutyl, isopentyl, isohexyl は、優先名 PIN では使用できないが、一般名 GIN では許容される。これより炭素数の多い分岐アルキル基に iso〜 という慣用名は無い。
複雑なようだが、優先名 PIN で使用できる分岐アルキル基の慣用名は、tert-butyl ただ一つのみで、他は一般名 GIN で使用可能であるかどうかは別にして一切使用しない、ということにしておけば単純化できる。
d) 置換命名によれば、N-methyl-N-propylpropan-1-amine
f) 置換命名によれば、N-ethyl-N-methylcyclohexanamine
3.28
教科書の言うところの慣用名は書かなくても OK とする。
主鎖の選定の優先順位に即してみてみる。
(1) 主基が最多の鎖を第一優先とする。いずれの分子も、アミノ基が1つしかない。つまり、アミノ基(窒素)と結合している部分を主鎖に選ぶ。これにより、b) と d) は、主鎖がシクロヘキサンと決まる。
(2) 環 > 鎖。 一つのアミノ基に、シクロアルキル基とアルキル基が結合しているような場合には、シクロアルカンアミンが優先されるということ。この問いの選択肢の中では、この(2) の条件で選ばれるようなものはない。
(3) 連続した鎖長が長いものを主鎖とする。c) はこれにより主鎖が決まる。
(解答例)
a) 6-methylheptan-1-amine
× isooctylamine は誤り。3.27 の解答例の補足 c) をみよ。
第1級アミン
b) cyclohexanamine
cyclohexylamine
第1級アミン
c) 4-methyl-N-propylpentan-1-amine
isohexylpropylamine(非推奨)
第2級アミン
非推奨なのは、isohexyl 基が優先名 PIN で使用することのできない慣用名であるため。
d) 2,5-dimethylcyclohexan-1-amine
シクロヘキサン環上の主基の位置番号(-1-)は、省略可。
第1級アミン
官能種類命名法的な置換命名は、アルキル基を複合置換基(2,5-dimethylcyclohexyl) として命名しないといけないため、適用できない。
3.29
酸素、窒素も、sp3 混成をとる場合、基本構造とすると正四面体型の対称性をとることになるので、基本の結合角は、109.5度である。しかし、孤立電子対は、σ 結合よりも反発が大きいので、水、アルコール、エーテルにおいては、2対ある孤立電子からの反発が大きいために、2本の σ 結合間の結合角は小さくなり約 105 度、アンモニア、第1級、第2級、第3級アミンにおいては、1対の孤立電子対からの反発が大きいために、2本の σ 結合間の結合角は小さくなり約 107 度となる。第4級のアンモニウム塩では、孤立電子対は存在せず、4本の σ 結合間の反発となるので、再びメタンなどと同じ、基本の結合角 109.5 度に戻る。
(解答例)
a) 約 105 度
b) 約 107 度
c) 約 105 度
d) 約 110 度
3.30
教科書 p103 の表などを参照せよ。
(解答例)
直鎖アルカンの系列の中では、pentane が答えに当たる。
pentane の沸点は、36.1 ℃ であり、室温(25 ℃)では液体である。炭素数の1つ少ない butane では沸点が -0.5 ℃であり、室温で気体となる。
アルカンは、枝分かれがあると同じ分子量であっても表面積が相対的に小さくなるから、分子間力が弱くなる傾向にある。すなわち沸点が下がる。教科書 p130 の構造と沸点の図をみてください。2-methylbutane(慣用名 isopentane)では、沸点が 27.9 ℃と下がり、室温で液体であるが、同じ分子量の 2,2-dimethylpropane(慣用名 neopentane)では、沸点が 9.5 ℃となり、ついに室温で気体となる。
問いの内容は、室温で液体である中で最も分子量の小さい炭化水素は何か、ということである。いまのところ、pentane および、その異性体である 2-methylbutane が解の候補であるが、これより分子量が小さく、かつ室温で液体の炭化水素があるだろうか。教科書 p103 の表の中には、これに該当するものはない。(直鎖アルカンの系列では、分子量が小さいほど沸点が下がる。)ならば、もう1点検討すべきは、butane の骨格異性体である。2-methylpropane(慣用名 isobutane)は、直接この表の上から沸点を知ることはできないが、アルカンが分岐をもつと同じ分子量でも沸点が下がることから類推するに、-0.5 ℃よりも低い沸点をもつことが予想される。したがって、室温では気体であるだろう。(実際に、データを調べてみると、-11.7 ℃という数値がみつかった。)
というわけで、やっと答え。pentane および 2-methylbutane
3.31-3.40
3.31
a) 「同じ分子同士で水素結合をする」ということは、「水素結合に関与できる水素を持つ」(すなわち、酸素、窒素、フッ素に結合した水素を持つ)ことと「その水素を受け取ることができる」(すなわち、酸素、窒素、フッ素上の孤立電子対をもつ)という2つの条件がが、同時に成立するということを意味する。
b) エタノールは、水素結合に関与できる水素をもち、また、その水素を受け取る孤立電子対も併せ持つ。従って、エタノールと水素結合をするためには、a) で示した条件2つのうち、どちらか一方のみを満たせばよい。もちろん、両方をあわせ持つ分子でもよい。
(解答例)
ヒントに述べた観点から調べてみる。
1) 2-ethoxyethanol
CH3CH2OCH2CH3OH
水素結合に関与できる水素を持つ。また、水素結合を受け取るための孤立電子対もある。
そのため、同じ分子同士でも水素結合できるし、エタノールとも水素結合が可能である。
2) N,N-dimethylethanamine
CH3CH2N(CH3)2
水素結合を受け取るための孤立電子対はあるが、窒素に直接水素が結合していないから、水素結合に関与できる水素がない。
そのため、同じ分子同士では水素結合できないが、エタノールからの水素結合を受けることが可能である。
3) 1-bromobutane
同じハロゲンであっても、臭素は水素結合を受け取る能力はない。酸素、窒素、フッ素に結合した水素も、酸素、窒素、フッ素の孤立電子対もないから、水素結合を与えることも受け取ることもない。
4) N-methylpropan-1-amine
CH3CH2CH2NHCH3
水素結合に関与できる水素をもつ。水素結合を受け取るための孤立電子対もある。
そのため、同じ分子同士でも水素結合できるし、エタノールとも水素結合が可能である。
5) butanoic acid
CH3CH2CH2C(=O)OH
水素結合に関与できる水素をもつ。また、水素結合を受け取るための孤立電子対もある。
そのため、同じ分子同士でも水素結合できるし、エタノールとも水素結合が可能である。
カルボキシ基には、2つ酸素があり、どちらの酸素でも水素結合を受け取る能力はある。しかし、酸−塩基の章で学んだように、カルボニル(C=O)の構造は強く分極している(水酸基酸素よりもカルボニル酸素の方が大きな負の部分電荷 δ- をもつ)ため、水素結合を受け取りやすい。
6) 1-fluorobutane
CH3CH2CH2CH2F
水素結合に関与できる水素は持たないが、フッ素原子が、その孤立電子対を用いて、水素結合を受け取ることが可能である。
そのため、同じ分子同士では水素結合できないが、エタノールからの水素結合は受けることが可能である。
3.32
「沸点が高い」=「分子間力が強い」である。
分子間力には、
もっとも弱く、すべての分子間に働く、ファンデルワールス力
中程度であり、極性分子をもつ分子間に働く、双極子-双極子相互作用
上記2つよりずっと強い、水素結合
などがある。従って、水素結合性の分子の場合は、水素結合が分子間力に対して支配的になる。
ここで、問いの対象となっているところでは、その「水素結合の程度に差があること」が「沸点の違い」となっているのであるから、その水素結合の程度に差がある理由を示すことが求められている。
(解答例)
水素結合に関与する水素および孤立電子対を数えると次表のようになる。
| 水素数 | 孤立電子対数 | 1分子あたりに可能な水素結合本数の平均値 | |
|---|---|---|---|
| 水 | 2 個 | 2 対 | 4 本 |
| メタノール | 1 個 | 2 対 | 2 本 |
| アンモニア | 3 個 | 1 対 | 2 本 |
| フッ化水素 | 1 個 | 3 対 | 2 本 |
a), b), c) は、いずれも、主にこの水素結合の本数の影響で説明可能である。水以外の分子は、水素結合を与え(1本)、同時に水素結合を受け取り(1本)、平均的には、直鎖状にならんだ水素結合の形態をとることができる(※)のに対し、水では、同時に2本の水素結合を与え、同時に2本の水素結合を受け取るため、氷(融点以下に冷やされて固体となった水)においては、水分子が水素結合により互いに連結した3次元的なネットワーク構造をとる。
液体の水、ましてや沸点近くでは、水分子がネットワーク構造にとどまっているわけではないし、互いに自由に動き回っているのであるから、「1分子あたり4本の水素結合を持っている」という記述は正しくない。あくまでも、構造的に可能な最大本数の平均が4本であるということである。だが、沸騰して気化していく際に、アンモニアなどに対し、2倍の数の水素結合を切らなくてはいけないだろうことは、おそらく変わらないだろう。(発展)の項でも考察しているように、水の沸点における水素結合の影響(分子量から推測される値からの上昇値)は、アンモニアにおけるものと比較しておよそ2倍程度になっているのは、この水素結合の本数の影響であると考えられる。
(※)たとえば、メタノールには孤立電子対が2対あるから、ある1つの分子に着目したとき、1本の水素結合を与えると同時に、別の2分子より2本の水素結合を受けることが構造的には可能であり、その場合、その分子は計3本の水素結合をもつことになる。しかし、そのような枝分かれのある水素結合の連鎖の構造を考えたとしても、メタノールは、平均的には1分子あたり2本までの水素結合しかとることができない。水素結合に使用される孤立電子対の数と水素の数が同じであるから、集団としてみたとき、メタノールの孤立電子対の半数は水素結合できずに残されているからである。
アンモニアやフッ化水素についても、1分子あたりの形式的な最大の水素結合の可能本数は、水と同じ4本であるが、同じ議論により、平均的には2本である。
d) は、互いに可能な水素結合の本数が同じであるので、元素の種類の違いによる水素結合の強さについて考察しなくてはならない。(発展)の項でも考察しているように、フッ化水素の沸点における水素結合の影響(分子量から推測される値からの上昇値)は、アンモニアにおけるものの約1.5倍程度である。
教科書では、これを、「フッ素がより電気陰性であるために、より大きく負に帯電しているため、水素結合がより強い」ためであると表現している。同じく電気陰性度の差に由来して、フッ化水素分子がアンモニアより大きく分極しているために、双極子-双極子相互作用も当然大きくなっているはずである。水素結合と、この双極子間相互作用は、完全に分離して議論することはできないかもしれない。
ただし、厳密な理論付けはさておいて、水素結合の強さは、一般的に電気陰性度の強さの順となっており、また、窒素や酸素上に電子供与性の置換基であるアルキル基が少ないほど強くなるという傾向があるという事実は、忘れないようにしよう。(教科書では、同じ分子量であれば、アミンよりアルコールの方が沸点が高く、また、アミン間では同じ分子量であれば、第1級より第2級のアミンの方が沸点が低くなることが述べられている。)
(発展)
「化学」の教科書にも同じ図がでていたと思うが、水素化合物の沸点をグラフ化した図を示した。
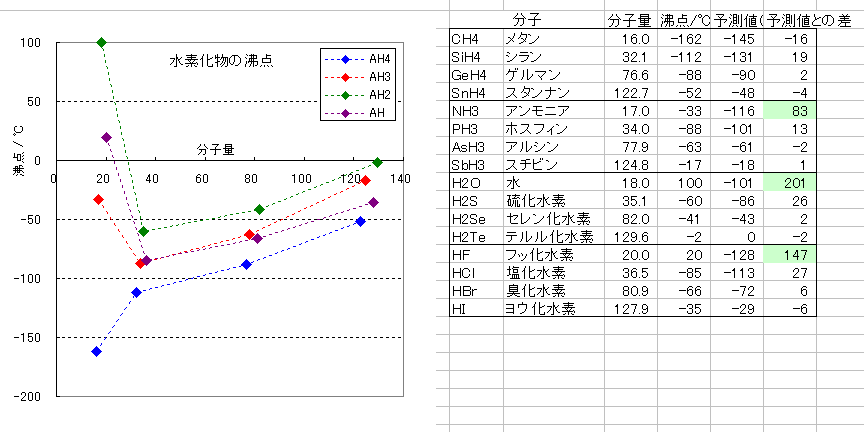
メタン、シラン、ゲルマン、スタンナン(14族元素の水素化合物)のシリーズについて、分子量と沸点の間にほぼ直線関係が認められた。これは、ファンデルワールス力が分子の大きさに依存していることに由来する。最小二乗法により、この直線の式は y = 0.9093 x - 159.66 であることが分かったので、他のシリーズについても、同じ傾きを持つ式で、分子量より沸点を予測できるものと仮定した。このときの切片の大きさは、第3周期および、第4周期の元素の沸点がほぼ正しく推定できるよう、適当に定めた。
表から読み取れるように、アンモニア、フッ化水素、水の3種以外は、沸点と、上記推定値の差は、30 K 以内にとどまった。
(硫化水素と塩化水素で、やや推定値より高い沸点であった。水とフッ化水素は、水素結合の影響により沸点が高くなることが既知である。第2周期の硫黄や塩素でも、典型的な水素結合とはいえないまでも、やや水素結合の影響があるようにも見える。しかし、本質的に、孤立電子対を持たないために水素結合のありえない第14族元素の水素化合物のシリーズにおいても、第2周期のケイ素の水素化合物で、推定値よりやや高い沸点となっていることを考慮すると、硫化水素や塩化水素においてみられる沸点の上昇値(予測値との差)が、水素結合(的な相互作用)の影響があると結論できるほどの差ではないと判断される。)
さて、この表から読み取るべき大事な点として、水素結合による沸点の上昇度(分子量から予測される沸点の予測値と、実測の沸点の間の差)が、水では、アンモニアの2倍程度、フッ化水素ではアンモニアの1.5倍程度となっていることである。(この問いでは、この差の理由が問われている。)
3.33
「沸点が高い」=「分子間力が大きい」である。
まず、水素結合性の置換基を持つものと持たないものに分けて考える。
1) 水素結合性の置換基をもたないもの。
ファンデルワールス力が主な分子間力である。ファンデルワールス力は、分子の表面積が大きいほど強い。
2) 水素結合性の置換基(アミノ基、水酸基)をもつもの。
フッ素も水素結合するが、フッ化水素以外では、フッ素上に水素を持たないから、同一種の分子のみで水素結合を形成するためには、アミノ基か水酸基が必須である。酸素の方が、電気陰性度が高いので、水酸基による水素結合の方が強い。すなわち、他の条件が同じなら、アミンよりアルコールの方が沸点が高い。
(解答例)
最も沸点が高いものから、沸点が低くなる順に記述する。
propane-1,2,3-triol
butane-1,2-diol
水酸基の数が増えるに従って、水素結合の影響で沸点が上昇する。沸点の議論とは関係ないが、命名時、「〜diol」「〜triol」は、子音で始まるので、主鎖アルカンの最後の e が省略されないことに注意されたし。
pentan-3-ol
pentan-3-amine
アミノ基か水酸基かの差以外は同じものの比較では、アミンの方が沸点が低い。これは、水素結合が、電気陰性度の高い酸素を含む水酸基の方が強くなるため。
hexane
3-methylpentane
最後の2つは、水素結合性の置換基を持たない。同じ分子量(どちらも C6H14)の場合、分岐があると、表面積が小さくなり、ファンデルワールス力が弱くなる。
3.34
a)、b) は水素結合性の置換基を持たないから、ファンデルワールス力の大きさが分子の表面積によって決まることを思い出せばよい。
c) も水素結合性の置換基をもつもの、持たないものに分けた上で、a)、b) と同様に判断する。
(解答例)
沸点が高い(分子間力が強い)ものから、低くなる順にならべる。
a) 1-bromohexane > 1-pentane > 1-bromobutane
b) nonane > octane > 2-methylheptane > 2,2,3,3-tetramethylbutane
nonane 以外は、C8H18 の構造異性体。
c) pentan-1-ol > butan-1-ol > 1-chlorobutane > pentane
1-chlorobutane と pentane では、炭素数は少ないものの、1-chlorobutane の方が、分子量が大きい(※)。
また、pentane はほとんど極性結合がないが、1-chlorobutane では塩素-炭素間の結合が分極しており、双極子間の相互作用も期待できる。
※ R が共通なら、R-CH3 より、R-Cl の方が分子量は大きいですね。
分子量が大きくなると沸点が高くなる傾向にあるのは、あくまでも分子間力であるファンデルワールス力が大きくなるからです。「分子が重くなるから、(重力の影響により)気化しにくい」というイメージは間違いです。ある液体の沸点は、周囲の圧力でのみ決まるので、重力の強さは関係ありません。(蒸気圧が外圧と等しくなる点が沸点です。蒸気圧の大小に重力は関係ない。)
そうすると、直鎖のアルカンと分岐アルカンのところで説明したように、分子の表面積を比較したくなります。次図は、Cl-CH3 を空間充填モデル(space filling model)の方式で表した分子模型の図です。
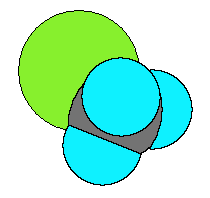
なんとなく、-CH3 基も、-Cl 基も、両者ほぼ同じ大きさに見えます。むしろ、凹凸のあるぶん -CH3 基の方が表面積は大きいようにも見えます。これは、上で出した結論とは逆です。では、どのように考えるのでしょうか。
ファンデルワールス力の正体は、教科書では p129 あたりから説明しているように、分子内での電子のゆらぎに応じた瞬間的な分極(双極子)と、その瞬間的な分極によって隣接する分子に誘起される双極子との間の引力的な相互作用でした。分子同士がほぼ接しているときに働くので、隣接する分子と触れ合うことのできる表面積が大きいほど、ファンデルワールス力は強くなるのでした。
この観点から、-CH3 基と -Cl 基を比べてみます。炭素が L 殻が最外殻であるのに対し、塩素の最外殻は M 殻です。そのため、塩素の方が最外殻の電子に対する原子核からの束縛が緩く(イメージとすると、原子核からの距離が遠いので、でOKです)、したがって電子がゆらぎやすいのです。結果、ファンデルワールス力が強く働くことになります。
まあ、このあたりは、3.32 の発展の項にまとめた、各種元素の水素化合物の沸点のところとも合致していると思います。
とまあ、理屈はあるのですが、「分子量が大きいほどファンデルワールス力が強い傾向にある」というまとめにしておいて、大丈夫そうだということです。
3.35
アルコールやカルボン酸が水にとけていくときには、水酸基やカルボキシ基が水分子と水素結合することができる。また、水素結合できないものであっても、電荷または部分電荷をもつような構造は、水のもつ双極子との間で相互作用することができる。
b) では、水酸基1つあたりの炭素数で比較するとわかりやすい。
(解答例)
水に対する溶解度の大きいものから、小さいものの順で並べると
a) 3-hydroxypentanoic acid > pentanoic acid > pentan-1-ol > pentane
b) propane-1,3-diol (>) propan-1-ol > butan-1-ol > 1-chlorobutane
propan-1-ol と propane-1,3-diol は、ともに水と任意の割合で混和する。つまり、水に対する溶けやすさに差があるとは言えない。とはいえ、理屈としては水酸基に対する疎水部の割合(水酸基1つあたりの炭素数)の小さな propane-1,3-diol の方が、水との親和性は大きいともいえる。
pentanoic acid(慣用名 valeric acid, 吉草酸。「吉草」とは、セイヨウカノコソウという薬用植物。)の水に対する溶解度は、2.4 g -100 mL水。水と任意の割合で混ざるわけではないので、β-ヒドロキシ吉草酸の溶解度はデータが見当たらなかったが、上の通りの順で問題ないはず。
なお、炭素数の1つ少ない butanoic acid(慣用名 butyric acid, 酪酸。バター由来の命名。)は、水と任意の割合で混和する。
(発展)
低級のアルコールの場合、水酸基1つあたり炭素数3つまでは特に問題なく水に溶ける。
炭素4の1価のアルコールでは、butan-1-ol と butan-2-ol は、少量水にとけるが任意の割合で混ぜることはできない。これに対し、2-methylpropan-2-ol は、任意の割合で水と混ぜることができる。(溶解度が無限大であるという表現をすることもある。)
この違いは、融点や沸点のところで見た、ファンデルワールス力の大小と同じように考えることができる。アルキル基は疎水性であり、水分子の間に混ざっていくとき、水分子間の水素結合や双極子間相互作用を切っていくことになる。その分不安定化が生じる。従って、同じ炭素数であってもその表面積が小さいほど、あらたに生じる不安定化は小さいということになる。
3.36
極性を持たない分子は、極性のない溶媒中で安定である。逆に極性分子やイオンは極性の高い溶媒中で安定である。
とはいえ、不適切な問題です。あるいは、翻訳者の配慮が不足していたのか。ここでは「溶けやすさ」ではなく、親和性の大小を問われていると思って解答してください。
(解答例)
cyclohexane は、無極性の分子である。hexane のように無極性の溶媒とは親和性が高い。逆に極性の高い溶媒とは親和性が低い。このリストの中では、アルコール2種が、その候補となるが、炭素数の少ない(疎水部の割合が小さく、分子全体に占める水酸基の割合が大きい)ethanol がもっとも高極性である。
とはいえ、cyclohexane は、ethanol と任意の割合で混和する。(※)
つまり、ethanol より極性の低い溶媒は、すべて cyclohexane と任意の割合で混和するということであり、「溶けやすさ」(や、溶解度)には、差がない。
(※)シクロヘキサンの安全データシート(外部リンク)
3.37
pentane のC2-C3 結合、 CH3-CH2-CH2-CH2CH3 の廻りの回転によって生じる配座をすべて書くように指定されているとき、C3-C4 など、他の結合軸の廻りの回転によって生じる配座は無視してよい。すなわち、C1 部分は、まとめてメチル基 -CH3 (または、-Me)とし、C4-C5 部分はまとめてエチル基 -CH2CH3 (または、-Et)として書いてよい。
つまり、この問題は、butane のC2-C3 結合の廻りの回転によって生じる配座を書く問題と類似である。(C3 上の -CH3 メチル基を、ペンタンでは、-CH2CH3 エチル基に変える。)
配座異性体のポテンシャルエネルギー図と、それぞれの二面角に対応する配座をNewman 投影図で書く。
この時の手順は、
1) はじめに60度きざみの二面角で配座を書く。
2) それぞれの配座のもつ歪みを数え上げ、その和を、ポテンシャル図上に点として書き込む。
3) これらの点を、極大値、および、極小値となるように、滑らかな線で結ぶ。
配座を書くための具体的な手順。
1-1) 分子の構造式を書き、どの結合軸の周りの回転を扱うのか、確認する。
1-2) 手前側の炭素についている3つの置換基が何かを把握する。同様に、奥側の炭素についている3つの置換基が何かを把握する。それぞれの中から二面角の基準にする置換基をひとつずつ定める。特にルールがあるわけではないから、自分で適当に選んでよいが、たとえば、もっとも大きいもの、などとするとわかりやすいかもしれない。
1-3) 二面角がゼロの基準となる重なり形配座を書き上げる。自分で基準にとった置換基を、上方向(時計の12時の方向)に書くように決めておくなどするとわかりやすい。
1-4) 結合軸の周りをまわすとき、手前の炭素か、または奥側の炭素のいずれかは固定し、いずれかの置換基をずらすように動かすことになる。どちらの炭素を固定するのかは任意だが、教科書 p141 の例では、奥側の炭素が固定されている。固定された炭素上の置換基のならびは、これから書くすべての配座の Nuwman 投影図において、同じ位置に描かれることになる。
1-5)回転角 60度刻みなので、ねじれ形と重なり形が交互になるように、Nueman 投影図の基本部分(マルと6本の線)を書き上げる。 1-6) 固定されているほうの炭素上の置換基を、すべて同じ位置に書き込む。
1-7) まわすほうの炭素上の置換基を、60度ずつずらしながら書き込み、完成。
配座のもつ歪みを数え上げる
2-1)重なり形の相互作用は、3組の和を出す。つまり、一組の H-H の重なりにつき 4 kJ/mol、一組の H-CH3 の重なりにつき 6 kJ/mol、一組の CH3-CH3 の重なりにつき 11 kJ/mol のように各部分ごとに分解した値の和として計算する。グラフのおよその形を書くだけの目的のとき、この値が未知ならば、既知の値と大きくは矛盾しないよう、適当な値を仮定しておいてもよい。
2-2) 手前の炭素上、および奥の炭素上の両方に水素以外の置換基がある場合、ねじれ形の配座では、ゴーシュ相互作用を数え忘れないようにする。このとき、H-H のゴーシュの位置関係のひずみは、とくに数え上げる必要はない。
(解答例)
上のヒントに沿って解説していく。
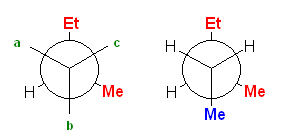
1-1) , 1-2)
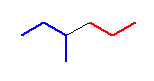
pentane のC2-C3 結合、 CH3-CH2-CH2-CH2CH3 について、配座を書く。C2, C3 のどちらを手前にして投影図を書いても構わないが、ここでは、C2 を手前にすることに決める。C2 上には、メチル基と水素2つが結合している。C3 には、エチル基と水素2つが結合している。2面角を、メチル基とエチル基の間でとることに決めることにする。
1-3)
メチル基(-Me)とエチル基(-Et)が重なり形になった配座を書いた。
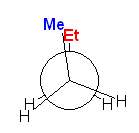
作画の都合上、手前側の炭素からの結合を少し長めにしたが、そういった細かい決まりはないので、見やすく書けていればよい。なお、二面角の基準にする置換基に色をつけてわかりやすくしたが、これも、特に決まりがあるわけではない。
1-4)〜1-7)
手前の炭素を、時計周りに回しながら、60度刻みで作図する。(奥側の炭素を回してもよい。また、回す方向が時計回りを正にとると決まっているわけでもない…が、共感しやすい方式として、時計回りが正ということにしておこう。)
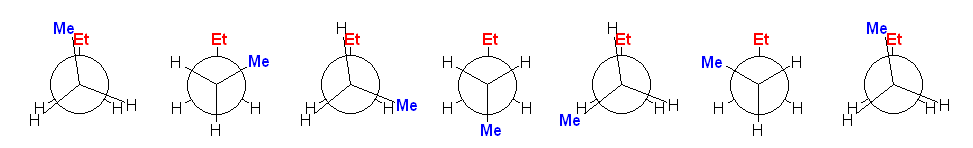
奥側炭素(C3)上の Et 基がすべて同じ位置で止まっていること、手前炭素(C2)上の Me 基が、60度ずつ時計廻りに動いている。そのため、重なり形、ねじれ形、重なり形、ねじれ形、と交互に現れている。0 度から 360 度の範囲で一回転させる場合、0度の配座と360度の配座は、同じものになる。
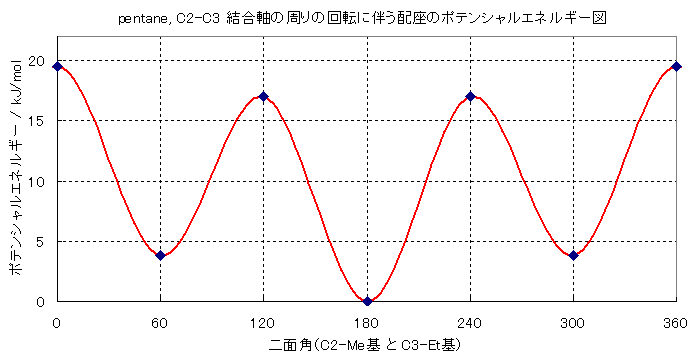
2-1, 2-2))
各配座ごとの歪みの大きさを、成分ごとに見積もることにする。ただし、メチル基とエチル基のゴーシュおよび重なり形相互作用の大きさは、数値が不明なので、仮に、メチル基とメチル基の値で計算する。(実際には、もう少し大きい可能性が高い。)
| 0 度 | 60 度 | 120 度 | 180 度 | 240 度 | 300 度 |
| 重なり形 | ねじれ形 | 重なり形 | ねじれ形 | 重なり形 | ねじれ形 |
| H-H 4 kJ/mol ×2組 Me-Et 11+α kJ/mol | Me-Et ゴーシュ 3.8+α kJ/mol | H-H 4 kJ/mol H-Me 6 kJ/mol H-Et 6+α kJ/mol | ゴーシュ相互作用なし | H-H 4 kJ/mol H-Me 6 kJ/mol H-Et 6+α kJ/mol | Me-Et ゴーシュ 3.8+α kJ/mol |
19+α kJ/mol | 3.8+α kJ/mol | 16+α kJ/mol | 0 kJ/mol | 16+α kJ/mol | 3.8+α kJ/mol |
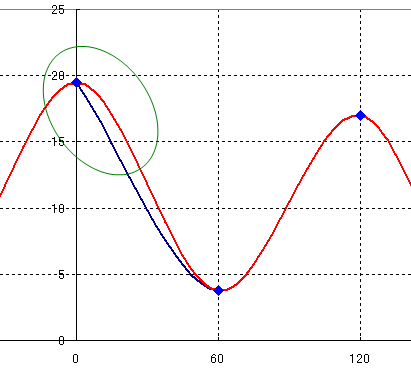
3)
あとは、これらの極大点、極小点をグラフ上にプロットし、滑らかな線で結ぶ。
なお、注意すべきこととして、0 度から 360 度の範囲で図を書こうとすると、往々にして、グラフ端の部分が、次図の青線のようになりやすい。回転は 0 度より小さいところも、360 度より大きいところも連続している。(その点、教科書の図を参照すること。)
3.38
a) の構造は、水酸基の結合している炭素が不斉炭素である(4章参照)が、ここでは、この炭素の立体は無視して考えてよい。
Newman 投影図では、回転について注目している結合軸の手前側と向こう側の2つの原子(炭素原子)が重なるように示されていることに注意する。
(解答例)
構造式は、まず、木曳き台表示(左側)をしてみると、Newman 投影との対応が分かりやすいだろう。図右が一般的な骨格構造式。
a) 3-ethylpentan-2-ol
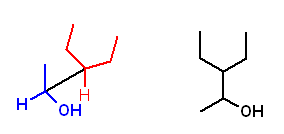
b) 2-methylpentan-2-amine
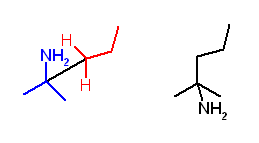
3.39
アルカンにおいて、安定な配座の条件とは
すべての炭素−炭素結合の廻りで、重なり形配座ではなく、ねじれ形配座を持つこと
大きな置換基が、ゴーシュの位置関係に来ないこと
などである。
ここでは、注目している結合についている置換基のうち、それぞれ最大のもの同士が anti 配座になるように作図するとよい。
(解答例)
a) 骨格構造式で書くと、3-methylpentane は次図となる。
まず、C3 上の置換基を書き込んだ Newman 投影図(未完成)が、次図左である。この a 〜 c のいずれかの位置に、C2-メチル基を置くことになる。c の位置は、ゴーシュ相互作用が2箇所存在する(対エチル基、および対メチル基)。a の位置と、b の位置は、いずれもゴーシュ相互作用が1箇所だが、相手の小さな b の位置の方がゴーシュ相互作用の大きさが小さいので、相対的に安定となる。答えは、次図の右。
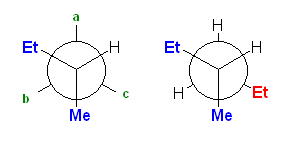
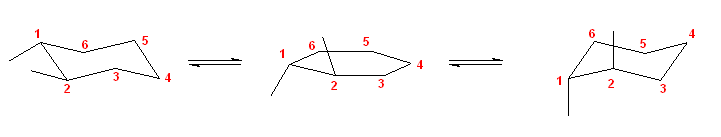
b) 骨格構造式で書くと、3-methylhexane は次図となる。
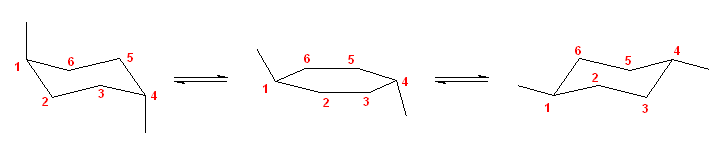
まず、C3 上の置換基を書き込んだ Newman 投影図(未完成)が、次図左である。この a 〜 c のいずれかの位置に、C4-エチル基を置くことになる。b の位置は、ゴーシュ相互作用が2箇所存在する(対エチル基、および対メチル基)。a の位置と、c の位置は、いずれもゴーシュ相互作用が1箇所だが、相手の小さな c の位置の方がゴーシュ相互作用の大きさが小さいので、相対的に安定となる。答えは、次図の右。
c) 骨格構造式で書くと、3,3-dimethylhexane は次図となる。
まず、C3 上の置換基を書き込んだ Newman 投影図(未完成)が、次図左である。この a 〜 c のいずれかの位置に、C4-エチル基を置くことになる。いずれの位置ともに、ゴーシュ相互作用が2箇所存在する。a の位置と、b の位置は、対エチル基、対メチル基のゴーシュ相互作用であるが、c の位置は、対メチル基×2である。対エチル基のゴーシュ相互作用の方が、対メチル基のゴーシュ相互作用より大きいので、c の位置が相対的に安定となる。答えは、次図の右。
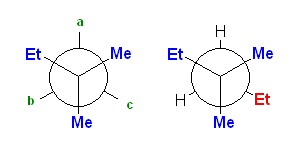
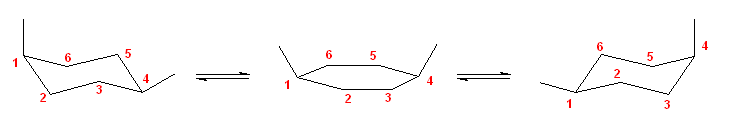
結果的に、いずれも、最も大きな置換基同士が anti の位置にあることに注意するとよい。
3.40
この問題文ですが、読んで言いたいことは分かるけれど、でも変だよね。
ここは、あくまでも平面の中に描かれた数学的な図形の問題として解いてください。だから、「結合角」は、「内角」と読み替えてください。
ちなみに、多角形の外角の和は、360 度になるので、正 n 角形の外角は、360/n 度です。そのため、ひとつの内角は、180-(360/n) 度になります。この式自体は、問題文に与えられているので、n に 8, 9 を代入して計算するだけの問題です。
ただし、これを正八角形から、cyclooctane に変えることが次の段階として想定されているのです。なので、a) の問題は、シクロアルカンの炭素が同一平面内にあり、正多角形をとることを仮定した場合の、cyclooctane の炭素の結合角、ということになるわけです。当然、sp3 混成の炭素を考えるので、109.5 度との差を考えることになります。
実際の cyclooctane は、この問いで算出されるような結合角をとることができないので、「すべての炭素が同一平面内にある」という算出の前提がくずれた構造となっています。
(解答例)
a) 正八角形の内角は、135 度である。
b) 正九角形の内角は、140 度である。
3.41-3.50
3.41
教科書の同ページの「問題解答の指針」を読めば分かるだろうとはいえ、問題文の指示がお粗末すぎます。ヽ(゚Д゚) ノ
修正後「表3.8に示されているシクロヘプタンの歪みエネルギーの大きさ(表中の数値、6.2 kcal/mol = 26.0 kJ/mol)を、シクロヘプタンの生成熱をもとに算出し、表の値となることを確かめよ」
とにかく、表の上の「問題解答の指針」の部分を読んで考えること。
(解答例)
解答の指針に沿って解く。
1) シクロへキサンにひずみがまったくないと仮定する。
シクロヘキサンの生成熱は、-29.5 kcal/mol であるから、メチレン基 -CH2- ひとつあたりの生成熱は、-29.5/6 = -4.92 kcal である。
2)シクロヘプタンは、メチレン基 -CH2- が 7 つ結合しているのだから、もしシクロへキサンにも、同様にひずみがまったくないと仮定すると、その生成熱は、-29.5 ÷6 ×7 = -34.42 kcal/mol であるはずである。
3) しかし、実際のシクロヘプタンの生成熱は、表に示すとおり、-28.2 kcal/mol という値であり、歪みがないと考えた場合よりも、6.2 kcal/mol だけのずれがある。
4) このずれ、生成熱が大きくなる(絶対値は小さくなっているが、負の値なので)のは、分子が歪みをもち、その分をポテンシャルエネルギーが高い状態で存在しているからである。従って、歪みエネルギーは、6.2 kcal/mol である。この値は、表に示されているものを、あらためて計算しなおしたものである。
3.42
「鎮痛剤としての効果は、細胞の非極性の膜を通り抜ける能力と関係がある」→「細胞の非極性の膜を通り抜ける能力が高いと、鎮痛剤としての効果が大きい」→「非極性の構造に対し親和性が高いと、非極性の膜の中に溶け込む平衡の平衡定数が大きくなり、結果として通り抜けやすくなる」→「分子内に非極性の構造、疎水部の割合が大きいほど、非極性の構造との親和性が高い」→ 「非極性な疎水部が大きいほど、鎮痛剤としての効果が大きい」
(解答例)
より長いアルキル基がついたヘキセタールの方が、細胞膜の疎水部との親和性が高く、膜を通り抜ける能力が高い。したがって、ヘキセタールの方が鎮痛剤としての効果が高い。
(発展)
溶液1 ←→ 非極性の(疎水性の)膜内部 ←→ 溶液2
というような平衡により、疎水性の膜を通りぬけ、溶液1より溶液2の部分へ移動することが可能となる。従って、膜の疎水部との親和性が低いような分子は、そもそも疎水性の膜内部に侵入できないので、この膜により区切られてしまい、拡散することができない。
3.43
0) この問題文の「立体異性体」は、「配座異性体」と読み替えて答えてください。
1) この問題で指定されている条件では、教科書には当て嵌まるものを全て書くように指定されているが、それぞれの条件につき、1つずつしか書くことができない。
2) 一般的に配座異性体は室温で相互変換可能なものが多く、立体異性体として区別しない。たとえば、エタンはねじれ形、重なり形の代表的な配座(と、その間の回転角をもつ無数の配座)をもつが、これらを立体異性体として区別することはない。
3) 一般的に、シクロアルカンの立体異性体と指定された場合は、環の上、下によって区別されるような、シス、トランス等の位置関係に由来するものを指す。そのような目的の場合には、シクロヘキサン環は、平面の正六角形の形で書いて差し支えない。
4) 環の反転により、置換基の上下の入れ替えは起こらず、かつ、アキシャルとエカトリアルの入れ替えが起きる。すなわち、a) で解答したすべてのアキシャル位にあるクロロ基は、環の反転により、すべてエカトリアル位にくる。従って、b) の条件を満たす。すなわち、a) で解答した立体異性体と、b) で解答した立体異性体は、配座の違いはあるものの、同一の立体異性体である。
(解答例)
a), b)シクロヘキサンの椅子形配座を書き、アキシャル水素をすべて塩素で置換したもの(下図、左)、エカトリアル水素をすべて置換したもの(下図、右)を書く。
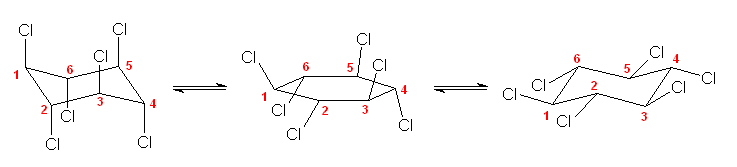
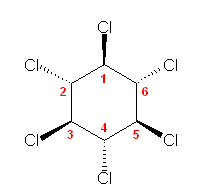
これらは、環の反転により互いに入れ替え可能な配座異性体であり、同一の立体異性体である。この立体異性体を別の書き方をして示すと、次図の通り。
(発展)
シクロヘキサン環の反転は、教科書 p148 に示されるように、半椅子形、ねじれ舟形を経て起こる。そのおよその様子を gif アニメーションにしたので、以下に示す。
このアニメーションでは、ねじれ舟型の代わりに舟型を経由しています。その他、動きは、厳密に正しいわけではありません。イメージ程度の参考にしてください。
とはいえ、左右の炭素(説明の都合上、1, 4 位とします)の上下に伴い、2,3 位の炭素間、5,6 位の炭素間の結合が回転すること、舟型では 2,3 位、5,6 位の水素が重なり形になっていること、が見てとれると思います。
gif アニメーションの作成には、「GIFアニメ工房」というサイトを利用しました。
3.44
ひとつしか置換基を持たない cyclohexane 誘導体において、その置換基がエカトリアル位にある場合には、ひずみは存在しない。エカトリアル位(環を上から見たときに、放射状、外側に向かってでている方向)は、隣接の炭素上の水素との間に十分な距離があるからである。(ただし、1、2位など、隣接した二置換体では、エカトリアル位同士が、二面角 60 度の関係になるため、ゴーシュ相互作用が存在する。)
methylcyclohexane の、メチル基がアキシャル位にあるときの椅子形配座は、教科書 p149-150 にあるように、メチル基と水素の間の 1,3-ジアキシャル相互作用を2組もつ。このそれぞれ1組は、(アキシャル位の)メチル基と、骨格上のメチル基に対して3位の炭素上の水素(すなわち、アキシャルメチル基に対して、骨格の2位から結合している-CH2R 基)の間の立体的な反発であるため、ブタンのゴーシュ配座におけるねじれひずみと同じであるとみなされる。
(発展の項を参照してください。)
この問題では、アキシャルメチル基が、フルオロ基(フッ素)に置き換えられており、それ以外は全く同じ説明ができるはずである。
教科書 p150 の図 3.15 のNewman投影図について、メチル基をフルオロ基に書き換えて調べてみよ。
(解答例)
アキシャル位にフッ素をもつ fluorocyclohexane について調べてみると、フッ素(フルオロ基)と同じ方向を向いたアキシャル水素2つ(3位、5位)との間に、それぞれ同じ大きさの 1,3-ジアキシャル相互作用がある。
下図では、3位アキシャル水素との間の反発について示したが、同様に、5位水素との間にも反発がある。
フッ素がエカトリアル位にある場合にはひずみを全く持たないから、問題文に与えられた 1.0 kJ/mol のひずみは、「フッ素-水素間の1,3-ジアキシャル相互作用×2組」に由来するものである。
つまり、1組の「フッ素-水素間の1,3-ジアキシャル相互作用」の大きさは、0.5 kJ/mol である。
この値が、1-fluoropropane のゴーシュ配座におけるひずみと同じである。
(発展)
methylcyclohexane について、(教科書 p150、図 3.15)のように、メチル基がアキシャル位にあるいす型配座を考える。メチル基の結合した炭素を1位とし、2位−1位および、4位−5位が重なるような視点からみた Newman 投影図を書くと、次の左より2番目の図となる。
ここで、3位の炭素は、メチレン -CH2- であるが、炭素4以降を R と表すことにして、-CH2R として描いたものが、右より2番目の Newman投影図である。その位置関係より、1位炭素上のメチル基が、2位炭素上の「3位炭素を含むアルキル基」との間にゴーシュの位置関係になっていることがわかる。
すなわち、1位メチル基の、3位アキシャル水素との相互作用(立体的な反発)は、本質的に、ブタンのゴーシュひずみと同じであることが判る。(右図)
ここで、注意深く図を見た者は、3位炭素をC2上の置換基としてみたとき、C1上のC6を置換基としてみたものとの間に、同様の60度の二面角が成立している(したがって、ゴーシュ相互作用があるように見える)ことに気づくだろう。しかし、実際には、3位炭素と6位炭素の間のゴーシュ相互作用は数えなくてよい。このことを次に示そう。
Newman 投影図の代わりに、シクロヘキサン環を上から見た図を次に示す。
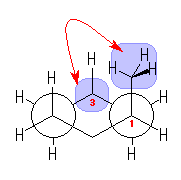
1 位アキシャルメチル基、3位のアキシャル水素、5位のアキシャル水素は、画面に垂直、手前側につきだしている。2位、4位、6位のアキシャル水素は画面に垂直、奥側につきだしている。
3位と6位では、アキシャル水素同士も面をはさんで手前側と奥側であり、十分に離れている。また、6位エカトリアル水素も、3位炭素から離れる方向である画面の上方にのびている。同様に3位のエカトリアル水素も、6位炭素から離れる方向にのびている。結局、3位と6位の炭素の間で、通常のアルキル基同士のゴーシュの位置関係では反発の原因となるような立体的位置関係にあるのは、環の骨格の一部であるC3−C4結合と、C6−C5結合であるということになるが、これらは、C4−C5間で共有結合をすることにより反発を失っている。
すなわち、シクロヘキサン環の骨格を構成している六角形の辺同士については、たとえ、ある結合に沿ってみたときにゴーシュ相互作用があるかのように見えても、実際には反発は生じていない(ので、数えなくてよい)。
3.45
この問いは、Keq の意味がわかれば容易だろう。
着目している置換基がアキシャル位にある配座の濃度を [A] とし、エカトリアル位にある配座の濃度を [E] としたとき、Keq = [E]/[A] である。たとえば、これが 10 であるならば、仮に [A] = 1、[E] = 10 と置いてよい。全体に占める [E] の割合は、[E]/([A]+[E]) なので、10/(1+10) である。
(解答例)
ヒントを参照せよ。
25℃で、平衡時に、水酸基がアキシャル位にある配座の濃度を [A]、エカトリアル位にある配座の濃度を [E] とすると、表の値より、Keq = [E]/[A] 5.4 である。
従って、全体に対するエカトリアル体の割合は、5.4/(1+5.4) = 5.4/6.4 = 0.84
全体のうち、84 % が水酸基がエカトリアル位にある配座をとる。
(発展)
教科書 p149 の上部に記述されているように、シクロヘキサン環は、椅子型配座のみを考えればよい(場合がほとんどである)。無置換のシクロヘキサン環では、椅子形配座に対し、ねじれ舟型配座を取る割合は2/10000程度である。そのため、この問いでは無視してもよい。
もし、これを含めて計算したとするならば、
5.4/(1+5.4+0.0002) ということになり、答えで導いた数値との間での差はほとんどない。
表よりわかるように、椅子形配座とねじれ舟型配座の間のエネルギー差は、2組の tert-ブチル基と水素の間の 1,3-ジアキシャル相互作用とほぼ同じ値である。(平衡定数が 1/4800 で、およそ 2/10000 に等しい。)
このため、「シクロヘキサン環は、椅子型配座のみを考えればよい」に対しての例外として、2つのtert-ブチル基をもつシクロヘキサンで、椅子型配座をとるとき、一方のtert-ブチル基をエカトリアル位にすると、どうしてももう一方のtert-ブチル基がアキシャル位に来なければいけないような立体配置である場合、ねじれ舟型をとり、両置換基がともにエカトリアル方向に向くことがある。
3.46
ここでは、水素以外の置換基が、環の上にあるか、下にあるかを調べよ。もし、ともに上、または、ともに下であるならば、cis 体である。もし、上と下の組であるならば、trans 体である。配座は無視して考えてよい。
※ 「cis 異性体」「trans 異性体」は、「cis 体」「trans 体」(「シス体」、「トランス体」)などと表記してよい。
(解答例)
a) 臭素が下、塩素が下。両者同じ側なので、cis 体。
b) メチル基は上、臭素も上。両者同じ側なので、cis 体。
c) 臭素は下、メチル基も下。両者同じ側なので、cis 体。
d) 臭素は下、メチル基は上。面の逆側にあるので、trans 体
e) 塩素は下、メチル基は上。面の逆側にあるので、trans 体
f) 一方のメチル基(アキシャル位)は上、もう一方(エカトリアル位)は下。面の逆側にあるので、trans 体
(発展)
なお、ここでは2置換のシクロヘキサンについて問題にしており、かつ、2つの置換基の結合位置が異なる炭素である。もし、2つの置換基が同じ炭素上に結合しているようなもの、1,1-二置換のシクロヘキサンであるならば、必ず上と下の組しかとらない。すなわち、これは立体異性体をもつとはいえない。そのため、上と下の組ではあるが、トランス体であるという表現は一般的にはなされない。
シス、トランスと言う表現は2つの置換基の位置関係を示すものである。シクロヘキサン環に対して3つ以上の置換基が結合している場合にも、稀に、シス、トランスを用いて立体異性体を区別する場合もある。その場合は、基準とする置換基を1つ指定した場合に、2つ目の置換基が基準の置換基に対してシス、トランスのいずれであるか、3つ目の置換基が基準の置換基に対してシス、トランスのいずれであるか、といった表現の仕方になる。(例 : 1,c-2,t-3-trichlorocyclohexane :1位の塩素に対し、2位の塩素は同じ側、3位の塩素は逆側に結合したトリクロロシクロヘキサンの立体異性体)
3.47
指定された配座を書き、それぞれのもつ立体ひずみを数え上げること。環反転の前後で、ひずみの差が大きいほど、平衡は安定な配座にかたよる。一般的には、p150 の表3.9 に示されるように、大きな置換基がアキシャル位にあることを嫌う。また、置換基の大きさは、メチルとエチルや1−メチルエチルでは、わずかな大きさの差しかない(これは、エチル基や1−メチルエチル基では、その中でも相対的に嵩高さの小さい方が内側に向いて立体的な反発をなるべく小さくしようとするためである。どう回転させても嵩高さののこる1,1-ジメチルエチル基(tert-ブチル基)では、ほとんどアキシャル位にくることができない。
(解答例)
表 3.9 から示唆されるように、tert-ブチル基がアキシャル位にくると、非常に大きなひずみをもつ。(1置換体において、tert-ブチル基がアキシャル位にくるのは、1/4800 程度、0.02 % しか存在できない。)
これに対し、メチル基は、1/(1+18) により求まる値、約 5.3 % はアキシャル位にくることができる。
したがって、より大きな tert-ブチル基がアキシャルに来るほうが極端に不利であり、trans-1,4-dimethylcyclohexane の方が、ジアキシャル体の存在する割合が(相対的に)多いと予想できる。これは、逆に言い換えると、ジエカトリアル体の割合が多いのは、より大きな置換基(である tert-ブチル基)をもつcis-1-tert-ブチル-3-メチルシクロヘキサンであるということである。
解答はここまででOKです。
さて、念のため、定量的な議論が可能かどうか考えてみよう。
trans-1,4-dimethylcyclohexane について、環の反転の前後の配座を椅子形で示した。
右の ジエカトリアルの配座では、ひずみを持たないのに対し、左のジアキシャルの配座では、緑の矢印で書き込んだ 4組の 1,3-ジアキシャル相互作用がある。これが1組につき、(ブタンのゴーシュ相互作用と同じ大きさである)3.8 kJ/mol であったので、この場合、3.8×4 = 15.2 kJ/mol のひずみをもつ。これを用い、ボルツマン分布式より計算することが可能である。その概略は(発展2)に示した。
計算結果は、(実は p150 の表 3.9 とわずかに差があるが、)メチルシクロヘキサンについて、3.8 kJ/mol×2 のエネルギー差がある場合、Keq = 21 で、この時アキシャル体の割合は、4.5 % である。trans-1,4-ジメチルシクロヘキサンについては、3.8 kJ/mol×4 のエネルギー差があるので、Keq = 462 で、この時ジアキシャル体の割合は、0.22 % である。
この平衡定数は、表 3.9 に与えられた、モノ-tert-ブチルシクロヘキサンについての平衡定数 4800 より小さい。モノ-tert-ブチルシクロヘキサンのアキシャル体の割合は、0.02 % で、すでに、trans-1,4-ジメチルシクロヘキサンのジアキシャル体 0.22 % よりも少ない。
つまり、この時点で、一つのtert-ブチル基がアキシャル位にくるほうが、2つの1,4位のメチル基がアキシャル位にくるよりも不利であることが判る。
なお、cis-1-tert-ブチル-3-メチルシクロヘキサンについても、同様に2つのいす型配座を示した。
tert-ブチル−水素間の 1,3-ジアキシャル相互作用は、(それが2組あったときに平衡定数が 4800 を与えるだけの数値なので)10.5 kJ/mol である。水素−メチル基間の 1,3-ジアキシャル相互作用 3.8 kJ/mol も存在する。更に、tert-ブチル−水素間よりもずっと大きいはずのtert-ブチル−メチル基間の1,3-ジアキシャル相互作用も存在する。少なく見積もって、tert-ブチル−水素間と同じであったと仮定しても、平衡定数は 22000 という値になり、ジアキシャル体は、無視できるほど少量しか存在できない。
(発展)
表 3.9(教科書 p150) に示されるように、1,3-ジアキシアル相互作用の大きさは、メチル、エチル、イソプロピルで(順に大きくなるが)ほぼ同じであるのに対し、tert-ブチル基では急に大きくなる。
以下には、メチル基のもつ 1,3-ジアキシアル相互作用についての図を示す。
1,3-ジアキシャル相互作用の本質は、ゴーシュブタンの立体ひずみと同じ(教科書 p119、図4.14)であり、1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式(上図)で示されるような、C1-置換基と、C3-H の間のゴーシュ相互作用である。
1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式を、置換基がエチル基、イソプロピル基、tert-ブチル基と変化させて示した。
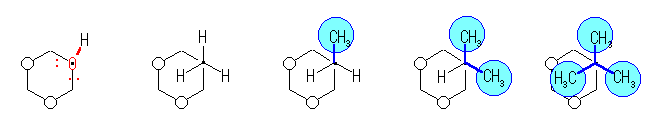
また、C1-置換基軸の方向から(すなわち、シクロヘキサンの環の平面に(ほぼ)垂直な方向から)眺めた時の、1,3-ジアキシャル相互作用の様子を模式的に示した。ただし、白丸は、3位、および5位のアキシャル水素である。置換基は、左より、水酸基、メチル基、エチル基、イソプロピル基、tert-ブチル基である。
なお、水酸基では、酸素上の(水素より小さな)孤立電子対が3位、および5位のアキシャル水素と反発するだけであるのに対し、メチル基、エチル基、イソプロピル基では、置換基の中の C-H 結合が、また、tert-ブチル基では、置換基の中の C-CH3 結合が、それぞれ3位、および5位のアキシャル水素と反発する。
これらの図を比較すると、ゴーシュ相互作用の大きさが、置換基が tert-ブチル基の時以外は、ほぼ同じであるのに対し、tert-ブチル基では特別に大きいことが分かるだろう。
(発展2)
ある状態 A と B の間に平衡があるとき、そのエネルギー差を ΔE とすると、平衡定数 [A]/[B] は、exp(ΔE/RT) で与えられることが知られている(ボルツマン分布式)。
ここで、R は気体定数、T は絶対温度である。(簡単のため、室温においては R×T = 2.5 kJ/mol としてよい。)
これを用いて計算するための、十進BASIC のプログラムを貼っておきます。
SET ECHO "OFF"
LET RT = 8.314*(273+25)/1000
DO
INPUT PROMPT "2つの配座のエネルギー差 (kJ/mol)を入力してください。 ": e
PRINT "2つの配座のエネルギー差が "; e ; "kJ/mol のとき、"
PRINT "室温で、不安定な配座をとる分子の割合は、";
PRINT ROUND (1/(1+EXP(e/RT))*100,2) ;"% です。"
PRINT "平衡定数は、K="; EXP(e/RT) ;"です。"
PRINT
LOOP
END
3.48
a)、b) では、なるべく大きいものが優先的にエカトリアル位にくるように書く。
c) では、それぞれの立体異性体について、環反転を考えたとして、安定な方の配座同士で比較すればよい。(不安定な方の配座は、不安定であればあるほど、実際にその形を分子が取らないのだから、考慮にいれなくてよい。)
(解答例)
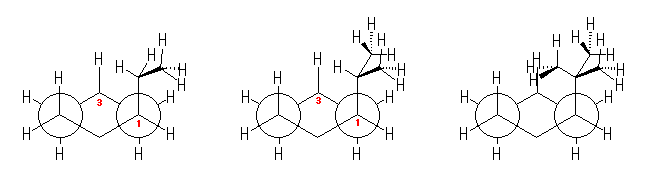
a) 表 3.9(教科書 p150) に示されるように、エチル基とメチル基では、より大きいエチル基がアキシャル位にくるほうが、より不利である。
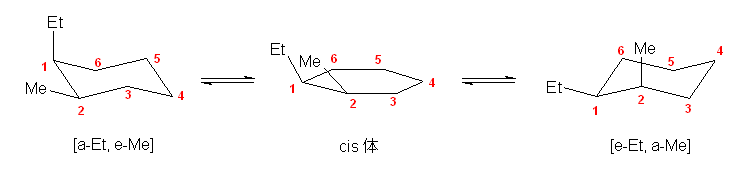
そのため、エチル基がエカトリアル位をとり、メチル基がアキシャルをとる右側の配座 [e-Et, a-Me] の方が相対的に安定である。( a はアキシャル、e はエカトリアルの意である。)<
(なお、C1−C2の方向から見ると判るが、左右の配座に共通するもう一つのひずみとして、メチル基とエチル基の間のゴーシュ相互作用がある。
これは、左右に共通しており、別の教科書を参考にすると、およそ 4.0 kJ/mol の大きさである。水素との 1,3-ジアキシャル相互作用の大きさは、メチル基で 3.8 kJ/mol に対し、エチル基では 4.0 kJ/mol である。従って、上の2つの配座のエネルギー差は 0.4 kJ/mol程度の差なので、45 % : 55 % くらいの割合で存在する。)
b) 次図に示すように、一方の配座では、両置換基がエカトリアル位をとることができるため、次図、右側の配座 [e-Et, e-Me] が安定である。
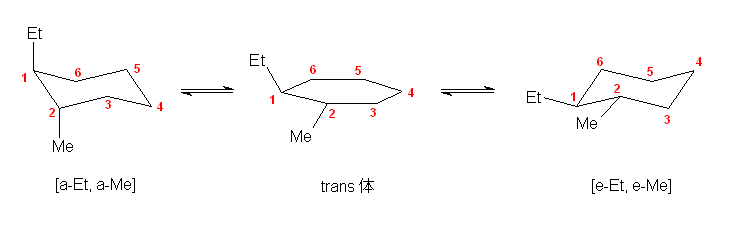
(右の配座のみ、メチル基とエチル基の間にゴーシュ相互作用がある。そのため、上記数値を用いると、この2つの配座のエネルギー差は、3.8×2 + 4.0×2 - 4.0 = 11.6 (kJ/mol)であるから、平衡定数 Keq = 108、ジアキシャル体の割合は、0.9 % である。)
c) trans- 体は、ジアキシャル体では不安定であるため、ジエカトリアル体として存在している。このジエカトリアル体は、cis- 体のいずれよりも安定であるから、この問いの答えとすると、「trans- 体の方が安定である」となる。(ただし、cis- 体とtrans- 体は、相互に入れ替わることが不可能な立体異性体である。配座異性体のときのように、平衡定数を求めたりすることはできない。)
3.49
実際に、具体的にシクロヘキサンの椅子形の骨格を書き、置換基の位置関係を調べてもよいが、次のように考えることでも答えはでる。
シクロヘキサン環のアキシャル位水素は、環の面に対して、交互に上下上下上下の位置関係である。エカトリアル水素も、環の面に対して、交互に下上下上下上の位置関係である。従って、たとえば、1,2-二置換体の場合、トランス体であれば(上下または下上なので)両方ともエカトリアル、または両方ともアキシャル位をとり、シス体であるならば、アキシャル−エカトリアルの組(またはエカトリアル−アキシャル)となる。
(解答例)
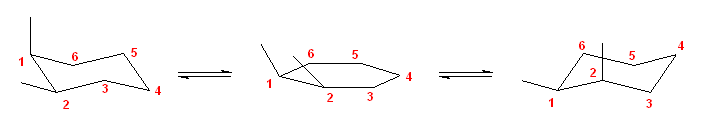
a)
椅子形配座では、必ず一方の置換基がアキシャル位なら、もう一方の置換基はエカトリアル位をとる。2つの置換基が同じならば、左右の配座の安定性に差はない。異なる置換基の場合には、より嵩高いほうがエカトリアル位をとるほうが安定である。
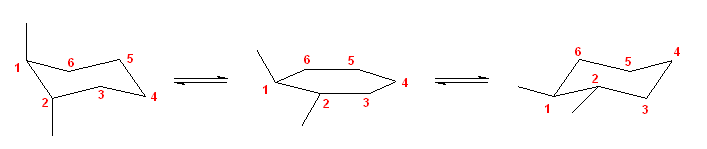
b)
椅子形配座では、2つの置換基がジアキシャル、またはジエカトリアルとなる。ジエカトリアルの配座の方が安定である。
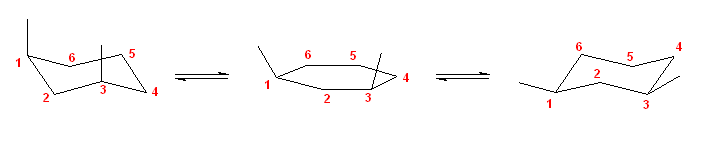
c)
椅子形配座では、2つの置換基がジアキシャル、またはジエカトリアルとなる。ジエカトリアルの配座の方が安定である。
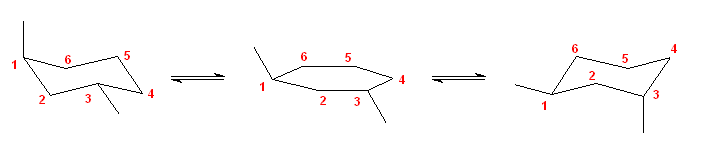
d)
椅子形配座では、必ず一方の置換基がアキシャル位なら、もう一方の置換基はエカトリアル位をとる。2つの置換基が同じならば、左右の配座の安定性に差はない。異なる置換基の場合には、より嵩高いほうがエカトリアル位をとるほうが安定である。
e)
椅子形配座では、必ず一方の置換基がアキシャル位なら、もう一方の置換基はエカトリアル位をとる。2つの置換基が同じならば、左右の配座の安定性に差はない。異なる置換基の場合には、より嵩高いほうがエカトリアル位をとるほうが安定である。
f)
椅子形配座では、2つの置換基がジアキシャル、またはジエカトリアルとなる。ジエカトリアルの配座の方が安定である。
(発展)
なお、この章では詳しく述べないが、b) および d) の構造は、光学異性体を持つ。
つまり、b) の例では、次の2つの立体異性体は、空間内でどのように動かしても、互いに重ね合わせることのできない(右手と左手のような)関係である。
図の中央に示した、平面型の配座で上下の2つを重ね合わせることができないことを確認せよ。

3.50
a) 解答例をみながら作図してみること。ただし、教科書の解答例における2つの Newman投影図は、互いに環の反転で入れ替え可能な書き方ではないため、本質的には、誤りである。ある意味で、悪い例なので、この問いの解答では、教科書をマネしないよう。1位のメチル基が一方の図では上、もう一方の図では下になっているのは、オカシイのです。
なので、これに配慮して書くと、更によいだろう。その場合、手前側のメチレン -CH2- が、両方とも上にくるように書くのではなく、一方を上に書いたなら、もう一方は下にくるように書くとよい。
b) 立体ひずみの少ないもののの方が平衡時に多く存在する。
c) a) を参考に書く。trans 体であるから、一方が環の上方であるなら、もう一方は下方になる。環の反転により、アキシャル−エカトリアルが入れ替わるので、念のためa) と同様に2組書いてみるとよい。(なお、trans 体の場合、4章で学ぶ光学異性体の組が生じる。この段階では考慮しなくてよい。)
d) 考え方として
1) 立体ひずみの少ないものの方が平衡時に多く存在する。
2) 立体ひずみが同じならば、等量ずつ存在する。
のですが、皆さんが今の段階で、厳密な意味で正解を出せることは、おそらくないでしょう。これは、問題が悪いので、あしからずご了解ください。(面倒だと思いますが、解答例のところの解説をよく読んでおいてください。)
(解答例)
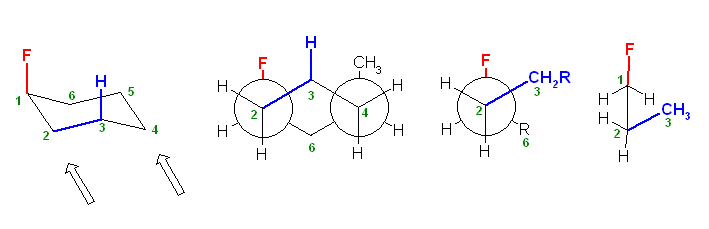
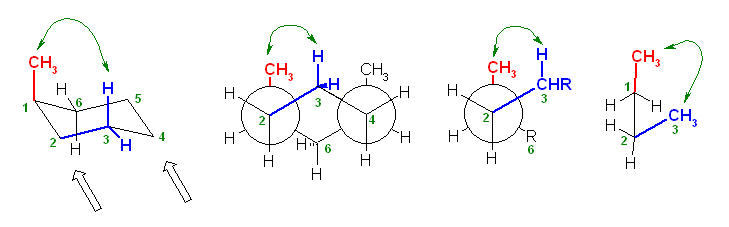
椅子形配座の反転の前後を描いたのが次図である。
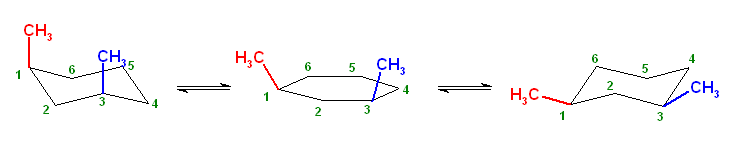
a) ジアキシャル配座(上図左)および、ジエカトリアル配座(上図右)について、Newman 投影式を描くには、次図のように、C1−C6 および、C3−C4の2本の結合が重なるような方向から見るようにして書くとよい。(2つの円を挟むかたちのメチレン、次図では、2位および5位)に置換基がない方が書きやすい。)
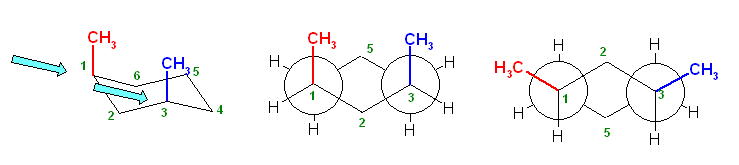
ここで、環の反転前後で、平均的な面より上にあった炭素は下にきて、下にあった炭素は上にくる。つまり、2位、5位のメチレン -CH2- の上下が入れ替わっていることに注意する。
また、環の反転でアキシャルとエカトリアルは入れ変わるが、置換基の上下は入れ替わらない。上の図で、1位メチル基、3位メチル基、ともに環の上のままを保っていることにも注意する。
従って、環の反転の前後のペアを次図のように書くのは、本質的に誤りである。
(環の反転前は、1位、3位のメチル基が環の上方に突き出ていたものが、環の反転により下向きの置換基になってしまっているため、誤り。)
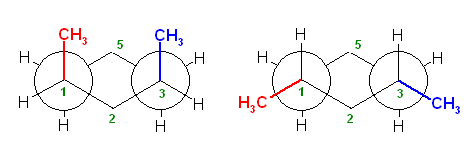
(ただし、2つの置換基が等しい場合に限っては、次図のように、正しく反転したあと、更に空間内を上下入れ替わるように180度ぐるりとまわしてやることができる。そのため、実は、教科書の解答例でも、答えに至る考え方に間違いがあり、本質的にまねてもらっては困るのだが、たまたまでてきた答えは間違いとはいえないということになる。)
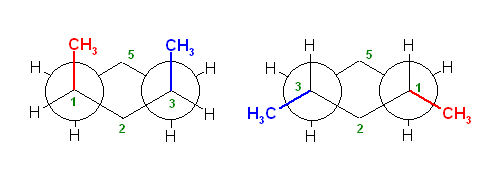
以下のような書き方は、推奨されないが、間違いではない。
右の配座で、3位メチル基はエカトリアル位であり、C1−C2 およびC5−C4結合に平行である。従って、この Newman 投影図では、C3炭素とメチル基炭素が重なる位置に書くことになる(紙面手前側に突き出しているように書く)。
b) ジエカトリアル配座の方が安定である。そのため、平衡状態ではより多く存在する。
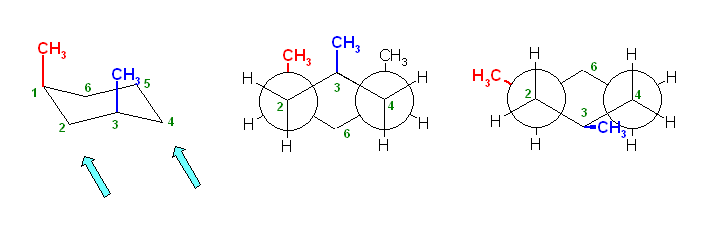
c) 反転の前後で、次図のように配座が入れ替わる。
これに対し、Newman 投影図を正しく書くと、次のようになる。
また、trans-1,3-ジメチルシクロヘキサンでは、上の投影図で書いた構造と、次の図とでは、互いに光学異性体の関係にあり、これらは環の反転のみで入れ替えることができない。(問 3.49 の発展の項を参照。)
また、推奨されないが、次のような書き方もありえる。
d) 環の反転前後、どちらの配座においても、アキシャル位メチル基1つ、エカトリアル位メチル基1つで、エネルギー的には等価である。従って、どちらが過剰ということはなく、50 % : 50 % で存在する。と言いたくなるし、「問題の解き方」の解説にもそのように書いてあるのだが、これは実は間違い。
(考え方は、正しい。)
環の反転前後の2つの配座をあらためて示した。
(縦線の区切りの左右が、環の反転前後の配座である。)一番右には、右側の配座を空間の中で上下が入れ替わるように、ぐるっと180度回転させたものを示した。これが、左側の配座と同じ構造であることに気づくだろう。すなわち、trans-1,3-ジメチルシクロへキサンは、環の反転により、反転前と全く同じ構造、同じ配座を生じる。反転の前後で、ただ一つの配座しかなく、互いに区別がないのだから、その1つの配座が 100 % あるだけで、どちらが多い、少ないということを言うことができない。(つまり、前提としてある問題文が正しくない。)
3.51-3.60
3.51
(解答例)
3.52
(解答例)
3.53
(解答例)
3.54
(解答例)
3.55
(解答例)
3.56
(解答例)
3.57
いずれもねじれ形配座だから、歪みの原因としては、大きめの置換基同士のゴーシュ相互作用が考えられる。それぞれの配座がもちうるそのような相互作用を数え上げよ。
(解答例)
塩素がもつ歪みとして、メチル基との間のゴーシュ相互作用が考えられる。(B) および (C) の構造は、塩素-メチルの間のゴーシュ相互作用が2組あるのに対し、(A) では、1組である。従って、(A) の配座が最も安定である。
3.58
(解答例)
3.59
(解答例)
3.60
(解答例)
3.61-3.70
3.61
(解答例)
3.62
(解答例)
3.63
(解答例)
3.64
(解答例)
3.65
(解答例)
3.66
(解答例)
3.67
(解答例)
3.68
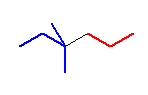
2-methylhexane の構造を書き、C3-C4 を確認してみること。C3上には、2つの水素と1つのアルキル基(1-methylethyl基。慣用名 isopropyl基)が結合している。C4上には、2つの水素と1つのアルキル基(ethyl基)が結合している。
そのように考えると、butane の C2-C3 結合軸の廻りでの回転や、pentane のC2-C3 結合軸の回転の場合の類似の問題であることがわかる。
(解答例)
骨格構造式を示すと、次図となる。
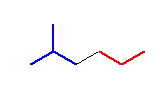
つまり、C3 上の置換基としては、2つの水素の他に、1-methylethyl 基(慣用名、イソプロピル基なので、-iPr と省略することにする)がある。また、C4 上には、2つの水素の他に ethyl 基(-Et)が結合している。
a) もっとも安定な配座は、大きな置換基同士が anti の位置にある(そのため、ゴーシュ相互作用が存在しない)ものであるから、
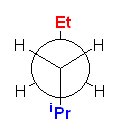
b) 最も不安定な配座は、重なり形配座で、かつ、最も大きい置換基同士が重なったものである。(教科書 p141、butane の C2-C3 回転軸のまわりの回転に伴うポテンシャルエネルギー図を思い出すこと。)
そのため、
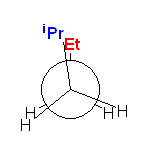
c) 環の構造などにより、自由回転が妨げられたような単結合は存在していない。すなわち、この分子においては、すべての C-C 結合が回転できる。
d) 注目している結合軸の一方の炭素上の3つの置換基がすべて等しい場合、ゴーシュ相互作用(があったとして、の和)がすべて同じになる。(-CH3 の場合は、ゴーシュ相互作用がない。)
その観点からこの分子を調べると、末端の -CH3 との結合軸、3本(C1-C2,C2-側鎖Me、C5-C6)がこれにあたる。
3.69
(解答例)
3.70
(解答例)
3.71-3.80
3.71
(解答例)
3.72
(解答例)
3.73
a) 問 3.37 を参照すること。縦軸は、kcal/mol から kJ/mol に変換したほうが、他の図と比較できます。
1 kcal = 4.2 kJ
b) 「最も濃度の高い」= 「最も安定なので、平衡時、多く存在する」
c), d) ポテンシャルエネルギー図が書けてしまえば、後は計算するだけでしょう。
(解答例)
a)
まず、アンチ配座(ねじれ形配座のうち、最も安定な配座、二面角 180 度)に対し、塩素がゴーシュ相互作用をもつときの大きさが、1.2 kcal/mol (5.0 kJ/mol)であるから、
二面角 60 度と、300 度の位置は、縦軸 5.0 kJ/mol のところに点をうつ。
次に、2つのエネルギー障壁(たとえば、二面角 60 度のところから、左右に回転させたときに越えるべき山の高さ)は、5.2 kcal/mol(21.8 kJ/mol)と、9.3 kcal/mol(39.1 kJ/mol)であるから、
二面角 120 度と、240 度のところは、縦軸 5.0 + 21.8 = 26.8 kJ/mol のところに点を打ち、
二面角 0 度と、360 度のところは、縦軸 5.0 + 39.1 = 44.1 kJ/mol のところに点を打つ。
これらを滑らかに結ぶと、次図となる。
3.37 で書いた pentane の C2-C3 結合回転に伴うポテンシャルエネルギー図や、教科書 p141 の、butane の C2-C3 結合回転に伴うポテンシャルエネルギー図などと比較すると分かるように、-CH3 よりも、-Cl の方が、立体的に大きい置換基としてはたらいており、回転に伴う障壁が高いことがわかる。
なお、重なり形配座をとったときの歪みが非常に大きく変化するのに対し、ゴーシュ歪みは、わずかにしか変化していないという特徴も読み取れる。
b) 次図の、塩素が anti 位にある配座がもっとも安定であり、最も多く存在する。
c) 二面角 120 度と、180 度とのエネルギー差なので、26.8 kJ/mol(6.4 kcal/mol)
d) 二面角 0 度と、180 度とのエネルギー差なので、44.1 kJ/mol(10.5 kcal/mol)
3.74
(解答例)
3.75
(解答例)
3.76
(解答例)
3.77
(解答例)
3.78
(解答例)
3.79
(解答例)
3.80
(解答例)
3.81-3.90
3.81
(解答例)
3.82
(解答例)
3.83
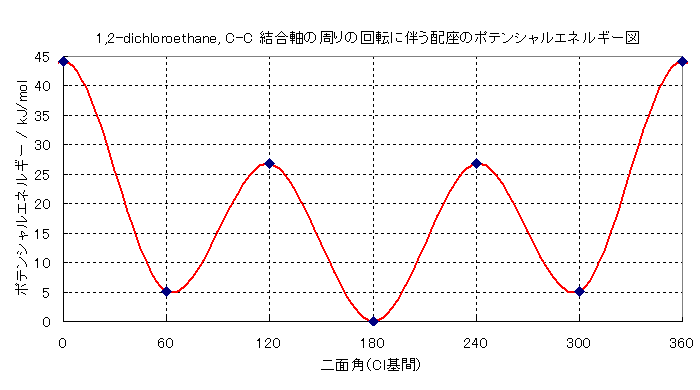
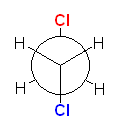
1,2-dichloroethane は、butane の C1 および C4 のメチル基を塩素に置き換えたものと考えればよい。
b) 「最も濃度の高い」というのは、「最も安定な」という意味である。より不安定な構造は、より安定な構造になろうとする。結果として、不安定な構造をとる分子より、安定な構造をとる分子の方が、数が多い。定量的な扱いは、ボルツマン分布の式 平衡定数 K = exp (-ΔE/RT) または、ΔE = -RT ln(K) を用いることができる。
c), d) ΔE を求めることを求められている。これらの問いは、結局、ポテンシャルエネルギー図が描けることを前提としている。
(解答例)
3.84
(解答例)
3.85
(解答例)
3.86
(解答例)
3.87
(解答例)
3.88
(解答例)
3.89
(解答例)
3.90
(解答例)