7.01-7.10
7.01
不飽和度について思い出すこと。
飽和アルカン(多重結合も環構造も持たないもの)は、一般式として CnH(2n+2) を持つから、テトラデカンの分子式は、C14H30 である。
三重結合がひとつある(不飽和度が2つ増える)ごとに、水素は4つ減少する。
(解答例)
三重結合2つにつき、不飽和度4、水素は8つ減少する。
環の構造1つにつき、不飽和度1、水素は2つ減少する。
したがって、C14H20。
7.02
英語で命名する際、サイレントe の次に yne が来たとき、そのサイレントe が省略されるのは、「イン yne」の「y」の文字は子音ではなく、母音だからです。(y の文字が、単語や音節の先頭にある場合は子音となりますが、それ以外ではすべて母音です。ただし、他の母音+y の形では y を発音せずに、前の母音を長母音として発音します。y が母音として働くとき、基本的には i と同じです。フランス語では、y のことを「イグレック = イ(i) ・グレック(ギリシャの)」と言います。)
もし、y を子音だとしたら pentyne ペンチンの y の文字を別の子音(たとえば t)にして、penttne にしても発音できないとダメですが、これ、無理でしょう? (lol)
他にも、hydroxy 基なんて単語をみれば、ここでは y が母音としてはたらいていることが判りますよね。
「ジメチルアセチレン」のごとき命名は IUPACでは認められるない※が、まあ対応した構造は判るだろう。
H-C≡C-H :アセチレン → エチン
Me-C≡C-H :メチルアセチレン → プロピン
Me-C≡C-Me :ジメチルアセチレン → ブタ-2-イン
※) H-C≡C-H 、IUPACによる体系名 ethyne を、慣用名 acetylene と称するのことは、(2013勧告より前では)認めていたが、誘導体を作ることは認められていなかった。(他方、ベンゼンのような慣用名は、誘導体を作ることが可能である。)すなわち、メチルアセチレン、ジメチルアセチレンなどの名称は、IUPAC では(慣用名としても)不許容ということである。というわけで、皆さんの立ち位置とすると「ジメチルアセチレン」と言われて、その構造は理解できるが、自分ではきちんと正しく IUPAC名でブタ-2-イン(2−ブチンは否推奨)と言えるようにする。
(解答例)
三重結合炭素は sp混成で、その結合角は 180 度です。しかし、紙の上に構造を写すとき、結合角を正確に反映させる必要はありません。
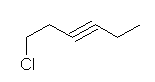
a) 1-chlorohex-3-yne
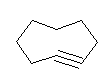
b) cyclooctyne
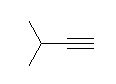
c) 3-methylbut-1-yne
※ isopropylacetylene は、IUPAC の規則に従えば、acetylene が誘導体を作ることのできない慣用名なので、誤り。また、isopropyl 基は、2013年勧告以降、非推奨。
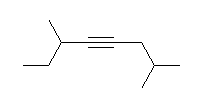
d) 2,6-dimethyloct-4-yne
※ sec-butylisobutylacetylene は、上と同様に、IUPAC の規則に従えば誤り。sec-butyl基、isobutyl基ともに、2013年勧告以降、非推奨
e) 4,4-dimethylpent-1-yne
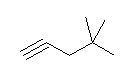
f) but-2-yne
※ dimethylacetylene は、上と同様に、IUPAC の規則に従えば誤り。
7.03
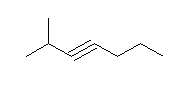
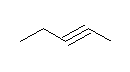
与えられた分子式から不飽和度を求めると(14-10)/2 = 2 である。従って、三重結合が一つあれば、他には環の構造も不飽和結合もない。そこで、ヘキサンの異性体をすべて書いてみること。(この際、主鎖がヘキサンであるもの、ペンタンであるもの(メチルペンタンの位置異性体)、ブタンであるもの(ジメチルブタンの位置異性体、エチルブタンは存在しない)というように数えていく。)
以上について、可能で重複のない位置に三重結合を入れてやれば、すべてを網羅して書き出すことができる。
(解答例)
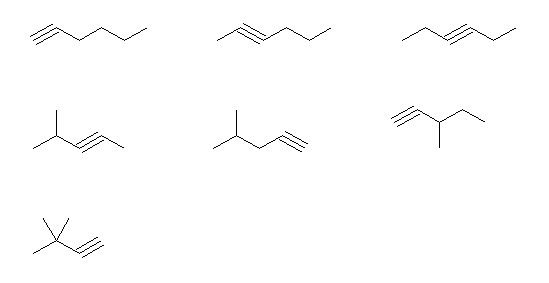
hexane から誘導されるもの。(上図、上段)
hex-1-yne, hex-2-yne, hex-3-yne
pentane から誘導されるもの。(上図、中段)
4-methylpent-2-yne, 4-methylpent-1-yne, 3-methylpent-1-yne
butane から誘導されるもの。(上図、下段)
3,3-dimethylbut-1-yne
間違いやすいポイント。ひとつの炭素が5本(以上)の結合を持つことはできない。そのため、第3級炭素を含む三重結合を書いてはいけない。そのため、たとえば 2,3-dimethylbutane を母体としてアルキンにすることはできない。
また、命名において(主基がないので、次の優先順位として)多重結合の位置番号が小さくなるように番号を振る。従って、たとえば中段のメチルペンチン左2つは、2-methylpent-3-yne や 2-methylpent-4-yne ではない。また、正しい名称 4-methylpent-2-yne (4-メチルペンタ-2-イン)に対し、4-methyl-2-pentyne (4-メチル-2-ペンチン)のように書くのは、IUPACの1993年勧告以降、非推奨。
なお、二重結合とは異なり、三重結合には幾何異性体(シストランス異性体)は、原理的に存在しない。三重結合炭素は sp 混成を持つため、結合角が180度であるからである。上図では、トランス体(or E体)であるかのように見える書き方になっているが、実際にはそのようなことを意味しているわけではないので注意されたい。
7.04
位置番号を決める際、(主基がないので、それに次ぐ優先順位として)多重結合の位置番号が小さくなるように振る。
b) のようにどちらから数えても多重結合の位置番号が同じ場合には、残りの置換基の位置番号の組が小さくなる(すなわち、もっとも小さいものがより小さくなる)ように決める。
ただし、置換基を並べるときはアルファベット順。
c) アルコール(水酸基)であれば主基になるが、エーテルは主基にならないので側鎖置換基として命名する。
(解答例)
a) 5-bromopent-2-yne
b) 6-bromo-2-chlorooct-4-yne
c) 1-methoxypent-2-yne
d) 3-ethylhex-1-yne
b) では、クロロ-オクチンの部分で、chloro-octyne と o (母音)が重なるが省略されない。次に母音がきて省略されるのは、サイレント e(単語の語尾にでてきて発音しない e )です。
7.05
ヒント不要だよね?
(解答例)
a) 6-methyloct-2-yne
b) 5-ethyl-4-methylhept-1-yne
c) 2-bromooct-4-yne
7.06
二重結合と三重結合の両方がある場合は、alk
位置番号を決める際は、もし主基があればそれを最優先。なければ、二重結合、三重結合を区別せず多重結合の位置番号の組が小さくなるように決めます。これが同じ場合は、二重結合の位置番号が小さくなるようにします。それでも更に同じ場合は、側鎖の位置番号を小さくします。
(解答例)
a) hept-1-en-4-yne
b) 4-methylhexa-1,4-diene
c) 5-ethenyloct-5-en-1-yne
d) but-3-yn-1-ol
e) hepta-1,3,5-triene
f) 2,4-dimethylhex-4-en-1-ol
7.07
7.6 のヒントをもう一度読んで!
(解答例)
a) (E)-hept-2-en-4-ol
b) hept-1-en-5-yne
c) (E)-hept-4-en-1-yne
7.08
室温で液体ということは、沸点が室温より上ということです。あとは、落ち着いて表をよく見れば間違いようがないと思いますが。
末端アルケンは R-CH=CH2 または RR'C=CH2 の構造のもの、末端アルキンはR-C≡CH の構造のものです。
(解答例)
pentane, pent-1-ene, pent-1-yne
7.09
沸点が高い=分子間相互作用が強く、気化しにくい。 ここでは、分子間力として、分子のもつ永久双極子を考えることになります。
(解答例)
(E)-but-2-ene は、分子の永久双極子は、ゼロになります。これは、二重結合炭素に結合した4本の置換基について、C-CH3 と C-H がそれぞれ逆の方向を向いたペアをもっており、各結合に基づく分極があってもベクトルとして打ち消されてしまうからです。そのため、(E)-but-2-ene の分子間力は、ファンデルワールス相互作用によるもののみです。
他方、(Z)-but-2-ene は、小さいながらゼロではない永久双極子を持っています。(4本の結合に沿った分極の和は、C=C を中央で分割する法線方向のベクトルになりますね。)そのため、この分極に応じた静電相互作用が働く(分子内に生じた δ+ と δ-が引き合う)ので、沸点がやや高くなります。
7.10
ヒントは不要だよね?
(解答例)
a) sp2 - sp2
b) sp2 - sp3
c) sp - sp2
d) sp - sp3
e) sp - sp
f) sp2 - sp2
g) sp2 - sp3
h) sp - sp3
i) sp2 - sp
7.11-7.20
7.11
活性化自由エネルギーが小さいほど、反応が速い。
(解答例)
反応物(出発物)が不安定であろうとなかろうと、遷移状態が安定で、従って活性化自由エネルギーが小さくなれば、その反応は起こりやすくなる。
以上が答え。以下、解説。
この問いの出題の意味は、教科書を読むと理解できると思う。
アルカンよりアルケンの方が不安定であったのと同様に、アルケンよりもアルキンの方が不安定である。また、もし最終生成物が共通なら*、アルキンの方が大きな反応エネルギー差を持つ。(より発エルゴン的(≒発熱的)である。)これらを根拠にして、アルキンの方が反応性が高いだろうと予想する※かもしれない。しかし、事実は逆である。
教科書では、アルケンにくらべアルキンではなぜ反応性が低いのかという疑問に対し、より不安定な中間体(ビニルカチオンまたは π錯体)を経由するので、遷移状態のエネルギーも高いからであるからという説明をしている。
もし、ここで理屈を抜かして「アルキンはアルケンと比べて、より不安定だから、反応性も低い」という誤った因果関係を捉えてしまうような学習の仕方をしている学生が居たなら、この設問が意味を持ってくるわけだ。
※) 「(熱力学的に)不安定 = 変化しやすい」という単純な認識は、熱力学定な安定性と速度論的な安定性を混同しており、誤りである。(もちろん、「(熱力学的に)不安定 = 変化しにくい」という認識も誤りである。)ここではすべて「安定/不安定」は、熱力学的な安定性についての言及であり、速度論的に不安定であるものを「反応しやすい」「反応性が高い」というような表現を用いている。
遷移状態が同じエネルギーを持つならば、出発物が不安定である方が反応性が高い。(これは常に正しい。)次に、共通の出発物から生成物を与えるとき、より大きく発エルゴン的である場合に、遷移状態のエネルギーが低くなる傾向がある(多くの場合に成り立つが、常に正しいとは限らない)。
以上より、出発物質が不安定であるほど、反応が起こりやすいという結論を導きたくなる。(実際、これが成り立つケースも多々ある。が、常に正しいわけではない。)
*) 注意深く考えると、水和反応や水素添加反応において、この仮定も正しいわけではないことが判る。アルケンの場合は、骨格が「アルケン → アルカン」の反応であるのに対し、アルキンの場合は、骨格が「アルキン → アルケン」の反応である。つまり、そもそも反応熱の大小の関係と、出発物質の安定性には関係がない。
単純に、三重結合における π 結合の強さが、二重結合における π 結合と同じであると仮定するなら、この2種の反応における反応エネルギー差にはほとんど差がない。
7.12
位置選択性:マルコフニコフ配向
立体選択性:アンチ付加(HBr の付加、Br2の付加とも)
「過剰量の試薬」骨格が、アルキン → アルケンになったのち、もう一回反応させる。この際、はじめの反応で結合した臭素は、アルキル基と同様にカルボカチオンを安定化させる効果をもつ。
(解答例)
a) 2-bromoprop-1-ene
b) 2,2-dibromopropane
c) (E)-2,3-dibromobut-2-ene
d) 1,1,2,2-tetrabromopropane
e) 2,2-dibromobutane
(2,3-dibromobutane は生成しない。)
f) 2,2-dibromopentane と 3,3-dibromopentane が等量ずつ生じる。
(2,3-dibromopentane は生成しない。)
7.13
アルケンの反応と同じように書く。
(解答例)
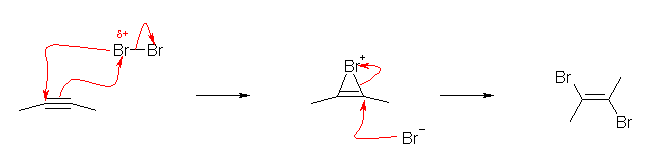
環状ブロモニウムイオンを経由する。そのため、アンチ付加になるから、生成物における2つの臭素は必ずトランスの位置関係になる。
7.14
酸触媒での水和:はじめに多重結合に H+ が付加するところから始まる。これにより、アルケンの場合はカルボカチオンを生じた。アルキンからは、教科書の記述のように π 錯体(または、ビニルカチオン)を生じる。
いずれにしても、より安定なカルボカチオンの位置に求核種が攻撃する。(そのため、マルコフニコフ配向となる。)ただし、内部アルキンの場合は、ここで2つの炭素に差がないため、位置選択性がなく、位置異性体の混合物を与えることになる。
アルキンからはエノールを生じるので、ケト=エノール互変異性化によりケトン等を与える。
(解答例)
heptan-3-one + heptan-4-one の等量の混合物。
7.15
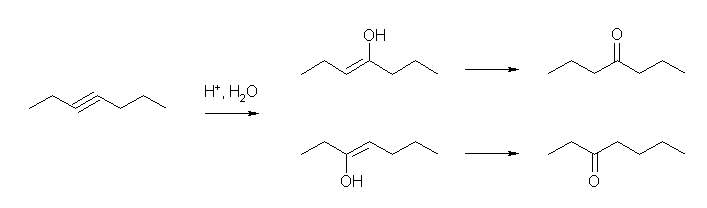
ケトンの前駆体であるエノールの構造を予測せよ。(cf. 7.16)
ただし、このとき、二種の可能性がある場合がある。(→ b)
(解答例)
a) propyne
b) hex-3-yne
c) ethynylcyclohexane
b) は、hex-2-yne からも、hexan-2-one との等量の混合物として hexan-3-one を与える。しかし、hex-3-yne から出発した場合は、対称性の関係で hexan-3-one が唯一の生成物として得られるため、より原料として適切である。
7.16
no hint
(解答例)
a)
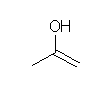
対称性の関係から1種類のみ。
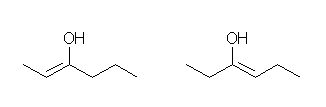
b)
c)
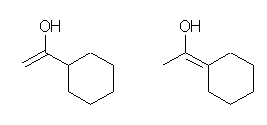
c) は、前駆体として考えられる2種類のエノール体のうち、上図右側の構造(1-cyclohexylidene-ethanol) は、対応する三重結合が書けない。そのため、問い 7.15 において解候補から外される。
7.17
末端アルキン R-C≡CH は、内部アルキン R-C≡C-R より反応性が低いため、単なる酸触媒では水の付加反応が起きない(遅い)。そのため、水銀イオンを触媒として加えることがある。ただし、形式的には酸触媒のときと同じ位置選択性で反応が進行する。
そのため、より級数の高い側の炭素に水酸基が結合していく。すなわち、形式的には R-C+=CH2 を経由すると考えたときと同じ生成物を与える。
(解答例)
(1) は酸触媒、または特に末端アルキンの場合は硫酸水銀触媒による水和。
(2) はヒドロホウ素化-酸化反応。
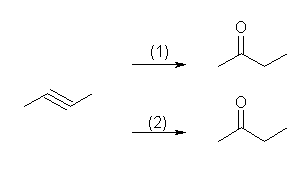
a) 末端アルキンは、この2つの反応で異なる生成物を与える。ヒドロホウ素化反応ではアルデヒドが、硫酸水銀の触媒での水和ではメチルケトンが得られる。
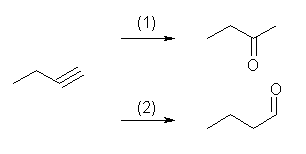
b) 内部アルキンなので、どちらの反応でも位置選択的な反応にはならないが、原料の対称性の関係で、butan-2-one のみが得られる。
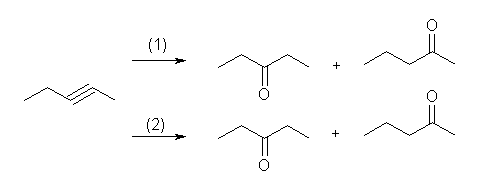
c) 内部アルキンなので、どちらの反応とも位置選択的な反応とはならずに、位置異性体の等量の混合物を与える。
7.18
no hint
(解答例)
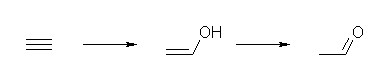
ethyne
どちらの炭素に水が付加しても、生じたエノール(ethenol, 慣用名 vinyl alcohol)は、ethanal(慣用名 acetaldehyde)を生じる。
7.19
アルキンからアルケンへの還元法には、主に2種類あり、トランス体を得たい場合は溶解金属還元(Na/liq. NH3)を用いる。シス体を得たい場合はリンドラー触媒を用いた接触水素化を行う。
ただし、末端アルキンに対して溶解金属還元を行うことはできない。末端アルキン自身が酸性水素を持ち、プロトンを放出することが可能であるためで、アルキンではなくプロトンが電子を受け取る反応が進行してしまうためである。
R-C≡CH + Na → R-C≡C- + Na+ + (1/2)H2
(解答例)
a) pentyne の位置異性体(pent-1-yne または pent-2-yne)は、どちらでもよい。パラジウム炭素などを用いた接触水素化を行う。
b) but-2-yne に対し、リンドラー触媒を用いた接触水素化を行う。
c) pent-2-yne に対し、溶解金属還元を行う。
d) hex-1-yne を原料としてリンドラー触媒を用いた接触水素化を行う。
溶解金属還元では反応できない(ヒント参照)。
7.20
アルケンが得られる反応では、シン付加なのかアンチ付加なのかを区別してください。
(解答例)
a) hexane
b) (Z)-hex-2-ene
c) (E)-hex-2-ene
d) 4-methylpentanal
e) hexan-2-one + hexan-3-one の等量混合物
f) hexan-2-one + hexan-3-one の等量混合物
英語版解答では、d)、e) がアルコールになっているが、誤り。
7.21-7.30
7.21
アルカンとアンモニアの酸性度の大小で議論できる。
(解答例)
アルカン R-H を、アミドイオン NH2- で共役塩基にすることができないから。
この反応は、次式となる。
R-H + NH2- ←→
R- + NH3
ここで、平衡を示す矢印の左右で、酸として働いている「アルカン R-H」と「アンモニア NH3」を比較すると、アンモニアの方が強酸(もちろん、相対的に)である。そのため、上の平衡は左に大きく偏る。(より強酸が酸として働き共役塩基を生じ、より弱酸であるアルカンは酸型として遊離する。)
7.22
末端アルキン R-C≡C-H の酸性度は、エチン(アセチレン)H-C≡C-H の酸性度とほぼ同じで、pKa ≒ 25 である。
(解答例)
R-C≡C-H + B- ←→
R-C≡C- + B-H
末端アルキンと、塩基 B- を等量用いたとして、その塩基の共役酸の酸性度が pKa = 25 である場合、上の平衡は丁度中央で釣り合う。すなわち、末端アルキンの 50 % が水素を引き抜かれる。
もし、末端アルキンより B-H の方が弱い酸である場合、B-H の pKa が 26 であるなら末端アルキンの 90 % が水素を引き抜かれ、B-H の pKa が 27 であるなら末端アルキンの 99 % が水素を引き抜かれる。
逆に末端アルキンよりも B-H の方がやや強い酸で、pKa が 24 であるなら末端アルキンの 10 % が水素を引き抜かれ、B-H の pKa が 23 であるなら末端アルキンの 1 % だけが水素を引き抜かれる。
反応が完全に進行するために、平衡時に、末端アルキンの水素を 100 % 引き抜いていることが常に必要なわけではない。系中で引きつづきおきる反応があり、生じた R-C≡C- が消費されるような場合には、ルシャトリエの原理により平衡がずれるため、平衡の移動によりそれまで未反応であった R-C≡C-H からプロトンの引き抜きが生じるからである。
とはいえ、一般的には、塩基を1当量のみ用いる場合では、平衡時に 99 % 以上の引き抜きを生じるために、pKa で2以上大きい(B-H が酸として100倍以上弱い)ような系を選ぶのが好ましい。
よって、共役酸 B-H の pKa が 27 以上であるような塩基 B- を用いることが望ましい。
7.23
微妙な場合は、共役酸の pKa を巻末等で調べること。強い酸の共役塩基は、弱い塩基である。
(解答例)
a) 共役酸について考えたとき、アルカン < アルケン < アルキン の順で酸性度が高くなる。(対象として考えている水素が結合した炭素の混成状態について着目した場合、s 性が高い方が酸性度が高い。)よって、
R-CH2- > R-CH=CH- > R-C≡C-
b) 酸性水素の結合している元素の電気陰性度で判断できる。(フッ化水素 HF は、フッ素の電気陰性度を考えると異例に弱い酸であるが、それでも pKa = 3 程度であり、アルコールやアミンと比較して十分に強い酸である。)
NH2- > R-C≡C- > R-O- > F-
7.24
ここで問われているのは、カルボカチオンの安定性についての議論である。
共役酸の酸性度を議論するために、共役塩基(カルボアニオン)の安定性を考慮した。これと同じ議論を適用してよい。
(解答例)
電荷を担う炭素原子の s 性が高いほど、電気陰性度の高い元素として振舞う。
そのため、カルボアニオンでは、sp 混成炭素(すなわち R-C≡C-)が最も安定で、ついで、sp2 混成炭素(すなわち R-CH=CH-)であり、もっとも不安定なのは、sp3 混成炭素(すなわち R-CH2-)であった。
カルボカチオンでは逆であり、R-CH2+ が最も※安定、ついで R-CH=CH+、そして最も不安定なのが R-C≡C+ である。
※) ここでは、アルカン、アルケン、アルキンという比較の中での話である。最も安定といいながら第1級のカルボカチオンは、反応の中間体として考えるには不充分な安定性しか持たない。第2級、第3級のカルボカチオンは更に安定であることは言うまでもない。
7.25
hept-3-yne の構造を書いてみるとよい。
C2H5-C≡C-C3H7 である。
これを、pent-1-yne を用いて合成するためには、
C2H5-X + -C≡C-C3H7
のように反応させることになる。よって、結合を作る位置を選びなおせば、pent-1-yne 以外の出発物質から反応させることができる。
答えは、2通り書ける。
(解答例)
1) but-1-yne を用いる方法。
C2H5-C≡C- + X-C3H7
2) ethyne を用いる方法。
H-C≡C- + R-X → H-C≡C-R
により、but-1-yne または pent-1-yne を生成し、続いて同様の反応を行い、hept-3-yne とする。
いずれも、反応条件は、「1) NH2-, 2) R-X」などとなる。塩基は、アミドイオンなので、実際に加えるのは、ナトリウムアミド NaNH2 などなので、「1) NaNH2, 2) R-X」 でもよい。
1)、2) と分けているのは、1) の反応が十分に進行してから、次いで、2) の試薬を加えて反応をさせるということである。2つの試薬を同時に混ぜる場合は、単にカンマ等で区切って並列で表し、「NH2-, R-X」と書くことになる。ただし、この反応では、アミドイオンがハロゲン化アルキル R-X に対する求核攻撃が副反応として考えられるので、同時に混ぜないほうがよい。
もちろん、ここで示した答えは一例にすぎない。
たとえば、もう少し学習を進めると別の選択肢もあることに気付くだろう。たとえば、次のような反応でも、hept-3-yne を得ることができる。
hept-3-ene → 3,4-dibromoheptane → hept-3-yne
1段階目の反応は、すでに学習したアルケンと臭素 Br2 の反応である。これにより得られるビシナルジブロミドを強塩基で処理すると、アルキンを得る。
あと、当然のことながらこれは教科書の問題なのであって、現実的に pent-1-yne がないからといって、but-1-yne や ethyne を代替として使えるかというと、必ずしもそうではない場合もある。たとえば、pent-1-yne は沸点が 40 ℃で、室温で(かろうじて)液体として扱うことができるのに対し、but-1-yne の沸点は 8 ℃なので、気体試料として扱う必要がある。
7.26
アセチレンから:エチンから
炭素数が増える反応は、エチンの共役塩基とハロゲン化アルキルの反応で行うことができる。なので、実質すべての炭素数の任意のアルキンをエチンを出発物質として合成してよい。
なので、次に、同数の炭素を持つアルキンから目的物をどのように合成するかを考えればよい。
ステップ数が多いものもあるが、ひとつひとつ落ち着いて考えること。
(解答例)
a) 基本となる反応で、炭素−炭素結合を形成させる。
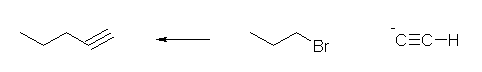
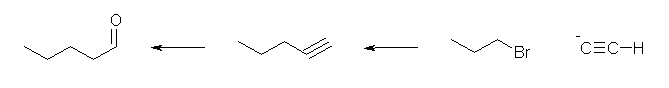
ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromopropane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
b) 末端アルケンを得るためには、末端アルキンをリンドラー触媒で接触水素化する。
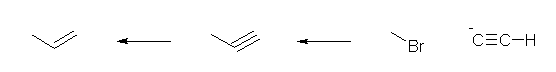
1) ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromomethane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
2) 得られた propyne に対し、リンドラー触媒を用いて接触水素化する。
c) 対応する内部アルキンを、リンドラー触媒を用いて接触水素化する。
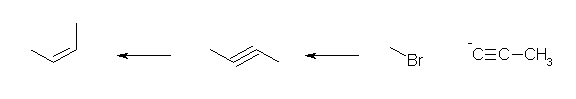
1) ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromomethane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
2) 得られた propyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromomethane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
3) but-2-yne が得られるので、これをリンドラー触媒を用いて接触水素化する。
d) 末端アルキンを、ヒドロホウ素化−酸化する。
1) ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromopropane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
2) 得られた pent-1-yne に、R2BH を作用させる。
3) 次いで、塩基性の過酸化水素による酸化反応を行う。得られたエノール(pent-1-en-1-ol)は、自発的にケト体に互変異性化し、pentanal を与える。
e) アルケンに対するマルコフニコフ配向による HBr 付加を考える。
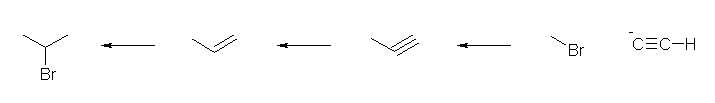
1) ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromomethane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
2) 得られた propyne に対し、リンドラー触媒を用いて接触水素化する。
3) 得られた propene に対し、極性溶媒中で HBr の付加を行う。
f) アルケンにハロゲン化水素を付加させると、ジェミナルジハライドを得ることができる。
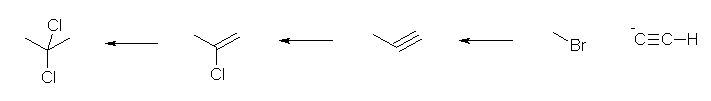
1) ethyne に対し、NaNH2 を作用させ、アセチリドイオンとしたのち、1-bromomethane と反応させる。(ハロゲンは、ヨウ素や塩素でも可。)
2) 得られた propyne に対し、2当量の HCl を付加させる。この反応はアルキンの方が反応性が低いため、生じた 2-chloropropene は速やかに 2,2-dichloropropane を与える。
7.27
「過剰の HCl」 →
アルキンの場合、1分子の付加で生じたアルケンが更に反応する。
アルケンの場合、無関係。
位置選択性に注意すること。
アルキンの場合、HCl の付加はアンチ付加になるが、結果的に2分子が付加するので、立体選択性については考慮の必要がなくなっている。
問 7.11 を参照のこと。
(解答例)
a) 2,2-dichlorobutane
b) 3,3-dichlorohexane
(3,4-dichlorohexane は生じない。)
c) 3,3-dichloroheptane と 4,4-dichloroheptane が等量ずつ生じる。
(3,4-dichloroheptane は生じない。)
7.28
問いに与えられたいくつかの命名は、IUPAC的には認めていないものである。 命名については、7.2 のコメントを読んでおくこと。
(解答例)
a) hex-2-yne
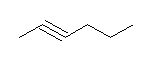
b) 5-ethyloct-3-yne
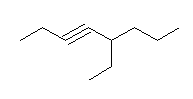
c) propyne
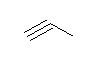
d) but-1-en-3-yne
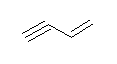
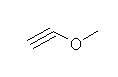
e) methoxyethyne
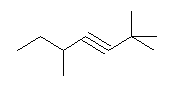
f) 2,2,5-trimethylhept-3-yne
g) 1-bromopent-1-yne
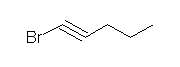
h) 5-methylcyclohex-2-enol
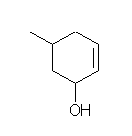
i) hex-3-yne
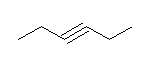
j) 2,2,5,5-tetramethylhex-3-yne
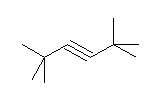
k) ethynylcyclopentane
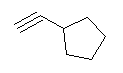
l) 5,6-dimethylhept-2-yne
h の構造のみ主基(水酸基)を持っており、シクロアルカンのアルコールなので、主基の位置番号は必ず1位であり、省略している。
他は、すべて主基が存在していない。
7.29
与えられた命名を見て構造を書いてみること。そして、その構造を正しく命名してみること。まあ、ぶっちゃけ「ペンタ-2-イン」とすべきものを「2-ペンチン」とか言っている時点ですべてIUPACの1993年勧告に従っておらず、すべて間違いなのであるが。
(解答例)
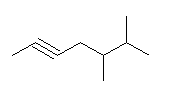
a) 主鎖の選び方が間違っている。
正しくは、4-methylhex-2-yne
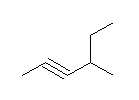
b) 位置番号の付け方が間違っている。側鎖よりも、多重結合の位置番号が優先である。
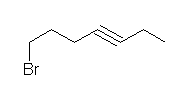
正しくは、7-bromohept-3-yne
c) 三重結合の位置番号を yne の直前に書かねばならない点以外は正しい。
2-methylhept-3-yne
d) 位置番号の付け方が間違っている
正しくは、pent-2-yne
7.30
特にヒントは不要かな。
ただし、b) のような酸塩基反応について「求核種」という言い方をしない場合が多い。同じ正の電荷(または部分電荷)を求めていく反応であっても、炭素に対する反応では「求核種」、プロトンを引き抜く反応では「塩基」とする。
(解答例)
a) 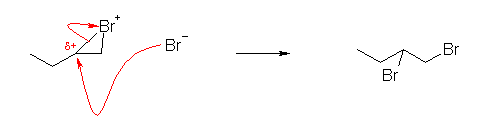
求核種は Br-、求電子種は環状ブロモニウムイオン。
b) 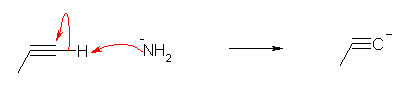
アミドイオンが「塩基」として働いている。(「求核種」として働いているとは言わない。)
c) 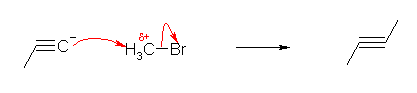
アセチリドイオンが求核種である。
7.31-7.40
7.31
問い 7.2 のヒントなどを参照すること。
(解答例)
a) 5-bromohex-2-yne
b) 5-methyloct-2-yne
c) 5,5-dimethylhex-2-yne
d) 6-chloro-2-methylhept-3-yne
e) cycloocta-1,5-diene
f) 1,6-dimethylcyclohexa-1,3-diene
7.32
該当する生成物を与える反応について、教科書 pp 371-372 の「反応のまとめ」などを参考にすること。なお、アルキンから直接得ることのできない生成物の多くは、アルケンを経由することで合成が可能になる場合が多い。そのため、教科書代6章の「反応のまとめ」(pp 331-332)も参照してください。
なお今回の問題では、出発物質が末端アルキンであるので、アルケンへの還元に「溶解金属還元」は用いることができないので、「リンドラー触媒を用いた接触水素化」しか使用できないことに注意すること。
(解答例)
※ ヒントにも書いたように、出発物質が末端アルキンであるので、アルケンへの還元に「溶解金属還元」は用いることができないので、「リンドラー触媒を用いた接触水素化」しか使用できない。以下、解答に「アルキンをアルケンに変換したのち」と書いた部分は、省略していちいち示さないが「リンドラー触媒、H2」が反応試薬となる。
右上から時計回りの順番で。
(右上)1) 一般名エポキシド epoxide, 化合物名 2-alkyloxirane (命名上、オキシラン環の1位は酸素の位置です)
エポキシドはアルケンと過酸の反応で生じる。過酸としては、過酢酸 CH3CO3H を用いてもよいが、m-クロロ過安息香酸(mCPBA)も代表的な過酸の試薬である。
2) 2-bromoalkane
アルキンをアルケンに変換したのち、HBr を付加させる。
3) 一般名ケトン ketone。化合物名 alkan-2-one
カルボニル化合物は、ケト=エノール互変異性化で生じるから、アルキンにマルコフニコフ配向で水を付加させて、alk-1-en-2-ol としてやればよい。水和反応に対しては、アルキンはアルケンよりやや反応性が低く、その中でも内部アルキンより末端アルキンの方が反応性が下がる。そのため、末端アルキンの(マルコフニコフ配向での)水和は、単なる酸触媒ではなく、硫酸水銀(Hg2+イオン)を触媒として用いる。
4) 一般名アルデヒド aldehyde。化合物名 alkanal
3) と同様に水和して、alk-1-en-2-ol としてやればよい。ただし、逆マルコフニコフ配向なので、用いる反応は、ヒドロホウ素化-酸化反応を用いる。ヒドロホウ素化に用いる試薬は、R2BH という書き方が最も一般的ではあるが、より具体的には、9-BBN (教科書p357)などを用いる場合が多い。
(左下)5) 2-bromoalk-1-ene
6) 2,2-dibromoalkane
5) はアルキンに対して、1当量の HBr をマルコフニコフ配向で付加させる。このとき、過剰量の HBr を用いると、速やかに次の付加反応が起こり、6) が得られる。
7) alk-1-ene
リンドラー触媒を用いた接触水素化を行う。
8) alkane
パラジウム-炭素などを触媒として用い、接触水素化を行う。
※ こうやって解説してみて思ったが、左上から反時計回りの方がよかったかな?
7.33
分子式が C7H12 なので、不飽和度は2である。
そのため、これが三重結合を一つ持つなら、それ以上に不飽和結合も環の構造も持たない。
まず、炭素7のアルカンの骨格異性体をすべて書き、そのそれぞれに対し可能な位置を三重結合にした位置異性体をすべて書くようにすればよい。(全部で14種類ある。)
命名に際しては、置換基の位置番号よりも三重結合の位置番号を小さくすることの方が優先であることを忘れないこと。
「慣用名」と称しているのは、alkylalkylacetyleneの如き名称のことだ(と思われる)が、これを書く必要はない。
(解答例)
対応するアルカンが heptane であるもの。
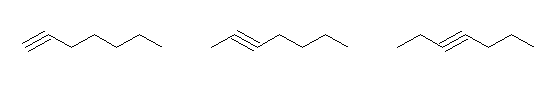
hept-1-yne, hept-2-yne, hept-3-yne
対応するアルカンが、2-methylhexane であるもの。
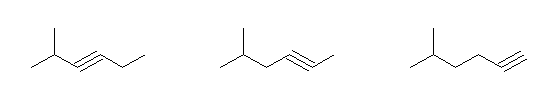
2-methylhex-3-yne, 5-methylhex-2-yne, 5-methylhex-1-yne
対応するアルカンが、3-methylhexane であるもの。
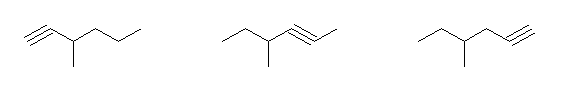
3-methylhex-1-yne, 4-methylhex-2-yne, 4-methylhex-1-yne
対応するアルカンが、dimethylpentane または ethylpentane であるもの。
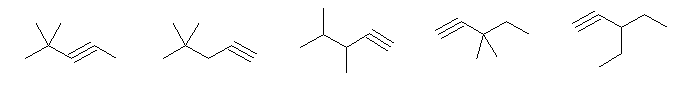
4,4-dimethylpent-2-yne, 4,4-dimethylpent-1-yne, 3,4-dimethylpent-1-yne,
3,3-dimethylpent-1-yne, 3-ethylpent-1-yne
なお、2,4-dimethylpentane と 2,2,3-trimethylbutane に対応するアルキンは書けない。
7.34
・アルケンと Br2 の反応では、環状ブロモニウムイオンが生じ、これに対し、Br- の代わりに水が求核攻撃することで β-ブロモヒドリンを生成した。三重結合に対しても同様の反応を考えてよい。
・三重結合に対する水和(ヒドロホウ素化-酸化反応でも、酸触媒または硫酸水銀触媒による水和反応でも)では、生じたエノール体が互変異性化し、ケト体を与える。
(解答例)
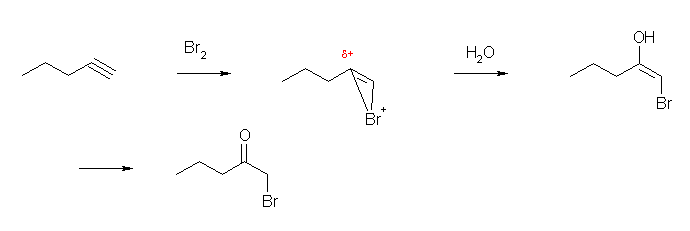
環状ブロモニウムイオンに水が求核付加することで、エノール 1-bromopent-1-en-2-ol を生じる。これがケト=エノール互変異性化することで、ケト体 1-bromopentan-2-one を与える。
7.35
a), c) はエノール体を得たのち、互変異性化により目的生成物を与える反応を考える。b) は、アルキンをはじめにアルケンに変換してから反応させればよい。
(解答例)
a) pent-1-yne に、ヒドロホウ素化-酸化反応を行う。
b) but-1-yne をリンドラー触媒を用いた接触水素化で、but-1-ene に変換し、次いでヒドロホウ素化-酸化反応を行う。
(アルデヒドの反応性は、現段階では学んでいないが)but-1-yne に対しヒドロホウ素化-酸化反応をして得られた butanal を原料とし、NaBH4(BH4- は、ヒドリド H- を与える試薬として働く)を用いた「ヒドリド還元反応」を行うことでも、butan-1-ol を与える。
c) 内部アルキンを原料として用いる必要があるので、本質的には2種類の出発原料を選ぶことが可能であるが、対称性からただ1種類の生成物のみを与える反応を選ぶことが可能な場合は、そのような選択をする。ここでは、oct-4-yne を用いる。酸触媒を用いた水和により、一旦エノール体 oct-4-en-4-ol を与えるが、これがケト=エノール互変異性化すると、目的物の octan-4-one を与える。
7.36
反応のまとめ等を参照せよ。
(解答例)
a) (Z)-体を与えるのであるから、シン付加での接触水素化を行う。アルキンからアルケンの段階で反応を止める必要があるので、触媒にはリンドラー触媒を用いる。
b) (E)-体を与えるのであるから、溶解金属還元を行う。Na または Li を 液体アンモニア(liq. NH3)中で用いる。
c) アルカンまでの還元なので、パラジウム炭素などを用いた接触水素化を行う。
7.37
反応のまとめ等を参照せよ。
(解答例)
a) 2-bromoprop-2-ene
この反応の位置選択性は、マルコフニコフ配向である。
b) 2,2-dibromopropane
2当量目の HBr の付加でも、マルコフニコフ配向で進行している。中間体は、臭素を考えなくても炭素の級数が高い方にカルボカチオンを生じているが、臭素はアルキル基と同様にカルボカチオンの安定化に効果を持つ。
c) 溶媒として水やアルコールではなく CH2Cl2 を選択しているので、環状ブロモニウムイオンに対し求核攻撃するのは、臭化物イオン Br- であるから、ビシナルなジハライドを与える。この反応の立体選択性は、アンチ付加となるから、得られるのは、(E)-1,2-dibromoprop-1-ene である。
d) c)の生成物にもう1当量の Br2が付加する。1,1,2,2-tetrabromopropane
e) propan-2-one
原料が末端アルキンなので、水和をするのに酸触媒ではなく硫酸水銀を用いている。この水和反応において、位置選択性はマルコフニコフ配向である。ただし、得られるエノールは互変異性化する。
f) propanal
ヒドロホウ素化-酸化では、位置選択性が逆マルコフニコフ配向で水和が生じる。生じたエノール体は、ケト=エノール互変異性化する。
g) propane
h) prop-1-ene
i) アセチリドイオン CH3-C≡C-
j) hex-2-yne
7.38
b) のみ主基(水酸基)をもつので注意すること。
問7.2 ヒントなどを参照すること。
(解答例)
a) oct-1-en-6-yne
b) (Z)-hex-3-en-1-ol
c) octa-1,5-diyne
d) 5-chlorocyclohexa-1,3-diene
e) 1-methylcyclohepta-1,3,5-triene
解答本(英語版)では、b) の立体を cis-体(これはこれで正しい)または (E)-体と記している。明らかに誤りですね。
7.39
不飽和度を考えてください。
(解答例)
C32H56
炭素数32なので、不飽和度0の場合、C32H66 である。二重結合が2つあることで不飽和度2、三重結合が1つあることで不飽和度2の寄与があり、更に、単環式(環構造がひとつあること)で不飽和度1の寄与があるから、水素の数は10個少ない。
7.40
反応のまとめ等を参照せよ。
(解答例)
a) 2-bromobut-2-ene
この反応の位置選択性は、マルコフニコフ配向であるが、出発原料が内部アルキンなので、位置選択的な反応とはならない。ただし、原料のアルキンの位置が対称の中心の位置なので、反応生成物は1種類のみである。
b) 2,2-dibromobutane
2,3-dibromo体は得られない。2当量目の HBr の付加でも、マルコフニコフ配向で進行し、臭素はアルキル基と同様にカルボカチオンの安定化の効果を持つためである。
c) 溶媒として水やアルコールではなく CH2Cl2 を選択しているので、環状ブロモニウムイオンに対し求核攻撃するのは、臭化物イオン Br- であるから、ビシナルなジハライドを与える。この反応の立体選択性は、アンチ付加となるから、得られるのは、(E)-2,3-dibromobut-2-ene である。
d) c)の生成物にもう1当量の Br2が付加する。2,2,3,3-tetrabromobutane
e) butan-2-one
原料が内部アルキンなので、水和をするのに酸触媒でも十分であるが、硫酸水銀を用いたときにも同じ反応が生じる。この水和反応において、位置選択性はマルコフニコフ配向であるが、出発原料が内部アルキンなので位置選択的とはならない。ただし、原料のアルキンの位置が対称の中心の位置なので、得られるエノール体は1種類のみである。また、このエノール体は互変異性化する。
f) butan-2-one
ヒドロホウ素化-酸化では、位置選択性が逆マルコフニコフ配向で水和が生じるが、出発原料が内部アルキンなので位置選択的とはならない。ただし、原料のアルキンの位置が対称の中心の位置なので、得られるエノール体は1種類のみで、e) と同じものを与える。これが互変異性化する
g) butane
h) (Z)-but-2-ene
立体選択性は、シン付加である。
i, j) なにも反応しない。内部アルキンは、sp 炭素上にはアルキル基が置換しており、酸性の高い水素を持たない。メチル基上の水素、sp3 炭素上の水素は、pKa が 60 程度の(最も弱い)酸でしかないので、ナトリウムアミドで引き抜くことはできない。
7.41-7.50
7.41
反応のまとめ等を参照せよ。
(解答例)
a) hexane
接触水素化である。触媒の種類を見ると、アルキンがアルカンまで還元される条件であることがわかる。
b) (Z)-hex-2-ene
リンドラー触媒を用いた接触水素化なので、アルケンで止まる。反応の立体選択性はシン付加となる。
c) (E)-hex-2-ene
溶解金属還元を行っているので、アンチ付加での水素化となる。
d) 4-methylpentanal
ヒドロホウ素化-酸化反応なので、位置選択性が逆マルコフニコフ配向での水和となる。得られるエノール体(4-methylpent-1-en-1-ol)は、互変異性化してアルデヒドを与える。
e) hexan-2-one と hexan-3-one の等量混合物。
内部アルキンを原料としているため、位置選択的な反応にならない。
f) hexan-2-one と hexan-3-one の等量混合物。
内部アルキンを原料としているため、位置選択的な反応にならない。
英語版の解答本では、e) がアルコールを与えるとしているが、誤りでしょう。
7.42
物質名を構造に書き直すと答えが見えてくるかも。
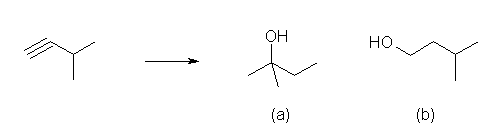
(a) の構造を生成するためには、いずれかの時点で骨格転位が関与していることがわかる。
アルキンは、いちどアルケンに還元してから反応させればよい。
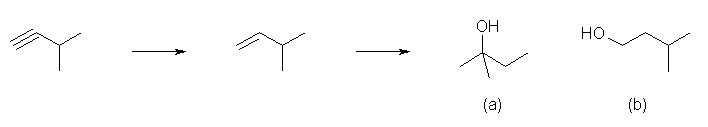
(解答例)
3-methylbut-1-yne をリンドラー触媒を用いて 3-methylbut-1-ene に変換したのち、
a) 酸触媒で水和する(希硫酸を用いる)と、はじめに炭素2位上に第2級のカルボカチオンを生じるが、3位のヒドリド(共有結合電子対と水素原子、H:-)が2位に転位し、より安定な第3級のカルボカチオンとなる。

これに対し水が求核攻撃するので、2-methylbutan-2-ol が得られる。このとき、転位前に水の求核攻撃が生じると、副生成物(少量生成物)として、3-methylbutan-2-ol を与える。
b) ヒドロホウ素化-酸化反応を行うことで、逆マルコフニコフ配向での水和がおき、3-methylbutan-1-ol が得られる。ヒドロホウ素化試薬の種類や反応の温度、その他の条件により、位置選択性が低い場合は、(本来の位置選択性とは逆の)3-methylbutan-2-ol を副生成物として与える。
7.43
まず、与えられた名前で構造を書いてみて下さい。
側鎖の位置番号より、多重結合の位置番号の方が優先されることを思い出すこと。
(解答例)
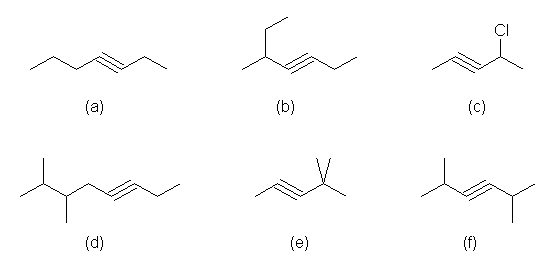
a) hept-3-yne
b) 5-methylhept-3-yne
c) 4-chloropent-2-yne (「2-pentyne」という非推奨な書き方をしている以外は、正しい。)
d) 6,7-dimethyloct-3-yne
e) 4,4-dimethylpent-2-yne (「2-pentyne」という非推奨な書き方をしている以外は、正しい。)
f) 2,5-dimethylhex-3-yne (「3-hexyne」という非推奨な書き方をしている以外は、正しい。)
7.44
ケト=エノール互変異性化が進行するのは、水酸基が二重結合炭素のどちらか上にあるときのみです。また、水酸基の結合して位置でカルボニル基になっていくのであるから、酸素の結合している位置が入れ替わるものは、ケト=エノール互変異性体の関係にはない。
(解答例)
c) と e) が、その組の中のものが互変異性体の関係にある。
a) 水酸基が sp2 炭素上にないので、pent-2-en-1-ol は互変異性化しない。
b) そもそも分子式が異なる組であり、異性体の関係ではない。
d) pent-1-en-1-ol の互変異性体は、pentan-2-one ではなく、pentanal である。(互変異性化により、酸素の結合位置が変化しない。)
7.45
炭素数が増えているものは、アセチリドイオンを経由してハロゲン化アルキルとの反応で炭素鎖伸長を行っている。
目的生成物と同数の炭素をもつ、内部または末端のアルキンの反応として、どのような反応をすればよいのかを考えればよい。
(解答例)
a) 硫酸水銀を触媒とした水和、または、ヒドロホウ素化-酸化反応により、水和する。ethen-1-ol は互変異性化により ethanal を与える。
b) ethyne → but-1-yne → but-1-ene → 1,2-dibromobutane の順で変換するとよい。
まず ethyne をナトリウムアミドでアセチリドイオンとし、1-bromoethane などと反応させ but-1-yne とする。次に、リンドラー触媒を用いた接触水素化で but-1-ene とすることができる。これに Br2 を反応させる。(溶媒には、水やアルコールではないものを用いる必要がある。教科書の例では、 CH2Cl2 を用いている。)
c) ethyne → prop-1-yne → prop-1-en-2-ol → propan-2-one の順で変換可能である。(練習問題に対してこんなことを言っても仕方ないが、propan-2-one(慣用名:アセトン)を買うほうが、ethyne を買うより安いんじゃないだろうか。ましてや、試薬の準備、反応、精製等の手間を考えると…)
まず ethyne をナトリウムアミドでアセチリドイオンとし、1-iodomethane などと反応させ、propyne とする。これに(末端アルキンなので、単なる酸触媒では不適切)硫酸水銀触媒により水和を行う。得られるエノールは、互変異性化により propan-2-one を与える。
d 〜 f) は、まず pent-2-yne を得れば、そこから生成させられる。( f は pent-1-yne でもよいが。)
まず ethyne を c) の途中までと同じ手順に従い、prop-1-yne とし、次いで、もう一度アセチリドイオンとしたのち、1-bromoethane などと反応させ、pent-2-yne とすることができる。
溶解金属還元(Na または Li/ liq. NH3)により、(E)-pent-2-ene を与える。
リンドラー触媒を用いた接触水素化では、(Z)-pent-2-ene を与える。
パラジウム炭素を触媒とした、過剰量の水素を用いた接触水素化では、pentane を与える。(pentane も買ったほうが安くつくと思う。)
7.46
問 7.21 などと同じような問題です。平衡は、相対的に強い酸が酸として働き共役塩基となり、相対的に弱い酸が遊離する側に偏る。
(解答例)
a) 過酸化水素 H2O2 の pKa は 11.6 で、水よりも強酸である。そのため、この平衡は 右に偏る。
b) エチンの pKa は、約 25 であった。従って、過酸化水素の方が強酸である。そのため、この反応は左へ偏る。
7.47
各反応の立体選択性(シン付加、アンチ付加)に基づき考えてみればよい。第4章の学習内容に基づいて考えた方が結果を整理しやすいかもしれない。(2年生では学習範囲外とする。)
(解答例)
a) リンドラー触媒を用いた接触水素化は、シン付加、次の臭素化はアンチ付加で進行する。従って、次のように光学異性体のペアとして生成物を与える。

b) 溶解金属還元による水素化はアンチ付加、次の臭素化はアンチ付加で進行する。従って、次のように生成物を与える。
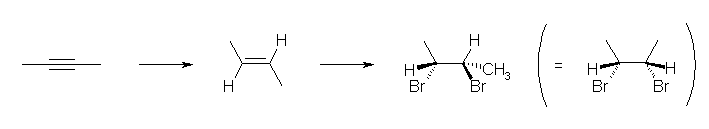
カッコの中の構造は、メチル基の向きがそろうように C2-C3 結合を回転させた結果である。更に、C2-C3 結合軸の中心を垂直に横切る軸に沿って回転(ペン回しみたいに回転)させると、表と裏を入れ替えることができるから、a) とは異なり光学異性体のペアは存在しない。(「メソ体」であるという。第4章参照のこと。)
a) と b) の生成物は、分子の結合軸の周りの自由回転や、分子の平行移動や回転では互いに重ね合わせることのできない構造、すなわち立体異性体の関係であることを確認しておこう。
c) ハロゲン化は、ともにアンチ付加で進行する。従って。
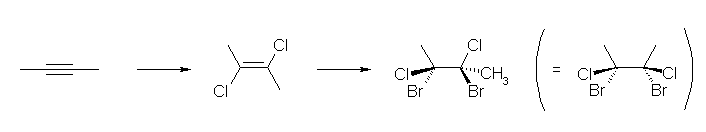
7.48
とりあえずノーヒントで。
(解答例)
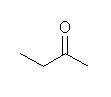
a) butan-2-one
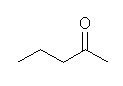
b) pentan-2-one
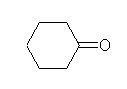
c) cyclohexanone
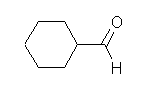
d) cyclohexanecarbaldehyde
7.49
a 〜 c は、まず、炭素数をそろえたアルキンにするところを基本として考える。
(解答例)
a) 〜 c) は、まず ethyne をナトリウムアミドを用いてアセチリドイオンとしたのち、適切な数の炭素数をもつハロゲン化アルキルと反応させることで、目的生成物と炭素数をそろえたアルキンとすることができる。
a) hexan-2-one ← hex-1-en-2-ol ← hex-1-yne ← ethyne の順で変換できる。
hex-1-yne は末端アルキンなので、硫酸水銀を触媒として水和することができる。生じたエノールは、互変異性化して hexan-2-one を与える。
b) 2-bromobutane ← but-1-ene または but-2-ene ← but-1-yne または but-2-yne ← ethyne の順で変換できる。
butyne はリンドラー触媒を用いて対応する butene に変換可能である。but-1-ene を前駆体として用いる場合には、これに対するマルコフニコフ配向での HBr を考えればよいので、カルボカチオンを中間体として経由する HBr の極性付加でよい。また、but-2-ene を前駆体として用いる場合には対称性の関係で位置選択性に関係なく HBr の付加反応は 2-bromobutane を与える。
c) pentan-2-ol ← pent-1-ene ← pent-1-yne ← ethyne の順で変換できる。
pent-1-yne はリンドラー触媒を用いて pent-1-ene に変換可能である。これに、カルボカチオンを中間体として経由する(酸触媒下での)水和反応を行えばよい。
pent-2-ene からは、pentan-2-ol とともに pentan-3-ol を等量与えてしまうから、前駆体として選ぶには適切ではない。
d) 逆マルコフニコフ配向での水和をすればよいので、ヒドロホウ素化-酸化を用いる。得られるエノール体 2-cyclohexyleth-1-en-1-ol は、互変異性化して目的の 2-cyclohexylethanal を与える。
e) マルコフニコフ配向での水和をすればよい。末端アルキンなので、硫酸水銀を触媒として用いる必要がある。得られるエノール体 1-cyclohexyleth-1-en-1-ol は、互変異性化して目的の 1-cyclohexylethan-1-one を与える。
f) リンドラー触媒を用い、接触水素化を行う。この反応はシン付加で進行する。原料の prop1-ynylbenzene から、目的生成物の (Z)-prop-1-enylbenzene が得られる。
7.50
7.25 などと同じ問題
(解答例)
hex-1-yne と 1-bromoethane(または 1-iodoethane)を原料として用いる。
7.51-7.57
7.51
内部アルキンは、基本的に2つの sp 炭素の級数に差がないため、潜在的には位置選択的に生じる可能性のある反応であっても、位置選択性が発現しない。
(解答例)
ヒントにも書いたように、内部アルキンはどのような反応であっても位置選択性が発現しないが、but-2-yne のようにアルキンが対称中心となる位置に存在する場合、どちらの炭素に酸素が結合しても対称性の関係から同一の生成物となってしまう。
but-2-yne 以外の同様の例とすると、(いくらでもあるが)hex-3-yne、oct-4-yne、dec-5-yne など。
読み方に注意。
decane デカン、decene、decyne デセン、デシン。
7.52
7.47 と同様の問題です。省略。
(解答例)
省略。
7.53
側鎖置換基よりも多重結合の位置番号を優先することを忘れないこと。
(解答例)
(3E, 6E)-3,7,11-trimethyldodeca-1,3,6,10-tetraene
7.54
アルキンの立体選択的な還元でアルケンにする反応を用いる。
原料が ethyne で、結果として内部アルキンが欲しい場合は、炭素鎖伸長反応を2回行う。
(解答例)
炭素鎖伸長反応は、ナトリウムアミドを用いてアルキンをアセチリドイオンとし、次いで適切なハロゲン化アルキルと反応させる。エチンを原料として用いた場合、はじめにナトリウムアミドと反応させたときには、一方の端のみが水素が引き抜かれる。(H-C≡C-H の水素の酸性度に比して、アセチリドイオンのもう一端の水素 -:C≡C-H の酸性度は下がる。これは、共役塩基である二価のアニオンでは、電荷間の反発があるためである。)そのため、ナトリウムアミドの量を1当量としておき、次いで得られたアセチリドイオンをハロゲン化アルキルと反応させた時点で、末端アルキンのみが得られている。従って、この末端アルキンをいちど単離してから、あらためて炭素鎖伸長反応を行うことで目的の内部アルキンを得ることができる。
a) 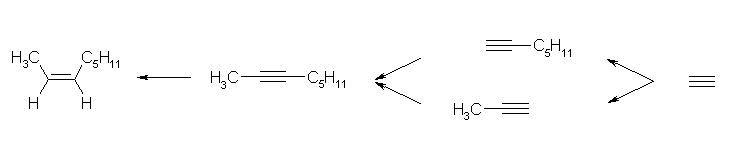
最後の立体選択的な還元には、リンドラー触媒を用いた接触水素化を用いる。
b) 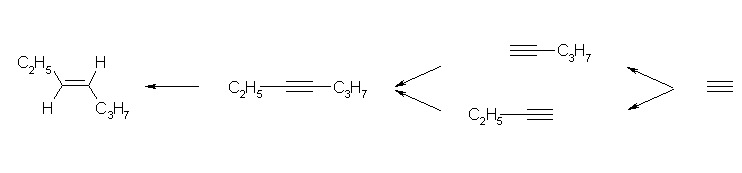
最後の立体選択的な還元には、溶解金属還元を用いる。
7.55
なにが起きているのかを知っていれば、落ち着いて考えればわかるはず。
ヒドロホウ素化反応では、はじめに、ホウ素が求電子試薬(ルイス酸)として働き、多重結合の π 電子を受け取っている。
(解答例)
もしはじめから HO- や HOO- といった強い求核試薬があると、多重結合の π 電子より先にホウ素に攻撃してしまうから。
7.56
S,R の記号は、不斉炭素(4つの置換基がすべて異なる炭素)の光学異性体(鏡像異性体)を区別するときにつける記号です。ここでは学習範囲外なので省略
(解答例)
省略
7.57
反応のまとめなどを参照すること。
(解答例)
a) 1,1,2,2-tetrachloro-4-methylpentane
b) (E)-1,2-dichloro-4-methylpent-1-ene
c) 4-methylpentan-2-one
d) 4-methylpentanal
e) pentane
f) (Z)-pent-2-ene
g) (E)-pent-2-ene
h) pentan-2-one と pentan-3-one の等量混合物