2.01-2.10
2.01
水素を持つ化学種(分子、イオン等)は、酸になりえる(教科書 p60)。
授業でも扱ったように、Brønsted-Lowry の酸-塩基の考え方では、ある物質が単独で「酸である」と考えるのではなく、相手との関係の中で「酸として働く」のである。そのため、教科書p60 の記述は、「酸としてはたらきうる」と修正し、この問いの問題文は「酸でない」ではなく、「酸としてはたらくことがない」と修正すること。
なお、極端な例とすると、ほとんどの場合において酸として働かない(最も弱い酸のひとつである)メタンでも、次の式は、酸として働いた場合の式である。このような式が書けるということが、酸として働く可能性があるということである。
CH4 → H+ + CH3-
(解答例)
分子内に水素を持たない CO2 と CCl4 は、Brønsted-Lowry の酸として働くことはない。
2.02
酸として働く → H+ を失った形(共役塩基)を生じる。
塩基として働く → H+ を受け取った形(共役酸)を生じる。
(解答例)
a)
HCl(酸) → Cl-(HClの共役塩基)
NH3(塩基) → NH4+(NH3の共役酸)
b)
H2O(酸) → OH-(H2Oの共役塩基)
NH2-(塩基) → NH3(NH2-の共役酸)
もちろん、HCl → Cl- という式において、HCl を Cl-の共役酸であるという言い方もまた正しい。
2.03
共役酸:ある物質が塩基としてはたらき、 H+ を受け取って生じる形のこと。
共役塩基:ある物質が酸としてはたらき、 H+ を放出して生じる形のこと。
(解答例)
a) H+ を受け取って生じる形
1) NH4+
2) HCl
3) H2O
4) H3O+
b) H+ を放出して生じる形
1) NH2-
2) Br-
3) NO3-
4) OH-
2.04
Ka が大きい(pKa が小さい)ほど、強い酸である。
-log10Ka = pKa
Ka = 10-pKa
(解答例)
a) pKa = 5.2 の物質の方が強酸である。
Ka1 = 10-5.2 = 6.3 × 10-6
Ka2 = 10-5.8 = 1.6 × 10-6
b) Ka = 3.4 × 10-3 の物質の方が強酸である。
pKa1 = -log10(3.4 × 10-3) = 2.47
pKa1 = -log10(2.1 × 10-4) = 3.68
上に示したように、Ka と pKa の変換もできるようにしておくこと。(関数電卓を使用する。)
2.05
それぞれ、酸塩基反応の平衡定数、酸解離定数は、
Keq = [H3O+][A-]/([H2O][HA])
Ka = [H+][A-]/[HA]
であるから、
Ka = Keq × [H2O]
である。
(解答例)
酸解離平衡の平衡定数が Ka であるから、
AH ←→ A- + H+
| Ka = | [ A− ] | [ H+ ] |
| [ AH ] | ||
一方で、「水との反応」は、次の平衡反応なので、
AH + H2O ←→ A- + H3O+
| Keq = | [ A− ] | [ H3O+ ] |
| [ AH ] | [ H2O ] | |
ここで、水中では、H+ として示されるイオンはすべて H3O+ であるから、
[ H+ ] = [ H3O+ ] である。
従って、
| Keq = | [ A− ] | [ H+ ] | = | Ka |
| [ AH ] | [ H2O ] | [ H2O ] | ||
また、水は溶媒として多量に含まれているので、酸の解離によって水の濃度は(有効精度の範囲内で)一定のままである。すなわち、溶液 1 L 中の水を 1000 g とすると、水の分子量で除して、1000/18.015 = 55.5 mol/L である。
よって、Keq = 4.53×10-6 ÷ 55.5 = 8.16×10-8
2.06
pKa より Ka を求めるには、2.4 も参照すること。
「ビタミンCより強い酸であるかどうか」を知るためには、ビタミンCと pKa の大小を比較する。ビタミンCの pKa は、その上(教科書のレイアウトのミスかな?)の「問題解答の指針」中に示されている。
(解答例)
10-4.82 を関数電卓で計算する。
1.51 × 10-5
※ 検算のため、Ka の範囲について、10-4 > 10-4.82 > 10-5 であるから、その計算値も、1 × 10-5 から 1 × 10-4 の範囲(1〜10 × 10-5 の範囲)であることを意識するようにしよう。
※ 計算結果の精度(有効桁数)を確認するためには、次の3つの計算を比較すれば分かる。
10-4.815 = 1.531… × 10-5
10-4.820 = 1.513… × 10-5
10-4.825 = 1.496… × 10-5
従って、Ka が 1.51±0.02 × 10-5 程度の範囲であれば、pKa は(4.81でもなく、4.83でもなく)4.82 になる。
(発展)
酪酸は、CH3CH2CH2CO2H、IUPAC名 ブタン酸。
酪は乳製品の一種。ブタン酸は、はじめにバターから得られたため慣用名として酪酸をもつ。銀杏の実の匂いの原因物質のひとつ。銀杏拾いをしたあと手についた匂いは重曹などで洗ってあげると改善するかもしれません。
2.07
制酸剤として胃液の「過剰の酸をとりのぞく」とは、酸を中和する反応(= 塩基として H+ を受け取る反応)を書いてやればよい。
(解答例)
a)
Mg(OH)2 ←→ Mg(OH)+ + OH-
Mg(OH)+ ←→ Mg2+ + OH-
OH- + H+ ←→ H2O
または、
Mg(OH)2 + 2 H+ → Mg2+ + 2 H2O
水酸化マグネシウムは、溶解度積 Ksp = 1.2 × 10-11 程度なので、純水にはあまり溶けない。(そのため、上式では、単なる解離の式ではなく、平衡として記した。)酸溶液には可溶。酸溶液中では、上3式で書いた平衡が、最後の中和反応が右へ偏ることにより、結果としてルシャトリエの原理(平衡移動の原理)により、すべての水酸化マグネシウムが解離する方向へ平衡を偏らせる。
b)
まずはじめに、炭酸水素カリウム(= 重炭酸カリウム)と炭酸水素ナトリウム(= 重炭酸ナトリウム、重曹)は、いずれも溶解により解離し、炭酸水素イオン(重炭酸イオン)を生じる。
NaHCO3 → Na+ + HCO3-
HCO3- + H+ ←→ H2CO3
H2CO3 ←→ H2O + CO2
炭酸水素イオンは、炭酸の共役塩基である。炭酸は、水に二酸化炭素が溶解したときの形である。従って、炭酸水素イオンが、その共役酸である炭酸になると、その溶液の温度に依存した溶解度より、大部分の二酸化炭素が気体として発生し、溶解平衡の系外に出る。(つまり、重曹(や炭酸ナトリウム)を中和すると、二酸化炭素が発生する。)
このため、2番目の式も、失われる炭酸を補う方向に平衡が移動するため、ほぼ全量の炭酸水素イオンが中和により消費される。
c)
炭酸カルシウムも水には溶けにくい。(25℃において、Ksp = 3.6 × 10
CaCO3 ←→ Ca2+ + CO32-
CO32- + H+ ←→ HCO3-
HCO3- + H+ ←→ H2CO3
炭酸カルシウムの溶解平衡により生じた炭酸イオンが、酸性溶液中では b) と同様に二酸化炭素と水になり、消費されるので、平衡移動が生じるため、炭酸カルシウムは酸性水溶液に溶解する。(大理石に塩酸を反応させて二酸化炭素を発生させるのは、高校化学の範疇でしたよね。)
a) から c) のいずれも、H+ を受け取る反応(塩基が共役酸になる形の反応)を、赤で示した。
(発展)
炭酸水素ナトリウムの別名は、重曹である。ナトリウム(Sodium)の漢字表記が曹達(ソーダ)であるため。重炭酸ソーダから。
2.08
体液と表記されているが、要は水溶液である。水溶液の液性(酸性か塩基性か)は、pH で判断できますね。
(解答例)
室温付近においては、水のイオン積 Kw = [ H+ ][ OH- ] = 10-14 であるから、中性の条件 [ H+ ] = [ OH- ] では、[ H+ ] = [ OH- ] = 10-7 である。従って、 pH = 7 となる。pH > 7 の水溶液では、[ H+ ] < 10-7 となり、塩基性、pH < 7 の水溶液では、[ H+ ] > 10-7 となり、酸性である。
従って、
a) 塩基性
b) 酸性
c) 塩基性
(発展)
水のイオン積 Kw は、温度により変化することが知られている(※)。そのため、中性水溶液の pH (= pKw /2)は、温度を指定しないと決まらない。(厳密な議論をしていない場合には、温度 25℃を想定している。その場合は、中性で pH = 7 として扱える。)
中性水溶液は、およその値であるが、0 ℃ では pH = 7.5、60 ℃ では pH = 6.5 となります。中性水溶液を 0 ℃ から 60 ℃ に温度を上げるだけで、pH が 1.0 程度小さくなりますから、水素イオン濃度 [ H+ ] は 10 倍になっていますが、同時に、水酸化物イオン濃度 [ OH- ] も同じように上昇しているわけです。
※ 一般に、化学平衡の平衡定数は温度依存する。水の解離平衡の平衡定数に、水溶液中の水濃度(大過剰に存在するため、一定とみなせる。[ H2O ] = 55.5 mol/L )を乗じたものが、水のイオン積である。
2.09
共役酸とは、ある化学種が塩基としてはたらき、 H+ を受け取って生じるもの。
では、どこで H+ を受けとるのか。それは、孤立電子対のある位置である。
特に、c と e は、分子内に孤立電子対をもつ原子が2つあるので注意すること。
(解答例)
分子内の、孤立電子対のある位置で H+ を受け取る。
孤立電子対をもつ陰性原子(窒素、酸素など)が複数あり、いずれも電気的中性である場合は、(窒素 > 酸素 > ハロゲン)の順。(より電気陰性度の高い原子上の孤立電子対は、原子核に強く引き寄せられており、塩基性度が低い。)
a) CH3CH2O+H2
b) CH3CH2OH
c) では、一方の酸素は電気的に中性だが、もう一方の酸素が負電荷を持っているので、その位置でH+ を受け取る。
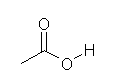
d) CH3CH2N+H3
e) は、電気的に中性な酸素が2箇所ある。H+ を受け取って生じる構造は、次図、左側ではなく、右側となる。
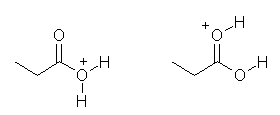
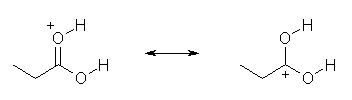
酸素の s 性だけで判断すると、-OH(sp3 混成、s 性 25 %)よりも =O(sp2 混成、s 性 33 %)の方が電気陰性度が高く、孤立電子対を強く引き付けて塩基性度が下がっているように見えるが、この場合は、分極の寄与を考える必要がある。カルボニル基は、>C=O ←→ >C(+)-O(-) のような共鳴で表されるような分極の寄与がある(うごきやすい π 電子が、電気陰性度の高い酸素側に引き寄せられている)ため、炭素−酸素単結合よりも大きく分極できる。また、逆に、電子求引基であるカルボニルに隣接しているため、(単なるアルコールの水酸基と異なり、カルボキシ基中の)-OH 基の酸素上の電子密度は下がっている。これらのため、酸素上の負の部分電荷は、-O-H より C=O 上でより大きい(より大きな δ- をもつ)。
また、上図左の構造は、共鳴を書くことができないのに対し、右の構造は、次の共鳴を書くことができる。
2.10
2.7 と同様に考えてください。
アルコール R-OH は、水と同様、酸としても塩基としても働くことができます。
(解答例)
a-1) 「酸として働く」= H+ を相手に与える、なので
CH3OH + NH3 → CH3O- + NH4+
ここで、教科書の表 2.1 を見ると、プロトン化されたアミンの pKa はおよそ10であり、アルコールのpKa およそ15 より小さく、強酸である。すなわち、この反応を平衡として考えた場合は、
CH3OH + NH3 ←→― CH3O- + NH4+
より強い酸(アンモニアの共役酸)が酸としてはたらき、より弱い酸(アルコール)が遊離する方向に平衡が偏る。従って、アルコールとアンモニアを混ぜても、アルコールが酸として働く反応は、実質的に生じない。
(pKa に 5 の差があるので、アルコールの濃度が、アミンの 105 倍以上大きいときに、はじめてアルコールが酸として働く反応の寄与がでてくる。ただし、アルコールを溶媒として用いても102 mol/L を越えることはない(それ以上濃くできない)ので、実質的に考えなくてよい程度である。)
a-2) 「塩基として働く」= H+ を相手から受け取る、なので
CH3OH + HCl → CH3O+H2 + Cl-
ここで、教科書の表 2.1 を見ると、プロトン化されたアルコールの pKa は、ゼロ以下で強酸。塩酸も強酸。
CH3OH + HCl ←→ CH3O+H2 + Cl-
平衡がどちらに偏るかは、pKa の大きさをきちんと調べないと判断できない。ただし、溶媒としてアルコールを用いており、塩酸が溶質である場合は、アルコールが多量であるが故に平衡は右へ進行する。
b-1)
NH3 + CH3O- → NH2- + CH3OH
アンモニア(pKa 〜 36)の方がアルコール(pKa 〜 15)(アルコキシドの共役酸)よりずっと弱い酸であるから、上記の反応は進行しない。
b-2)
NH3 + HBr → NH4+ + Br-
プロトン化されたアンモニア(pKa 〜 10)は、臭化水素(強酸、pKa はゼロ以下)より弱酸である。従って、上記の反応は進行する。
2.11-2.20
2.11
表 2.1(教科書 p67)などを参照すること。
多くの場合、酸や塩基として働く官能基の構造から、およその pKa は定まる。
(解答例)
教科書等より、類似の構造を探すこと。
a) 教科書 p65、メチルアミン(pKa = 40)とほぼ同じ pKa をもつと予測される。
b) 教科書 p64、メタノール(pKa = 15.5)やエタノール(pKa = 15.9)とほぼ同じ pKa をもつと予測される。
c) 教科書 p64、酢酸(pKa = 4.76)などとほぼ同じ pKa をもつと予測される。
d) 教科書 p64、プロトン化されたメチルアミン(pKa = 10.7)や、プロトン化されたエチルアミン(pKa = 11.0)などとほぼ同じ pKa をもつと予測される。
2.12
pKa の大小から、異なる2つの酸の相対的な強さの順を決めることができる。
pKa は小さい方が、Ka は大きい方が強い酸である。
(解答例)
「強い酸 (= H+ を放出しやすい、共役塩基が安定で、H+ を受け取りにくい) = その共役塩基は弱い」の関係がある。同様に「弱い酸 = その共役塩基は強い」である。従って、
a) 相対的に弱い酸の共役塩基が、より強いということになるから、酢酸(pKa = 4.8)の共役塩基である「酢酸イオン」CH3CO2- の方が、ギ酸(pKa = 3.8)の共役塩基である「ギ酸イオン」HCO2- よりも強塩基である。
b) 同様に、アンモニア(pKa = 36)の共役塩基である「アミドイオン」NH2- の方が、水(pKa = 15.7)の共役塩基である「水酸化物イオン」HO- よりも強塩基である。
c) 相対的により弱い酸である「オキソニウムイオン」H3O+ の共役塩基である水 H2O の方が、メタノールと比較して塩基性が強い。
相対的な大小の比較をすると上記のようなことになるのであって、オキソニウムイオン(pKa = -1.7)は、塩酸などと匹敵する強酸である。
2.13
ある化学種が塩基として働くと、共役酸を生じる。
塩基 + H+ ←→ 共役酸
この反応は、平衡であり、平行が右に傾くほど塩基は強い。逆の観点から見ると、共役酸は酸として弱いことになる。つまり
「塩基性が強い」=「共役酸の酸性度が弱い」
の関係があることに着目せよ。従って、pKa(教科書 2.3 節)を参照すべきは、リストに与えられた物質そのものではなく、リストに与えられた物質の共役酸である。
(解答例)
それぞれについて共役酸の構造を考え、その酸性度が弱い順にならべる。
塩基性の強い順は
R-NH-(共役酸の pKa 〜 40) > R-O-(共役酸の pKa 〜 15) > R-NH2(共役酸の pKa 〜 10) > R-CO2-(共役酸の pKa 〜 5) > R-OH(共役酸の pKa 〜 -2)
となる。
2.14
ここで、メタノール、メタンアミンともにヘテロ原子に結合した水素(酸素、窒素は、電気陰性度が炭素より大きい。従って酸素上、窒素上の水素は酸として働く際に放出される可能性がある。)をもち酸として働くことが可能な構造であり、また、同じへテロ原子上に孤立電子対も持つため、塩基としても働く可能性がある構造である。酸として、または塩基としてのいずれで反応するのかは、相手との酸性度の大きさで決まる。すなわち、より強酸が酸として働くことになる。
メタノールとメタンアミンの pKa を参照して解くのが正道であるが、水とアンモニアの類推から考えてもOKである。(構造の似ているもの同士の組、すなわち、メタノールと水の pKa は似ており、また、メタンアミンとアンモニアの pKa も似ているからである。)
(解答例)
(a) まず、メタノールが酸として働く反応を考える。メタノール(pKa 〜 15)と、プロトン化アミン(pKa 〜 10)では、プロトン化アミンの方が強酸である。従って、この反応は原系の方が安定である。
CH3OH + CH3NH2 ←→― CH3O- + CH3NH3+
従って、この反応は、等量まぜただけではほとんど進行しない。
(b) 次に、メタノールが塩基として働く反応を考える。プロトン化アルコール(pKa 〜 -2.5)とメタンアミン(pKa = 40)の比較をすることになる。プロトン化アルコールの方が強酸なので、やはり原型の方が安定である。
CH3OH + CH3NH2 ←→――― CH3OH2+ + CH3NH-
この反応も、ほとんど進行しない。
というわけで、メタノールとメタンアミンを等量混合しても、メタノールが酸として働く反応も、メタノールが塩基として働く反応も、いずれもほとんど進行しないというのが正解である。
ところで問題には、「反応するとき」という条件が書かれている。「ほとんど」反応しないが、わずかに反応するなら、それはどっち?という問いだと考えてみよう。
(a) のケースでは、pKa の差が約 5 である。つまり、等量混ぜたとき、その 1/105 程度はメタノールが酸として働いている。これに対し、(b) のケースでは、pKa の差が42以上ある。等量混ぜたときに、1/1042 程度以下しかメタノールが塩基として働かない。アボガドロ数が 6×1023 であったことを考えると、1/1042 というのは実質ゼロであるとみなしてよい。すなわち、(a) は、わずかには進行するが、(b) は全く進行しない、と言ってよい。
ヒントにも書いたように、これを水とアンモニアのケースに当てはめて同様の考察をしてみる(教科書 p61 参照)。水(pKa 〜 15)は、プロトン化アンモニア(アンモニウムイオン、pKa 〜 10)と比較して弱酸である。従って、水とアンモニアを等量混合しても、水が酸として働くような中和反応が進行するわけではない。
H2O + NH3 ←→― HO- + NH4+
しかし、この反応は水中で一部進行している。この反応により生じた OH- により、pH が大きくなり、水溶液は塩基性を示す。計算すると、アンモニアの 0.1 mol/L 水溶液では、アンモニアの 99 % は、NH3 として水に溶けており、約 1 % のアンモニアが塩基として働いて NH4+ となっている。このときの pH はおよそ 11 である。
(発展)
「メチルアミン」は、置換命名法では「メタンアミン」である。2013 IUPAC改訂により導入された優先IUPAC名(PIN)は、methylamine ではなく、methanamine のようである。(※)
官能種類命名法では、クラスネーム amine の前に置換基名をスペースで区切って示すことになるが、一般的には、メチルアミンは 「methylamine」とスペース区切りを入れずに表記される(※2)。スペース区切りの無い「methylamine」は、厳密には官能種類命名法とは別の独自の命名規則と解釈される。通常の置換命名法では、官能基を水素に置き換えた構造に官能基名を書き足すが、アミン独自のルールでは置換基名(アルキル基名)に官能基名を書き足すことが許される。
※ http://old.iupac.org/reports/provisional/abstract04/BB-prs310305/Chapter6-Sec60-64.pdf の p20 参照。(見てわかるように、ドラフト(下書き)バージョンなので、不確定要素を残す。)
探してみたが、正式な 2013年改訂による命名規則の記述の詳細は、いまのところ見当たらない。
※2 http://www.acdlabs.com/iupac/nomenclature/93/r93_398.htm IUPAC のウェブサイトから。R-5.4.1-(c) による。(ただし、1993年改訂)
2.15
強酸とは、酸として働きやすいものをいうのだから、酸としてはたらいた結果である共役塩基になりやすい。弱酸は、酸として働きにくいものをいうのだから、酸の形のまま残りやすい。
いま、Brønsted-Lowry の定義による酸塩基反応を平衡で書くと、次式となる。
酸1 + 塩基2 ←→ 酸1の共役塩基 + 塩基2の共役酸
従って、酸1、および、塩基2の共役酸を比較したとき、相対的に強い酸は消費され、相対的に弱い酸が遊離する方向に平衡がずれる。
具体的な指針として、与えられた酸塩基平衡の両辺における酸を探し出し、pKa などの数値より、相対的な酸の強度を判定せよ。強酸を消費し、弱酸を生成する側に平衡がずれるはずである。
(解答例)
§2.1
p60 下2行
HCl + H2O ―←→ Cl- + H3O+
HCl の pKa は -7(教科書 p69)、H3O+ の pKa は -1.7(教科書 p68、問2.12)より、オキソニウムイオンの方が、相対的に弱酸である。結果として塩化水素は水中で(ほぼ)100 % 解離し、オキソニウムイオンを与える。
p61 6行目
NH3 + H2O ←→― NH4+ + HO-
H2O の pKa は 15.7(教科書 p68、問2.12)、アンモニウムイオン NH4+ の pKa は 9.4(教科書 p69、§2.5)なので、水の方が弱酸である。強酸であるアンモニウムイオンはほとんど生じない。問 2.14 の解説も参照のこと。
§2.3
p66 4行目
CH3OH + OH- ←→ CH3O- + H2O
CH3OH の pKa は 15.5 (教科書、p64)、H2O の pKa は 15.7(教科書 p68、問2.12)、ほぼ同じ pKa の値であり濃度が高い方の成分が消費される側に平衡がずれる。強いていえば、ややメタノールの方が強酸であるので、等量の混合物の場合、この平衡はわずかに右へ偏る。
p66 5行目
CH3OH + H3O+ ←→― CH3O+H2 + H2O
H3O+ の pKa は -1.7、CH3O+H2 の pKa は -2.5(教科書 p65)。オキソニウムイオンの方がやや弱い酸であり、等量の混合物の場合、この平衡はやや左に偏る。
p66 下4行目
CH3CO2H + OH- ―←――→ CH3CO2- + H2O
酢酸 CH3CO2H の pKa は 4.76(教科書 p64)、水の pKa は 15.7。pKa の値に大きく差があり、水が弱酸である。この反応は大きく右へ偏る。
p66 下3行目
CH3CO2H + H3O+ ←→― CH3C(=O+H)OH + H2O
プロトン化酢酸(酢酸の共役酸)の構造については、問い 2.9 (e) の解説を参照のこと。
オキソニウムイオンの pKa は -1.7、プロトン化酢酸(酢酸の共役酸)の pKa は -6.1(教科書 p65)。プロトン化された酢酸は、オキソニウムイオンよりも強酸である。平衡は左に偏る。すなわち、酸性水溶液中であっても、酢酸がプロトン化をうけて共役酸の構造をとるものはほとんどない。
p67 1行目
CH3NH2 + HO- ←→――― CH3NH- + H2O
CH3NH2 の pKa は 40(教科書 p65)、水の pKa は 15.7。pKa の値に大きく差があり、メタンアミンが弱酸である。この反応は大きく左へ偏っており、右への反応は実質上生じない。
p67 2行目
CH3NH2 + H3O+ ―←――→ CH3NH3+ + H2O
オキソニウムイオンの pKa は -1.7、プロトン化メタンアミンの pKa は 10.7。pKa の値に大きく差があり、プロトン化メタンアミンは相対的にとても弱い酸である。メタンアミンが塩基として働く方向、すなわち右側に平衡が大きく偏っている。
(発展)
ある酸 HA が pKa = 0 の値を持ったとしよう。上と同様の理屈で考えると、HA の方がオキソニウムイオンより弱酸であるので、
HA + H2O ←→― A- + H3O+
となり、HA と H2O を等量混ぜても、HA のほとんどは解離できない。
しかしながら、実際に水溶液にする場合は([ H2O ] = 55.5 mol/L なので、)0.5 mol/L の溶液でも、HA の濃度は水中の水の濃度の 1/100 以下となる。すなわち、pKa に 2 程度の差があっても、濃度の効果により HA の大部分が解離する側に平衡が移動する。そのため、pKa が 0 付近よりも小さければ、実質的に強酸として扱うことができる。
2.16
ここでは、次の反応を考えることになる。
エチン(HC≡CH) + リストにある塩基 ←→ エチンの共役塩基(HC≡C-) + リストにある塩基の共役酸
問 2.15 と同様に、与えられた酸塩基平衡の両辺における酸を探し出し、pKa などの数値より、相対的な酸の強度を判定せよ。より具体的には「エチン(HC≡CH)」と「リストに与えられた塩基の共役酸」の2つについて pKa よりどちらが強い酸であるかを判定せよ。より強い酸は消費され、より弱い酸が遊離する方向に平衡が傾くはずである。
(解答例)
a) HC≡CH + OH- ←→― HC≡C- + H2O
ここで、エチン(pKa = 25)、水(pKa = 15.7)であるから、水の方が相対的に強い酸であり、上の平衡は、水(相対的に強い酸)が消費され、エチン(相対的に弱い酸)が遊離する方向、すなわち左に偏る。
b) HC≡CH + NH2- ―←→ HC≡C- + NH3
ここで、エチン(pKa = 25)、アンモニア(pKa = 36)であるから、エチンの方が相対的に強い酸であり、上の平衡は、エチン(相対的に強い酸)が消費され、アンモニア(相対的に弱い酸)が遊離する方向、すなわち右に偏る。
c) アミドイオン NH2- は、エチンから水素を完全に引き抜くことが可能である。水酸化物イオン OH- を等量用いても(水とエチンの pKa に 9.3 の差があるので)、平衡下、エチンのうち 1/109.3 程度(無視できるほど少量)しか共役塩基として存在できない。水酸化物イオンの濃度をエチンの109.3倍以上にすることは実質的に不可能であるから、水酸化物イオン OH- はこの目的のために適さない。
2.17
酢酸からプロトンを取り除く方向に平衡が傾くかどうかを判断するのだから、ここでは、次の反応を考えることになる。
酢酸(CH3CO2H) + リストにある塩基 ←→ 酢酸の共役塩基(CH3CO2-) + リストにある塩基の共役酸
あとは、2.16などと同様に考えよ。
(解答例)
ヒントの平衡式が、生成物側(右側)に偏るための条件は、リストにある塩基の共役酸が、酢酸(pKa = 4.76)よりも弱い(pKa が大きい)ことである。
HO- (共役酸 H2O の pKa は 15.7)
CH3NH2 (共役酸 CH3N+H3 の pKa は 10.7)
HC≡C- (共役酸 HC≡CH の pKa は 25)
なお、以下の塩基は共役酸が酢酸よりも相対的に強酸であるため、平衡は反応物側(左側)に偏り、酢酸は一部(もしくはごくわずか)しか解離しない。
CH3OH (共役酸 CH3O+H2 の pKa は -2.5)
H2O (共役酸 H3O+ の pKa は -1.7)
Cl- (共役酸 HCl の pKa は -7)
2.18
まず、これらの物質の組み合わせのうち、相対的に強い酸がどちらかを判断すること。これにより、酸-塩基反応を平衡として書くことができるようになる。
つづいて、平衡定数を書いてみること。(この値を求めよ、というのが問いの求めるところである。)
この平衡定数は、2つの物質の Ka の組み合わせで算出できる。
いま、次の平衡を考えることにしよう。
AH + B- ←→ A- + BH
この反応の平衡定数 Keqは、
| Keq = | [ A− ][ BH ] |
| [ AH ][ B− ] |
ここで、AH およびその共役塩基のみをまとめ、BHおよびその共役塩基のみをまとめる。
| Keq = | [ A− ] | ÷ | [ B− ] |
| [ AH ] | [ BH ] |
[H+] を両者に補う。同じもの [H+] を、割り算する両方に掛けるので、1を掛けるのと同じことである。
| Keq = | [ A− ][ H+ ] | ÷ | [ B− ][ H+ ] |
| [ AH ] | [ BH ] |
= Ka(AH) / Ka(BH)
なお、pKeq = pKa(AH) - pKa(BH)
(解答例)
a) HCl + H2O ←→ Cl- + H3O+
pKa(HCl) = -7
pKa(H3O+) = -1.7
Keq = 107 ÷ 101.7 = 105.3
= 2.0 × 105
b) CH3CO2H + H2O ←→ CH3CO2- + H3O+
pKa(CH3CO2H) = 4.76
pKa(H3O+) = -1.7
Keq = 10-4.76 ÷ 101.7 = 10-6.46
= 3.5 × 10-7
c) CH3NH2 + H2O ←→ CH3N+H3 + HO-
pKa(H2O) = 15.7
pKa(CH3N+H3) = 10.7
Keq = 10-15.7 ÷ 10-10.7 = 10-5
= 1.0 × 10-5
d) CH3NH3+ + H2O ←→ CH3NH2 + H3O+
pKa(CH3N+H3) = 10.7
pKa(H3O+) = -1.7
Keq = 10-10.7 ÷ 101.7 = 10-12.4
= 4.0 × 10-13
2.19
「塩基性の高いもの」 = 「H+ を受け取って共役酸となろうとするもの」 =「共役酸が弱く、酸としては相対的に働かないもの」
従って、リストにある塩基に対し、共役酸の構造を調べ、その pKa なり構造から酸としての強さを調べるとよい。
(解答例)
共役酸の pKa を調べる。
H3C- の共役酸 CH4 の pKa は約 60(教科書 p73、表2.2)
H2N- の共役酸 NH3 の pKa は 36
HO- の共役酸 OH2 の pKa は 15.7
F- の共役酸 HF の pKa は 3.2(教科書 p73、表2.2)
従って、塩基性の強さの順は
H3C- > H2N- > HO- > F-
なお、ここで比較した4つの塩基は、いずれも同一周期の元素の水素化物の共役塩基である。従って、pKa の数値がなくとも、共役酸の酸性度の相対的な大小関係は、元素の電気陰性度より判断できる。 → 教科書 p 71、6行目までのところを参照のこと。
2.20
「相対的に塩基性が強い」 = 「相対的に、その共役酸が弱い」 = 「共役酸の pKa が大きい」
エタン(CH3-CH3)は、C-H 結合に、炭素の sp3 軌道を用いている。
エテン(CH2=CH2)は、C-H 結合に、炭素の sp2 軌道を用いている。
エチン(HC≡CH)は、C-H 結合に、炭素の sp 軌道を用いている。
R-H が酸として働いたときに生じる共役酸 R- は、もともとC-H 結合を与えていた軌道に孤立電子対の入ったカルバニオンである。その電子対は、教科書 p72 にもまとめられているように、s性の高い軌道に入った場合により安定である。
(解答例)
右に欄外はない。
というのを答えにするわけにはいかないので、左の欄外の3種のカルバニオンを比較する。
その構造が「最も安定である」という記述は、「H+を受け取らなくても安定である」=「塩基性が低い」ということを意味している。
従って、塩基性の強さの順は、
CH3-CH2- >
CH2=CH- >
CH≡C-
(発展)
教科書 p71 からのところでは、「軌道の s 性が高いほど、相対的な電気陰性度が高い」と結論しており、教科書 p72 では、第2段落にて、「2s 電子の原子核からの平均距離は、2p 電子の原子核からの平均距離よりも小さい」ことが理由であると述べている。
(みなさんが既に学習した内容との対応)構成原理で学んだように、同じL殻の軌道であるならば、2s の方が 2p よりもエネルギーが低い。エネルギーが低いということは、そこに電子が入っているほうが安定であるということである。
→ よりエネルギーが低い軌道は、相対的な電気陰性度が高いと言ってよい。
→ s 性の大きい軌道に電子対が入ると、s 性の小さな軌道に入る場合に比べて、より安定である。
(共役塩基の孤立電子対が s 性の高い軌道に入って、「共役塩基が安定化する」ということは、酸が、酸として強いということである。)
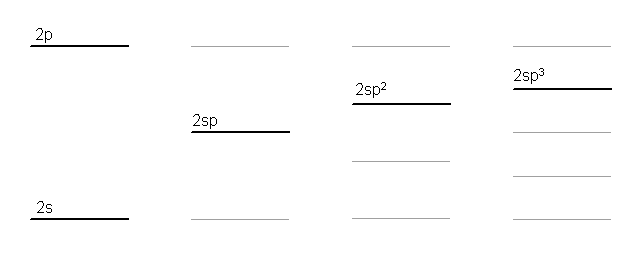
図 2s, 2p 軌道および混成軌道の相対的なエネルギーの模式図
sp 混成軌道は、50% の s 性を持ち、エネルギー的には、s軌道とp軌道の中間。
sp2混成軌道は、33% の s 性を持ち、エネルギー的にも s軌道 33 %、p 軌道 67 % から計算できるような、下から 2/3 の位置。
sp3混成軌道は、25% の s 性を持ち、エネルギー的にも s軌道 25 %、p 軌道 75 % から計算できるような、下から 3/4 の位置。
(ここから先は、上の説明に対し、疑問を持った方だけで結構です)
この科目では、軌道について数学的な記述を避け、定量的な議論を行っていない。そのため、急に「原子核からの平均距離は」などと言われても分からないかもしれない。有機化学では、それでOKである。なお、この科目での学習範囲を超えるが「軌道の貫入効果 (Orbital Penetration Effect)」「遮蔽効果」という概念について、簡単に説明しておこう。少々ややこしくなるが、興味のある方はお付き合いください。
- まず、動径分布関数を次図に示す。
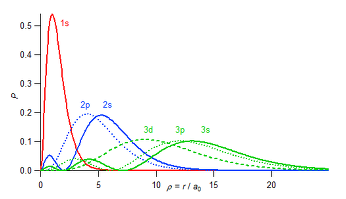
横軸が原子核からの距離で、縦軸がその距離に電子が見つかる確率である。
- 動径分布関数からは、2s 軌道と 2p 軌道は、ほとんど同じ大きさが同じ(原子核からの距離に対して電子の分布している範囲がほとんど同じ)であることが見て取れる。更にいうならば、わずかに 2p 軌道よりも 2s 軌道の方が外側にまで広がった軌道である。(これより、「2s 電子の原子核の平均距離は、2p 電子の原子核からの平均距離よりも小さい」と書かれている教科書の記述を、単純に鵜呑みにしてはいけないことがわかる。)
- 同様の傾向は、3s、3p、3d についてもいえる。軌道の大きさは、この3つでほとんど同じでありながら、3s が一番大きく、次いで 3p、3d の順となる。
- 原子核からの電子に対する束縛は、静電引力によるものであるから、距離の短い場合の方が、束縛が強くなるはずである。つまり、距離の短いところにある軌道に入ったほうが、安定であると結論づけるのが妥当のように思われる。さて、軌道の大きさは、同じ L殻、M殻、N殻 …内であるならば、s の方が p よりもわずかに大きかった。しかし、軌道の安定性は、やはり構成原理で見たように、s の方が p よりも安定である。ここに矛盾があるように見えるのだが、どうしたらよいだろうか。これを、この後説明していく。
- 動径分布関数に戻ろう。2s 軌道は、動径節を持っている。すなわち玉ねぎのような階層構造を持っている。これは、動径分布関数のグラフが青実線(2s)で2山になっていることから確認できるだろう。横軸の数字で 2 のあたりで電子が存在できない距離がある。これが動径節である。
- 2s 軌道では、1s 軌道とほぼ同じ距離(むしろやや短い距離)のところに全体の1割以下ではあるが、小さなピークを持っている。このように、外側にあるはずの軌道の一部が、内側の軌道の内部に分布をもつことを「軌道の貫入」という。
- K殻(1s軌道)は、内殻として電子が詰まっているとき、2s や 2p に電子が入るときに、その電子はどのような静電引力を感じるのだろうか。たとえば、リチウム原子は、原子番号が3である。原子核は「3+」の電荷をもつのであるが、その周囲にあるK殻により「遮蔽」されているため、L殻の電子から見ると、原子核とK殻込みで、「1+」の球であるかのように見える。ナトリウム原子は、原子番号が11である。原子核は「11+」の電荷をもつのであるが、その周囲にあるK殻、L殻により「遮蔽」されているため、M殻電子から見ると、原子核、K殻、L殻込みで、「1+」の球であるかのように見える。このようなことから、周期表において、同じ族の元素とは、最外殻の電子の数が同じものであるという関係が生じている。
- さて、この「遮蔽」の効果と、「軌道の貫入」を付き合わせて考えてみよう。2s 軌道の電子も、2p 軌道の電子も、原子核の電荷のうち「2+」分は、K殻により遮蔽されて感じている。しかしながら、2s 軌道の電子のうち、ごく一部は1s軌道に貫入している。1s軌道に貫入した2s電子は、1s軌道(K殻)電子による遮蔽を受けない(受けても小さい)。そのため、Li 原子の 2s 軌道電子のほとんどは、遮蔽された原子核の電荷「1+」から束縛されているのに対し、一部貫入した2s軌道電子は、遮蔽を受けない原子核の電荷「3+」から束縛を受けているということになる。
- このように、わずかに内殻に貫入した軌道電子が、内殻による遮蔽を受けないため、より強く束縛される効果がある。そのため、軌道全体としてみるとやや大きい 2s 軌道の方が、2p 軌道よりも原子核からの束縛が強くなる。そのため、2s 軌道の方が、2p 軌道よりもエネルギー的に安定である。
2.21-2.30
2.21
左、プロトン化エーテルも、右、プロトン化ケトンも、酸素の孤立電子対で H+ を受け取った結果生じている。
炭素の場合と同様に、s性の高い軌道を使った水素との結合の方が、酸性度が高い。
(解答例)
s 性の高い酸素上に水素をもつプロトン化ケトンの方が、強い酸である。
以下のシートを見ると、プロトン化アセトンの pKa は -7.3 と、塩酸よりも強酸である。一方、プロトン化ジメチルエーテルの pKa は -3.8 である。
(参照)http://cactus.dixie.edu/smblack/chem2310/summary_pages/pKa_chart.pdf
(参照)http://evans.harvard.edu/pdf/evans_pKa_table.pdf
(参照)教科書巻末付録I
ここで重要なのは、一般的に、アルコール、エーテル、ケトンが共存している中に、塩酸などの強酸を加えたとき、いずれもプロトン化することが可能であるが、アルコールやエーテルの方が相対的にプロトン化を受けやすいという事実である。
※ 問 2.9 e のカルボキシ基のプロトン化の位置とは、状況が異なることに注意。
2.22
a) 酸−塩基反応である。
1R-H + 2R- ←→ 1R- + 2R-H
の式を書いてみること。
b) この平衡が生成物側(平衡の右側)に傾くのはどれか。1R-H と 2R-H の酸性度を比較したとき、1R-H
の方が酸性度が高いことが必要である。
(解答例)
A) CH≡CH + CH3-CH2- ―←→ CH≡C- + CH3-CH3
B) CH2=CH2 + CH≡C- ←→― CH2=CH- + CH≡CH
C) CH3-CH3 + CH2=CH- ←→― CH3-CH2- + CH2=CH2
b) 炭素の s 性が高いほど酸性度が高くなるので、HC≡CH > H2C=CH2 > H3C-CH3 の順となる。
(言い換えると、カルバニオンの安定性、生じやすさは CH≡C- > CH2=CH- > CH3-CH2- の順である。)
従って、相対的に強い酸が消費され、相対的に弱い酸が遊離する方向に平衡が偏るので、上の A) 〜 C) の3つの反応のうち、生成物側(右側)に平衡が偏るのは、A) のみである。
2.23
「塩基として強い」=「単独では不安定で、H+ を受け取りやすい」=「H+ を受けって生じた共役酸は、酸として弱い」=「共役酸の中の X-H 結合が強く、切れにくい」=「ハロゲン原子 X が小さい。価電子殻が、より内側の殻である。」
(解答例)
同族元素間の比較なので、周期が下の元素(原子サイズの大きい元素)の水素化物の方が高い酸性度をもつ。相対的に弱い酸の共役塩基ほど、塩基として強いのであるから、
F- > Cl- > Br- > I-
の順。
共役酸の pKa 値については、教科書 p73、表2.2を参照のこと。
2.24
酸素と硫黄は、同族元素(周期表上、縦に重なった位置関係)である。
(解答例)
同族元素間の比較なので、周期が下の元素(原子サイズの大きい元素)の水素化物の方が高い酸性度をもつ。
a) 酸素
b) H2S
c) CH3SH
水やアルコールは pKa が 15 程度であったが、H2S の pKa は 7 程度、R-SH の pKa は 10 程度である。(H2S は、水にとけて弱酸性を示す。R-SH の pKa 〜10 は、フェノールなどと同程度で、水に溶けて酸性を示すとは言い難いが、水酸化ナトリウムにより完全に中和することが可能である。)
(発展)
フッ素の同族元素をハロゲンというのと同様に、酸素族元素(酸素、硫黄、セレン、テルル、ポロニウム…)を、カルコゲンと呼ぶことがある。なお、窒素族元素はプニクトゲン(または p を発音せずにニクトゲン)である。
2.25
1) a), d) のように、同族元素で比較するときは、原子の大きさ(価電子殻がどれであるか)が優先する。この時の酸性度と電気陰性度の関係は、逆になっており、注意しなければいけない。
2) 酸素と窒素のように、同周期元素(価電子殻が同じ)間で比較するときは、原子の大きさではなく、電気陰性度の順で考えなければならない。
(解答例)
a) HBr > HCl (同族元素なので、原子の大きい元素の水素化物の方が酸性度が高い。)
b) R-O+H2 > R-N+H3 (同一周期の元素なので、電気陰性度の高い酸素化合物の方が酸性度が高い。)
c) R-OH > R-NH2 (同一周期の元素なので、電気陰性度の高い酸素化合物の方が酸性度が高い。)
d) R-SH > R-OH (同族元素なので、原子の大きい元素の化合物の方が酸性度が高い。)
2.26
2.23 と同じことを聞いている。
(解答例)
a) F-
b) I-
2.27
a) のみ、比較する2つの化学種が、中性分子と陰イオンである。H+ と静電気的に引き合うのはどちらであるかを考えれば、どちらが強い塩基であるかが分かる。
答えを得るためであれば、逆に、それぞれの共役酸を考え、その pKa を調べてもよい。
(解答例)
まず、解答作成のためのロジックのひとつとして、「より弱い酸の共役塩基が強い」ことを用いることができる。共役酸の pKa の数値が与えられている場合などは、このロジックを用て解答して構わない。
英語版の答えと解説本では、このロジックで解説を行っている。
ただし、ある構造が酸として弱いか強いかを判断する場合に、その共役塩基の構造を考え、塩基性の強弱を考えて決めた。上のロジックと裏表の関係にあるのであるが、酸の強さの判断にその共役塩基の強弱を用い、塩基の強さの判断にその共役酸の強弱を用いるということでは、いつまでたっても(pKa などの数値が与えられない限り)堂々巡りをすることになる。
教科書 §2.6 をよく読み、共役塩基の構造の安定性より、酸としての強弱を判断できるようにしておかないといけない。
a) HO- の方が強い塩基である。負電荷をもっており、H+ と強く結合できる。(他方、H2O と H+ の間には、あらわな静電引力は働いていない。)
b) NH3 の方が強い塩基である。同一周期にある窒素と酸素では、酸素の方が電気陰性度が高く、孤立電子対を強く引き寄せている。そのため、電子対の供与性(塩基性)は、窒素の方が高い。
c) CH3O- の方が塩基性が強い。これは、酢酸イオンが、教科書 p 1行目に示されているような共鳴をもち、2つの酸素で電荷を折半している構造をとるからである。実際、アルコキシドイオンと酢酸イオンの静電ポテンシャル図は、教科書 p 78 の中ほどの図で確認することができる。アルコキシドイオンの方が、酸素上の負電荷密度が高いことがわかるだろう。
d) CH3O- の方が塩基性が強い。同族元素である酸素と硫黄を比較すると、硫黄の方が原子が大きく、従って負電荷が大きく広がることで安定化できるので弱い塩基(共役酸である水素化物は強い酸)となる。
2.28
b) は、酸性水素が結合している原子の種類が異なっている。窒素と酸素は、同じ第2周期の元素であるから、電気陰性度の高い元素に結合した水素の方が酸性度が高い。
d) は、酸性を示す官能基の種類が異なる。一方は、カルボニル基をもつが、酸性水素はアルコール性の水酸基にある。もう一方はカルボン酸の構造をもつ。
a), c) の2つは、この節の主題である「置換基の効果」による酸性度の違いを問題にしている。
C-H 結合を、C-Cl や C-ORなど、電気陰性度の高い元素に置換すると、あらたに生じた結合の電気陰性度の差に由来して分極が生じる。つまり、炭素上の電子が、ハロゲンや酸素などに求引され、もともと形式電荷をもたない中性炭素であれば δ+ を炭素上に生じ、炭素上にはじめに負電荷があれば、ハロンゲや酸素上に引き寄せて、炭素だけの上から電気陰性原子上にまで非局在化(ひろげる)効果がある。そのため、電気陰性の置換基は、負電荷を非局在化して安定化する効果がある。
このような効果を「誘起効果」という。誘起効果は、σ結合を介して及ぶが、1本余分に σ 結合を挟むごとに、およそ 1/3 に減衰していく。そのため、負電荷を帯びている原子と、電気陰性の置換基の位置関係として、ひとつでも間にはさむ結合の本数が少ない方が効果が大きくなる。
a) の一方は、エタノール CH3CH2-OH の2位炭素上に、電気陰性度の高い酸素がメトキシ基として結合している構造をもつ。すなわち、CH3O-CH2CH2-OH
もう一方は、ブタノールであるが、比較すると、アルコールの2位炭素上に、(炭素と同じ電気陰性度である)エチル基が結合してる構造であると見ることができる。CH3CH2-CH2CH2-OH
c) は、アルコキシ基 RO- の結合している位置の違いがある。左の構造は、アルコールの3位の炭素上にアルコキシ基を持つが、右の構造は、アルコールの2位の炭素上にアルコキシ基をもつ。
(解答例)
a) CH3OCH2CH2OH の方が、CH3CH2CH2CH2OH より強い酸である。共役塩基(CH3OCH2CH2O-)
の負電荷を、電気陰性の酸素が求引し、安定化するためである。このような効果を誘起効果という。(そのため、共役塩基の塩基性が下がる。従って、もとのアルコールは、相対的に酸として強い。)
b) CH3CH2CH2O+H2 の方が強い酸である。同一周期の元素である酸素と窒素では、より電気陰性度の高い酸素上の水素の方が酸性度が高いからである。(※ 共役塩基の構造を考えたとき、電気陰性度の高い酸素の方が、孤立電子対を強く引き寄せるため、電子対供与性(塩基性)が小さくなる。)
この ※ のロジックは、「ある化合物の塩基性が低いから、その同じ化合物の酸性が相対的に高い」ではない。CH3CH2CH2O+H2 が相対的に強い酸であるのは、CH3CH2CH2OH が相対的に弱い塩基であるからである。CH3CH2CH2O+H2 が相対的に弱い塩基であることが理由ではない。
c) CH3CH2OCH2CH2OH の方が、CH3OCH2CH2CH2OH よりも酸性度が高い。電気陰性な酸素による電子求引性の効果(酸素による誘起効果)は、結合を介して弱くなっていくので、酸素の位置がより近いほうが効果が強い。
d) CH3CH2C(=O)OH はカルボン酸であり、ケト基をもつアルコール(※2)CH3C(=O)CH2OH よりも酸性度が強い。官能基の種類が異なるが、どちらも水酸基上の水素が酸性度を示す。カルボニル基が電子求引基として働くが、c) と同様、この位置が水酸基に近いほど、その効果が強い。
※2 IUPAC として命名する場合は、アルコールよりもケトンの方が主基としての優先度が高いので、水酸基をもつケトンとして命名する。1-hydroxypropan-2-one である。
2.29
2.28 のヒントをよく読んでみてください。
基本の骨格は、プロパン-1-オールである。酸性水素は、酸素上の水素なので、共役塩基の構造は、R-O-である。
さて、リストの構造を見てみよう。
ひとつは、負電荷を安定化してくれるような電気陰性の置換基が結合していないもの。
残り3つは、電気陰性の置換基として、-F または -Cl が結合している。同じ距離にあるならば、より電気陰性度の高いフッ素の方が、共役塩基に現れる負電荷を安定化する効果は高い。また、同じ塩素の組であるならば、共役塩基に現れる負電荷、すなわち、酸素上の負電荷と塩素の間に挟まれている σ結合の本数が少ないほうが負電荷を安定化する効果が高い。
共役塩基が安定化されるということは、もとの酸の構造が、強い酸性を示すということである。
(解答例)
ハロゲンによる誘起効果を考慮する。
同じ置換基であれば、酸性水素(この場合は、水酸基水素)に近い位置のほうが、誘起効果は大きい。
同じ位置であれば、塩素より、電気陰性度の高いフッ素の方が誘起効果は大きい。
従って、次の順で酸性度が強い。
CH3CH(F)CH2OH > CH3CH(Cl)CH2OH > CH2(Cl)CH2CH2OH > CH3CH2CH2OH
2.30
「負電荷を安定化する効果が相対的に小さい」 = 「塩基として強い」 = 「共役酸が弱い」 ものを探す。
2.28、2.29 と同様に考えていく。
a) 同じ位置に、電気陰性度の異なる -Br と -F が結合している。
b) 同じ塩素が、負電荷の位置(カルボン酸塩の構造、酸素上に負電荷がある)から異なる距離に結合している。
c) 片や電気陰性の -Br に置換されているが、もう一方は -H のままである。
d) カルボニルの構造(炭素上の「=O」としては、オキソ基と言う。← 官能基の命名で、カルボニルの構造を接頭語として命名する場合の名称。)が、電気陰性の置換基である。このオキソ基の位置が異なる。
(解答例)
誘起効果による負電荷の安定化が少ないほうが塩基性が強い。
a) 置換位置は同じである。電気陰性度の高いフッ素の方が、臭素より強い誘起効果を示す。従って、CH3CH(Br)COO- の方が強い塩基である。
b) 置換基は同じ塩素である。置換位置が近いほうが強い誘起効果を示す。従って、CH3CH(Cl)CH2COO- の方が強い塩基である。
c) 一方は誘起効果をもつ臭素があり、負電荷を安定化する。もう一方はそのような置換基を持たない。従って、C3CH3COO- の方が強い塩基である。
d) カルボニル基の位置が異なる。カルボニル基が近いほうが、誘起効果が強い。従って、CH3C(=O)CH2CH2O- の方が強い塩基である。
2.31-2.40
2.31
酸の強さとして、負電荷を担う元素の違いを比べる場合、塩素と臭素では、異なる周期の同族(ハロゲン族)元素であるので、原子の大きさが酸性度を決めた。その結果、より電気陰性度の小さい臭素の方がハロゲン化水素で酸性度が高い。
これに対し、酢酸の誘導体の場合は、負電荷は同じカルボン酸塩の酸素上にある。ハロゲンは、電気陰性度が高いほど大きな誘起効果を示す。
あれ、これってほとんど答えじゃね? 自分の言葉で説明してみてね。
(解答例)
HCl と HBr など、ハロゲン化水素の酸性度を決めるのは、その共役塩基であるハロゲン化物イオン Cl- および Br- などの安定性である。この安定性は、電気陰性度の順とは逆に、原子の大きさで決まる。
これに対し、酢酸上の置換基の誘起効果は、電気陰性度が大きいほど強い。
2.32
(出題者の意図を汲むと)6つの「酸性官能基」とは、6種類の「水素との結合」があると読んでよい(そうでもしないと「6つの」が説明できない)。すなわち、
1) リンに結合した -OH(これは、左右同じものが2つある。)
2) 中央の炭素から結合した -OH
3) -NH3+
4-6) -CH2- が3種類。
ただし、特別な構造でもない限り、通常は sp3 炭素上の水素はほとんど酸性を示さない。
b) の問いの文章「残り4つの官能基の中で」は、誤植だと思われる。6種類の「水素との結合」(をもつ置換基)のうち、リン P に結合した -OH (1種類、2つ)以外の残り、すなわち、5種類のはず。
a) については、(発展)の項も読んでから解答すること。
(解答例)
カルボン酸の共役塩基が、教科書 p78 に図示された共鳴の寄与があり、安定化を受けているのと同様に、リン酸の共役塩基(第二解離までした構造で示した)は、次図のような共鳴の寄与があり、安定化を受ける。
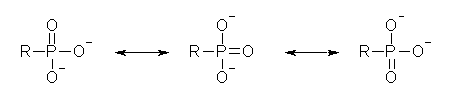
この共鳴の結果として、3つの酸素原子が同等に負電荷を分担している。
リン酸の第一解離では、pKa が約 2、第二解離では pKa が約 7 である。(この差は、第一解離によって生じた負電荷が、二番目の H+ の放出を妨げることによる。)
プロトン化された第一級アミンの pKa は約 10 であった。
中央付近にある炭素上の水酸基は、通常のアルコールとみなし、pKa は約 15 なので、これが(全く酸性を示さない -CH2- を除いて)最も低い酸性を示す。
(発展)
教科書著者の用意した解説(英語版の解説)では、リン上に電気陰性度の高い酸素が多く結合しているからである、と説明している。これは、あまり一般的な説明方法ではない。
類似の構造として、カルボン酸(典型的な pKa 〜 5)の酸性度を原因を考えよう。アルコール(典型的な pKa 〜 15)と比べてかなり酸性度が上がっている。もし、この原因を「水酸基の付け根の炭素に電気陰性の高い酸素が結合しているための誘起効果による」と答えたならば、そいつはちょっぴり勉強不足だといわざるを得ない。教科書の p78 の図のように、カルボン酸の共役塩基 R-CO2- は、2つの酸素が等しく負電荷をもつことのできる構造であることが、カルボン酸の酸としての強さの原因である。
というわけで、リン酸についても、同様の説明が可能であるはず。
2.33
カルボン酸の酸性度の高い理由として、教科書の p78 の図のように、その共役塩基が負電荷を2つの酸素で(電荷を非局在化して)担うことが可能であることが挙げられる。
スルホン酸でも同じことが言えるかどうか確認してみること。
なお、酸素が結合している元素の違い(炭素であるのか硫黄であるのか)は、直接の原因として考える必要はない。
なお、右の構造はメタンスルホン酸。アルコールと水がほぼ同じ程度の pKa を持つように、基本的には、アルキルスルホン酸は硫酸と同程度の pKa を持つ。
(解答例)
酢酸(pKa = 4.76) よりも、メタンスルホン酸の方が強い酸である(pKa 〜 -2程度)。
どちらもそれなりに強い酸であるのは、カルボン酸も、アルキルスルホン酸も、どちらも共役塩基の構造に共鳴を書くことができ、負電荷を複数の酸素原子で担うことによる。
酢酸イオンの場合は2つの酸素原子が負電荷を担い、スルホン酸イオンの場合は3つの酸素原子が負電荷を担う。そのため、後者の方が、より安定化の効果が強いので、安定な共役塩基であると言える。
これが、カルボン酸よりアルキルスルホン酸の方が強酸である主な理由である。
2.34
教科書の p78 以外に、詳細は、 教科書の §8.4(pp.383-386) を参照すること。
a) は炭酸イオン、b) は硝酸イオンである。
(解答例)
a) 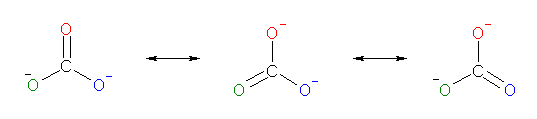
b) 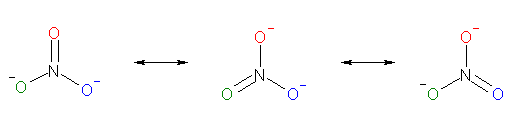
いずれも、3つの酸素が平等に2価の負電荷を分担している。
※ 上の共鳴式は、構造を 120 度回転させたものではない。赤で示した酸素、青で示した酸素、緑で示した酸素は、それぞれの位置にあるままである。ケクレ構造式の規則に従ったとき、その分子骨格の上に存在する電子のあり方として3通りに書くことができるが、その3つのが同じ程度に確からしいことを示している。すなわち、共鳴寄与式のひとつずつを見ると、いずれか1つのみの酸素が二重結合を持ち、残り2つの酸素が単結合と形式電荷をもっている。しかし、この2つの共鳴式でかかれるひとつだけ存在している、真の構造は、3つの酸素がいずれも単結合と二重結合の中間的な性質で中央原子と結合し、負電荷も3つの酸素上に約 2/3 価ずつ存在している。
2.35
「付録I」は、教科書の巻末。(p809相当)
(解答例)
pKa が小さいほど強い酸、大きいほど弱い酸である。
また、カルボン酸は R-C(=O)OH の構造を持つ分子である。
a) CH3C≡NH+ (pKa = -10.1)
b) CH3-CH3 (pKa > 60)
c) CF3CO2H (pKa = 0.2)(トリフルオロ酢酸、フッ素の誘起効果により、酢酸(pKa = 4.76)に比べてかなり強い酸になっている。)
カルボン酸がプロトン化されたものは、当然、カルボン酸より酸性度が高いが、対象外。
d) sp2原子は、独立した p 軌道を残して三配位を取るか、あるいは二重結合を持つので、電気的中性なまま水素と結合した sp2酸素は、この表中に無い。従って、>C=O+-H の構造をとるものを比較対象の一方に選ぶことになる。そうすると、 sp3 も同様に、+1 の形式電荷をもつ酸素を選ぶ必要がある。
たとえば、プロトン化アセトン (CH3)2C=O+-H (pKa = -7.3)とプロトン化ジエチルエーテル (CH3CH2)2O+-H (pKa = -3.6)とを比較すればよい。結果、sp2 酸素の方が s 性が大きく、電気陰性度が高いため、結合した水素の酸性度が高いことが分かる。(関連問題、2.21)
e) 同様に、同じ形式電荷をもつ組み合わせで比較する。たとえば次の組み合わせ(※)。
CH3C≡NH+ (pKa = -10.1)
(CH3)2C=N+H(CH3) (pKa = 5.5)
(CH3)3N+H (pKa = 10.6)
※ ここで、他の要因が入ってくることを避けるため、窒素がベンゼン環やカルボニル炭素と結合しているようなもの、環の構造に組み込まれているようなものは避けて比較を行う必要がある。
2.36
問題には、AH という酸と、そのAH の pKa が与えられている。示された pH において、酸型である「AH」と、その共役塩基型である「A-」のいずれが多く存在するのかが問われている。
AH の酸解離平衡を書くと次式である。
AH ←→ A- + H+
従って、Ka は次式である。
| Ka = | [ A− ][ H+ ] |
| [ HA ] |
式の両辺を [ H+ ] で割る。
| Ka | = | [ A− ] |
| [ H+ ] | [ HA ] |
いま、その水溶液の pH を測定したとき、pH = pKa であったならば、[H+]= Ka であるから、
(ある濃度で溶かしたら、たまたまその pH になったのでもよいし、pH を調整するために、HCl や NaOH などを加えた水溶液でも構わない。HA, H+, A- 以外の成分が共存していても、それらの成分は、上記の平衡に影響を与えないから、以下のの結論に変更はない。)
[H+]= Ka を代入して、
| 1 = | [ A− ] |
| [ HA ] |
重要な結論、その1:もし、ある酸の水溶液を、その酸の pKa と同じ pH の値に調整したら、半量が酸型 AH として存在し、残りの半量は、共役塩基型 A-として存在する。
次に、その水溶液の pH を測定したとき、pH = pKa + 1 であったならば、[H+]= Ka × 10-1 であるから、(pH および pKa の定義式より算出されるこの関係を、いちど自分で確認しておくことを奨める。なお、pH が pKa よりも1大きいということは、アルカリ性側にずれているということである。すなわち、[H+]はその分だけ小さくなっているはずである。)
| Ka | = | [ A− ] |
| [ H+ ] | [ HA ] |
| 10 = | [ A− ] |
| [ HA ] |
である。
重要な結論、その2:もし、ある酸を、その pKa より大きい pH の値に調整したら、酸型 HA として存在するよりも、共役塩基型 A- として存在する量の方が優先する。
重要な結論、その3:pKa の値と pH の値が1だけ異なる場合は、酸型、塩基型の量の比は 10:1、または 1:10である。pKa の値と pH の値が2だけ異なる場合は、酸型、塩基型の量の比は 100:1、または 1:100である。従って、およそ、pKa の値よりも2以上異なる(大きい、または小さい)pH に調整した水溶液中では、その一方(塩基型、または酸型)のみが優先し、逆の型は1%未満となり無視できる。
(もっと一般的な式の誘導)
教科書 p83 「Henderson-Hasselbalch式の誘導」を参照。
AH ←→ A- + H+
について、
| Ka = | [ A− ][ H+ ] |
| [ HA ] |
である。
従って、この両辺を [ H+ ] で割ると、次式となる。
| Ka | = | [ A− ] |
| [ H+ ] | [ HA ] |
今、Ka = 10-pKa、 [ H+ ] = 10-pH の関係があるから、
| [ A− ] | = | Ka | = | 10-pKa | = 10( pH - pKa ) |
| [ HA ] | [ H+ ] | 10-pH |
与えられた条件から、水溶液の pH と、用いた酸の pKa を代入すると、上式により、酸型と共役塩基型の比が求まる。
(ただし、アミンなどの塩基を用いる場合は、その「共役酸の」pKa を用いること。)
(解答例)
問題文に「酸の形で示す」と指定されている。つまり、与えられた構造、およびその共役塩基のいずれかで答えればよい。(与えられた構造の共役酸は考慮しなくてよい。)
ヒントをよく読むこと。結論として、pKa よりも pH の値が小さいとき(つまり酸性側)では、酸型をとる。逆に、pKa よりも pH の値が大きいとき(つまり塩基性側)では、共役塩基型をとる。pH の値とpKa の値が同じときは、酸型と共役塩基型が半々になる。
a) CH3CO2-
b) CH3CH2NH3+
c) H2O
d) Br-
e) NH4+
f) HC≡N
g) NO2-
h) NO3-
2.37
2.36 のヒントをよく読んでください。
「ある「プロトン化したアミン」の pKa が 10.4 である」ということは、たとえば「アミン」の構造が RNH2 であるならば、次の酸解離平衡を考えるわけです。
RNH3+ ←→ RNH2 + H+
(解答例)
10.4
たとえば pH 9.4 に調製された水溶液中では、このアミンの 91 % がプロトン化を受け、RNH3+ の形を取る。pH 10.4 (pKa と同じ値)では、半々になる。pH 11.4 では、逆に 91 % が中性の塩基型(RNH2)を取る。12.4 では 99 % が中性の塩基型をとる。
2.38
2.36 のヒントをよく読むこと。
「何の」pKa が与えられているのかを、問題文よりきちんとその都度把握すること。同じ物質であっても、酸として働くときの平衡を考えるべきであるのか、塩基として働くときの平衡を考えるべきなのかが変わると、正しい答えを導けない。かならず、pKa を示されている形のものが酸型 AH である。
そのため、「電荷をもっている状態」とは、カルボン酸およびアルコールについては、その共役塩基型(R-CO2-, R-O-)を指し、アミン(プロトン化アミン pKa が与えられているので)酸型の RNH3+ である。
(解答例)
それぞれの pH で主に存在する構造を示した。
1) pH = 1
2) pH = 3
R-CO2H, R-NH3+, R-OH
3) pH = 5
4) pH = 7
R-CO2-, R-NH3+, R-OH
5) pH = 10
6) pH = 13
R-CO2-, R-NH2, R-OH
※ pH = 5 の時、pKa = 4.5 のカルボン酸は、酸型:共役塩基型が約 1:3 の比で存在している([酸型]/[塩基型] = 10-0.5 ≒ 1/3)。
2.39
a) 「pKa の値が低い = 酸として強い = 共役塩基の構造が安定である」のロジックを用いて説明せよ。すなわち、アラニン(および一般的にアミノ酸)のカルボキシは、酢酸などのカルボキシと比較して、共役塩基 R-CO2- が安定である理由を示せばよい。
b) 以下、2.36 のヒントをよく読んで答えよ。
(解答例)
a) pKa の値が小さい(酸性度が高い)のは、共役塩基(R-CO2-)の構造を安定化する要因があるからである。ここまでの練習問題で見てきたものでは、カルボニル酸素(=O)や、ハロゲンが結合することにより、その電子求引基としての効果(誘起効果)がある。ここでは、正に帯電した置換基である -NH3+ が電子吸引性基として働くからである。
また、帯電した置換基を持たないカルボン酸では、R-CO2H が電気的に中性で、共役塩基 R-CO2- が負電荷をもつ。そのため、H+ を放出しようとするときに、共役塩基との間の静電引力に打ち勝たなくてはならない。これに対し、はじめから正に帯電した置換基を持つ場合、その電荷と打ち消しあうため、共役塩基 R-CO2- 自体が全体として電気的に中性となる。そのため、H+ を放出しやすい。
以上2つの要因が考えられる。
b) 指定された pH (=0) では、カルボキシ基、プロトン化アミノ基、ともに酸型を取る。
H3N+-CH(CH3)-CO2H
c) 指定された pH (=7.4) では、カルボキシ基は共役塩基型、プロトン化アミノ基は酸型を取る。
H3N+-CH(CH3)-CO2-
d) 指定された pH (=12) では、カルボキシ基、プロトン化アミノ基、ともに共役塩基型を取る。
H2N-CH(CH3)-CO2-
e) カルボキシ基の pKa が2.34 なので、これが電荷をもたない構造が主となるのは、pH = 2.34 よりも酸性側である。pH = 3.34 では 9 % 程度に減り、更に pH 4.34 では 1 %に減る。 他方、アミノ基側は、プロトン化アミノ基の pKa が 9.69 であるから、これが電荷をもたない(プロトン化アミノ基の)共役塩基である R-NH2 の構造を主とするのは、 pH が 9.69 よりも塩基性側である。pH が 8.69 では 9 % 程度に減り、更に pH 7.69 では 1 % に減る。
なので、どちらの置換基も電気的中性が安定となるような pH 領域は存在しない。
f) 2つの pKa の平均である pH = 6.02 において、カルボキシ基が電荷をもたないでいる割合は、全体の 0.209 % である(カルボキシ側において、[酸型]/[共役塩基型] = 106.02-2.34 = 103.68)。
同様に、アミノ基が電荷を持たないでいる割合も、全体の 0.209 % になる(アミノ基側において [塩基型]/[共役酸型] = 109.69-6.02 = 103.68)。
このように、アミノ酸の2つの基の pKa の平均値においては、完全に正電荷の総量と負電荷の総量が同じになる。このような pH のことをそのアミノ酸の「等電点」という
2.40
2.36 のヒントを参照せよ。
(解答例)
a) 100倍(102倍)の差となるのだから、pKa との差が 2 であるような pH である。塩基型の濃度が高くなるのは、pH が pKa より大きいとき。従って、10.4
b) 10倍の差となるのだから、pKa との差が 1 であるような pH である。酸型の濃度が高くなるのは、pH が pKa より小さいとき。従って、2.7
c) 100倍(102倍)の差となるのだから、pKa との差が 2 であるような pH である。酸型の濃度が高くなるのは、pH が pKa より小さいとき。従って、6.4
d) 半々(1:1) になっているのだから、pKa = pH の条件である。7.3
e) 10倍の差となるのだから、pKa との差が 1 であるような pH である。塩基型の濃度が高くなるのは、pH が pKa より大きいとき。従って、5.6
2.41-2.50
2.41
2.36 のヒントを参照せよ。
特に、単純な間違いをしないために、「pH が大きい = アルカリ性 = 溶液中の H+ 濃度は少ない = 酸解離平衡は、ルシャトリエの原理により解離側に傾く = 酸型 AH より塩基型 A- が増える」の一連のロジックの連なりを意識すること。逆の「pH が小さい = … = 酸型 AH が増える」でチェックするようにしてもよい。
(解答例)
a) 50% : 50% つまり、酸型と塩基型が 1:1 となるのは、pKa = pH の条件。
b) 99% : 1% つまり、酸型と塩基型が 100:1(または、1:100)となるのは、pH が pKa の値から 2 だけずれている条件。ただし、カルボン酸が電荷をもつのは共役塩基型、アミンが電荷をもつのは共役酸型である。
1) a: pH = 4.9、b: pH > 6.9
2) a: pH = 10.7、b: pH < 8.7
2.42
2.36 のヒントを参照せよ。
「水相に(ほぼ完全に)溶ける」というのは、酸解離平衡を考えたときに「99% 以上がイオンで存在している」ということに読み替えてよい(※)。逆に「エーテルなどの有機相に(ほぼ完全に)溶ける」というのは、「99% 以上が電荷をもたない形で存在している」ということに読み替えてよい。
(解答例)
ここでは、簡単な整理として、電荷をもたない中性分子はエーテルに溶け、イオンになると水に溶けるものとして問題を解いてよい。(一般論として拡張すると、当然いろいろな例外がでてくるので気をつけること。)
カルボン酸は、pKa よりも pH が大きい領域(塩基性側)で、共役塩基の形で水に溶ける(※)。99 % 以上が溶解するためには、pKa よりも 2 以上大きな pH が要求される。従って、
(1) カルボン酸の大部分が水に溶ける条件は、「 pH が 6.8 以上であること。」
(2) カルボン酸の大部分が水に溶けない条件は、「 pH が 2.8 以下であること。」
アミンは、プロトン化アミンの pKa よりも pH が小さい領域(酸性側)で、プロトン化されて、水に溶ける。上と同様に、99 % 以上が溶解するためには、pKa よりも 2 以上小さな pH が要求される。
(3) アミンの大部分が水に溶ける条件は、「 pH が 8.7 以下であること。」
(4) アミンの大部分が水に溶けない条件は、「 pH が 12.7 以上であること。」
以上を組み合わせる。
a) 条件(1)、(3) を同時に満たす範囲。すなわち、6.8 〜 8.7 の間。
b) 条件(1)、(4) を同時に満たす範囲。すなわち、12.7 以上。
c) 条件(2)、(3) を同時に満たす範囲。すなわち、2.8 以下。
(発展)
※ 主に疎水部であるアルキル基が小さいものなど、カルボン酸の構造によっては、解離していない構造でも水に溶けるものもある。
この問題でシクロヘキサンカルボン酸は、疎水部であるアルキル基がかなり大きいので、水に対する溶解度はさほど大きくなく、イオン化したときにのみ水に溶けるものとして問題をといてよい。文献値によると、15℃の水 100 mL に対する溶解度は、0.201 g。
(参照)http://www.chemicalbook.com/ChemicalProductProperty_JP_CB0332732.htm
カルボン酸がエーテルやベンゼンに溶ける際には、次図のようにカルボキシ基部分の水素結合を用いた二分子会合をすることが知られている。
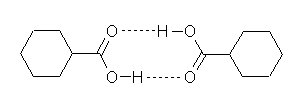
2.43
教科書の、問2.43 のすぐ上に書かれている説明を読め。(ほとんどそのままを写すことで問いに対する解答となる。)
(解答例)
この緩衝溶液は、酢酸の約半量が中和され、CH3CO2H と CH3CO2- がほぼ等量、そして比較的大量に溶解している溶液である。
a) 溶液に少量の酸(H+)が加えられると、次の平衡反応が右へずれることにより、加えられた H+ を消費してしまうため、溶液の pH の変動が小さくなる。
CH3CO2- + H+ ←→ CH3CO2H
b) 溶液に少量の塩基(OH-)が加えられると、次の平衡反応が右へずれることにより、加えられた OH- を消費してしまうため、溶液の pH の変動が小さくなる。
CH3CO2H + OH- ←→ CH3CO2- + H2O
2.44
教科書の解説をよく読んでみてください。また、上の問 2.43 も参照すること。
(解答例)
ギ酸、または酢酸を AH と書く。
緩衝溶液中で、ある反応を生じさせるとき、その反応で OH- が発生し、そのことによる pH の大きな変動を抑えるためには、次の平衡反応が右へずれる必要がある。
AH + OH- ←→ A- + H2O
従って、緩衝溶液(AH と A- がほぼ等量、比較的大量に溶けている水溶液)において、この問いの条件では、AH の濃度が高い場合に、より有効であると言える(*)。
さて、ギ酸(pKa = 3.75)について、次の平衡を考える。
HCO2H ←→ HCO2- + H+
水溶液の pH が 3.75 であるとき、[ AH ] = [ A- ] であり、反応を起こす pH = 4.2 の条件では、pKa と同じ pH よりも塩基性側であるから、[ AH ] < [ A- ] となっている。(計算すると、およそ、1:3 の比。)
同様に、酢酸(pKa = 4.76)について、次の平衡を考える。
CH3CO2H ←→ CH3CO2- + H+
水溶液の pH が 4.76 であるとき、[ AH ] = [ A- ] であり、反応を起こす pH = 4.2 の条件では、pKa と同じ pH よりも酸性側であるから、[ AH ] > [ A- ] となっている。(計算すると、およそ 4:1 の比。)
従って、(*)より、酢酸/酢酸イオン緩衝溶液の方が、この問題に与えられた条件に、より相応しいといえる。
2.45
「曲がった矢印」の使い方の詳細は、教科書の p66 を見直すこと。
1) 反応の前後の構造を比較する。このとき、構造式では、孤立電子対を省略しないこと。
2) 反応の前後で、電子の数自体は変化しない。すなわち、ある位置にあった電子が、その位置になくなったということは、他の場所に移動したことを示す。
3) (重要)共有結合は、その結合位置に電子対があることを意味する。従って、ある結合が切れるということは、その位置にあった電子対が、他の位置へ移動することを意味する。
4) その結果移動した電子対が、特定の原子上に孤立電子対として残るか、または、別の原子との間の結合に使用されることになる。
5) 反応における以上の電子対の動きを、「曲がった矢印」で示す。
6) 「曲がった矢印」の出発点は、その反応のある段階において、移動する電子対(孤立電子対、または共有結合電子対など)である。
7) 「曲がった矢印」の示す先は、移動する電子対が、その反応の段階を経て、孤立電子対となる場合は、その孤立電子対を格納する原子である。その反応の段階を経て、多重結合を作る場合(単結合が二重結合になる、など)では、そのもととなる単結合の中央付近を指すように書く。いままで共有結合していなかった相手原子と、新たに結合が生じる場合には、その相手原子を指すように書く。
(解答例)
a) 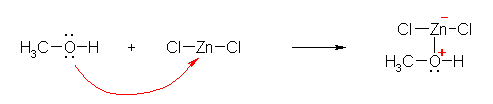
b) 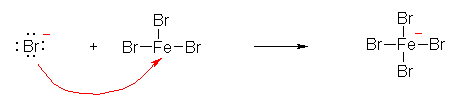
c) 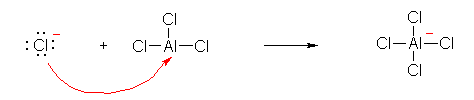
2.46
まず、相手が、プロトン(H+)を放出することが可能かどうか判断せよ。 プロトンを放出する(ブレンステッド酸としてはたらき、共役塩基を生じる)場合には、その共役塩基と水(プロトンと水酸化物イオンから生じる)を与える反応となる。
そもそも水素を持たない分子(d, f, g)の他、炭素上に結合した水素しか持たない e は、プロトンを放出しない。
これらについては、次にルイス酸として働く部位があるかどうかを判断せよ。ルイス酸としてはたらき得る(電子対を受け取る余地がある)場合には、水酸化物イオンとの間に結合を生じる。
(解答例)
a), b), c), h) は、Brønsted 酸として、H+ を放出し、共役塩基を与える。(反応式上、H2O も生じる。)
a) CH3O-(ただし、等量の OH- では完全には反応しない。)
b) NH3
c) CH3NH2
h) CH3CO2-
d), e), f), g) は、いずれも、酸性水素を持たず、また、オクテット則を満たしていないために電子対の配位を受けることができる中心原子を持つ。このため、 Lewis 酸として働く。
d) F3B--OH
e) H3C-OH
f) Br3Fe--OH
g) Cl3Al--OH
2.47
Ka は、酸解離平衡の平衡定数である。平衡定数が大きいほど、プロトン放出側に平衡が偏り、強酸であったことを思い出すこと。
「酸性度が小さくなる順に」=大きい方から小さい方へ
b. の「相対酸性度について説明せよ」は、「相対酸性度」というものについて説明を求めているのではなく、「(この問いで与えられた3つのカルボン酸の)相対(的な)酸性度(の大小関係の理由)について説明せよ」という指示と捉えてください。
(解答例)
Ka の値が大きいほど、また、pKa の値が小さいほど強酸である。
従って、ここでは Ka の値が大きいものから順にならべればよい。
CCl3CH2OH > CHCl2CH2OH > CH2ClCH2OH
ここで、塩素(電気陰性度の大きな元素)は、電子求引性の置換基としてはたらき、誘起効果により、アルコールの共役塩基を安定化する。この3つのアルコールは、同じ位置(エタノールの2位)に、異なる数の塩素が置換したものを比較しており、酸性度が最も強いのが、3置換体、次が2置換体、最後に1置換体となっている。このリストには無いが、無置換のエタノールは、2-クロロエタノールよりも酸性度は小さい。
2.48
ある酸が弱酸である場合、その構造はプロトンを放出しにくいのであるから、その共役塩基はプロトンを強く引き付けて、強い塩基として働くということである。
(ここで、「ある物質が酸として弱いほど、その物質は塩基として強い」は、陥りやすい誤りであるから、注意しておくこと。正しくは、「ある物質が酸として弱いほど、その共役塩基は塩基として強い」である。
たとえば、a) では、それぞれの共役酸である H2S と H2O の相対的な酸の強さを考えること。より弱い酸の共役塩基の方が、塩基としては強いということになる。
ある Brønsted 酸の強さについては、教科書の §2.6「酸の構造は、その pKa 値にどのような影響を与えるか」、§2.7「置換基は酸の強さにどのような影響を与えるか」、§2.9「酸の強さを決定する因子についてのまとめ」にまとめられている。
(解答例)
a) HO-
酸素と硫黄は同族元素である。同族元素間での比較なので、より大きな硫黄上で負電荷は相対的により安定となる。このため共役酸同士で比較すると、水と硫化水素では、硫化水素の方が酸性度が高い。学生実験の金属イオンの分属などで使用したことと思うが、硫化水素水が弱酸性を示すことは容易に思い出すだろう。これと関連付けて覚えておくとよい。
b) CH3N-H
酸素と窒素は、同一周期の元素である。同一周期内の元素間での比較なので、より電気陰性度の高い酸素上で、負電荷は相対的により安定となる。
c) CH3O-
同じ元素(酸素)で、混成状態も同じ(sp3)であるが、一方は形式電荷をもち、もう一方は形式電荷をもたない。負電荷をもつ方が、正電荷をもつプロトン H+ と強く相互作用する(強塩基である)。
d) Cl-
塩素、臭素は同族元素である。同族元素間での比較なので、より大きな臭素イオン上で負電荷は相対的により安定となる。
e) CH3CO3-
トリフルオロ酢酸の共役塩基では、電気陰性度の高いフッ素が電子求引性基としてはたらき、その誘起効果により負電荷を安定化している。トリフルオロ酢酸は、pKa = 0.2 の強酸である。
f) CH3CHBrCO2-
電子求引性の置換基として働くときの要因は、電気陰性度であるから、臭素よりも塩素の方が大きな誘起効果を持つ。そのため、ハロゲン化水素では、HBr > HCl の順の酸性度となるが、ハロゲン化置換のアルコールやカルボン酸では、(同じ位置、同じ数であれば)塩素化物の方が相対的酸性度が高い。
※ (誤植)英語版の解答と解説本において、b の答えの構造式において、負電荷を示すべき「-」が、窒素原子の上の傍線( N− ) として表示されている。これは、窒素上の孤立電子対( N‥ ) と同じ意味で使用されることのある表記方法である。
2.49
2.45 のヒントを再読すること。
要は、反応の前後でのルイス構造を比較すればよい。
(解答例)
a) 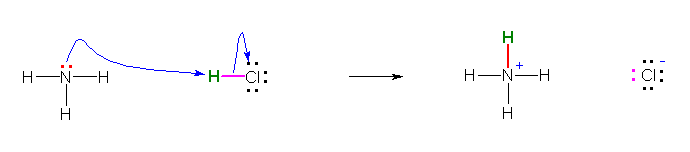
b) 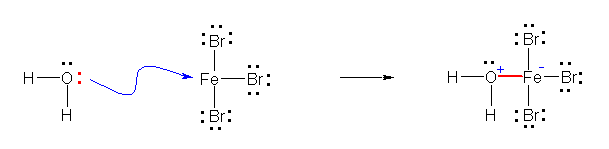
c) 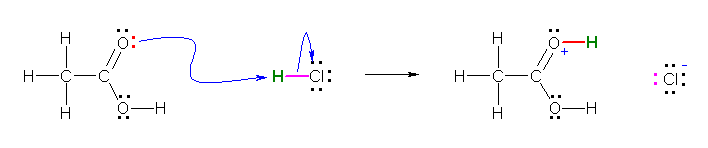
※ (誤植)教科書において、b の生成物の構造式において、負電荷を示すべき「-」が、鉄原子の上の傍線( Fe− ) として表示されているのは、誤植である。
2.50
a) の問いに対しては、Ka の大小より判断してよい。
b) と c) は、与えられた数値と構造とから考察せよ。
(解答例)
a) Ka の小さな(= pKa の大きな)方から順にならべる。
CH3CH2CH2CO2H < CH2ClCH2CH2CO2H <
CH3CHClCH2CO2H <
CH3CH2CHClCO2H
b) 電気陰性度の高い塩素原子からの誘起効果によりカルボン酸の酸性度が上がる。
c) 塩素原子がカルボキシ基に近いほうが、その誘起効果が強い。
2.51-2.60
2.51
いずれも、孤立電子対が出発となった「曲がった矢印」が書かれている。
これは、曲がった矢印によって示されるような電子の動きについて、そのうごきの前は「孤立電子対」であった電子対が、その動きのあとでは、孤立電子対ではなくなり「結合電子対」に変化することを意味する。矢印の指し示す先の原子が、新たにできる結合の相手である。
b) では、共有結合(H-Cl)から出発した「曲がった矢印」がある。この矢印の示す先が塩素原子である。
これは「結合電子対」が、塩素上の「孤立電子対」に変化することを示している。
(解答例)
a) 
b) 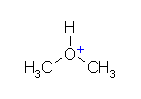
c) 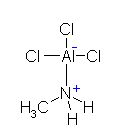
2.52
電気陰性の高い原子として、酸素と窒素があることに注意して答えること。
a) 共役酸を書く(塩基として働いた結果生じる構造を書く)場合には、どちらが先に塩基として働くのかを考える。単純には、水(やアルコール)とアンモニア(やアミン)のどちらが塩基性度が高いのか、という比較で考えてもよい。筋道をたてて考える場合には、塩基として働くために必要な孤立電子対について考察する。より電気陰性度の高い酸素原子上の孤立電子対は、原子核によって強く引き付けられているため、H+ などとの反応性は、窒素原子上の孤立電子対よりも小さくなる(塩基性が小さい)。
b) 共役塩基を書く(酸として働いた結果生じる構造を書く)場合には、生じるアニオンが酸素上と窒素上のどちらで安定であるかを考えればよい。
(解答例)
a) アミノ基が先に塩基として働くので、共役酸は
HO-CH2CH2CH2-N+H3
b) 水酸基が先に酸として働くので、共役塩基は、
-O-CH2CH2CH2-NH2
2.53
強い酸は、共役塩基が安定な構造をもつものである。
すぐに判断できない場合は、§2.6 から §2.9 の範囲を読み直すこと。
(解答例)
CH3CH2-SH > CH3CH2-OH > CH3CH2-NH2 > CH3CH2-CH3
まず、硫黄と酸素は同族元素であるから、より大きい硫黄上の水素の方が酸性度が高い。
酸素と窒素は同一周期内の元素であるから、より電気陰性度の高い酸素上の水素の方が酸性度が高い。
電気陰性ではない炭素上の水素は、酸性度が低い。特に sp3 混成炭素上の水素なので、pKa が 60程度以上。
2.54
§2.10 の内容に関係する。
2.36 のヒントも読むこと。
(解答例)
酸−塩基平衡の酸型の構造について与えられた pKa の値との比較をする。これよりも小さな pH の水溶液中では酸型が、大きな pH の水溶液中では共役塩基型がより多く存在する。pKa の値との差が 2 以上ある場合は、多い方の成分が 99 % 以上となる。
| pH | 3 | 6 | 10 | 14 |
| a) | CH3CO2H | CH3CO2- | CH3CO2- | CH3CO2- |
| b) | CH3CH2NH3+ | CH3CH2NH3+ | CH3CH2NH3+ | CH3CH2NH2 |
| c) | CF3CH2OH | CF3CH2OH | CF3CH2OH | CF3CH2O- |
2.55
「酸1 + 酸2の共役塩基」の反応で、「酸1の共役塩基 + 酸2」を生じるように書けばよい。
単なる組み合わせの問題とすると、示された分子(またはイオン)のうち、いずれが酸としてはたらき、いずれが塩基としてはたらくのかにより、2種類の反応式を書くことが可能である。ここでは、これら2つの分子(またはイオン)を比較し、相対的に強い酸が、酸として働くような式を書けばよい。
ここで、a, b は、CH3O-、-NH2 が負電荷を持っており、もし酸として働くならば2価のマイナスのイオンを生じる必要があるため、酸としてはかなり弱いだろうと考えてよい。
(解答例)
相対的に強い酸は消費され、相対的に弱い酸が遊離する方向に平衡が偏る。
a) CH3CO2H + CH3O- ―←→ CH3CO2- + CH3OH
酢酸の方が、メタノールよりも強い酸であるから、平衡は右に偏る。
b) CH3CH2OH + NH2- ―←→ CH3CH2O- + NH3
エタノールの方がアンモニアよりも強い酸であるから、平衡は右に偏る。
c) CH3CO2H + CH3NH2 ―←→ CH3CO2- + CH3NH3+
酢酸(pKa = 4.76) は、プロトン化メチルアミン(pKa = 10.7)よりも強い酸である。平衡は右に偏る。
d) CH3CH2OH + HCl ―←→ CH3CH2O+H2 + Cl-
塩化水素(pKa = -7)は、プロトン化エタノール(pKa = -2.4)よりも強い酸である。エタノールに塩化水素を溶かした溶液(または、非水溶媒中)では、この平衡は右に偏る。
ただし、塩酸(塩化水素の水溶液)を用いた場合は、別の結果となる。
水中で、塩化水素はすべてオキソニウムイオン H3O+(pKa = -1.7)と塩化物イオンになる。オキソニウムイオンは、プロトン化エタノールよりも弱い酸である。そのため、エタノールに等モル量の塩酸(塩化水素の水溶液)を加えても、生成物であるプロトン化エタノールは 17% 程度しか生じない(1/(1+10-1.7-(-2.4)) = 0.166)。
(発展)
d) の解説に書いたように、たとえば水中ではどんな強酸を用いても、オキソニウムイオンよりも強い酸として振舞うことはできずない。水との間の酸−塩基反応により、オキソニウムイオンを生じてしまうためである。これを「水平化効果」と呼ぶ。そのため、(溶媒の共役酸より強い酸を用いる場合、)酸の強さに違いがあっても、見かけ上、その差が隠れてしまう。
2.56
強い酸は、共役塩基が安定な構造をもつものである。
すぐに判断できない場合は、§2.6 から §2.9 の範囲を読み直すこと。
(解答例)
CH≡C-CH2-OH > CH2=CH-CH2-OH > CH3-CH2-CH2-OH
CH2-OH に結合した炭素(上の構造式中、赤で示した炭素)の混成状態が異なる。s 性の高い炭素の方が電気陰性度が高いものとして振舞う。
より電気陰性度の高い sp 炭素を持つものが、共役塩基の構造を安定化するので、もっとも酸性度が高い。
2.57
プロトン化されやすい = 塩基性の高い、である。孤立電子対の位置でプロトンを受け取る(ルイス塩基として働く)。それぞれ、窒素、酸素での比較となる。
(解答例)
窒素、酸素とも同一周期内の元素である。従って電気陰性度がその塩基性の大小(または、その共役酸の酸性度の大小)を決める。
すべての選択肢において、水酸基よりも、アミノ基の方が塩基性の高い官能基として振舞う。構造式中の −NH2 の窒素が最もプロトン化を受けやすい原子である。
2.58
Ka より pKa にするためには、常用対数(10を底とする対数)を取ることになる。
a) で求められているのは、「(例)pKa は、3と4の間」などという計算でよい。この例は、すなわち「Ka は、1/1000 と 1/10000 の間である」ことを意味する。
(解答例)
| Ka (given) | a) range of pKa | b) pKa | ||
| 1) | 4.0 × 10-4 | 10-3 > 4.0 × 10-4 > 10-4 | 3 < pKa < 4 | 3.4 |
| 2) | 22 | 102 > 22 > 101 | -2 < pKa < -1 | -1.3 |
| 3) | 6.3 × 10-11 | 10-10 > 6.3 × 10-11 > 10-11 | 10 < pKa < 11 | 10.2 |
| 4) | 7.9 × 10-10 | 10-9 > 7.9 × 10-10 > 10-10 | 9 < pKa < 10 | 9.1 |
| 5) | 2.0 × 10-4 | 10-3 > 2.0 × 10-4 > 10-4 | 3 < pKa < 4 | 3.7 |
c) Ka も最も大きい(pKa の最も小さい)酸が、最も強い。この選択肢の中では、硝酸が最も強い酸である。
2.59
エタン、エテン、エチンの水素の酸性度の違いは、炭素の s 性の大小で説明された。同じことを考えることになる。すなわち、sp3 炭素よりも sp2、sp 炭素(s 性が大きい)ほど、(炭素、窒素、酸素の順の変化と同様であり)電気陰性度が高いと考えてよい。
(解答例)
同じ炭素であっても、s 性の大きさで電気陰性度が異なるものとして振舞う。電気陰性度の大きさは、
sp 炭素 > sp2炭素 > sp3炭素
の順。従って、
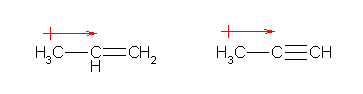
2.60
構造を見ながら考えること。
なお、「酸性度が高い」=「共役塩基の構造が安定である」なので、教科書 §2.6 を参照すると、第1要因として、電気陰性度があげられている。
酸性度の高い水素の候補として「電気陰性度の高い原子に結合した水素」を考えることになる。
1) 酸素に結合した水素(水酸基)
2) 窒素に結合した水素(酸アミド)
3) 窒素に結合した水素(2級のアミン)
(解答例)
酸素に結合した水素が最も酸性度が高い。分子中にある水酸基の位置の水素がこれにあたる。
(発展)
教科書 §2.6 で、2番目の要因としてあげられているのが
同じ元素間の比較である場合、その原子の混成状態(s 性の大きさ)である。
第3番目に書かれているが、第1の要因(電気陰性度)より優先するものとして、
周期の異なる元素間での比較の場合、原子の大きさが大きな要因となる。(とはいえ、標2.2 を見ればあきらかなように、HF と H2S の pKa は原子の大きさよりも電気陰性度が優先している。つまり、この第3番目の要因は、同族元素間での比較に適用されるべき規則であると把握すること。
(おまけ)
® は、登録商標マーク。
Tenormin (テノーミン)は、アストラゼネカ株式会社の登録商標。atenolol (アテノロール)は、同一の試薬についての(登録商標ではないという意味での)一般名。従って、同じ成分であっても、ジェネリック薬品等の場合は、後者の表示になる。
2.61-2.70
2.61
いま、(A) 〜 (D) の酸を、一般式として HA と書くならば、「HO- がプロトンを引き抜いて、生成物に向かう反応」とは、次の式で表せる。
HO- + HA → H2O + A-
ブレンステッドの酸−塩基反応は、平衡であり、その平衡は、弱酸が遊離する方向に偏る。(平衡の左右にある2つの酸のうち、より強い酸はプロトンを放出し、共役塩基の形で存在する。)
つまり、問いの意味は、(A) 〜 (D) の4種類の酸のうち、H2O(HO- の共役酸)のより強い酸であるもの(H2O の方が弱い酸であるもの)は、どれであるかということである。
(解答例)
HO- が水素を引き抜いて共役酸である水になるためには、HO- と反応する酸が、水よりも相対的に強い酸でなければならない。この条件に該当するのは、A(pKa = 4.76), C(pKa ≒ 10) の2つ。
2.62
ブレンステッドの酸−塩基反応の平衡は、弱酸および弱塩基が遊離する方向に偏る。
すなわち、1) の組み合わせでは、2種のアルコール(エタノールとメタノール)の酸性度を比較するとよい。より強い酸が、共役塩基側として存在する量が多い。すなわち、平衡は生成物側に偏る。
2種のアルコールの pKa は、教科書の p71, p77 で確認できるように、メタノール(pKa = 15.5)、エタノール(pKa = 15.9)である。
2) の組み合わせでは、2種のアミン(アンモニアとメタンアミン)の塩基性の強さ、または、これらのアミンの共役酸(アンモニウムイオン、メチルアンモニウムイオン)の酸性度の弱さで考える。
メチルアンモニウムイオンの酸性度(pKa =10.7)は、教科書の p71 で確認できる。アンモニウムイオンの酸性度は、pKa = 9.4 の値を用いてよい。
b) 考え方は、教科書 §2.10 の延長である。平衡の左右において、左側の酸、右側にある(左側の塩基の)共役酸の2種の pKa から判断できる。(発展)の項を参照すること。
(解答例)
1)
CH3CH2OH + NH3 ←→― CH3CH2O- + NH4+
では、エタノール( pKa = 15.9 )、プロトン化アンモニア(アンモニウムイオン)(pKa = 9.4 ) であるから、
pKeq = 15.9 - 9.4 = 6.5
Keq = 10-6.5 = 3.2 × 10-7
CH3OH + NH3 ←→― CH3O- + NH4+
では、メタノール( pKa = 15.5 )、プロトン化アンモニア(アンモニウムイオン)( pKa = 9.4 ) であるから、
pKeq = 15.5 - 9.4 = 6.1
Keq = 10-6.1 = 7.9 × 10-7
Keq の大小を比較したとき、メタノールとの反応で、より大である。
(別解)2つの反応式を比較すると、アンモニアは共通している。エタノールとメタノールが酸として働く平衡なので、エタノール、メタノールの pKa を調べたとき、メタノールの方が若干であるが、酸性度が強い。従って、メタノールとアンモニアの方が、反応の平衡は生成物側に偏る度合いがやや大きい。
2)
CH3CH2OH + NH3 ←→― CH3CH2O- + NH4+
では、エタノール( pKa = 15.9 )、プロトン化アンモニア(アンモニウムイオン)(pKa = 9.4 ) であるから、
pKeq = 15.9 - 9.4 = 6.5
Keq = 10-6.5 = 3.2 × 10-7
CH3CH2OH + CH3NH2 ←→― CH3CH2O- + CH3NH3+
では、エタノール( pKa = 15.9 )、プロトン化メタンアミン( pKa = 10.7 ) であるから、
pKeq = 15.9 - 10.7 = 5.2
Keq = 10-5.2 = 6.3 × 10-6
Keq の大小を比較したとき、メタンアミンとの反応で、より大である。
(別解)2つの反応式を比較すると、エタノールは共通している。アンモニアとメタンアミンが塩基として働く平衡なので、これらアミンの共役酸であるプロトン化アンモニア、プロトン化メタンアミンの pKa を調べると、メタンアミンの共役酸の方が若干であるが、酸性度が低い。つまり、メタンアミンの方が塩基として強い。従って、エタノールとメタンアミンの反応の方が、平衡が生成物側に偏る度合いがやや大きい。
b) 4つの反応の Keq を比較する。エタノールとメタンアミンとの反応が、最も大きな Keq をもつ。(とはいえ、等量混ぜただけではいずれの4つの反応も、生成物の量は無視できるほど少ないはずである。)
(発展)
いま、酸 HA と塩基 B- の平衡を考える。
HA + B- ←→ A- + HB
ここで、平衡定数 Keq は、次式で与えられる。
| Keq = | [ A− ] | [ HB ] | = | [ H+] | [ A−] | × | [ HB ] | = | Ka(HA) | |
| [ HA ] | [ B−] | [ HA ] | [ H+] | [ B−] | Ka(HB) | |||||
従って、-log10 Keq ( = pKeq ) = pKa(HA) - pKa(HB)
2.63
§ 2.11 の緩衝液の項を読んでください。
問題の意図がわかりにくいかもしれないですね。問い2.44 の教科書の解説も読んでみるとよいでしょう。
緩衝液中で行おうとしている反応が、H+ を放出することが分かっている。H+ を放出する反応が進行しても、緩衝液の緩衝作用がより効率よくはたらいて、大きくは pH を変えないような計画をしたい。では、問いの文章に与えられた選択肢のうち、どちらが適切であるか。
このときの考え方として、ある pH に調製された緩衝液中に、共役塩基型分子がより多く含まれている方が、外部から加えられた(今回計画している反応により放出された)H+ に対する受容能力が高いと考えてよい。
つまり、2つの選択肢の緩衝液の組成を、与えられた条件である pH に調製したときにどうなっているのかを求めるという問題に帰着される。
なお、「プロトン化されたメチルアミン・メチルアミン緩衝液」(protonated methylamine / methylamine buffer)とは、CH3NH3+ / CH3NH2 緩衝液と書いてしまったほうがすっきりして分かりやすいかも。
(解答例)
メタンアミン、またはエタンアミンを B、その共役酸(プロトン化アミン)を BH+ と書く。
緩衝溶液中で、ある反応を生じさせるとき、その反応で H+ が発生し、そのことによる pH の大きな変動を抑えるためには、次の平衡反応が右へ移動する必要がある。
B + H+ ←→ BH+
従って、緩衝溶液(B と BH+ がほぼ等量、比較的大量に溶けている水溶液)において、この問いの条件では、B の濃度が高い場合に、より有効であると言える。
さて、メタンアミン(共役酸の pKa = 10.7)について、次の平衡を考える。
CH3NH2 + H+ ←→ CH3NH3+
水溶液の pH が 10.7 であるとき、[ B ] = [ BH+ ] であり、反応を起こす pH = 10.5 の条件では、pKa と同じ pH よりも酸性側であるから、[ B ] < [ BH+ ] となっている。(計算すると、およそ、2:3 の比。)
同様に、エタンアミン(共役酸の pKa = 11.0)について、次の平衡を考える。
CH3CH2NH2 + H+ ←→ CH3CH2NH3+
水溶液の pH が 11.0 であるとき、[ B ] = [ BH+ ] であり、反応を起こす pH = 10.5 の条件では、pKa と同じ pH よりも酸性側であるから、[ B ] < [ BH+ ] となっている。(計算すると、およそ、1:3 の比。)
上記を比較すると、メタンアミン/プロトン化メタンアミン緩衝液の方が、反応条件(pH = 10.5)において、塩基型でいる分子の割合が大きいため、この反応により適しているといえる。
2.64
a) c) いずれも、直接、酸として働くのはカルボキシ基(-CO2H)である。従って、R-CO2H の R 上の置換基の種類や位置が、どのように酸性度に影響を与えるのか、という問いである。ここでは、カルボキシ基に結合する炭素の混成状態(s性の大きさ)が変化している。s 性が大きいほど、同じ元素であっても電気陰性度が高くなっているとみなすことができることを思い出すこと。
b) 間に炭素鎖を挟んでいるが、炭素が、酸素(より電気陰性度の高い原子)に変わったことによる影響がある。
d) 窒素の混成状態(s性の大きさ)の違いを考えること。
(解答例)
a) CH2=CHCO2H の方が相対的に強い。
赤で示した炭素が、sp2 混成であり、もう一方のカルボン酸におけるsp3 混成炭素と比較して s 性が大きく、従って電気陰性度が高いため、電子求引性基としてはたらき、共役塩基を安定化する。
b) 右の構造(構造式省略)の方が酸性度が高い。
酸素原子による誘起効果(電気陰性度が高い置換基が示す電子求引性の効果)により、共役塩基を安定化するため。
c) HC≡CCO2H の方が相対的に強い。
赤で示した炭素が、sp 混成であり、もう一方のカルボン酸におけるsp2 混成炭素と比較して s 性が大きく、従って電気陰性度が高いため、電子求引性基としてはたらき、共役塩基を安定化する。
d) 右の構造(構造式省略、ピリジンの共役酸)の方が相対的に強い酸である。
窒素の混成状態に差がある。左の構造では sp3 混成で、右の構造では sp2 混成である。より s 性の高いほど電気陰性度が高くなり、共役塩基を安定化するため、相対的に強い酸となる。
2.65
1番目のカルボキシ基と、2番目、3番目のカルボキシ基とでは、置換基の効果により pKa に差が生じている。しかしながら、2番目のカルボキシ基と3番目のカルボキシ基は、左右対称で構造的に差がないように見える。(実際、教科書の図の左右のカルボキシ基同士で、pKa の値を入れ替えて示してもよい。)これは、2つ以上の酸性置換基がある分子で常におきる現象に由来する。すなわち、第一段階目の酸解離では、
HO2C-R-CO2H → HO2C-R-CO2- + H+
第二段回目の酸解離では、
-O2C-R-CO2H → -O2C-R-CO2- + H+
となるからである。
類似の話として、たとえば金属の第一イオン化エネルギーよりも第二イオン化エネルギーの方が大きいことを思い出してみよう。(金属元素などについて、「イオン化」というと、M → M+ + e- の式で表されるので、若干の差があるが、結果として帯電したイオンが生じているという点では酸解離と共通である。)
(解答例)
a) pKa が小さい、すなわち酸性度が上がっているのは、主に、水酸基の置換基効果であると考えられる。酸素は電気陰性度が高いため、ここでは水酸基が電子求引性の置換基としてはたらき、誘起効果を示す。中央のカルボキシ基と水酸基の間に炭素が1つあるだけであるが、左右のカルボキシ基との間には、余分な炭素があるため、この効果は、中央のカルボキシ基に対して強くはたらくものと考えられる。
(蛇足)つまり、-OH が電子求引性基として働く。-F による置換と同じ影響(誘起効果)を示す。たとえば、次のアルコールの酸性度は、CH3CH2OH < CH2FCH2OH < CH3CHFOH の順。これと同じ原理です。
b) 3番目のカルボキシ基が酸解離するときには、すでに、1番目、および2番目のカルボキシ基が解離済みで、負電荷を帯びている。負電荷をもつ置換基は、電子供与性の誘起効果により、カルボキシ基の共役塩基を不安定化する方向に働く。同じことは、実は2番目のカルボキシ基についても中央のカルボン酸の共役塩基からの電子供与性の誘起効果を受けているために言えるはずである。しかし、たまたま、水酸基からの電子求引性の誘起効果との釣り合いにより、2番目のカルボキシ基は酢酸とほぼ等しいか、やや強い程度の酸性度となっていた。3番目のカルボキシ基では、カルボン酸の共役塩基の構造が2つある状態での酸解離について考えるため、これらからの電子供与性の誘起効果が、水酸基からの電子求引性の誘起効果を上回ってしまった。そのため、酢酸よりも弱い酸となる。
2.66
水の酸解離平衡を表す Ka を書き下してみよ。その上で、分かっている数値を代入するとよい。
なお、「 pH + pOH = 14 」は、「水のイオン積が Kw = 10-14 である」ということの別表現である。
Kw = [ H+ ] × [ HO− ] = 10-14
について、常用対数を取って符号を逆転すると、
-log10( Kw ) = -log10( [ H+ ] ) -log10( [ HO− ] ) = 14
pKw = pH + pOH = 14
(解答例)
AH ←→ A- + H+
について、
| Ka = | [ A− ][ H+ ] |
| [ HA ] |
である。
ここで、AH を水 H2O として書きなおす。
| Ka = | [ HO− ][ H+ ] |
| [ H2O ] |
いま、25℃において、水のイオン積 Kw = [ HO− ][ H+ ] = 10-14 であり、水中の水の濃度 [ H2O ] = 55.5 mol/L であるので、これを代入する。
| Ka = | 1×10-14 |
| 55.5 |
従って、
pKa = -log10( Ka )
= pKw + log10(55.5) = 14 + 1.74 = 15.74
2.67
1年生で扱った、高校「化学」の範囲としても、頻出される問題である。原理は簡単で、塩基は酸性水溶液中で塩(プロトン化された共役酸の形)を形成して水に溶け、塩基性水溶液にすると、中性の塩基型に戻るので有機溶媒に溶ける。酸は、塩基性水溶液中で塩(プロトンを失った共役塩基の形)を形成して水に溶け、酸性水溶液にすると、中性の酸型に戻るので有機溶媒に溶ける。
以上のことを、各構造に付記された pKa と照らし合わせて説明すればよい。
教科書の § 2.10 なども参照すること。
2.36 のヒントを参照すること。
(解答例)
※ いろいろな pH の水に、それぞれの物質が溶けるかどうか
次の表に示す pH と構造の関係を利用する。水溶性の構造(電荷を帯びた構造)は青で、水に溶けない構造(電気的に中性である構造)は赤で示した。
(基本的には、pKa よりも酸性側の pH では、酸型の構造をとり、pKa よりも塩基性側の pH では、塩基型の構造をとる。問題 2.36 のヒントも参照してください。カルボン酸などは、酸性では塩基型で水に溶ける。アミンはどは酸型で水に溶ける。)
| 化合物 | 酸型のpKa | 2.2 以下 | 6.6 〜 8.0 | 12.7 以上 |
| 安息香酸 | 4.17 | PhCO2H | PhCO2- | PhCO2- |
| アニリン | 4.60 | PhNH3+ | PhNH2 | PhNH2 |
| フェノール | 9.95 | PhOH | PhOH | PhO- |
| クロロベンゼン | - | PhCl | PhCl | PhCl |
| シクロヘキサンアミン | 10.66 | C6H12NH3+ | C6H12NH3+ | C6H12NH2 |
※ 上のデータを用いて、どのように分離することが可能か。
どんな順序でも構わないが、たとえば
1) 5種の有機化合物をエーテルやベンゼンに加え、0.1 mol/L の塩酸(pH = 1)を用いて、分液する。水相にはアニリンとシクロヘキサンアミンが入り、有機相には、安息香酸、フェノール、クロロベンゼンが含まれる。
2) 上で得た水相を水酸化ナトリウム溶液を用いて中和する。ほぼ中性になったら、エーテルやベンゼンなどで分液する。水相にはシクロヘキサンアミンが塩酸塩の形で残り、アニリンは有機相に移動する。
3) 1) で得た有機相を、0.1 mol/L の水酸化ナトリウム水溶液(pH = 13)を用いて、分液する。安息香酸とフェノールが水相に移る。有機相に残ったものがクロロベンゼンである。
4) 上で得た水相を塩酸で中和する。ほぼ中性になったら、エーテルやベンゼンなどで分液する。安息香酸は、ナトリウム塩の形で水相に残り、フェノールが有機相に移る。
2.68
著者の用意した解答と解説(英語版)を参照すると、おそらく問題文の訳があまり適切ではないように思われる。
pH 7.4 に調製された H2CO3 / HCO3- 緩衝溶液の緩衝能力(系外から加えられた酸または塩基による pH の急激な変化を抑える能力)は、酸に対して、塩基に対してのどちらが優れているか、答えよ。
問 2.44 および 2.63 を参照すること。
(解答例)
pH 7.4 の緩衝溶液中では、この pH の値が pKa(6.1)よりも大きく、塩基性側であるため、緩衝溶液中の炭酸、炭酸水素イオンの濃度には、 [ H2CO3 ] < [ HCO3- ] の関係がある。(計算すると、約 1:20 の比になる。)塩基型が過剰に入っているので、系外から加えられた酸による pH 変化を抑える能力が高い。
2.69
教科書 p83 「Henderson-Hasselbalch式の誘導」を参照。
AH ←→ A- + H+
について、
| Ka = | [ A− ][ H+ ] |
| [ HA ] |
である。
従って、この両辺を [ H+ ] で割ったものを d と置く。
| d = | Ka | = | [ A− ] |
| [ H+ ] | [ HA ] |
今、Ka = 10-pKa、 [ H+ ] = 10-pH の関係があるから、
| d = | Ka | = | 10-pKa | = 10( pH - pKa ) = | [ A− ] |
| [ H+ ] | 10-pH | [ HA ] |
である。与えられた条件から pH と pKa を代入して、d の値が求まる。これが酸型と共役塩基型の比となっている。
ここで、
| 1 + d = | [ HA ] + [ A− ] |
| [ HA ] |
なので、全体の中で酸型でいる割合は、1/(1+d) である。
(解答例)
ヒントに書いた関係式をそのまま使う。
a) d = [ A- ] / [ HA ] = 10( 5.7 - 5.3 ) = 2.51
従って、酸型の割合は、1/(1+d) で計算でき、28 %
b) 80% が酸の形で存在するとき、d = 0.2C/0.8C = 1/4 である。ただし、C は、酸の全濃度。
log10(1/4) = -0.6 なので、pKa と pH の差は、0.6である。酸型が多いのだから、pKa よりも小さい(酸性側の) pH であるはずだから、pH = 4.7 のとき。
2.70
酸の解離度 α を求めることが必要である。
弱酸の酸解離平衡
AH ←→ A- + H+
について、酸の全濃度( [ A- ] + [ AH ] )を C と置く。
また、酸の解離度を α と置く。すなわち、α = [ A- ] / ( [ A- ] + [ AH ] )
| Ka = | [ A− ][ H+ ] | = | Cα × Cα | = | Cα2 |
| [ HA ] | C(1-α) | (1-α) |
今、α << 1 と近似できると仮定する。(その結果として求めらた α について、0.05 程度より小さければ、この近似はほぼ正しかったとしてよい。)
| Ka = | Cα2 | ≒ | Cα2 |
| (1-α) | 1 |
従って、α2 = Ka/C
2 × -log10( α ) = pKa + log10( C ) より、
α = 10-(pKa + logC)/2
酸の解離度 α が上式で求まれば、その溶液中の水素イオン濃度も Cα で、すぐに求めることができる。
(解答例)
a) Ka = Cα2 , C = 1.0 より、α = 10 -4.76 / 2 = 10-2.38 である。
従って、[ H+ ] = Cα = 10-2.38 mol/L。
pH は 2.38
b) Ka = Cα2 , C = 0.1 より、α = 10 -( 10.7 - 1 ) / 2 = 10-4.85 である。
従って、[ H+ ] = Cα = 10-5.85 mol/L。
pH は 5.85
c) [ HA ]:[ A- ] = 3:1 なので、pH は、pKa から log10(3) = 0.477 だけずれている。酸型が多いので、pH < pKa である。よって、pH = 3.28
2.T01-2.T12
2.T01
(解答例)
2.T02
(解答例)
2.T03
(解答例)
2.T04
(解答例)
2.T05
(解答例)
2.T06
(解答例)
2.T07
(解答例)
2.T08
(解答例)
2.T09
(解答例)
2.T10
(解答例)
2.T11
(解答例)
2.T12
(解答例)